Évolution du fardeau de la sténose aortique dans la
province de Québec entre 2000 et 2015
Mémoire
Philipp Frieden
Maîtrise en épidémiologie - avec mémoire
Maître ès sciences (M. Sc.)
Évolution du fardeau de la sténose aortique
dans la province de Québec entre 2000 et
2015
Mémoire
Philipp Frieden
Sous la direction de :
Marie-Annick Clavel, directrice de recherche
Claudia Blais, codirectrice de recherche
Résumé
La sténose aortique est la maladie valvulaire nécessitant le plus d’interventions et la troisième maladie cardiovasculaire la plus répandue après l’hypertension artérielle systémique et la maladie coronarienne dans les pays à haut revenu. La prévalence de la sténose aortique augmentant avec l’âge et les pays à haut revenu faisant face au phénomène du vieillissement populationnel, la maladie peut potentiellement devenir un fardeau de santé publique majeur. Cependant, les données sur le fardeau épidémiologique de la sténose aortique sont contradictoires, certaines études faisant état d'une augmentation de l'incidence et d'autres suggérant plutôt une diminution. De plus, le traitement de la sténose aortique fait face à un changement de paradigme majeur avec l’introduction de l’implantation valvulaire aortique par voie percutanée. L’introduction de cette intervention a changé la prise en charge de patients autrefois inopérables ou à haut risque chirurgical. Le fardeau de la sténose aortique dans la province peut donc être influencé à la fois par des tendances démographiques et par l’évolution du traitement de la maladie. Face à l’hétérogénéité de l’évolution du fardeau de la sténose aortique ailleurs dans le monde et au changement de la prise en charge de la maladie dans les dernières années, il est impératif d’évaluer l’évolution du fardeau de la sténose aortique au Québec.
L’hypothèse principale est que, à la suite de l’augmentation de la prévalence de
facteurs de risque cardiométaboliques dans les pays à haut revenu et au vieillissement de la population de la province, le fardeau de la sténose aortique dans la province de Québec a augmenté entre les années financières 2000-2001 et 2015- 2016.
L'objectif principal de l'étude est donc d'examiner l'évolution de la prévalence,
de l'incidence, de la mortalité toute-cause et de l'utilisation des interventions valvulaires aortiques au Québec entre les années financières 2000-2001 à 2015-2016.
Abstract
Aortic stenosis is the third most common cardiovascular disease in high income countries after arterial hypertension and coronary artery disease and is the valvular disease that requires the most interventions. The prevalence of aortic stenosis has been shown to increase with age and is becoming a major public health concern. However, data on the epidemiological burden of AS are contradictory, with some studies reporting an increase in incidence and others rather suggesting a decrease. The treatment of aortic stenosis faces a major paradigm shift with the introduction of percutaneous aortic valve implantation. The introduction of this procedure has changed the management of patients who were previously inoperable or at high surgical risk. The burden of aortic stenosis in the province can therefore be influenced both by demographic factors and by changes in aortic stenosis management. Faced with the heterogeneity of the evolution of the burden of aortic stenosis elsewhere in the world and the change in the management of the disease in recent years, it is imperative to assess the evolution of the burden of aortic stenosis in the province of Quebec.
The main hypothesis of the study is that, because of the increasing prevalence
of cardiometabolic risk factors in high-income countries and the aging of the province's population, the burden of aortic stenosis has increased in the province of Quebec between the fiscal years 2000-2001 and 2015-2016.
The main objective of the study is therefore to examine the evolution of the
prevalence, incidence, all-cause mortality and use of aortic valve interventions in the province of Quebec from the fiscal years 2000-2001 to 2015-2016.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... vi
Liste des figures ... vii
Liste des sigles ... ix
Remerciements ... x
Avant-propos ... xii
Introduction ... 1
Chapitre 1 La sténose aortique ... 3
1.1 La valve aortique ... 3
1.2 Étiologies ... 6
1.3 Facteurs de risque de la SA calcifiante ... 8
1.3.1 Facteurs de risque génétiques ... 8
1.3.2 Facteurs de risque cliniques ... 9
1.4 Physiopathologie de la SA calcifiante ... 9
1.4.1 Inflammation ... 11
1.4.2 Fibrose ... 12
1.4.3 Calcification ... 12
1.4.4 Impact de la sténose aortique sur le ventricule gauche ... 13
1.5 Histoire naturelle... 14
1.5.1 Sclérose aortique ... 14
1.5.2 Sténose aortique ... 14
1.6 Épidémiologie ... 15
Chapitre 2 Diagnostic et grades de sévérité de la sténose aortique ... 21
2.1 Diagnostic ... 21
2.2 Grades de sévérité ... 23
Chapitre 3 Traitements de la sténose aortique ... 27
3.1 Remplacement de la valve aortique par voie chirurgicale ... 27
3.2 Implantation d’une valve aortique par voie percutanée... 30
Chapitre 4 Objectifs et hypothèses de recherche ... 35
5.1 Source des données ... 37
5.2 Population à l’étude ... 37
5.3 Définition de la maladie ... 37
5.4 Analyse statistique ... 38
Chapitre 6 Article inséré ... 40
6.1 Résumé ... 41
6.2 Abstract ... 42
6.3 Introduction ... 43
6.4 Methods ... 44
6.4.1 Data sources ... 44
6.4.2 Study population and period ... 44
6.4.3 Definition of disease ... 44 6.4.4 Statistical analysis ... 45 6.5 Results ... 46 6.5.1Prevalence ... 46 6.5.2 Incidence ... 47 6.5.3 Mortality ... 50
6.5.4 Valve intervention among incident AS cases ... 51
6.5.5 Thirty-day mortality among incident AS cases ... 52
6.5.6 One-year mortality among incident AS cases ... 53
6.6 Discussion ... 54
6.6.1 Increase in the prevalence of AS ... 55
6.6.2 Evolution of the AS population ... 55
6.6.3 Impact of changing from ICD-9 to ICD-10-CA on AS incidence 56 6.6.4 Impact of sex... 56
6.6.5 Overall mortality and impact of operation ... 56
6.6.6 Limitations ... 57 6.7 Conclusions ... 58 6.8 Supplementary material ... 58 Discussion ... 63 Conclusion ... 68 Bibliographie ... 69
Liste des tableaux
Tableau 1.1: Incidence brute et ajustée de la sténose aortique en Suède entre
1989-1991 ... 19
Tableau 2.1: Sévérité de la sténose aortique selon trois critères
échocardiographiques... 23
Table 6.1: Summary of the characteristics of the prevalence, incidence and
all-cause mortality among aortic stenosis patients aged ≥20 years, Quebec, in 2015-2016 and changes observed between 2000-2001 and 2015-2015-2016 ... 46
Table 6.2: Characteristics of incident patients with aortic stenosis, 2000-2001 and
2015-2016 ... 48
Supplementary Table 1: International Classification of Diseases 9 & 10
diagnostic codes used to define pure, combined and broader aortic stenosis and comorbidities not included in the Combined Charlson-Elixhauser Comorbidity Index ... 58
Supplementary Table 2: Canadian Classification of Diagnostic, Therapeutic and
Surgical Procedures (CCP) & Canadian Classification of Health Interventions (CCI) codes used to define interventions on the heart ... 61
Liste des figures
Figure 1.1: Représentation schématique de la direction du flux sanguin du cœur
... 3
Figure 1.2: Architecture de l’anneau et de la valve aortique ... 4
Figure 1.3: Coupe schématique du cœur montrant l’emplacement des feuillets de la valve aortique ... 5
Figure 1.4: Coupe histologique d’un feuillet de la valve aortique ... 6
Figure 1.5: Types de sténoses aortiques ... 7
Figure 1.6: Facteurs de risque contribuant au développement de la sténose aortique ... 9
Figure 1.7: Phases de la sténose aortique calcifiante ... 10
Figure 1.8: Histoire naturelle de la sténose aortique ... 15
Figure 1.9: Changement dans la mortalité ajustée pour l’âge due aux cardiopathies rhumatismales ... 16
Figure 1.10: Prévalence de la sténose aortique dans l’étude de Tromsø ... 17
Figure 1.11: : Incidence ajustée pour l’âge et le sexe de la sténose aortique en Écosse entre 1997 et 2005 ... 18
Figure 1.12: Incidence ajustée pour le sexe de la sténose aortique en Ontario selon le groupe d’âge entre 2004 et 2013... 19
Figure 2.1a: Vitesse maximale d’éjection du sang du VG dans l’aorte par Doppler continu ... 22
Figure 2.1b: Illustration du calcul de l’aire valvulaire aortique par l’équation de continuité qui stipule que le volume sanguin avant la valve se retrouve après la valve ... 22
Figure 2.2: Survie sur 3 ans de patients atteints de différents types de sténose aortique sévère ... 25
Figure 3.1: Représentation photographique d’un remplacement de la valve aortique par voie chirurgicale ... 27
Figure 3.2: Modèles de valves aortiques mécaniques ... 28
Figure 3.3: Modèles de valves aortiques bioprothétiques ... 29
Figure 3.4: Prothèses valvulaires aortiques sans stent ou ne nécessitant pas de sutures ... 30
Figure 3.5: Représentation schématique d’un TAVI ... 31
Figure 3.6: Différentes voies d’implantation possibles pour un TAVI ... 32
Figure 3.7: Modèles de valves aortiques utilisées en TAVI ... 33
Figure 6.1: Age-standardized prevalence and number of prevalent cases of aortic stenosis by sex, for people aged ≥20 years, Quebec, 2000-2001 to 2015-2016... 47 Figure 6.2: Age-standardized incidence and number of incident cases of aortic stenosis, by sex, for people aged ≥20 years, Quebec, 2000-2001 to 2015-2016…50 Figure 6.3: Age-standardized all-cause mortality rates and number of deaths in aortic stenosis cases, by sex, for people aged ≥20 years, Quebec, 2000-2001 to 2015- 2016 ... 51
Figure 6.4: Age-standardized percentage and number of operated cases among
2001 to 2015-2016 ... 52
Figure 6.5a: Age-standardized percentage of 30-day mortality among incident
cases of aortic stenosis, with or without valve intervention, for people aged ≥ 20 years, Quebec, 2001 to 2014 ... 53
Figure 6.5b: Age-standardized percentage of 1-year mortality among incident
cases of aortic stenosis, with or without valve intervention, for people aged ≥ 20 years, Quebec, 2001 to 2014 ... 54
Supplementary Figure 1: Age-Standardized Prevalence of Pure, Combined and
Broader Aortic Stenosis for People aged ≥20 Years, Quebec, 2000-2001 to 2015- 2016 ... 59
Supplementary Figure 2: Age-specific prevalence and number of prevalent
cases of aortic stenosis, by sex, Quebec, 2015-2016 ... 60
Supplementary Figure 3: Age-specific incidence and number of incident cases
Liste des sigles
Apo : apolipoprotéine AS : aortic stenosis (=SA, sténose aortique) AVA : aire valvulaire aortique
AVAI : aire valvulaire aortique indexée par la surface corporelle CABG : Coronary artery bypass graft (pontage coronarien)
CCI : Canadian Classification of Health Interventions (Classification canadienne des interventions en santé)
CCP : Canadian Classification of Diagnostic, Therapeutic and Surgical Procedures (Classification Canadienne de procédures diagnostiques, thérapeutiques et chirurgicales)
eNOS : synthase endothéliale d’oxyde nitrique F : flux transvalvulaire
FN : flux transvalvulaire normal FB : flux transvalvulaire normal
G : gradient de pressionGE : gradient de pression élevé GB : gradient de pression bas
HIN : health insurance number (numéro d’assurance sociale) ICAM-1 : molécule 1 d’adhérence intercellulaire
ICD : International Classification of Diseases (classification internationale des maladies)
IL : interleukinesLDL : lipoprotéines de basse densité (low-density lipoprotein) Lp(A) : lipoprotéine A
Lp-PLA2 : lipoprotéine-phospholipase A2
NADPH : oxydase de la nicotinamide adénine dinucléotide phosphate NF-κB : facteur nucléaire κB OPG : ostéoprotégérine
PCI : Percutaneous coronary intervention (angioplastie coronaire) PMO 2 : protéine morphogénétique osseuse 2
QICDSS : Quebec Integrated Chronic Disease Surveillance System (système intégré de surveillance des maladies chroniques du Québec)
RANK : récepteur activant le facteur nucléaire κB
RANKL : ligand du récepteur activant le facteur nucléaire κB RUNX2 : runt-related
transcription factor 2
RVA : remplacement valvulaire aortique SA : sténose aortique
SAVR : Surgical aortic valve replacement (=RVA, remplacement valvulaire aortique)
TAVI : Implantation d’une valve aortique par voie percutanée (transcatheter aortic
valve implantation)
TLR : récepteurs de type Toll
TNF : facteur nécrosant des tumeurs (tumor necrosis factor) VCAM-1 : molécule d’adhérence aux cellules vasculaires 1 VE : vitesse d’éjection
VG : ventricule gaucheVIC : cellulaires valvulaires interstitielles (valvular interstitial
Remerciements
Durant ces deux années de maîtrise, beaucoup de personnes ont participé de près ou de loin à ma formation, que ce soit sur le plan scientifique ou humain. J’aimerais donc prendre le temps de les remercier, car je ne serais pas rendu à l’endroit auquel je me trouve sans elles.
Tout d’abord, j’aimerais remercier ma directrice de recherche, la Dre Marie-
Annick Clavel pour m’avoir donné l’occasion de m’initier à la recherche clinique
lors de mes stages, puis pour m’avoir proposé ce projet de nature épidémiologique lorsque je lui ai fait part de mon intérêt dans ce domaine. Son énergie, son leadership et ses qualités humaines ont été une source d’inspiration pour moi et je m’estime chanceux d’avoir pu évoluer sous son mentorat.
Pour continuer, j’aimerais également remercier ma co-directrice de recherche, la Dre Claudia Blais pour le chaleureux accueil que j’ai eu à l’Institut national de santé publique du Québec. J’ai avant tout pu constater à quel point ma réussite lui tient à cœur, ce qui se reflète notamment dans le temps qu’elle a consacré à discuter avec moi non seulement de mon projet de recherche, mais aussi de toutes les présentations orales, demandes de bourse et résumés soumis pour les congrès auxquels j’ai eu la chance de participer. Je lui suis reconnaissant pour ses conseils et ses multiples relectures de mes travaux.
Ensuite, j’aimerais remercier le Dr Philippe Pibarot. Malgré son horaire chargé et ses nombreuses obligations, il sait toujours se rendre disponible pour les étudiants évoluant sous son égide. Pendant ma formation, j’ai pu profiter de sa profonde connaissance de son domaine, de nombreux conseils de sa part ainsi que d’un excellent café lors de réunions de laboratoire. Marie-Annick, Philippe, c’était un privilège de faire partie de vos équipes de recherche.
Je tiens également à remercier Denis Hamel, qui a toujours su faire preuve de disponibilité lorsqu’il me fallait d’autres données ou lorsque j’avais des questions reliées aux analyses statistiques.
Je tiens aussi à remercier les étudiants que j’ai pu côtoyer au laboratoire durant ces deux années. Merci à Lionel, Mylène, Julien, Mohamed Salah,
Sébastien, Jérémy, Jasmine, Martine, Charles, Thomas, Amélie, ainsi qu’à
tous les autres, non seulement pour les moments plus académiques, mais également pour les bons moments de camaraderie que nous avons pu partager.
Finalement, j’aimerais aussi remercier les autres membres des équipes de la Dre Marie-Annick Clavel et du Dr Philippe Pibarot, Martine Fleury, Martine
Parent, Yvette Parent, Mireille Goupil et Sylvie Morin pour leur aide
indispensable dans le bon fonctionnement du laboratoire. Merci également à la
Avant-propos
Les travaux de recherche de ce projet ont été effectués au Centre de Recherche de l’Institut Universitaire de Cardiologie et de Pneumologie de Québec- Université Laval (CRIUCPQ-Université Laval) ainsi qu’à l’Institut national de santé publique du Québec (INSPQ), tous deux à Québec.
Les analyses statistiques ont été réalisées exclusivement à l’Institut national de santé publique du Québec, avec des données issues du Système intégré de surveillance des maladies chroniques du Québec.
Les résultats obtenus dans le cadre de cette maîtrise seront soumis à la revue scientifique Heart sous la forme d’un article scientifique intitulé « The Evolution of the Burden of Aortic Stenosis in the Province of Quebec between 2000 and 2015 » en février 2021.
Les coauteurs du manuscrit sont : Claudia Blais, Denis Hamel, Philippe Gamache, Philippe Pibarot et Marie-Annick Clavel.
La Dre Claudia Blais, Denis Hamel et Philippe Gamache ont participé à l’élaboration du protocole de recherche. La Dre Claudia Blais est co-superviseure du projet présenté dans ce mémoire. Denis Hamel et Philippe Gamache ont également extrait les données nécessaires aux analyses statistiques du Système intégré de surveillance des maladies chroniques du Québec. Le Dr Philippe Pibarot a relu le manuscrit et a aidé dans l’interprétation des résultats. Il est également co- superviseur du projet présenté dans ce mémoire. La Dre Marie-Annick Clavel a aidé dans l’interprétation des résultats et a relu le manuscrit. Elle est également la superviseure du projet présenté dans ce mémoire.
Introduction
La sténose aortique (SA) est la maladie valvulaire nécessitant le plus d’interventions et la troisième maladie cardiovasculaire la plus répandue après l’hypertension artérielle systémique et la maladie coronarienne dans les pays à haut revenu. C’est une maladie caractérisée par un remodelage fibrocalcifiant ainsi qu’un rétrécissement progressif de l’ouverture de la valve aortique.1 Il s’agit de la
maladie valvulaire la plus prévalente dans les pays à haut revenu, où elle touche surtout la population âgée, c’est-à-dire les individus de 65 ans et plus. La prévalence de la SA augmente avec l’âge2,3 et la maladie a le potentiel de devenir
une préoccupation majeure pour la santé publique.4
La principale étiologie de la maladie dans les pays à haut revenu est la SA calcifiante, qui est caractérisée par une rigidification et une calcification progressive de la valve aortique, ce qui restreint sa compliance et son ouverture. La réduction de l’ouverture de la valve aortique oppose un obstacle au passage du flux sanguin depuis le ventricule gauche (VG) du cœur vers le reste du corps, ce qui cause une surcharge de pression à laquelle le VG doit s’adapter et peut aboutir à une diminution du débit.5
La sévérité de la SA peut varier, allant de légère à sévère. La plupart du temps, les patients ne présentent pas de symptômes jusqu’à ce que le cœur ne puisse plus s’adapter et/ou que le flux sanguin devienne trop faible que ce soit lors d’activité physique plus soutenue ou même au repos.6 En s’hypertrophiant, le VG
réduit sa lumière, réduisant par le même fait le volume de sang pouvant être pompé vers l’aorte. La condition peut mener, si elle est assez sévère, à l’insuffisance cardiaque et à la mort.7
Le fardeau de la SA dans les pays à haut revenu est potentiellement en augmentation en parallèle au phénomène du vieillissement de la population8,9 et à
l’augmentation de la prévalence de facteurs de risque cardiométaboliques.10-12 Des
études sur le sujet ont été menées ailleurs dans le monde avec des résultats qui semblent contradictoires. Une étude conduite en Écosse13 et une en Ontario14 ont
constaté une augmentation de l’incidence de la SA, alors qu’une étude menée en Suède a montré une tendance à l’inverse.15
Il n’existe pas encore de traitement pharmacologique permettant d’enrayer, voire de ralentir la progression de la SA.16 Présentement, les seuls recours pour
un malade sont le remplacement de sa valve aortique, soit par l’intermédiaire d’une chirurgie à cœur ouvert (RVA)17 soit par voie percutanée (TAVI, transcatheter
aortic valve implantation).18 Auparavant, le recours au TAVI se limitait aux patients
que l’on soupçonnait être inopérables, c’est-à-dire des patients souvent très âgés ou avec de graves comorbidités ou pouvait être une alternative acceptable pour les patients «à haut risque chirurgical».19,20 Cependant, en 2016, une étude a
montré que des patients à risque intermédiaire auraient aussi une indication favorable au TAVI.21 Plus récemment, en 2019, une possible supériorité du TAVI
face au RVA à 1 an chez des patients à faible risque chirurgical a également été constatée.22 À la suite de ces découvertes et à l’arrivée du TAVI dans la pratique
clinique de routine dans la dernière décennie, le traitement de la SA fait face à un changement de paradigme majeur. L’introduction de cette intervention a changé la prise en charge de patients autrefois inopérables ou à haut risque chirurgical et peut possiblement être implantée chez une catégorie plus large de patients.
Face à l’hétérogénéité de l’évolution du fardeau de la SA ailleurs dans le monde et au changement de la prise en charge de la maladie dans les dernières années, il est impératif d’évaluer l’évolution du fardeau de la SA au Québec.
L’objectif de ce mémoire sera donc d’évaluer l’évolution du fardeau de la SA au Québec. Plus précisément, il s’agira d’examiner l'évolution de la prévalence, de l'incidence, de la mortalité toute-cause et de l'utilisation des interventions valvulaires aortiques au Québec entre les années financières 2000-2001 à 2015- 2016 ainsi que d'examiner l'évolution des taux de mortalité à 30 jours et à un an chez les nouveaux patients atteints de SA dans la même période de temps.
Chapitre 1 La sténose aortique
1.1 La valve aortique
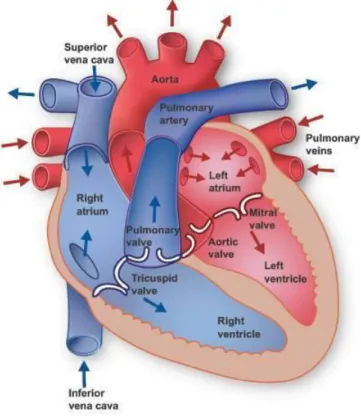
La valve aortique se situe entre le ventricule gauche (VG) du cœur et la racine de l’aorte (Figure 1.1). Lorsque le VG se contracte, la pression dans la chambre cardiaque augmente, ce qui ouvre la valve et permet au sang expulsé de passer vers l’aorte, puis vers le système artériel dans le but d’irriguer le corps de sang oxygéné.23 Lorsque le VG se remplit de sang, une valve aortique saine se
refermera en réponse à la baisse de pression dans le VG. Cette fermeture de la valve empêche le sang expulsé vers l’aorte de retourner dans le VG. De cette manière, lorsque la valve fonctionne telle qu’elle le devrait, le sang peut uniquement être expulsé du VG vers l’aorte.24
Figure 1.1 : Représentation schématique de la direction du flux sanguin du cœur.
Tiré de : http://www.medecine-integree.com/systeme-circulatoire-le-coeur/#.VrtYlP nhC00
La valve aortique est composée de trois structures : l’anneau aortique, les feuillets de la valve et les commissures. L’anneau se trouve à la jonction entre le VG et la racine aortique (Figure 1.2). Il s’agit d’un tissu fibreux riche en collagène qui est relié au myocarde d’une façon analogue à l’attachement de tendons aux muscles squelettiques.23,25 L’anneau a une forme de couronne et est lié aux bases
des feuillets de la valve.26
Figure 1.2 : Architecture de l’anneau et de la valve aortique. Tiré de : (27)
La valve aortique a trois feuillets, sauf chez environ 0,5 à 2% de la population, qui aurait une valve bicuspide, ce qui est une anomalie congénitale.28
Les trois feuillets sont nommés selon leur proximité aux ostia des artères coronaires (Figure 1.3). Ainsi, il y a le feuillet coronaire gauche, coronaire droit et non-coronaire. Ces feuillets sont ancrés à l’anneau aortique et ont une forme semi-lunaire.29 Les feuillets sont composés de plusieurs couches de tissu. Tout d’abord,
ils sont couverts d’une couche de cellules endothéliales jointes les unes aux autres de la même façon que dans le reste du système vasculaire.23 Ces cellules jouent
un rôle dans l’équilibre homéostatique du feuillet. Elles vont notamment être impliquées dans la régulation de réactions immunitaires et inflammatoires.30,31
Figure 1.3 : Coupe schématique du cœur montrant l’emplacement des feuillets de
la valve aortique. A : feuillet coronarien gauche; B : feuillet coronarien droit; C : feuillet non-coronarien. Tiré de : (32)
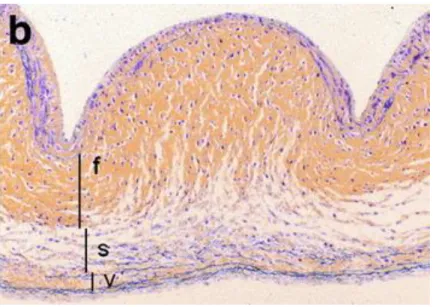
Entre ces cellules endothéliales se trouvent trois couches de tissu conjonctif appelées, du côté ventriculaire vers le côté aortique du feuillet, la lamina
ventricularis, la lamina spongiosa et la lamina fibrosa (Figure 1.4). La ventricularis
contient du collagène ainsi que des fibres d’élastine ayant une orientation radiale. Cet arrangement des fibres de collagène et d’élastine a comme fonction de contrer les effets des contraintes subies par les feuillets lors de l’ouverture et de la fermeture de la valve. La spongiosa est caractérisée par une plus haute concentration de glycosaminoglycanes et sert surtout à lubrifier les couches de tissu conjonctif qui l’entourent. La fibrosa, située du côté aortique du feuillet, est surtout constituée de fibres de collagène de type I et III arrangées d’une façon circonférentielle. Cette couche de tissu conjonctif maintient la structure du feuillet et est cruciale dans la résistance des feuillets aux contraintes mécaniques qu’ils subissent.30,31,33
Figure 1.4 : Coupe histologique d’un feuillet de la valve aortique. F : fibrosa; S :
spongiosa; V : ventricularis. Tiré de : (24)
Les trois couches de tissu fibreux contiennent également différents types de cellules, des cellules valvulaires interstitielles (VIC), des cellules musculaires lisses, bien que ces dernières représentent moins de 5% des cellules dans les feuillets ainsi que des myofibroblastes. Elles joueront un rôle dans le maintien des structures internes des feuillets.34
Les commissures, au nombre de trois, réfèrent à l’endroit auquel les feuillets valvulaires s’attachent à la paroi de l’aorte. Les forces auxquelles les feuillets de la valve aortique fermée font face sont transférées à l’anneau et à la paroi aortique au niveau de ces structures.35
1.2 Étiologies
La plupart du temps, la SA trouve son origine dans trois causes : la fièvre rhumatismale, une valve aortique bicuspide, soit avec deux feuillets et non trois, ou alors la maladie valvulaire calcifiante (Figure 1.5).
Figure 1.5 : Types de sténoses aortiques. A : Valve aortique normale; B :SA
congénitale (bicuspidie); C : SA rhumatismale; D : SA calcifiante. Tiré de : https://thoracickey.com/valvular-heart-disease-2/
Depuis les années 1970, les cas de SA causés par la fièvre rhumatismale sont à la baisse dans les pays à haut revenu, au profit d’une augmentation de cas de SA causés par la maladie valvulaire calcifiante.36 Si le patient a une SA à la
suite d’une fièvre rhumatismale, sa valve mitrale, entre l’oreillette gauche et le VG sera aussi affectée dans la plupart des cas. Une caractéristique qui distingue une SA causée par cette maladie est une fusion des commissures des feuillets de la valve, ce qui permet de la distinguer de la SA résultant d’une maladie valvulaire calcifiante.37
La SA peut aussi avoir une cause congénitale, soit la SA causée par la bicuspidie de la valve. Même en présence d’une bicuspidie, certains individus ne développeront pas une SA sévère.28,38 Ils ont cependant plus de risques de
développer la SA que les individus n’ayant pas cette anomalie.39 La SA se
développant chez cette population survient généralement plus tôt que la SA causée par la maladie valvulaire calcifiante. Ainsi, dans les pays à haut revenu, la plupart
des cas de SA chez des individus de moins de 65 ans sont attribuables à la bicuspidie de la valve aortique.28,38
La maladie valvulaire aortique calcifiante est la cause la plus commune de la SA dans les pays à haut revenu et chez les personnes âgées. La SA attribuable à cette cause survient généralement entre le début de la soixantaine et la fin de la 8e décennie de la vie d’un individu. Elle est causée par l’apparition et le
développement de nodules contenant notamment du calcium solide dans les feuillets de la valve.40,41
1.3 Facteurs de risque de la SA calcifiante
Les facteurs de risque de la SA peuvent être divisés en facteurs de risque génétiques et cliniques.
1.3.1 Facteurs de risque génétiques
Plusieurs preuves existent quant à un possible lien entre la présence de variantes de certains gènes et la hausse de l’incidence de la SA chez les individus qui les portent. Tout d’abord il est à noter que la SA peut notamment être causée par une anomalie congénitale, soit la bicuspidie de la valve aortique. La présence de cette anomalie congénitale est donc un facteur de risque génétique qui peut être transmis aux générations suivantes.42 Le lien entre certaines variantes
génétiques du gène de la lipoprotéine A (Lp(A)) et la SA a été mis en évidence. Ainsi, un polymorphisme d’un seul nucléotide dans le locus du gène de la Lp(A) (rs10455872) a été associé à une calcification de la valve aortique.43 Il est aussi
connu que la présence de mutations du gène NOTCH1 seraient associées au développement et à la progression de la SA. En effet, le gène NOTCH1 serait impliqué dans une cascade de signalisation impliquant l’ostéoprotégérine (OPG), le récepteur activant le facteur nucléaire κB (RANK) et son ligand (RANKL). Cette cascade signalétique est impliquée dans les processus ostéogénétiques. OPG réprime l’activation de la cascade qui, une fois activée, promeut la calcification ostéogénique dans les cellules valvulaires interstitielles humaines.44 Il a
également été montré qu’une haploinsuffisance de NOTCH1 dans des cellules endothéliales humaines cultivées in vitro perturbe la réponse de ces cellules au stress mécanique et joue un rôle dans l’initiation d’une réponse ostéogénique et inflammatoire.45
1.3.2 Facteurs de risque cliniques
Différents facteurs de risque cliniques peuvent influencer le développement et la progression de la SA. Les principaux facteurs de risque sont l’âge avancé et le sexe masculin (Figure 1.6). D’autres facteurs de risque associés à la maladie sont l’hypertension artérielle systémique, l’obésité, la dyslipidémie, le syndrome métabolique, le diabète, l’insuffisance rénale et le tabagisme.46-50
Figure 1.6 : Facteurs de risque contribuant au développement de la SA
calcifiante. Tiré de : (33)
1.4 Physiopathologie de la SA calcifiante
La SA a longtemps été comprise comme étant l’aboutissement d’un processus dégénératif de la valve aortique causé par le vieillissement des feuillets et au dépôt progressif de calcium au sein de ces derniers. Cependant, cette compréhension de la maladie a évolué au cours des dernières décennies.51 La SA
calcifiante s’est avérée être une maladie complexe impliquant notamment un processus d’inflammation, de fibrose et de calcification (Figure 1.7).33,52
Figure 1.7 : Phases de la SA calcifiante. LDL : : lipoprotéines de basse densité
(low-density lipoprotein); Lp(a) : lipoprotéine A ; oxLDL : LDL oxydés ; oxPL : phospholipides oxydés ; eNOS : synthase endothéliale d’oxyde nitrique; ROS : espèces réactives d’oxygène (Reactive oxygen species); LysoPC : lysophosphatidylcholine; VIC : cellules valvulaires interstitielles (valvular interstitial
cell); BMP-2 : protéine morphogénétique osseuse 2 (Bone morphogenetic protein 2) WNT : Wingless & Int-1; TGF-β : Transforming growth factor; IL-1β :
interleukine-1β; TNF : facteur nécrosant des tumeurs (tumor necrosis factor); IL :6 : interleukine 6; ENPP1 : ectonucleotide pyrophosphatase/phosphodiesterase 1; ATP : adénosine triphosphate; AMP :
adénosine monophosphate; PPi : pyrophosphate; RANK : récepteur activant le facteur nucléaire κB; RUNX2 : Runt-related transcription factor 2. Tiré de : (53)
1.4.1 Inflammation
La SA débute par l’endommagement des feuillets de la valve dû à divers facteurs tels que le stress mécanique. Une fois endommagé, le feuillet serait sujet à l’infiltration de lipoprotéines de basse densité (LDL) ainsi que d’apolipoprotéines (apo) telles que apoA1, apo(a) et apoB. En plus de la présence de ces infiltrats, une dérégulation de la voie de la synthase endothéliale d’oxyde nitrique (eNOS) et une augmentation de la concentration de l’oxydase de la nicotinamide adénine dinucléotide phosphate (NADPH) ont été constatées dans des valves aortiques humaines explantées.54-56
La combinaison de la dérégulation de la voie eNOS ainsi que la présence accrue de l’oxydase de la NADPH pourraient être à l’origine d’un stress oxydatif accru subi par les infiltrats lipoprotéiques. Ainsi, il y aurait formation de LDL oxydés (oxLDL) et de phospholipides oxydés (oxPL). Les phospholipides oxydés peuvent être transformés en lysophosphatidyl-choline (LysoPC) par la lipoprotéine-phospholipase A2 (Lp-PLA2), ce qui peut conduire à l’apoptose de VIC. Les
concentrations de Lp-PLA2 étant supérieures dans le tissu valvulaire aortique
sténosé, cette réaction pourrait contribuer à la compréhension des raisons derrière l’apoptose des VIC dans le contexte de la SA.57,58 De plus, les ox-LDL induisent
une régulation positive de molécules d’adhésion cellulaires telles que la molécule 1 d’adhérence intercellulaire (ICAM-1) et la molécule d’adhérence aux cellules vasculaires 1 (VCAM-1), ce qui augmente l’adhérence puis l’extravasation de cellules immunitaires telles que les lymphocytes T et les macrophages.54,59,60
Les lipides oxydés vont également induire une réponse inflammatoire dans le tissu valvulaire. Les cellules immunitaires locales telles que les macrophages, les lymptocytes T et les mastocytes s’activeront à la suite de l’absorption de ces molécules.30,61 L’activation de ces cellules est dû notamment à l’activation de
récepteurs de la classe des récepteurs de type Toll (TLR) et de la voie du facteur nucléaire κB (NF-κB).62 Les monocytes et macrophages ainsi activés stimulent la
facteur de nécrose tumoral (TNF), suivi par l’activation de NF-κB et de la sécrétion d’interleukines (IL) -1β et 6.64-67
1.4.2 Fibrose
Après la phase inflammatoire, la maladie entre dans sa phase fibrotique. Durant cette phase, les VIC se mettent à exprimer des phénotypes myofibroblastiques. Cette phase semble trouver son origine dans la sécrétion de cytokines par les cellules immunitaires infiltrées dans les feuillets de la valve.27,68
Ces myofibroblastes sécréteront à leur tour des composantes de la matrice extracellulaire telles que le collagène, ce qui initie la phase fibrotique à proprement parler.69
De plus, une activation de métalloprotéinases présentes dans la matrice extracellulaire des feuillets de la valve aortique contribuerait à leur remodelage fibrotique. Outre cela, une sous-production d’inhibiteurs des métalloprotéinases contribuerait à la désorganisation de la matrice extracellulaire lors de cette phase.70 Le système rénine-angiotensine-aldostérone joue également un rôle dans
cette phase. En effet, les hauts niveaux sanguins d’angiotensine de type II activeraient la voie NF-κB, ce qui contribuerait également à une hausse de la fibrose valvulaire aortique.52,71
1.4.3 Calcification
La calcification des feuillets de la valve aortique est l’aboutissement du processus de sténose agissant sur cette dernière. Elle est en effet la principale caractéristique des valves sténosées.72 Certaines cascades de signalisation
trouvant leur origine dans le processus d’inflammation du feuillet valvulaire pourraient contribuer à l’initiation de cette phase.27,33,73 Le processus de
calcification semble avoir des similarités avec le processus de la formation osseuse. En effet, durant cette phase, les VIC seront amenés à exprimer un phénotype ostéoblastique. Certains gènes dont notamment la protéine morphogénétique osseuse 2 (PMO2) et le runt-related transcription factor 2
(RUNX2) seront surexprimés dans les cellules affectées. À la suite de ce processus, les cellules touchées sécréteront des vésicules qui amorceront la calcification à proprement parler.74,75
La calcification ne dépend cependant pas que de ce mécanisme. Une conséquence du processus d’inflammation des feuillets de la valve aortique est notamment la mort localisée de cellules, suivi d’un relâchement de corps apoptotiques qui vont promouvoir une calcification diffuse. Le relâchement de vésicules extracellulaires par les macrophages et les VIC contribuera également au phénomène. Le processus de calcification augmentera à son tour la réponse immunitaire, ce qui commence un cercle vicieux dans lequel la réponse immunitaire stimule davantage de calcification, qui, à son tour, stimule une réponse immunitaire supplémentaire.76-79
De plus, l’apoptose cellulaire initiée dans la phase inflammatoire ainsi que les corps apoptotiques qui en résultent ont également des propriétés ostéogéniques et calcifiantes.80 Finalement, la diminution de la production de la
Fétuine A et de la Matrix Gla Protein, toutes deux pouvant agir à l’encontre de la calcification, semble également jouer un rôle dans le processus.69,81-83
1.4.4 Impact de la sténose aortique sur le ventricule gauche
Le remodelage fibrocalcifiant de la valve aortique induit une réduction progressive de l’ouverture normale de ses feuillets. Cette réduction oppose un obstacle à l’éjection du sang depuis le VG vers le reste du corps. La surcharge de pression causée par la SA et le stress myocardique en résultant induisent une adaptation du VG. Face à ces contraintes et dans le but de maintenir un débit sanguin adéquat, l’épaisseur des parois du VG augmente.5 Au début, cette
adaptation est réversible. Cependant, au fur et à mesure que la maladie devient plus sévère, l’hypertrophie devient pathologique et nuit au bon fonctionnement du myocarde, que ce soit par ischémie ou par la mort des myocytes, ce qui engendre de la fibrose. À ce stade, l’adaptation devient irréversible.84 En s’hypertrophiant, le
sanguin pouvant être pompé vers l’aorte. Lorsque la maladie est suffisamment avancée, la diminution du volume sanguin pompé vers l’aorte sera également due à la perte de fonction du VG. La condition peut mener, si elle est assez sévère, à l’insuffisance cardiaque et enfin, au décès du malade.7
1.5 Histoire naturelle
Pendant plusieurs décennies, la SA était comprise comme un processus passif de dégénération de la valve aortique avec l’avancement en âge accompagné d’accumulation de calcium. Toutefois, tel que vu dans la section précédente, la SA calcifiante est un processus actif qui s’étale sur plusieurs années et qui est caractérisé par une apparition tardive des symptômes.33
1.5.1 Sclérose aortique
La maladie se présente tout d’abord sous cette forme et est présente chez environ 29% des individus de 65 ans et plus.50,85 Elle se distingue par un
épaississement des feuillets de la valve aortique et une absence d’obstruction du flux sanguin entre le VG et la racine aortique. Même si elle ne cause pas de symptômes, sa présence n’est pas inoffensive. En effet, une sclérose aortique est associée à une augmentation d’environ 50% du risque d’infarctus du myocarde et de mort cardiovasculaire.85,86 De plus, environ 10% des patients ayant une
sclérose aortique développeront une SA durant une période de 5 ans.87
1.5.2 Sténose aortique
La SA commence par une longue période de latence pendant laquelle la maladie progresse et s’aggrave graduellement. Les symptômes de la maladie apparaissent lorsque le cœur du malade perd sa capacité à s’adapter à la compliance réduite de la valve aortique. Quand ce point est atteint, la mortalité des patients augmente d’une façon marquée (Figure 1.8).41,88,89 En effet, jusqu’à
la moitié des patients sont à risque de décéder dans la première à la deuxième année après l’apparition des symptômes.90-92 L’âge moyen de l’apparition de
dernières années, ce qui reflète la diminution de l’incidence de SA causée par une fièvre rhumatismale ou une anomalie congénitale au profit de la SA calcifiante.93
L’apparition de symptômes marque une étape cruciale de l’histoire naturelle de la SA. Ils comprennent notamment de l’angine, de la dyspnée, puis des syncopes qui peuvent survenir notamment lorsque le patient fait de l’activité physique.94-97
Figure 1.8 : Histoire naturelle de la sténose aortique. Tiré de : (98)
1.6 Épidémiologie
L’épidémiologie de la SA varie lorsque l’on compare les pays à haut revenu aux pays à bas revenu. En effet, la SA résultant de la fièvre rhumatismale reste dominante dans les pays à bas revenu, alors que la SA résultant d’une maladie calcifiante de la valve aortique représente la cause principale d’hospitalisation pour SA dans les pays à haut revenu.99 Ainsi, les populations touchées par la SA
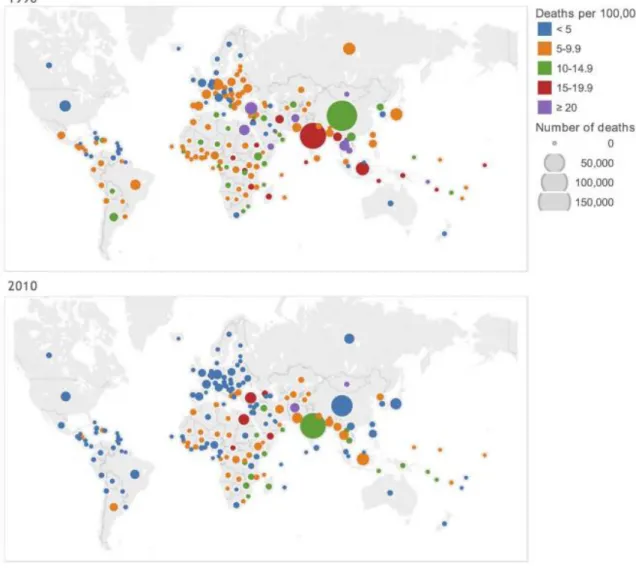
sont également différentes entres ces deux catégories de pays. Alors que ce sont surtout les personnes âgées qui sont touchées par la SA dans les pays à haut revenu, la maladie touche davantage des individus plus jeunes, parfois même des enfants lorsque l’étiologie dominante est la fièvre rhumatismale.99 Au niveau
toutefois diminué, sauf dans quatre pays, soient la Géorgie, le Zimbabwe, le Swaziland et le Burkina Faso (Figure 1.9).99
Figure 1.9 : Changement dans la mortalité ajustée pour l’âge due aux
cardiopathies rhumatismales. Tiré de : (99)
Dans les pays à haut revenu, la SA reste une maladie relativement rare chez les individus de moins de 65 ans s’ils ne présentent pas d’anomalie congénitale de la valve. Une méta-analyse incluant des études publiées entre 1993 et 2012 provenant de certains pays européens, des États-Unis et de Taïwan a mis en évidence des prévalences de la SA chez les personnes âgées allant de 2,6 à 22,8%, dépendamment des populations cibles des études individuelles. La
prévalence groupée de la SA chez les personnes âgées de 75 ans et plus était d’environ 12,0% selon la méta-analyse. De plus, la prévalence groupée de SA sévère chez les individus de 75 ans et plus était de 3,4%.100 La prévalence de la
maladie augmente de façon exponentielle avec l’âge. En effet, l’étude de Tromsø a montré une prévalence de 0,2% chez les 50-59 ans, de 1,3% chez les 60-69 ans, de 3,9% chez les 70-79 ans et de 9,8% chez les 80-89 ans (Figure 1.10).2
Figure 1.10 : Prévalence de la sténose aortique dans l’étude de Tromsø. La figure
montre des moyennes pondérées des enquêtes de Tromsø 4, 5 et 6 incluant les données hospitalières. Tiré de : (2)
L’évolution de l’incidence de la SA dans les pays à haut revenu, n’est pas tout à fait uniforme. Ainsi, une étude conduite en Écosse a constaté une augmentation de l’incidence ajustée pour l’âge et le sexe de la SA isolée (sans autre maladie de la valve aortique) hospitalisée entre 1997 et 2005, passant de 246 à 365 cas par million, une augmentation relative de 48% (figure 1.11).13 En
Ontario, la même tendance à la hausse a été constatée, l’incidence ajustée pour l’âge et le sexe de la SA hospitalisée passant de 36 par 100 000 en 2004 à 39 par
100 000 en 2013, soit une augmentation relative de 8,3% (figure 1.12).14
Cependant, une étude conduite en Suède a mis en évidence une tendance inverse, avec des taux d’incidence ajustés pour l’âge par 100 000 de la SA hospitalisée ou ambulatoire allant de 15,0 en 1989-1991 à 11,4 en 2007-2009 pour les hommes et de 9,8 à 7,1 chez les femmes dans la même période de temps, des diminutions relatives de l’incidence ajustée de la SA de 24 et de 28%, respectivement (Tableau 1.1).15 Un point majeur qui différencie cette étude des
deux citées précédemment est que l’étude n’utilise que les diagnostics principaux pour définir un cas incident de SA et n’utilise pas les diagnostics secondaires, ce qui pourrait contribuer à la différence constatée dans les tendances.
Figure 1.11 : Incidence ajustée pour l’âge et le sexe de la sténose aortique
hospitalisée en Écosse chez les personnes âgées ≥ 18 ans entre 1997 et 2005. Tiré de : (13)
Figure 1.12 : Incidence ajustée pour le sexe de la sténose aortique hospitalisée
en Ontario selon le groupe d’âge chez les personnes âgées ≥ 20 ans entre 2004 et 2013. Tiré de : (14)
Tableau 1.1 : Incidence brute et ajustée pour l’âge de la sténose aortique
hospitalisée ou ambulatoire en Suède chez les personnes âgées > 18 ans entre 1989-1991 et 2007-2009. Tiré de : (15)
Les projections du fardeau de la SA dans les pays à haut revenu sont à la hausse. En effet, la maladie sévit surtout chez les personnes âgées puisque la prévalence de la maladie augmente de façon exponentielle avec l’âge. La proportion d’individus âgés de 65 ans et plus a augmenté dans l’ensemble des pays
de l’Union Européenne, avec des tendances similaires présentes au Royaume-Uni.101 L’Amérique du Nord n’est pas épargnée par ce phénomène. En effet, on
prévoit que le quart de la population canadienne sera âgée de 65 ans et plus dans les 20 prochaines années102 et il est projeté que cette proportion sera d’environ
Chapitre 2 Diagnostic et grades de sévérité de
la sténose aortique
Une SA peut être suspectée lors d’un examen physique, pendant une auscultation du cœur. Lors de l’évaluation du patient, le médecin peut entendre un souffle systolique qui peut l’amener à soupçonner la présence de la maladie. Cet indice ne prédit cependant pas adéquatement la présence ni la sévérité de la SA dans la population générale. Un autre outil à la disposition des médecins et l’estimation de la pression aortique par le moyen de la palpation des artères carotides, plus précisément par l’amplitude et le temps reliés au pouls carotidien. Finalement, une altération du second bruit cardiaque peut également servir d’indice. En effet, si celui- ci paraît faible ou absent, et que d’autres indices portant à croire à une possible SA sont présents, le médecin pourrait inviter le patient à passer des examens plus poussés pour établir un diagnostic de SA. En effet, bien qu’une auscultation permette au médecin de soupçonner une présence de SA chez le patient, elle ne représente pas un outil permettant un diagnostic définitif.104
2.1 Diagnostic
La méthode diagnostique la plus communément utilisée dans la détection et la surveillance de la maladie est l’échocardiographie Doppler. Elle rend aussi possible l’émission de recommandations quant aux mesures à prendre face à la maladie, allant de la surveillance périodique de la progression de la sténose avec des examens ultérieurs à la recommandation du remplacement de la valve, si la sténose est suffisamment sévère ou que la fonction cardiaque du patient est compromise. En échocardiographie, les recommandations pour la classification de la sévérité de la SA se basent surtout sur la vitesse maximale d’éjection du sang du VG dans l’aorte (VE) (Figure 2.1a), le gradient de pression moyen entre les deux cavités (G) qui est calculer à partir de la vitesse dans l’aorte par l’équation de Bernoulli, l’aire de l’ouverture de la valve (AVA) qui est calculer par l’équation de continuité (Figure 2.1b). Cette dernière peut -être indexée par la surface corporelle pour donner l’aire valvulaire indexée (AVAI).17,105-107
Figure 2.1a : Vitesse maximale d’éjection du sang du VG dans l’aorte par
Doppler continu (Laboratoire Dr Clavel)
Figure 2.1b: Illustration du calcul de l’aire valvulaire aortique par l’équation
de continuité qui stipule que le volume sanguin avant la valve se retrouve après la valve (Laboratoire Dr Clavel) : 𝐶𝐶𝑉𝐺𝑎𝑖𝑟𝑒× 𝐼𝑇𝑉𝐶𝐶𝑉𝐺 = 𝐴𝑉𝐴 × 𝐼𝑇𝑉𝐴𝑜
VE= 3,21 m/s G=22 mmHg
Où CCVGaire : Aire de la chambre de chasse du ventricule gauche
ITVCCVG : intégrale temps-vélocité dans la CCVG
AVA= Aire valvulaire aortique
ITVAo : intégrale temps-vélocité dans l’aorte
2.2 Grades de sévérité
Ces mesures permettent de classifier les patients comme ayant une sclérose aortique, une SA légère, modérée ou sévère (Tableau 2.1). Voici les seuils classiques utilisés. Lorsque la VE est inférieure à 2 mètres/seconde, les patients seront considérés comme ayant une sclérose aortique. Lorsque la VE est dans la plage des 2,0-2,9 m/s, que le G est inférieur à 20 mm HG et que l’AVA est supérieure à 1,5 cm2, la sténose est considérée comme légère. Lorsque la VE est
dans la plage des 3,0-3,9 m/s, que le G est dans la zone des 20-39 mm HG et que l’AVA est entre 1,0 et 1,5 cm2, la sténose est considérée comme modérée.
Finalement, lorsque la VE est supérieure à 4,0 m/s, que le G est supérieur à 40 mm HG et que l’AVA est inférieure à 1,0 cm2, le médecin classifiera le patient dans
la catégorie des SA sévères.5,17,106
Tableau 2.1 : Sévérité de la sténose aortique selon trois critères
échocardiographiques.
Cependant, la SA est une maladie complexe dont la progression peut difficilement être simplifiée en quelques valeurs et seuils. Le gradient
transvalvulaire par exemple ne reflète pas toujours la sévérité de la SA. Cette mesure est calculée notamment à l’aide du flux transvalvulaire, soit le volume de sang fourni au corps par battement. Cette mesure dépend de l’ouverture de la valve aortique, mais aussi de la fonction systolique du VG. Le gradient varie selon le carré du flux, ce qui signifie qu’il est influencé par la réduction de l’ouverture de la valve et par la fonction systolique du VG.
Ainsi, une fonction systolique du VG compromise peut abaisser un gradient, même si la sténose est sévère.108 Cette imperfection dans les critères
diagnostiques « classiques » a été corrigée à la suite de discordances découvertes dans les critères diagnostiques échocardiographiques communément utilisés et la sévérité réelle de la SA de certains patients. Ainsi, certains patients sténotiques avaient une fraction d’éjection normale et un gradient bas, ce qui signifiait, selon les critères diagnostiques, que leur maladie n’était pas sévère. En réalité, leur maladie était tellement avancée que même si leur fraction d’éjection était normale, le flux transvalvulaire, soit le volume de sang fourni au corps par battement, était très bas. De plus, leur bas gradient transvalvulaire était dû à un début d’insuffisance cardiaque et ne reflétait donc pas la sévérité réelle de la sténose.109
Les mesures échocardiographiques utilisées pour diagnostiquer la maladie ont donc dû être modifiées pour inclure ces formes de SA. Ainsi, les sténoses aortiques sévères selon l’AVA et la fraction d’éjection sont séparées selon le flux transvalvulaire (F) (<35 ou ≥35 mL/battement) et le gradient (G) de pression transvalvulaire (<40 ou ≥40 mm Hg). Ainsi, le patient peut avoir un F normal (FN) ou bas (FB) ainsi qu’un G élevé (GE) ou bas (GB). Les quatre types de sténose sévère sont donc une combinaison de ces facteurs, soient : FN/GE, FN/GB, FB/GE et FB/GB. Cette classification supplémentaire résulte du remodelage que subit le myocarde lors du développement de la SA.110
La sténose sévère FN/GE correspond à la SA sévère « classique » abordée dans le premier paragraphe de la présente section. Ce type de SA correspondant au modèle de SA sévère « classique » décrit dans les lignes directrices du
moment, les mesures échocardiographiques utilisées pour le diagnostic sont avant tout adaptées pour la détecter. Une sténose sévère FN/GB signale un stade moins avancé de la SA que le type décrit précédemment. Dans les lignes directrices du moment, cette SA est considérée comme celle à FN/GE, même si la mortalité des patients ayant celle-ci est supérieure à la SA à FN/GB (Figure 2.2). Une SA sévère FB/GE signale une augmentation de la post charge et possiblement une dysfonction myocardique malgré une fraction d’éjection normale.110 La mortalité de patients atteints de ce type de sténose tend à être plus
élevée que celle de patients ayant un flux transvalvulaire préservé (Figure 2.2).
Figure 2.2 : Survie à 3 ans de patients atteints de différents types de sténose
aortique sévère. LF/HG : Flux bas/gradient élevé; LF/LG : Flux bas/gradient bas; NF/HG : Flux normal/gradient élevé; NF/LG : Flux normal/gradient bas. Tiré de : (111)
Finalement, le type de SA ayant la mortalité la plus élevée est celle à FB/GB (Figure 2.2). Alors qu’un gradient bas et une fraction d’éjection préservée
pourraient indiquer une sténose qui n’est pas nécessairement sévère, le remodelage concentrique augmenté ainsi que la fibrose plus avancée du myocarde chez ces patients conduit à une cavité du VG plus petite et à une contractilité diminuée. Ainsi, même si la fraction d’éjection demeure constante, un volume de sang bas est éjecté avec un gradient faible, ce qui signifie que ces patients ont une sténose sévère et bénéficieraient d’un remplacement valvulaire.112
Chapitre 3 Traitements de la sténose aortique
Il n’existe pas encore de traitement pharmacologique permettant d’enrayer, voire de ralentir la progression de la SA.16 Présentement, les seuls recours pour
un malade sont le remplacement de sa valve aortique, soit par voie chirurgicale (RVA) via une chirurgie à cœur ouvert5,17,105-107 ou plus récemment, par voie
percutanée (TAVI).18 Dans les premières années suivant son arrivée dans la
pratique clinique de routine, le recours au TAVI se limitait aux patients que l’on soupçonnait être inopérables autrement, c’est-à-dire des patients souvent très âgés ou « à haut risque chirurgical ».20
3.1 Remplacement de la valve aortique par voie chirurgicale
Le RVA est une chirurgie à cœur ouvert que subiront des patients atteints de SA sévère et symptomatiques (Figure 3.1). Tout d’abord, l’éligibilité du patient sera évaluée par une équipe de spécialistes. En effet, si le patient semble en trop mauvaise santé pour pouvoir subir une chirurgie aussi majeure, d’autres traitements seront envisagés. Deux types de valves peuvent être implantées chez les patients subissant l’opération, soient les valves mécaniques, soient les valves incorporant des tissus biologiques, souvent de provenance porcine ou bovine.113
Figure 3.1 : Représentation photographique d’un remplacement de la valve
Avec l’avènement de la circulation extracorporelle dans les années 1950, une procédure permettant de faire circuler le sang dans le corps avec une machine sans qu’il ait à passer par le cœur, les opérations de remplacement valvulaire sont devenues une possibilité.115 La première implantation valvulaire aortique sur un
patient humain a été réalisée en 1962.116
Par la suite, l’industrie de la fabrication de valves de remplacement a pris son essor, tout d’abord par la fabrication de valves mécaniques. Plusieurs modèles ont été utilisés, dont notamment les modèles balle-en-cage, à disque unique et à deux disques (Figure 3.2).117 Aujourd’hui, seul les modèles à deux
disques sont encore utilisés en pratique clinique.118
Figure 3.2 : Modèles de valves aortiques mécaniques. Tiré de : (113)
Les valves mécaniques sont plus durables que les valves biologiques. Cependant, elles ont plusieurs inconvénients par rapport à ces dernières. Les valves mécaniques requièrent notamment une utilisation à vie d’anticoagulants, car la surface de ces valves est propice à la formation de caillots sanguins, qui peuvent notamment causer des accidents vasculaires cérébraux.113
Les valves bioprothétiques ont l’avantage de ne pas nécessiter une utilisation à vie d’anticoagulants. Cependant, ces valves ont une durabilité moindre que les valves mécaniques. En effet, plusieurs patients devront être réopérés 10 ou 20 ans après l’implantation d’une valve bioprothétique.118 La
première génération de ce type de valve étaient des valves porcines, que l’on jugeait comme étant les plus similaires aux valves humaines (Figure 3.3).119
Cependant, ces valves présentaient plusieurs inconvénients, notamment au niveau hémodynamique et au niveau de leur durabilité, ce qui a mené à l’avènement de valves utilisant du péricarde bovin.113
Figure 3.3 : Modèles de valves aortiques bioprothétiques. Tiré de : (113)
Face à l’augmentation progressive de la prévalence de patients à haut risque chirurgical atteints de SA, d’autres types de valves comme les valves ne nécessitant pas de sutures ont vu le jour.100 Ces valves sont avant tout destinées
aux patients à risque chirurgical intermédiaire (Figure 3.4). Cependant, après l’avènement du TAVI, leur utilisation chez cette catégorie de patients n’a pas pris l’essor escompté.113
Figure 3.4 : Prothèses valvulaires aortiques sans armature ou ne nécessitant pas
de sutures. Tiré de : (113)
3.2 Implantation d’une valve aortique par voie percutanée
Le TAVI a été présenté initialement comme étant une alternative moins invasive que le RVA chez les patients âgés et à haut risque chirurgical. Cette procédure a l’avantage d’éviter une ouverture de la cage thoracique ou une circulation extracorporelle du sang (Figure 3.5). Puisque ce n’est pas une chirurgie à cœur ouvert, l’intervention est moins traumatique pour les patients. C’est pour cette raison que l’intervention avait avant tout été considérée comme une alternative au RVA pour les patients que l’on jugeait comme étant à trop haut risque chirurgical.20,113
Figure 3.5 : Représentation schématique d’un TAVI. De gauche à droite : Le
cathéter est placé dans la valve sténosée, la prothèse valvulaire est placée puis déployée à l’aide d’un ballon, puis le ballon est dégonflé, le cathéter enlevé puis la nouvelle valve reste en place. Tiré de : https://baycare.org/hospitals/st-josephs- hospital/services/heart-and-vascular/valve-center/transcatheter-aortic-valve-replacement-tavr
L’intervention consiste en l’implantation d’une valve prothétique dans la valve aortique calcifiée, qui se verra pressée entre la racine aortique et l’implant. La prothèse, qui se trouve sur un cathéter, sera introduite dans le système artériel du patient. La plupart du temps, le cathéter sera introduit dans l’artère fémorale, bien que d’autres voies existent (Figure 3.6). Une fois introduite dans le système artériel, le chirurgien guidera le cathéter vers la racine aortique, puis vers la valve sténosée. La prothèse sera finalement déployée dans la valve sténosée.120
Figure 3.6 : Différentes voies d’implantation possibles pour un TAVI. Tiré de :
(121)
La première implantation d’une valve aortique par voie transcathéter a été rapportée par Cribier en 2002.18 Cette valve représente la première dans une des
deux grandes catégories de valves utilisées en TAVI, les valves déployées à l’aide d’un ballon et les valves auto extensibles.
La première valve à être implantée était la valve Cribier-Edwards®, qui
incorporait du péricarde de cheval monté sur un châssis d’acier inoxydable.22 Le
développement suivant a été l’ajout d’une couche de tissu autour du châssis dans le but de mieux sceller le pourtour de la valve pour réduire le risque de fuites périvalvulaires.113 La valve incorporant cette innovation, la SAPIEN® de la
compagnie Edwards, a vu le jour en 2006 (Figure 3.7).122 La valve SAPIEN® a été
perfectionnée à plusieurs reprises et est aujourd’hui commercialisée sous le nom de SAPIEN 3® depuis l’année 2013. Elle a un diamètre inférieur lorsque non déployée
transfémoral et a été dotée d’une deuxième couche de tissu qui limite encore davantage le risque de fuite à la périphérie de la valve implantée.123
Figure 3.7 : Modèles de valves aortiques utilisées en TAVI. Tiré de : (113)
La première valve auto extensible a vu le jour en 2005 sous la forme de la Corevalve® de Medtronic. Son design incorpore du tissu péricardique bovin monté
sur un châssis de nitinol. Le remplacement du tissu bovin par du tissu porcin ainsi qu’une optimisation de l’architecture du châssis a mené au développement de la deuxième génération de ces valves sous la forme de l’EVOLUT R® (Figure 3.7).
D’autres innovations dans le développement des valves auto extensibles les ont rendues repositionnables au moment de leur déploiement. Elles permettent également aux chirurgiens de les rengainer au besoin pendant l’intervention. D’autres améliorations ont touché le système de déploiement qui a diminué en diamètre et en hauteur en parallèle au développement des valves prothétiques, ce qui facilite l’insertion du cathéter dans le système artériel des patients. La valve auto extensible la plus utilisée présentement est la dernière génération des valves
EVOLUT®, soit l’Evolut PRO®, qui intègre une enveloppe externe ayant comme
fonction de limiter le risque de fuite périvalvulaire.113
Au début de l’implantation du TAVI dans la pratique clinique de routine, l’intervention était avant tout destinée aux individus à haut risque chirurgical, le RVA restant l’intervention par défaut chez les patients subissant une intervention valvulaire. Bien qu’il ait été prouvé que le TAVI est une alternative non inférieure au RVA chez des patients à haut risque chirurgical,20 des études plus récentes
indiquent une non-infériorité du TAVI chez des patients à risque chirurgical moyen21 et même une possible supériorité du TAVI face au RVA à 1 an chez des
patients à faible risque chirurgical.22
Face à ces constatations, il est clair que le paradigme du traitement de la SA fait face à de possibles changements majeurs. Le TAVI étant non-inférieur au RVA chez les patients atteints de SA sévère, peu importe leur niveau de risque, pourrait amener une utilisation à plus large échelle de la procédure, qui ne serait plus limitée aux patients les plus âgés et à plus haut risque à l’avenir. Cependant, une limitation importante de ce changement de paradigme est la durabilité des valves. En effet, puisque l’intervention est jeune comparativement au RVA, la durabilité des valves implantées par TAVI cinq à dix ans après la procédure n’est pas encore connue, surtout pour les valves de dernière génération.124,125
Chapitre 4 Objectifs et hypothèses de recherche
Comme présenté précédemment, le fardeau de la SA dans les pays à haut revenu semble être en augmentation. En parallèle à ce phénomène, on assiste également à un vieillissement de la population8,9 ainsi qu'à l’augmentation de
l’incidence de facteurs de risque cardiométaboliques dans ces régions.10-12
Considérant que la SA est la troisième maladie cardiovasculaire la plus répandue et la maladie valvulaire nécessitant le plus d’interventions,1 une augmentation du fardeau de
la maladie pourrait représenter une charge non négligeable sur le système de santé.4
De plus, comme dit précédemment, le traitement de la SA a subi un changement de paradigme majeur dans la dernière décennie avec l’introduction du TAVI.19-22 Ensuite,
l’évolution du fardeau de la SA n’est pas homogène dans l’ensemble des pays à haut revenu. En effet, des études conduites ailleurs au Canada et dans le monde ne constatent pas toutes les mêmes tendances. Alors que le fardeau semble être en augmentation dans certains pays et régions,13,14 il semble diminuer ailleurs.15 Pour
toutes ces raisons, il est impératif de conduire une étude au niveau de la province de Québec. L’objectif général de ce projet de maîtrise vise donc à examiner l’évolution du fardeau de la SA au Québec entre les années financières 2000-2001 à 2015-2016 et de comparer les taux de mortalité des individus ayant subi une intervention valvulaire à ceux qui n’en ont pas subi. En atteignant cet objectif, il sera possible de brosser un portrait global de l’évolution de la maladie à l’échelle de la province ainsi que de la survie à 30 jours et à un an de patients incidents.
Objectif spécifique 1 : Examiner l'évolution de la prévalence, de l'incidence,
de la mortalité toute-cause et de l'utilisation des interventions valvulaires aortiques au Québec entre les années financières 2000-2001 à 2015-2016.
Hypothèse spécifique 1 : À la suite de l’augmentation de la prévalence de
facteurs de risque cardiométaboliques dans les pays à haut revenu et au vieillissement de la population de la province, le fardeau de la SA dans la province de Québec a augmenté entre les années financières 2000-2001 et 2015-2016.
et à un an chez les nouveaux patients atteints de SA dans la province de Québec entre les années financières 2000-2001 et 2015-2016.
Hypothèse spécifique 2 : La mortalité postopératoire toute-cause à 30
jours et à un an chez les nouveaux patients de SA a diminué dans la province de Québec entre les années financières 2000-2001 et 2015-2016 notamment après l’introduction du TAVI dans la pratique clinique et à l’amélioration des résultats chez les patients recevant des RVA au fil des années, alors que la mortalité des patients non-opérés restera stable, voire augmentera légèrement puisque le TAVI permettra d’opérer davantage de patients, laissant une proportion croissante de patients à haut risque chirurgical sans intervention.