UNIVERSITÉ DU QUÉBEC
ÀMONTRÉAL
EXPLORATION D'INTRANTS BIOLOGIQUES ET CHIMIQUES
POUR ASSISTER LA PHYTOREMÉDIATION D'UN SOL
QUÉBÉCOIS CONTAMINÉ AU MERCURE
MÉMOIRE
PRÉSENTÉ
COMME EXIGENCE PARTIELLE
DE LA MAÎTRISE EN SCIENCES DE L'ENVIRONNEMENT
PAR
SOPHIE BOULERICE
Avertissement
La diffusion de ce mémoire se fait dans le respect des droits de son auteur, qui a signé le formulaire Autorisation de reproduire et de diffuser un travail de recherche de cycles supérieurs (SDU-522 - Rév.0?-2011 ). Cette autorisation stipule que «conformément à l'article 11 du Règlement no 8 des études de cycles supérieurs, [l'auteur] concède à l'Université du Québec à Montréal une licence non exclusive d'utilisation et de publication de la totalité .ou d'une partie importante de [son] travail de recherche pour des fins pédagogiques et non commerciales. Plus précisément, [l'auteur] autorise l'Université du Québec à Montréal à reproduire, diffuser, prêter, distribuer ou vendre des copies de [son] travail de recherche à des fins non commerciales sur quelque support que ce soit, y compris l'Internet. Cette licence et cette autorisation n'entraînent pas une renonciation de [la] part [de l'auteur] à [ses] droits moraux ni à [ses] droits de propriété intellectuelle. Sauf entente contraire, [l'auteur] conserve la liberté de diffuser et de commercialiser ou non ce travail dont [il] possède un exemplaire.»
REMERCIEMENTS
Ce travail n'amait pas été possible sans la précieuse collaboration de l'équipe d'Enutech. Je tiens à remercier particulièrement Philippe Giasson de m'avoir accueillie au sein de l'équipe ainsi que Christophe Gamsonré, Myriam Breton, Luz A. Bedoya-Gonzalez et Robert Serli pour lem grande générosité de temps et de connmssances.
Je souligne également l'appui d'Alfred Jaouich, mon directem à qui je souhaite une belle retraite active, ainsi que le soutien technique de Gwenaël Chamoulaud et de Diogo Bametche de l'UQAM.
Natmellement, un grand merci à mon conjoint Andreas pom sa contribution quotidietme à mon bien-être par son aide et son mnom, ainsi qu'à mes ami(e)s (Miriam!) et à ma famille qui m'ont encouragée, écoutée et conseillée. Votre présence sans faille est ce qui m'est de plus précieux!
Je me dois finalement de remercier Mitacs pour son soutien financier, à travers le programme Mitacs Accélération.
be ethical only in relation to something we can see, fe el, understand, love, or otherwise have faith on.
Aldo Leopold
The best and most evolved technologies are those that do not destroy the very base on which we live.
TABLE DES MATIÈRES
LISTE DES TABLEAUX ... vi
LISTE DES FIGURES ... viii
RÉSUMÉ ... x ABSTRACT ... xi INTRODUCTION ... 1 CHAPITRE I PROBLÉMATIQUE ... 3 1.1. La contamination des sols ... 3
1.1.1. Conséquences socio-économiques de la contamination des sols ... 4
1.1.2. Règlementation québécoise sur les sols contaminés ... 5
1.1.3. Approches conventionnelles de décontamination ... 5
1.2. Une solution biologique : la phytoremédiation ... 8
1.3. Contexte du projet ... 10
1.3.1. Enutech ... 11
1.4. Question de recherche et objectifs ... 12
CHAPITRE II CADRE THÉORIQUE ... 13
2.1. Le mercure ... 13
2.1.1. Utilisations industrielles du mercure ... 13
2.1.2. Aperçu du cycle global du mercure ... 15
2.1.3. Biochimie dans les sols et les sédiments ... 19
2.1.4. Biodisponibilité et toxicité ... 27
2.2. La phytoextraction ... 30
2.2.1. Absorption, hyperaccumulation et tolérance ... 31
2.2.2. Translocation ... 36
2.2.3. Intrants biologiques et chimiques ... 39
CHAPITRE III MÉTHODOLOGIE ... 47
3.1. Origine et prélèvement du sol contaminé ... 47
3 .1.1. Caractérisation physico-chimique du sol contaminé ... 4 7 3.2. Phase I-UQAM ... 49
3 .2.1. Description des installations ... 49
3.2.4. Entretien et suivi ... 53
3. 3. Phase II - Enutech ... 54
3.3.1. Tests de mobilisation ... 54
3.3.2. Description des installations ... 54
3.3.3. Traitements ... 55
3.3.3. Entretien et suivi ... 56
3.4. Traitement des échantillons ... 56
3 .4.1. Récolte et préparation des échantillons végétaux ... 56
3.4.2. Dosage du mercure dans les tissus végétaux et les sols ... 57
3.4.3. Colonisation mycorhizienne ... 58
3.5. Analyse statistique des données ... 59
CHAPITE IV RÉSULTATS ET DISCUSSION ... 61 4.1. Phase I-UQAM ... 61 4.1.1. Phase la ... 61 4.1.2. Phase lb ... 67 4.2. Phase II -Enutech ... 69 4.2.1. Production de biomasse ... 69
4.2.2. Accumulation de mercure et translocation ... 73
4.3. Tests de mobilisation ... 73
4.4. Discussion générale ... 76
4.4.1. Bilans de masse ... 76
4.4.2. Rôle des intrants chimiques ... 81
4.4.3. Limites de l'étude ... 82 CONCLUSION ... 85 ANNEXE A COMPLÉMENTS DE PROTOCOLE ... 87 ANNEXEB RÉSULTATS ... 93 ANNEXEC COMMUNICATIONS EXTERNES ... 106 BIBLIOGRAPHIE ... 110
LISTE DES TABLEAUX
Tableau Page
1.1 Grille des critères génériques du MDDELCC pour le mercure ... 5
1.2 Grille comparative des coûts de divers traitements de remédiation de sols ... 7
2.1 Teneur en mercure de roches magmatiques et sédimentaires (mg/kg) ... 15
2.2 Spéciation du mercure dans les sols ... 26
3.1 Résultats des analyses pour les éléments nutritifs majeurs ... .48
3.2 Spéciation du mercure ... .49
4.1 Modification de la spéciation du Hg par deux intrants chimiques en 7 jours ... 74
ANNEXE A Description des traitements de la phase I ... 88
2 Description des traitements de la phase Il ... 90
ANNEXEB Biomasse produite par les combinaisons végétales A et B selon les traitements ... 93
2 Biomasse produite par D. punctilobula selon les traitements ... 95
3 Concentration en Hg dans la biomasse des mélanges végétaux A et B selon les traitements ... 96
4 Concentration en Hg dans la biomasse de D. punctilobula selon les traitements ... 97
5 Facteur de translocation du Hg par les combinaisons végétales A et B ... 98
6 Facteur de translocation du Hg par D. punctilobula ... 99
7 Taux de colonisation mycorhizienne ... l 00 8 Biomasse produite par S. alba selon la concentration de KI ( 10 plantes) ... ] 01 9 Concentration en Hg dans les tissus végétaux selon la concentration de KI ... 1 01 10 Facteur de translocation du Hg selon la concentration de KI ... 1 02 Il Biomasse produite par F arundinacea, B. juncea, A. tricolor et Cardamine sp. selon les
12 Concentrations en Hg dans les tissus de F arundinacea, B. juncea et Cardamine sp. selon les traitements ... 1 04 13 Facteur de translocation du Hg par F arundinacea selon les traitements ... ! 04 14 Concentration initiale en Hg dans les sols ... ! 05
LISTE DES FIGURES
Figure Page
1.1 Situation géographique du terrain de golf La Providence ... 11
2.1 Émissions anthropogéniques de mercure en 2010 ... 14
2.2 Cycle biogéochimique du mercure ... 18
2.3 Flux de masse des métaux en solution vers la racine ... 31
2.4 Voies de mobilisation des éléments par les racines ... 32
2.5 Mécanismes de tolérances ... .34
2.6 Transport d'éléments traces régulé par des phytochélatines ... 37
2.7 Bloquage des éléments toxiques dans les racines au niveau de l'endoderme ... 38
3.1 Observation des racines colonisées ... .. 59
4. 1 Mélanges B et A, semaine 4 ... 62
4.2 Mélanges B et A, semaine 10 ... 62
4.3 D. punctilobula, semaine 9 ... 63
4.4 Effet de l'intoxication au Hg sur la production de biomasse ... 64
4.5 Phase Ib ... 68
4.6 Récolte de B.juncea et de Lepidium. sp ...... 71
4.7 Récolte d'A. tricolor ... 72
4.8 F arundinacea 1 conséquence d'une application unique de thiosulfate d'ammonium .72 4.9 Résultats de la phase la: effet des intrants sur l'extraction du Hg par les mélanges végétaux A et B ... 76
4.10 Résultats de la phase la: effet des intrants sur l'extraction du Hg par D. punctilobula 77 4.11 Résultats de la phase lb : Effet du KI sur 1 'extraction du Hg parS alba sur un mètre2 ... 78
4.12 Résultats de la phase II: Effet d'intrants biologiques et chimiques sur l'extraction du Hg par F arundinacea, B.juncea et Lepidium sp. sur un mètre2 ... 79
ANNEXE A:
Protocole d'extraction séquentielle pour la spéciation du mercure ... 87
2 Phase la ... 91
3 Phase lb ................................................... 91
RÉSUMÉ
Effectuée conjointement avec un partenaire industriel, Enutech, cette recherche avait
pour objectif concret de trouver une solution de phytoremédiation pour un tenain
contaminé au mercure. Puisqu'il s'agit d'un élément trace métallique relativement
peu étudié dans le domaine, le travail fut exploratoire. La disponibilité du métal dans le sol constitue un obstacle majeur à son extraction par les plantes, c'est pourquoi les
intrants mobilisateurs, biologiques et chimiques ayant le potentiel de dynamiser le
processus furent au centre de la recherche. Les traitements furent effectués ex-situ.
Une première phase eut lieu dans w1e chambre de croissance de 1 'Université du
Québec à Montréal. Vingt-huit traitements impliquant trois variations végétales, deux
intrants chimiques et deux intrants biologiques furent alors comparés. Une deuxième
phase, dans les locaux d'Enutech, a permis d'ajuster la méthodologie afin de mieux
comprendre la contribution de chacune des espèces végétales en présence des
différents intrants. Six traitements furent alors évalués.
Il en ressort que les intrants biologiques n'ont pas semblé avoir d'influence sur la
production de biomasse, la résistance à la toxicité du mercure, 1 'extraction du
mercure et sa translocation. Les intrants chimiques ont permis d'augmenter la
quantité de mercure absorbé par les racines plantes, mais n'ont pas aidé à sa
translocation vers les parties aériennes. De plus, la présence des intrants chimiques a
eu un effet négatif sur la santé des plantes, suggéré par une corrélation négative avec
la biomasse produite. Les intrants chimiques constituent donc une avenue de
recherche intéressante pour optimiser la phytoremédiation du mercure mais beaucoup
d'intenogations demeurent, notamment concernant leur écotoxicité et leur impact sur
les milieux naturels.
Mots clés: phytoextraction assistée, mercure, thiosulfate d'ammonium, iodure de potassium, mycorhizes, consortium biologique
Designed in pmtnership with an industrial patiner, Enutech, this study aimed to elaborate an effective phytoremediation solution to mercury sail contamination. Since mercury is much less studied than other trace elements, this research was exploratory. It is known that the main challenge to mercury extraction from sail by plants is its comparatively low mobility. Consequently, mobilizing agents, bath biological and chemical, were the focus of this research. All treatments were tested ex-situ. Twenty-eight (28) treatments including tlu·ee (3) plant variations, two (2) chemical additives and two (2) biological additives were first tested in a growth room at 1 'Université du Québec à Montréal. A second phase followed at Enutech to adjust the methodology and better assess the reaction of each plant variation with the additives. Six (6) treatments were then evaluated.
Biological additives did not seem to affect biomass production, mercury extraction, mercury resistance nor translocation. Chemical additives, on the other band, allowed a greater amount of mercury to be absorbed by plants' roots but did not contribute to translocation towards aerial parts. Moreover, sorne chemical additives had a negative effect on plants' health, as suggested by a negative conelation with biomass production. Hence, chemical additives bear an interesting potential to assist phytoremediation of mercury, but further research on their ecotoxicity and their fate in the environrnent is definitely needed.
Keywords: assisted phytoextraction, mercury, ammonium thiosulfate, potassium iodide, mycorrhizae, biological consortium
INTRODUCTION
Depuis quelques années, la phytoremédiation connaît un gain de popularité notable
grâce aux nombreux avantages qu'elle offre : ce processus de décontamination
alternatif a un coût d'exécution relativement faible et une grande versatilité, en plus d'être en adéquation avec les principes du développement durable. Le présent projet a pour objet d'étude un terrain de golf ayant cessé ses activités en 2014. Ce terrain situé à St-Hyacinthe, dans le sud du Québec, fut entretenu pendant des décennies avec des fongicides à base de mercure. Le métal s'est accumulé dans le sol jusqu'à atteindre des concentrations atteignant le seuil C du Ministère du Développement Durable
Environnement et Lutte contre les changements climatiques (MDDELCC), c'est-à
-dire le niveau de contamination pour lequel les usages des terrains sont les plus restreints.
Le mercure est un élément trace métallique (ETM) particulièrement problématique, car même une infime quantité peut s'avérer toxique. En phytoremédiation, il demeure pourtant relativement peu étudié. Puisque sa chimie et ses interactions avec le vivant diffèrent des autres éléments traces, il est nécessaire de développer une approche spécifique intégrant le contexte écologique. Cette recherche se penche donc sur les facteurs biotiques et abiotiques affectant la mobilité du mercure. D'une part, la
symbiose entre végétaux, bactéries et mycètes est un phénomène naturellement
omniprésent qui a le potentiel d'augmenter la diversité des contaminants extractibles ou dégradables et d'aider la plante à supporter des niveaux exceptionnellement élevés
de toxicité. De l'autre part, des intrants chimiques peuvent contribuer à la
disponibilité des métaux pour permettre et encourager leur extraction par les plantes. Le terme phytorhizoremédiation est parfois employé pour nommer ces mesures agissant sur la rhizosphère dans le but d'optimiser la phytoremédiation.
Ce projet est effectué en collaboration avec 1 'entreprise Enutech, spécialisée dans le traitement écologique et in situ de sols contaminés. Il constitue une première étape
vers l'élaboration d'un guide décisionnel facilitant la phytoremédiation pom une
CHAPITRE I
PROBLÉMATIQUE
1.1. La contamination des sols
La contamination des sols est définie comme l'accumulation de substances
organiques ou inorganiques à des niveaux mettant en péril la santé humaine, la faune
et la flore (Beaulieu 20 16). Les causes d'une telle situation sont diverses: présence
d'industries chimiques et métallurgiques, déversement ou fuite de produits toxiques
xénobiotiques, activités minières, écoulement de lixiviat des dépotoirs, épandage de
pesticides et dépôts atmosphériques, pour ne nommer que celles-ci (Kabata-Pendias
et Pendias 2001; Dumesnil et Ouellet 2002). La nature des contaminants est aussi
diversifiée que leurs sources: benzène, toluène, éthylbenzène et xylènes (couramment
regroupés sous l'acronyme BTEX), hydrocarbures pétroliers, hydrocarbures
aromatiques polycycliques (HAP), composés organiques volatils (COV) et éléments
traces métalliques (ETM). Dans les faits, la contamination est souvent mixte et est
constituée d'un cocktail de substances organiques et/ou inorganiques. Au Québec,
dans la seule région métropolitaine de Montréal sont recensés plus de 1500 terrains
contaminés. Il est toutefois difficile d'obtenir un portrait juste de la situation dans la
province puisque seuls les cas de terrains contaminés « portés à 1' attention » des
gouvernements provmctaux ou mumc1paux sont répertoriés (Ministère du
Développement Durable; Environnement et Lutte contre les Changements
1.1.1. Conséquences socio-économiques de la contamination des sols
Les effets directs de la contamination des sols sm la santé humaine varient entre des maux et des malaises de courte durée jusqu'au développement de maladies chroniques, selon le type de contaminant ainsi que 1 'intensité, la dmée et la voie d'exposition. La contamination menace également la biodiversité et l'équilibre des écosystèmes en affectant la croissance et la capacité reproductive des animaux et des végétaux. Les effets spécifiques du mercme sur la santé des êtres vivants seront davantage détaillés à la section 2.1.4.
L'enjeu des sols contaminés est vaste et soulève, en plus des enJeux enviroru1ementaux et de santé publique, des questions d'urbanisme et d'aménagement du territoire. Les normes établies par le MDDELCC restreignent 1 'utilisation des terrains contaminés au-delà de certains seuils propres à chaque contaminant selon leur toxicité (voir section 2.1.2). Cela fait chuter la valeur foncière, ce qui mène à la sous-valorisation de ces terrains. Délaissés, ils parsèment le paysage de zones mortes inesthétiques. Dans un contexte de raréfaction des terres en périphérie des villes, la contamination du sol complique la densification et encourage de ce fait l'étalement mbain au détriment des terres agricoles malgré la Loi sur la Protection du Territoire Agricole (1978). C'est ainsi que se font ressentir les effets indirects de la contamination des sols. D'un point de vue urbanistique, la restauration des sites dégradés est nécessaire pom redonner une unité au paysage et améliorer la qualité de vie des environs en les dotant à nouveau d'une vocation économique (développement d'entreprises et de serv1ces de proximité, construction d'habitations) ou récréoenvironementale (création de parcs et autres lieux d'agrément) (Dumesnil et Ouellet 2002).
5
1.1.2. Règlementation québécoise sur les sols contaminés
En termes de législation, la Politique québécoise sur la protection des sols et la
réhabilitation de terrains contaminés est 1' autorité gouvernementale qui définit les
critères de contamination et les usages permis sur un terrain contaminé. Ces critères
représentent les concentrations maximales permises sur un site donné en tenant
compte de la nature des contaminants, de leur mobilité dans 1 'environnement ainsi
que du risque qu'ils représentent pour les êtres vivants et les milieux naturels
(Dumesnil et Ouellet 2002). Ces seuils servent notamment à établir des objectifs de
décontamination en fonction de la vocation à venir du site. Le tableau 1.1 montre les
critères génériques pour le mercure.
Tableau 1.1 : Gt·ille des uitères génériques du MDDELCC pout· le met·cut·e
Critère Concentration*
A 0,2
B 2
c
10Usages permis
Pour un usage agricole. Il est considéré que cette valem est la teneur de fond.
Pour un usage récréatif, résidentiel et institutionnel, ou encore commercial en zone résidentielle
Pour un usage industriel et commercial
*
maximale (en ppm, ou mg/kg de matière sèche)1.1.3. Approches conventionnelles de décontamination
L'excavation suivie de l'enfouissement est la solution la plus courante au problème de
contamination. Informellement mais adéquatement décrite par l'appellation dig and
dump, cette méthode est populaire car elle est fiable et efficace à court terme. Des
inconvénients majeurs, économiques et écologiques, y sont cependant associés. En
terrains contaminés laissés à 1 'abandon (Bert 2013 ). Les coûts d'excavation, de transport, de réception de matière contaminée au site d'enfouissement et de remplacement peuvent facilement s'élever à plus de 250$/tonne de sol (S. Roger, conversation personnelle, 13 octobre 2016). Également, l'excavation est invasive et destructive, et peut par conséquent être inappropriée ou limitative. Par exemple, la richesse végétale exceptionnelle des friches en ville sert d'habitat pour la faune urbaine, parfois même d'espèces rares et inusitées en milieu urbain. Lorsqu'émerge la volonté de conserver cette richesse et de s'en servir comme base à 1 'aménagement d'un parc, la nécessité d'une alternative est évidente (Les Amis du Champ des Possibles 2014 ). Similairement, le cadre bâti peut rendre délicate 1 'excavation de terrains enclavés.
Après avoir été excavés, les sols contaminés doivent être transportés dans des sites d'enfouissement spécifiques à cet usage. Le Québec compte en 2017 cinq sites d'enfouissement de sols, dont certains ne sont pas autorisés à accueillir au-delà du critère B-C. Ceux-ci se trouvent à Bécancour (dans le Centre-du-Québec), à L'Épiphanie et à Mascouche (dans Lanaudière), à Grandes-Piles (en Mauricie) ainsi qu'à Larouche (au Saguenay) (Ministère du Développement Durable; Environnement et Lutte contre les Changements Climatiques 2014). En plus de l'évidente contrainte imposée par la capacité limitée d'enfouissement de ces sites, le transpo11 de sols excavés sur de grandes distances émet une quantité importante de gaz à effet de serre. Pour ces deux raisons, la réduction du volume de déchets transportés aux sites d'enfouissement représente un objectif pet1inent. De plus, les possibilités de réutilisation de ces sols sont limitées. La règlementation en vigueur interdisant de couvrir un sol avec un sol plus contaminé empêche son utilisation comme remblai dans des projets résidentiels ou commerciaux. Par conséquent, l'option courante de revalorisation pour ces sols est le recouvrement journalier dans les lieux d'enfouissement teclmiques, quoique cette pratique soit très encadrée par la législation et de plus en plus restreinte (Beaulieu 20 16). Un dernier souci à mentionner est que 1 'excavation et le déplacement des sols contaminés engendrent le
7
risque de mobiliser les contaminants en modifiant les conditions environnementales
du site et du substrat, les rendant ainsi plus dangereux (Rugh et al., 2000).
Bien qu'elles soient beaucoup moms courantes, d'autres méthodes de décontamination du sol existent et ont fait leurs preuves. Il s'agit notamment de la désorption thermique, l'incinération, l'extraction chimique et la vitrification (ou
stabilisation chimique). Ces méthodes peuvent être exécutées ex situ, après
1' excavation du sol, ou in situ si les conditions et le contexte le permettent. Ces
méthodes ne sont toutefois pas non plus sans inconvénient. L'extraction chimique et
la vitrification, par exemple, impliquent 1 'utilisation d' intrants chimiques souvent
nocifs. L'incinération, en plus d'être extrêmement énergivore, détruit toute matière
organique et rend le substrat inerte et dont la seule utilisation est à des fins de
remblayage (National Council of Research (NRC) 1993). Le coût de ces méthodes est
également très élevé, parfois encore bien plus que 1 'excavation (tableau 1.2).
Tableau 1.2 : Grille comparative des coûts de divers traitements de remédiation de sols (Singh, Kuhad et Ward 2009)
Traitement
Phytoremédiation (graminées) Bioremédiation in situ Ventilation
Traitement therm igue Lavage chimique
Sol idification/stabi 1 isation Extraction au solvant Incinération
Estimation des coûts ($US/tonne) 10-35 50-150 20-220 120-300 80-200 240-340 360-440 200-1500
Tout cela souligne la pertinence d'explorer des solutions alternatives qui se doivent
des conditions auxquelles la phytoremédiation répond bien.
1.2. Une solution biologique : la phytoremédiation
La phytoremédiation est un ensemble de techniques employant des plantes pour restaurer des milieux contaminés. Pourtant étudiée depuis des décennies (Garrett 1963), ce n'est que depuis quelques années que la phytoremédiation gagne en popularité et fait 1 'objet de diffusion auprès du grand public (Lachapelle et Montpetit 20 15). Les végétaux impliqués ont la capacité de dégrader, volatiliser, stabiliser ou extraire les contaminants. Selon le processus en jeu, la phytoremédiation se décline sous les termes de phytodégradation, phytovolatilisation, phytostabilisation et phytoextraction. La phytoremédiation s'est montrée efficace pour des hydrocarbures pétroliers, des BTEX (un groupe comprenant benzène, toluène, éthylbenzène et xylènes), des hydrocarbures aromatiques polycycliques (HAP), des composés organiques volatils (COV) et ce11ains éléments traces (Kvesitadse et al. 2006).
La phytoremédiation a le potentiel de substituer en tout ou en partie l'excavation lors d'un projet de décontamination, puisqu'il est possible de procéder à la phytoremédiation de manière ex-situ ou in situ. Cette dernière option incarne tout le potentiel de la phytoremédiation en permettant d'éviter plusieurs inconvénients écologiques, économiques et sociaux liés à l'excavation. Premièrement, même lorsque les végétaux deviennent des déchets contaminés (principalement dans les cas de contamination aux métaux), le volume à gérer est considérablement réduit par rappo11 au volume de sol initial (Blaylock et Huang 2000). La biomasse résiduelle de la phytoremédiation a par ailleurs le potentiel d'être revalorisée, notamment en étant compostée, brulée ou même utilisée comme matériau de construction, selon son niveau de contamination (Giasson et al. 2004; Bert 2013). La gestion in situ des sols permet d'éviter les coûts environnementaux et monétaires souvent prohibitifs liés à
9
1 'excavation, au transport et à la gestion des sols contaminés (Bert et al. 2009). De plus, procéder in situ minimise la perturbation subie par 1 'écosystème (K vesitadse et al. 2006) et la plantation de végétaux protège la couche superficielle du sol au lieu de 1 'exposer à 1 'érosion (Bert et al. 2009) tout en préservant ou même en améliorant la structure du sol (Lombi et al. 2001). Si le contexte le permet, le site peut être valorisé par un aménagement paysager agréable pendant le processus de décontamination (Bert et al. 2009). Finalement, la phytoremédiation étant une technologie relativement simple, elle est par conséquent accessible (Lombi et al. 2001 ).
Malgré les alléchantes promesses de la phytoremédiation, il est impératif de reconnaître ses limites afin de ne pas créer d'attentes irréalistes. À l'heure actuelle, bien qu'elle ait un grand potentiel de versatilité, elle n'est pas efficace dans tous les contextes pour tous les types de contaminants. Tout d'abord, la nature et la concentration de la contamination sont les principaux facteurs déterminant la faisabilité de la phytoremédiation. Ils influencent la durée du traitement qui peut facilement être de plusieurs décennies (Khan 2006) : en trop grosse concentration, certains contaminants nuisent si fortement à la croissance des plantes que la phytoremédiation n'est pas possible dans un délai réaliste. Des contaminants très coriaces, comme les biphényles polychlorés (BPC) et les dioxines, ou qui ne sont pas biodisponibles, sont également difficiles et longs à dégrader (Kvesitadse et al. 2006). Cela étant dit, le temps d'attente, quoique inévitable, peut être optimisé. Par exemple,
la biomasse produite par la végétation peut être exploitée, ou encore un aménagement paysager temporaire ou pérenne peut valoriser le site pendant son traitement. Par ailleurs, la végétalisation d'un site peut permettre de restaurer des services écosystémiques (Bett et al. 2009).
Également, la profondeur d'action de la phytoremédiation est limitée par la portée des racines des végétaux. Or, celle-ci varie grandement selon les espèces. Par exemple,
les racines des graminées peuvent atteindre plus de 100 cm, alors que la moyenne des végétaux est d'environ 50 cm (Kvesitadse et al. 2006). L'ajout de microorganismes,
particulièrement de mycorhizes, constitue une solution potentielle à cette limitation (section 2.2.3), mais à ce jour peu d'études p011ent sur cet aspect.
En dernier lieu, il faut reconnaître le risque que les contarninants entrent dans la chaîne alimentaire via la consommation des fleurs, des fruits ou même des parties végétatives par les animaux ou les insectes. Ce risque est toutefois considéré comme très faible, et certaines mesures permettent de l'atténuer davantage (Angle et Linacre 2005). Par ailleurs, les contaminants ont peu tendance à s'accumuler dans les parties reproductives des végétaux, mais il s'agit encore d'un aspect peu exploré.
1.3. Contexte du projet
Le terrain ayant servi d'objet d'expérimentation est l'ancien terrain de golf La Providence, situé dans la région de Saint-Hyacinthe (figure 1.1 ). Le terrain a perdu sa vocation sp011ive en 2014, après qu'il ait été racheté pour y construire un complexe résidentiel. La contamination du site au mercure, au premier abord inusitée dans cette région principalement agricole, est due à des décennies d'utilisation de fongicides à base de mercure pour l'entretien régulier du terrain. Les échantillons de sol prélevés sur les verts du golf ont révélé une contamination très hétérogène, de 13 mg Hg/kg en moyenne. Cela correspond au critère C du MDDELCC (2013). Pour y construire des habitations, il est exigé d'atteindre au minimum la catégorie B dont le seuil maximal est de 2 mg/kg (tableau 1.1 ).
La contamination au mercure de cet ancien terrain de golf n'est certainement pas un cas unique, puisque les fongicides à base de mercure furent largement employés sur ce type de terrains (Mac Lean, Stone et Cordukes 1973) avant d'être ba1mis par Santé Canada en 1995 en vertu de la Loi sur les produits antiparasitaires (2002). Bien que leur vente fut dès lors interdite, leur utilisation fut tolérée jusque dans les années 2000.
11
Figure 1.1 : Situation géographique du terrain de golf La Providence
Fond de cane : Google Maps
Fait intéressant à noter au passage, l'utilisation de pesticides a diminué de 15,6% entre 2003-2005 et 2009-2011 suite à des restrictions plus strictes imposées par le MDDELCC en termes de quantités applicables permises. Malgré cela, l'indice de risque sanitaire pour les joueurs et les employés d'entretien des terrains de golf a augmenté de 12,1% pour la même période (Laverdière et al,. 2013). Cela indique que ce n'est pas seulement la quantité, mais également la composition des produits employés qui est problématique.
1.3.1. Enutech
Afin de réhabiliter le site, le nouveau propriétaire du terrain de golf a fait appel à
l'entreprise montréalaise Enutech, spécialisée dans le traitement écologique et in situ de sols contaminés. S'inscrivant dans le volet recherche et développement de la compagnie. ce projet de phytoremédiation du mercure constitue une première étape vers !"élaboration d"un guide décisionnel facilitant la décontamination des sols grâce
à la symbiose biologique et à des intrants chimiques pour une variété de contaminants et de conditions environnementales.
1.4. Question de recherche et objectifs
La question de recherche qm découle de la problématique et de 1 'état des
connaissances sur le sujet est :
Comment optimiser le processus de phytoextraction du mercure d'un sol contaminé à l'aide d'intrants biologiques ou chimiques altérant les propriétés de la rhizosphère?
Pour répondre à cette question, des objectifs clés ont été identifiés :
1. Caractériser les processus impliqués dans la phytoextraction des métaux, en
identifiant les contraintes spécifiques au mercure;
2. Décrire la symbiose entre les plantes et les microorganismes du sol pouvant
contribuer à la décontamination du sol, ainsi que les mécanismes
biochimiques régulant la spéciation du mercure dans le sol;
3. Proposer ou offrir des pistes de solution pour un traitement efficace et adapté
CHAPITRE II
CADRE THÉORIQUE
2.1. Le mercure
La dynamique des contaminants dans le sol ainsi que les interactions avec les autres
constituants du sol et les organismes vivants sont des informations cruciales pour la
phytoremédiation. Les éléments traces métalliques comme le mercure, contrairement aux polluants d'origine organique, ne se dégradent pas. Conséquemment, ils
s'accumulent au fil du temps et les milieux récepteurs sont contaminés de façon
permanente, à moins que la contamination soit entraînée ailleurs. Si la plupart des
études et ouvrages généraux sur la phytoremédiation de métaux s'intéressent au
cuivre, au zinc, au plomb ou au cadmium, pour ne nommer que ceux-là, ils
mentionnent rarement le mercure. Or, les méthodes et les résultats présentés dans ces travaux ne s'appliquent pas nécessairement au mercure. En effet, celui-ci diffère des
autres éléments traces de par son interaction avec le vivant et son comportement dans
le sol. C'est pourquoi il est impératif de comprendre le cycle du mercure dans
l'environnement pour s'y attaquer.
2.1.1. Utilisations industrielles du mercure
Le mercure est couramment employé dans certains processus industriels et se
conductrices, préservatrices ou désinfectantes sont recherchées. Cependant, une prise de conscience sur les risques qu'il pose pour la santé encourage de plus en plus son
remplacement. Il se retrouve encore dans les appareils électroniques, les néons et
ampoules haute densité, certains appareils médicaux, les amalgames dentaires, les batteries et certains vaccins. Son utilisation dans les peintures, solvants, vernis et agents de conservation pour le bois, produits cosmétiques, fongicides et chandelles, entres autres, a quant à elle généralement cessé, mais nombre de ces produits à base
de mercure sont encore en circulation (Laverdière et al., 2013).
Les principales victimes de la pollution au mercure sont souvent plus démunies et
résident dans des pays en développement ou près d'usines employant des composés
de mercure (United Nations Environmental Program 2013). La figure 2.1 illustre la
répartition géographique des émissions industrielles de mercure en 2010 en Asie, en
Afrique et en Amérique Latine. Les émissions anthropiques fournissent entre 70 et 80%
de tout le mercure retrouvé dans les cycles biogéochimiques (Steinnes 20 13).
Mercury em1ssion 2010, glkm'
15
2.1.2. Aperçu du cycle global du mercure
La concentration du mercure dans la croûte terrestre est plutôt faible, évaluée en
moyenne à 50 jlg/kg. Le tableau 2.1, extrait de Kabata-Pendias et Pendias (2002), détaille les concentrations de mercure retrouvées dans différents types de roches.
L'extraction et l'utilisation industrielle du mercure ont cependant mené à la
concentration excessive, et par conséquent à la pollution de sols et de cours d'eau à
l'échelle locale et régionale (Steinnes, 2013). Au total, la quantité de mercure extraite
des sols depuis l'antiquité est estimée à près de 1 000 000 tonnes, le maximum annuel
ayant été atteint dans les décennies 1970-1980. C'est alors près de 3600 tonnes par
année qui étaient extraites en moye1me, principalement sous fonne de cinabre (HgS)
(Steinnes, 2013 ).
Tableau 2.1 : Teneur en Hg (mg/kg) de roches magmatiques et sédimentaires (Kabata-Pendias et Pendias 2001)
Roches magmatiques Roches sédimentaires
Roches Roches
magmatiques Roches sabl
o-magmatiques magmatiques Grès Carbonates
intermédiaires argileuses
basiques acides
n.d. n.d. 0,08 0,18-0,40 0,04-0,10 0,04-0,05
Dans 1 'atmosphère, les principales émissions naturelles de mercure sont le résultat
d'activités géologiques et volcaniques, particulièrement les éruptions et le dégazage
de la croûte terrestre (Steiru1es, 2013 ). Les zones longeant les plaques tectoniques, où l'activité géologique est la plus intense, sont d'aillems appelées ceintures
mercurifères, et les émissions y sont estimées à 500 Mg par année. Quoique mineure, l'évaporation des océans est également recmmue comme une source naturelle de mercure atmosphérique (Bolan et al. 2014 ).
Ceci étant dit, la principale source de mercure dans l'atmosphère est anthropique: la combustion d'énergie fossile et l'incinération de déchets médicaux rejettent près de 3400 Mg Hg/an (Selin et al. 2008). Plus de la moitié de ces émissions proviennent de l'Asie, mais l'Afrique du Sud, l'Inde, le Japon, l'Australie et les États-Unis sont également des contributeurs impot1ants (Steinnes 2013; United Nations Enviromnental Program 2013). Il est estimé que la moitié du mercure provenant de sources anthropogéniques entre dans le système global, alors que l'autre moitié est recyclée dans les cycles locaux ou régionaux (Kabata-Pendias et Mukherjee 2007). Le temps de résidence du mercure dans l'atmosphère sous forme Hg(II) et pat1iculaire Hg(P) est de l'ordre de quelques semaines, alors que celui de Hg(O) est de 6 à 24 mois (Reeves et Baker 2000). En résultat, depuis l'ère préindustrielle, la quantité de mercure dans l'atmosphère est passée de 2000 Mg à 5600 Mg, majoritairement sous forme de Hg(O) (Selin et al. 2008).
Le mercure atmosphérique peut être transporté sur de longues distances avant de se déposer et se fixer dans les sols, particulièrement ceux riches en matière organique (Steinnes 20 13). Toutes formes de mercure confondues, Se lin et al. estiment ce transfert à 4100 Mg/an, bien qu'une pat1ie soit retournée dans l'atmosphère dans les jours ou les mois suivant sa déposition. L'utilisation de fongicides et de fumiers, pouvant contenir jusqu'à 1ÜÜJ.lg Hg/kg, ainsi que d'amendements industriels (les engrais chimiques phosphatés peuvent contenir plus de 50 J.lg Hg/kg, et les engrais calcaires plus de 2ÜJ.lg Hg/kg) est la principale source de mercure dans les sols en culture : l'utilisation régulière de ces intrants a pu ajouter jusqu'à 200 mg/m2/an dans certaines grandes cultures (Steinnes 2013). Des estimations de la quantité de mercure contenu dans les sols oscillent entre 1 et 3 x 10 12g (Selin 2008 et Steinnes 20 13). La
17
migration du mercure dans le profil du sol est limitée par sa forte tendance à se fixer à la matière organique. Il tend donc à s'accumuler en surface (Kabata-Pendias et Mukhe1jee, 2007). Pour les mêmes raisons, le transpmi du mercure par la lixiviation ou le ruissellement se fait rarement avec la solution du sol, mais plutôt par le biais de la matière organique (Steinnes 2013).
Les cours d'eau et les océans recevraient quant à eux 7100 Mg Hg/an de l'atmosphère. Le ruissellement de sources terrestres comme la lixiviation des dépotoirs, des industries de pâte et papiers, d'équipements électroniques et de peintme, ainsi que de
1 'épandage de pesticides et fertilisants sont également des sources importantes de
mercure dans les eaux, évaluées à 200 Mg/an (Wang et al. 2012; Beaulieu 2016; Selin
et al. 2008). Bien que la législation sm 1 'utilisation du mercme ait été grandement
resserrée depuis les années 1980, certains usages informels, voire illégaux, comme
l'extraction de l'or, demement comants. Ces activités rejettent beaucoup de mercure
sous forme soluble dans les cours d'eau, particulièrement des régions défavorisées
(Wang et al. 2012).
Malgré la quantité importante de mercure qm transite par les océans de surface
chaque année, relativement peu, 7000 Mg, y dememe (Selin et al. 2008). La moitié du
mercme reçu par les océans de surface retourne dans l'atmosphère sous forme de
Hg(O), dont une partie est réduite lors de son passage dans les eaux. En raison de sa
fmie affinité avec les ligands organiques des colloïdes et des particules, l'autre moitié
migre vers le fond de la colonne d'eau vers les sédiments de fond (Conseil canadien des ministres de l'environnement 1999). Formant l'habitat d'une grande variété
d'organismes marins, ces sédiments constituent une source majeme d'exposition pour
la faune aquatique (Envirom1ement et Changement Climatique Canada 2013). Avec
les sols, les sédiments marins sont les récepteurs ultimes de mercure. Le temps de
résidence est estimé à plus de 1000 ans pom les sols et encore plus pour les sédiments
des fonds marins (Su et al. 2008; Selin et al. 2008). Conséquemment, les
-concentrations de ces sédiments sont estimées être de 2 et 7 ordres de magnitude plus élevées que dans les océans de smface et l'atmosphère, respectivement.
La figme 2.2 résume le travail de modélisation du cycle biogéochimique du mercure effectué par Selin et al. (2008). Ce modèle résume les données disponibles sm les réservoirs et les flux dans l'environnement.
Atmosphere: 5€00 J~, ~
'
8
0 jg•
~6
0 0 0 0 0 0 <D ~ l'il ~ il) 0 (.0 w 0 Ng
!.() r-tp l() ç ë o;l O'l ~ c: ë 0 ":f c ë 0 c: c 0 0 0 (") 0 0 ·c ë 0l
';:::; l3 :;::: ·= l() 0N
:;:::::1 'ëii ~ 5. 0 '(ji) 'âi (5 ((! 0 ' 'ëii8.
0 'ë; 15 .. ~ Q. Q) .0 ~ Q. 'ë Q1 rn w Q) ....~
C]) Q) dl Cl c: ~ -o "0 ëL Q) "0 "0 0') 0 0 o. ~g
§ i Ci:' E E ôs
n:-il.)e
0:s:
e
0~
'-""'' (!) ..c: o., Ol 0) -0... m -:r ;;x: 'ë~
~
r--l
o; <t; 1 ::r: i{
.Soil; 1.15>;1 Q6
~
~unoff
..
:
2o
..
~
f
Surface Oéean: 70000 0 0 0
;
,r
co ~t
Deep ocean: 350,000J
0 ~· ... ···- ... .. . Sediments;3x1
~
1
1
J
[
Figure 2.2 : Cycle biogéochimique du mercure (Selin et al. 2008). Les
- -- - -
-19
2.1.3. Biochimie dans les sols et les sédiments
Le mercure fait partie du groupe liB du tableau de Mendeleïev, comme le zinc et le
cadmium. Il présente trois états d'oxydation: Hg(O), Hg(I) et Hg(II). Le Hg(I) n'étant
généralement pas stable, Hg(O) et Hg(II) sont les plus couramment retrouvés dans les
sols (Schuster 1991). Le mercure élémentaire, Hg(O), est plutôt stable, peu soluble
(6* 1
o-
5g/L à 25°C), mais assez volatil (1 ,22* 1o-
3mm à 20°C). Au contraire, le Hg (II)est vite complexé et se retrouve rarement comme cation libre Hg2
+ ou dans la solution
du sol (Kabata-Pendias et Pendias 2001).
Étant un acide de Lewis mou comme le zinc et le cadmium, le mercure s'associe
facilement par des liaisons covalentes avec des bases molles telles que le soufre et
l'iode. Son comportement dans les sols et les sédiments, incluant sa toxicité, sa
mobilité et son temps de résidence, est déterminé par un certain nombre de facteurs
physico-chimiques. Les plus importants sont la nature et la quantité de mercure introduit, le pH, la température, le potentiel d'oxydoréduction, la granulométrie ainsi
que la quantité et la qualité de la matière organique et des colloïdes organiques et
inorganiques (Steinnes 2013; Environnement et Changement Climatique Canada
2013). La présence et la composition de la flore et de la microfaune influence ces
facteurs édaphiques, et a donc aussi un impact sur le comportement du mercure (Selin
et al. 2008; Hesterberg 1998).
2.1.3 .1. Solubilisation
Les concentrations de Hg(O) et Hg(II) retrouvées en solution en conditions naturelles
sont généralement en dessous des valeurs théoriques de solubilisation, car la plupart
du Hg(O) qui peut être solubilisé est dans les faits oxydé en Hg(II) puis adsorbé sur
différentes composantes solides du sol (Schuster 1991 ).
sont généralement formées de Hg(II) puisque les conditions aquatiques près de la
surface sont généralement bien oxygénées. Dans les sols, les associations chimiques
solubles du Hg(II) sont majoritairement déterminées par la présence de ligands
communs, entre autres de types hydroxyde et chlorure, et dans une moindre mesure par échange ionique (Schuster 1991; Steinnes 2013). Ainsi, selon le pH, on retrouve
principalement en conditions naturelles (Eh>400 rn V) : HgCh (pH<7), HgOHCI
(pH::::;7) et Hg(OH)2 (pH>7, à moins d'une concentration en Cl- assez élevée pour
compétitionner avec l'ion OH" en milieu basique) (Schuster 1991). Quant à Hg(O),
bien qu'il soit très peu soluble, une très grande concentration (> 1 Og/L) pounait
permettre sa dissolution quoique ce cas de figure soit improbable en conditions
naturelles (Canela et Jardim 1997).
2.1.3 .2. Adsorption, complexation et précipitation
L'adsorption et la complexation du Hg(II) sur la matière organique sont des réactions
fortement dépendantes du pH du milieu. Un pH faible, entre 3 et 5, maximise 1 'affinité du mercure inorganique pour la matière organique et la force avec laquelle il y est lié (Tremel-Schaub et Feix 2005). Puisque le tiers de la capacité de rétention de
l'humus est allouée à l'échange de cations et les deux tiers à la complexation
métallique, il n'est pas surprenant que ce dernier processus soit de plus grande
importance dans la rétention du mercure (Schuster 1991 ). La très forte propension du
mercure à être chélaté ou adsorbé, à former des liaisons ioniques, à co-précipiter et à
former des complexes avec la matière organique s'explique par la présence fréquente
de soufre dans les groupements fonctionnels, pour lequel le mercme démontre une
très forte affinité. Par ailleurs, pour cette même raison, les substances contenant des
thioligands (ligands dont l'oxygène est remplacé par du soufre) forment des
complexes très stables avec le mercure. Cela peut, selon les circonstances, augmenter
21
quant à eux comme chélatants pour désorber le mercure. La masse moléculaire de
l'acide est proportionnelle à sa capacité de désorber le mercure, grâce à une zone de
contact plus grande, plus de charges négatives et surtout, plus de groupements fonctionnels -OH et -COOH (Jing et al., 2007). Parmi toutes les substances organiques, le mercure se retrouve le plus souvent lié aux acides humiques et
fulviques (Yu et al. 2006).
Puisque les acides organiques ont tendance à se dissoudre avec l'augmentation du pH,
le mercure dans des milieux neutres à alcalins est plutôt retenu sur les argiles et les
oxydes, notamment de fer. C'est également le cas dans les sols naturellement pauvres
en matière organique (Schuster 1991; Tremel-Schaub et Feix 2005). L'adsorption du
mercure, y compris des composés organomercuriques comme le méthylmercure et le
phénylmercure, suit alors 1 'ordre suivant (Andersson 1979) :
Al(OH)3
< kaolinite
< montmorillonite
< illite < sols riches en Fe ou Al (latéritiques)
< sols organiques
< oxydes de fer hydratés (Fe2Ü3.XH20)
Le mercure ainsi adsorbé est très peu à risque d'être naturellement exporté, car sa
mobilité est directement liée à celle des oxydes, eux-mêmes peu mobiles
Les sels mercuriques sont fréquents et généralement, le mercure contenu dans ces sels
peut seulement être mobilisé suite à la dégradation physique du minerai, dans des conditions extrêmes rarement issues de processus naturels (Steiimes 2013). Par
exemple, le cinabre (HgS) se forme et précipite en conditions légèrement réductrices. Il est par la suite particulièrement résistant à 1' oxydation et à l'érosion. Le carbonate de mercure (HgC03) est également peu soluble (Rugh et al., 2000; Steinnes 2013).
Les halogènes, particulièrement l'iode, le brome et le chlore, ont des constantes de
formation Kr élevées avec le mercure. Ils forment par conséquent des complexes stables ne nécessitant pas une grande énergie d'activation (Gates et al. 1994). C'est
pourquoi en présence d'ions Cl-, qui sont d'ailleurs onmiprésents dans les sols, le mercure forme quasi systématiquement du chlorure de mercure. Or, les complexes solubles Hg(II)-Cl ont peu d'affinité avec les sites d'adsorption à charge variable à moins de se trouver en milieu basique (Jing et al., 2007). Par ailleurs, la constante de
formation élevée et la stabilité de ces complexes ont pour résultat que Cl- agit parfois même comme agent désorbant (Ga tes et al. 1994; Schuster 1991).
Les connaissances sur la provenm1ce, la distribution et même la composition des ligands est encore généralement peu avancée. Il semble toutefois y avoir consensus
que les composés mercuriques organiques sont souvent adsorbés sur les colloïdes
inorganiques, et les composés mercuriques inorganiques sur la matière organique du
sol, pmiiculièrement sur les acides humiques et fulviques (Schuster 1991; Yu et al.
2006).
2.1.3 .3. Volatilisation
La volatilisation du mercure se produit suite à la réduction du Hg(II) en Hg(O) par des
agents microbiens ou abiotiques. Plus précisément, la volatilisation augmente avec
23
(Tremel-Schaub et Feix 2005; Kabata-Pendias 2001). Dans les zones tropicales, le rayonnement solaire intense pourrait également causer la volatilisation du mercure.
La volatilisation du mercure présent dans le sol, surtout celui provenant de
dépositions fraîches, représente de 25 à 50% du total des émissions naturelles du sol
vers 1 'atmosphère (Canela et Jardim 1997; Rugh et al., 2000).
2.1.3.4. Lixiviation
Puisque Je mercure se retrouve en quantité très limitée dans la solution du sol, sa mobilité est corrélée à celle des particules fines de la phase solide du sol et aux paramètres physico-chimiques qui la gouvernent, plutôt qu'à celle des fluides. De fait, dans des conditions acides où 1 'affinité du mercure pour la matière organique est maximisée, la mobilité du mercure devient même directement reliée à la mobilité de la matière organique. Cela est d'autant plus marqué dans les sols ou les horizons de
sol à la fois acides et faibles en matière organique (Schuster 1991; Kabata-Pendias et
Pendias, 2001; Yu et al. 2006), par exemple l'horizon éluvié d'un podzol (Andersson 1979). Des conditions sèches peuvent quant à elles causer la formation de fissures
verticales et l'infiltration dans la colonne du sol de colloïdes humiques, et du même
coup du mercure qui y est lié (Lodenius et al 1987 de Steinnes 2013 ). Similairement,
l'érosion et le ruissellement peuvent entraîner le déplacement du mercure.
Finalement, il n'est pas exclu qu'un changement de l'utilisation du sol, l'aération du
sol, les pratiques culturales et les conditions climatiques puissent induire d'autres modifications dans les conditions édaphiques, notamment du potentiel
d'oxydoréduction, et favoriser la formation de composés solubles de Hg(II) tels que
2.1.3.5. Méthylation
Le méthylmercure (MeHg) est d'une importance particulière car il est très mobile,
s'accumule dans la chaîne trophique et surtout, est très réactif (voir section 2.1.4). Il
s'agit d'un produit de l'action microbieru1e, le plus souvent dans des conditions
anaérobiques (Rugh et al., 2000; Steiru1es 2013). Les populations bactériennes et les
facteurs influençant leur activité, comme la présence de nutriments, le pH et la température, exercent donc un contrôle majeur sur le taux de méthylation et de déméthylation du mercure (Tremel-Schaub et Feix 2005). La composition
géochimique des sédiments (granulométrie, teneur en matière organique, en oxydes
métalliques et en sulfures) affecte aussi la méthylation en changeant la biodisponibilité du mercure (Envir01mement et Changement Climatique Canada
2013). Généralement, le Hg(II) en solution est plus disponible pour la méthylation
que le Hg(II) lié aux particules de sol (Steinnes 2013 ).
La méthylation est facilement réversible, mais la déméthylation est un processus plus lent que la méthylation. Les différents composés mercuriques organiques (méthyl-,
phényl- et éthyl-) sont sujets à une dégradation partielle dans le sol suite à leur
formation (Kabata-Pendias et Pendias, 2001)
2.1.3 .6. Spéciation et vieillissement de la contamination
Dans les faits, à 1 'exception de complexes de méthylmercure, la nature chimique du mercure dans l'environnement n'est pas toujours identifiée (Conseil canadien des ministres de 1 'Envir01mement 1999). Or, tel qu'exposé dans les sections précédentes,
il n'est pas suffisant de ne coru1aître que la quantité totale de mercure dans un sol
pour planifier sa remédiation puisque son comportement varie grandement selon sa
25
fractions, caractérisées par la nature de ses liaisons avec les composants du sol et sa réactivité. L'extraction séquentielle, dont il existe plusieurs protocoles, est l'une des
méthodes permettant de compartimenter les différentes espèces métalliques en
fractions. Les protocoles sont cependant difficilement comparables : la séparation des fractions peut différer (figure 2.2), ou alors les instructions retrouvées dans la
littérature sont imprécises quant au rapport entre la masse de 1 'échantillon, le volume
d'extractant ainsi que l'ordre d'ajout des réactifs. Non seulement ces omissions ne
permettent pas une réplicabilité fiable, mais l'extraction des métaux peut être
quantitativement affectée (Tremel-Schaub et Feix 2005; Sanchez et al. 2005). La
température et les propriétés physico-chimiques du sol influencent également le
processus d'extraction (Kalembkiewicz et Soco 2002). De plus, la possibilité de
refixation ou redéposition des métaux extraits pendant les manipulations peut mener à surestimer la force de liaison des espèces métalliques avec le substrat (Sanchez et al. 2005). Dans tous les cas, la non-sélectivité des réactifs extractants ne permet pas d'attribuer à une seule espèce métallique la quantité de métal extrait lors d'une étape (Tremel-Schaub et Feix 2005; Kheboian et Bauer 1987). Ceci étant dit, la spéciation
demeure malgré tout un guide utile.
Dans la présente étude, le schéma de spéciation pour le mercure choisi fut celui de
Giulio et Ryan (1987), qui permet d'isoler les fractions d'acides humiques et
fulviques (tableau 2.2). Celles-ci sont déterminantes étant donné la forte affinité du
mercure avec la matière organique et sont généralement absentes des schémas de
spéciation classique.
Les fractions biodisponibles, FI et F2, traversent facilement les membranes
biologiques des organismes du sol. Le mercure de la fraction échangeable, F2, est
désorbé ou solubilisé par les exsudats chimiques produits par les racines et les
microorganismes actifs dans la rhizosphère (Di Giulio et Ryan 1987). Les autres
arriver que le mercure lié à des substances humiques (F3 FH) soit phytodisponible dans des sols sablonneux, acides et riches en matière organique (Yu et al. 2004).
Tableau 2.2 : Spéciation du mercure dans les sols
Fl
F2
Giulio et Ryan 1987
Soluble à l'eau :lons libres ou fixés par des
1 iaisons de faible énergie
lons associés aux carbonates, ou adsorbés spécifiquement
F3 FF Lié aux acides fulviques F3 FH Lié aux acides humiques F4
FS
Lié à la matière organique et aux sulfures ou incorporé dans les organismes vivants Lié à la fraction résiduelle; Incorporé dans les silicates, la matière organique récalcitrante et cettains oxydes
Tessier et al. 1979 F 1 Échangeable
F2 Lié au carbonates
F
3 Lié aux oxydes de Fe et de Mn
F4 Lié à la matière organique
F5 Lié à la fi·action résiduelle
La mobilité et la disponibilité du mercure sont grandement influencées par le temps. Des études isotopiques menées entre autres par Hintelmann et al. (2002) ainsi que Graydon et al. (2006) ont démontré que le mercure intégré depuis peu dans un sol est
sujet à être réémis dans 1 'atmosphère dans les jours ou les mois suivant sa déposition
sous l'action de facteurs biotiques et abiotiques (section 2.1.3.3). Après ce délai, il devient indifférenciable du mercure dit « résident » (Selin et al., 2008). Le phénomène de vieillissement des métaux dans les sols découle d'une réaction lente d'échange entre la fraction solide et la solution du sol qui se solde en la rétention de plus en plus forte du métal par la phase solide du sol, et conséquemment de la
27
diminution de la biodisponibilité avec le temps (Tremel-Schaub et Feix 2005; Wang
et Greger 2006). Les processus potentiellement responsables sont multiples :
diffusion dans les micropores, occlusion dans la phase solide, précipitation, etc.
(Kabata-Pendias et Pendias 2001). Cela demeure très dépendant des conditions édaphiques. Du moins pour le cuivre, ce phénomène semble être réversible à court
terme (Ma et al. 2005 cité par Adams et Chapman 2007). Ceci étant dit, la
compréhension générale du processus de vieillissement des métaux dans les sols est encore incomplète.
Dans les études de phytoextraction, bien des chercheurs emploient un substrat sain
additionné de mercure. Cette méthode offre l'avantage de travailler avec un sol
homogène, dont la quantité de mercure est assurée, mais cela ne tient pas compte de
la diminution de la biodisponibilité du mercure avec le temps. Ainsi, même une terre
enrichie, puis vieillie toute une année, ne reproduit pas les mêmes conditions de
culture qu'une tene dont la contamination date de plusieurs décennies. Les essais faits avec de la terre enrichie représentent donc souvent mal la réalité des tenains
contaminés (Wang et Greger 2006).
2.1.4. Biodisponibilité et toxicité
Le mercure est l'un des éléments traces les plus toxiques. Puisqu'aucune fonction
biologique ne lui est connue, même une très faible concentration peut causer des
dommages potentiellement inéversibles. Chez les animaux, en règle générale, les
formes inorganiques de mercure affectent les organes, alors que les formes organiques causent des donunages au système nerveux. Plus elles sont mobiles, plus
elles sont toxiques (Steinnes 2013). Ainsi, le mercure lié à des sulfures ou à la matière organique est difficilement assimilable pour les organismes alors que le
quantité ingérée est absorbée par le système. La toxicocinétie des trois valences de
Hg (Hg(O), Hg(I) et Hg(Il)) est très différente, mais toutes sont toxiques (Steümes
2013). Hg(O) est facilement absorbé par les poumons et diffuse passivement à travers
les tissus. Cependant, son temps de résidence comi fait qu'il ne s'accumule pas et
n'est que très peu réactif. Une exposition intense, même de courte durée, au Hg(O)
peut tout de même mener à la m01i par arrêt respiratoire. De plus, à l'intérieur d'un
organisme, il peut être oxydé en Hg(II) sous 1 'action d'enzymes peroxydase ou
catalase. Hg(II) est quant à lui très mobile, mais ne diffuse pas facilement à travers les
membranes cellulaires et est peu absorbé par l'intestin. Il cause des dommages au foie,
aux reins et au tract intestinal lors de son passage, avant d'être en grande partie
évacué (Rugh et al., 2000; Kabata-Pendias et Mukherjee 2007). Le méthylmercure,
quand à lui, interfère avec des neurotransmetteurs, notanm1ent en perturbant le flot de
Ca+ dans les canaux ioniques des membranes cellulaires (Rugh et al., 2000). Étant
liposoluble, il est fortement susceptible d'être bioaccumulé dans la chaîne trophique depuis les sédiments marins jusqu'à l'humain (Steinnes 2013). Il migre facilement à
travers les membranes, présumément à cause de son hydrophobie et sa tendance à
former des sels neutres. C'est pourquoi le méthylmercure est la forme la plus
dangereuse pour le vivant (Kabata-Pendias et Mukherjee, 2007).
Les cmq sens, particulièrement la vue et le toucher, sont les premières facultés
affectées par une intoxication au mercure. Il en résulte fréquemment une difficulté à
se mouvoir et de tremblements. Au même titre que d'autres éléments traces métalliques, le mercure affecte la croissance et le métabolisme des êtres vivants,
végétaux comme animaux (Patra et Sharma 2000; Su et al. 2008). Chez les animaux,
il cause des troubles nerveux, le cancer, la paralysie cérébrale, la microcéphalie, des
troubles moteurs, des troubles de 1 'élocution, la cécité, la surdité, des problèmes
intestinaux ainsi que des maladies cutanées. Le syndrome d'affectation du système
nerveux par le méthylmercure est appelé maladie de Minamata, suite à 1 'émission
29
baie de Minamata, au Japon (Rugh et al. 2000). La consommation de pmsson contaminé au mercure biométhylé fut recorume comme la cause du décès de milliers
de personnes habitant la baie, ce qui confirme le danger de sa bioaccumulation (Balan
et al. 20 14).
Dans le règne végétal, le mercure peut également inhiber les fonctions vitales au point d'être létal (Kabata-Pendias et Mukherjee, 2007). Si la plupart des plantes ont la capacité de tolérer des niveaux modérés dans Je sol ou dans l'air, leur croissance en
est souvent affectée. Une concentration de 0,5 à 3 mg/kg (masse sèche) est toxique
pour les végétaux; le tableau 2.3 compare Je seuil de toxicité du mercme avec celui d'autres éléments traces fréquemment retrouvés dans les sols. Le mercure perturbe la photosynthèse et le métabolisme oxydatif en modifiant la perméabilité des membranes des chloroplastes et des mitochondries (Kabata-Pendias et Mukherjee,
2007). En altérant le potentiel des membranes, il modifie également l'apport en eau
des cellules et 1 'homéostasie des nutriments (Rugh et al., 2000). Il en résulte une
chlorose, des racines écourtées et une croissance réduite des végétaux, des
symptômes sont typiques d'une exposition excessive aux éléments trace mais qui
s'apparentent également à l'attaque de pathogènes (Kabata-Pendias et Pendias 2001).
Puisque le prélèvement par les plantes des éléments nutritifs ne peut se faire qu'à partir de la solution du sol (Kabata-Pendias et Pendias, 2001), la phytodisponibilité est surtout fonction de la recharge de 1 'élément dans la solution du sol à partir de la phase solide (Tremel-Schaub et Feix 2005; Yu et al. 2004). Il n'y a donc pas de
corrélation directe entre la quantité totale, toutes fractions chimiques confondues,
Tableau 2.3 : Comparaison des seuils de toxicité de différents éléments tmces avec le Hg pour les végétaux (extrait de Kabata-Pendias, 2001)
ETM Normal (mg/kg) Excessif ou toxique (mg/kg)
As 1-1,5 5- 20 Cr 0,1 -0,5 5 -30 Cd 0,01 - 0,2 5-30 Cu 5-30 20- 100 Hg 0,5-3 Pb 5 -JO 30 -300 Zn 25-150 100-400 2.2. La phytoextraction
La phytoextraction est le processus de phytoremédiation visant l'accumulation dans
les végétaux des contaminants qui ne peuvent être dégradés, comme les métaux et les
métalloïdes. Les caractéristiques recherchées chez la plante sont alors :
la capacité d'hyper accumuler le polluant
la tolérance à la toxicité du polluant (Bert et al. 2009)
le facteur de translocation des éléments vers les parties aériennes (Giasson et al. 2005; Su et al. 2008)
une production rapide et impmiante de biomasse (Smolinska et Leszczynska
2015)
la facilité de la récolte à des fins d'exportation (Bert et al. 2009)
la rusticité, pour des projets dans des régions plus nordiques comme le
- - - - -- - - -- - -
-31
Les trois premières caractéristiques, 1 'hyperaccumulation, la tolérance et la
translocation, sont étroitement liées et seront détaillées dans les sections suivantes.
2.2.1. Absorption, hyperaccumulation et tolérance
Les végétaux n'ont pas tous la même capacité d'absorption, d'où la nécessité de bien
choisir les espèces végétales dans une optique de phytoextraction. Les légumes
-feuilles, par exemple, accumulent plus de métaux que les céréales (Tremel-Schaub et
Feix 2005). Plusieurs espèces auraient par ailleurs la capacité de développer une
tolérance au mercure lorsqu'elles y sont exposées, à l'instar des espèces s'étant
adaptées aux sols métallifères. Cette adaptation peut être autant au niveau du
génotype ou du phénotype (Kabata-Pendias et Mukhetjee, 2007).
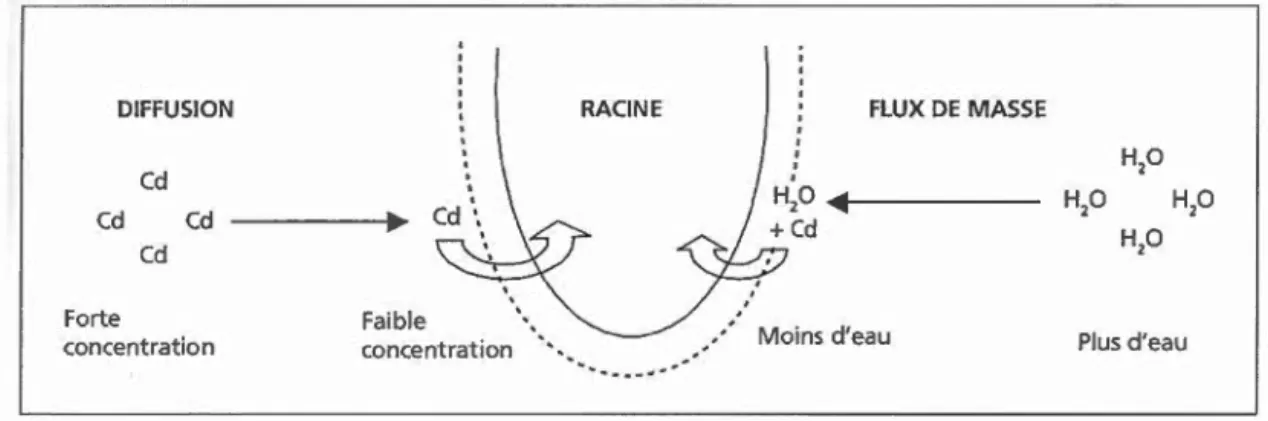
DIFFUSION RACINE FLUX DE MASSE
Cd H20 Cd Cd H20 H20 Cd H20 Forte Faible Moins d'eau
concentration concentration ' ' ' Plus d'eau
'
-
___ ..-Figure 2.3 :Flux de masse des métaux en solution vers la racine (cas du Cadmium)
(Tremel-Schaub et Feix 2005)
Le système racinaire est la principale voie d'absorption des éléments par les plantes.
Par la voie racinai re, les contaminants sont absorbés avec 1 'eau, de la même manière
pourquoi un système racmmre dense, dit « fibreux », est le plus efficace, cm· une grande quantité de radicelles offre une grande surface d'absorption (K vesitadse et al. 2006). Cependant, le mercure étant rarement naturellement retrouvé en solution dans les sols, l'absorption racinaire représenterait une voie d'accumulation limitée. Conséquemment, dans des conditions favorables à la formation de Hg(O), le mercure
retrouvé dans les feuilles des végétaux provient majoritairement de la déposition
atmosphérique (Steinnes 2013). Une revue de la littérature effectuée par Tremel-Schaub et Feix (2005) démontre que les légumes feuilles, parmi d'autres cultures alimentaires, tendent particulièrement à bioaccurnuler le mercure par absorption foliaire. ligands inorganiques ASSOCLA.TIONS RACINES-lv.IICROBES
----F=======ll
~-ymes
1
phytosidérophores acides organiquesFigure 2.4 : Voies de mobilisation des éléments par les racines associées aux microorganismes (Tremel-Schaub et Feix 2005)