1
UNIVERSITE DE PICARDIE JULES VERNE
FACULTE DE MEDECINE D’AMIENS
Année 2017 n°2017 - 128
THESE POUR LE DOCTORAT EN
MEDECINE-HEPATOGASTROENTEROLOGIE
(DIPLOME D'ETAT)
PRESENTEE ET SOUTENUE PUBLIQUEMENT
LE MERCREDI 11 OCTOBRE 2017
PAR
MARION ALLART-SAVA
PRESIDENT DU JURY :
Monsieur le Professeur Eric NGUYEN-KHAC
MEMBRES DU JURY :
Monsieur le Professeur Denis CHATELAIN
Monsieur le Professeur Bruno CHAUFFERT
Monsieur le Docteur Charles SABBAGH
DIRECTEUR DE THESE :
Monsieur le Docteur Vincent HAUTEFEUILLE
Adénocarcinome à cellules indépendantes
colorectal métastatique : description
clinique, histologique et moléculaire à partir
2
A mon Maître,
Monsieur le Professeur Eric NGUYEN-KHAC Professeur des Universités-Praticien Hospitalier
Hépato-Gastroentérologie et Cancérologie Digestive
Chef de Service
Pôle "Médico-chirurgical digestif, rénal, infectieux, médecine interne et endocrinologie"
(D.R.I.M.E)
Pour l'honneur que vous me faites de présider mon jury de thèse, Votre expertise et votre rigueur sont à prendre en modèle,
Veuillez trouver ici l'expression de mon respect et de ma reconnaissance pour votre enseignement.
3
A mon Maître,
Monsieur le Professeur Denis CHATELAIN Professeur des Universités-Praticien Hospitalier
Anatomie et cytologie pathologique
Pôle Oncopôle
Pour votre analyse anatomopathologique des tumeurs digestives, Merci de me faire l'honneur et le plaisir de juger ce travail,
4
A mon Maître,
Monsieur le Professeur Bruno CHAUFFERT Professeur des Universités-Praticien Hospitalier
Oncologie médicale
Chef de Service
Pôle Oncopôle
Pour votre enseignement à chaque réunion pluridisciplinaire, Merci de me faire l'honneur et le plaisir de juger ce travail,
5
A mon Maître,
Monsieur le Docteur Charles SABBAGH
Maître de Conférences des Universités-Praticien Hospitalier
Chirurgie digestive
Pôle "Médico-chirurgical digestif, rénal, infectieux, médecine interne et endocrinologie"
(D.R.I.M.E)
Pour votre enseignement et votre disponibilité, Merci de me faire l'honneur de juger ce travail,
6
A mon Maître,
Monsieur le Docteur Vincent HAUTEFEUILLE Praticien Hospitalier
Hépato-Gastroentérologie et Cancérologie Digestive
Pôle "Médico-chirurgical digestif, rénal, infectieux, médecine interne et endocrinologie"
(D.R.I.M.E)
Pour avoir accepté de diriger ce travail,
Pour ta disponibilité, ta rigueur et ton investissement,
Pour ton implication dans ma formation professionnelle, pour toutes les choses que tu m'as enseignées,
Pour tenter désespérément de me donner confiance en moi,
7 Remerciements :
Au Professeur Dupas, Docteur Joly, Docteur Delcenserie et Docteur Yzet, merci pour votre implication dans ma formation médicale, votre disponibilité et le partage de vos connaissances. Monsieur Dupas, merci de m'avoir mise en interdit bancaire à 1 mois de mon mariage!
A Franck, merci pour ton enthousiasme, ta pédagogie, tes coups de gueule et ton humour de carabin.
A Sami, merci pour ta patience et ton enseignement lors de mon semestre aux soins continus d'HGE.
A mes anciens chefs, Marie-Laure, Marthe, Morgane, Adrien et Justine, merci pour tout ce que vous m'avez appris.
A mes chefs, Mathurin, Henri, Jean-Phi, Pierre, Marie, Valérie, Ruxandra, Justine, merci pour tout ce que vous m'avez appris et vos conseils tout au long de mon internat. Une sacrée brochette de gastro-entérologues!
A mes cointernes, merci pour votre bonne humeur et votre cohésion :
- Constance, on en a parcouru du chemin depuis notre premier semestre en A5 Sud!
- Julien, futur co-chef et seul mâle de la promo qui devait nous raccompagner après les soirées des journées DES, même si c'était souvent l'inverse
- Clara, on se souviendra d'ailleurs (ou pas) de nos retours de soirées, toi qui veilles toujours à ce que nos verres soient pleins
- Aline, on se motive pour un body combat ? Et…on l'a retrouvée ta petite culotte!
- Clémentine, avec ton franc-parler, toujours à jour sur les potins et à te chamailler avec Aline
8
A mes co-internes de radiothérapie, Aline, Deborah et Mickaël. Merci de m'avoir ménagé du temps à l'approche de mon mariage et de m'avoir couverte lorsque j'allais à mes rendez-vous du mardi!
Aux équipes d'A5 Sud, d'A5 Est, d'HGE A, B, des endoscopies, des soins continus d'HGE, et aux secrétaires Catherine, Louisette et Régine.
A toute l'équipe du service d'Hépato-gastroentérologie et d'Oncologie de Compiègne.
A la team d'Abbeville, Jessica, Sophie et Esther. On se souviendra d'une certaine soirée à l'internat.
9
A mon mari, Jean-Charles, qui a eu (et a toujours) la patience de m'écouter me plaindre. Merci pour ton soutien et ton amour.
A mes parents, merci de m'avoir permis de faire ces études formidables, de m'avoir encouragée, soutenue et fait de moi ce que je suis maintenant.
A mon frère et ma sœur, Antoine et Camille, qui me faisaient faire des pauses lorsque je révisais mes cours de médecine.
A toute ma famille : mes tantes et oncles et leurs enfants, Joëlle et Fabrice, Victoria, Erwan, Morgane et Samuel, Anne et Mehmet, Céline et Matteo; ma tante Anne-Marie religieuse; ma grand-mère Nelly; mon oncle François et mon cousin Martin. Une pensée pour mes grands-parents paternels et mon grand-père maternel qui sont déjà partis.
A ma belle-famille, Dominique, Jean-Maurice, Fanfan et Juju et leurs enfants Pauline et Suzanne, Jean-Do et Fabienne et leurs enfants Jules et Zoe. Merci de m'avoir accueillie si chaleureusement dans votre famille.
A mes amies et témoins de mariage Caroline, Suzanne et Claire, pour m'avoir écoutée et conseillée tout au long de mes études de médecine, et jusqu'au bout du monde! A Marine et Cécile qui ont également participé à mon EVJF mémorable. Merci d'être mes amies et merci pour tous ces bons moments passés ensembles et à venir.
A Sophie, pour nos confidences à la salle de sport, et…on en aura parlé des rhododendrons!
A mes poupoules Annabelle et Elise, amies bordelaises de longue date. Annabelle, heureuse de savoir de ton casier judiciaire est bien vierge. Elise, on se souviendra toujours de notre été à Soulac et de notre périple au Maroc!
10
RESUME
Introduction : Les adénocarcinomes à cellules indépendantes colorectaux métastatiques (ADCI CCRm) sont rares et mal connus. L'efficacité de la chimiothérapie n'a jamais été étudiée en situation métastatique. L'objectif était d'analyser leur chimiosensibilité, leurs caractéristiques cliniques, moléculaires et pronostiques.
Patients et méthode : Les patients avec un ADCI CCRm inclus rétrospectivement de 2003 à 2017 dans 31 centres français ont été séparés en 3 groupes : prise en charge curative des métastases (groupe 1), chimiothérapie palliative (groupe 2) et soins de supports exclusifs (groupe 3).
Résultats : Les 204 patients inclus avaient un âge médian de 63 ans. Les tumeurs étaient plus souvent coliques proximales (46%) et rectales (29%), T4 (71%) et peu différenciées (86%). Les sites métastatiques étaient préférentiellement péritonéal (69%), ganglionnaire (28%) et hépatique (23%). Il y avait 19% d'instabilité microsatellite (MSI) et 9% de mutation BRAF, plus souvent à droite. Il y avait 23% de mutation RAS. La médiane de survie globale (SG) était de 10,1 mois (IC95%=[7.9;12.8]). La médiane de SG pour les groupes 1 (n=38), 2 (n=112) et 3 (n=54) était de 45,1 mois, 10,9 mois et 1,8 mois respectivement. La localisation colique droite/gauche/rectum, le pourcentage de cellules indépendantes et le statut microsatellite n'avaient pas d'influence sur la survie globale (p=0,13 ; p=0,40 et p=0,82). Dans le groupe 2, 28,4% ont eu un antiVEGF et 22% un antiEGFr en 1ère ligne (L1). Les taux de réponse et de contrôle en L1 étaient de 13,2% et 50%, la survie sans progression (SSP) était de 5 mois avec une biothérapie et de 3,9 mois avec une chimiothérapie cytotoxique seule (p=0,016). Il n'y avait pas de différence de SSP entre les antiVEGF et les antiEGFr (p=0,8) en L1, que ce soit à droite (p=0,275) ou à gauche (p=0,265).
Conclusion : Les ADCI CCRm sont de mauvais pronostic avec une localisation tumorale et des altérations moléculaires spécifiques, leur conférant une chimiosensibilité médiocre. Le statut microsatellite devrait être recherché, compte tenu des perspectives prometteuses de l’immunothérapie dans les tumeurs MSI.
11
ABSTRACT
Background : Metastatic colorectal signet ring cell carcinoma (mSRCRC) is a rare entity and data are limited. Chemosensitivity for metastatic disease has never been assessed. This study analyzes their chemosensitivity and investigates their clinicopathological, molecular and prognostic characteristics.
Patients and methods : This nationwide retrospective study included patients with mSRCC from 2003 to 2017, divided into three groups : curative care (group 1), palliative chemotherapy (group 2) and best supportive care (group 3).
Results : Data on 204 patients were collected. Median age was 63 years. Tumors were more frequent in proximal colon (46%) and rectum (29%), were T4 (71%) and poorly differenciated (86%). Sites for metastases were mainly peritoneum (69%), lymph nodes (28%) and liver (23%). Microsatellite instability (MSI) and BRAF mutation were found in 19% and 9% of patients, and were mainly right sided. RAS mutation was found in 23%. Median overall survival (mOS) was 10,1 months (95%CI=[7.9;12.8]). mOS for group 1 (n=38), group 2 (n=112) and group 3 (n=54) were 45,1 months, 10,9 months and 1,8 months respectively. No difference in mOS was found between tumor location, signet ring cell's percentage and microsatellite status (p=0,13 ; p=0,40 and p=0,82). In group 2, first-line treatment (1L) was antiVEGF-based in 28,4% and antiEGFr-based in 22% of cases. Response and control rates were 13,2% and 50% respectively in 1L, progression-free survival (PFS) was 5 months with biotherapy and 3,9 months with cytotoxics alone (p=0,016). There was no difference in PFS between antiVEGF and antiEGFr (p=0,8), and between right-sided (p=0,275) and left-sided (p=0,265) tumors.
Conclusion : mSRCRC have poor prognosis, specific location and molecular alterations which provides low chemosensitivity. Microsatellite analysis should be done regarding promising results of immunotherapy in MSI-high tumors.
12
TABLE DES MATIERES
1. INTRODUCTION………..…..14
2. MATERIEL ET METHODE………18
2.1 Type d'étude………18
2.2 Critères d'inclusion………..18
2.3 Critères d'exclusion……….18
2.4 Recueil des données………18
2.4.1 Méthode………18 2.4.2 Variables recueillies……….19 2.4.3 Analyse de sous-groupes………..19 2.5 Objectifs de l'étude………..19 5.6 Analyse statistique………...20 3. RESULTATS………....21 3.1 Données au diagnostic……….21 3.1.1 Caractéristiques de la population………..21 3.1.2 Caractéristiques tumorales………...….21
3.1.3 Type de traitement effectué………..24
3.2 Données de survie………...25
3.2.1 Survie globale………...25
3.2.2 Survie sans progression selon le type de traitement……….27
4. DISCUSSION………...28
5. CONCLUSION……….31
6. ANNEXES………32
13
LISTE DES ABBREVIATIONS
ADCI : adénocarcinomes à cellules indépendantes
ADK : adénocarcinome lieberkühnien
CCRm : cancer colorectal métastatique
OMS : organisation mondiale de la santé
TNM : tumor, nodes, metastasis
PS : performance status
PAL : phosphatases alcalines
LDH : lactate déshydrogénase
ACE : antigène carcino-embryonnaire
CA19.9 : antigène carbohydrate 19-9
MSI : instabilité microsatellite
MSS : stabilité microsatellite
CHIP : chimiothérapie hyperthermique intrapéritonéale
IRM : imagerie par résonnance magnétique
VEGF : vascular endothelial growth factor
EGFr : epidermal growth factor receptor
14
1. INTRODUCTION
Les adénocarcinomes à cellules indépendantes (ADCI) colorectaux sont des tumeurs coliques malignesrares et mal connues.
Représentant 1% des cancers colorectaux (1,2), ils se caractérisent par la présence de cellules indépendantes, définies microscopiquement par la présence de mucine intracytoplasmique déportant le noyau en périphérie et leur conférant un aspect de "bague à chaton". Elles sont disséminées dans un stroma fibreux abondant avec une infiltration pariétale prédominant dans les couches profondes [Figure 1], pouvant leur conférer un aspect macroscopique tubulisé appelé linite.
Figure 1 : Différents types histologiques d'adénocarcinomes colorectaux. (A) Adénocarcinome à cellules indépendantes. (B) Adénocarcinome mucineux avec contingent à cellules indépendantes. (C) Adénocarcinome mucineux sans cellules indépendantes. (D) Adénocarcinome lieberkühnien classique (images : PrD. Chatelain – Service d'Anatomopathologie – CHU d'Amiens).
La définition d'un ADCI selon l’Organisation Mondiale de la Santé (OMS) est la présence d'un contingent majoritaire (supérieur à 50%) intratumoral de cellules indépendantes (3). Macroscopiquement, on retrouve une induration pariétale blanchâtre avec un aspect tubulisé et rigide en endoscopie et sur la pièce opératoire [Figure 2]. L'aspect scannographique montre un épaississement pariétal diffus circonférentiel spontanément hyperdense, avec une infiltration péridigestive fréquente et une prise de contraste en cible de la lésion (4).
A B
15 Figure 2 : Aspect d'un adénocarcinome à cellules indépendantes rectal. (A) Aspect macroscopique.
(B) Aspect endoscopique. (C, D) Aspect scannographique en coupe axiale et sagittale. (E, F) Aspect
en IRM en coupe coronale et sagittale. (G) Aspect écho-endoscopique (images : Pr D. Chatelain - Service d’anatomopathologie ; Dr V. Hautefeuille – Service d’Hépato-gastro-entérologie – CHU d'Amiens).
Les ADCI gastriques sont mieux connus. Ilssurviennent chez des sujets plus jeunes, sont diagnostiqués à un stade tardif, avec une extension ganglionnaire et une carcinose péritonéale plus fréquentes (5,6). La présence de cellules indépendantes en contingent majoritaire semble être un facteur d'agressivité tumorale, avec un impact péjoratif sur la
A B C D E F G B A C D F E G
16
survie globale (21 mois pour les ADCI gastriques contre 44 mois en cas d'adénocarcinome classique) (7). D'un point de vue thérapeutique, différentes études rétrospectives suggèrent une chimiorésistance des ADCI gastriques (8–10).
Les caractéristiques épidémiologiques des ADCI colorectaux sont assez bien décrites dans la littérature, les plus grandes séries étant celles de Hyngstrom et al. (n=2260) (11) et Hugen et al. (n=1972) (12). En revanche, leurs caractéristiques moléculaires et en situation métastatique pure sont très peu connues, concernent des effectifs de petite taille, de l'ordre de 10 à 40 patients. La plus grosse série décrivant jusqu'à présent leurs caractéristiques moléculaires est celle de Korphaisarn et al. (13) avec 93 patients.
Sur le plan clinique, les ADCI colorectaux touchent des sujets plus jeunes puisque 25% surviennent avant l'âge de 60 ans, les adénocarcinomes lieberkühniens (ADK) ne survenant avant cet âge que dans 10 à 20% des cas (2,11,12). Ils sont majoritairement localisés dans le colon droit (50 à 75%) et 20% d’entre eux se développent dans le rectum (1,11–14). Ils sont diagnostiqués à un stade plus avancé : 38à 51% des ADCI colorectaux au stade III et 29 à 40% au stade IV [Annexe 1], alors que ce n'est respectivement le cas que pour 25% et 20% des adénocarcinomes classiques (1,11,12). L'invasion ganglionnaire y est plus fréquente (67% contre25%) tout comme la dissémination péritonéale, présente dans 50 à 90% au diagnostic (14–17) contre 10 à 20% en cas d'ADK (2,14,17). Ce sont des tumeurs moins bien différenciées (1,2) et plus agressives avec des survies inférieures à celles des ADK, de l'ordre de 8 à 18 mois tous stades confondus ; la survie à 5 ans étant de 67 à 98% pour les ADCI stades I-II, de 25 à 35% pour les stades III et de moins de 4% pour les stades IV, alors qu'elle est respectivement de 70-90%, 55% et 10% en cas d'ADK (1,12,18).
La présence d’un contingent minoritaire de cellules indépendantes semble conférer aux adénocarcinomes le même pronostic péjoratif qu'en cas d'ADCI vrai : âge plus jeune et stade plus avancé au diagnostic, taux de résection R1 plus important, survie à 5 ans inférieure (14,4 mois pour les ADCI et 18,6 mois pour le groupe avec contingent minoritaire de cellules indépendantes contre 47,2 mois pour les adénocarcinomes classiques)(13,19,20).
Au niveau biomoléculaire, la mutation du gène KRAS (codons 12 et 13 de l’exon 2) semble moins fréquente dans les ADCI colorectaux tous stades confondus (20–23) ou métastatiques seuls (13% contre 50% pour les adénocarcinomes lieberkühniens dans l’étude de Korphaisarn et al. (13)). La mutation NRAS est beaucoup plus rare, alors qu'ils possèdent
17
plus fréquemment une mutation BRAF V600E (20–22) en situation métastatique (10% contre 7.7% (13)).
Par ailleurs, les ADCI colorectaux présentent plus d’instabilité microsatellite (MSI) (1,21,22) : au stade métastatique, on observe trois fois plus d’instabilité dans les ADCI : 14% contre 3.5 à 5% (13,24–26) [Annexe 2]. Aucune des études n'a permis de confirmer la valeur pronostique du statut MSI dans les ADCI colorectaux (1,20,27–29), péjorative dans les ADK (30).
Sur le plan thérapeutique, le bénéfice d'une chirurgie du primitif et des métastases n'est pas évident (16,31–34). On constate globalement que la survie des ADCI colorectaux métastatiques opérés à visée curative est inférieure à celle obtenue pour les adénocarcinomes lieberkühniens (survie à 5 ans de 10% versus 25%), avec une récidive postopératoire à 6 mois plus fréquente (25% de récidive à 6 mois contre 13%) (31,35). De plus, la réalisation d'une chimiothérapie suivie d'une chirurgie à visée curative n'entraine pas forcément de meilleurs résultats qu'une chimiothérapie seule en terme de survie (36).
En cas de carcinose péritonéale, les ADCI colorectaux traités par chirurgie cytoréductive et chimiothérapie hyperthermique intrapéritonéale (CHIP) n'avaient une médiane de survie que de 14 mois, alors qu'elle était de 35 mois pour les adénocarcinomes colorectaux classique (p<0,01) dans l'étude hollandaise de Van Oudheusden et al. (16). Mais en l'absence de réalisation de ce traitement invasif, les médianes de survies étaient inférieures, de l'ordre de 5 mois en cas d'ADCI et de 11 mois en cas d'ADK, en sachant queces données portaient sur depetitseffectifs.
Concernant leur chimiosensibilité, il semble y avoir un bénéfice à la réalisation d'une chimiothérapie adjuvante pour lesstades III (12). En situation métastatique, il n'existe aucune donnée de chimiosensibilité, notamment s'il existe un bénéfice à l'utilisation des antiVEGF (bevacizumab) ou des antiEGFr (cetuximab ou panitumumab).
Le but de cette étude de cohorte rétrospective multicentrique était d'évaluer la chimiosensibilité des ADCI colorectaux métastatiques traités à visée palliative et de confirmer lescaractéristiques cliniques, biologiques, moléculaires et pronostiques.
18
2. MATERIEL ET METHODE
2.1 Type d'étudeIl s'agissaitd'une étude non interventionnelle, rétrospective, multicentrique, portant sur une cohorte française de patients atteints d'adénocarcinome à cellules indépendantes colique ou rectal, avec métastases synchrones ou métachrones.
2.2 Critères d'inclusion
Les patients porteurs d'un adénocarcinome de primitif colique ou rectal prouvé histologiquement, avec présence de cellules indépendantes (quelqu'en soit le pourcentage) et des métastases synchrones ou métachrones diagnostiquées après 2003 ont été inclus et analysés rétrospectivement. Les tumeurs avec un contingent mucineux pouvaient être inclus.
2.3 Critères d'exclusion
Les patients n'étaient pas inclus dans l'étude s'ils présentaient un autre cancer évolutif, un adénocarcinome colorectal à cellules indépendantes non métastatique, ou un cancer à cellules indépendantes dont l'origine était incertaine.
2.4 Recueil des données 2.4.1 Méthode
Les données ont été recueillies de façon rétrospective entre novembre 2016 et juillet 2017. Le recueil n'était pas exhaustif selon les centres. La présence de cellules indépendantes était recherchée avec le code ADICAP «cellules indépendantes »A7N6, croisé avec « colorectal ».
Les médecins responsables de chaque centre étaient chargés de recueillir les données cliniques et paracliniques des patients. Les données étaient saisies dans un tableur Excel (Microsoft®). Toutes les données ont été centralisées au CHU d'Amiens. L’analyse statistique a été réalisée par le laboratoire de Biostatistique du Professeur Franck Bonnetain du CHU de Besançon par Mmes Aurélia Meurisse et Astrid Pozet. La concordance des données était vérifiée, et les données manquantes étaient complétées autant que possible.
19 2.4.2 Variables recueillies
Les caractéristiques des patients recueillies étaient l'âge, le sexe, le poids, le Performance status (PS), la présence d'une maladie inflammatoire chronique intestinale, d'un antécédent personnel ou familial de carcinome lobulaire du sein ou d'ADCI gastrique, et certains paramètres biologiques (leucocytes, plaquettes, PAL, albumine, LDH). La date de décès était recueillie, ou à défaut, la date des dernières nouvelles.
Les données oncologiques comprenaient la date du diagnostic initial et le stade TNM, la localisation tumorale primitive, les marqueurs tumoraux (ACE et CA19.9), les caractéristiques tumorales histologiques (pourcentage de cellules indépendantes) et biomoléculaires (statut microsatellite et mutationnel), ainsi que les sites métastatiques. Les tumeurs du caecum, du colon ascendant et du colon transverse étaient regroupées en "colon droit". Les tumeurs du colon descendant et du sigmoïde étaient regroupées en "colon gauche". Les modalités thérapeutiques étaient colligées (chirurgie, chimiothérapie, soins de supports).
2.4.3 Analyse de sous-groupes
Les patients ont été répartisen trois groupes selon leur prise en charge :
- groupe 1 : prise en charge curative du cancer métastatique ;
- groupe 2 : chimiothérapiepalliative exclusive(les patients du groupe 1 ayant récidivé n’ont pas été inclus dans l’analyse du groupe 2) ;
- groupe 3 : soins de supports exclusifs.
La survie globale de chaque groupe a pu être calculée, ainsi que la survie sans récidive des métastasesdans le groupe 1 et les survies sans progression de la ligne 1 (L1) à la dernière ligne (Ln)dans le groupe 2. Enfin, le taux de réponse objective (réponse complète et partielle) et de contrôle (réponse complète, partielle et stabilité) ont été calculés en L1 pour les différents protocoles de chimiothérapie.
2.5 Objectifs de l'étude
L'objectif principal de notre étude était d'évaluer la chimiosensibilité des ADCI colorectaux métastatiques traités à visée palliative (groupe 2).
20
Les objectifs secondaires étaient de définir les caractéristiques cliniques, biologiques, moléculaires et pronostiques de la population ; et de recueillir les données de survie des 3 groupes, à savoir : survie globale et sans récidive des patients métastatiques traités à visée curative (groupe 1), survie globale et sans progression des patients métastatiques traités à visée palliative (groupe 2), et survie globale des patients ayant bénéficié de soins de support exclusifs (groupe 3).
5.6 Analyse statistique
Les variables continues étaient exprimées en moyenne, médiane, écart type et intervalle de confiance à 95% (IC95%). Les variables catégorielles étaient exprimées en pourcentage et effectif total. Une valeur de p<0,05 était considérée comme statistiquement significative. Le suivi médian était calculé selon une méthode non paramétrique de Kaplan-Meier inversé. La survie globale et la survie sans progression et sans récidive étaient évaluées selon une méthode non paramétrique de Kaplan-Meier.
La survie globale de la cohorte était définie par le délai entre le diagnostic métastatique et la date de décès, quelle que soit la cause.
La survie sans maladie de la cohorte était définie par le délai entre la fin de prise en charge du cancer localisé (date de fin de chimiothérapie adjuvante ou date de chirurgie selon les cas) et la date de progression métastatique, la survie globale des 3 groupes par le délai entre la date du diagnostic des métastases et la date de décès.
La survie sans récidive du groupe 1 était définie par le délai entre la date de fin du traitement des métastases à visée curative et la date de récidive métastatique. La survie sans progression (SSP) dans le groupe 2 était définie à chaque ligne de chimiothérapie par le délai entre la date de début de la chimiothérapie et la date de progression. Les patients en vie ou perdus de vue étaient censurés à la date des dernières nouvelles.
21 52 59 93 Localisation (n=204) Colon gauche Rectum Colon droit
3. RESULTATS
3.1 Données au diagnostic 3.1.1 Caractéristiques de la populationSur les 246 patients présentant un ADCI colorectal, 42 ont été exclus (ADCI non métastatique, métastase d'un ADCI dont l'origine était incertaine, composante neuroendocrine de haut grade). Au total, 204 patients de31 centres français ont été inclus [Annexe 3].
Il y avait une prédominance d’hommes (61% des patients), avec une proportion d’hommes moindre pour les tumeurs situées à droite (49% dans le colon droit versus 70% dans le colon gauche et le rectum). L'âge médian au diagnostic initial était de 62,3 ans. Au diagnostic métastatique, l'âge médian était de 62,9 ans, le PS 0-1 dans 74% des cas et les taux d'ACE et de CA 19.9 étaient augmentés respectivement dans 61% et 44%. L'aspect de linite était évocateur en endoscopie, écho-endoscopie ou imagerie dans 37% des cas.
Nous retrouvions 4% de patients porteurs d'une maladie inflammatoire chronique intestinale (3 cas de rectocolite hémorragique et 5 cas de maladie de Crohn), tous provenant de centres de la partie nord de la France. Trois patients présentaient un antécédent personnel ou familial de cancer lobulaire du sein ou d'ADCI gastrique.
3.1.2 Caractéristiques tumorales
Quarante-six pourcents des ADCI étaient localisés dans le colon droit, 25,5% dans le colon gauche et 29% dans le rectum [Figure 3]. Les ADCI étaient T4 dans 71,3% des cas et N+ dans 95%. Ils étaient peu différenciés dans 86% des cas. Les métastases siégeaient principalement au niveau péritonéal (69%), ganglionnaire (28%) et hépatique (23%). Le pourcentage de cellules indépendantes était disponible pour 87 patients. [Tableau 1].
25,5%
28,9%
Figure 3 : Répartition de la localisation des ADCI colorectaux au diagnostic. 45,6%
22 Tableau 1 : Caractéristiques de la population au diagnostic métastatique.
Variable Population (n=204) Groupe 1 (n=38) Groupe 2 (n=112) Groupe 3 (n=54) Age (années) 62,9 56,5 60,3 76,6 Sexe (n, %) Homme Femme 124 (60,8) 80 (39,2) 18 (47,4) 20 (52,6) 68 (60,7) 44 (39,3) 38 (70,4) 16 (29,6) OMS (n, %) 0-1 2 3-4 128 (74,4) 26 (15,1) 18 (10,5) 31 (96,9) 1 (3,1) 0 86 (81,9) 15 (14,3) 4 (3,8) 11 (31,4) 10 (28,6) 14 (40) ACE (ng/mL) 9,05 2 11,75 28,1 CA19.9 (UI/mL) 28,6 22,15 28,6 58,5 Aspect de linite (n, %) Oui Non 37 (37) 63 (63) - - -
Localisation tumeur primitive (n, %) Colon droit Colon gauche Rectum 93 (45,6) 52 (25,5) 59 (28,9) 20 (52,6) 11 (29) 7 (18,4) 45 (40,2) 28 (25) 39 (34,8) 28 (52) 13 (24) 13 (24) Sites métastatiques (n, %) ganglionnaire hépatique pulmonaire péritonéal osseux cérébral autre 57 (28,2) 47 (23,3) 27 (13,4) 139 (68,8) 18 (8,9) 3 (1,5) 24 (11,9) 8 (21,1) 6 (15,8) 1 (2,6) 30 (78,9) 0 0 4 (10,5) 37 (33) 31 (27,7) 17 (15,2) 72 (64,3) 13 (11,6) 1 (0,9) 13 (11,6) 12 (22,2) 10 (18,5) 9 (16,7) 37 (68,5) 5 (9,3) 2 (3,7) 7 (13) Statut T (n, %) Tx T1-T2 T3 T4 37 1 (0,6) 47 (28,1) 119 (71,3) 2 0 12 (33,3) 24 (66,7) 28 1 (1,2) 20 (23,8) 63 (75) 7 0 15 (31,9) 32 (68,1) Statut N (n, %) Nx N0 N1 N2 44 8 (5) 35 (21,9) 117 (73,1) 3 4 (11,4) 8 (22,9) 23 (65,7) 29 0 19 (22,9) 64 (77,1) 12 4 (9,5) 8 (19,1) 30 (71,4) Différenciation (n, %) moyenne peu 21 (14) 129 (86) 8 (25,8) 23 (74,2) 9 (11,2) 71 (88,8) 4 (10,3) 35 (89,7) Cellules indépendantes (n, %) <50% ≥50% 31 (35,6) 56 (64,4) 7 (30,4) 16 (69,6) 19 (40,4) 28 (59,6) 5 (29,4) 12 (70,6)
23
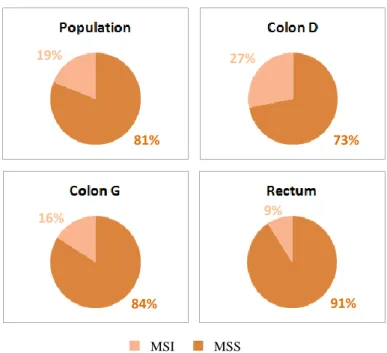
Les données moléculaires sont présentées dans les figures 4 et 5. Les données concernant le statut microsatellite, la mutation RAS et la mutation BRAF manquaient respectivement pour 96, 77 et 101 patients. On retrouvait 23% de mutation RAS, 9% de mutation BRAF et 19% d’instabilité microsatellite. Dans le colon droit, le colon gauche et le rectum, on retrouvait une mutation RAS dans 21%, 27% et 22% des cas ; une mutation BRAF dans 12%, 8% et 3% des cas, et une instabilité microsatellite dans 27%, 16% et 9% des cas. Les ADCI CCRm MSI étaient BRAF mutés dans 19 % des cas (3/16).
Figure 4 : Répartition des mutations des ADCI colorectaux métastatiques.
Figure 5 : Répartition du statut microsatellite des ADCI colorectaux métastatiques.
68% 67% 65% 75% 23% 27% 22% 9% 12% 8% 3%
Mutation KRAS/RAS Mutation BRAF Sauvage
MSS MSI 19% 27% 9% 16% 81% 73% 91% 84% 21%
24 3.1.3 Type de traitement effectué
Parmi les 204 patients de la cohorte, 38 ont bénéficié d’une prise en charge curative de leurs métastases (groupe 1, 19%), 112 d’une prise en charge par chimiothérapie exclusive (groupe 2, 55%) et 54 de soins de supports exclusifs (groupe 3, 26%). A noter, 34 % des patients de cette cohorte ont été opérés de leur primitif au stade localisé.
Dans le groupe 1, les patients avaient un bon état général, avec un PS 0-1 dans 97% des cas. La maladie métastatique était péritonéale pour 79%, ganglionnaire pour 21% et hépatique pour 16% des patients. Aucun n’avait de métastase osseuse ou cérébrale. L’ACE et le CA19.9 médians au diagnostic étaient de 2 ng/mL et 22 UI/mL. La moitié des patients avaient une chimiothérapie néoadjuvante (nombre médian de 6 cures), permettant 37% de réponse objectiveet une stabilité dans 58%, soit un taux de contrôle de 95%. Parmi eux, 66% ont bénéficié d’une CHIP. Une chimiothérapie adjuvante était réalisée dans 81% des cas (nombre médian de 8 cures).
Dans le groupe 2, les patients étaient PS 0-1 dans 82% des cas. On retrouvait des métastases péritonéales pour 64%, ganglionnaires pour 33% et hépatiques pour 28% des cas. Il y avait 11% de métastases osseuses. Seul un patient avait des lésions cérébrales. L’ACE et le CA19.9 médians étaient de 12 ng/mL et 29 UI/mL au diagnostic métastatique.
Les patients ont bénéficié d’une première ligne de chimiothérapie dans 100% des cas, la deuxième ligne était réalisée chez 50%, la troisième ligne chez 21% et la quatrième ligne chez 5% des patients. Les taux de réponse et de contrôle étaient respectivement de 13,2% et 50% en L1, de11% et 39% en L2,de 0% et 52,6% en L3.
En première ligne, il y avait 36% de patient recevant une chimiothérapie à base d’irinotecan, 47% à base d’oxaliplatine et 5% à base de ces deux molécules. Concernant les protocoles administrés, 49,6% ont eu une chimiothérapie cytotoxique exclusive et 50,4% ont reçu une association avec un anticorps : 43,6% d’antiEGFr (soit 22% du groupe 2) et 56,4 % d’antiVEGF (28,4% du groupe 2). Le taux de contrôle en L1 était de 63,6% pour les antiEGFr, de 44% pour les antiVEGF et de 45,5% pour les cytotoxiques seuls [Tableau 2].
Enfin, dans le groupe 3, les patients étaient PS 0-1 dans 31% des cas. On retrouvait des métastases péritonéales pour 69%, ganglionnaires pour 22%, hépatiques pour 19%, osseuses pour 9% et cérébrales pour 4% des cas.
25 Variables L1 L2 L3 L4 Nombre de patients (n) 110 57 22 6 Chimiothérapie à base (n, %) d'oxaliplatine d'irinotecan des 2 molécules autre 52 (47,3) 40 (36,4) 5 (4,5) 13 (11,8) 20 (35,1) 28 (49,1) 3 (5,3) 6 (10,5) 4 (18,2) 8 (36,3) 0 10 (45,5) 0 2 (33,3) 1 (16,7) 3 (50) Thérapie ciblée (n, %) aucune antiVEGF antiEGFr 54 (49,6) 31 (28,4) 24 (22) 28 (49,1) 18 (31,6) 11 (19,3) 4 (18,2) 7 (31,8) 11 (50) 2 (33,3) 4 (66,7) 0 Taux de réponse (n, %) Cytotoxique antiVEGF antiEGFr 12/91 (13,2) 7/44 (15,9) 2/25 (8) 3/22 (13,6) 5/44 (11) - - - 0/19 (0) - - - 0/4 (0) - - - Taux de contrôle (n, %) Cytotoxique antiVEGF antiEGFr 45/91 (50) 20/44 (45,5) 11/25 (44) 14/22 (63,6) 17/44 (39) - - - 10/19 (52,6) - - - 4/4 (100) - - - PFS (mois) 4,7 2,2 2,5 3,1
Tableau 2 : Chimiosensibilité des patients du groupe 2 selon les lignes de chimiothérapie.
3.2 Données de survie
Le suivi médian de la cohorte était de 6,2 ans. A la date de fin de l'étude, seulement 18,7% des patients étaient en vie. Seuls 4 patients étaient perdus de vue. La survie sans maladie métastatique évaluée sur les 53 patients opérés d'un ADCI localisé n’était que de 8,6 mois (intervalle de confiance à 95 % IC95%=[4.6;10.8]).
3.2.1 Survie globale
La médiane de survie globale de la cohorte était de 10,1 mois (IC95%=[7.9;12.8]) avec une survie à 1, 2 et 3 ans respectivement de 44%, 22% et 15% [Figure 3].
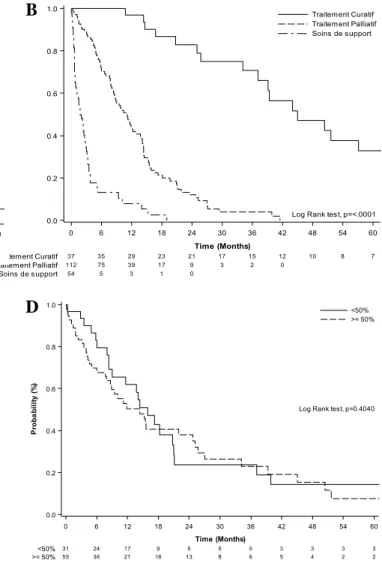
La médiane de survie globale des patients du groupe 1 était de 45,1 mois (IC95%=[34.2;67.1]). Le taux de survie à 1, 2 et 3 ans était respectivement de 97%, 83% et 71% [Figure 6A]. Celle des patients du groupe 2 était de 10,9 mois (IC95%=[8.6;13.8]), avec un taux de survie à 1, 2 et 3 ans de 43%, 12% et 4%. Pour le groupe 3, la médiane n’était que de 1,8 mois (IC95%=[0.9;2.8]), avec un taux de survie à 1 an de 7,9%. La survie globale était significativement différente entre les 3 groupes (p<0,0001) [Figure 6B].
26 93 55 36 22 18 14 12 10 8 6 5 51 31 17 9 8 3 3 2 2 2 2 59 29 18 10 4 3 2 0 ADCI Droit ADCI Gauche ADCI Rectum 0 6 12 18 24 30 36 42 48 54 60 Time (Months) 0.0 0.2 0.4 0.6 0.8 1.0 P ro b a b il it y (% )
Log Rank test, p=0.1325 ADCI Rectum ADCI Gauche ADCI Droit 31 24 17 9 5 5 5 3 3 3 3 55 36 21 16 13 8 6 5 4 2 2 <50% >= 50% 0 6 12 18 24 30 36 42 48 54 60 Time (Months) 0.0 0.2 0.4 0.6 0.8 1.0 P ro b a b il it y (% )
Log Rank test, p=0.4040 >= 50% <50% 21 17 14 12 10 7 6 6 5 4 4 4 3 86 76 66 59 54 45 40 38 27 22 20 16 15 MSS MSI 0 2 4 6 8 10 12 14 16 18 20 22 24 Time (Months) 0.0 0.2 0.4 0.6 0.8 1.0 P ro b a b il it y (% )
Log Rank test, p=0.8183
MSI MSS
Il n'y avait pas de différence de survie globale entre les ADCI coliques droits, gauches et rectaux (p=0,13) [Figure 6C] ; de même le pourcentage de cellules indépendantes (<50% vs ≥50%) n'avait pas d'influence sur la survie globale de la cohorte (p=0,4) [Figure 6D], ni sur celle du groupe 1 (p=0,28) et du groupe 2 (p=0,5). Il n'y avait pas non plus de différence de survie globale dans la cohorte selon le statut microsatellite (p=0,82) [Figure 6E].
37 35 29 23 21 17 15 12 10 8 7 112 75 39 17 9 3 2 0 54 5 3 1 0 Traitement Curatif Traitement Palliatif Soins de support 0 6 12 18 24 30 36 42 48 54 60 Time (Months) 0.0 0.2 0.4 0.6 0.8 1.0 P ro b a b il it y (% )
Log Rank test, p=<.0001 Soins de support Traitement Palliatif Traitement Curatif A a C a 203 115 71 41 30 20 17 12 10 8 7 At risk 0 6 12 18 24 30 36 42 48 54 60 Time (Months) 0.0 0.2 0.4 0.6 0.8 1.0 P ro b a b il it y (% ) A a B a D a
Figure 6 : (A) Courbes de survie globale de la cohorte (B) selon le type de traitement (C) selon la localisation (D) selon le pourcentage de cellules indépendantes (E) selon le statut microsatellite.
21 17 14 12 10 7 6 6 5 4 4 4 3 86 76 66 59 54 45 40 38 27 22 20 16 15 MSS MSI 0 2 4 6 8 10 12 14 16 18 20 22 24 Time (Months) 0.0 0.2 0.4 0.6 0.8 1.0 P ro b a b il it y (% )
Log Rank test, p=0.8183
MSI MSS 21 17 14 12 10 7 6 6 5 4 4 4 3 86 76 66 59 54 45 40 38 27 22 20 16 15 MSS MSI 0 2 4 6 8 10 12 14 16 18 20 22 24 Time (Months) 0.0 0.2 0.4 0.6 0.8 1.0 P ro b a b il it y (% )
Log Rank test, p=0.8183
MSI MSS
E a
27 54 45 31 24 16 10 7 5 3 2 0 53 38 23 15 9 3 3 1 0 anti-VEGF ou anti-EGFR cytotoxique seul 0 2 4 6 8 10 12 14 16 18 20 22 24 Time (Months) 0.0 0.2 0.4 0.6 0.8 1.0 P ro b a b il it y (% )
Log Rank test, p=0.0156 cytotoxique seul anti-VEGF ou anti-EGFR
3.2.2 Survie sans progression selon le type de traitement
Dans le groupe 1, la survie sans progression après la fin du programme de traitement curatif des métastases était de 14 mois (IC95%=[6.5;20.9]). A la date des dernières nouvelles, 22 patients (59%) ont présenté une récidive métastatique.
Dans le groupe 2, la survie sans progressionétait de 4,7 mois en L1 (IC95%=[3.6;5.9]), de 2,2 mois en L2 (IC95%=[1.7;2.7]), de 2,5 mois en L3 (IC95%=[1.2;5.0]), et de 3,1 mois en L4 (IC95%=[0.9;11.1]). Quatre patients ont été exclus de l'analyse car ils n'avaient pas débuté leur traitement de 1ère ligne au moment du recueil des données.
La survie sans progression lors d’une première ligne comprenant un antiEGFr était de 6,2 mois, contre 5,1 mois avec un antiVEGF et 3,9 mois avec une chimiothérapie cytotoxique seule. L'utilisation d'un traitement par antiEGFr ou antiVEGF était significativement supérieure à l'utilisation d'une chimiothérapie cytotoxique seule avec une médiane de survie sans progression en L1 de 5 mois versus 3,9 mois (p=0,016) [Figure 7]. Il n'y avait pas de différence entre l'utilisation d'un antiEGFr ou d'un antiVEGF (p=0,8) en terme de survie sans progression en L1, que ce soit à droite (p=0,275) ou à gauche (p=0,265).
28
4. DISCUSSION
A notre connaissance, nous rapportons ici la plus grande cohorte étudiant la prise en charge et les données de survie des ADCI colorectaux métastatiques à la lumière des données cliniques et moléculaires actuelles. Notamment, la chimiosensibilité de ces cancers en situation métastatique n’est pas connue.
Les ADCI colorectaux métastatiques présentent des caractéristiques différentes des adénocarcinomes lieberkühniens traditionnels. Alors que ces derniers sont localisés dans 30-40% au colon proximal, 35-30-40% au colon distal et 20-25% au rectum (12,37), les ADCI CCRm sont plus souvent situés dans le colon proximal (46%) et dans le rectum (29%) avec seulement 25% au colon gauche. On retrouve la prédominante colique droite dans la série de Hugen et al. (12), la localisation rectale étant à l’inverse plus fréquente dans notre cohorte. Alors que l’âge et l’état général au diagnostic sont classiques, les ADCI sont majoritairement porteurs de facteurs d’agressivité : tumeurs de stade T4 et peu différenciées, dissémination métastatique péritonéale prédominante (69% contre 13 à 20% en cas d'ADK) (38,39).
Par ailleurs, l’instabilité microsatellite, de mauvais pronostic en situation métastatique (30) et habituellement retrouvée chez 3,5 à 5% des ADK métastatiques (13,24–26), est retrouvée chez 19% des patients de notre série. Ce chiffre est supérieur aux 14% de Korphaisarn et al. (13) et cela suggère qu'il faille rechercher le statut microsatellite dans les ADCI CCRm compte tenu des perspectives prometteuses de l'immunothérapie dans les tumeurs MSI. La valeur pronostique défavorable de la localisation colique droite et du statut MSI sont maintenant bien établies (30,40,41), nous ne retrouvons pas dans cette cohorte de différence de survie globale, entre les ADCI CCRm proximaux et distaux, ainsi qu’entre les tumeurs MSS et MSI (p=0,82). Cela suggère l'implication d'autres facteurs intervenant dans leur mauvais pronostic. Le pourcentage de mutation BRAF était de 9% (contre 7 à 11% des ADK (42,43)). Au vu du nombre important d’ADCI coliques droits et d’ADCI MSI, ce pourcentage semble bas. Alors qu’environ 35% des ADK MSI sont mutés BRAF (30), seuls 18,8% des ADCI MSI de notre série sont mutés BRAF. Enfin, bien que beaucoup de patients n'aient eu qu’une recherche de mutation KRAS exon 2 (le statut RAS complet n’étant réalisé en routine qu'à partir de 2013), la fréquence de mutation de l’oncogène KRAS n’était que de 23%, contre 35-40% de mutation KRAS exon 2 (44) et 50 à 58% de mutation RAS pour les ADK dans les études SPECTAcolor et RASANC (42,45), concordant avec les résultats de
29
Korphaisarn et al. (13). Ces données suggèrent de vraies différences moléculaires qui pourraient être le reflet d'une carcinogénèse différente.
Sur le plan thérapeutique, les ADCI sont des tumeurs chimiorésistantes. En première ligne, le taux de contrôle est de 50%. Le taux de réponse objective n’est que de 13,2%, alors qu’il est de l’ordre de 60-70% avec une bichimiothérapie + antiEGFr (41,46) et de l’ordre de 50-55% avec une bichimiothérapie + antiVEGF (41,47). Nous avons cependant mis en évidence un bénéfice à l'utilisation en première ligne d'une chimiothérapie associée à un antiEGFr ou un antiVEGF par rapport à l'utilisation d'une chimiothérapie cytotoxique seule (p=0,016). Le gain de 1,1 mois était cependant minime, et nécessiterait l’étude d’autres options thérapeutiques telles qu’une trichimiothérapie + biothérapie ou une chimiothérapie + immunothérapie type antiPD1/PDL1 ou antiCTLA4 au vu des 19 % de tumeurs MSI. Les effectifs de réponse selon le protocole de chimiothérapie étant petits, il n'est pas possible de tirer de conclusion sur le protocole de chimiothérapie le plus efficace. Enfin, il n'a pas été constaté de différence entre les antiEGFr et les antiVEGF, que ce soit à droite ou à gauche.
Ces critères histologiques, moléculaires et de chimiorésistance se traduisent par un pronostic sombre : dans notre cohorte, la survie sans maladie après chirurgie d’un ADCI non métastatique n’est que de 8,6 mois. Au stade métastatique, la médiane de survie globale de la cohorte de 10,1 mois est extrêmement basse. Après une 1ère ligne de chimiothérapie, les médianes de survie globale et de survie sans progression ne sont que de 10,9 mois et 4,7 mois contre environ 25 à 35 mois et 10 à 12 mois respectivement dans les essais publiés incluant une bichimiothérapie + biothérapie (46–48). Ces données sont assez proches de la série de Korphaisarn et al. (13) avec une médiane de survie globale d’environ 16 mois.
Seul résultat positif, les 38 patients du groupe 1 ayant été opéré curativement de leurs métastases ont un meilleur pronostic, avec une médiane de survie globale de 45,1 mois et un taux de survie à 3 ans de 71%. Ces résultats sont cependant inférieurs aux presque 65 mois des patients opérés R0 après une 1ère ligne comprenant une bichimiothérapie + biothérapie de l’étude américaine CALGB80405 (41).
Cette étude confirme les données précédemment publiées sur l’épidémiologie et le pronostic de ces tumeurs rares et apporte des données de chimiosensibilité, jusqu’alors jamais étudiées sur une large cohorte. Les faiblesses sont celles d’une étude rétrospective descriptive : étalement sur un peu plus de 15 ans, données manquantes (notamment statut
30
microsatellite, analyse mutationnelle incomplète du statut RAS, et des autres mutations comme PIK3CA, FBWX7, APC, TP53, KIT, etc…) et effectifs des groupes de chimiothérapie ne permettant pas d’étudier correctement le bénéfice des antiVEGF et antiEGFr à droite et à gauche. Par ailleurs, une cohorte d'appariement permettant de comparer les caractéristiques des ADCI CCRm et des adénocarcinomes lieberkühniens serait souhaitable.
31
5. CONCLUSION
Les ADCI CCRm sont des cancers à développement locorégional aboutissant à une dissémination péritonéale majoritaire, avec des caractéristiques cliniques et moléculaires différentes des ADK lieberkühniens (localisation colique droite prédominante, mutation KRAS moins fréquente, statut microsatellite instable plus fréquent et mutation BRAF anormalement normale au vu de la proportion de colons droits et de MSI), leur conférant une chimiorésistance importante et un pronostic environ 3 fois inférieur, de l’ordre de l’année. Le statut microsatellite devrait être recherché compte tenu des perspectives prometteuses de l'immunothérapie dans les tumeurs MSI.
32
6. ANNEXES
Annexe 1 : Classification TNM et par stade des adénocarcinomes colorectaux.
Classification TNM.
Tumeur
Tx Renseignements insuffisants pour classer la tumeur primitive Tis Carcinome in situ : intra-épithéliale ou intra-muqueuse T1 Tumeur envahissant la sous-muqueuse
T2 Tumeur envahissant la musculeuse T3 Tumeur envahissant la sous-séreuse
T4 T4a : tumeur envahissant le péritoine viscéral T4b : tumeur envahissant un organe de voisinage
Ganglion
Nx Renseignements insuffisants pour classer les adénopathies régionales N0 Pas de métastase ganglionnaire
N1 N1a : 1 ganglion envahi N1b : 2-3 ganglions envahis
N1c : dépôts tumoraux "satellites" dans la sous-séreuse, ou dans le tissu péri-colique ou péri-rectal non péritonisé, sans tissu ganglionnaire identifié
N2 N2a : 4-6 ganglions envahis N2b : >7 ganglions envahis
Métastases
Mx Renseignement insuffisant pour classer les métastases à distance M0 Pas de métastase
M1 M1a : métastases à distance confinées à un organe
M1b : métastases atteignant plus d'un site métastatique ou atteinte du péritoine
Classification par stade selon la classification TNM.
Stade 0 pTis N0 M0 I pT1-T2 N0 M0 II IIA : pT3 N0 M0 IIB : pT4a N0 M0 IIC : pT4b N0 M0
III IIIA : pT1-T2 N1/N1c M0 et pT1 N2a M0
IIIB : pT3-T4a N1/N1c M0, pT2-T3 N2a M0, pT1-T2 N2b M0 IIIC : pT4a N2a M0, pT3-T4a N2b M0, pT4b N1-N2 M0 IV IVA : tout T, tout N, M1a
33 Annexe 2 : Fréquence de la localisation tumorale et des caractéristiques biomoléculaires selon le pourcentage de cellules indépendantes dans l’étude de Korphaisarn et al. (13).
Colon droit Colon gauche Rectum Mutation KRAS Mutation BRAF MSI ADCI avec ≥ 50 % de cellules indépendantes (n=30) 75,9% 17,2% 6,9% 13,3% 10% 14,3 % ADCI avec < 50% de cellules indépendantes (n=63) 50,8% 34,9% 17,2% 25,4% 20,6% 6,4% Adénocarcinomes lieberkühniens (n=572) 33,3% 43,6% 23,1% 49,7% 7,7% 4,9%
Annexe 3 : Centres inclueurs français.
Ville Nombre de cas
Amiens CHU 21
Angers CHU 6
Besançon CHU 15
Bichat Claude-Bernard CHU 2
Bourgoin-Jallieu CHU 3
Brest CHU 2
Caen CHU 6
CH Bretagne Atlantique 3
CH Bretagne Sud 1
CH Edouard Herriot (Lyon) 4
CH Jean-Mermoz (Lyon) 4
CH Léon Berard (Lyon) 7
CH Meaux 3
CH Sud Francilien 7
Cochin CHU 2
Créteil / Henri Mondor CHU 9
Curie / Ambroise Paré CHU 7
Gustave Roussy 18 HEGP 9 Lille CHU 11 Limoges CHU 7 Nantes CHU 2 Orléans CHU 5
Pitié Salpêtrière CHU 3
Poitiers CHU 6
Reims CHU 6
Rouen CHU 11
Saint Louis CHU 5
Strasbourg CHU 8
Toulouse CHU 6
Tours CHU 5
34
7. REFERENCES BIBLIOGRAPHIQUES
1. Nitsche U, Zimmermann A, Späth C, Müller T, Maak M, Schuster T, et al. Mucinous and signet-ring cell colorectal cancers differ from classical adenocarcinomas in tumor biology and prognosis. Ann Surg. 2013 Nov;258(5):775–82.
2. Chew M-H, Yeo S-AE, Ng Z-P, Lim K-H, Koh P-K, Ng K-H, et al. Critical analysis of mucin and signet ring cell as prognostic factors in an Asian population of 2,764 sporadic colorectal cancers. Int J Colorectal Dis. 2010 Oct;25(10):1221–9.
3. Bosman et al., 2010 F. WHO classification of tumors of the digestive system. ed 4 Geneva, World Health Organisation, International Agency for Research on cancer 2010. 4. Li Z, Zhang Z, Dong X, Gao D, Zhang D. Comparison of CT manifestations of primary colorectal mucinous adenocarcinoma and signet ring cell carcinoma. Zhonghua Wei Chang Wai Ke Za Zhi Chin J Gastrointest Surg. 2017 Mar 25;20(3):315–9.
5. Jung K, Park MI, Kim SE, Park SJ. Borrmann Type 4 Advanced Gastric Cancer: Focus on the Development of Scirrhous Gastric Cancer. Clin Endosc. 2016 Jul;49(4):336–45. 6. Voron T, Messager M, Duhamel A, Lefevre J, Mabrut J-Y, Goere D, et al. Is signet-ring
cell carcinoma a specific entity among gastric cancers? Gastric Cancer Off J Int Gastric Cancer Assoc Jpn Gastric Cancer Assoc. 2016 Oct;19(4):1027–40.
7. Piessen G, Messager M, Leteurtre E, Jean-Pierre T, Mariette C. Signet ring cell histology is an independent predictor of poor prognosis in gastric adenocarcinoma regardless of tumoral clinical presentation. Ann Surg. 2009 Dec;250(6):878–87.
8. Messager M, Lefevre JH, Pichot-Delahaye V, Souadka A, Piessen G, Mariette C, et al. The impact of perioperative chemotherapy on survival in patients with gastric signet ring cell adenocarcinoma: a multicenter comparative study. Ann Surg. 2011 Nov;254(5):684– 93.
9. Pernot S, Voron T, Perkins G, Lagorce-Pages C, Berger A, Taieb J. Signet-ring cell carcinoma of the stomach: Impact on prognosis and specific therapeutic challenge. World J Gastroenterol. 2015 Oct 28;21(40):11428–38.
10. Charalampakis N, Nogueras-Gonzalez GM, Elimova E, Wadhwa R, Shiozaki H, Shimodaira Y, et al. Signet ring cell (SRC) histology of localized gastric adenocarcinoma (LGAC) to predict response to preoperative chemoradiation. J Clin Oncol. 2015 May 20;33(15_suppl):4067–4067.
11. Hyngstrom JR, Hu C-Y, Xing Y, You YN, Feig BW, Skibber JM, et al. Clinicopathology and outcomes for mucinous and signet ring colorectal adenocarcinoma: analysis from the National Cancer Data Base. Ann Surg Oncol. 2012 Sep;19(9):2814–21.
35
12. Hugen N, Verhoeven RH, Lemmens VE, van Aart CJ, Elferink MA, Radema SA, et al. Colorectal signet-ring cell carcinoma: benefit from adjuvant chemotherapy but a poor prognostic factor. Int J Cancer. 2015 Jan 15;136(2):333–9.
13. Korphaisarn K. Signet ring cell colorectal cancer : genomic insights into a rare
subpopulation of colorectal adenocarcinoma. ASCO GI, 2017,
doi:101200/jco2017354_suppl606.
14. Hugen N, van de Velde CJH, de Wilt JHW, Nagtegaal ID. Metastatic pattern in colorectal cancer is strongly influenced by histological subtype. Ann Oncol. 2014 Mar;25(3):651–7.
15. Chen J-S, Hsieh P-S, Hung S-Y, Tang R, Tsai W-S, Changchien C-R, et al. Clinical significance of signet ring cell rectal carcinoma. Int J Colorectal Dis. 2004 Mar;19(2):102–7.
16. van Oudheusden TR, Braam HJ, Nienhuijs SW, Wiezer MJ, van Ramshorst B, Luyer P, et al. Poor outcome after cytoreductive surgery and HIPEC for colorectal peritoneal carcinomatosis with signet ring cell histology. J Surg Oncol. 2015 Feb;111(2):237–42. 17. Lee W-S, Chun H-K, Lee WY, Yun SH, Cho YB, Yun H-R, et al. Treatment outcomes
in patients with signet ring cell carcinoma of the colorectum. Am J Surg. 2007 Sep;194(3):294–8.
18. Thota R, Fang X, Subbiah S. Clinicopathological features and survival outcomes of primary signet ring cell and mucinous adenocarcinoma of colon: retrospective analysis of VACCR database. J Gastrointest Oncol. 2014 Feb;5(1):18–24.
19. Tan Y, Fu J, Li X, Yang J, Jiang M, Ding K, et al. A minor (<50%) signet-ring cell component associated with poor prognosis in colorectal cancer patients: a 26-year retrospective study in China. PloS One. 2015;10(3):e0121944.
20. Inamura K, Yamauchi M, Nishihara R, Kim SA, Mima K, Sukawa Y, et al. Prognostic significance and molecular features of signet-ring cell and mucinous components in colorectal carcinoma. Ann Surg Oncol. 2015 Apr;22(4):1226–35.
21. Ogino S, Brahmandam M, Cantor M, Namgyal C, Kawasaki T, Kirkner G, et al. Distinct molecular features of colorectal carcinoma with signet ring cell component and colorectal carcinoma with mucinous component. Mod Pathol. 2006 Jan;19(1):59–68. 22. Kakar S, Deng G, Smyrk TC, Cun L, Sahai V, Kim YS. Loss of heterozygosity, aberrant
methylation, BRAF mutation and KRAS mutation in colorectal signet ring cell carcinoma. Mod Pathol. 2012 Jul;25(7):1040–7.
23. Wistuba II, Behrens C, Albores-Saavedra J, Delgado R, Lopez F, Gazdar AF. Distinct K-ras mutation pattern characterizes signet ring cell colorectal carcinoma. Clin Cancer Res. 2003 Sep 1;9(10 Pt 1):3615–9.
24. Venderbosch S, Nagtegaal ID, Maughan TS, Smith CG, Cheadle JP, Fisher D, et al. Mismatch repair status and BRAF mutation status in metastatic colorectal cancer
36
patients: a pooled analysis of the CAIRO, CAIRO2, COIN, and FOCUS studies. Clin Cancer Res. 2014 Oct 15;20(20):5322–30.
25. Smith CG, Fisher D, Claes B, Maughan TS, Idziaszczyk S, Peuteman G, et al. Somatic profiling of the epidermal growth factor receptor pathway in tumors from patients with advanced colorectal cancer treated with chemotherapy ± cetuximab. Clin Cancer Res. 2013 Aug 1;19(15):4104–13.
26. Koopman M, Kortman G a. M, Mekenkamp L, Ligtenberg MJL, Hoogerbrugge N, Antonini NF, et al. Deficient mismatch repair system in patients with sporadic advanced colorectal cancer. Br J Cancer. 2009 Jan 27;100(2):266–73.
27. Hartman DJ, Nikiforova MN, Chang DT, Chu E, Bahary N, Brand RE, et al. Signet ring cell colorectal carcinoma: a distinct subset of mucin-poor microsatellite-stable signet ring cell carcinoma associated with dismal prognosis. Am J Surg Pathol. 2013 Jul;37(7):969–77.
28. Kakar S, Smyrk TC. Signet ring cell carcinoma of the colorectum: correlations between microsatellite instability, clinicopathologic features and survival. Mod Pathol. 2005 Feb;18(2):244–9.
29. Kim IY. Impact of Microsatellite Instability in Signet-Ring Cell and Mucinous Components in Patients With Colorectal Carcinoma. Ann Coloproctology. 2016 Apr;32(2):45–6.
30. Tougeron D, Cohen R, Sueur B, Sefrioui D, Gentilhomme L, Lecomte D et al. A large retrospective multicenter study evaluating prognosis and chemosensitivity of metastatic colorectal cancer with microsatellite instability. ESMO 2017, Madrid, Abstr#533P. 31. Shibata J, Kawai K, Nishikawa T, Tanaka T, Tanaka J, Kiyomatsu T, et al. Prognostic
Impact of Histologic Type in Curatively Resected Stage IV Colorectal Cancer: A Japanese Multicenter Retrospective Study. Ann Surg Oncol. 2015 Dec;22 Suppl 3:S621-629.
32. Anthony T, George R, Rodriguez-Bigas M, Petrelli NJ. Primary signet-ring cell carcinoma of the colon and rectum. Ann Surg Oncol. 1996 Jul;3(4):344–8.
33. Song W, Wu S, He Y, Cai S, Zhang C, Zhang X, et al. Clinicopathologic features and survival of patients with colorectal mucinous, signet-ring cell or non-mucinous adenocarcinoma: experience at an institution in southern China. Chin Med J (Engl). 2009 Jul 5;122(13):1486–91.
34. Lee H-S, Soh JS, Lee S, Bae JH, Kim K-J, Ye BD, et al. Clinical Features and Prognosis of Resectable Primary Colorectal Signet-Ring Cell Carcinoma. Intest Res. 2015 Oct;13(4):332–8.
35. Fu J, Wu L, Jiang M, Tan Y, Li D, Chen F, et al. Signet ring cell carcinoma of resectable metastatic colorectal cancer has rare surgical value. J Surg Oncol. 2016 Dec;114(8):1004–8.
37
36. Chua TC, Pelz JOW, Kerscher A, Morris DL, Esquivel J. Critical analysis of 33 patients with peritoneal carcinomatosis secondary to colorectal and appendiceal signet ring cell carcinoma. Ann Surg Oncol. 2009 Oct;16(10):2765–70.
37. Qiu M, Hu J, Yang D, Cosgrove DP, Xu R. Pattern of distant metastases in colorectal cancer: a SEER based study. Oncotarget. 2015 Nov 17;6(36):38658–66.
38. Franko J, Shi Q, Meyers JP, Maughan TS, Adams RA, Seymour MT, et al. Prognosis of patients with peritoneal metastatic colorectal cancer given systemic therapy: an analysis of individual patient data from prospective randomised trials from the Analysis and Research in Cancers of the Digestive System (ARCAD) database. Lancet Oncol. 2016 Dec;17(12):1709–19.
39. van Oudheusden TR, Razenberg LG, van Gestel YR, Creemers GJ, Lemmens VE, de Hingh IH. Systemic treatment of patients with metachronous peritoneal carcinomatosis of colorectal origin. Sci Rep. 2015 Dec 21;5.
40. Lenz HJ et al. Independent radiological evaluation of objective response, early tumor shrinkage, and depth of response in FIRE-3 in the final RAS evaluable population. ESMO 2014, Madrid, LBA11.
41. Venook AP, Niedzwiecki D, Lenz H-J, Innocenti F, Fruth B, Meyerhardt JA, et al. Effect of First-Line Chemotherapy Combined With Cetuximab or Bevacizumab on Overall Survival in Patients With KRAS Wild-Type Advanced or Metastatic Colorectal Cancer: A Randomized Clinical Trial. JAMA. 2017 20;317(23):2392–401.
42. Folprecht G, Beer P, Salazar R, Roth A, Aust D, Salgado R, et al. Frequency of potentially actionable genetic alterations in EORTC SPECTAcolor. ESMO 2016 Cph Abstr458O.
43. Bokemeyer C, Van Cutsem E, Rougier P, Ciardiello F, Heeger S, Schlichting M, et al. Addition of cetuximab to chemotherapy as first-line treatment for KRAS wild-type metastatic colorectal cancer: pooled analysis of the CRYSTAL and OPUS randomised clinical trials. Eur J Cancer. 2012 Jul;48(10):1466–75.
44. Modest DP, Ricard I, Heinemann V, Hegewisch-Becker S, Schmiegel W, Porschen R, et al. Outcome according to KRAS-, NRAS- and BRAF-mutation as well as KRAS mutation variants: pooled analysis of five randomized trials in metastatic colorectal cancer by the AIO colorectal cancer study group. Ann Oncol. 2016 Sep;27(9):1746–53. 45. Bachet JB, Bouche O, Taïeb J, Dubreuil O, Garcia ML, Meurisse A et al. RAS mutations
concordance in circulating tumor DNA (ctDNA) and tissue in metastatic colorectal cancer (mCRC): RASANC, an AGEO prospective multicenter study. Journal of Clinical Oncology: Vol 35, No 15_suppl.
46. Heinemann V, von Weikersthal LF, Decker T, Kiani A, Vehling-Kaiser U, Al-Batran S-E, et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol. 2014 Sep;15(10):1065–75.
38
47. Loupakis F, Cremolini C, Masi G, Lonardi S, Zagonel V, Salvatore L, et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med. 2014 Oct 23;371(17):1609–18.
48. Van Cutsem E, Lenz H-J, Köhne C-H, Heinemann V, Tejpar S, Melezínek I, et al. Fluorouracil, leucovorin, and irinotecan plus cetuximab treatment and RAS mutations in colorectal cancer. J Clin Oncol. 2015 Mar 1;33(7):692–700.
39
RESUME
Introduction : Les adénocarcinomes à cellules indépendantes colorectaux métastatiques (ADCI CCRm) sont
rares et mal connus. L'efficacité de la chimiothérapie n'a jamais été étudiée en situation métastatique. L'objectif était d'analyser leur chimiosensibilité, leurs caractéristiques cliniques, moléculaires et pronostiques.
Patients et méthode : Les patients avec un ADCI CCRm inclus rétrospectivement de 2003 à 2017 dans 31
centres français ont été séparés en 3 groupes : prise en charge curative des métastases (groupe 1), chimiothérapie palliative (groupe 2) et soins de supports exclusifs (groupe 3).
Résultats : Les 204 patients inclus avaient un âge médian de 63 ans. Les tumeurs étaient plus souvent coliques
proximales (46%) et rectales (29%), T4 (71%) et peu différenciées (86%). Les sites métastatiques étaient préférentiellement péritonéal (69%), ganglionnaire (28%) et hépatique (23%). Il y avait 19% d'instabilité microsatellite (MSI) et 9% de mutation BRAF, plus souvent à droite. Il y avait 23% de mutation RAS. La
médiane de survie globale (SG) était de 10,1 mois (IC95%=[7.9;12.8]). La médiane de SG pour les groupes 1
(n=38), 2 (n=112) et 3 (n=54) était de 45,1 mois, 10,9 mois et 1,8 mois respectivement. La localisation colique droite/gauche/rectum, le pourcentage de cellules indépendantes et le statut microsatellite n'avaient pas d'influence sur la survie globale (p=0,13 ; p=0,40 et p=0,82). Dans le groupe 2, 28,4% ont eu un antiVEGF et
22% un antiEGFr en 1ère ligne (L1). Les taux de réponse et de contrôle en L1 étaient de 13,2% et 50%, la survie
sans progression (SSP) était de 5 mois avec une biothérapie et de 3,9 mois avec une chimiothérapie cytotoxique seule (p=0,016). Il n'y avait pas de différence de SSP entre les antiVEGF et les antiEGFr (p=0,8) en L1, que ce soit à droite (p=0,275) ou à gauche (p=0,265).
Conclusion : Les ADCI CCRm sont de mauvais pronostic avec une localisation tumorale et des altérations
moléculaires spécifiques, leur conférant une chimiosensibilité médiocre. Le statut microsatellite devrait être recherché, compte tenu des perspectives prometteuses de l’immunothérapie dans les tumeurs MSI.
Mots clés : adénocarcinome à cellules indépendantes - colorectal - métastatique - moléculaire
Metastatic colorectal signet-ring cell carcinoma : clinical, histological and molecular description from a multicentric french cohort
ABSTRACT
Background : Metastatic colorectal signet ring cell carcinoma (mSRCRC) is a rare entity and data are limited.
Chemosensitivity for metastatic disease has never been assessed. This study analyzes their chemosensitivity and investigates their clinicopathological, molecular and prognostic characteristics.
Patients and methods : This nationwide retrospective study included patients with mSRCC from 2003 to 2017,
divided into three groups : curative care (group 1), palliative chemotherapy (group 2) and best supportive care (group 3).
Results : Data on 204 patients were collected. Median age was 63 years. Tumors were more frequent in
proximal colon (46%) and rectum (29%), were T4 (71%) and poorly differenciated (86%). Sites for metastases were mainly peritoneum (69%), lymph nodes (28%) and liver (23%). Microsatellite instability (MSI) and BRAF
mutation were found in 19% and 9% of patients, and were mainly rightsided. RAS mutation was found in 23%.
Median overall survival (mOS) was 10,1 months (95%CI=[7.9;12.8]). mOS for group 1 (n=38), group 2 (n=112)
and group 3 (n=54) were 45,1 months, 10,9 months and 1,8 months respectively. No difference in mOS was
found between tumor location, signet ring cell's percentage and microsatellite status (p=0,13 ; p=0,40 and
p=0,82). In group 2, first-line treatment (1L) was antiVEGF-based in 28,4% and antiEGFr-based in 22% of cases. Response and control rates were 13,2% and 50% respectively in 1L, progression-free survival (PFS) was 5 months with biotherapy and 3,9 months with cytotoxics alone (p=0,016). There was no difference in PFS
between antiVEGF and antiEGFr (p=0,8), and betweenright-sided (p=0,275) and left-sided (p=0,265) tumors.
Conclusion : mSRCRC have poor prognosis, specific location and molecular alterations which provides low
chemosensitivity. Microsatellite analysis should be done regardingpromising results of immunotherapy in
MSI-high tumors.
Adénocarcinome à cellules indépendantes colorectal métastatique : description clinique, histologique et moléculaire à partir d'une cohorte multicentrique française