Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR de médecine et de pharmacie
Laboratoire Inflammation, tissus épithéliaux et cytokines - LITEC (Poitiers) (Diplôme National - Arrêté du 25 mai 2016)
École doctorale : Biologie-santé - Bio-santé (Limoges)
Secteur de recherche : Aspects moléculaires et cellulaires de la biologie
Présentée par : Mathilde Pohin
Rôle de l'oncostatine M et des interleukines 6 et 31 dans l'inflammation cutanée chez la souris
Directeur(s) de Thèse : Franck Morel
Soutenue le 17 janvier 2017 devant le jury Jury :
Président Frédéric Caux Professeur des Universités, HP, Université de Paris 13 Rapporteur Julien Seneschal Professeur des Universités, HP, Université de Bordeaux 2 Rapporteur Michel Simon Directeur de recherche CNRS, Université de Toulouse Membre Franck Morel Professeur des Universités, Université de Poitiers Membre Jean-Claude Lecron Professeur des Universités, HP, Université de Poitiers Membre Jean-François Jégou Maître de conférences, Université de Poitiers
Pour citer cette thèse :
Mathilde Pohin. Rôle de l'oncostatine M et des interleukines 6 et 31 dans l'inflammation cutanée chez la souris [En ligne]. Thèse Aspects moléculaires et cellulaires de la biologie. Poitiers : Université de Poitiers, 2017. Disponible sur Internet <http://theses.univ-poitiers.fr>
THESE
Pou l o te tio du G ade de DOCTEU‘ DE L UNIVE‘“ITE DE POITIE‘“
(Faculté Médecine et Pharmacie) (Diplôme National - Arrêté du 25 mai 2016) Ecole Doctorale : BioSanté N°524
Secteur de Recherche : Aspects Moléculaires et cellulaires de la biologie Présentée par :
Mathilde POHIN
************************‘ôle de l o ostati e M et des i te leuki es et 1 dans
l i fla
atio uta e hez la sou is
************************
Directeurs de Thèse : Pr. Franck MOREL et Dr. Jean-François JEGOU ************************
Soutenue le 17 janvier 2017 de a t la Co issio d E a e
************************
JURY
Rapporteurs : Pr. SENESCHAL Julien PU-PH INSERM, Bordeaux Dr. SIMON Michel DR1 CNRS, INSERM, Toulouse Examinateurs: Pr. CAUX Frédéric PU-PH INSERM, Paris 13
Dr. JEGOU Jean-François MCU, Poitiers Pr. MOREL Franck PU, Poitiers Pr. LECRON Jean-Claude PU-PH, Poitiers
Remerciements:
J ad esse es p e ie s e e ie e ts au P . Julie “ es hal et au D . Mi hel “i o pou a oi a ept d t e appo teu s de th se et de e fai e l ho eu de juge e t a ail. Veuillez t ou e i i, l e p essio de a g atitude et de o plus p ofo d espect.
Je e e ie gale e t le P . F d i Cau pou l aluatio de e t a ail. Veuillez t ou e i i, l e p essio de a g atitude et de o plus p ofo d espe t.
Je remercie chaleureusement mes deux directeurs de thèse, Franck Morel et Jean-François Jégou. Merci pour la qualité de votre encadrement, la transmission de vos connaissances et pour les nombreuses opportunités professionnelles : l e seig e e t, les o g s et les collaborations aux différents projets du laboratoire. Franck, merci pour votre disponibilité, pour nos échanges scientifiques et pour avoir fait progresser ma rigueur scientifique, qualité essentielle au métier de chercheur. Jean-F a çois, e i de a oi fo e durant mon stage de master, pour ta disponibilité, ton soutien et la confia e ue tu as a o d e tout au lo g de ette th se. E fi e i pou to aide p ieuse da s l itu e de e a us it.
Je remercie le Pr. Jean-Claude Le o pou a oi a ueillie au LITEC. Merci pour vos conseils, votre gentillesse et votre bienveillance qui font la richesse et la particularité de ce laboratoire.
Je remercie vivement le Pr. Carolina Veaute pour son aide, ses conseils et pour sa participation à mon projet de thèse au cours de son séjour en France.
Je remercie le Dr. François-Xavier Bernard pour son implication dans le projet de mise au point des épidermes reconstruits murins et pour avoir mis à disposition son équipement et son savoir-faire dans la réalisation de ce projet. Je remercie aussi tout particulièrement Christine Barrault et Julien Garnier pour leur accueil chaleureux à BIOalternatives, pour leurs savoir-faire et leurs disponibilités.
Je e e ie i e e t tous les e es du LITEC pou a oi pe ise de venir chaque jour au laboratoire avec la même joie, envie et énergie grâce à leurs convivialités et leurs dispo i ilit s. Ga dez et tat d esp it si p ieu da s u e uipe de t a ail. Je e e ie tout particulièrement Laure, Martine, Isabelle, Adriana et Sandrine pour leurs conseils et
leu s aides, Ma ti e Ga ia pou avoir libérée de e tai es ha ges d e seig e e ts au ou s de l itu e de e a us it.
Je remercie également mes collègues de bureau et les doctorants du LITEC Eric, Magalie, Aina, Philippe, Vincent, Marie, Arthur et José pour les moments joyeux passés ensemble. Ai a, e i de a oi fo e au cours de mon stage de L3, merci pour toutes nos dis ussio s s ie tifi ues et a i ales, j ai u e pe s e pou toi à ha ue fois ue j a ti ipe et p pa e o e te e t u e e p ie e. Philippe e i d a oi appo t ton regard médical à os dis ussio s s ie tifi ues toujou s f u tueuses, pou a oi fait pa ti ipe à to p ojet de thèse et pour avoir été un excellent colocataire de bureau. Merci à Elodie pour ta ge tillesse et ta dispo i ilit , e i d a oi appo t ta vision clinique à nos échanges scientifiques. Merci à Marie pour nos discussions et pour ton aide durant la rédaction de ce manuscrit, je te souhaite de réaliser une excellente thèse.
Je remercie aussi Jean-Ma Be jeaud pou a oi o ie t e vers la faculté de biologie et la a i e de s ie tifi ue. “a s toi j au ais p o a le e t hoisi la fa ult de de i e pa défaut.
Je e e ie les do to a ts et e es d aut es u it s H l e, Elodie P, Elodie M, E ilie, Audrey, Madga, Adélie et tout particulièrement Julie, Sandie, Audrey et Obélia pour tous les o e ts de joie, de i e et aussi pou les o e ts d outes pass s au ou s de es t ois a s, et pou tous eu à e i j esp e ! Je vous souhaite à toutes de réussir dans votre vie professionnelle et personnelle.
Je remercie mes parents pour leur soutien, pour leur présence à mes côtés à chaque étape de a ie et pou les aleu s u ils o t e seig e en particulier le fait que le travail est toujours récompensé. Je remercie ma famille et mes proches pour leurs soutiens et leurs générosités. Enfin merci à Mathieu pour avoir partagé ces trois années à mes côtés, pour ta patience et ton écoute.
Tables des matières
Chapitre 1 – La peau normale ... 1
1. L h pode e... 2
2.Le derme ... 2
3. La jonction dermo-épidermique... 5
4. L pide e ... 7
4.1. Composition cellulaire ... 7
4.2. Les jonctions intercellulaires ... 9
4.2.1. Les jo tio s d adh e e ... 10
4.2.2. Les desmosomes... 12
4.2.3. Les jonctions serrées ... 13
4.2.4. Les jonctions communicantes ... 14
4.3 Processus de différenciation des kératinocytes ... 15
4.2.5. La couche basale ... 16
4.2.6. La couche épineuse ... 18
4.2.7. La couche granuleuse ... 20
4.2.8. La couche cornée ... 22
5. Spécificité de la peau de souris ... 24
Chapitre 2 - Système immunitaire cutané ...26
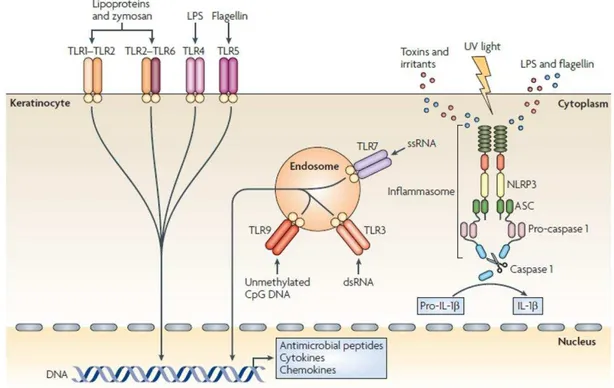
1. Le k ati o te, i itiateu de l i fla atio ... 27
1.1. E pressio de r epteurs de l’i u it i e ... 27
1.2. Produ tio de diateurs de l’i fla atio ... 30
1.2.1. Les peptides antimicrobiens ... 30
1.2.2. Les cytokines/chimiokines ... 32
1.3. Cellule pr se tatri e d’a tig es o professio elle ... 35
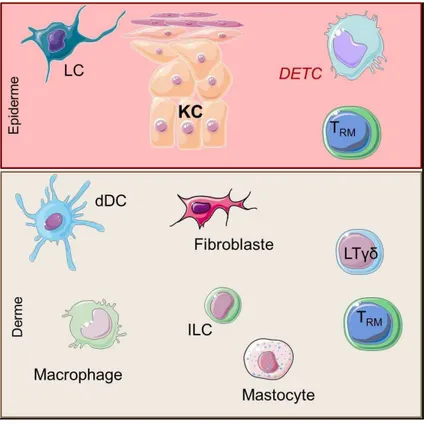
2. Immunité innée dermique... 36
2.1. Les macrophages résidents ... 37
2.2. Les mastocytes ... 38
2.3. Les cellules Lymphoïdes innées ... 39
2.4. Les fibroblastes ... 40
3. Les cellules dendritiques ... 42
3.1. Les cellules dendritiques myéloïdes ... 42
4. Les Lymphocytes T ... 44
4.1.1. Les lymphocytes T cytotoxiques ... 45
4.1.2. Lymphocytes T helper ... 46
4.2. Les l pho tes T et NKT o o ve tio els ... 48
4.2.1. Les lymphocytes T Natural Killer ... 48
4.2.2. Les lymphocytes T gamma delta ... 49
Chapitre 3. Le psoriasis et la dermatite atopique, principales pathologies inflammatoires cutanées ...51
1. Epidémiologie ... 51
2. Caractérisation comparative du psoriasis et de la DA ... 53
2.1. Aspects cliniques du psoriasis et de la DA ... 53
2.2. Aspects histologiques, cellulaires et moléculaires du psoriasis et de la DA ... 54
2.2.1. Caractérisation des épidermes psoriasiques et atopiques... 56
a. Différenciation épidermique ... 56
b. Fo tio i u itai e i e de l pide e ... 57
2.2.2. Caractérisation des infiltrats immunitaires psoriasiques et atopiques ... 58
a. Les cellules dendritiques ... 58
b. Les macrophages ... 59
c. Les lymphocytes T ... 59
d. Les polynucléaires ... 60
3. Physiopathologie du psoriasis ... 62
3.1. Etiologie du psoriasis ... 62
3.1.1. Défaut intrinsèque des kératinocytes ... 62
3.1.2. Présentation antigénique et rupture de la tolérance au soi ... 64
3.2. Modèle physiopathologique du psoriasis ... 65
3.2.1. Phase d i itiatio ... 65
3.2.2. Phase de polarisation cytokinique... 67
3.2.3. Phase d e p essio du pso iasis et a ti it s des toki es su les k ati o tes. .... 68
a. L IL- α et β ... 69
b. L i te f o - ... 70
c. Le Tumor Necrosis Factor α ... 70
d. L i te leuki e ... 71
e. L i terleukine-22... 72
3.3. Mod les uri s de Psoriasis i duit par appli atio d’AldaraTM ... 74
4. Physiopathologie de la dermatite atopique ... 77
4.1. Etiologie de la dermatite atopique ... 78
4.1.1. Altération de la barrière cutanée ... 78
4.1.2. Hypothèse hygiéniste ... 79
4.2. Mécanismes physiopathologiques de la DA ... 79
4.2.1. Phase d i itiatio ... 79
4.2.2. Phase d e p essio aiguë ... 82
4.2.3. Phase d e p essio h o i ue ... 83
4.3. Modèle murin de dermatite atopique induit par application de Calcipotriol ... 84
Chapitre 4 - Cytokines de la famille de l’IL- et ôle da s l’i fla atio uta e ...87
1. G alit s su les toki es de la fa ille de l IL-6 ... 87
2. L i te leuki e ... 90
2.1. Généralités ... 90
2.2. IL-6 et réponse inflammatoire ... 92
2.3. A tivit de l’IL-6 sur les kératinocytes ... 93
2.4. Rôle de l’IL-6 dans le psoriasis ... 93
3. L o ostati e M ... 94 3.1. Genéralités ... 94 3.2. OSM et homéostasie ... 97 3.3. OSM et inflammation ... 98 3.4. OSM et kératinocytes ... 100 4. L i te leuki e-31 ... 101 4.1. Généralités ... 101 4.2. IL-31 et prurit ... 103
4.3. IL-31 et barrière cutanée ... 104
4.4. IL-31 et inflammation ... 104
Objectif de la thèse ... 104
A e I. Rôle de l’OSM, de l’IL- et de l’IL- da s l’i fla atio uta e hez la sou is. ... 106
1. P se tatio de l a ti le O ostati M o e e p essio i du es ski i fla atio ut is ot required in the mouse model of imiquimod-induced psoriasis-like i fla atio ... 106
2. Etude du profil transcriptomique de cultures primaires de kératinocytes murins stimulés par l O“M ... 108
3. Co pa aiso de l a ti it in vitro de l O“M et de l IL-31 sur des cultures primaires de kératinocytes murins et in vivo chez la souris. ... 115
. ‘ôle de l O“M da s u od le de de atite atopi ue i duite pa appli atio de al ipotriol. 117
A e . Mise au poi t d’u od le d’ pide e e o st uit u i et appli atio s ... 125
1. P se tatio de l a ti le De elop e t of a e odel of e o stituted ouse epide is a d ha a te izatio of its espo se to p oi fla ato toki es ... 125
2. Développement des épidermes reconstruits chez la souris et comparaison avec les cultures primaires de kératinocytes en monocouche dans un contexte inflammatoire ... 149
1. Co pa aiso de l a ti it de l O“M su les NMEK et su les ‘ME ... 163
Discussion générale et Conclusion ... 169
1. A ti it de l O“M su la diff e iatio des k ati o tes ... 170
2. A ti it de l O“M su la p odu tio de diateu s de l i fla atio pa les k ati o tes. 172 3. A ti it de l O“M su d aut es t pe ellulai es ... 175
4. A ti it de l O“M da s les pathologies i fla atoi es uta es ... 178
Liste des abréviations
α-SMA: α-smooth muscle actin Ad: adénovirus recombinant
ADAM: a disintegrin and metalloprotease AIM2: Absent in Melanoma 2
AHR: Aryl Hydrocarbon Receptor ARN: acide ribonucléique
ASC: Apoptosis-associatedSpeck-like
containing a CARD
ATP: Adénosine triphosphate BD: β-défensines
C-EBP: CCAAT enhancer-binding protein β CLA: Cutaneous Leukocyte Antigen
CMH: o ple e ajeu d histo o pati ilit Cx: connexine
DA: dermatite atopique
DAMP : motifs moléculaires de dangers DC : cellules dendritiques
dDC: cellules dendritiques dermique, iDC : cellules dendritiques inflammatoires pDC : cellules dendritiques plasmacytoïdes DETC: Dendritic Epidermal T Cell
DSG: desmogléines DSC: desmocollines
EGF: Epidermal Growth Factor
E-cadhérine: Epidermal cadhérine
GM-CSF: Granulocyte Macrophage
Colony-Stimulating Factor
HLA : Human Leukocyte Antigen
ICAM-1 : InterCellular Adhesion Molecule IFN: interféron
Ig : immunoglobuline IL: interleukine
IL-1R1AcP : IL1-R Accessory Protein ILC : cellules lymphoïdes innées IMQ : Imiquimod
JAK : Janus Kinases
JDE: jonction dermo-épidermique K: kératine ou CK : cytokératine KO: Knock Out
KGF: Keratinocyte Growth Factor
LC : Langerhans Cell, cellules de Langerhans LCE: Late Cornified Enveloppe
LIF: Leukemia Inhibitory Factor LPS : lipopolysaccharides
LT : lymphocytes T non conventionnels à
TCR gamme delta
LTh: lymphocyte T helper LTc: lymphocyte T cytotoxique LTi : Lymphoid Tissue Inducers
LTRM : lymphocytes T résidents mémoires
MAPK: Mitogen Associated Protein Kinase M1/M2 : macrophage de type 1 / macrophage
de type 2
NCR: Natural Cytotoxicity Receptor
NHEK: Normal Human Epidermal Keratinocyte NMEK: Normal Murine Epidermal Keratinocyte NLR: NOD-Like Receptors
NLRP: NLR à domaine Pyrin
NK: Natural Killer / NKT : lymphocytes T NK OSM: oncostatine M
P-cadhérine : Placental cadhérine PAM : peptides antimicrobiens
PAMP: motifs moléculaires associés aux
pathogènes
PASI: Psoriasis Area Severity Index PCNA: Proliferating Cell Nuclear Antigen PNE: polynucléaires éosinophiles PNN : polynucléaires neutrophiles PRR: Pattern Recognition Receptor RHE: Reconstituted Human Epidermis RME: Reconstituted Murine Epidermis ROR: Retinoic Acid Orphan Receptor ROS : esp e a ti e de l o g e sIL- Rα : IL-6 récepteur soluble sgp130 : gp130 soluble
SAA: Serum Amyloid Protein
SHC: SH2-and
collagen-homology-domain-containing protein
SOCS: Suppressor of cytokine signaling SPRR: Small Proline Rich Regions shRNA : petit ARN en épingle à cheveux STAT: Signal Transducers and Activators of
Transcription
TCR: T Cell Receptor
TEWL: Trans Epidermal Water Loss TGF-β: transforming growth factor TNF-α:Tumor Necrosis Factor TLR: Toll-Like Receptors
Treg: lymphocytes T régulateurs TSLP: Thymic Stomal Lymphopoietin UV: ultra-violets
Listes de publications:
M. Pohin, C. Veaute, J. Garnier, C. Barrault, L. Cronier, F.X. Bernard, J.C. Lecron, F.
Morel, J.F. Jégou. Establishment of a reconstituted mouse epidermis model to
characterize response to pro-inflammatory cytokines. En révision, J. Tissue. Eng.
Regen. Med.
E. Couderc, F. Morel, P. Levillain, A. Buffière-Morgado, M. Camus, C. Paquier, L.
Favot, C. Bodet, J.F. Jegou, M. Pohin, V. Huguier, J. Mcheik, C. Lacombe, F.X. Bernard, H. Yssel, G. Guillet, J.C. Lecron. Interleukin-17A-induced production of
acute serum amyloid A by keratinocytes contributes to psoriasis pathogenesis. En
révision, Brit. J. Dermatol.
P. Vasseur, M. Pohin, P. Liagre, C. Paquier, JF. Jégou, L. Favot, N. Venisse, F. Morel,
JC. Lecron, C. Sylvain. Liver fibrosis is associated with the severity of cutaneous inflammation in a murine model of chronic psoriasiform dermatitis and in psoriatic patients. En révision, Brit. J. Dermatol.
P. Vasseur, L. Serres, J.F. Jégou , M. Pohin, A. Delwail, I. Petit-Paris, P. Levillain, L.
Favot, M. Samson, H. Yssel, F. Morel, C. Sylvain, J.C. Lecron. High-fat
diet-induced IL-17A exacerbates psoriasiform dermatitis in a mouse model of
steatohepatitis. Am. J. Pathol. 2016. 186:2292-2301.
M. Pohin, W. Guesdon, A.A.Tagne Mekouo, H. Rabeony, I. Paris, H. Atanassov, L.
Favot, J. Mcheik, F.X. Bernard, C.D. Richards, J. Amiaud, F. Blanchard, J.C. Lecron, F. Morel, J.F. Jegou. Oncostatin M overexpression induces potent skin
inflammation but is not required in the mouse model of imiquimod-induced
psoriasis-like inflammation. Eur. J. Immunol. 2016. 46: 1737–1751
H. Rabeony, M. Pohin, P. Vasseur, I. Petit-paris, J.F. Jégou, L. Favot, E. Frouin, M.
Boutet, and F.Blanchard, D. Togbe, B. Ryffel, F.X. Bernard, J.C. Lecron, F. Morel.
IMQ-induced skin inflammation in mice is dependent on IL-1R1 and MyD88
signaling but independent of the NLRP3 inflammasome. Eur. J. Immunol. 2015.
Ava t-p opos
Au cours des deux dernières décennies, la compréhension du rôle des cytokines dans la physiopathologie de maladies inflammatoires cutanées fréquentes comme le psoriasis et la dermatite atopique (DA) a permis le développement de nouveaux outils thérapeutiques. De fait, les biothérapies ciblant les cytokines produites dans la peau inflammatoire et ayant des activités majeures sur les kératinocytes ont montré une efficacité remarquable dans le traitement de ces pathologies. Néanmoins, certains patients restent en échec thérapeutique ou peuvent échapper à la réponse aux traitements à long terme. Lide tifi atio de nouvelles cibles thérapeutiques constitue donc un enjeu majeur de la recherche fondamentale, e i afi d toffe l a se al médicinal disponible dans le traitement des pathologies inflammatoires cutanées.
Le Laboratoire Inflammation, Tissu Epithéliaux et Cytokines (LITEC, EA-4331) étudie le ôle des toki es da s l i fla atio utanée et leur contribution à la communication entre les cellules immunitaires et les kératinocytes. Pa i les toki es do t l e p essio est aug e t e au ou s de p o essus i fla atoi e, le LITEC a d it ue l oncostatine M (OSM) pourrait être impliquée da s l i fla atio uta e pa es a ti it s proinflammatoires sur les kératinocytes humains in vitro (Boniface et al, 2007). A mon a i e au la o atoi e, u p ojet isa t à o pa e les a ti it s de l O“M à elles d aut es toki es de la fa ille de l interleukine (IL)-6avait été initié. Au cours de mon stage de master 2 puis de ma th se, j ai o t i u à déc i e le ôle de l O“M da s l i fla atio cutanée en comparaison à celui de l IL-6 et de l IL-31 (Pohin et al. 2016). Pour cela, nous avons utilisé plusieurs approches méthodologiques : in vitro, pa l utilisatio de ultu es primaires de kératinocytes murins, et in vivo pa l utilisatio de modèles murins d i fla atio uta e. E pa all le de es t a au su l O“M et e olla o atio a e l entrep ise BioAlte ati es, j ai gale e t d elopp u od le d pide e e o st uit à partir de cultures primaires de kératinocytes murins (Pohin et al. en révision JTERM). Ce modèle couramment utilisé dans les tests de produits cosmétiques ainsi que dans la re he he fo da e tale hez l homme, a ait pas connu un développement satisfaisant chez la souris à ce jour. Ce modèle de culture tridimensionnelle de kératinocytes, plus ep se tatif d u pide e natif de souris, répond aux cytokines inflammatoires de
manière similaire aux modèles in vivo. Parmi les cytokines connues pour leur implication dans les pathologies inflammatoires cutanées, nous montrons que l O“M possède une activité plus importante que le Tumor Necrosis Factor (TNF)-α ou l IL-17 sur la différenciation des épidermes reconstruits murins. Ces résultats e fo e t l id e ue le lo age de l O“M est une cible thérapeutique pertinente dans les pathologies inflammatoires cutanées.
1
Chapit e – La peau o ale
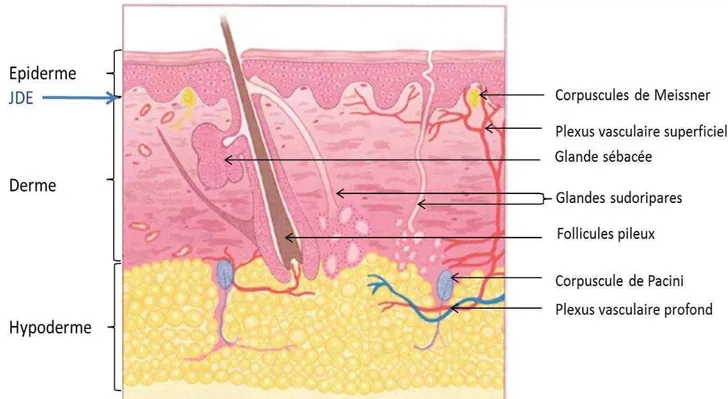
La peau couvre le corps humain sur une surface de 2m², représente 15% du poids d u o ga is e et o ilise jus u à % du ta olis e (Kolarsick et al. 2011). Sa structure o ple e lui pe et d assu e de o euses fo tio s vitales. Ainsi, chez les organismes terrestres, la principale fonction de la peau est de former une enveloppe imperméable o t e les pe tes d eau. Son rôle est aussi de réguler la température corporelle, de participer à la synthèse de certaines vitamines et de former une protection particulièrement efficace contre les agressions environnementales. Les annexes cutanées épidermiques comprennent les glandes sébacées, les glandes sudoripares, les follicules pileux et les phanères qui participent aux fonctions protectrices de la peau (Figure 1). Des terminaisons nerveuses sensitives essentielles à la perception du milieu extérieur sont également présentes, ainsi
u u s st e as ulai e de se pe etta t les ha ges a e les o ga es i te es.
Figure 1 : Structure de la peau et des annexes cutanées. La peau est divisée en trois couches d fi ies pa des it es histologi ues. Le de e et l h pode e so t des lieu d a age pou différentes annexes épidermiques en particulier pour les follicules pileux et les glandes sébacées et sudoripares. JDE : jonction dermo-épidermique. Repris et modifié d’apr s Kolarsick et al. 2011.
2
1.
L’h pode e
L h pode e est u tissu o jo tif adipeu la réparti en lobules graisseux formés d adipo tes. Ces cellules spécialisées régulent le métabolisme par le stockage ou la li atio de lipides et la ph siologie de diff e ts o ga es pa la p odu tio d ho o es. Le tissu adipeux permet aussi de réguler la température corporelle et amortit les chocs mécaniques. Chez un individu non obèse, il peut représenter 10% de la masse corporelle (McKee 2012). Les lobules graisseux sont séparés par des septums fibreux riches en vaisseaux sanguins et en fibres nerveuses qui permettent les échanges avec le reste de l o ga is e. Les ellules e doth liales et les a ophages p se ts da s les septu s participent à la régulation endocrinienne et métabolique pa la p odu tio d adipoki es. La t a sitio e t e l h pode e et le de e est g ossi e e t d limitée par le plexus vasculaire profond composé de vaisseaux artériels, veineux et lymphatiques (Figure 1).
2.
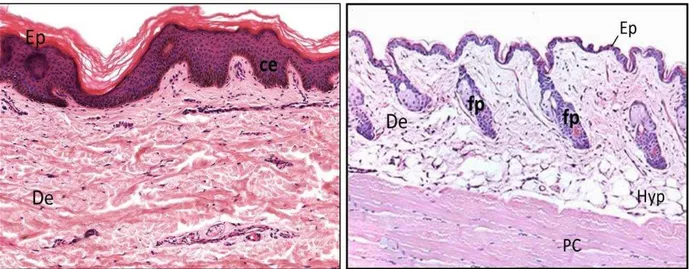
Le derme
Le derme est un tissu conjonctif fibreux de soutien qui assure les propriétés biophysiques de la peau en particulier son élasticité, sa résistance et sa résilience (Prost-Squarcioni 2006; McKee 2012). Pour cela, le derme est formé d u vaste réseau de fibres de collagènes et d lasti es reposant sur une substance fondamentale amorphe (Figure 2). Les composants de cette matrice dermique sont synthétisés par les fibroblastes, des cellules spécialisées dans la formation et le remodelage de la matrice extracellulaire présentes dans tous les tissus conjonctifs sous-épithéliaux. Le derme est richement vascularisé par deux plaques vasculaires et un réseau de petites artères et veines (Figure 1). Cette vascularisation pe et l appo t de ut i e ts, l e po t des vitamines synthétisées dans la peau et le trafic de cellules immunitaires. En histologie, deux zones du derme humain se distinguent par l o ga isatio de la at i e e t a ellulai e (Figure 2).
3
Figure 2. Structure du derme
.
(A) Coupe histologique de derme humain en coloration de Verhoeff contre coloré au Van Gieson faisant apparaitre les fibres élastiques (marron) et les fibres de collagènes (rose). (B) Schéma représentant la composition de la matrice extracellulaire. Les fibres de collagènes sont attachées à la jonction dermo-épidermique par le collagène de type VII. Les fibres d lau i e so t u e forme intermédiaire de fibres élastiques comportant un ratio équivalent d lasti es et de fi illi es. ‘ep is et odifi d’apr s (Naylor et al. 2011).E su fa e, le de e papillai e s i te ale e papilles de i ues e t e les tes épidermiques. Cette dispositio o li ai e aug e te la su fa e d a age et d ha ge e t e le de e et l pide e. Le derme papillaire est un support nourricier dynamique de l pide e. Pour cela, il est irrigué par des micro-vaisseaux provenant du plexus vasculaire supe fi iel ui s a o ise t e fi es a t ioles et ei ules dans les papilles dermiques. Cette a o isatio pe et l appo t de nutriments nécessaires à la croissance et au renouvellement épidermique. Sur les mains et le visage, le derme papillaire contient également des récepteurs sensitifs, les corpuscules de Meissner responsables de la sensation tactile fine
4 (Figure 1). Il est formé de fibres de collagène de type I et de type III lâches et peu organisées et de fi es d oxytalanes composées de fibrillines. Les fi es d o tala es sont des fibres élastiques i atu es p og essi e e t e odel es pou fo e des fi es d lau i e puis des fi es lasti ues atu es o pos es d lasti es et de fi illi es (McKee 2012). Les fibroblastes sont surtout présents dans le derme papillaire, leur forme étendue est caractéristique de cellules prolifératives et métaboliquement actives (Janson et al. 2012). Les fi o lastes du de e papillai e pa ti ipe t à l ho ostasie pide i ue e p oduisa t des fa teu s de oissa e tels ue l Epidermal Growth Factor (EGF) ou les Keratinocyte Growth
Factor (KGF) 1 et 2 (Sorrell and Caplan 2004).
Le derme réticulaire est, quant à lui, plus dense. Son épaisseur est variable en fonction de la zone recouverte (épais au niveau des mains et des pieds, fin au niveau des paupières). D paisses fi es de ollag e de type I et de fibres élastiques matures orientées parallèlement à la jonction dermo-épidermique (JDE) le constituent (Figure 2). Les fibres de collagènes assurent une résistance aux chocs mécaniques tandis que les fibres élastiques permettent à la peau de reprendre sa forme initiale après une pression et répondent aux ti e e ts u elle su it (Figure 2). Les rares fibroblastes présents dans le derme réticulaire ont des propriétés contractiles importantes mais se multiplient peu. De plus, leurs formes étoilées diffèrent de celles des fibroblastes papillaires, suggérant un état de différenciation plus avancé (Sriram et al. 2015). Toutefois, les fibroblastes du derme réticulaire sont distingués des ofi o lastes a a t is s pa l e p essio de la p ot i e de st ess
α-smooth muscle actin α-SMA) et retrouvés dans des tissus fibrotiques ou lors de la
cicatrisation (Gabbiani 2003).
Le derme réticulaire est aussi le lieu d a age de o euses a e es épidermiques. Les glandes sudoripares sont particulièrement nombreuses au niveau de la paume des mains et des pieds et secrètent la sueur, un liquide riche en sel et en certains composés peptidiques qui régule la température corporelle (Kolarsick et al. 2011). Les glandes sébacées sont le plus sou e t a e es au folli ules pileu , l e se le fo a t u follicule pilo-sébacé. Le sébum, synthétisé dans la glande sébacée, est libéré dans le canal du follicule pileux et remonte à la surface de la peau avec le poil. Le sébum forme une couche lipidique protectrice qui limite la déshydratation et la prolifération de bactéries à la surface de l pide e (McKee 2012). En outre, les annexes épidermiques constituent des réservoirs
5 de cellules souches, en particulier les follicules pileux, qui participent activement au processus de ré-épithélialisation après lésion (Kolarsick et al. 2011). Dans le derme réticulaire profond, sont aussi retrouvés des corpuscules de Pacini permettant la détection des vibrations et des changements de pression (Kolarsick et al. 2011).
Enfin la substance fondamentale qui forme la matrice amorphe du derme est o pos e d a ide h alu o i ue, de p ot ogl a es et de gl op ot i es (Figure 2). Les longues chaines de glycosaminoglycanes de ces ol ules pi ge t les ol ules d eau et les facteurs de croissance et constituent ainsi un réservoir pour la croissance épidermique (Krieg and Aumailley 2011).
3.
La jonction dermo-épidermique
La JDE est un complexe macromoléculaire s pa a t le de e de l piderme parfois considéré comme une couche à part entière. La JDE e fo e l i t g it de la peau e constituant une zone d a age pou l pide e. Elle permet l ta lisse e t de la polarité et la croissance des kératinocytes (Has and Nystrom 2015). La JDE est une membrane poreuse qui autorise les échanges moléculaires et cellulaires sélectifs entre le derme et l pide e (Kolarsick et al. 2011). De l pide e e s le de e, trois zones se distinguent :
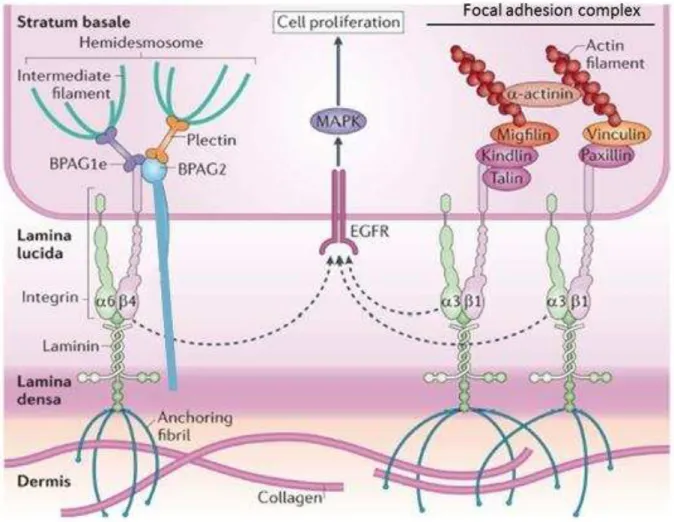
La membrane plasmique basale des kératinocytes basaux est fixée au mésenchyme sous-jacent par des hémidesmosomes et des comple es d adh e e focale (Figure 3.). Ces jonctions cellules-matrices coordonnent la polarité des cellules épithéliales par leur fixation au cytosquelette intracellulaire et gule t la p olif atio de l pide e pa leu i te a tio avec le récepteur membranaire de l EGF (Simpson et al. 2011). Les hémidesmosomes sont fo s d i t g i es α β et deBullous Pemphigoid Antigen 1/2 spécifiques de la JDE tandis ue les o ple es d adh e e fo ale so t o pos s d i t g i es α β retrouvées dans de nombreuses lames basales (Simpson et al. 2011). De fait, les hémidesmosomes sont des structures rigides spécifiques de la peau qui participent au mécanisme de résistance face aux te sio s a i ues. A l i e se, les o ple es d adh e e fo ale sont dynamiques et pe ette t la ig atio des ellules de l pide e au ou s de la i at isatio (Tsuruta et al. 2011; Has and Nystrom 2015).
6 La la e asale ui s pa e l pide e du de e est fo e d u e zo e lai e au électrons, la lamina lucida et d u e zo e so e la lamina densa. La lamina lucida est constituée de fila e ts d a age de laminines 332 et 311 reliés aux intégrines par leur domaine extracellulaire formant ainsi des jonctions cellules-matrices. La laminine 332, dont l e p essio est est ei te à la peau, est esse tielle au ai tie de la o ti uit entre l pide e et le de e (Has and Nystrom 2015). La lamina densa est composée de fibres de ollag es de t pe IV et de p ot i es d ag gatio p oduites pa les fi o lastes de i ues notamment les nidogènes 1 et 2 (Breitkreutz et al. 2013). Cette lamina densa est finalement fixée aux fibres du derme par de petite fibres de collagènes de type VII.
Figure 3 : Structure de la jonction dermo-épidermique. Les hémidesmosomes sont composés de complexes transmembranaires ; les intég i es α β et de Bullous Pemphigoid Antigen 2 aussi appelée collagène VXII, reliées aux filaments intermédiaires par des protéines adaptatrices. Les o ple es d adh rence focale sont structurés de manière identique mais so t o pos s d u aut e di e d i t g i es α β et so t eli s au fila e ts d a ti e. Repris et modifié d ap s (Simpson et al. 2011). BPAG: Bullous Pemphigoid Antigen, MAPK: Mitogen Associated Protein Kinase, EGFR:
7 La ise e pla e d u e JDE effi ie te est le p oduit d u e olla o atio t oite e t e les kératinocytes ui fo e t l pide e et les fibroblastes dermiques (Marionnet et al. 2006; Breitkreutz et al. 2013). Certains composants protéiques de la JDE comme le nidogène ne sont produits que par les fibroblastes alors que seuls les kératinocytes produisent la la i i e . De plus, il a t o t ue l e p essio de la la i i e pa les kératinocytes est dépendante de leur interaction avec les fibroblastes (Breitkreutz et al. 2013). Ce i d o t e l i po ta e des i te a tio s e t e es deu types cellulaires dans le développement et la structure cutanée.
4.
L’ pide e
L pide e est la ou he isi le de la peau. Il s agit d u épithélium pavimenteux, stratifié et kératinisé (Prost-Squarcioni 2006). Cette spécificité morphologique lui confère des propriétés de protection et de résistance nécessaires à la vie terrestre. L pide e ta t pas irrigué, l appo t de ut i e ts est uniquement dépendant de la vascularisation dermique. En revanche, il est pourvu de terminaisons nerveuses sensitives qui participent à la mécanoréception.
4.1.
Composition cellulaire
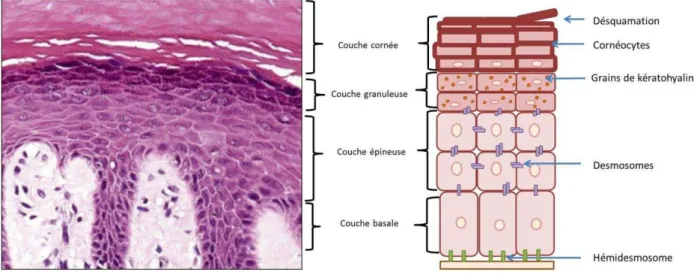
Les kératinocytes représentent 90% des cellules de l pide e. Ils assurent la oh sio et la sista e a i ue de l pide e pa la formation de jonctions intercellulaires (cf section 4.1) et forment, au te e d u p o essus de diff e iatio complexe, une couche externe protectrice. La différenciation des kératinocytes et les jonctions intercellulaires sont aussi responsables de la structure stratifiée et pavimenteuse de l pide e (Simpson et al. 2011). En coupe histologique, quatre couches se distinguent (Figure 4):
- la couche basale (Stratum basale) est une assise cellulaire unique, polarisée, de kératinocytes cylindriques et immatures. La strate basale permet le renouvellement de l pide e ;
- la couche épineuse (Stratum spinosum) est caractérisée par la présence de nombreuses jo tio s d adh e es i te ellulai es spécifiques de l pide e, les
8 desmosomes. Cette couche se compose de 5 à 15 assises cellulaires de kératinocytes polygonaux hez l ho e ;
- la couche granuleuse (Stratum granulosum) se compose de deux ou trois couches de kératinocytes aplatis. Elle doit son nom à la présence de grains de kératohyaline intracytoplasmiques basophiles ;
- la couche cornée (Stratum corneum) est la couche visible de la peau. Elle est composée de cellules mortes, empilées et anucléées appelées cornéocytes. Les cornéocytes et la matrice qui les entourent sont familièrement comparés à un système « brique-ciment ». Après deux semaines, les cornéocytes sont éliminés de la peau pa des ua atio , est-à-dire par lyse du ciment intercellulaire.
Figure 4 : St u tu e de l’ pide e hu ai . (A) Coupe histologi ue d pide e hu ai . Repris
et odifi d ap s (McKee 2012). (B) Schéma représentant la structure de chaque couche épidermique.
L pide e comprend également des mélanocytes responsables de la pigmentation cutanée et pileuse et impliqués dans la photoprotection au travers de leur capacité à synthétiser la mélanine. Au stade mature, leur corps cellulaire est enchâssé dans la couche basale et des prolongements cytoplasmiques, appelés dendrites, s te dent entre les kératinocytes des couches suprabasales. Ces prolongements dendritiques permettent le transfert de la mélanine, synthétisée par les mélanocytes, aux kératinocytes. Dans le cytoplasme des kératinocytes, la mélanine s o ga ise en coiffe au-dessus du noyau, protégeant ainsi l ADN des a o s ult a-violets (UV) (Cichorek et al. 2013).
9 Les cellules de Langerhans (LC) ont été identifiées par Paul Langerhans dès 1878. Il fut le premier à décrire une population de cellules dendritiques (DC), non pigmentée dans l pide e U si le plus ta d, es ellules o t t lass es pa i les ellules d o igi e h atopoï ti ue et so t et ou es sp ifi ue e t da s l pide e où elles ep se te t à 5 % des cellules. Les fonctions immunitaires de ces cellules seront développées dans le chapitre II.
Les cellules de Merkel représentent entre 0,5 et % des ellules de l pide e. Initialement identifiées par Friedrich S. Me kel e , l o igi e et la fo tio de es ellules so t e o e aujou d hui o t o e s es. La plupart sont associées à des terminaisons nerveuses et forment des synapses impliquées dans la sensation tactile fine mais certaines pourraient avoir un rôle immunitaire en interagissant avec les LC. Les cellules de Merkel produisent en particulier des hormones neuroendocrines comme la substance P impliquée dans la p olif atio des fi o lastes et la li atio d hista i e, ainsi que le vasoactive
intestinal peptide, la sérotonine et le calcitonin gene-related peptide ayant un rôle
i po ta t da s l ho ostasie pide i ue (Moll et al. 2005; Boulais and Misery 2007).
4.2.
Les jonctions intercellulaires
Contrairement au tissu o jo tif de i ue et h pode i ue, l pide e est composé du seau de cellules étroitement liées. L adh sio i te ellulai e est essentielle à la formation, à la continuité et à la fonction barrière des tissus épithéliaux stratifiés. Les jonctions intercellulaires permettent cette adhésion, organisent le cytosquelette et contrôlent ainsi la morphogenèse cellulaire. Des études récentes suggèrent aussi leurs implications dans le contrôle de nombreuses voies de signalisation nécessaire à l ho ostasie pide i ue (Niessen 2007; Sumigray et al. 2014). L pide e est a a t is par la présence de nombreuses et diverses jonctions intercellulaires dont la composition et les fonctions sont étroitement liées aux couches épidermiques dans lesquelles elles sont exprimées (Figure 5).
10
Figure 5 : Diversité des jonctions intercellulaires p se tes da s l’ pide e. Les jonctions présentes
da s l pide e so t de uat e t pes ; les jonctions d adh e e, les desmosomes, les jonctions serrées et les jonctions communicantes. Les jonctions d adh e e peuvent aussi former une structure en ceinture autour du pôle apical des kératinocytes appelée Zonula Adherens.
4.2.1. Les jo tio s d’adhérence
Les jonctions d adhérence ou jo tio s d a age so t des poi ts d attache entre deux cellules adjacentes retrouvés dans de nombreux tissus épithéliaux. Da s l pide e, les jonctions d adh e e sont ponctuellement présentes sur les pôles basaux, apicaux et latéraux des kératinocytes. Elles présentent une organisation complexe et multiprotéique. Les parties extracellulaire et transmembranaire sont ainsi composées d Epidermal (E)-cadhérines et de Placental (P)-(E)-cadhérines, des protéines transmembranaires se liant par homodimères de deux cellules voisines. La fo tio d adh sio des adh i es est dépendante du calcium présent dans le milieu extracellulaire (Figure 6A). L e p essio d E-cadhérine est homogène pour toutes les couches épidermiques alors que le p essio de P-cadhérine est restreinte à la couche basale (Simpson et al. 2011). Dans le cytoplasme, l e t it te i ale des adh i es est asso i e à des p ot i es Armadillo, la β-caténine et la p120-caténine, et à l α-caténine une protéine adaptatrice. Enfin, l α-caténine se lie aux fila e ts d a ti e par son extrémité C-terminale et aux β-caténines par son extrémité N-terminale Figu e A . Les fila e ts d a ti e so t ainsi ancrés à la membrane plasmique par les jonctions d adh ence d où ils o ga ise t la o phologie ellulai e (Brandner et al. 2010).
11
Figure 6 : Composition protéique des jonctions adhérentes. (A) s h a de la st u tu e d u e
jonction d adhérence. (B) s h a de la st u tu e d u des oso e ep is d ap s “i pso et al, 2011). (C) Tableau listant la composition des protéines impliquées dans la formation des jonctions. La st u tu e g ale des jo tio s d adh e e ellule-cellule est basée sur la présence de protéines transmembranaires associées à des protéines Armadillo, elles-mêmes reliées à des composants du cytosquelette par des protéines adaptatrices. cat : caténine, DP : desmoplakine, PG : plakoglobine, PKP : plakophiline, DSCG : desmogléine, DSC : desmocolline.
Dans la couche granuleuse, sous l effet de te sio s a i ues, les jo tions d adh e e so t o ga is es pou fo e u e ei tu e autou du pôle api al des kératinocytes. Ces complexes particuliers appelés Zonula Adherens sont associés aux fila e ts d a ti e/ osi e pa les uels ils e fo e t la sista e de l pide e. Le a a ge e t des jo tio s d adh e e e Zonula Adherens est dépendant du e ute e t de la i uli e pa la β-caténine (Ray et al. 2013).
Le ôle des jo tio s d adh e e da s la o phoge se pide i ue a t apporté par les modèles de souris transgéniques. Ainsi, les sou is d fi ie tes pou le g e oda t l E-cadhérine ont permis de o t e ue les jo tio s d adh e e o t ôle t l o ga isatio des filaments intermédiaires de kératines (K aussi nommées cytokératine CK) ainsi que la formation des desmosomes (Tinkle et al. 2008) et des jonctions serrées (Tunggal et al. 2005; Brandner et al. 2010).
12 4.2.2. Les desmosomes
Les desmosomes supplémentent les jonctions d adh e e « classiques » de l pide e et so t e p i s dans les tissus soumis aux tensions mécaniques. Ils sont définis par Getsios, Huen et Green comme des points de soudure intercellulaire mécanorésistants (Getsios et al. 2004). La structure des desmosomes est très semblable à celle des jonctions d adh e e classiques (Figure 6B). Ils sont formés de cadhérines transmembranaires couplées au cytosquelette par des protéines Armadillo dont au moins une isoforme de plakophiline et de plakoglobine liées à une desmoplakine adaptatrice (Figure 6C). Les desmosomes sont ainsi reliés aux filaments intermédiaires. Ces complexes forment un réseau trans-cellulaire dense qui renforcent la cohésion cellulaire et relaie les tensions mécaniques à t a e s l pide e. Dans un modèle murin déficient pour le gène codant la desmoplakine, la se e d e p essio des desmoplakines entraine la mort rapide des souriceaux. Cette dernière est en effet nécessaire à la liaison des filaments intermédiaires du cytosquelette aux cadhérines desmosomales. En son absence, le choc mécanique provoqué par la mise- as e t ai e u e dislo atio de l pide e et u e o t des sou i eau pa déshydratation d o t a t l i po ta e des des oso es da s la ai tie des fo tio s épidermiques (Bouameur et al. 2014).
La diversité des cadhérines desmosomales est plus importante que celles des jo tio s d adh e e lassi ues. Les adh i es des oso ales sont sous-divisées en deux groupes, les desmogléines (DSG) 1, 2, 3 et 4 et les desmocollines (DSC) 1, 2 et 3. Elles p se te t u e st u tu e ol ulai e se la le à l E-cadhérine avec la présence de domaine de fixation extracellulaire dépendant du calcium (Sumigray et al. 2014). Les DSG et les DSC sont toutefois capables de se lier indépendamment de la présence de Ca2+. Cette propriété est spécifique des cadhérines desmosomales et contribue à la résistance des tissus. A ce titre, les desmosomes sont qualifiés de complexe « super-adhésif » (Getsios et al. 2004; Garrod and Chidgey 2008). Contrairement aux jonctions d adh e e, la o positio protéique des desmosomes diffère selon les couches épidermiques étudiées. DSG2, DSC2, DSG3, DSC3 et la plakophiline 2 sont exprimées dans la couche basale et sont progressivement remplacées par DSG1, DSG, DSC1 et la plakophiline 3 dans les couches suprabasales (Garrod and Chidgey 2008; Simpson et al. 2011). Ce remodelage des cadhérines
13 desmosomales est impliqué dans la régulation de la balance entre prolifération et différenciation des kératinocytes. Ainsi, une surexpression anormale de DSG3 sous le contrôle du promoteur de la K1 dans les couches suprabasales de l pide e entraine une hyperprolifération des kératinocytes ainsi u u e i hi itio de la diff e iatio (Garrod and Chidgey 2008; Sumigray et al. 2014). Inversement, lorsque DSG1 est exprimée prématurément da s la ou he asale, le sig al de p olif atio i duit pa l EGF est i hi et l pide e est at ophi (Sumigray et al. 2014).
Enfin, les desmosomes sont considérés comme des mécanosenseurs. Par leur fixation aux filaments intermédiaires, ils relaient les tensions mécaniques à travers le cytoplasme jus u à la e a e nucléaire des kératinocytes et peu e t ai si i flue e l ho ostasie cutanée (Garrod and Chidgey 2008). Les d fauts d e p essio des des oso es e t ai e t également des altérations de l organisation des microtubules, des fila e ts d a ti es, des
Zonula occludens et des jonctions serrées dans la couche granuleuse. Ces propriétés sont
dépendantes des protéines Armadillo associées aux cadhérines desmosomales (Garrod and Chidgey 2008; Bouameur et al. 2014).
4.2.3. Les jonctions serrées
L adaptatio des o ga is es à la ie te est e a essit le d eloppe e t d u épiderme protégeant le milieu intérieur aqueux contre la déshydratation. Les jonctions serrées de la couche granuleuse assurent la prévention de la déshydratation en régulant les mouvements extracellulaires d eau et d io s des ou hes i f ieu es de l pide e e s le milieu extérieur (Kirschner et al. 2010). Pour se faire, elles relient étroitement les feuillets externes des membranes plasmiques de deux cellules voisines et forment ainsi des jonctions étanches entre les pôles basal et api al d u e ellule. Les jonctions serrées contrôlent également le passage d agents pathogènes et des cellules immunitaires à travers les strates épidermiques (Brandner et al. 2015). Les jonctions serrées sont formées de protéines à plusieurs domaines transmembranaires ; les claudines et les occludines ainsi que des « junctional adhesion molecule » (Figure 7A). Dans la cellule, les claudines et les occludines so t eli es au fila e ts d a ti e pa des p ot i es Zonula Occludens adaptatrices (Simpson et al. 2011). La perméabilité paracellulaire des jonctions serrées dépend de leurs compositions protéiques. De fait, la claudine-1 est la seule protéine exprimée par toutes les
14 couches épidermiques. E e a he, l o ludi e et la claudine-4 sont uniquement exprimées dans la couche granuleuse où elles participent à la formation de jonctions étanches qui s o se e t e i os opie le t o i ue sous la fo e de « kissing-point » (Figure 7B). La fonction de barrière contre les mouveme ts d eau e s le ilieu e t ieu des jo tio s se es a t d ite pa l tude de sou is d fi ie tes pou le g e oda t la laudi e-1. A leur naissance, les souriceaux présentent une peau squameuse et sèche et meurent prématurément de déshydratation (Furuse et al. 2002).
Figure 7 : Structure des jonctions serrées. (A) S h a de la st u tu e d u e jo tio se e. Rep is d ap s (Simpson et al. 2011). (B) I age e i os opie le t o i ue d u « kissing point » caractéristique de jonctions serrées étanches de la couche granuleuse. Rep is d ap s (Kirschner et al. 2010). ZO: Zonula Occludens
Les jonctions serrées sont également impliquées dans le maintien de la polarité cellulaire en régulant le passage intramembranaire de lipides ou de protéines. Cette fonction appelée « fence function » est particulièrement importante lors de la transition entre la couche granuleuse et o e et se ait i pli u e da s le ai tie d u ilieu e t a ellulai e favorable à la différenciation des kératinocytes (cf section 4.2). Enfin, les protéines Zonula
Occludens 1 et 2 exprimées dès la couche basale auraient également un rôle dans le contrôle de la balance entre prolifération et différenciation ainsi que dans la séquestration de certains facteurs de transcriptio i pli u s da s l i fla atio (Kirschner et al. 2010).
4.2.4. Les jonctions communicantes
Les jonctions communicantes forment des tunnels intercellulaires coordonnant les voies de signalisation de cellules adjacentes. Cette coordination est régulée par le passage
15 intracytoplasmique de petites molécules, de métabolites et de messagers secondaires dont le poids ol ulai e e de pas kDa (Scott et al. 2012). Afin de former ces tunnels, les jonctions communicantes sont composées de protéines à quatre domaines transmembranaires nommées connexines (Cx). L asse lage de si o e i es ho o ou hétérodimériques forme un hémi-canal et la liaison de deux hémi-canaux forme la jonction communicante entre deux kérati o tes. Da s l pide e, es jo tio s oo do e t e particulier la différenciation épidermique (Scott et al. 2012). Cx43 et Cx31.1 sont exprimées par les kératinocytes des couches basales et épineuses (Churko and Laird 2013). L i hi itio de l e p essio de Cx43 par l utilisatio de petit acide ribonucléique (ARN) en épingle à cheveux (shRNA) chez la sou is adulte i duit u e di i utio de l e p essio des a ueu s de différenciation et suggèrent que la Cx43 joue un rôle dans le processus de différenciation (Churko and Laird 2013). Dans la couche granuleuse, sous l i flue e d u e aug e tatio de la o e t atio e al iu , l e p essio de C est i hi e au p ofit de l e pression de Cx30, Cx31.1 et Cx45 (Kretz et al. 2004). L ho ostasie pide i ue se le en partie dépendre de la plasticité de composition des jonctions communicantes. Pour exemple, l e p essio de la C est uasi-absente des épidermes normaux mais augmentée au cours de la cicatrisation (Churko and Laird 2013). Cette connexine serait aussi exprimée en réponse à un stress et son expression est fortement augmentée dans les épidermes hyperprolifératifs en particulier dans le psoriasis (Kretz et al. 2004; Scott et al. 2012). Néanmoins, les conséquences biologiques de la plasticité des connexines sont peu décrites.
4.3
Processus de différenciation des kératinocytes
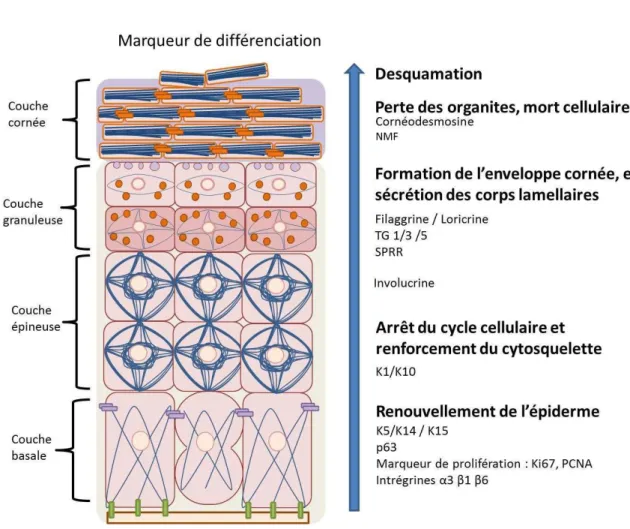
Malg la essit d ta lir des jonctions cellulaires stables et fonctionnelles, l pide e est u tissu e e ou elle e t o sta t. Les cornéocytes sont éliminés de la surface de la peau par desquamation et doivent être remplacés par de nouveaux cornéocytes afin de maintenir une barrière continue. Chez l ho e, le e ou elle e t de l pide e est effe tu e à jou s (Koster 2009). Ce renouvellement permanent est assuré par la prolifération des cellules de la couche basale qui pousse les kératinocytes néoformés vers les couches supérieures où ils subissent une différenciation complexe. Tout au lo g de l pide e, ette diff e iatio s a o pag e d u e e p essio g aduelle de protéines impliquées dans la fonction barrière de la peau. Ces protéines sont spécifiques de
16 l tat de diff e iatio des k ati o tes et sont considérées comme des marqueurs de la différenciation (Figure 8).
Figure 8 : Etapes et marqueurs associés à la différenciation des kératinocytes. Les grandes étapes de la différenciation des kératinocytes sont indiquées en gras, les protéines exprimées au cours de cette différenciation et considérées à ce titre comme des marqueurs de la différenciation sont également indiqués. SPRR: Small Proline Rich Region, TG: transglutaminase, K: kératine, PCNA:
Proliferating Cell Nuclear Antigen, NMF: Natural Moisturizing Factor.
4.2.5. La couche basale
Dans la couche basale, le renouvellement physiologique de l pide e est assuré par une population de cellules souches épidermiques (Solanas and Benitah 2013). Dans leurs niches de la couche basale au niveau des espaces inter-folliculaires, les cellules souches épidermiques sont quiescentes (Koster 2009). Périodiquement, elles sortent de leurs niches et entrent en phase mitotique pour générer des divisions asymétriques ou symétriques (Blanpain and Fuchs 2009; Solanas and Benitah 2013). Les cellules en mitose, issues de l a tivation des cellules souches, sont appelées « Transit-Amplifying » ou cellules
17 amplificatrices. Elles ep se te t e i o % des ellules de la ou he asale et s ide tifie t par des marqueurs classiques de prolifération comme le Proliferating Cell Nuclear Antigen (PCNA) ou Ki67 (Heenen et al. 1998). La cellule amplificatrice peut subir plusieurs cycles mitotiques avant de migrer vers la couche épineuse où elle perdra son potentiel prolifératif. Le potentiel prolifératif des cellules de la couche basale est do asso i à l e p essio des i t g i es α , β et β ui les atta he t à la JDE (Morasso and Tomic-Canic 2005). La balance e t e p olif atio et diff e iatio des k ati o tes est u a is e gul . L u des acteurs majeurs de cette régulation est le facteur de transcription p63. Il maintient les ellules sou hes pide i ues e p olif atio et i duit gale e t la t a sitio e s l a t du cycle cellulai e et l i itiatio de la diff e ciation (Blanpain and Fuchs 2009). En condition ph siologi ue, p est e p i u au i eau de la ou he asale des k ati o tes.
Les cellules post-mitotiques indifférenciées de la couche basale sont caractérisées par l e p essio de K5, K14 et K15 (Figure 8). Les kératines sont des protéines hélicoïdales qui s asse lent en h t odi e fo d u e k ati e de t pe I a ide et d u e k ati e de t pe II asi ue. Les h t odi es s asse le t e suite e t t a es puis e protofilaments. Enfin, les filaments intermédiaires du cytosquelette sont unis par la liaison des domaines terminaux de plusieurs protofilaments de kératines. Le cytosquelette de kératines ainsi formé, relie la membrane plasmique à la membrane nucléaire (Bousquet and Coulombe 2002). Le p essio des k ati es est sp ifi ue d u t pe ellulai e ou de so tat de différenciation (Bousquet and Coulombe 2002). Le p essio spatio-temporelle app op i e des k ati es o ditio e la po se de l pide e au st ess a i ue, supporte une adhésion cellulaire forte et contrôle la croissance épidermique ainsi que l o ga isatio des o ga ites i t a toplas i ues (Kumar et al. 2015). L tude alis pa Ba et coll. portant sur des épidermes de souris déficientes pour les kératines de type II a o fi ue le i eau d e p essio des k ati es est di e te e t li à la sista e de l pide e au fo es a i ues (Bar et al. 2014). Chez l ho e et hez la sou is, des d fauts d e p essio ou de fo tio s de K14 ou K5 entrainent une dislocation des kératinocytes de la couche basale et une cytolyse (Tableau 1) (Moll et al. 2008; Bar et al. 2014).
18
Kératines Type Localisation épidermique Phénotype des souris déficientes Couche
basale
K5 Type I Expression majoritairement
basale remplacée progressivement dans la couche épineuse
mutation K14 (Coulombe et al. 1991) mutation K5 (Peters et al. 2001)
Cytolyse des kératinocytes basaux mimant une épidermolyse bulleuse simplex humaine après traumatismes physiques
K14 Type II
K15 Type I Expression uniquement
basale.
Non décrit Couche
épineuse
K1 Type II Expression couche
suprabasale
K1-KO : décès néonatal associé à une expression de molécules proinflammatoires (Roth et al. 2012)
K10-KO : phénotype mineur, hyperprolifération, cytolyse suprabasale
Compensation par K5/14 (Fuchs et al. 1992; Reichelt et al. 2001)
Double KO : décès néonatal, défaut de formation des desmosomes et perte prématurée des noyaux (Wallace et al. 2012)
K10 Type I
K2e Type II Expression couche
suprabasale tardive
Epide ol se de l pide e supe fi ielle
K9 Type I Différenciation tardive des
épidermes palmoplantaires
Epidermolyse palmoplantaire
Kératine inductible
K6 (a, b) Type II Exprimée en réponse à un stress ou une activation dans la couche basale et suprabasale
Délai de cicatrisation (Wojcik et al. 2000; Mazzalupo et al. 2003)
K16 Type I Exprimée en réponse à un
stress ou une activation dans la couche suprabasale
Hyperkératose palmoplantaire
Défaut de structure de la langue (Lessard and Coulombe 2012)
K17 Type I Délai de cicatrisation (Mazzalupo et al. 2003)
Tableau 1 : Kératines exprimées dans la peau, localisation et phénotype des souris déficientes pour ces kératines. K : kératine, KO : Knock-Out
4.2.6. La couche épineuse
En migrant vers la couche épineuse, les kératinocytes débutent leur processus de différenciation. La première étape clé de la différenciation des kératinocytes consiste en un remplacement des dimères de K5/14 par des dimères plus denses composés de K1 et K10
19 (Figure 8) (Moll et al. 2008; Bragulla and Homberger 2009). Les i eau d e p essio de K et K so t la ge e t sup ieu s au i eau d e p essio des aut es k ati es de l pide e (Kumar et al. 2015). U d faut d e p essio des K / est et ou da s e tai es pathologies pide ol ti ues et e t ai e u e dislo atio de l pide e sup a asal, u e expression suprabasale de la K14 associée à une hyperprolifération des kératinocytes (Tableau 1). K1 aurait également un rôle majeur dans le contrôle de la réponse inflammatoire des kératinocytes (cf Chapitre 2). Ainsi, les souriceaux déficients pour cette k ati e p se te t u pide e d aspe t o al mais meurent rapidement après la naissance de défaut de la barrière épidermique associée à une forte expression de diateu s de l i fla atio e pa ti ulie l IL-18 (Roth et al. 2012). Cette fonction semble t e sp ifi ue de K et est pas et ou e hez les sou is d fi ie tes pou le g e oda t K10 (Reichelt and Magin 2002). Ces dernières sont viables mais présentent un épiderme hyperprolifératif associé à une cytolyse des kératinocytes de la couche épineuse (Fuchs et al. 1992; Reichelt et al. 2001). Chez les souris pour lesquelles le gène codant K10 est muté ou a se t, u a is e de o pe satio pa le ai tie de l e p essio sup a asale de K et de K14 est aussi observé (Fuchs et al. 1992; Reichelt et al. 2001) ta dis u il est pas p se t chez les souris déficientes pour le gène (« Knock Out » KO) codant K1 (Roth et al. 2012). De plus, K10 pourrait directement prévenir la prolifération des kératinocytes de la couche épineuse en séquestrant des kinases de la voie de signalisation Akt impliquée dans l a ti atio du le ellulai e (Paramio et al. 2001).
Parmi les autres kératines de l piderme, K2e est faiblement exprimée dans les couches épineuses supérieures et est associée à un niveau de différenciation avancé des kératinocytes (Bragulla and Homberger 2009). Dans les zones soumises aux tensions mécaniques répétées comme la paume des mains et des pieds, l e p essio de K9 supplémente les filaments classiques de K1/10 (Moll et al. 2008). En condition physiologique, K6, 16 et 17 e so t e p i es u au i eau des folli ules pileu ou da s les pide es se renouvelant apide e t o e l pide e pal o-plantaire (Moll et al. 2008). Leurs présences dans les couches basale et épineuse des espaces inter-folliculaires sont associées à un état activé des kératinocytes et aux épithéliums hyperprolifératifs (Moll et al. 2008). La K16 est exprimée par les kératinocytes post-mitotiques tandis que K6 et K17 sont exprimées pa l e se le des ou hes pide i ues. Enfin, K6, 16 et 17 sont connues pour leurs
20 expressions dans de nombreuses pathologies cutanées. Dans les épidermes pathologiques, ces kératines favoriseraient la plasticité des kératinocytes et donc leurs potentiels prolifératifs, migratoires voir invasifs (Bousquet and Coulombe 2002). K16 et K17 pourraient être impliquées dans la réponse immunitaire innée en gula t l e p essio des diateu s de l i fla atio cf chapitre 2) produits par les kératinocytes (Depianto et al. 2010; Lessard et al. 2013).
E fi , da s la ou he pi euse sup ieu e, l aug e tatio de la concentration i t a ellulai e de al iu i duit gale e t l e p essio de p ot i es p o es de l e eloppe o e telle l i olu i e ai si ue les p ot i es Armadillo périplakine et envoplakine (Kalinin et al. 2002; Candi et al. 2005).
4.2.7. La couche granuleuse
La couche granuleuse est composée de kératinocytes en différenciation tardive. A cette étape, les kératinocytes produisent des protéines impliquées dans la formation de l e eloppe o e ainsi que des corps lamellaires ha g s de lipides et d e z es qui formeront le ciment lipidique extracellulaire (Candi et al. 2005). Les grains de kératoyaline synthétisés dans cette couche sont des agrégats de protéines insolubles constitués de pro-filaggrine phosphorylée ou de loricrine (Candi et al. 2005).
La ise e pla e de l e eloppe cornée est dépendante de la concentration en calcium i t a ellulai e. “ous l i flue e du Ca2+, l e oplaki e et la p iplaki e so t d pos es près de la membrane plasmique où elles se e t d atta he aux filaments de K1/10. L i olu i e est e suite ajoutée à ce complexe intracytoplasmique. Les études sur souris d fi ie tes pou le g e oda t l i olu i e (Djian et al. 2000), l e oplaki e (Maatta et al. 2001) ou la périplakine (Aho et al. 2004) o t o t u i di iduelle e t, au u e tait i dispe sa le à la st u tu e de l pide e ou à la fo tio a i e de la peau sugg a t u e fo te edo da e da s les fo tio s de es p ot i es. A l i e se, la d fi ie e o joi te de ces trois protéines induit un délai de formation de la barrière épidermique durant l e oge se, des d fauts d asse lage de l e eloppe o e, u e du tio de la densité du ciment intercornéocytaire, un défaut de desquamation de la couche cornée et une inflammation chez la souris (Sevilla et al. 2007). Ces études ont permis de confirmer le
21 ôle de es p ot i es da s la fo atio de l e eloppe o e. En effet, la présence de o ple e p ot i ue o pos d i olu i e, d e oplaki e et de p iplaki e à proximité de la membrane plasmique se t d hafaudage pou la fi atio de p ot i es de l e eloppe cornée comme la loricrine, les « Small Proline Rich Regions » (SPRR), les « Late Cornified
Enveloppe » (LCE) ou les protéines S100 (Kalinin et al. 2002; Eckert et al. 2004). A elle seule la
lo i i e ep se te % de la asse p ot i ue de l e eloppe o e, et avec la filaggrine elles constituent des marqueurs tardifs de la différenciation du kératinocyte (Figure 8). La lo i i e est pas i dispe sa le à la fo atio de la a i e pide i ue. Les études sur souris déficientes pour le gène codant cette protéine ont en effet montré que chez ces souris l a se e de lo i i e est o pe s e pa u e aug e tatio de l expression de protéines SPRR et de protéines S100 post-natale (Koch et al. 2000).
Pa all le e t à la fo atio de l e eloppe o e, le calcium intracellulaire permet aussi le t afi si ulai e des o ps la ellai es jus u à la e a e plas i ue sup rieure des kératinocytes de la couche granuleuse (Matsui and Amagai 2015). Au niveau de la jonction entre la couche granuleuse et la couche cornée, les corps lamellaires fusionnent avec la membrane plasmique des kératinocytes et déversent leur contenu lipidique et e z ati ue da s l espa e e t a ellulai e. L aug e tatio de la o e t atio e Ca2+
entraine également l a ti atio des t a sgluta inases (Candi et al. 2005). Ces enzymes atal se t la fo atio de po ts isopeptidi ues e t e les p ot i es de l e eloppe o e et rigidifient ainsi la membrane des kératinocytes (Eckert et al. 2005). Parmi les transglutaminases identifiées da s l pide e, la transglutaminase 1 semble avoir un rôle majeur dans la formation de la barrière cutanée. En effet, les souriceaux déficients pour ette e z e eu e t de d sh d atatio peu de te ps ap s la aissa e. L e a e de la peau de ces souris a montré ue l a se e de ette e z e entraine une augmentation des ou e e ts d eau de la couche basale vers la couche cornée (« Trans Epidermal Water
Loss » TEWL) associée à des défauts de fo atio du i e t lipidi ue et de l e eloppe
cornée (Kuramoto et al. 2002). La transglutaminase 1 est en effet impliquée dans la formation de liaisons covalentes e t e l i olu i e et la membrane plasmique ainsi que dans la fi atio des ω-hydroxycéramides, composant majeur du ciment lipidique, à l i olu i e (Kalinin et al. 2002). Ainsi reliés, les ω-hydroxycéramides forment une monocouche extracellulaire qui complémente les phospholipides de la membrane plasmique
22 des kératinocytes et constitue une matrice pour la formation du ciment lipidique (Matsui and Amagai 2015).
4.2.8. La couche cornée
La transition des kératinocytes de la couche granuleuse à la couche cornée s a o pag e d u e pe te des o ga ites et d u e o t ellulai e programmée appelée cornification (Simpson et al. 2011). Cependant, les cornéocytes restent biochimiquement actifs et co t ai e e t au a is e d apoptose lassi ue, la o ifi atio est pas d pe da te de l a tio de aspases telles ue les aspases , 7 et 8. Seule la caspase 14 est active dans la couche cornée. Elle est pas di e tement impliquée dans les mécanismes de mort cellulaire mais participe aux fonctions de la peau par son action protéolytique en particulier sur la filaggrine (Denecker et al. 2008).
La transition entre la couche granuleuse et la ou he o e s a o pag e d u e chute de la proportion d eau de 70% à 30% (Madison 2003). Le maintien de ce gradient aqueux, nécessaire aux fonctionnements des enzymes de la couche cornée, est assuré par les jonctions serrées et les lipides hydrophobes (Madison 2003). Dans la couche cornée inférieure, les lipides polaires provenant des corps lamellaires sont modifiés par des réactions enzymatiques et organisés en feuillet hydrophobes entre les cornéocytes (Matsui and Amagai 2015). Le ciment lipidique ainsi formé est o stitu de a ides % , d a ides gras libres (15%) et de cholestérol (25%) (Feingold 2007). Une altération de la composition lipidique ou des défauts enzymatiques de maturation des lipides entrainent l aug e tatio du TEWL asso i e à u e s he esse uta e ai si u une altération de la desquamation (Madison 2003; Proksch et al. 2008; Lopez-Pajares et al. 2013).
La couche cornée est aussi le lieu de atu atio e z ati ue d un grand nombre de protéines. Parmi ces dernières, la filaggrine est particulièrement importante dans les fonctions barrières de la peau. La filaggrine est une protéine de la famille des S100 fused protéines comprenant la filagg i e , l ho e i e, la t i hoh ali e. La filaggrine est synthétisée sous la forme d u p u seu dans la couche granuleuse et subit un long processus de maturation post-traductionnelle comprenant une étape de déphosphorylation et plusieurs clivages protéolytiques dans la couche cornée. Plus précisément, la