UNIVERSITÉ MOHAMMED V – AGDAL
FACULTÉ DES SCIENCES
Rabat
N° d’ordre : 2312
THÈSE DE DOCTORAT D’ETAT
Présentée par
Nom et Prénom : ZOUITEN Habiba
Discipline : Biologie
Spécialité : Immunologie-Parasitologie
Titre :
Résistance aux anthelminthiques des nématodes parasites du tube
digestif chez les ovins et les équidés au Maroc
Soutenue le 20 Juillet 2006 , Devant le jury
Président :
Mr. Cabaret J.
Directeur de recherche de première classe à l’INRA de Tours, France
Examinateurs :
Mr. Saddak A.
Professeur à la Faculté des Sciences de Rabat
Mr. Berrag B.
Professeur de l’Enseignement Supérieur à l’IAV Hassan II de Rabat
Mme. Atay Kadiri Z.
Professeur à la Faculté des Sciences de Rabat
Mr. Benhoussa A.
Professeur à la Faculté des Sciences de Rabat
Mr. Oukassou M.
Le présent travail a été réalisé sous la codirection de Messieurs Abderrahim Sadak, Professeur au département de Biologie de la Faculté des Sciences de Rabat, et Boumadiane Berrag, Professeur de Parasitologie à l’Institut Agronomique et vétérinaire Hassan II à Rabat. C’est le fruit d’une étroite collaboration entre les deux départements avec l’aide des projets de recherche : PARS (Agro 011), PRAD (coopération Maroc-France) et le PRFI (1006).
Au terme de ce travail, il m’est très agréable d’évoquer l’appui intellectuel, moral et matériel dont j’ai pu bénéficier de la part de plusieurs personnes.
Ma profonde gratitude va à Monsieur le Professeur Sadak A. du département de Biologie de la Faculté des Sciences de Rabat qui m’a proposé ce sujet de travail. Il n’a cessé de me soutenir tout le long de cette période en suivant pas à pas l’évolution de ce travail. J’espère n’avoir pas trahi cette confiance qu’il ma accordée.
Je remercie Madame le Professeur Atay-Kadiri Z. du département de Biologie de la Faculté des sciences de Rabat qui m’a suivi de prés dans la réalisation de ce travail. Son expérience, sa compétence et ses conseils très enrichissants m’ont énormément facilité la tache.
Je remercie également les professeurs qui ont bien voulu juger mon travail
Monsieur Jacques Cabaret, directeur de recherche à l’INRA de tours et président du jury. Monsieur A. Sadak, Professeur à la Faculté des Sciences, Rabat
Madame Z. Atay Kadiri, Professeur à la Faculté des Sciences, Rabat Monsieur A. Benhoussa, Professeur à la Faculté des Sciences, Rabat
Monsieur B. Berrag, Professeur de l’enseignement supérieur à l’IAV Hassan II, Rabat Monsieur M. Oukessou, Professeur de l’enseignement supérieur à l’IAV Hassan II, Rabat
Je tiens à témoigner ma plus vive reconnaissance à Monsieur le Professeur Berrag B. qui m’a accueillie au sein du département de Parasitologie de L’I.A.V. Hassan II. Il m’a aidé à réaliser toute la partie expérimentale du travail avec une grande patience et une maîtrise professionnelle. Il m’a offert des conditions de travail très favorables au sein de son laboratoire. Qu’il accepte ici, l’hommage de ma gratitude, qui si grande qu’elle puisse être, ne sera jamais à la hauteur de son dévouement.
Mes plus vifs remerciements vont à Monsieur Cabaret J., directeur de recherche à l’Institut National Agronomique et responsable de l’équipe Ecologie et Génétique des parasites à l’INRA de Tours, qui a su montrer une très grande disponibilité à mon égard lors de ses missions au Maroc ou par courrier. Je n’ai jamais hésité à le solliciter à chaque problème si minime soit il. Ses conseils et ses réponses instantanés m’ont toujours procuré soulagement et réconfort. Qu’il accepte ici ma profonde gratitude,
Ma plus grande estime va à Monsieur le Professeur Oukessou M., chef du département de physiologie et thérapeutique de l’IVA Hassan II pour m’avoir aider puis autoriser à travailler au sein de son laboratoire, notamment dans la préparation des gammes de concentrations des anthelminthiques utilisées dans les tests in vitro. Je voudrais remercier aussi Monsieur Ablouh du
J’adresse mes vifs remerciements à toutes les personnes de la garde Royale pour leurs aides précieuses lors des prélèvements effectués sur les chevaux de la Garde Royale ainsi que leurs renseignements relatifs à l’élevage des chevaux au sein de leur établissement. Je pense particulièrement au Vétérinaire Commandant J. Chakir, au Vétérinaire Colonel-Major E.H. Marzak et au Vétérinaire Capitaine A. Bouchiba. .Par la même occasion, je ne pourrais omettre de remercier tous les responsables et techniciens des haras nationaux, des centres d’élevages et de l’ANOC. Je voudrais également remercier les étudiants de 6ième année vétérinaire pour leur aide lors des sorties. Je pense notamment à Chaib A., Sellak M., Jait A., Boukhris R., Nouhi A., Quefsaoui M. Un merci chaleureux va à mes collègues et amis du département de Biologie de la faculté des Sciences ; Benazzou L., Chraibi N., Yassine F., Ennya A., Fassi Fihri A., Ettaouil S. et tous ceux que j’ai oublié et qui ont su m’écouter et me réconforter à chaque fois que ceci a été nécessaire. Je tiens enfin à remercier tous les membres enseignants, chercheurs et techniciens du département de Biologie de la faculté des sciences de Rabat et du département de Parasitologie et de Physiologie de l’IAV Hassan II qui ont participé de prés ou de loin à la réalisation de ce travail.
Je ne pourrais jamais remercier assez mes parents pour l’appui moral qu’ils m’ont procuré, ainsi que mon époux Rachid Tazi, mes enfants ; Amine, Youssef et Aida qui ont été très patients pendant ces longues années de recherches. Des années qui ont pris de mon temps et de ma disponibilité à leur égard. Avec toute mon affection.
SOMMAIRE
Introduction………..……...5
Chapitre I : Revue bibliographique…….……….……...7
I. Présentation des parasites…………...………..……….………8
I.1. Les strongles digestifs………..………...…8
a- Chez les petits ruminants
b- Chez les Équidés
I.2. Cycle biologique……….16
II. Lutte contre les strongles……….……….……..16
II.1. Action sur la phase libre.………...………..16
a- lutte biologique
b- Gestion des pâturages
II.2. Action sur la phase parasitaire………...…………17
a- Sélection d’hôtes résistants
b- Vaccination
c- Nutrition complémentée
III. Les anthelminthiques……….19
III.1. Historique ……….………...19
III.2. Les Benzimidazoles (BZs) ...………...19
III.2.1. Structure des BZs………...….19
III.2.2. Mode d’action des BZ…...………...25
a-
Effet ovicide des BZs
b-
Qu’est ce que les microtubules ?
c-
Qu’est ce que la tubuline ?
d-
Relation tubuline-BZs
IV. La résistance aux anthelminthiques………...26
IV.1. Définition de la résistance.………...26
IV.2. Situation de la résistance dans le monde…....…...…………...26
a- Chez les Ovins
b- Chez les Équidés
c- Conclusion
IV.3. Espèces touchées par la résistance…….….………..27
IV.4. Déterminisme génétique de la résistance………..…….………28
IV.4.1. Mécanismes qui régissent la résistance aux BZs …….29
IV.4.2. Comment peut-on expliquer génétiquement cette
résistance……….29
IV.5. Techniques de détection de la résistance..……….30
IV.5.1. Tests in vivo……….….……….30
a- Bilan parasitaire
b- Test de réduction fécal des œufs (FECRT)
c- Test d’identification des larves L3 après coproculture
IV.5.2. Tests in vitro………..…33
a- Test d’inhibition d’éclosion des œufs (EHT)
b-
Test de développement larvaire des L1
c-
Test de paralysie des larves L3.
IV.5.3. Diagnostic moléculaire………..………34
IV.6. Comment peut on éviter le développement de la résistance ….35
IV.6.1. En évitant de traiter trop fréquemment avec la même
molécule
IV.6.2. En traitant au bon moment tout en tenant compte de la zone
refuge
IV.6.3. En traitant à la bonne dose en évitant le sous dosage.
Problématique………..…
39
Chapitre II : Résistance aux anthelminthiques des nématodes
gastro-intestinaux chez les ovins……….……
41
I.Introduction………..………….42
II.Utilisation des anthelminthiques chez les ruminants au Maroc……..…….42
II.1. LCMV et firmes pharmaceutiques………...42
II.2. Vétérinaires privés………...45
II.3. Conclusion de l’enquête………..46
III. Evaluation de l’efficacité des anthelminthiques chez les ovins…………48
III.1. Matériel et méthodes………..48
III.1.1. Présentation des régions d’étude………...48
III.1.2. Infestations expérimentales………...53
III.1.2.1. Parasites
III.1.2.2. Animaux
III.1.2.3. Infestations
III.1.2.4. Traitement
III.1.2.6. Bilan parasitaire
III.1.2.7. Test de paralysie des larves (L3
III.1.3. Test de réduction fécale des œufs (FECRT)……...…..58
III.1.3.1. Choix des animaux et anthelminthiques utilisés
III.1.3.2. Protocole expérimental
a. Coproscopie
b. Interprétation des résultats
III.2. Résultats………..60
III.2.1. infestations expérimentales
III.2.1.1. Résultat du EHT
III.2.1.2. Résultat du bilan parasitaire
III.2.1.3. Résultat du test de paralysie des larves L3
III.2.2. FECRT………...64
IV. Discussion et conclusion………....…66
Chapitre III : Résistance aux anthelminthiques des nématodes
gastro-intestinaux chez les équidés………..…
68
I. Introduction……….………...69
II. Parasitisme des chevaux au Maroc ……….70
II.1. les écuries de courses…………...………..71
II.2. Les haras nationaux……….…..71
II.3. Les Forces Armées Royales (FAR)………...71
II.4. Conclusion……….75
III. Efficacité des anthelminthiques à utilisation courante contre les strongles
gastro-intestinaux chez le cheval……….76
III.1. Matériel et méthodes…...……….76
III.1.1. Les sites
III.1.2. Molécules testées et choix des animaux
III.1.3. Evaluation de la résistance
III.2.Résultat………79
III.2.1. Au niveau des haras nationaux
III.2.2. Au niveau de l’unité 1 des FAR
III.2.3. Au niveau de l’unité 2 des FAR
IV. Diagnostic de la résistance aux BZs chez le cheval de selle………..……82
IV.1. Matériel et méthodes………..……..82
IV.1.1. Choix des animaux
IV.1.2. Choix de l’anthelminthique
IV.1.3. Protocole expérimental
IV.2. Résultats………94
IV.2.1. FECRT
IV.2.2. EHT
IV.2.3. Détermination des larves L3
IV.2.4. Bilan parasitaire
V. Parasitisme chez des équidés non traités : les asins……….……...100
V.1. Enquête……….….…...100
V.2. Matériel et méthodes……….101
V.2.1. Animaux
V.2.2. Coproscopies
V.2.3. Test d’inhibition des œufs
V.2.4. Coproculture
V.2.5. Traitement des ânes
V.3. Résultats………..101
V.3.1. EHT
V.3.2. FECRT
V.3.3. Charge parasitaire
V.3.4. Détermination des parasites
VI. Discussion et conclusion………...……….106
Discussion générale et conclusion……….109
Perspectives……….…………..113
Références bibliographiques………..115
Annexes……….127
La chimiorésistance est un mécanisme biologique universel, décrit dans tout le règne vivant, allant des virus aux mammifères. Ce phénomène est trés préoccupant, car les parasites, face aux anthelminthiques s’adaptent en développant une résistance. C’est ainsi que Darwin définit pour la première fois la notion de sélection naturelle qui est le processus conduisant à une meilleure adaptation des organismes à leur environnement. Le développement de la génétique a ensuite montré que ces adaptations ne pouvaient survenir que grâce à l’existence dans les populations, d’une variabilité générée par les processus de mutation. C’est donc une lutte permanente entre le parasite et l’hôte pour la survie. Vers la fin des années 40, les premiers cas de résistance, chez certaines bactéries pour un groupe d’antibiotiques, les sulphonamides (Towner, 1995), et chez les insectes pour le DTT (Dichloro-Diphényl-Trichloréthane) (Roush, 1993), furent signalés.
La résistance aux anthelminthiques chez les parasites des mammifères est de plus en plus répandue, notamment pour les nématodes parasites du tube digestif des ruminants et des équidés. En 1957, Drudge et al signale l’apparition du premier cas de résistance d’un isolat d’Haemonchus contortus isolé sur des ovins soumis depuis 10 ans à des traitements intensifs à base de phénotiazine, alors que chez les équidés, le premier cas de résistance des petits strongles vis-à-vis de la même molécule a été signalé en 1960 par Gibson. Rapidement, cette molécule a été remplacée par le premier anthelminthique de la famille des benzimidazoles : le thiabendazole. Malheureusement, à peine 3 années après, une résistance à cette molécule apparaît chez les ruminants et les équidés (Drudge et al., 1964, 1965). Ensuite, sont apparues d’autres molécules, à spectre d’activité plus général, à dose thérapeutique plus faible et sans danger pour la plupart des animaux domestiques. Mais depuis une trentaine d’années, aucun nouveau produit n’est apparu malgré le signalement d’une résistance de plus en plus importante à presque toutes les molécules dans le monde.
Le nombre de familles chimiques étant limité, et compte tenu des coûts très élevés pour le développement de molécules originales, les possibilités d’extension de la pharmacopée antiparasitaire sont restreintes. Il paraît donc indispensable de mieux comprendre l’apparition et le développement de la résistance afin de tenter de la prévenir lorsque cela est encore possible, d’essayer de la gérer lorsqu’elle est déjà installée ou mieux encore l’éviter en conservant les molécules qui sont encore efficaces. Devant cette effervescence de tous les parasitologistes
réalisés sur la résistance des nématodes gastro-intestinaux des herbivores au Maroc d’autre part, nous avons voulu à travers cette étude, faire tout d’abord un constat de la situation sanitaire des ovins et des équidés au Maroc, vérifier l’efficacité des anthelminthiques à usage courant contre les strongles digestifs et déterminer les espèces de nématodes qui ont développé une résistance à ces produits.
Avant de préciser la problématique de notre travail, nous présenterons rapidement dans un premier temps la morphologie, l’écologie et l’épidémiologie des strongles digestifs. Nous exposerons ensuite les différents moyens de lutte contre ces nématodes. La résistance aux anthelminthiques sera ensuite abordée par une description de la situation dans le monde et par la présentation de quelques mécanismes ainsi que les techniques de détection de cette résistance. Nous terminerons enfin cette revue bibliographique en essayant de recenser les moyens qui permettent de limiter le développement de cette résistance.
I : PRESENTATION DES PARASITES
I.1 : Les strongles digestifs
Les nématodes parasites du tube digestif appelés strongles digestifs ou strongles gastro-intestinaux appartiennent à l’ordre des Strongylida. Ils se caractérisent par la présence chez le mâle, de deux spicules et d’une bourse copulatrice soutenue par des côtes musculeuses (fig.1). Ce sont les agents responsables des strongyloses.
a- Chez les petits ruminants
Les parasites des petits ruminants et spécialement des ovins (fig.2) qui nous intéressent dans cette étude appartiennent à la famille des Trichostrongylidés. Ils se caractérisent par une capsule buccale absente ou rudimentaire et un cycle monoxène. Ces helminthoses digestives évoluent généralement pendant la période de pâture et se traduisent essentiellement par des troubles gastro-entéritiques avec diarrhée rebelle ou par l’évolution d’un syndrome anémique. Les principales caractéristiques des différents genres sont résumés dans le tableau 1.
b- Chez les équidés
Les espèces hébergées par les équidés (fig.3) appartiennent essentiellement à la super-famille des Strongyloidea et la famille des Strongylidae. Elles sont localisées dans le gros intestin et se traduisent par une anémie accompagnée parfois de troubles digestifs pouvant évoluer vers la cachéxie. Elles se caractérisent morphologiquement par la présence d’une capsule buccale dont la morphologie détermine 2 sous familles :
° Sous famille des Strongylinae appelés aussi « grands strongles » présentent une capsule buccale globuleuse (fig.4). Les larves L3 après ingestion par l’animal, vont migrer dans différents organes de l’hôte selon les espèces et provoquer des lésions plus ou moins graves allant jusqu’à la mort de l’animal (Tableau 2).
° Sous famille des Cyathostominae, appelés aussi Trichonèmes ou « petits strongles » à cause de leur petite taille par rapport aux strongylinés. Ces parasites présentent une capsule buccale annulaire (fig.5). Leur cycle de vie est direct, se fait sans migration larvaire. De ce fait la période prépatente est plus courte que chez les grands strongles. Ce sont les plus nombreux : 13 genres et une quarantaine d’espèces.
Remarque
Bien que les nématodes parasitant le tube digestif des ruminants et des équidés appartiennent au même ordre des Strongylida, ils se différencient de point de vue fonctionnel puisqu’ils n’affectent pas le même organe du tube digestif, ne présentent pas le même cycle de développement et ne provoquent pas les mêmes lésions et donc pas les mêmes symptômes.
Teladorsagia circumcincta Haemonchus contortus
Trichostrongylus axei (x 375).
Figure 1 : Photos de l’extrémité postérieure des strongylides mâles (Euzeby, 1981) Spicules
Spicules
Côtes
Trichostrongylus axei, T. vitrinus
Figure 2 : Parasites internes du mouton ainsi que leurs organes cibles
cc
Strongylus vulgaris x72 S. equinus x40 S. edentatus x33 Figure 4 : Photo de la capsule buccale des strongylinés (grands strongles). (Bowman, 1999)
Face Dorsoventrale Face latérale
Figure 5 : Photo de la capsule buccale des Cyathostominés (petits strongles) Cylicocyclus leptostomum x283 (Bowman, 1999)
Capsule buccale
Capsule buccale
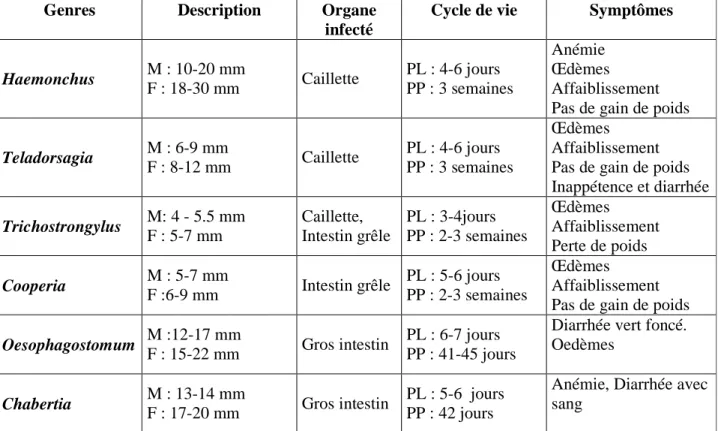
Tableau 1 : Caractéristiques des principaux genres de parasites du tractus digestif chez les ovins, bovins et caprins.
Genres Description Organe
infecté
Cycle de vie Symptômes
Haemonchus M : 10-20 mm F : 18-30 mm Caillette PL : 4-6 jours PP : 3 semaines Anémie Œdèmes Affaiblissement Pas de gain de poids
Teladorsagia M : 6-9 mm F : 8-12 mm Caillette PL : 4-6 jours PP : 3 semaines Œdèmes Affaiblissement Pas de gain de poids Inappétence et diarrhée Trichostrongylus M: 4 - 5.5 mm F : 5-7 mm Caillette, Intestin grêle PL : 3-4jours PP : 2-3 semaines Œdèmes Affaiblissement Perte de poids Cooperia M : 5-7 mm F :6-9 mm Intestin grêle PL : 5-6 jours PP : 2-3 semaines Œdèmes Affaiblissement Pas de gain de poids
Oesophagostomum M :12-17 mm
F : 15-22 mm Gros intestin
PL : 6-7 jours PP : 41-45 jours
Diarrhée vert foncé. Oedèmes
Chabertia M : 13-14 mm
F : 17-20 mm Gros intestin
PL : 5-6 jours PP : 42 jours
Anémie, Diarrhée avec sang
Légende : M = Mâles ; F = Femelles.
PL = Période libre : nombre de jours minimal pour que le parasite atteigne le stade larvaire infectieux (L3) après l’éclosion de l’œuf.
PP : Période prépatente : temps qui s’écoule entre l’ingestion des L3 par l’hôte et le moment ou apparaissent les premiers œufs dans les matières fécales.
Tableau 2 : Caractéristiques des grands strongles chez le cheval (Euzeby, 1981 et Bussieras, 1995)
Espèces Taille Site migratoire
des L3 Symptômes Période pré-patente Strongylus vulgaris M :15 mm F. 20 – 25mm Vx sanguins du Tube digestif Diarrhées/ constipations Coliques. Mort. 6 à 7 mois S. edentatus M : 25 mm F : 35 – 45mm Foie, Cavité abdominale Hépatite Peritonite. 9 à 10 mois S. equinus M : 25 – 35 F : 35 – 45mm Foie Pancréas. Hépatite Peritonite. 8 à 9 mois
I.2. Cycle biologique
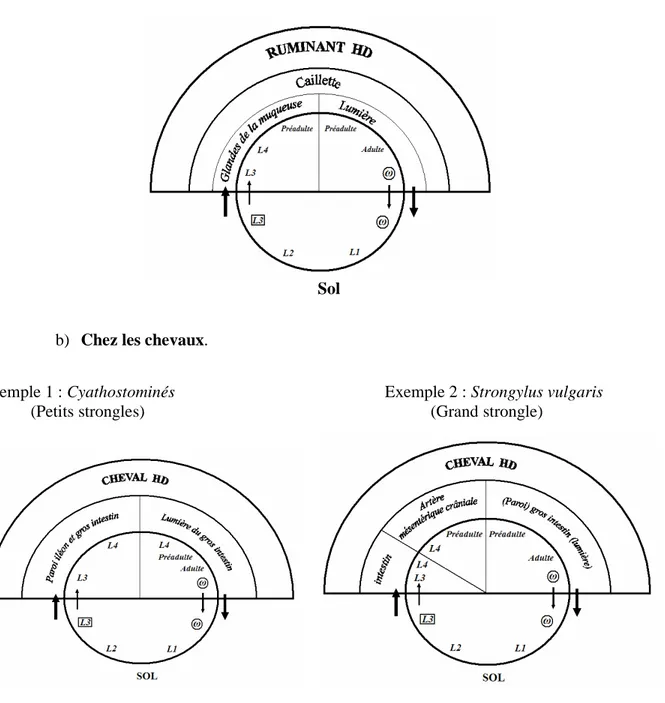
Sauf pour les grands strongles, le cycle de développement des strongles gastro-intestinaux chez les ovins et les équidés est direct sans migration des larves L3 (Fig.6). Il est monoxène et se divise en deux phases :
→ → →
→ La phase parasitaire se déroule à l’intérieur de l’hôte. Elle commence par l’ingestion d’herbe contenant des larves du stade 3 (L3) dites larves infestantes. Ces larves pénètrent dans la muqueuse de l’organe cible du tube digestif, subissent un dégainement et muent en L4. Elles quittent ensuite la muqueuse et passent dans la lumière du tube digestif où elles muent en L5, stade appelé préadulte. Cinq jours après, elles acquièrent la maturité sexuelle. Après accouplement, les femelles libèrent leurs œufs dans la lumière du tube digestif qui seront rejetés à l’extérieur avec les matières fécales de l’hôte. Commence alors la deuxième phase du cycle.
→ → →
→ La phase libre : Les œufs se trouvant sur le sol éclosent en donnant des larves du premier stade (L1) qui subissent deux mues successives pour évoluer en L3.
La durée du cycle de vie des strongles digestifs varie selon les conditions climatiques. Par exemple la température optimale pour la survie des L3 se situe entre 10 et 30°C chez les cyathostomes. D’autre part, la durée de la période prépatente (de l’ingestion des L3 jusqu’au développement des adultes) dépend du phénomène de l’hypobiose. En effet, quand les conditions climatiques sont défavorables à un bon déroulement de la phase libre, on assiste chez quelques espèces à un enkystement des L4 dans la muqueuse du tube digestif , ce qui assure la survie de la population en évitant la maturation des adultes et donc une émission des œufs à une période où les conditions climatiques externes sont défavorables pour la poursuite du cycle. Ce phénomène (hypobiose) peut avoir comme conséquence une diminution de l’efficacité des anthelminthiques. Il a été bien étudié chez les strongles digestifs des ruminants (Cabaret, 1977) et chez les équidés (Love et Ducan, 1988). En climat tempéré l’hypobiose se produit en hiver (période froide) alors qu’en climat tropical, elle est induite par la saison sèche (Reid et Armour, 1972).
Figure 6 : Cycles biologiques des nématodes parasites du tractus du tube digestif. a) Chez les ruminants.
Exemple : Teladorsagia sp. (Bussieras et Chermette 1995)
Sol
b) Chez les chevaux.
Exemple 1 : Cyathostominés Exemple 2 : Strongylus vulgaris
(Petits strongles) (Grand strongle)
II. LUTTE CONTRE LES STRONGLES
Les parasites internes du tube digestif constituent un problème qui revient périodiquement dans presque tous les élevages. D’ailleurs, on peut se demander à quel point les parasites peuvent jouer un rôle puisque l’exposition des animaux à un faible parasitisme peut leur permettre de développer une certaine immunité protectrice. L'importance de ce phénomène conduit à la mise en place d'un plan de prophylaxie dont le but n’est pas d’éliminer le parasitisme mais de le maintenir à un niveau acceptable. Les moyens de lutte contre les strongles gastro-intestinaux peuvent intervenir sur la phase libre ou la phase parasitaire du cycle du nématode.
II.1 Action sur la phase libre
L’objectif principal à ce stade est de diminuer le niveau d’infestation de l’hôte en réduisant le nombre d’œufs et de larves L3 présents sur le pâturage, ce qui implique une grande connaissance des cycles de vie des parasites.
a- Lutte biologique
C’est un moyen fondé sur les propriétés nématophages des champignons. Faedo et al. en 1998 ont montré que les spores d’un champignon hyphomycète : Duddingtonia flagrans pouvaient réduire la taille des populations de larves L3 des strongles infectant les ovins. Ensuite, Larsen et al. en 1998 ont administré oralement les spores de ce champignon microscopique à des ovins infestés expérimentalement par Trichostrongylus colubriformis. Résistants à leur passage dans le tube digestif, ces spores vont se multiplier lorsque les fèces sont rejetées au champ où ils piègent et détruisent les larves en développement. Les résultats sont prometteurs mais pour obtenir une action prolongée il faut maintenir un fort niveau des spores de ce champignon prédateur dans les fèces, ce qui limite l’intêret de cette technique. Plus récemment, Chauhan et son équipe en 2005 ont montré l’efficacité d’un autre champignon (Arthrobotrys musiformis) sur les larves d’ Haemonchus contortus. Les spores de ce champignons peuvent être utilisés seuls ou en association avec ceux de Duddingtonia flagrans (Chauhan et al., 2005). D’autres tests ont été réalisés sur Muellerius capillaris, un parasite pulmonaire des petits ruminants. Les résultats ont montré clairement que Duddingtonia flagrans n’avait aucun effet sur les stades L1 du parasite (Paraud et al., 2005).
b- Gestion des pâturages.
C’est l’un des moyens le plus important et le plus utilisé pour limiter le parasitisme chez les ovins en élevage biologique. La transmission et la multiplication des parasites impliquent le passage au pâturage. La technique consiste à utiliser des parcelles saines pour les troupeaux :
- L’utilisation de pâtures saines c’est à dire non pâturées par la même espèce d’hôte depuis au moins un an est conseillée surtout pour les jeunes animaux après sevrage.
- La technique de rotation des pâturages consiste à limiter le contact entre les L3 et leurs hôtes. Les parcelles, indemnes de parasites sont divisées en bandes et les animaux passent de l’une à l’autre. La durée pendant laquelle une parcelle est mise au repos permet sa décontamination. Cette stratégie est limitée car selon les conditions climatiques (particulièrement en climat tempéré) les L3 peuvent survivre longtemps.
- De même, la création d’un système de pâturage mixte ou alterné par plusieurs espèces d’hôtes lorsqu’ils cohabitent permet de limiter l’infestation des pâturages. La surface réservée aux ovins la première année, sera, par exemple, pâturée par les bovins ou les équidés la deuxième année. Malheureusement certaines espèces de strongles infestent tous les ruminants domestiques ainsi que les équidés, tel que Trichostrongylus axei. Cette technique est très utilisée dans les régions nordiques de la France dans les élevages biologiques (Cabaret et al., 2002). Le même principe de pâturage mixte peut être proposé pour une seule espèce d’hôte à condition de placer des jeunes animaux avant les adultes, car les jeunes sont généralement plus sensibles aux parasites que les adultes (Baudena et al., 2003). Cette immunité acquise chez les femelles adultes ne se transfert malheureusement pas chez leurs petits.
- L’état du pâturage est aussi très important. On peut limiter l’infestation par les L3 en empêchant les animaux de brouter dans les prairies ou l’herbe est courte car 80% des parasites se tiennent dans les cinq premiers centimètres du sol.
II.2 Action sur la phase parasitaire.
a-
Sélection d’hôtes résistants.On trouve dans tous les troupeaux certains animaux qui sont naturellement plus résistants aux parasites que d’autres. Ils sont capables de limiter l’installation des parasites ou de provoquer leur élimination. La composante génétique de cette résistance (héritabilité) est estimée entre 20 et 30% (Leboeuf, 2003).
L’utilisation d’animaux résistants permet une diminution progressive de la contamination des pâturages (Windon, 1990) ce qui nécessite la sélection d’animaux rejetant le moins d’œufs.
En Australie et en Nouvelle Zélande où les troupeaux sont très largement dépendant du pâturage et où le phénomène de résistance aux vermifuges est problématique, la sélection pour des animaux résistants est la voie de l’avenir. En effet, chez les ruminants, des études faîtes à partir d’infestations naturelles et expérimentales inter-races et intra-races ont prouvé l’existence grâce à des mesures
simples des OPG (nombre d’œufs rejetés par gramme de matière fécale de l’hôte) de races résistantes aux strongles gastro-intestinaux (Baker, 1997, Vercoe et Frish, 1992). Woolaston et al. en 1990 ont sélectionné des moutons de race Merinos présentant une résistance innée à l’ Haemonchus contortus. L’héritabilité de ce caractère s’est révélé importante (0.41).
Chez les chèvres par exemple, il a été montré que l’excrétion des œufs par des strongles digestifs était moins importante chez les animaux de race Alpine que chez ceux de race Saanen (Richard et al., 1990).
b- Vaccination
La vaccination pourrait aider à optimiser l’ immunité prorectrice et limiter le niveau d’infestation des animaux domestiques (Newton,1995). Malheureusement, le seul vaccin existant et commercialisé est celui contre la bronchite vermineuse due à Dityocrocaulus viviparus chez les bovins. Les problèmes rencontrés lors de la mise au point d’un vaccin contre les strongles gastro-intestinaux sont importants car les infestations naturelles par ces derniers sont plurispécifiques.
c- Nutrition complémentée
Les strongles gastro-intestinaux provoquent chez l’hôte des modifications métaboliques et physiologiques importantes. Ainsi des apports nutritifs peuvent compenser par exemple les pertes en protéines en fin de gestation ainsi que de réduire l’amplitude de la hausse de ponte des parasites associée à l’agnelage (Leboeuf, 2003).
d- Phytotérapie
Il existe de nombreuses plantes qui sont recensées comme ayant des propriétés anthelminthiques. Leur utilisation faisait d’ailleurs partie des pratiques traditionnelles des éleveurs avant la généralisation des vermifuges de synthèse qui malheureusement a entraîné l’apparition de la résistance à certaines molécules. Plusieurs études ont été faites dans ce domaine, notamment celles des vertus de l’ail (Grieve, 1971), de l’Armoise (Idris et al. 1982), la sève résineuse du pin (Cabaret, 1986) particulièrement efficace contre les strongyloses du cheval, les graines de certaines Cucurbitacées (Lys et al., 1955, Sharma et al., 1971, Forgacs et al.,1970).
Toutes ces solutions proposées ne suffisent pas à gérer le parasitisme interne chez les ruminants et les équidés, et les éleveurs ont recours la plus part du temps aux traitements anthelminthiques. Ce moyen de lutte sera particulièrement développé dans le chapitre suivant.
III. LES ANTHELMINTHIQUES
III.1 : Historique
Le premier produit découvert fut la phénotiazine en 1939, et les premiers résultats de son utilisation furent rapportés sur les parasites des ruminants et des chevaux (Roberson,1982 ; Lanusse et Prichard, 1993). Cette molécule fut ensuite remplacée par d’autres ayant un spectre d’action plus large : le premier produit synthétisé et commercialisé fut le thiabendazole (TBZ) appartenant à la grande famille des benzimidazoles (Brown et al.,1961). Parallèlement aux benzimidazoles(BZs), plusieurs autres anthelminthiques ont été découverts et mis sur le marché dont le dernier né est l’ivermectine. Le tableau 3 résume la classification des principaux anthelminthiques en fonction de leur mode d’action ainsi que leur cible. Leur structure est représentée sur les figures 7, 8, 9 et10.
III.2 : Les Benzimidazoles (BZs)
Ce sont les anthelminthiques les plus couramment utilisés chez les ruminants et les équidés car ils sont bon marché et présentent un indice thérapeutique élevé. Leur étude sera donc plus développée que les autres anthelminthiques.
III.2.1 : Structure des BZs
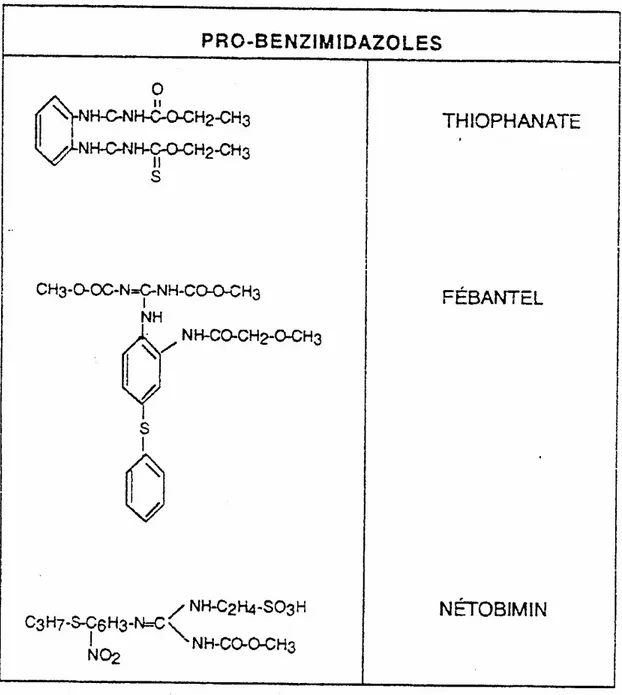
La structure de base des BZs est un cycle double correspondant à la fusion d’un noyau et d’un hétérocycle (tableau 4). Les substitutions des groupements fixés en position R1 et R2 de cette structure permettent d’obtenir les différents composés de cette famille (Towsend et al., 1990). Pour améliorer la solubilité des BZs dans l’eau ainsi que leur absorption, différentes prodogues ont été élaborées : ce sont les pro-benzimidazoles. Ces composés présentent en plus l’avantage d’être moins toxiques pour l’hôte (Horton, 1990). Les principaux pro-benzimidazoles sont : le thiophanate, le fébantel et le nétobimin (Tableau 3 et 5).
Tableau 3 : Classification des anthelminthiques strongylicides utilisés chez les ruminants et les équidés
Classes Nom générique Cible Mode d’action
Phénothiazine Phénothiazine Action sur le métabolisme énergétique Pipérazine Pipérazine diéthylcarbamazine Récepteur à l’acide gamma-amino-butyrique (GABA) Hyperpolarisation neuro-musculaire Organophosphorés Trichlorfon Dichlorvos Coumaphos Naphtalofos Choline-estérase Anti cholinestérasiques Benzimidazoles et Pro-benzimidazoles Thiabendazole Albendazole Fenbendazole Mebendazole Oxfendazole Oxibendazole Cambendazole Fébantel Nétobimin Thiophanate β tubuline Action sur le métabolisme énergétique par inhibition de la fumarate réductase Inhibiteur de la polymérisation de la β- tubuline Imidazothiazoles Lévamisole Tétramisole Récepteur à l’acétylcholine Cholinomiméthiques Tétrahydropyrimidines Morantel Pyrantel Récepteur à l’acétylcholine Cholinomiméthiques Salicylanides Closantel Nitroxinil Rafoxanide Protons ionophores Découpleur de la phosphorylation oxydative Avermectines Ivermectine
Moxidectine Canaux à chlore GABA-agoniste
Figure 7 : Structure chimique des Imidazothiazoles
Figure 9 : Structure chimique des Salicylanides
III.2.2 : Mode d’action des BZs
a- site d’action des BZs : Chez toutes les cellules eucaryotes, le cytosquelette est formé de
plusieurs types de filaments dont les microtubules, leur rôle est d’assurer : - L’architecture de la cellule.
- Les mouvements des vésicules excrétrices dans le cytoplasme cellulaire. - La formation des flagelles.
- L’élongation des cellules nerveuses. - La formation du fuseau mitotique.
Ce sont des tubes creux cylindriques de 24nm de diamètre et 5nm d’épaisseur formés par l’association de deux types de sous unités homologues d’α et de β-tubulines. Ces deux protéines présentent un poids moléculaire d’environ 50.000 daltons chacune et comprennent respectivement 450 et 455 acides aminés. L’homologie entre les deux polypeptides est, selon les espèces, comprise entre 36 et 42% (Littel et Seehaus, 1988).
La longueur des microtubules est déterminée par la polymérisation à l’un des pôles des dimères (pôle positif) de tubuline, pendant que l’extrémité inverse (pôle négatif) se dépolymérise. Cet équilibre peut être modifié par certains facteurs comme :
* Le GTP (Guanosine Tri-Phosphate) et le magnésium qui favorisent la polymérisation. * Le Calcium qui augmente la dépolymérisation (Lacey, 1988).
b- Effet ovicide des BZs : Le premier rôle suspecté de ces molécules fut une action sur la fumarate réductase, une enzyme du cycle de Krebs dans le métabolisme anaérobie du glucose (Prichard, 1973). Ensuite, d’autres travaux ont montré que les BZs sont surtout des antimitotiques qui détruisent le réseau de microtubules du parasite sans altérer celui de l’hôte (Lacey, 1988), ce qui explique l’effet ovicide de ces anthelminthiques.
Le rôle des BZs comme inhibiteur de la synthèse des microtubules fût mis en évidence chez des levures par Clemons et Sisler en 1971 puis confirmé par Borgers et De Nollin en 1975 sur des cellules de l’Ascaris suum en présence du mébendazole.
Les BZs se fixent sur le pôle positif de la β tubuline et bloque la polymérisation du microtubule ce qui diminue sa longueur et entraîne la destructuration du réseau. Cette liaison dépend de la température. Les BZs se lient à la tubuline des nématodes avec une grande affinité à 37°C, alors que les conditions optimales de cette liaison chez les mammifères est de 4°C (Russel et Lacey, 1992). Ces résultats pourraient expliquer l’efficacité des BZs sur les nématodes et l’absence de toxicité chez leurs hôtes : les mammifères.
IV. LA RESISTANCE AUX ANTHELMINTHIQUES
IV.1. Définition
La résistance à une substance a été définie comme étant le développement de la capacité d’individus à tolérer des doses de toxique qui seraient mortelles pour la majorité des individus d’une population normale de la même espèce (FAO 2004). Il s’agit d’une préadaptation par mutation dont le déterminisme est génétique et la transmission héréditaire. Elle peut concerner une seule molécule, on parle alors de résistance simple, ou deux, voir plusieurs molécules apparentées ou non : c’est la résistance multiple.
IV.2. Situation de la résistance dans le monde
La résistance aux anthelminthiques enregistrée chez les ovins, caprins, bovins et équidés a fait l’objet de nombreuses études à travers le monde. Les plus importantes se rapportent aux ovins avec comme principale molécule incriminée celle des BZs, à cause probablement du fait qu’ils soient les premiers anthelminthiques à large spectre d’action contre les strongles digestifs et les moins chers, ce qui peut influencer les éleveurs dans leur utilisation exclusive et abusive. Le premier cas de résistance a été enregistré vis-à-vis de la phénothiazine chez les ruminants (Drudge et al., 1964), et chez les chevaux en Ukraine (Poynter, 1958) et aux USA (Drudge, 1961).
a- Chez les ovins.
Les populations de nématodes parasites résistants aux anthelminthiques sont tout d’abord apparues dans les pays tropicaux (Van Wyck,1990 ; Maciel, 1996 ; Waller, 1997). Les conditions climatiques dans ces pays sont favorables au maintien du cycle de développement des strongles digestifs, en plus de la taille importante des élevages et de l’utilisation fréquente des anthelminthiques. Tous ces éléments sont favorables pour le développement de la résistance. Le phénomène a été également signalé en France (Chartier, 1997), au Royaume-Uni (Hong et al., 1992), puis dans d’autres pays européens. Le cas le plus catastrophique enregistré jusqu’à ce jour est celui de l’Afrique du Sud où toutes les molécules d’anthelminthiques sont devenues inefficaces contre les strongles gastro-intestinaux des ovins et dans certains cas, les éleveurs ont été obligés d’abandonner leur activité (Van Wyck, 1990). Les autres molécules impliquées dans cette résistance mais à un moindre degré sont le lévamisole ( Kerbœuf et al 1988 ; Varady et al 1996 et Hoekstra et al., 1997) le pyrantel (Kerbœuf et al., 1988 ; Varady et al., 1996) et l’ivermectine chez les ovins (Gill et al.,1991) et les caprins (Barré et al., 1997).
b- Chez les équidés, les traitements anthelminthiques, utilisés à l’origine pour contrôler Strongylus vulgaris (grand strongle), ont été extrêmement efficaces contre les maladies parasitaires. Malheureusement, ils ont eu pour conséquence la sélection de cyathostomes (petits strongles) résistants aux anthelminthiques, qui sont désormais considérés comme les principaux agents pathogènes parasitaires chez les chevaux. La résistance au thiabendazole a été raportée pour la première fois par Drudge (Dudge, 1965).
Parmi toutes les classes d’anthelminthiques, la résistance aux BZs reste la plus répandue. Elle a été observée initialement dans quelques haras ou aires géographiques isolées, puis mentionnée dans plus de 21 pays (Kaplan, 2002). Plusieurs fermes ont été étudiées en Europe et aux USA et la prévalence de cette résistance a été estimée à 75% et plus (Fisher et al., 1992 ; Craven et al., 1998 ; Wood et al.,1998 ; Tarigo-Martinie et al., 2001).
D’autres molécules ont remplacé progressivement les BZs tel que le pyrantel. Des résistances à ce principe actif ont été mentionnées (Chapman et al., 1996 ; Lyons et al., 2001). Certaines populations de cyathostomes sont même multirésistantes aux BZs et au pyrantel (Chapman et al., 1996). Aux USA, la prévalence de la résistance à ce produit est estimée approximativement à 40% (in Kaplan 2002). Kaplan en 2003 a montré à travers une étude faite sur 44 fermes situées dans des régions différentes que la prévalence de la résistance était respectivement de 100%, 67%, 48% et 0% pour le fenbendazole, l’oxibendazole, le pamoate de pyrantel et l’ivermectine.
c- Conclusion
Si les BZs posent le plus grand problème parce que ce sont les molécules les plus anciennes, les plus utilisées et celles qui sont utilisables chez les femelles laitières en raison de faibles résidus dans le lait, la résistance au pyrantel est entrain de s’installer chez les ruminants et les équidés. Cependant, la résistance à l’ivermectine, déjà mentionnée chez les ruminants, n’a jamais été rapportée chez les chevaux malgré plus de 20 ans d’utilisation. Mais étant donné que c’est l’anthelmintique le plus utilisé actuellement contre les cyathostomes, le potentiel que ces parasites développent une résistance est grand.
Comme l’indiquent Llyod et Soulsby en 1998, l’émergence des résistances est inévitable et la question n’est pas de savoir si la résistance va se développer mais quand ?
IV. 3. Espèces parasites touchées par la résistance.
Elle s’étend de plus en plus à toutes les espèces de nématodes parasites du tractus digestif des ruminants et des équidés. (Tableau 6).
En effet, chez les chevaux, les espèces les plus impliquées sont essentiellement les cyathostominés. Ce fait est à mettre probablement en relation avec une période prépatente plus courte que chez les grands strongles (1 à 2 mois contre 6 à 11 mois). Il y a donc un écart plus bref entre les générations. Dans les conditions optimales, 2 à 3 générations de cyathostomes peuvent se succéder dans l’année, alors qu’il ne se développera qu’une génération de Strongylus vulgaris. Le nombre de parasites soumis à la pression de sélection de la résistance est donc plus important chez les cyathostomes, favorisant une sélection rapide.
Parmi les 40 espèces recensées de cyathostomes, 12 présentent une résistance aux BZs ou (et) au pyrantel appartenant aux genres : Cylicocyclus, Cyathostomum, Cylicostephanus, Cylicodontophorus, Poteriostomum et Gyalocephalus. Ce sont en fait les genres les plus fréquents et par conséquent les plus soumis au processus de sélection (Reinemeyer et al., 1984).
Chez les petits ruminants, Haemonchus contortus est l’une des espèces la plus incriminée. Il peut avoir une prédisposition particulière pour acquérir des caractères de résistance ou à cause peut être de sa grande prolificité. La deuxième espèce touchée par cette résistance est Teladorsogia spp et elle suit le même schéma de distribution qu’ H. contortus. Les espèces des genres Teladorsagia et Trrichostrongylus sont aussi souvent reconnues comme résistantes aux benzimidazoles (Cabaret 2000.)
Tableau 6 : Résistance des espèces de nématodes parasites aux principales classes d’anthelminthiques (Sangster 2001)
Hôtes Parasites Benzimidazoles Imidazothia-zoles.
Avermectines Salicynilides Organo-phosphorés H. contortus + + (rare) + + + Teladorsagia + + + - Trichost. spp + + + (rare) - ovins et caprins Nematodirus + - Cooperia spp + + - - H. placei + + - Teladorsagia + + - - bovins Trichost. axei + - -
équidés Cyathostomes + + (rare) -
IV. 4. Déterminisme génétique de la résistance
Comme nous l’avons déjà mentionné, plusieurs méthodes de lutte contre les parasites gastro-intestinaux dîtes alternatives existent mais malheureusement l’utilisation des anthelminthiques reste la méthode la plus utilisée pour contrôler ces populations de strongles ce qui entraîne l’apparition et
le maintien d’une résistance. Pour éviter cette chimiorésistance, une bonne compréhension des mécanismes biochimiques et génétiques de ce phénomène s’impose.
IV.4.1. Quels sont les mécanismes qui régissent la résistance aux BZs ?
C’est la résistance la plus ancienne et la plus répandue donc la plus étudiée. Chez les parasites résistants, le système fumarate-réductase ainsi que l’équilibre tubuline/microtubules sont moins soumis à l’action inhibitrice des BZs que chez les parasites sensibles. Différents mécanismes peuvent intervenir :
- Diminution de l’absorption de la molécule toxique chez les souches résistantes des nématodes. Ce mécanisme a été mis en évidence, chez H. contortus, grâce à des molécules marquées de thiabendazole et de fenbendazole (Prichard, 1981).
- Destruction du réseau des microtubules des cellules intestinales chez la souche sensible de Trichostrongylus colubriformis lors d’une exposition au thiabendazole. Le réseau reste intact chez les vers de la souche résistante (Sangster et al., 1985).
- Production accrue d’enzymes de détoxification : Chez une souche résistante au cambendazole d’H. contortus, l’activité de la Glutathion-S-Transférase est 1,5 à 1,8 fois supérieure à celle de cette enzyme chez une souche sensible (Kawalek et al., 1984).
- Altération de la cible : Lacey en 1988 a montré que les BZs se fixent sur la tubuline d’H. contortus résistants avec une affinité bien plus faible que celle observée avec une souche sensible.
IV.4.2.Comment peut-on expliquer génétiquement cette résistance ?
L’apport des techniques de la biologie moléculaire a permis une connaissance plus approfondie des mécanismes génétiques de la résistance aux Benzimidazoles (BZs). La première approche fut réalisée chez un nématode libre : Caenorhabditis elegans (Driscoll et al., 1989) : 28 mutations ont été identifiées dans le gène de la β-tubuline et qui confèrent la résistance aux BZs.
Ensuite Kwa et al en 1994 puis Elard et al en 1996 ont montré respectivement que cette résistance chez H. contortus et Teladorsagia circumcincta était déterminée par une mutation ponctuelle : substitution d’une Phénylalanine par une Tyrosine en position 200 de l’isotype 1 du gène de la β -tubuline. Cette même mutation a été trouvée également chez deux champignons : Aspergillus nidulans (Jung et al., 1992) et Venturia inaequalis (Koenraadt et al., 1992). Chez les équidés, des résultats similaires ont été mentionnés et le seul gène de beta-tubuline séquencé jusqu’à présent est
celui de Cylicocyclus nassatus. C. nassatus et H. contortus partagent plus de 98% de l’identité de séquence de protéine (Kaplan et al., 1999).
Le fait de retrouver la même mutation associée à la résistance aux BZs chez des organismes aussi différents prouve que cette mutation a un rôle fonctionnel dans la résistance aux BZS.
Plus récemment, une autre mutation de la Phénylalanine en Tyrosine de l’isotype 1 du gène de la β -tubuline a été observée, mais en position 167 : chez deux lignées résistantes d’H. contortus (Prichard et al., 2000) , une lignée de Cyathostomes chez les équidés (Kaplan et al., 2000) et chez Neurospora crassa (Orbach et al., 1986). Cette mutation 167 est plus rare dans les conditions naturelles, mais elle peut expliquer la survie des vers Phe/Phe en position 200 après traitement (Silvestre et Cabaret, 2001). Kaplan en 2002 rapporte que les deux mutations (200 et 167) ne se produisent jamais en même temps.
Ces mutations sont récessives puisque seuls les individus homozygotes (Tyr/Tyr) survivent aux traitements. En plus Elard et al en 1998 ont montré qu’il n’y a aucune différence significative au niveau de la fitness entre les individus des trois génotypes :
- rr, qui sont les homozygotes mutants et donc résistants. - SS, qui sont homozygotes sensibles
- rS, qui sont les hétérozygotes et donc sensibles.
Au vue de ces travaux, les mêmes auteurs pensent qu’aucune réversion de la résistance n’est possible même lorsque les BZs ne sont plus utilisés; les rares observations sur le terrain le confirment.
La résistance peut donc apparaître par mutation spontanée ou correspondre à l’existence d’allèles de résistance au BZs qui sont présents depuis longtemps dans les populations parasites sous formes d’allèles rares et qui peuvent se multiplier suite à une pression de la sélection ( Silvestre et Humbert, 2002).
IV.5. Techniques de détection de la résistance
IV.5.1. Tests in vivo
Ces tests réalisés in vivo, permettent d’estimer l’effet du produit administré à l’animal dans les conditions pratiques de l’emploi. Ils tiennent compte en particulier de la métabolisation du produit et peuvent être appliqués à tous les anthelminthiques.
a- Bilan parasitaire
Ce test est fondé sur la comparaison des charges parasitaires observées après autopsie de deux lots d’animaux :
• 1 lot d’animaux infestés expérimentalement par la souche de parasites suspects et traités.
• 1 lot d’animaux témoins, infesté dans les mêmes conditions, et non traités.
C’est la méthode la plus informative puisqu’elle permet l’identification des espèces parasites résistantes. Cependant elle est très coûteuse car elle nécessite l’abattage des animaux et sa réalisation est longue.
b- Test de réduction fécale des œufs (FECRT = Faecal Egg Count Reduction Test) Il permet d’estimer indirectement la charge parasitaire à l’intérieur du tube digestif de l’hôte en comptant le nombre d’œufs rejeté par gramme de matière fécale (OPG). Cabaret et al. en 1998, ont montré qu’il existe une bonne corrélation entre l’excrétion des œufs et la charge parasitaire chez les strongles digestifs des ovins et des caprins.
Sur des animaux infestés naturellement ou expérimentalement, des coproscopies individuelles sont réalisées en considérant un lot d’animaux témoins non traités depuis au moins un mois, et un lot d’animaux, 11 à 14 jours après traitement à l’anthelminthique à tester. C’est le temps nécessaire pour une expulsion totale des vers tués. Au dela de cette période, il y a risque d’une nouvelle réinfestation (Coles et al., 1992).
Le pourcentage de réduction du taux d’excrétion des œufs se calcule le plus souvent selon la formule suivante :
FECR % = OPG avant traitement – OPG après traitement x100 OPG avant traitement
D’autres formules mathématiques ont ensuite été proposées avec ou sans les valeurs des OPG du lot témoin, comme elles peuvent inclure les moyennes arithmétiques ou géométriques des OPG.
1 : Coles 1992 :
*FECR = 100 (1- (T2/C2))
T2 = moyenne arithmétique des OPG d’animaux traités. C2 = moyenne arithmétique des OPG d’animaux témoins
2 : Dash 1988 (in Mejia et al., 2003):
*FECR = 100 (1- (T2/T1) x (C1/C2)) ; C1 et C2 sont les moyennes arithmétiques des OPG avant et après traitement chez les témoins.
3 : Présidente 1985 (in Mejia et al., 2003)
*La formule est la même que celle de Dash mais l’auteur utilise les moyennes géométriques.
4 : Modèle linéaire généralisé (GLM : General linear model) = Les OPG après traitement dépendent des OPG initiaux et du traitement. Cette méthode est basée sur la transformation logarithmique des données ce qui stabilise davantage la variance.
La valeur du seuil du FECR à partir de laquelle on considère qu’il y a résistance est variable selon les auteurs et se situe entre 80 et 95%. Sangster en 1996 propose les valeurs suivantes :
FECR > 95% ⇒ la population est sensible
80% < FECR < 95% ⇒ la résistance est suspectée FECR< 80% ⇒ la population est résistante.
Sur recommandation de L’WAAVP (World Association for the Advancement of Veterinary Parasitology) la valeur limite est fixée actuellement à 90% (Coles et al., 1992), valeur qui notons le a toujours été utilisée chez les chevaux (Wood et al., 1995). Vu le grand nombre de formules proposées pour calculer le FECR, cette valeur reste arbitraire.
Le FECRT est un test bon marché et bien adapté aux enquêtes épidémiologiques. Il ne nécessite ni personnel qualifié, ni matériel sophistiqué. Cependant il reste peu fiable si l’excrétion des œufs est faible. D’autre part, sachant que la fécondité varie d’une espèce à l’autre, l’interprétation est délicate lorsque les hôtes hébergent plusieurs espèces ce qui est le cas chez les chevaux. Le résultat du test dépend essentiellement des espèces prolifiques. Ainsi, par exemple, H. contortus est beaucoup plus prolifique (1000 à 10000 œufs / jour) que Trichostrongylus (100 à 200 œufs / jour). Enfin ce test ne détecte la résistance que lorsque la fréquence des allèles de résistance dépasse environ 25% (Sangster, 2001).
Le FECRT est donc un test adapté essentiellement aux cas de résistance avancée. Il peut permettre dans un premier temps la suspicion de la résistance, mais des tests plus performants sont indispensables pour déterminer le niveau de la résistance ainsi que les espèces impliquées.
c- Identification des larves (L3)
Bien que très peu utilisé dans la pratique, ce test présente au moins deux avantages :
- L’étude morphologique des L3 obtenue par coproculture chez les ruminants et les équidés permet d’estimer l’abondance relative des différentes espèces composant la faune parasitaire. Les L3 étant plus faciles à déterminer que les œufs de strongles.
- L’analyse des L3 obtenues par coproculture de matières fécales prélevées sur des animaux avant et après traitement permet de déterminer les espèces résistantes à l’anthelminthique utilisé.
IV.5. 2. Tests in vitro
Ces tests biologiques sont des mesures indirectes de la résistance, ils portent sur les stades libres (œufs et larves).
a-Test d’inhibition d’éclosion des oeufs (EHT = Egg Hatch Test)
Il est utilisé pour tester les BZs car il est fondé sur l’activité ovicide de cette famille. Généralement c’est le TBZ qui est utilisé dans ces tests à cause de sa plus grande solubilité dans l’eau.
Ce test, mis au point initialement par Le Jambre en 1976 puis modifié par Beaumont-Schwartz en 1987, consiste à incuber des œufs de strongles à 25°c dans des concentrations croissantes de TBZ. 48h après, on dénombre les œufs qui n’ont pas éclos et on calcule le pourcentage d’inhibition d’éclosion. Un témoin est prévu qui consiste à incuber des œufs dans de l’eau distillée. La courbe dose/effet permet de calculer la DL50 (concentration du TBZ qui entraîne 50% de mortalité des œufs). Le rapport de cette DL50 sur celle d’une souche sensible de référence du même parasite et provenant de la même espèce d’hôte détermine le facteur de résistance (FR). Si le FR est supérieur à 3, la population est considérée comme résistante. Dans les mêmes conditions expérimentales et chez les mêmes espèces plusieurs auteurs ont montré qu’il y avait des variations dans les résultats, ce qui montre que ce test manque de strandardisation. Néanmoins et selon Whittlock et al. en 1980, les œufs des souches sensibles éclosent rarement à des concentrations supérieures à 0,1µg de TBZ/ml. Cette valeur peut être retenue pour évaluer le degré de résistance dans une population de nématodes parasites.
Ce test long et onéreux (150 euros par test), nécessite des œufs fraîchement prélevés du rectum (conditions d’anaérobie) ou conservés à 4° pendant une durée inférieure à 72 heures. L’interprétation de ce test est rendue difficile comme pour le FECRT lorsque plusieurs espèces sont incriminées. Ce test est donc davantage destiné à la recherche qu’à une utilisation pratique dans les élevages.
b – Test de développement larvaire (L1) C’est un test qui peut être réalisé avec tous les anthelminthiques.
Dans un milieu de culture donné (plaques de gélose par exemple) des larves (L1) de Trichostrongylides sont placées à 27°c en rajoutant l’anthelminthique à concentrations croissantes. Le développement de ces larves est observé au bout de 7 jours. Les souches résistantes sont capables de se développer à des concentrations d’anthelminthique létales pour une souche sensible de référence (Coles et al., 1988).
c – Test de paralysie des Larves (L3)
Il n’est réalisé que pour tester l’effet paralysant du lévamisole (parfois aussi le morantel ou le pyrantel). Il a été mis au point en 1979 par Martin et le Jambre.
Des larves (L3), obtenues par coproculture, sont mises à incuber à 25°c dans le lévamisole à différentes concentrations. Après 24 heures, les larves sont observées et classées en normales (mobiles) et paralysées (aucun mouvement pendant 5 secondes). Le pourcentage de larves paralysées est ensuite calculé pour chaque concentration.
Ce test s’est révélé très peu efficace à cause notamment de la difficulté de sa lecture : comment différencier une larve paralysée d’une larve uniquement immobile ? Plusieurs auteurs ont essayé de trouver une solution telle que l’utilisation d’appareil de mesure qui pourrait apprécier la mobilité des larves ou l’excitation des larves après une sollicitation directe par contact.
Devant ces difficultés, un autre test a été mis en place par Dobson en 1986, il consiste à rajouter le lévamisole sur les larves (L1) à l’intérieur de l’œuf. C’est un test plus objectif que le précédent présentant une bonne sensibilité mais le moment de l’ajout de l’anthelminthique est crucial pour un bon déroulement du test. Il doit correspondre à l’instant où le développement embryonnaire est très avancé, mais le processus d’éclosion pas encore amorcé.
IV. 5. 3. Diagnostic moléculaire de la résistance aux BZs
Une nouvelle technique de typage moléculaire par PCR (réaction de polymérisation en chaîne) a été mise au point par Humbert et Elard en 1997. Elle a permis la détection d’une mutation ponctuelle : substitution de la Phénylalanine (TTC) par une tyrosine (TAC) en position 200 de l’isotype 1du gène de la β – tubuline. Ensuite et grâce à cette technique, Elard et son équipe en 1999 ont montré l’existence d’une forte corrélation positive entre la valeur de la DL50 calculée par les tests classiques et la proportion de nématodes homozygotes mutants (TYR/TYR), ce qui confirme l’importance de cette mutation dans la résistance aux BZs.
Plus récemment, Silvestre et Humbert en 2002 ont appliqué la même méthode sur des larves infestantes de nématodes trichostrongles. Le but était d’une part de déterminer l’espèce parasite et d’autre part le génotype vis-à-vis de la résistance :
• individus homozygotes mutants : TAC/TAC = Résistants
• individus homozygotes non mutants : TTC/TTC = Sensibles
• individus hétérozygotes : TAC/TTC = Sensibles.
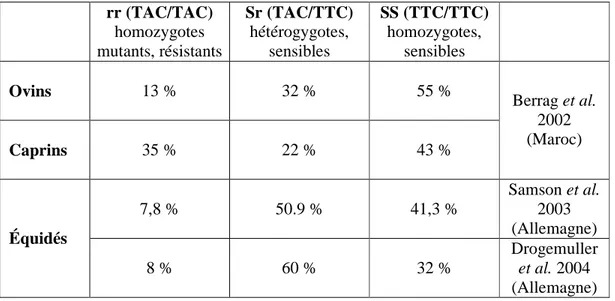
Chez les chevaux, Von Samson-Hammelstjerna et son équipe ont montré, en 2003, que sur 102 L3 de petits strongles supposés résistants, 7,8% uniquement sont homozygotes recessifs rr. Les pourcentages des homozygotes TTC et des hétérozygotes étaient respectivement de 41,3 et 50,9%.
Ils concluent que le polymorphisme du codon 200 de la β–tubuline n’est pas le seul mécanisme impliqué à la résistance aux BZs chez les petits strongles. Drogemuller et al. en 2004 ont confirmé ce résultat malgré une augmentation du dosage du fenbendazole.
Au Maroc, une étude similaire a été réalisée sur Teladorsagia circumcincta : Le génotypage de cette espèce après traitement à l’albendazole et le fenbendazole a révélé que 13% présentaient le génotype résistant (rr), 32% le génotype rS du phénotype sensible et 55% le génotype sensible (SS) (Berrag et al., 2002) (tableau 7).
L’avantage de ces tests moléculaires c’est la détection très précoce de la résistance. En effet, le génotypage permet de déceler une résistance dès que la fréquence de l’allèle de résistance est de 4%, et de démontrer qu’une fraction des nématodes sensibles peut survivre au traitement par un phénomène appelé d’échappement.
Bien que ce soit la méthode de choix, le génotypage reste néanmoins limité à quelques laboratoires spécialisés.
IV.6. Comment peut on éviter le développement de cette résistance ?
IV. 6. 1. En évitant de traiter trop fréquemment avec la même molécule
Comme nous l’avions déjà mentionné auparavant, il est clairement admis actuellement que les gènes de résistance peuvent préexister sous forme d’allèles rares dans les populations des parasites avant toute exposition à la molécule. L’usage répété d’un anthelminthique sélectionne progressivement les individus porteurs d’allèles de résistance. Quand l’intervalle entre deux traitements par le même anthelminthique est trop court, seul les vers résistants qui ont survécu au traitement se reproduisent, alors que les vers sensibles n’ont pas eu le temps d’atteindre leur maturité sexuelle et donc ne participe pas à la formation de la génération suivante. Barton en 1983, suite à des traitements au lévamisole, a montré que les animaux les plus fréquemment traités (entre 1 et 49 traitements par an) sont ceux qui présentent le plus grand OPG.
Chez les chevaux, Kaplan en 2002, rapporte que plusieurs parasitologistes sont d’accord pour ne traiter les animaux que lorsque le nombre moyen d’œufs par gramme de matière fécale se situe entre 100 et 200. Les traitements curatifs sont donc préférés aux traitements préventifs qui eux, en sélectionnant les parasites résistants, sont plus rentables pour les éleveurs à court terme. Drogemuller et al. en 2004 ont montré que des traitements répétés avec une augmentation progressive du dosage du fenbendazole chez les souches de cyathostomes résistantes au benzimidazole, n’avait ancune modification sur le phénotype et le génotype de ces populations (FECR<90%, la DL50 comprise entre 0.20 et 0.31µg/ml).
Tableau 7 : Résultats du génotypage réalisé sur des vers parasites des ovins, caprins et équidés après leur traitement aux BZs.
rr (TAC/TAC) homozygotes mutants, résistants Sr (TAC/TTC) hétérogygotes, sensibles SS (TTC/TTC) homozygotes, sensibles Ovins 13 % 32 % 55 % Caprins 35 % 22 % 43 % Berrag et al. 2002 (Maroc) 7,8 % 50.9 % 41,3 % Samson et al. 2003 (Allemagne) Équidés 8 % 60 % 32 % Drogemuller et al. 2004 (Allemagne)
Pour contrecarrer ce phénomène, les scientifiques proposent des associations d’anthelminthiques à mode d’action différents, chacun utilisé à sa dose maximale (Anderson et al., 1988 ; Van Wyk, 2001).
Chez les chevaux plusieurs essais ont été entrepris dans ce domaine et ont donné de bons résultats. Notons entre autres l’association de la moxidectine avec l’avermectine (Starovir, 2003), l’ivermectine avec le praziquantel (Squires et al., 2003). Avec des doses bien ajustées, aucun effet secondaire de ces drogues n’a été enregistré, notamment sur les juments gestantes ainsi que leurs nouveaux-nés, la croissance des poulains et la performance de reproduction chez les étalons.
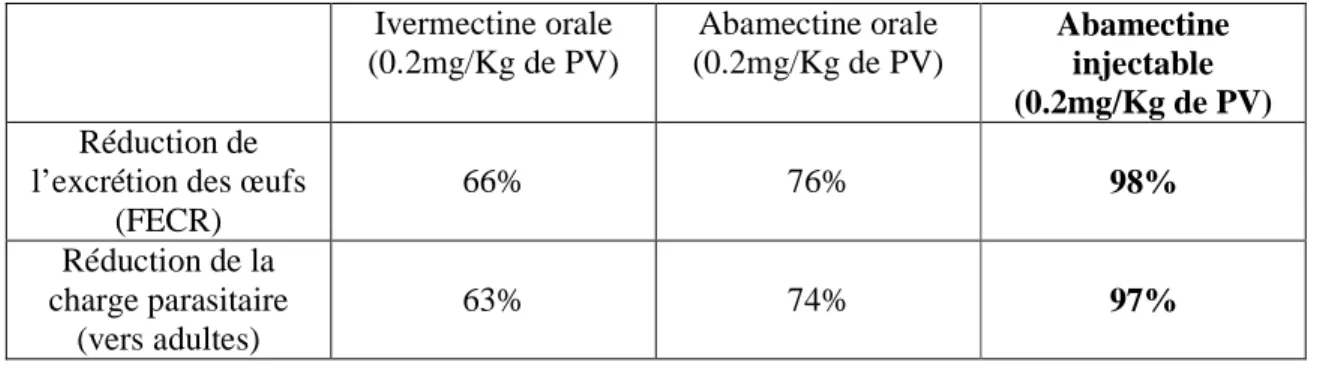
Notons également que le choix de la forme du produit à administrer est très important. C’est ainsi que Alka et al. en 2004 ont montré que l’abamectine à la même dose était plus efficace par injection que par voie orale chez une lignée résistante de Trichostrongylus colubriformis chez le mouton (tableau 8).