Caractérisation des parties aériennes et racinaires des
cultures de couverture en dérobée et leur contribution
au rendement du blé l’année subséquente
Mémoire
Samuel Gagné
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
Caractérisation des parties aériennes et racinaires des
cultures de couverture en dérobée et leur contribution
au rendement du blé l’année subséquente
Mémoire
Samuel Gagné
Supervision :
Caroline Halde, directrice de recherche
Anne Vanasse, codirectrice de recherche
RÉSUMÉ
Ce projet avait pour but d’étudier la contribution respective des parties racinaires et aériennes de quatre espèces de cultures de couverture (CC) (seigle d’automne (Secale cereale L.), radis fourrager (Raphanus sativus L.), vesce commune (Vicia sativa L.) et pois fourrager (Pisum
sativum L.)) implantées en dérobée durant l’automne sur la productivité d’un blé de
printemps (Triticum aestivum L.) l’année subséquente. Durant les deux années de l’expérience, répétées sur deux sites adjacents (2016-2017 et 2017-2018) à la Station agronomique de l’Université Laval, située à Saint-Augustin-de-Desmaures (Qc), le contenu en azote (N) minéral du sol, la biomasse sèche et la concentration en N et en carbone (C) des parties racinaires et aériennes des CC ainsi que les rendements et le contenu en N du blé ont été déterminés. Parmi les CC étudiées, le radis et le pois sont les deux espèces qui ont produit la plus forte biomasse sèche totale (aérienne et racinaire) alors que c’est le radis qui a produit la biomasse racinaire la plus élevée. La vesce commune avait une concentration en N plus élevée que les autres espèces dans ses parties aériennes alors qu’elle avait une concentration en N similaire au radis et au pois dans ses racines. Au moment de la destruction du pois et de la vesce, le contenu en N minéral dans les 15 premiers cm du sol de ces espèces était plus élevé que celui du radis et du seigle. Le contenu en N minéral dans les 45 premiers cm du sol était significativement plus élevé au semis du blé dans les traitements d’incorporation des CC entières par rapport aux traitements d’incorporation des parties aériennes ou racinaires seules. En 2017, les rendements du blé étaient plus élevés suite à l’incorporation des CC entières que suite à l’incorporation des parties aériennes ou racinaires seules.
TABLE DES MATIÈRES
RÉSUMÉ ... iii
LISTE DES TABLEAUX ... vi
LISTE DES FIGURES ... vii
REMERCIEMENTS ... ix
INTRODUCTION ... 1
CHAPITRE 1. REVUE DE LITTÉRATURE ... 2
1.1 LES CULTURES DE COUVERTURE... 2
1.1.1 Quelques définitions et concepts ... 2
1.1.2 Bénéfices des cultures de couverture ... 3
1.1.2.1 Bénéfices environnementaux ... 3
1.1.2.2 Bénéfices agronomiques et économiques ... 6
1.1.3 Espèces utilisées comme cultures de couverture ... 10
1.1.3.1 Pois fourrager ... 10
1.1.3.2 Seigle d’automne ... 13
1.1.3.3 Radis fourrager ... 15
1.1.3.4 Vesce commune ... 17
1.2.1 Cycle de l’azote ... 20
1.2.2 Fixation de l’azote atmosphérique ... 20
1.2.2.1 Généralités et diversité des processus ... 20
1.2.2.2 Fixation de N2 par la symbiose rhizobium-légumineuse ... 21
1.2.3 Minéralisation de l’azote organique ... 22
1.2.3.1 Ammonification de l’azote organique ... 23
1.2.3.2 Nitrification de l’ammonium ... 23
1.2.4 Immobilisation de l’azote... 24
1.2.5 Facteurs influençant la minéralisation et l’immobilisation de l’azote ... 25
1.2.5.1 Influence des facteurs environnementaux ... 25
1.2.5.2 Influence de la composition chimique des résidus organiques... 26
1.3. LE BLÉ DE PRINTEMPS (TRITICUM AESTIVUM L.) ... 27
1.3.2 Facteurs influençant le rendement du blé ... 29
1.3.3 Culture biologique du blé ... 31
1.3.4 Impact des cultures de couverture sur le rendement du blé ... 31
CHAPITRE 2. OBJECTIFS ET HYPOTHÈSES DE RECHERCHE ... 36
CHAPITRE 3. MATÉRIEL ET MÉTHODES ... 38
3.1 SITES DE L’ÉTUDE ET DISPOSITIF EXPÉRIMENTAL ... 38
3.2 MISE EN PLACE DES UNITÉS EXPÉRIMENTALES ... 39
3.3 COLLECTE DES DONNÉES ET MANIPULATIONS ... 40
3.4 ANALYSES STATISTIQUES ... 42
CHAPITRE 4. RÉSULTATS ... 44
4.1 TEMPÉRATURES ET PRÉCIPITATIONS ... 44
4.2 LES CULTURES DE COUVERTURE... 44
4.2.1 Les parties aériennes des cultures de couverture ... 44
4.2.2 Les parties racinaires des cultures de couverture ... 45
4.2.3 Les cultures de couverture entières (parties aériennes et racinaires) ... 46
4.3 L’AZOTE MINÉRAL DU SOL ... 47
4.4 LE BLÉ ... 48
CHAPITRE 5. DISCUSSION ... 50
5.1 LES CULTURES DE COUVERTURE... 50
5.1.1 Les parties aériennes des cultures de couverture ... 50
5.1.2 Les parties racinaires des cultures de couverture ... 52
5.2 L’AZOTE MINÉRAL DU SOL ... 54
5.3 LE BLÉ ... 57 CONCLUSION ... 60 TABLEAUX ET FIGURES ... 63 BIBLIOGRAPHIE ... 81 ANNEXE A. ... 92 ANNEXE B. ... 93 ANNEXE C. ... 94
LISTE DES TABLEAUX
Tableau 1. Propriétés chimiques du sol du champ sur lequel s’est déroulé le deuxième cycle de l’expérience (2017-2018). ... 63 Tableau 2. Températures et précipitations mensuelles pour les trois années de l’expérience (2016,
2017 et 2018) et températures et précipitations moyennes pour les années 1981 à 20101. ... 64 Tableau 3. Calendrier des travaux effectués au site expérimental pour les deux années de chaque
cycle de production (2016-2017 et 2017-2018). ... 65 Tableau 4. Calendrier des collectes de données et manipulations en laboratoire pour les deux années
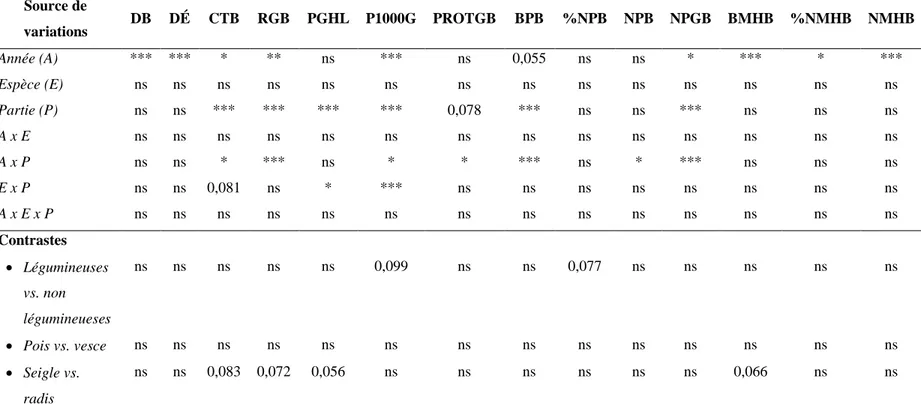
de chaque cycle de production (2016-2017 et 2017-2018)... 66 Tableau 5. Analyse de la variance (ANOVA) pour les caractéristiques des parties aériennes des
cultures de couverture (CC). ... 67 Tableau 6. Analyse de la variance (ANOVA) pour les caractéristiques des parties racinaires des
cultures de couverture (CC). ... 68 Tableau 7. Analyse de la variance (ANOVA) pour les caractéristiques des cultures de couverture
(CC) entières (parties aériennes et racinaires)1. ... 69 Tableau 8. Analyse de la variance (ANOVA) pour le contenu en azote (N) minéral du sol (0-45). ... 70 Tableau 9. Analyse de la variance (ANOVA) pour les caractéristiques du blé de printemps. ... 71
LISTE DES FIGURES
Figure 1. (a) Biomasse des parties aériennes des cultures de couverture (CC) en fonction des espèces de CC (pois fourrager, radis fourrager, seigle d’automne et vesce commune) et des années d’implantation (2016 et 2017); (b) Rapport carbone/azote (C/N) des parties aériennes des CC en fonction des espèces de CC et des années d’implantation; (c) Concentration en N minéral (NO
3-et NH4+) des parties aériennes de CC en fonction des espèces de CC et des années d’implantation;
(d) Contenu en N minéral (NO3- et NH4+) des parties aériennes des CC en fonction des espèces
de CC et des années d’implantation. Les différentes lettres dans un même graphique indiquent une différence significative entre les traitements selon une probabilité de P ≤ 0,05. ... 72 Figure 2. Biomasse en matière sèche des racines des cultures de couverture (CC) en fonction de la profondeur (0-15 cm, 15-30 cm et hors sol pour le radis), des parties (plante entière (PE) et racines (R)), des espèces de CC (pois fourrager, radis fourrager, seigle d’automne et vesce commune) et des années d’implantation (2016 et 2017). Les différentes lettres dans un même graphique indiquent une différence significative entre les traitements selon une probabilité de P ≤ 0,05... 73 Figure 3. (a) Rapport carbone/azote (C/N) des parties racinaires des cultures de couverture (CC) (0-30 cm) en fonction des espèces de CC (pois fourrager, radis fourrager, seigle d’automne et vesce commune) et des années d’implantation (2016 et 2017) ; (b) Concentration en N minéral (NO3- et
NH4+) dans les racines des CC (0-30 cm) en fonction des espèces de CC ; (c) Contenu en N
minéral (NO3- et NH4+) des racines des CC (0-30 cm) en fonction des espèces de CC. Les
différentes lettres dans un même graphique indiquent une différence significative entre les traitements selon une probabilité de P ≤ 0,05. ... 74 Figure 4. (a) Biomasse des cultures de couverture (CC) entières en fonction des espèces de CC (pois fourrager, radis fourrager, seigle d’automne et vesce commune) et des années d’implantation (2016 et 2017); (b) Rapport carbone/azote (C/N) des parties aériennes et racinaires (PE) des CC en fonction des espèces de CC; (c) Concentration en N minéral (NO3- et NH4+) des parties
aériennes et racinaires (PE) des CC en fonction des espèces de CC; (d) Contenu en N minéral (NO3- et NH4+) des parties aériennes et racinaires (PE) des CC en fonction des espèces de CC et
des années d’implantation. Les différentes lettres dans un même graphique indiquent une différence significative entre les traitements selon une probabilité de P ≤ 0,05. Les données et les lettres dans ces graphiques ont été obtenues à partir des résultats provenant des traitements de l’incorporation des plantes entières (PE) uniquement. ... 75 Figure 5. Contenu en azote (N) minéral (NO3- et NH4+) du sol (0-45 cm) en fonction des parties
(aériennes (A), plante entière (PE) et racines (R)) des cultures de couverture (CC) et de la période d’échantillonnage (au semis des CC, à la destruction des CC et après le semis du blé de printemps). Les différentes lettres dans un même graphique indiquent une différence significative entre les traitements selon une probabilité de P ≤ 0,05. ... 76
Figure 6. Contenu en azote (N) minéral (NO3- et NH4+) du sol pour les profondeurs (a) 0-15 cm, (b)
15-30 cm et (c) 30-45 cm en fonction des espèces de cultures de couverture (CC) (pois fourrager, radis fourrager, seigle d’automne et vesce commune) et de la période d’échantillonnage (au semis des CC, à la destruction des CC et après le semis du blé de printemps). Les différentes lettres dans
un même graphique indiquent une différence significative entre les traitements selon une probabilité de P ≤ 0,05. ... 77
Figure 7. Contenu en azote (N) minéral (NO3- et NH4+) du sol pour les profondeurs (a) 0-15 cm, (b)
15-30 cm et (c) 30-45 cm en fonction de la période d’échantillonnage (au semis des cultures de couverture (CC), à la destruction des CC et après le semis du blé de printemps) et des années d’échantillonnage (2016 et 2017). Les différentes lettres dans un même graphique indiquent une différence significative entre les traitements selon une probabilité de P ≤ 0,05. ... 78 Figure 8. (a) Rendement en grain du blé de printemps en fonction des parties (aériennes (A), plante entière (PE) et racinaires (R)) incorporées au sol comme précédent cultural et des années d’échantillonnage (2017 et 2018); (b) Contenu en azote (N) minéral (NO3- et NH4+) total de la
paille et du grain du blé en fonction des différentes parties (A, PE et R) incorporées au sol comme précédent cultural et des années d’échantillonnage (2017 et 2018); (c) Poids de 1 000 grains du blé en fonction des espèces de cultures de couverture (CC) (pois fourrager, radis fourrager, seigle d’automne et vesce commune) et des parties (A, PE et R); (d) Teneur en protéines du grain de blé en fonction des parties (A, PE et R) incorporées au sol comme précédent cultural et des années d’échantillonnage (2017 et 2018). Les lignes horizontales jaunes et vertes représentent les valeurs des traitements témoins sans CC pour les années 2017 et 2018 respectivement. Les différentes lettres dans un même graphique indiquent une différence significative entre les traitements selon une probabilité de P ≤ 0,05. ... 79 Figure 9. (a) Biomasse des parties aériennes des plantes adventices dans le blé de printemps en fonction des années d’échantillonnage (2017 et 2018); (b) Contenu en azote (N) minéral (NO3- et NH4+)
dans les parties aériennes des plantes adventices en fonction des années d’échantillonnage (2017 et 2018). Les différentes lettres dans un même graphique indiquent une différence significative entre les traitements selon une probabilité de P ≤ 0,05. ... 80
REMERCIEMENTS
Tout d’abord, mes premiers remerciements vont bien sûr à ma directrice, Caroline Halde, qui m’a donné l’opportunité de travailler sur un projet de recherche en lien avec un sujet qui me tient particulièrement à cœur, l’agriculture biologique. Je tiens à la remercier pour sa grande implication dans ce domaine qui, j’en suis convaincu, est d’une importance prioritaire pour l’avenir des générations futures. Merci pour tous tes conseils, ton temps et ta grande disponibilité, ton ouverture, ton positivisme et ta bonne humeur. Merci aussi pour la liberté, l’autonomie et la confiance que tu m’as accordées tout au long du projet, j’en suis franchement reconnaissant. Tout cela a fait en sorte que ces trois années passées sous ta direction ont été extrêmement formatrices d’un point de vue professionnel, mais aussi faciles et très agréables d’un point de vue relationnel.
Un énorme merci à ma codirectrice, Anne Vanasse, qui, par sa très grande expérience en recherche, a su apporter une aide précieuse et des commentaires extrêmement constructifs à la réalisation de ce travail. Ta bonne humeur, ta motivation, tes encouragements et ta passion pour l’agriculture et l’enseignement ont eu une influence certaine sur moi et ont grandement contribué au plaisir et à l’intérêt que j’ai eu à travailler sur ce projet.
Merci à Marie-Noëlle Thivierge, à Chantale Lachance et à toute l’équipe d’Agriculture et Agroalimentaire Canada pour l’aide et le temps consacré à ce projet. Sans vous, j’aurais passé un temps fou à laver des racines à la main, un travail long et pénible qui a été grandement facilité par votre aide, et par l’aide de votre superbe machine à laver les racines…
Je souhaite aussi remercier toutes les personnes qui ont contribué de près ou de loin à ce projet. Premièrement, toute l’équipe du Labo, Héloïse, Stéphanie, Audrey-Kim, Oupré Claude, Marihouma, Julie, Maude et tous ceux que j’oublie, pour les bons moments passés avec vous et pour l’aide que vous m’avez accordée. Ensuite, un grand merci à Francis Gagnon pour tout le travail que tu as fait à la ferme, sans jamais compter le temps passé à nous aider, et pour ta bonne humeur qui embellit et qui continuera à embellir nos journées. Merci aussi à Marie-Ève Giroux pour ton aide au champ, ton expérience et tes connaissances ont été d’une aide précieuse.
Pour terminer, merci à mon père et à ma mère qui m’ont toujours supporté tout au long de mes études, qui m’ont encouragé lors des moments plus difficiles et qui ont su m’apporter conseils lorsque j’en avais besoin. Merci tout particulièrement à Julie, ma copine, qui a toujours cru en moi et m’a redonné confiance dans les moments plus difficiles. Merci pour ta patience dans les moments de stress, pour ta compréhension et pour avoir su m’aider à surmonter les moments les plus difficiles. Sans oublier, merci pour ton temps, ta présence et pour les bons soupers, les boules d’énergie et les smoothies que tu as préparés pour t’assurer que je ne manque de rien dans mes périodes d’écriture de dernière minute!
INTRODUCTION
Au Canada, en 2016, plus de 20 000 producteurs agricoles ont déclaré avoir cultivé des cultures de couverture (CC) d’hiver sur leurs terres pour les divers services agronomiques et écologiques qu’elles apportent (Statistique Canada, 2018). Que ce soit pour limiter le lessivage des éléments nutritifs des sols (Tribouillois et al., 2015; Meisinger et Ricigliano, 2017), pour améliorer les propriétés physiques ou chimiques des sols (Blanco-Canqui et al., 2015) ou encore pour favoriser la croissance des cultures subséquentes (Coombs et al., 2017), les avantages des CC sont indéniables.
Tout comme l’incorporation au sol de la biomasse aérienne des CC peut favoriser l’augmentation du taux de matière organique et du contenu en azote (N) du sol (Rinnofner et al., 2008; Mazzoncini et al., 2011), leurs racines peuvent jouer des rôles substantiels sur plusieurs paramètres édaphiques. Elles peuvent entre autres stimuler l’activité des microorganismes du sol, apporter différents composés carbonés par leurs exsudats racinaires, favoriser l’infiltration de l’eau dans le sol et, pour certaines espèces, augmenter la quantité d’N disponible dans le sol de manière importante lors de leur décomposition (Kavdir et al., 2005). En étudiant les CC, des chercheurs ont démontré l’importance du rapport carbone/N (C/N) des différents tissus végétaux dans leur vitesse de minéralisation (Mohanty et al., 2011; Barel et al., 2018a) et l’impact de la biomasse produite sur leur potentiel fertilisant (Tautges et al., 2018). Cependant, comme les conditions environnementales, dont la température et les précipitations, sont des facteurs qui influencent la production de biomasse des végétaux et leur vitesse de minéralisation (Guntinas et al., 2012), il est difficile de prévoir l’effet que les CC auront sur la culture subséquente.
Comme les parties aériennes et racinaires des CC peuvent contribuer de manière différente à la nutrition azotée des cultures subséquentes, une meilleure compréhension du rôle respectif des différentes parties des CC est nécessaire. Dans un contexte québécois où les températures hivernales sont très froides et où la période de croissance des cultures est limitée, très peu d’études ont été réalisées pour quantifier ce phénomène. C’est donc dans ce but que cette étude a été réalisée.
CHAPITRE 1. REVUE DE LITTÉRATURE
1.1 LES CULTURES DE COUVERTURE
1.1.1 Quelques définitions et concepts
Dépendamment des auteurs et des articles, on retrouve dans la littérature une multitude de termes en lien avec les CC. Avant d’entrer dans le cœur du sujet de ce travail, il est important de bien définir ces différents termes pour éviter les confusions. Selon l’organisme Action Semis Direct, « une CC est une plante (ou un mélange de plantes) semée après ou pendant la croissance de la culture principale et dont le principal objectif est de couvrir le sol. Elle ne sera pas récoltée, mais retournée au sol afin de remettre en circulation les éléments nutritifs qu’elle avait captés ». Aussi, dépendamment de la période de l’année où ces CC sont semées, elles porteront différents noms. On appelle « cultures intercalaires » celles qui sont implantées durant la même période de croissance que la culture de rente alors que le terme « cultures en dérobée » est employé pour celles qui sont semées après la récolte de la culture de rente (Weill et Duval, 2009).
Selon Fageria (2007), le terme « engrais vert » définit tout matériel végétal qui est incorporé au sol au stade végétatif ou au stade de maturité. On utilise aussi ce terme pour désigner les CC dont l’objectif est d’améliorer la fertilité du sol et de fournir des éléments nutritifs à une culture subséquente (Fageria, 2007). Les plantes les mieux adaptées pour cette fonction sont celles de la famille des légumineuses (Thorup-Kristensen et al., 2003) à cause de leur capacité à utiliser l’azote de l’air pour leur croissance et à retourner cet azote dans le sol par leurs exsudats racinaires (Thilakarathna et al., 2016) et lors de leur décomposition. Ainsi, les engrais verts contribuent à augmenter les réserves d’azote disponibles dans le sol pour une culture subséquente.
On rencontre aussi parfois le terme « culture-abri » pour désigner une CC dont la fonction première est de protéger le sol contre l’érosion éolienne et hydrique (Canadian Organic Growers, 2001). Les graminées à croissance rapide sont particulièrement intéressantes pour cette fonction, car elles possèdent un système racinaire fasciculé et dense qui assure la cohésion du sol (OMAFRA, 2005).
Toujours dans le Canadian Organic Growers (2001), on retrouve le terme « tête d’assolement » pour désigner les CC qui limitent le développement des ravageurs, des maladies ou des mauvaises herbes. Ces cultures doivent préférentiellement appartenir à une famille différente de celle de la culture de rente pour éviter de servir d’hôte aux prédateurs indésirables. De plus, leur croissance se doit d’être rapide pour compétitionner avec les plantes adventices pour la lumière, l’eau et les nutriments.
Tout au long de ce mémoire, seul le terme « cultures de couverture » sera utilisé pour éviter les ambiguïtés et les nomenclatures trop complexes. En effet, comme les CC peuvent jouer plusieurs rôles en même temps (par exemple la protection du sol contre l’érosion, le recyclage des éléments nutritifs, la réduction de la croissance des mauvaises herbes), il serait embêtant d’avoir à distinguer à chaque fois le terme spécifique.
1.1.2 Bénéfices des cultures de couverture
L’utilisation des CC procure de nombreux bénéfices tant au niveau environnemental qu’au niveau agronomique et économique (Blanco-Canqui et al., 2015). C’est pour cette raison que leur utilisation est de plus en plus répandue, tant auprès des producteurs conventionnels que des producteurs biologiques (Cherr et al., 2006). En effet, selon Statistique Canada (2014), 23 % et 15 % des fermes au Québec et au Canada, respectivement, disaient avoir utilisé des CC en 2011.
1.1.2.1 Bénéfices environnementaux
Diminution du lessivage de l’azote
La diminution du lessivage de l’N par l’utilisation de CC est un phénomène bien documenté dans la littérature scientifique (McCracken et al., 1994; Ritter et al., 1998; Tribouillois et al., 2015). L’N étant un élément très mobile dans le sol, il est facilement lessivé lors des fortes pluies ou lors de la fonte des neiges, d’autant plus lorsque le sol est laissé à nu. Les CC en dérobée permettent de conserver cet élément en prélevant l’N résiduel de la culture précédente et en le stockant dans ses tissus.
Meisinger et al. (1991) ont compilé les résultats de plusieurs études traitant du lessivage des nitrates (NO3-N) et ont constaté un taux de réduction allant de 20 à 80 % avec l’utilisation de
CC durant l’hiver. Une autre étude a montré une réduction du lessivage des NO3-N de 95 %
lors d’une année sèche et de 50 % lors d’une année pluvieuse par l’utilisation de céréales comme CC. De plus, la diminution de ce lessivage était en corrélation avec l’augmentation de la biomasse des CC produite et leur contenu en N (Meisinger et al. 2017).
Le choix des CC est un élément fondamental à prendre en considération pour maximiser le recyclage de l’N. Selon Meisinger et al. (1991), les CC de la famille des graminées et des brassicacées ont une efficacité trois fois supérieure à celle des CC de légumineuses pour réduire le lessivage de l’N. Dans une étude réalisée au Kentucky, aux États-Unis (É-U), les auteurs ont mesuré la quantité de NO3-N lessivés durant l’hiver sous des CC de vesce velue
(Vicia villosa Roth.) et de seigle d’automne (Secale cereale L.). Pour toutes les années de l’étude, le seigle a été beaucoup plus efficace que la vesce pour réduire le lessivage des NO3
-N, même lorsque la biomasse sèche de la vesce était plus élevée que celle du seigle (McCracken et al., 1994). Les auteurs expliquent ce résultat par deux observations. Premièrement, le seigle établit son système racinaire beaucoup plus rapidement à l’automne, permettant ainsi une assimilation plus efficace de l’N résiduel dans le sol. Deuxièmement, le seigle reprend sa croissance après l’hiver trois à quatre semaines plus tôt que la vesce, ce qui permet encore une fois de prélever davantage d’N et de réduire son lessivage. Ainsi, l’établissement des CC tôt à l’automne permet un prélèvement optimal de l’N avant la période hivernale, ce qui aide à réduire son lessivage (Di et al., 2002).
L’utilisation de CC intercalaires entre les rangs d’une culture de rente exigeante en éléments nutritifs peut aussi limiter les pertes en N. Plusieurs études (Schroder et al., 1996; Hauugaard-Nielsen et al., 2003; Whitmore et al., 2007) ont observé une diminution du lessivage de cet élément dans les traitements avec des cultures intercalaires comparativement à ceux en monoculture. La complémentarité des systèmes racinaires des deux espèces favoriserait ainsi une utilisation maximale des éléments nutritifs et pourrait expliquer cette diminution des pertes en N (Kanwar et al., 2005). Hauggaard-Nielsen et al. (2001) ont étudié le développement spatial des racines de deux cultures en intercalaires, soit l’orge (Hordeum
vulgare L.) et le pois (Pisum sativum L.). En comparaison avec ces deux espèces cultivées
l’orge et augmentait la rapidité de développement latéral des racines pour les deux espèces. Ces phénomènes expliquent donc l’amélioration de l’utilisation des éléments nutritifs dans le sol par un tel système.
Diminution de l’érosion du sol
L’érosion du sol est une des causes majeures de la pollution aquatique due à l’augmentation de la concentration en sédiments dans l’eau (Gouvernement du Canada, 2018). En produisant une forte biomasse qui réduit la vitesse des vents et qui protège les agrégats du sol de l’impact des fortes pluies, les CC participent à la diminution de cette érosion (Dabney et al., 2001). En effet, l’énergie cinétique contenue dans les gouttes de pluie qui touchent au sol est principalement responsable de la perte de sol (Smith et al., 1990). L’évapotranspiration des CC augmente le potentiel d’infiltration de l’eau de pluie dans le sol, ce qui réduit aussi les pertes de sédiments par ruissellement (Dabney, 1998). Ce potentiel d’infiltration de l’eau est aussi augmenté par l’amélioration de la structure du sol par les CC.
Dans une étude réalisée dans le nord du Mississippi, les auteurs ont analysé la perte de sol dans des cultures de coton (Gossypium sp.) avec et sans CC d’hiver de vesce et de blé d’automne (Triticum aestivum L.) (Mutchler et al., 1990). Pour les traitements avec les CC, ils ont observé en moyenne une perte de sol de 20 t ha-1 an-1, comparativement à 74 t ha-1 an -1 pour les traitements sans CC. Une autre étude a montré une tendance similaire, passant
d’une perte de sol de 91,8 t ha-1 an-1 pour un sol nu à une perte de 0,7 t ha-1 an-1 pour un sol
continuellement couvert de pâturin des prés (Poa pratensis L.) (Miller, 1936). Zhu et al. (1989) ont mené une étude sur la réduction des pertes de sol dans une culture de soya (Glycine
max (L.) Merr.) par l’utilisation de CC d’hiver en dérobée. Ils ont comparé les résultats pour
les trois espèces de CC, soit la stellaire commune (SC) (Stellaria media L.), le pâturin du Canada (PC) (Poa compressa L.) et le brome des toits (BT) (Bromus tectorum L.) et pour le témoin sans CC. Ainsi, avec des CC de SC, de PC et de BT, ils ont obtenu respectivement une réduction de 96, 95 et 87 % de la valeur du sol perdu par le traitement témoin sans CC. Aussi, ils ont obtenu une très forte corrélation négative (r = -0,98) entre la perte de sol et le degré de couverture du sol par les CC. Les CC jouent donc un rôle fondamental dans le maintien de la couche arable des sols agricoles et dans la diminution de la pollution aquatique.
1.1.2.2 Bénéfices agronomiques et économiques
Par leur capacité à améliorer les propriétés chimiques, physiques et biologiques du sol (Fageria et al., 2005), les CC apportent d’incontestables bénéfices agronomiques aux cultures de rente. Malgré les coûts d’implantation, les connaissances nécessaires à leur bonne utilisation et les travaux supplémentaires requis pour leur gestion, l’utilisation des CC peut conduire à des bénéfices économiques pour les producteurs (Lu et al., 2000).
Amélioration de la structure du sol
L’amélioration de la structure du sol, caractérisée par la formation d’agrégats stables, est un processus qui résulte de l’organisation des particules du sol, de leur floculation et de leur cimentation (Duiker et al., 2003). La formation d’agrégats stables est entre autres influencée par le contenu en C organique du sol (COS), les microorganismes, les interactions ioniques et la présence des argiles et des carbonates (Bronick et al., 2004). Une étude menée sur une période de 15 ans a montré une augmentation de 10 % de la teneur en COS par l’utilisation répétée de CC de légumineuses par rapport à un témoin sans CC (Mazzoncini et al., 2011). Une autre étude menée par Schutter et al. (2002) a démontré le potentiel des CC d’hiver à augmenter la biomasse microbienne du sol. Ainsi, de par leur capacité d’augmenter le COS et l’activité des microorganismes, les CC ont un effet bénéfique sur la structure du sol (Liu et al., 2005). Une bonne structure du sol augmente la capacité de rétention en eau et en éléments nutritifs et favorise l’infiltration des racines en profondeur, influençant directement le rendement des cultures subséquentes (Bronick et al., 2004).
Décompaction du sol
La compaction du sol est un phénomène qui affecte négativement le rendement des cultures en limitant, entre autres, la circulation de l’air dans le sol, l’infiltration de l’eau dans le sol et en empêchant les racines de pénétrer en profondeur (Unger et al., 1994). L’implantation de CC peut aider à réduire ce problème par le développement de leur système racinaire (Reeves, 1994). En se décomposant, les racines des CC laissent des macropores dans le sol, ce qui permet aux cultures subséquentes de mieux se développer.
En comparant le rendement des plants de soya cultivés sur des sols compacts avec ou sans précédent de CC, Williams et al. (2004) ont montré que ces dernières réduisent les
conséquences négatives de la compaction des sols sur la croissance d’une culture de rente. Sur un site d’étude, le rendement du soya était significativement supérieur lorsqu’il était précédé d’un mélange de CC de radis fourrager (Raphanus sativus L.) et de seigle d’automne que lorsque le sol était laissé à nu pendant l’hiver. Pour expliquer ce résultat, les auteurs mentionnent entre autres les canaux laissés par les racines de radis fourrager qui ont pu faciliter le prélèvement de l’eau en profondeur par les racines de la culture de soya.
Diminution des mauvaises herbes
L’utilisation des CC pour limiter la croissance des mauvaises herbes est une pratique fréquemment rencontrée. Selon les études, plusieurs espèces remplissent bien cette fonction dont la vesce velue, le seigle (Teasdale et al., 1991; Johnson et al., 1993) et différentes variétés de trèfle (Trifolium spp.) (Hollander et al., 2007). Ce phénomène peut s’expliquer par l’altération des conditions propices à la germination des mauvaises herbes, dont le relâchement de composés allélopathiques (Creamer et al., 1996), la diminution de la température du sol, de son humidité (Fisk et al., 2001) et de la lumière qui y parvient (Teasdale et al., 1993a). En plus de limiter la germination des semences, les CC entrent en compétition avec les mauvaises herbes pour certaines ressources nécessaires à leur croissance dont la lumière, les nutriments et l’eau (Liebman et al., 2000; Fisk et al., 2001). Ainsi, la densité des CC et leur biomasse produite sont proportionnelles à leur potentiel de répression des mauvaises herbes (Upadhyaya et al., 2007). Ekeleme et al. (2003) ont étudié le potentiel de différentes CC de légumineuses pour la répression des mauvaises herbes dans la savane du Nigeria. Pour les deux années de leur étude, une corrélation négative a été observée entre le degré de couverture du sol par les CC et la densité des mauvaises herbes établies. Il a aussi été mentionné que la suppression des mauvaises herbes était optimale seulement pour les CC qui procuraient un couvert complet du sol.
Teasdale et al. (1993b) ont comparé l’effet d’un couvert de vesce velue vivant et mort sur la capacité de répression des mauvaises herbes. Semés comme CC d’hiver en automne, certains traitements ont été détruits à l’aide d’un herbicide au printemps suivant alors que d’autres ont été laissé intacts. À différents moments durant l’été, la densité et la biomasse des mauvaises herbes ont été déterminées pour chacun des traitements. Ainsi, les auteurs ont conclu que le couvert de vesce velue vivant supprimait les mauvaises herbes plus
efficacement et sur une plus longue période que le couvert de vesce velue mort. Selon eux, ce résultat peut s’expliquer par une plus grande capacité à intercepter le rayonnement solaire et par une diminution de l’amplitude thermique du sol durant le jour.
Dans une autre étude, Creamer et al. (1996) ont voulu étudier le mécanisme de suppression des mauvaises herbes par différentes CC. Par une expérience effectuée en laboratoire, ils ont montré que des composés allélopathiques issus du lixiviat de la paille de seigle inhibaient la germination des semences de laitue. Une autre expérience menée cette fois au champ consistait à recouvrir des semences de mauvaises herbes avec des résidus végétaux issus de différentes espèces de CC. Pour toutes les espèces, la moitié des résidus avaient été simplement séchés alors que pour l’autre moitié, le lixiviat des résidus avait été extrait. Ainsi, il était possible de dissocier l’effet physique du couvert végétal de l’effet allélopathique du lixiviat des résidus de CC sur la germination des mauvaises herbes. Cette expérience a démontré que le simple effet physique créé par l’application de résidus parvenait à limiter la germination des mauvaises herbes, résultat qui justifie l’utilisation des CC pour l’obtention de ce bénéfice.
À la lumière des résultats, le rôle des CC dans la suppression des mauvaises herbes est indéniable si les techniques culturales et les espèces de CC sont choisies convenablement.
Fourniture en N par les CC de légumineuses
L’utilisation des CC de la famille des légumineuses permet d’augmenter la quantité d’N du sol sans apport d’origine anthropique. C’est le processus que l’on appelle « fixation symbiotique de l’N atmosphérique » qui permet cet apport. Ce phénomène sera discuté plus en détail dans le chapitre intitulé « processus de transformation de l’azote ». Ainsi, cette « fixation » permet aux CC de légumineuses de croître en dépendant moins de l’N présent dans le sol. Durant leur croissance et leur décomposition, ces cultures fournissent une source d’N considérable pour les cultures suivante, processus bien documenté dans la littérature scientifique (Blevins et al., 1990; Thorup-Kristensen et al., 2003; Rinnofner et al., 2008; Thilakarathna et al., 2016). Il a été démontré que l’N contenu dans différentes CC de légumineuses issu de la fixation biologique variait de 78 à 128 kg N ha-1 (Li et al., 2015).
pour une culture d’orge subséquente, variait de 16 à 23 kg N ha-1. Le rôle que ces cultures
ont dans l’augmentation de la quantité d’N du sol est donc très important.
En Ontario, Coombs et al. (2017) ont étudié l’impact de différentes espèces de CC de légumineuses (trèfle incarnat (Trifolium incarnatum L.), trèfle rouge (Trifolium rubens L.) et luzerne), de leur taux de semis (3,4; 6,7 et 13,5 kg ha-1) ainsi que de leur date d’enfouissement
(à l’automne ou au printemps) sur la productivité du maïs (Zea mays L.) non fertilisé. L’étude comportait aussi un témoin sans CC dans lequel le maïs avait été fertilisé à des doses de 0, 112 et 224 kg N ha-1. En ce qui concerne le rendement en grain du maïs, pour les quatre
sites/années de l’étude, il n’y a pas eu de différence significative entre les traitements de trèfle rouge et de luzerne au plus haut taux de semis et le traitement sans CC fertilisé au taux de 112 kg N ha-1. Seul le traitement de trèfle incarnat a impacté négativement le rendement
du maïs comparativement au témoin sans fertilisant, ce qui serait dû à une trop faible production de biomasse par la CC. Les traitements de trèfle rouge et de luzerne ont aussi donné des rendements significativement semblables au traitement sans CC fertilisé au taux de 224 kg N ha-1 pour trois des quatre sites/années de l’étude. De plus, les auteurs ont noté
que l’incorporation des CC au printemps favorisait les rendements en grain du maïs par rapport à l’incorporation des CC à l’automne. Ainsi, on constate que l’utilisation de CC peut fournir une quantité d’N équivalente à ce que fournissent les engrais minéraux.
Holderbaum et al. (1990) ont mené une étude dans le Maryland (É-U) pour étudier l’effet d’un précédent de différentes espèces de CC de légumineuses (trois espèces de vesce, du pois et du trèfle) sur les rendements d’une culture subséquente de maïs. Un traitement sans CC servait de témoin. Les CC ont été semées à l’automne 1983 et 1984 et ont été détruites à l’aide d’un herbicide au printemps suivant, avant le semis du maïs. Du maïs a été semé au printemps dans chacun des traitements et la moitié de chaque parcelle a été fertilisée avec une dose de 90 kg N ha-1 au stade 5-7 feuilles du maïs. Pour l’année 1984, les traitements de
deux espèces de vesce sans fertilisant ont fourni des rendements en grain du maïs significativement plus élevés que le traitement sans CC fertilisé alors que pour les autres traitements de CC, les résultats étaient soit significativement semblables ou soit inférieurs au maïs fertilisé sans CC. Ces résultats montrent bien la capacité des CC à contribuer au bon rendement des cultures de rente par leur apport en N et par leur capacité à recycler cet élément.
1.1.3 Espèces utilisées comme cultures de couverture
Les producteurs agricoles intègrent une grande variété d’espèces de CC dans leurs systèmes culturaux pour obtenir différents bénéfices spécifiques. Comme chaque espèce de CC possède des caractéristiques chimiques et physiques qui leur sont propres, il est important de les caractériser pour pouvoir mieux évaluer leur potentiel de minéralisation et ainsi être en mesure de choisir la bonne espèce en fonction des conditions environnementales et des bénéfices escomptés. Puisque les CC étudiées dans la présente étude sont le pois fourrager, le seigle d’automne, le radis fourrager et la vesce commune, ces quatre espèces seront celles visées dans la section qui suit. Une courte description générale de la culture sera d’abord présentée, alors que différentes données issues de la littérature scientifique portant sur la biomasse et sur la concentration en N et en C de leurs parties aériennes et racinaires seront ensuite exposées. Finalement, quelques résultats d’expériences portant sur la minéralisation des résidus de ces quatre espèces de CC seront présentés.
1.1.3.1 Pois fourrager
Description générale et historique d’utilisation
Le pois est une plante annuelle de la famille des légumineuses. Au Canada, en 2018, près d’un million et demi d’hectares y ont été récoltés (Statistiques Canada, 2018), ce qui en fait une culture importante. Il est cultivé autant pour la consommation humaine que pour l’alimentation animale, mais il est aussi fréquemment utilisé en tant qu’engrais vert pour améliorer la fertilité des sols (Mooleki et al., 2016; Stagnari et al., 2017; Tautges et al., 2018).
Caractéristiques chimiques et physiques des parties aériennes et racinaires
Comme on retrouve très peu d’information dans la littérature sur les racines de CC de pois au stade végétatif, les études portant sur le pois à maturité seront citées dans cette section seulement pour caractériser les parties racinaires. Le pois fourrager est connu pour avoir une courte période végétative (Vasileva, 2015), une croissance rapide et une production élevée de biomasse aérienne. Dans une étude réalisée en Suisse, sur 19 espèces de légumineuses cultivées durant trois mois, la biomasse aérienne du pois (4 500-5 500 kg ha-1) était la
albus L.), dépendamment de l’année de l’expérience (Buchi et al., 2015). Jensen (1987) a
obtenu un rendement en biomasse aérienne similaire dans le pois au stade de pleine floraison, soit 56 jours après le semis, avec une valeur d’environ 5 000 kg ha-1. Finalement, dans une
étude menée en Caroline du Nord, du pois a été semé comme CC d’hiver de la fin septembre jusqu’au début du mois de mai. Avant son incorporation au stade de floraison, les auteurs ont noté une biomasse aérienne variant de 6 100 à 6 500 kg ha-1 dépendamment des sites (Jani et
al., 2015).
En ce qui concerne la biomasse racinaire du pois, Williams et al. (2013) ont obtenu, à maturité, des valeurs allant de 310 à 370 kg ha-1, dépendamment des sites, pour une
profondeur de 0 à 40 cm. Ils ont aussi noté que 70 % de cette biomasse racinaire se trouvait dans les 18 premiers cm du sol. Kwabiah et al. (2005) ont aussi obtenu des valeurs de biomasse racinaire moyenne de 370 kg ha-1 au stade d’anthèse du pois pour une profondeur
allant jusqu’à 30 cm. Cependant, certaines études montrent des valeurs beaucoup plus élevées que celles citées précédemment. Par exemple, dans l’étude réalisée par Jani et al. (2015), les auteurs ont obtenu une biomasse racinaire de 1 700 kg ha-1 pour une CC de pois. Jensen
(1987) a aussi obtenu une biomasse racinaire variant de 990 à 1 190 kg ha-1 pour la strate
0-15 cm et de 320 à 410 kg ha-1 pour la strate 15-30 cm selon les différents traitements de
fertilisation lors d’un échantillonnage effectué à la fin de la période de floraison.
Comme il peut être difficile pour un producteur de mesurer avec précision la biomasse racinaire d’une espèce de CC, certains chercheurs ont déterminé, pour différentes espèces, un taux correspondant au rapport de la biomasse aérienne sur la biomasse racinaire (A/R). Ainsi, Vasileva (2015) a calculé un rapport A/R pour le pois fourrager d’une valeur moyenne de 5,52. Dans l’étude de Kwabiah et al. (2005), leur rapport A/R moyen calculé était plutôt de 10,8, en prenant la valeur de la biomasse aérienne à maturité du pois et la valeur de la biomasse racinaire au stade d’anthèse. En effet, selon Campbell et al. (1977), la biomasse racinaire atteint sa valeur maximale à la période de l’anthèse et commence à décroître par la suite alors que la biomasse aérienne atteint son maximum à maturité des plants. En déterminant le rapport A/R de cette manière, l’évaluation de la dynamique du C et de l’N des résidus de culture, en fonction de leur biomasse produite, peut s’avérer plus représentative de la réalité.
Pour ce qui est de la concentration en C des parties aériennes d’une CC de pois, Verville (2014) a obtenu des valeurs variant entre 43 % et 45 % et pour la concentration en N, des valeurs variant entre 4,0 % et 5,7 %. Dans cette étude, selon les années et les sites, les rapports C/N variaient entre 7,9 et 11,4. Dans son projet de maîtrise, Langelier (2018) a aussi obtenu des concentrations en N, dans les parties aériennes, variant entre 4,4 % et 4,8 % et des rapports C/N entre 7,8 et 9,3 pour des CC en dérobée de pois. Dans une étude menée en France, le contenu en N dans les racines de pois mature pour une année variait entre 1,77 % et 1,90 % selon la fertilisation (Voisin et al., 2002).
Minéralisation des résidus de culture
Dans la littérature, on retrouve très peu d’informations sur la minéralisation des résidus de CC de pois. Ainsi, une étude sur le pois mature sera présentée, mais il est bon de garder en tête que la vitesse de minéralisation des résidus à un stade physiologique moins avancé, comme c’est le cas pour les résidus de CC enfouis, serait probablement différente. Jensen (1994) a étudié la décomposition des résidus de pois mature (contenant 2,5 % de N) marqués à l’15N, incorporés dans le sol, sur une période de trois ans. Avant leur incorporation, les
résidus ont été broyés soit à une grosseur de 10 mm (expérience 1), soit à une grosseur inférieure à 3 mm (expérience 2). Ainsi, 10 jours après l’incorporation au sol des résidus, une perte de 28 % de l’N organique marquée a été observée pour l’expérience 1 alors que l’N inorganique marquée correspondait à 18 % de l’azote inorganique totale du sol. Durant cette même période, pour l’expérience 2, 22 % de l’N des résidus marqués à l’15N a été incorporé
dans la biomasse microbienne du sol. Selon l’auteur, la perte initiale d’N organique correspond à la minéralisation des résidus et au transport de l’N dans les couches plus profondes du sol. Durant la première année de décomposition, l’N organique résiduelle marquée a diminué dans le sol avec un taux de 44 % année-1 alors qu’il diminuait au taux de
1.1.3.2 Seigle d’automne
Description générale et historique d’utilisation
Le seigle d’automne est une céréale annuelle très résistante au gel hivernal. C’est entre autres pour cette raison qu’il est cultivé de manière importante au Canada, soit sur plus de 130 000 hectares à l’automne 2017 (Statistique Canada, 2018). Le seigle est utilisé pour l’alimentation humaine et animale, mais aussi comme CC d’hiver. Puisque la plante ne meurt pas durant la période hivernale, c’est une espèce intéressante pour limiter le lessivage des éléments nutritifs durant cette période.
Caractéristiques chimiques et physiques des parties aériennes et racinaires
Avec une hauteur à maturité qui peut atteindre de 1,2 à 1,5 m (Hayes et al., 2005), le seigle d’automne est une culture qui peut produire une forte biomasse si la période de croissance est adéquate. Au Danemark, une biomasse aérienne moyenne de 2 100 kg ha-1 a été obtenue
pour une CC de seigle d’automne semée au début du mois d’août et échantillonnée à la mi-novembre (Thorup-Kristensen, 2001). Dans différents sites en Iowa aux États-Unis, Pantajo et al. (2016) ont étudié la production de biomasse du seigle d’automne semé entre le 17 septembre et le 29 octobre et récolté entre le 19 avril et le 8 mai de l’année suivante, dépendamment des sites et des précédents culturaux (maïs ou soya), dans un système de rotation maïs – seigle d’automne – soya (M-SA-S) ou soya – seigle d’automne – maïs (S-SA-M). Sans fertilisation, la biomasse aérienne du seigle obtenue suite à une culture de soya variait entre 700 et 1 100 kg ha-1 alors que celle obtenue suite à une culture de maïs variait
entre 500 et 1 900 kg ha-1. Selon les auteurs, la variabilité des rendements du seigle ayant eu
le même précédent cultural est due aux températures printanières plus fraîches de certains sites. En moyenne, les rendements de biomasse du seigle dans le système de rotation M-SA-S étaient de 10 % plus élevés que ceux dans le système M-SA-S-M-SA-SA-M à cause de la période de destruction plus tardive du seigle dans le premier système. Dans une autre étude menée dans l’Illinois, du seigle d’automne semé entre le 1er et 5 octobre et détruit entre le 28 avril et le 4
mai dépendamment des sites et des années a donné des biomasses allant de 2 900 à 4 700 kg ha-1 (Ruffo et al., 2003).
Le seigle est une graminée réputée pour avoir un système racinaire fasciculé dense. Thorup-Kristensen (2001) a étudié le développement racinaire de différentes espèces de CC semées
entre le 31 juillet et le 5 août, dépendamment des années, et analysées à la mi-novembre. Après ces trois mois et demi de croissance, il a noté une biomasse racinaire moyenne du seigle d’automne de 1 000 kg ha-1 pour une profondeur allant jusqu’à 0,2 m. Dans une autre
étude menée en Géorgie, Sainju et al. (2005) ont étudié la biomasse racinaire produite par différentes CC pour une période de croissance allant des mois d’octobre ou novembre, dépendamment des années, jusqu’au mois d’avril de l’année suivante. Pour une profondeur allant jusqu’à 1,2 m, les auteurs ont obtenu des biomasses racinaires moyennes allant de 170 jusqu’à 770 kg ha-1, pour tous les traitements de fertilisation et de travail du sol confondus.
Dans l’état de Washington, aux États-Unis, pour un seigle d’automne semé durant la première semaine d’octobre et analysé le 24 avril ou le 5 mai de l’année suivante, dépendamment des années (peu avant le stade d’épiaison), la biomasse racinaire obtenue variait entre 1 280 et 3 940 kg ha-1 pour les 20 premiers cm de profondeur (Kuo et al., 1997).
Il est bien connu dans la littérature scientifique que les graminées en général, incluant le seigle d’automne, ont une concentration en N dans les parties aériennes et racinaires relativement faible, du moins inférieure aux légumineuses (Kuo et al., 1997; Sainju et al., 2002; Barel et al., 2018a). Ainsi, dans l’étude de Pantajo et al. (2016), les auteurs ont noté, pour les parties aériennes du seigle, un rapport C/N moyen de 14 pour tous les sites avec comme précédent cultural le soya et un rapport C/N moyen variant de 15 à 28 pour tous les traitements de fertilisation, dépendamment des sites, avec comme précédent cultural le maïs. Un résultat similaire a été obtenu par Kuo et al. (1998) pour le rapport C/N des parties aériennes de seigle au stade végétatif avec une valeur de 23. Pour un seigle analysé peu avant le stade d’épiaison, Kuo et al. (1997) ont obtenu des rapports C/N des parties aériennes de 32 et de 37 et des rapports C/N des parties racinaires de 62 et de 64, selon l’année. Finalement, Sainju et al. (2005) ont calculé un rapport C/N moyen variant de 29 à 57 pour les parties aériennes et de 33 à 45 pour les parties racinaires.
Minéralisation des résidus de culture
En serre, dans des bacs, Snapp et al. (2005) ont comparé la vitesse de minéralisation de l’N provenant des résidus de CC de seigle détruits selon trois traitements différents (à l’aide d’un herbicide, à l’aide de la coupe des parties aériennes à 1 cm du sol et aucune destruction) et incorporés au sol sur une profondeur de 19 cm. Un bac de sol sans résidus de culture était
aussi présent dans l’expérience. Les auteurs ont noté une minéralisation des résidus de CC de seigle plus rapide pour les deux traitements détruits que pour le traitement non détruit. Pour tous les traitements, le niveau d’N inorganique était maximal après trois semaines suite à l’incorporation des résidus. Pour toutes les observations réalisées sur une période de 39 jours, le contenu d’N inorganique dans le sol était plus faible pour le traitement non détruit que pour le sol sans résidus de culture, ce qui suggère une immobilisation d’N (le phénomène d’immobilisation d’N sera expliqué à la section 2.2.4). Pour le seigle détruit à l’aide de l’herbicide, le contenu en N du sol 20 jours après l’incorporation des résidus était deux fois plus élevée que le contenu d’N du sol sans culture.
1.1.3.3 Radis fourrager
Description générale et historique d’utilisation
Le radis fourrager est une espèce annuelle appartenant à la famille des brassicacées qui possède une croissance rapide en automne (Lawley et al., 2011; White et al., 2011). En plus d’être cultivé pour l’alimentation animale, il est fréquemment utilisé pour décompacter les sols (Chen et al., 2010), pour éviter le lessivage des éléments nutritifs en fin de saison (Dean et al., 2009) et pour diminuer la pression des plantes adventices durant l’automne et le printemps (Lawley et al., 2012).
Caractéristiques chimiques et physiques des parties aériennes et racinaires
Lorsque le radis fourrager bénéficie d’une assez longue période de croissance durant l’automne, il peut produire une biomasse élevée (Jahanzad et al., 2016). Dans une étude réalisée dans l’état du Maryland, Lawley et al. (2011) ont semé du radis fourrager entre la fin août et le début septembre. Entre le 6 et le 21 novembre, dépendamment des sites et des années, la biomasse aérienne du radis fourrager variait entre 2 200 et 6 700 kg ha-1. Au
Massachussetts, aux États-Unis, pour du radis fourrager semé entre le 25 et le 28 août, Jahanzad et al. (2016) ont obtenu une biomasse aérienne moyenne de 3 500 kg ha-1
lorsqu’échantillonnée à la fin novembre. Finalement, dans une autre étude menée dans le Maryland, White et al. (2011) ont échantillonné du radis fourrager lorsqu’il était au maximum de sa production de biomasse. Pour un semis réalisé entre le 27 août et le 12 septembre et un
échantillonnage réalisé entre le 31 octobre et le 15 novembre, dépendamment des années/sites, les auteurs ont obtenu des rendements de biomasse aérienne de radis fourrager allant de 1 300 à 4 200 kg ha-1.
Une des caractéristiques du radis fourrager pour laquelle il est fréquemment utilisé est la grosseur de sa racine, donc pour sa production de biomasse racinaire élevée. Dans l’étude menée par Lawley et al. (2011), les auteurs ont obtenu des biomasses racinaires allant de 800 kg ha-1 (période de croissance la plus courte de toutes les années/sites de l’expérience) à 3
200 kg ha-1. Pour l’expérience de White et al. (2011) citée plus haut, les résultats de la
biomasse racinaire obtenus variaient de 900 à 1 200 kg ha-1. Une étude réalisée dans le
Maryland, aux États-Unis, a donné des résultats de biomasse racinaire variant entre 1 400 et 3 800 kg ha-1 (Dean et al., 2009). Selon les auteurs, le rapport de la biomasse aérienne par
rapport à la biomasse racinaire varie de 5:1 à 1:1, dépendamment des espèces de brassicacées utilisées. De plus, il est noté que la portion racinaire hors sol du radis fourrager correspond à une valeur de 10 à 50 % de la biomasse racinaire totale (Dean et al., 2009).
Pour ce qui est du contenu en N des parties aériennes du radis fourrager, Jahanzad et al. (2016) ont obtenu une valeur moyenne de 2,79 % avec un rapport C/N moyen de 12 pour les deux années de l’étude. Quant à Dean et al. (2009) cités plus haut, ils ont obtenu un pourcentage de N dans les parties aériennes variant de 1,86 % à 3,93 % et de 1,15 % à 3,12 % dans les parties racinaires selon les années et les sites de l’étude. Dans une étude menée en chambre de croissance, le pourcentage d’N du radis fourrager était de 1,11 % dans les parties aériennes et de 1,82 % dans les parties racinaires (Lainé et al. (1993).
Minéralisation des résidus de culture
Une étude au champ a été menée dans l’état du Massachusetts aux États-Unis pour étudier la décomposition du radis fourrager, du pois fourrager et du seigle dans des sacs de décomposition placés à la surface du sol ou enfouis dans le sol (Jahanzad et al., 2016). Il est à noter que pour les sacs enfouis dans le sol contenant le radis fourrager, le contenu correspondait aux parties aériennes et à la racine pivotante alors que pour les autres espèces, les sacs contenaient seulement les parties aériennes. Tout d’abord, pour toutes les espèces de CC, les sacs placés sur le sol ont préservé leur contenu en N plus longtemps que les sacs enfouis dans le sol. Six semaines après l’enfouissement dans le sol des sacs de
décomposition, les auteurs ont noté une perte de 70 % du contenu initial en N du radis fourrager comparativement à 62 % pour le pois et 40 % pour le seigle. Ils ont aussi observé une diminution plus rapide du contenu en N des résidus enfouis lors des premières semaines de l’expérience. Finalement, 12 semaines après l’enfouissement du radis fourrager, il ne restait que 14 % du contenu en N initial dans les tissus (Jahanzad et al., 2016).
Dans une expérience d’incubation menée en laboratoire, les auteurs ont étudié la vitesse de minéralisation des parties aériennes du radis fourrager incorporées dans le sol à des températures de 2 °C et de 10 °C (Thomson et al., 2016). Durant le premier mois d’incubation, la vitesse de minéralisation de l’N pour les deux températures était semblable. Par contre, après 7 mois, le taux de minéralisation était supérieur pour le traitement à 10 °C par rapport au traitement à 2 °C. Ainsi, à la fin du septième mois, 50 % de l’N initial avait été minéralisé pour le traitement à 10 °C comparativement à 40 % pour le traitement à 2 °C. Ces résultats montrent bien qu’une température élevée du sol favorise la minéralisation des résidus de CC.
1.1.3.4 Vesce commune
Description générale et historique d’utilisation
La vesce commune (Vicia sativa L.) est une plante annuelle de la famille des légumineuses. Elle est connue dans la littérature scientifique pour avoir une croissance rapide et pour résister aux températures froides (Weill et Duval, 2009), sans toutefois survivre au gel hivernal du Québec.
Caractéristiques chimiques et physiques des parties aériennes et racinaires
En Turquie, Isik et al. (2009) ont semé de la vesce commune en tant que CC d’hiver le 2 novembre 2004 et le 14 novembre 2005. Avant de détruire et d’incorporer la culture le 4 mai 2005 et le 16 mai 2006, soit au stade de floraison, les auteurs ont mesuré une biomasse des parties aériennes de 2 500 et de 3 000 kg ha-1. Dans une autre étude menée en Turquie, Sincik
et al. (2008) ont semé de la vesce commune, de la féverole et du blé d’automne comme CC entre le 23 octobre 2003 et le 28 octobre 2004. Lors du semis des CC, chaque espèce a reçu une dose de 45 kg ha-1 d’N, de phosphore et de potassium. À l’échantillonnage, soit au stade
de pleine floraison, la biomasse aérienne de la vesce commune était de 2 500 kg ha-1 en 2005
et de 2 100 kg ha-1 en 2006. Une étude menée en Suisse visait à étudier différentes
caractéristiques des parties aériennes et racinaires de 20 espèces de CC, dont la vesce commune (Wendling et al., 2016). Les CC ont été semées au début du mois d’août et la vesce a été échantillonnée à la fin du mois d’octobre, lorsqu’elle était au stade végétatif. Ainsi, les auteurs ont obtenu une biomasse aérienne de 4 600 kg ha-1. Finalement, pour de la vesce
commune arrivée à la fin du stade de floraison, Montemurro et al. (2013) ont obtenu une biomasse aérienne variant entre 5 600 et 6 900 kg ha-1 dépendamment des traitements et des
années.
Comme la grande majorité des légumineuses annuelles, la vesce commune est connue pour avoir un système racinaire peu développé, donc une faible biomasse racinaire, en comparaison avec les graminées annuelles ou les plantes vivaces. En effet, dans l’étude de Sincik et al. (2008) citée plus haut, les auteurs ont noté une valeur moyenne de biomasse racinaire pour les deux années de l’étude de 120 kg ha-1. Dans l’étude de Thorup-Kristensen
(2001) citée plus haut, pour une période de croissance de trois mois et demi, la biomasse racinaire moyenne obtenue pour deux années d’étude était de 600 kg ha-1 pour une
profondeur allant jusqu’à 20 cm. Pour un échantillonnage racinaire réalisé sur une profondeur de 50 cm, Wendling et al. (2016) ont obtenu une biomasse de 750 kg ha-1. Finalement, dans
l’étude de Sainju et al. (2005), les auteurs ont obtenu une biomasse racinaire de vesce commune variant entre 140 et 650 kg ha-1 pour une profondeur de 120 cm, et ce, selon les
années et les dates de semis et d’échantillonnage.
Pour ce qui est de la concentration en N de la vesce commune, tout comme les autres légumineuses, elle est connue pour être relativement élevée par rapport aux graminées. Dans une étude menée en Géorgie aux États-Unis (Hargrove, 1986), la concentration en N des parties aériennes a été mesurée sur de la vesce commune semée entre le 13 octobre et le 21 novembre, dépendamment des années, et échantillonnée vers la fin mai de l’année suivante. En moyenne, la concentration en N pour les trois années de l’étude était de 3,11 %. Pour l’étude de Wendling et al. (2016), les auteurs ont noté une concentration en N dans les parties aériennes de 3,59 % avec un rapport C/N de 12,4. Dans cette même étude, la concentration en N obtenue dans les parties racinaires était plus faible (2,81 %) et le rapport C/N était plus élevé (13,4) que dans les parties aériennes.
Minéralisation des résidus de culture
Une étude a été menée en chambre de croissance pour étudier la dénitrification et la minéralisation de l’N des résidus de seigle et de vesce velue (Rosecrance et al., 2000). Les plants ont été cultivés en chambre de croissance sur une période de 73 jours avant d’être détruits par un herbicide. Neuf grammes de matériel végétal sec ont ensuite été appliqués sur la surface d’un sol placé dans des tubes d’aluminium, permettant ainsi de collecter l’eau de ruissellement sous ces tubes. Tout d’abord, avec un rapport C/N de 10,3 pour la vesce et de 21,4 pour le seigle, les auteurs ont noté une minéralisation nette de l’N pour la vesce et une immobilisation nette pour le seigle 55 jours après leur destruction. Ils ont aussi observé une quantité plus importante d’N dans l’eau de ruissellement des traitements de vesce que celle des traitements de seigle (84 mg de N par tube vs. 10 mg de N par tube, respectivement). En mesurant la quantité de N2O émis dans les tubes 5, 20 et 55 jours après la mort des plants,
les auteurs ont noté que la perte en N par dénitrification avait été maximale dans le traitement de vesce velue cinq jours après sa destruction. Pour ce qui est du lessivage des nitrates, peu de pertes ont été observées 5 et 15 jours après la destruction des cultures alors qu’après 55 jours, ces pertes étaient importantes pour la vesce (et non pour le seigle). Ainsi, les auteurs résument ces résultats en disant que la dénitrification de la vesce est importante peu de temps après sa destruction (après 5 et 15 jours) alors qu’elle est moins importante après 55 jours.
1.2 LES PROCESSUS DE TRANSFORMATION DE L’AZOTE
L’N est l’élément essentiel pour les organismes que l’on retrouve dans le sol sous la plus grande diversité de formes. Une grande quantité de cet N est contenue dans les différentes structures des organismes qui y habitent, sous forme organique. Par exemple, il est un constituant important des acides aminés, structure de base des protéines, et des bases nucléiques de l’ADN de tout êtres vivants. On peut aussi retrouver l’N dans le sol sous huit formes inorganiques. Dans l’atmosphère du sol, il est le plus abondant sous la forme de diazote (N2), mais est aussi présent sous forme d’ammoniac (NH3), d’oxyde nitreux (N2O),
de dioxyde d’N (NO2) ou de monoxyde d’N (NO). En solution dans le sol, on trouve trois
3-) (Paul, 20073-). Dans un contexte de production agricole, il est donc important de connaître les différentes formes de l’N pouvant être utilisées par les plantes et leurs processus de transformation.
1.2.1 Cycle de l’azote
L’N est le constituant majoritaire de l’atmosphère avec une concentration de 78 % (Francis et al., 2007). Son entrée dans le sol ou dans les organismes vivants est assurée par un processus qui peut être abiotique ou biotique, symbiotique ou non symbiotique, et que l’on nomme « fixation ». L’activité de certains microorganismes transforme l’N contenu dans la matière organique en une forme soluble, utilisable par les plantes. Ce processus se nomme la minéralisation de l’N. À partir de cette étape, le chemin que l’N entreprend dépend d’une multitude de facteurs. D’une part, il peut être réutilisé et stocké par d’autres organismes, phénomène que l’on appelle « immobilisation » ou « faim d’N ». D’une autre part, l’N peut être dénitrifié, c’est à dire retransformé sous forme gazeuse, et ainsi retourner à son point de départ, dans l’atmosphère. La section suivante détaille ces différents processus pour mettre en évidence leur complexité et leur importance dans la vie de tous les organismes.
1.2.2 Fixation de l’azote atmosphérique
1.2.2.1 Généralités et diversité des processus
La fixation de l’N est un processus par lequel l’N moléculaire (N2) se fait réduire en N
ammoniacal (NH3), lequel est ensuite utilisé par les organismes vivants pour la synthèse de
plusieurs composés (Taiz et al., 2015). Environ 106 t de N sont fixés annuellement par les
différents processus biotiques et abiotiques. De cette quantité, les éclairs sont responsables d’environ 10 à 15% de la fixation, le procédé industriel Haber-Bosch, utilisé pour la fabrication des engrais minéraux azotés, compte pour environ 25 % et la fixation biologique représente environ 60 % de la quantité annuelle d’N fixée (Zahran, 1999; Gage, 2004). La fixation biologique, effectuée exclusivement par les organismes du groupe des procaryotes (Arora et al., 2013), est donc le principal processus responsable de l’apport en N dans le sol, lequel pourra être prélevé par les plantes. Parmi ces organismes responsables de la fixation
biologique, certains vivent librement dans le sol et effectuent la fixation de manière indépendante alors que d’autres dépendent exclusivement d’hôtes pour y parvenir (Arora et al., 2013). Leur capacité à fixer l’N de l’air provient de l’activité d’un complexe d’enzymes, les nitrogénases, synthétisées par ces organismes. Les différentes réactions qui assurent cette fonction nécessitent une grande quantité d’énergie (Zahran, 1999). Ainsi, pour combler leur besoin énergétique élevé, les différents microorganismes fixateurs de N2 ont développé des
stratégies leur permettant un accès rapide à une source d’énergie/C. Par exemple, les organismes libres (non dépendants d’un hôte) les plus efficaces sont photosynthétiques ou vivent dans la rhizosphère des plantes, endroit très riche en C labile. Aussi, d’autres microorganismes fixateurs entrent en symbiose avec un hôte photosynthétique, comme c’est le cas chez des bactéries du genre Rhizobium qui entrent en symbiose avec les plantes de la famille des légumineuses (Paul, 2007). Ainsi, puisque les légumineuses sont largement utilisées comme CC et qu’elles jouent un rôle primordial dans la fertilisation azotée des cultures, le mécanisme de cette fixation symbiotique sera expliqué dans la section suivante.
1.2.2.2 Fixation de N
2par la symbiose rhizobium-légumineuse
La fixation symbiotique de l’N atmosphérique par les Rhizobia est un phénomène issu d’une symbiose entre ce type de bactéries et les plantes de la famille des légumineuses. Pour le microorganisme, l’avantage de cette relation vient de la source constante d’énergie, les produits de la photosynthèse, fournie par la plante alors que pour cette dernière, l’avantage vient de l’apport en N fixé par la bactérie à partir de l’atmosphère (Lodwig et al., 2003). Les rhizobia se caractérisent comme étant des bactéries du sol capables de pénétrer, avec l’aide de la plante hôte, les tissus racinaires et les nodules des végétaux de la famille des légumineuses (Arora et al., 2013). Étant particulièrement dépendantes de cette symbiose, ces bactéries acquièrent leur capacité fixatrice seulement lorsqu’elles ont rencontré leur partenaire. De plus, cette dépendance est dite « spécifique », car une espèce de bactérie en particulier ne peut entrer en symbiose qu’avec une ou quelques espèces spécifiques de légumineuses.
L’initiation de cette symbiose commence par la reconnaissance et par l’attachement du rhizobium avec un poil absorbant racinaire de la plante. À l’état initial, les rhizobia sont des