UNIVERSITE DE BRETAGNE OCCIDENTALE
FACULTE DE MEDECINE DE BREST
*****
Année 2017 N°
THESE DE DOCTORAT EN MEDECINE
DIPLOME D’ETAT
Par
Monsieur PADELLI Maël Né le 10 avril 1985 à Vannes
Présentée et soutenue publiquement le 4 avril 2017
INTERET DE LA RECHERCHE D’UNE
HYPOPHOSPHOREMIE AU COURS DU SEPSIS
Président : Monsieur le Professeur Jean-Luc CARRE
Membres du Jury : Madame le Professeur Cécile AUBRON
Monsieur le Professeur Jean-Marie BARD
Remerciements
À Monsieur le Professeur Jean-Luc Carré,
Je vous remercie de m’avoir fait confiance et de me faire l’honneur de présider ma soutenance de thèse.
À Madame le Professeur Cécile Aubron,
Je vous remercie d’avoir accepté de faire partie du jury de thèse. Soyez assurée de l’expression de ma profonde gratitude.
À Monsieur le Professeur Jean-Marie Bard,
Je vous remercie d’avoir accepté d’évaluer mon travail de thèse. Veuillez trouver ici l’expression de ma sincère reconnaissance.
À Madame le Docteur Geneviève Hery-Arnaud,
Je vous remercie d’avoir accepté d’évaluer ce travail de thèse. Veuillez trouver ici l’expression de mon profond respect.
À Monsieur le Docteur Cyril Leven,
Je te remercie de m’avoir guidé tout au long de l’étude et de sa rédaction. Merci pour ta pédagogie, ton professionnalisme, ta bonne humeur envers et contre tout et tes bons mots à l’internat…
Aux biologistes du laboratoire de Biochimie et Pharmaco-Toxicologie du CHRU de Brest,
Merci à vous, Ahmed, Amélie, Emmanuelle, Hélène, Marie-Pierre et Mehdi pour votre enseignement quotidien de la biochimie, votre sympathie et pour tous les bons moments passés ensemble. Merci aussi à tous ceux qui sont à présent en retraite et qui profitent enfin de la vie.
À tous ceux avec qui j’ai travaillé au labo,
Merci à vous, Eliane et Vanessa pour votre aide précieuse dès qu’on est perdu. Merci à toi, Fabienne, pour tes connaissances et ta disponibilité. Merci à vous les techniciennes et techniciens du labo pour le temps que vous avez toujours pour moi et la bonne ambiance que vous créez.
À mes cointernes,
Merci d’avoir supporté mes blagues et de savoir si bien encaisser la défaite au baby.
À Siemens,
Merci pour la fiabilité très formatrice de vos automates.
À ma famille,
Merci maman pour ton soutien de chaque instant et depuis toujours.
Merci Michel pour ta patience et ton aide.
À ma belle famille,
Merci pour votre accueil et votre gentillesse.
À Nassima,
Merci d’être aussi formidable. Merci d’être tombée dans tous mes pièges pour te séduire. Merci d’être toi.
À Assia,
Table des matières
Table des illustrations ... 12
Liste des tableaux ... 13
Abréviations ... 14
1 Préambule ... 15
1.1 Introduction ... 15
1.2 Le Phosphore ... 16
1.2.1 Rappel : le métabolisme du phosphore ... 16
1.2.1.1 Généralités ... 16
1.2.1.2 Fonctions biologiques ... 17
1.2.1.3 Le métabolisme du phosphore ... 22
1.2.2 Le dosage du phosphore ... 25
1.2.2.1 Phosphorémie ou phosphatémie ? ... 25
1.2.2.2 Indications du dosage du phosphore sanguin ... 26
1.2.2.3 Méthode de dosage ... 28
1.2.3 L’hypophosphorémie ... 29
1.2.3.1 Mécanismes de l’hypophosphorémie ... 29
1.2.3.2 Conséquences cliniques de l’hypophosphorémie ... 32
1.2.3.3 Traitement de l’hypophosphorémie ... 34 1.3 Le sepsis ... 36 1.3.1 Définitions ... 36 1.3.1.1 SRIS ... 36 1.3.1.2 État infectieux ... 36 1.3.1.3 Sepsis ... 37 1.3.1.4 Sepsis sévère ... 37 1.3.1.5 Choc septique ... 37 1.3.2 Épidémiologie ... 38 1.3.2.1 Incidence du sepsis ... 38 1.3.2.2 Mortalité ... 38 1.3.2.3 Coût ... 38
1.3.3 Physiopathologie du sepsis ... 39
1.3.3.1 Interaction hôte/pathogène, concepts d’immunité innée et d’immunité acquise .. 39
1.3.3.2 Notion d’immunoparalysie ... 40
1.3.3.3 Cytokines ... 40
1.3.3.4 Réponse métabolique et réponse neuro-hormonale ... 42
1.3.3.5 Aspects endothéliaux et coagulation ... 42
1.3.4 Principes de prise en charge ... 43
1.3.4.1 Précocité de la prise en charge ... 43
1.3.4.2 Documenter l’infection ... 43 1.3.4.3 Remplissage vasculaire ... 43 1.3.4.4 Oxygénothérapie ... 44 1.3.4.5 Antibiothérapie ... 44 1.3.4.6 Autres thérapeutiques ... 45 1.4 Hypophosphorémie et sepsis ... 45
1.4.1 Éléments en faveur de l’implication du sepsis dans le développement d’une hypophosphorémie ... 46
1.4.2 Éléments en faveur de l’implication de l’hypophosphorémie dans le développement du sepsis ... 46
1.4.2.1 Effet de l’hypophosphorémie sur l’immunité innée ... 47
1.4.2.2 Effet de la concentration en phosphore du milieu sur la bactérie : rôle du Pho régulon ... 48
2 Étude rétrospective au CHU de Brest ... 53
2.1 Introduction ... 53
2.2 Association entre hypophosphorémie et décès ... 54
2.3 Étude préliminaire ... 55
2.4 Détermination des paramètres de l’étude ... 57
2.4.1 Choix de la sous-population ... 57
2.4.2 Choix des facteurs de confusion ... 58
2.4.3 Choix d’une durée standardisée pour l’étude ... 59
2.4.4 Autres choix ... 59
2.4.4.1 Hémoculture ... 59
2.4.4.3 Délais entre hémoculture et phosphorémie ... 60
2.5 Article ... 60
3Conclusion ... 75
Table des illustrations
Figure 1. Formules chimiques de l’ion phosphate monovalent et de l’ion phosphate bivalent. ... 17 Figure 2. Représentation d’un phospholipide et de son organisation au sein de la bicouche des membranes biologiques d’après Kochman et al ... 18 Figure 3. Formule chimique d’un brin d’ARN. Mise en évidence des liaisons phosphodiesters qui structurent les acides nucléiques. ... 19 Figure 4. Formule chimique de l’adénosine triphosphate. Mise en évidence de la liaison anhydride phosphorique qui est à l’origine de la majorité des transferts énergétiques du vivant. ... 20 Figure 5. Schéma du métabolisme journalier du phosphore adapté d’Amanzadeh et Reilly . . 23 Figure 6. Variations nycthémérales de la phosphorémie chez le sujet sain et chez l’insuffisant rénal d’après Trivedi et al. ... 24 Figure 7. Formule chimique de la complexation de phosphate par le Molybdate en phosphomolybdate qui sera dosé en UV/Visible pour déterminer la concentration en phosphate de la solution. ... 29 Figure 8. Présentation des mécanismes et des principales causes d’hypophosphorémie rencontrés en pratiques cliniques et plus particulièrement en services de soins intensifs adaptée de Geerse et al. ... 30 Figure 9. Représentation de l’activation et de l’inhibition du Pho regulon en fonction de la concentration environnementale en phosphore à la membrane bactérienne, d’après McGrath et al. ... 50 Figure 10. Diagramme de flux de l’étude préliminaire réalisée au CHU de Brest. ... 56 Figure 11. Variation de la phosphorémie chez un patient de néphrologie dialysé. Chaque nouvelle dialyse voit une diminution brutale de la phosphorémie. ... 58
Liste des tableaux
Tableau 1. Diagnostics principaux évoqués à l’issue du bilan phosphocalcique et variations du bilan phosphocalcique qui les caractérisent. ... 28 Tableau 2. Liste des symptômes pouvant être causés par une hypophosphorémie d’après Geerse et al. (28). ... 33
Abréviations
2,3-BPG : Acide 2,3-bisphosphoglycérique ARN : Acide ribonucléique
ARNm : Acide ribonucléique messager ARNmi : Micro acide ribonucléique ARNr : Acide ribonucléique ribosomique ARNsi : Petit acide ribonucléique interférent ARNt : Acide ribonucléique de transfert ATP : Adénosine triphosphate
CD : Marqueur de différenciation
CHRU : Centre hospitalier régional et universitaire FGF23 : Facteur 23 de croissance du fibroblaste GTP : Guanosine triphosphate
IL : Interleukine
NF-κB : Facteur nucléaire kappa-B
NPT : Canal ionique cotransporteur sodium-phosphate NYHA : New York Heart Association
PAM : Pression artérielle moyenne Pho régulon : Régulon phosphate PTH : Hormone parathyroïdienne
RCPG : Récepteur couplé aux protéines G SAPS II : Score de gravité simplifié 2
SRIS : Syndrome de réponse inflammatoire systémique TLR : Récepteur de type Toll
TNF : Facteur de nécrose tumorale UV : ultra-violet
1 Préambule
1.1 Introduction
Le phosphore est un élément indispensable à tous les organismes vivants. Il est impliqué dans la vie de la cellule tant au niveau structural (acides nucléiques, phospholipides membranaires…), que fonctionnel (métabolisme énergétique, communication intracellulaire…). Malgré l’importance de son rôle cellulaire, le phosphore sanguin est aujourd’hui un paramètre qui suscite peu l’intérêt des cliniciens et des biologistes.
La phosphorémie est fréquemment dosée en routine. Le laboratoire de Biochimie du CHRU de Brest réalise environ 85000 dosages du phosphore sanguin par an. Mais son dosage s’intègre dans la très grande majorité des cas dans l’étude du bilan phospho-calcique. C’est alors bien moins la phosphorémie à laquelle on s’intéresse, qu’aux mouvements de calcium et au métabolisme osseux.
Compte tenu du manque d’études démontrant l’intérêt du dosage du phosphore et l’intérêt de la prise en charge de l’hypophosphorémie, les pratiques cliniques sont très hétérogènes. Certains services ne recherchent pas d’hypophosphorémie ni n’en supplémentent. D’autres en auront une approche occasionnelle. D’autres encore peuvent supplémenter avant même que l’hypophosphorémie ne survienne (avant une nutrition parentérale ou une mise sous ventilation mécanique par exemple).
Or, plusieurs études révèlent que l’hypophosphorémie pourrait avoir des conséquences cliniques à considérer, en particulier dans les services de soins intensifs. L’hypophosphorémie aurait un impact sur le métabolisme énergétique qui s’accompagnerait d’une diminution de la contractilité cardiaque (1–3) et diaphragmatique (4–6). Dans le sepsis, l’hypophosphorémie est associée à 60% des infections (7) et pourrait entraîner une dysfonction leucocytaire (8,9). Des modèles animaux suggèrent qu’une supplémentation adaptée en phosphore pourrait diminuer la mortalité lors du sepsis (10), voire prévenir la survenue d’infections (8).
Les études s’intéressant aux conséquences de l’hypophosphorémie chez l’homme sont peu nombreuses et souffrent d’un niveau de preuve faible, par manque d’effectif ou du fait de leur méthodologie. A l’heure actuelle, aucun essai thérapeutique n’a encore été entrepris concernant l’intérêt de la supplémentation en phosphore chez l’homme. Un approfondissement des connaissances sur l’hypophosphorémie et ses effets pourrait permettre, dans les services de soins, d’établir une prise en charge de l’hypophosphorémie documentée et homogène.
Ce travail de thèse s’inscrit dans la volonté d’étudier l’association entre hypophosphorémie et décès dans le sepsis, avec rigueur et en cherchant à minimiser autant que possible les biais méthodologiques, malgré les contraintes inhérentes au caractère rétrospectif de l’étude.
1.2
Le Phosphore
1.2.1
Rappel : le métabolisme du phosphore
1.2.1.1
Généralités
Le mot phosphore vient du grec « phosphoros » qui signifie « le porteur de lumière ». En effet, dans l’obscurité, la poudre de phosphore est phosphorescente : elle continue à émettre de la lumière après avoir été éclairée.
Le phosphore est un élément de la classification périodique des éléments. Il possède 15 protons et fait partie de la série chimique des « non-métaux », comme la plupart des éléments qui composent le vivant : hydrogène, oxygène, carbone et azote.
C’est un élément indispensable à la vie, présent dans la totalité des organismes vivants (11). Il est ainsi retrouvé en abondance dans l’alimentation. De par son implication dans le métabolisme énergétique, le phosphore est particulièrement concentré au niveau musculaire. Les viandes et poissons sont des aliments riches en phosphore comme les laitages, les noix et le soja.
En solution, le phosphore se lie à 4 atomes d’oxygène pour former l’ion phosphate. L'ion phosphate constitue l'anion principal des fluides intracellulaires. Il est présent dans
l'organisme à 80 % sous la forme bivalente (HPO 42- ) et à 20 % sous la forme monovalente
(H2PO 4- ) (figure 1).
Figure 1. Formules chimiques de l’ion phosphate monovalent et de l’ion phosphate bivalent.
1.2.1.2
Fonctions biologiques
Le phosphore entre dans la composition de nombreuses molécules du vivant assurant des fonctions biologiques variées, tant structurales que fonctionnelles.
a) L’os
L’os contient 85% du phosphore du corps soit environ 600g. C’est ainsi la réserve principale en phosphore de l’organisme qui peut être mobilisée en fonction des besoins par le système hormonal.
La matrice extra-cellulaire de l’os comporte une partie organique et une partie minérale. La partie organique est constituée principalement de fibres de collagène de type 1 et de protéines non collagéniques. La partie minérale est constituée de cristaux d’hydroxyapatite. L'hydroxyapatite, de formule Ca5(PO4)3(OH), est une espèce minérale de la famille
des phosphates qui assure la solidité et la rigidité du tissu osseux. C’est sous cette forme que la majorité du phosphore de l’organisme se trouve stockée. Au gré du remodelage osseux et de l’influence hormonale, le phosphore peut être relargué dans la circulation sanguine ou
b) Les membranes biologiques
Le phosphore est un constituant majeur des membranes biologiques qui sont des doubles couches phospholipidiques dans lesquelles s’insèrent de manière asymétrique et inhomogène d’autres structures comme des protéines. Les membranes sont constituées de 40% de lipides, 52% de protéines et de 8 % de glucides. Les lipides sont variés mais l’on rencontre principalement des phospholipides, des glycolipides et du cholestérol.
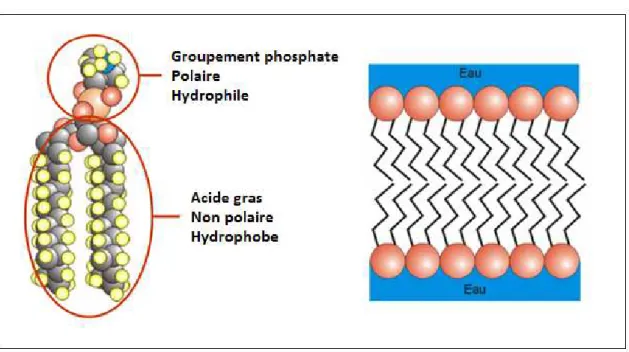
Les phospholipides membranaires possèdent une tête polaire hydrophile constituée par un groupement phosphate parfois associé à divers alcools. Cette tête hydrophile est orientée vers l’extérieur de la membrane, au contact de milieux aqueux. L’extrémité orientée vers l’intérieur de la membrane est une queue hydrophobe faite de chaînes d'acides gras saturées ou insaturées (Figure 2). Ce sont les interactions de faible intensité (interactions de Van der Walls) entre les phospholipides côte à côte qui permettent toute sa mobilité et sa plasticité aux membranes des cellules et organites.
Figure 2. Représentation d’un phospholipide et de son organisation au sein de la bicouche des membranes biologiques d’après Kochman et al. (12).
c) Les acides nucléiques
Les acides nucléiques jouent un rôle fondamental dans le vivant. L’acide désoxyribonucléique (ADN) est le support de l’information génétique. Les acides ribonucléiques (ARN) ont des rôles variés :
• Les ARN messagers (ARNm) servent de matrice pour la synthèse des protéines. • Les ARN ribosomiques (ARNr) entrent dans la composition des ribosomes.
• Les ARN de transfert (ARNt) portent les acides aminés et permettent leur incorporation dans les protéines.
• Les ARN interférents (ARNsi, ARNmi) régulent l’expression des gènes en ciblant la dégradation d’ARN messagers spécifiques ou en inhibant la traduction des protéines.
• Les acides nucléiques sont des polymères dont l’unité de base est le nucléotide.
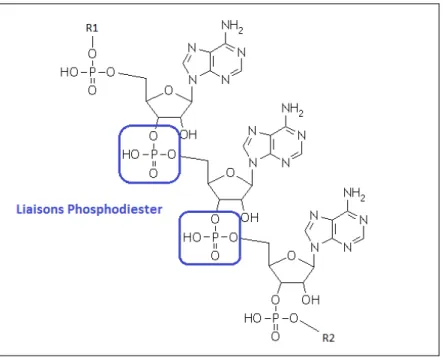
• Le phosphate joue un rôle structural majeur dans la constitution des acides nucléiques en assurant le lien entre chaque nucléotide par une liaison phosphodiester (Figure 3).
d) Le métabolisme énergétique
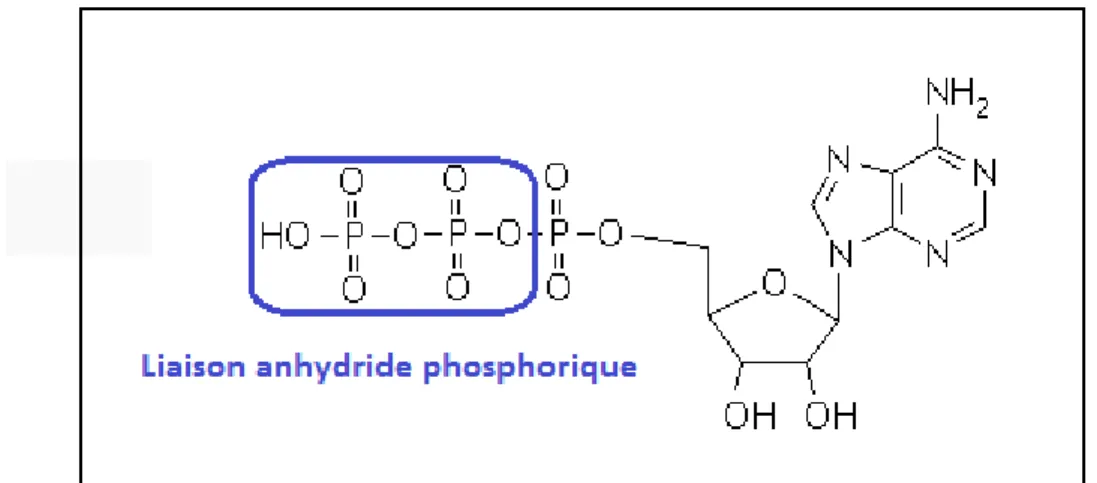
La source d’énergie majeure du vivant est l’hydrolyse de liaisons entre des groupements phosphate. En effet, pour ses besoins énergétiques, la cellule réalise, à partir de nutriments, un ensemble de réactions d’oxydo-réduction. Ces oxydations cataboliques conduisent, d'une part, à la production de coenzymes réduits et, d'autre part, à la production d’adénosine triphosphate (ATP). L’ATP est un nucléotide servant de forme de transport énergétique à toutes les cellules vivantes. Elle fournit, par hydrolyse, l’énergie nécessaire aux réactions chimiques du métabolisme par la présence de liaisons riches en énergie : les liaisons anhydride phosphorique (figure 4).
Figure 4. Formule chimique de l’adénosine triphosphate. Mise en évidence de la liaison anhydride phosphorique qui est à l’origine de la majorité des transferts énergétiques du vivant.
e) La signalisation cellulaire
Le corps humain est constitué d’environ 1014 cellules. La coordination des cellules et des tissus est indispensable pour assurer les différentes fonctions vitales et l’adaptation au milieu extérieur. Deux modes de communication cohabitent : une communication directe, de cytoplasme à cytoplasme, et une communication par l’intermédiaire de molécules sécrétées. Ces molécules vont atteindre des récepteurs au niveau des cellules cibles pour induire des modifications dans le métabolisme de la cellule.
Le phosphore est très impliqué dans la signalisation intracellulaire, une fois le signal extérieur perçu. Le phosphore intervient tant au niveau du fonctionnement des récepteurs qu’au niveau des voies de transduction du signal.
Pour exemple, les récepteurs couplés aux protéines G (RCPG) représentent la plus grande famille de récepteurs membranaires. Chez l’homme, plus de 1% des gènes codent pour des RCPGs (12). Ils interviennent dans la reconnaissance des hormones, des neurotransmetteurs et de la perception sensorielle. Les RCPGs activent des protéines G qui tiennent leur nom de leur association obligatoire à une guanosine triphosphate (GTP). L’état de phosphorylation de cette molécule va stimuler ou inhiber la cascade de médiateurs qu’elle dirige.
f) L’effet tampon sur le pH
Dans l'urine, le phosphate est un tampon pH efficace. En effet, le pKa de 6,8 entre la forme bivalente de l’ion phosphate (HPO 42- ) et monovalente (H2PO 4- ) est proche du pH urinaire et
sa concentration dans l’urine est relativement élevée. L’ion phosphate participe ainsi au maintien d’une relative stabilité du pH urinaire.
Dans le sang, l’impact du phosphore sur le pH est plus modeste.
g) Le 2,3-BPG
L’acide 2,3-bisphosphoglycérique (2,3-BPG) est une molécule retrouvée en quantité importante dans les hématies. C’est une molécule d’adaptation à l’hypoxie, à la vie en altitude ou à l’insuffisance cardiaque par exemple(13). Il agit en augmentant la stabilité de la forme désoxygénée de l'hémoglobine. Lorsque les besoins en oxygène augmentent, la concentration intra-érythrocytaire en 2,3-BPG augmente, favorisant la libération de l'oxygène au niveau des tissus périphériques (14).
Le phosphore sanguin module la concentration en 2,3-BPG érythrocytaire. Une phosphorémie basse s’accompagne d’un 2,3-BPG diminué et d’une oxygénation des tissus périphériques abaissée (15). L’hypophosphorémie pourrait, par ce biais, participer à une mauvaise oxygénation tissulaire.
1.2.1.3
Le métabolisme du phosphore
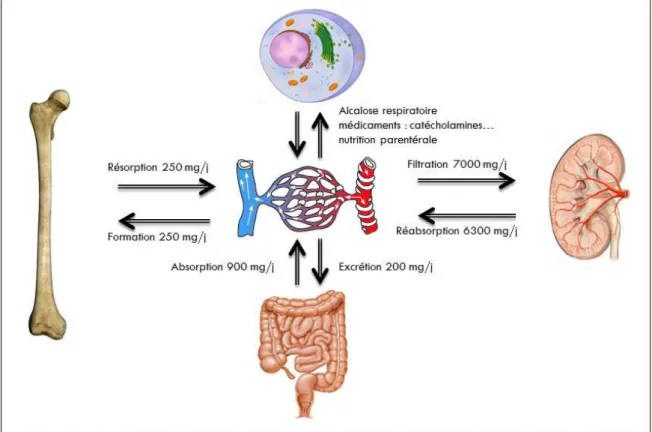
a) Métabolisme journalierLe métabolisme journalier en phosphore est illustré dans la figure 5 d’après Amanzadeh et Reilly (16).
Chez l'adulte, la quantité totale de phosphore de l’organisme est d’environ 700g, dont 85% se trouvent dans les os et les dents, 14% dans les tissus mous et seulement 1% dans le liquide extracellulaire.
Le phosphore de l’organisme est apporté par l’alimentation. 800 à 1400 mg de phosphore sont absorbés quotidiennement, principalement au niveau duodénal et iléal.
L’élimination du phosphore est principalement rénale. Le glomérule filtre près de 7g de phosphore par jour mais 80 à 90% du phosphore filtré est réabsorbé au niveau tubulaire. L’élimination digestive est d’environ 200 mg par jour.
Il existe au niveau osseux des mouvements continuels de phosphore et de calcium dus au renouvellement osseux journalier. La résorption osseuse par les ostéoclastes relargue environ 250 mg par jour de phosphore dans la circulation sanguine. La néoformation osseuse journalière consomme la même quantité de phosphore.
Le phosphore intracellulaire se trouve à des concentrations variées en fonction des tissus : de 0,4 à 0,8 mmol/L dans les globules rouges à 5 mmol/L dans les rhabdomyocytes (17).
Figure 5. Schéma du métabolisme journalier du phosphore adapté d’Amanzadeh et Reilly (17).
b) Le cycle nycthéméral du phosphore
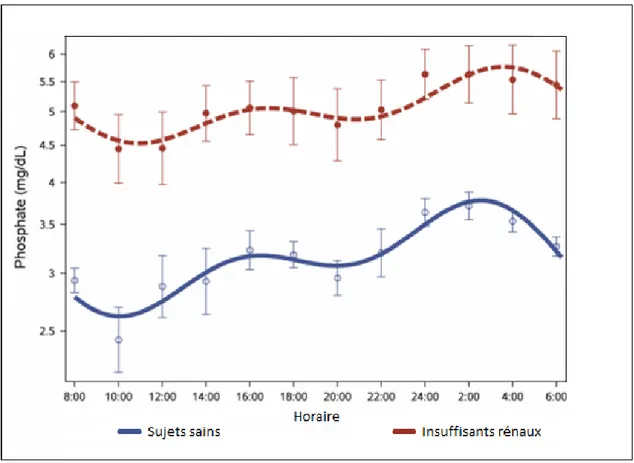
Les valeurs normales de la phosphorémie sont de 0,8 à 1,65 mmol/L soit 2,5 à 5,2 mg/dL. Lorsque l'apport en phosphore alimentaire et l’environnement hormonal sont habituels, la concentration sérique de phosphore présente un rythme circadien (figure 6) (18). On observe une phosphorémie minimale entre 9h et 11h du matin et maximale de minuit à 4h du matin. Les variations sont importantes puisqu’entre les deux extrêmes, on observe des différences de phosphorémie pouvant atteindre 40%. La variation nycthémérale de la phosphorémie s’observe aussi bien chez le sujet sain que chez le patient insuffisant rénal chronique.
Les variations nycthémérales de la phosphorémie posent la question de l’opportunité de choisir des horaires de prélèvements fixes, ou de prendre en compte l’horaire de prélèvement dans l’interprétation du résultat.
Figure 6. Variations nycthémérales de la phosphorémie chez le sujet sain et chez l’insuffisant rénal d’après Trivedi et al. (19).
c) La régulation du métabolisme du phosphore
Le métabolisme du phosphore est régulé par l’environnement hormonal qui agit sur l’absorption digestive, l’excrétion rénale et le métabolisme osseux.
Au niveau de la membrane apicale des cellules des tubules proximaux et des entérocytes, se trouvent des cotransporteurs sodium-phosphate appelés NPT. Ce sont des canaux sodium dépendants, qui transportent activement le phosphore se trouvant dans la lumière des tubules rénaux et du tube digestif vers la circulation sanguine. La diffusion passive du phosphore joue également un rôle important dans le métabolisme du phosphore (19).
L'expression rénale et digestive des NPT est contrôlée par des facteurs hormonaux et métaboliques. Un régime alimentaire faible en phosphore et une carence en vitamine D sont
les deux plus importants activateurs de la production de l'isoforme intestinale NPT-2b, qui va stimuler l’absorption digestive de phosphore (20,21).
De nombreux canaux sodium-phosphore comme NPT-1, 2a et 3 sont présents au niveau du tubule rénal. Leurs expressions à la membrane conditionnent la réabsorption tubulaire du phosphore ou son élimination urinaire (22). L'hormone parathyroïdienne (PTH) est le principal inhibiteur de la réabsorption de phosphate au niveau rénal. Soixante-dix pour cent de la réabsorption tubulaire du phosphate est médié par NPT-2a. La PTH, le facteur natriurétique atrial et l’oxyde d’azote (NO) sont capables d’activer une cascade de médiateurs intracellulaires menant à l’intériorisation et à la dégradation de NPT-2a. Son absence augmente l’excrétion rénale de phosphore (23).
Parmi les autres molécules régulatrices du phosphore, la calcitonine et les glucocorticoïdes inhibent la réabsorption tubulaire du phosphore alors que les hormones thyroïdiennes la stimulent (22).
Le facteur de croissance des fibroblastes 23 (FGF23) influence également l'expression apicale de NPT-2a. Une mutation au niveau du gène codant pour le FGF23 mène à une maladie rare : le rachitisme hypophosphatémique qui se caractérise par une hypophosphatémie par hypophosphaturie, une croissance lente et des douleurs et déformations osseuses (24).
1.2.2
Le dosage du phosphore
1.2.2.1
Phosphorémie ou phosphatémie ?
Des désaccords existent quant au terme le plus juste à donner au paramètre : phosphorémie ou phosphatémie ?
La technologie utilisée en routine médicale dose le phosphate inorganique, c'est-à-dire le phosphate non lié à une molécule contenant un atome de carbone. Le dosage médical ne concerne donc ni le phosphore élément, ni les phosphates organiques qui sont pléthores dans le vivant (phospholipides, ADN, ATP…). Les termes phosphorémie et phosphatémie n’étant ni l’un ni l’autre idéals, la littérature utilise indistinctement les deux appellations pour
désigner le dosage du phosphate inorganique sanguin. Ce travail de thèse choisira préférentiellement le terme de phosphorémie.
1.2.2.2
Indications du dosage du phosphore sanguin
Le dosage du phosphore sanguin est très rarement réalisé en vue de détecter une hypophosphorémie et de la supplémenter.
C’est un paramètre fréquemment utilisé dans le suivi de l’insuffisance rénale chronique, en particulier des patients dialysés. Le défaut d’élimination rénale du phosphore entraîne une hyperphosphorémie chronique et l’accumulation de phosphore dans l’organisme. Initialement, le phosphore ainsi accumulé se stocke au niveau osseux sous forme de cristaux d’hydroxyapatite. Les capacités de stockage osseux dépassées, les cristaux d’hydroxyapatite peuvent être à l’origine d’exostoses ou se déposer dans les tissus mous (calcifications vasculaires, tendineuses…). La lutte contre l’hyperphosphorémie chez les patients insuffisants rénaux comprend un régime alimentaire pauvre en phosphore (en limitant les apports protéiques), parfois accompagné d’un chélateur de phosphore comme les préparations orales d’hydroxyde d’aluminium (AlOH3).
En dehors de l’insuffisance rénale, les prescriptions de phosphorémie sont le plus souvent réalisées dans le cadre d’une analyse du bilan phosphocalcique.
Le bilan phosphocalcique comprend les dosages de la calcémie, de la phosphorémie, de la calciurie des 24 heures et de la phosphaturie des 24 heures. D’autres dosages doivent lui être associés :
• Le dosage de la créatininémie car toute insuffisance rénale, même modérée, modifie les paramètres précédemment cités.
• Le dosage de l’albumine qui permet d’éliminer les fausses hypocalcémies.
• La créatininurie et la diurèse qui sont indispensables pour savoir si le recueil urinaire des 24 heures est correct.
Trois circonstances motivent la prescription d’un bilan phosphocalcique :
• L’analyse du retentissement sur le calcium et le phosphore de pathologies touchant l’os comme le myélome, la maladie de Paget ou des métastases.
• Des signes cliniques pouvant être en rapport avec une anomalie du bilan phosphocalcique : asthénie, troubles digestifs, neurologiques, cardiaques.
• La recherche étiologique d’une affection osseuse : pour exemple, le bilan phosphocalcique doit être réalisé dans le bilan de toute ostéoporose afin de s’assurer que la déminéralisation ne soit pas secondaire à un processus pathologique.
Certains traitements peuvent modifier le bilan phosphocalcique et doivent être évités avant le dosage ou pris en compte dans l’analyse des résultats. Un traitement par calcium ou vitamine D augmente la calciurie. Les diurétiques modifient de façon majeure les excrétions urinaires de calcium et de phosphore : les diurétiques de l’anse augmentent la calciurie, les diurétiques thiazidiques diminuent la calciurie et augmentent la calcémie.
Enfin l’interrogatoire doit évaluer succinctement les apports alimentaires car, à fonction rénale et à tube digestif normaux, le bilan urinaire en calcium et phosphore est le reflet de l’alimentation du patient.
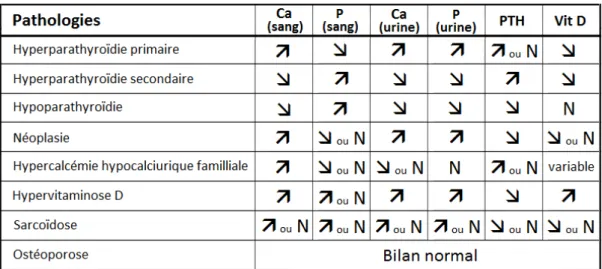
Les diagnostics fréquemment évoqués à l’issue du bilan phosphocalcique sont décrits dans le tableau 1.
Ca : calcium, P : Phosphore, PTH : Parathromone, Vit D : Vitamine D, : augmentation, : diminution, N : valeur normale.
Tableau 1. Diagnostics principaux évoqués à l’issue du bilan phosphocalcique et variations du bilan phosphocalcique qui les caractérisent.
1.2.2.3
Méthode de dosage
Le dosage du phosphore est réalisé au CHRU de Brest sur un automate ADVIA® 1800 Chemistry System (Siemens®). Il peut être réalisé sur un échantillon de plasma, de sérum ou d’urine.
La méthode ADVIA Chemistry Inorganic Phosphorus est basée sur la procédure de Daly et Ertinghausen qui s’appuie sur la formation d’un complexe entre le phosphore et le molybdène, capable d’absorber les UV (25). En effet, le phosphate inorganique seul n’est pas détectable en UV/Visible. La complexation du phosphate inorganique avec le molybdate d’ammonium en présence d’acide sulfurique donne le phosphomolybdate (Figure 7). C’est lui qui est détecté dans le domaine UV/visible par spectrométrie en point final à 340/658 nm.
Figure 7. Formule chimique de la complexation de phosphate par le Molybdate en phosphomolybdate qui sera dosé en UV/Visible pour déterminer la concentration en phosphate de la solution.
1.2.3 L’hypophosphorémie
L’hypophosphorémie est définie par un taux de phosphore sanguin inférieur à 0,8mmol/L soit 2,5mg/dL. Elle est très rare dans la population générale, présente chez 2 à 3% des patients hospitalisés et jusqu’à 28,8% des patients en réanimation (26).
1.2.3.1
Mécanismes de l’hypophosphorémie
Les causes d’hypophosphorémie sont décrites dans la figure 8.L’hypophosphorémie peut avoir trois origines non exclusives (16,27) :
• Une déplétion de l’organisme en phosphore par diminution de l’absorption digestive.
• Une redistribution du phosphore du compartiment extra-cellulaire vers le compartiment intra-cellulaire.
Figure 8. Présentation des mécanismes et des principales causes d’hypophosphorémie rencontrés en pratiques cliniques et plus particulièrement en services de soins intensifs adaptée de Geerse et al. (28).
a) La diminution d’absorption digestive
La dénutrition est de loin la cause la plus fréquente d’un défaut d’absorption intestinale de phosphore. Il est à noter que, seule, la dénutrition est rarement suffisante pour provoquer une hypophosphorémie (27).
Des pertes digestives de phosphore peuvent être causées par des vomissements, une diarrhée ou des aspirations digestives itératives.
b) Les déséquilibres acido-basiques
L’acidose sanguine comme l’alcalose peuvent être responsables d’une hypophosphorémie mais par des mécanismes différents. L’acidose favorise l’élimination rénale de phosphore alors que l’alcalose entraîne le passage intra-cellulaire du phosphore en stimulant la glycolyse (28).
c) Le syndrome de renutrition inappropriée
Le syndrome de renutrition inappropriée est causé par la reprise d’une alimentation trop abondante après un jeûne prolongé, sans une supplémentation électrolytique adaptée. Il peut provoquer une hypophosphorémie, une hypomagnésémie et une hypokaliémie. Lors de la dénutrition initiale, le corps puise dans ses réserves en phosphore. Lors de la renutrition, une quantité importante de phosphore est consommée par les voies métaboliques qui assurent l’assimilation des nutriments (cycle de Krebs, phosphorylation des sucres…). Le phosphore est alors attiré et utilisé dans le compartiment intracellulaire causant l’hypophosphorémie (29).
d) Influence médicamenteuse
De nombreux médicaments et une prise en charge hydro-électrolytiques intense font varier la phosphorémie.
Les administrations de glucose et d'insuline stimulent le métabolisme des glucides, au cours duquel le phosphate est transporté en intracellulaire. Les catécholamines, endogènes comme exogènes, induisent également une entrée intracellulaire du phosphore (30).
L'excrétion rénale de phosphate est augmentée par de nombreux médicaments comme les diurétiques, les glucocorticoïdes (22), les antirétroviraux et un certain nombre de chimiothérapies anticancéreuses (31). L’hémodialyse diminue habituellement la phosphorémie.
Les chélateurs de phosphore comme les préparations orales d’hydroxyde d’aluminium
(AlOH3) sont utilisés chez l’insuffisant rénal chronique pour diminuer l’absorption digestive
e) Les processus prolifératifs
Les processus prolifératifs comme les cancers et les hémopathies consomment une quantité importante de phosphore au cours de la néoformation cellulaire.
f) L’hypophosphorémie en soins intensifs
L’hypophosphorémie est fréquente dans les services de soins intensifs où près de 30% des patients pourront présenter un épisode d’hypophosphorémie au cours de leur hospitalisation (26). Les thérapeutiques employées et les troubles acido-basiques chez une population affaiblie et dénutrie favorisent l’hypophosphorémie. Les traumatismes (32) et les états post-opératoires (33) sont favorables aux passages en hypophosphorémie sans que les mécanismes physiopathologiques propres soient parfaitement élucidés. L’hypophosphorémie est particulièrement fréquente lors de brûlures, où le phosphate est perdu à travers la peau (34). Chez les patients traumatisés crâniens, l'induction d’une polyurie peut contribuer à une élimination rénale excessive de phosphore (35). L’infection est fréquemment associée à l’hypophosphorémie (36), en particulier les infections à bactéries gram negative (37).
1.2.3.2
Conséquences cliniques de l’hypophosphorémie
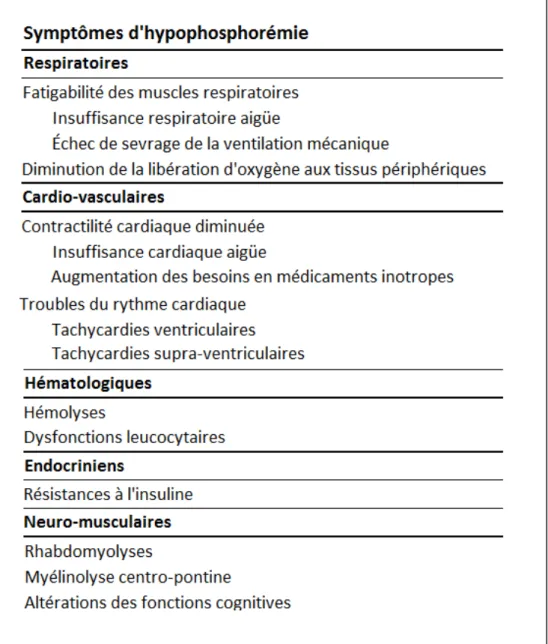
Bien que la plupart des patients ne présentent aucun symptôme, l’hypophosphorémie peut entraîner de graves complications. Le mécanisme commun des troubles causés par l’hypophosphorémie semble être une altération du métabolisme énergétique (27). Les effets respiratoires et cardio-vasculaires sont les mieux documentés.
Tableau 2. Liste des symptômes pouvant être causés par une hypophosphorémie d’après Geerse et al. (28).
a) Effets respiratoires
L’hypophosphorémie est associée à une diminution de la contractilité des muscles respiratoires, pouvant entraîner, chez des patients fragilisés, une insuffisance respiratoire aigüe ou des échecs de sevrage de la ventilation mécanique (4,6,38).
L’appauvrissement en 2,3-BPG intra-érythrocytaire dû à l’hypophosphorémie augmente l’affinité de l’hémoglobine pour l’oxygène et diminue les apports en oxygène aux tissus périphériques (39,40).
b) Effets cardio-vasculaires
L’hypophosphorémie peut causer des dysfonctions du muscle cardiaque et des arythmies. Elle entraîne une diminution de la contractilité cardiaque pouvant mener à de graves insuffisances cardiaques aigües. L’hypophosphorémie, après chirurgie cardiaque, semble nécessiter une augmentation des soutiens inotropes (33). La correction de l’hypophosphorémie est associée à une amélioration des fonctions cardiaques (26).
L’hypophosphorémie serait un prédicteur important de tachycardie ventriculaire après infarctus du myocarde (3) et une corrélation avec des troubles du rythme a été suggérée chez les patients infectés (41,42).
c) Autres effets
L’hypophosphorémie pourrait être à l’origine d’hémolyses (43,44), d’une dysfonction leucocytaire (8,9), d’une résistance à l'insuline (45), de rhabdomyolyses (46), de myélinolyses centro-pontiques (47,48) et de multiples altérations neurologiques et cognitives peu documentées.
1.2.3.3
Traitement de l’hypophosphorémie
Le traitement de l’hypophosphorémie est le traitement de son étiologie accompagné d’une supplémentation en phosphore. L’apport se fait sous la forme de Glucose-1-phosphate disodique par voie orale (Phosphoneuros®) ou par voie parentérale (Phocytan®).
À ce jour, une seule étude a recherché l’intérêt de la supplémentation en phosphore (41). Trente-quatre patients en sepsis et hospitalisés en soins intensifs ayant reçu une supplémentation en phosphore présentaient significativement moins d’arythmies cardiaques que 16 patients d’une précédente étude. La mortalité globale n’était pas significativement différente.
Aucune entité scientifique ne s’est prononcée quant au cadre de l’utilisation de la supplémentation en phosphore. Pour Amanzadeh et al. : « Il est généralement recommandé de supplémenter en phosphore si :
• Phosphorémie < 0,32 mmol/L
• Phosphorémie < 0,80 mmol/L + symptômes d’hypophosphorémie »
Cette proposition nécessite d’être capable d’identifier les symptômes d’hypophosphorémie qui sont peu décrits et peu spécifiques. La pratique clinique observée dans les services de soins intensifs du CHU de Brest est de supplémenter systématiquement en phosphore en cas de phosphorémie inférieure à 0,8 mmol/L. Les préparations de nutrition parentérale étant dépourvues de phosphore, une supplémentation en phosphore accompagne systématiquement sa mise en place.
Plusieurs études proposent des abaques pour adapter la posologie de la supplémentation à la situation clinique (49–53). Elles s’accordent toutes sur la rapidité pour obtenir une phosphorémie normale et l’innocuité de la supplémentation en phosphore lorsqu’elle est bien conduite. Un surdosage massif en phosphore peut néanmoins entraîner une baisse du calcium plus ou moins sévère, des troubles de la conscience, une hypotension ou une tachycardie.
Le manque d’étude quant à l’intérêt de la supplémentation en phosphore est la cause d’une grande hétérogénéité des pratiques cliniques. De nombreux services ne recherchent pas d’hypophosphorémie ni n’en supplémentent. Au CHRU de Brest, les services les plus demandeurs de phosphorémie sont les services de soins intensifs, d’hématologie, de nutrition et de néphrologie. Ce sont également les plus prescripteurs de supplémentation en phosphore. De rares centres, comme la réanimation médico-chirugicale du Centre Hospitalier du Mans, peuvent avoir une approche préventive et supplémenter en phosphore lors d’une situation à risque d’hypophosphorémie (la mise sous ventilation mécanique par exemple). Il est à noter que le service de maladie infectieuse du CHRU de Brest réalise très peu de demande de phosphorémie ; preuve du désintérêt du paramètre au cours de l’infection.
1.3 Le sepsis
1.3.1 Définitions
Les définitions d’infection (sepsis), de syndrome de réponse inflammatoire systémique (SRIS), de sepsis sévère et de choc septique ont été proposées il y a 25 ans par les critères de Bone (54,55). Elles utilisent des éléments qui illustrent la progression de l’infection et la réponse systémique de l’hôte. Ces définitions ont, depuis, sensiblement évolué, en particulier celle du sepsis sévère qui inclut à présent les défaillances d’organes. Les critères de Bone, s’ils permettent une description clinique intéressante, sont inaptes à prédire le devenir du patient et donc à identifier précisément la sévérité clinique (56).
1.3.1.1
Syndrome de réponse inflammatoire systémique
Le SRIS est un état défini sur des critères cliniques et biologiques. Il nécessite la présence de 2 critères parmi les suivants (55,57) :
• Température > 38,3°C ou < 36°C
• Fréquence cardiaque > 90/min
• Fréquence respiratoire > 20/min ou PaCO2 < 32 mmHg
• Leucocytose > 12000/mm3 ou < 4000/mm3 ou > 10% de formes immatures.
Un SRIS peut être la conséquence d’un état infectieux ou d’une étiologie non infectieuse (58). De façon non exhaustive, un SRIS peut se rencontrer en cas d’agression tissulaire (infarctus, pancréatite, maladie thrombo-embolique…), de pathologie métabolique (hyperthyroïdie, insuffisance rénale aigüe), inflammatoire, tumorale ou en cas d’effet indésirable d’un traitement (médicaments, chirurgie, greffe…).
1.3.1.2
État infectieux
L’infection est définie par la présence anormale de micro-organismes dans un ou plusieurs territoires de l’hôte. La source de l’infection est soit connue (mise en évidence du pathogène)
ou suspectée par la présence de pus dans un espace clos. L’infection est donc un processus pathologique résultant de l’invasion d’un tissu, d’un fluide ou d’une cavité corporelle, par un micro-organisme pathogène ou potentiellement pathogène. Ce micro-organisme peut être une bactérie, un virus, un parasite ou un champignon (57).
1.3.1.3
Sepsis
Le sepsis se définit par la présence d’une infection allant de pair avec des manifestations systémiques de l’organisme. Le sepsis correspond à l’association d’un SRIS avec une infection cliniquement ou microbiologiquement documentée (57).
1.3.1.4
Sepsis sévère
Le sepsis sévère correspond à l’association d’un sepsis et d’une ou plusieurs dysfonctions d’organes. Les symptômes de la dysfonction d’organes ne doivent pas être expliqués par une autre cause que l’infection (exemple de la dysfonction chronique préalable). Il est nécessaire qu’une dysfonction autre que celle directement en rapport avec le foyer infectieux existe (57).
Les dysfonctions d’organes les plus souvent citées sont les dysfonctions de la fonction circulatoire, de la fonction respiratoire, des fonctions supérieures, de la fonction rénale, de la coagulation et de la fonction hépatique (59).
1.3.1.5
Choc septique
L’apparition ou la persistance d’une hypotension (PAS < 90 ou PAM < 65 mmHg) ou de signes francs d’hypoperfusion (lactatémie ≥ à 2mmol/L) malgré les manœuvres initiales de remplissage vasculaire au cours d’un sepsis sévère, ou d’emblée chez un malade ayant des signes d’infection, définit le choc septique (60).
1.3.2
Épidémiologie
1.3.2.1
Incidence du sepsis
Aux Etats Unis, avant l’an 2000, l’incidence du sepsis sévère était d’environ 500 000 cas par an (61). Ce nombre est en constante augmentation et aurait plus que doublé entre 2000 et 2008 (62,63).
Le taux d’hospitalisation pour sepsis est similaire pour les hommes et les femmes. Il est significativement augmenté pour les patients de plus de 65 ans, de moins d’un an, et les patients présentant des pathologies associées tel que le VIH, le cancer, la cirrhose, l’alcoolisme, ou le diabète (58).
En France, l’incidence du sepsis dans la population générale est estimée entre 0,5 et 1,5/1000 habitants. L’incidence des états septiques graves à l’hôpital a été évaluée à 6 pour 1000 admissions à l’hôpital en 1996, avec plus de la moitié des cas de sepsis sévère recensés hors réanimation (64).
1.3.2.2
Mortalité
Le choc septique reste la première cause de mortalité en soins intensifs (65–67). On évalue à 120000 le nombre de décès dus au sepsis en 2000 aux Etats Unis. Ce nombre est en constante augmentation, du fait de l’augmentation de l’incidence du sepsis, malgré l’amélioration du prognostic passant en cas de sepsis sévère de 28% de décès en 1979 à 18% en 2000 (61). La mortalité en cas de choc septique reste très élevée, de l’ordre de 30% à 28 jours (70,71).
1.3.2.3
Coût
En 2005 en France, la durée médiane de séjour en réanimation des patients en sepsis sévère était de 11-15 jours, et jusqu’à 30 jours pour les malades qui y survivaient (68). Le coût moyen d’une hospitalisation en réanimation était deux fois plus élevé chez les patients atteints de sepsis sévère (22800€), que ceux hospitalisés sans critères de sepsis sévère (9600€). En dehors des services de réanimation, la journée d’hospitalisation d’un patient présentant un sepsis sévère était estimée à 1267€ en moyenne.
1.3.2.4
Origine de l’infection
Les infections en cause sont très majoritairement d’origine respiratoire (50%) ou intra-abdominale (25%), plus rarement urinaire (5%) ou d’autres origines (69). L’infection est microbiologiquement documentée dans moins de 70% des cas (70).
1.3.3 Physiopathologie du sepsis
La réponse immunitaire au cours de la phase aiguë du sepsis est caractérisée par l'inflammation et l'activation de mécanismes visant à l'élimination de l'agent pathogène. Au cours de la phase tardive, le système immunitaire déplace son activité sur la production d’agents anti-inflammatoires pour initier la réparation tissulaire. Cette chaîne d’évènements peut être mise en échec.
Notons que la phosphorémie n’est, à ce jour, pas considérée dans la physiopathologie du sepsis. Néanmoins, l’importance sur le pronostic de la réponse de l’hôte au sepsis laisse imaginer qu’un effet, même modeste, de la phosphorémie sur l’un des processus suivant puisse influer sur la mortalité dans le sepsis.
1.3.3.1
Interaction hôte/pathogène, concepts d’immunité innée et
d’immunité acquise
Lors des premières minutes de l’infection, la présence du micro-organisme et de certains composants de sa membrane vont induire une libération par l’hôte d’une cascade de médiateurs comme les cytokines (71). L’immunité innée joue le rôle de sentinelle destinée à intervenir rapidement, en cas d’invasion microbienne. Cette première ligne de défense repose sur les monocytes circulants, les macrophages tissulaires et les cellules dendritiques. Ces cellules immunitaires ont pour rôle initial de détecter, de phagocyter et d’éliminer l’agent infectieux, tout en initiant et coordonnant la réaction inflammatoire. L’initiation de la réponse innée repose sur l’interaction entre des motifs moléculaires spécifiques des pathogènes (Pathogen Associated Molecular Pattern) et les récepteurs présents sur les cellules ou les molécules composant le système immunitaire ancestral (Pattern Recognition Receptors). La découverte des récepteurs de type Toll et de leur implication dans la détection des micro-organismes ainsi que leur mise en jeu dans la réponse immune innée, puis acquise, sont des
De nombreuses études ont montré l’importance des récepteurs membranaires CD14 (72) et de type Toll (73) dans le déclenchement de la cascade de l’inflammation. Certains composants de la membrane des bacilles à Gram négatif, les lipopolysaccharides (encore nommés LPS ou endotoxines) sont reconnus par le CD14 du monocyte. Ils sont alors présentés aux récepteurs de type Toll (TLR) qui activent le facteur transcriptionnel NF-κB responsable de l’activation monocytaire et de la production de cytokines (74,75). Il a été observé une relation entre des mutations appartenant au polymorphisme génétique des TLR et la gravité de certains sepsis sévères (76,77).
L’immunité acquise, quant à elle, ne devient active qu’après 3 à 5 jours et repose sur la synthèse d’anticorps spécifiques qui assurent une défense durable dirigée spécifiquement contre le micro-organisme infectant. Elle nécessite le contact de l’immunité innée avec le micro-organisme, une dégradation intra-cellulaire du pathogène et la présentation des peptides microbiens aux lymphocytes T naïfs, conduisant à une prolifération clonale de lymphocytes T et B.
1.3.3.2
Notion d’immunoparalysie
Pendant la phase tardive de l’infection, l'activation des voies modulatrices de l’inflammation peut inhiber prématurément les défenses de l'hôte : c’est l’immunoparalysie innée (78). L’on observe, au cours de cet état d’anergie, une incapacité pour les cellules immunitaires à répondre à l’agression antigénique (79,80). Cet état serait en partie favorisé par l’apoptose des cellules immunitaires observée au cours du sepsis (81) et par la baisse d’expression monocytaire et macrophagique des composants du complexe majeur d’histocompatibilité de type II (82,83). L’apparition de cet état d’immunoparalysie au cours du sepsis entraîne des difficultés à juguler l’infection, et prédispose à la survenue d’infections nosocomiales (78,84– 87).
1.3.3.3
Cytokines
Les cytokines représentent un groupe hétérogène de polypeptides qui possèdent des actions de régulation humorale en modulant l’activité fonctionnelle de différents tissus et cellules. Les cytokines sont produites principalement par les cellules du système immunitaire. Elles
peuvent avoir des actions locales (transmission de signaux entre cellules voisines) ou systémiques (fièvre) en conditions physiologiques et pathologiques.
Les cytokines pro-inflammatoires semblent pour certaines particulièrement impliquées dans les manifestations systémiques du sepsis. Le TNF-α, en plus de réguler la prolifération et l’apoptose cellulaire, recrute et active les cellules de l’inflammation (neutrophiles, macrophages et lymphocytes) et stimule la sécrétion d’autres cytokines ou protéines par ces mêmes cellules. De nombreux travaux ont rapporté que le niveau d’augmentation du TNF-α était corrélé avec la sévérité et la mortalité des patients en choc septique (88,89). L’administration de TNF-α à des modèles animaux ou des sujets volontaires sains reproduit les caractéristiques d’un choc septique (90,91). Par ailleurs, l’administration d’anticorps anti-TNF chez l’animal prévient les manifestations systémiques associées à l’injection d’endotoxine (92). L’interleukine-1β (IL-1β) a des effets similaires et synergiques à ceux du TNF-α sur la dépression myocardique (93). L’IL-6 sanguin est corrélée à la sévérité et au devenir des patients en choc septique ce qui en fait un marqueur intéressant de la réponse au sepsis (94).
Parallèlement, des cytokines à visée anti-inflammatoire sont produites. Il s’agit principalement de l’IL-10, des formes solubles du TNF, de l’IL-1ra et de l’IL-4. L’IL-10 est une molécule anti-inflammatoire qui agit en inhibant la sécrétion macrophagique de TNF, d’IL-1 et d’IL-6. L’administration d’IL-10 prévient la mortalité dans des modèles septiques animaux (95).
Cependant, la dichotomie en médiateurs pro et anti-inflammatoires est probablement réductrice et la plupart des cytokines comme l’IL-6 ont des effets mixtes.
La cascade moléculaire de l’inflammation voit sa compréhension complexifiée par l’intervention de très nombreux autres médiateurs. On peut noter l’intrication avec le système de la coagulation (facteur tissulaire), le système du complément (C5a), le système contact (Facteur XII), les produits de dégradation des phospholipides membranaires, les métabolites de l’acide arachidonique (prostacycline, thromboxane cycline), les radicaux libres et le monoxyde d’azote (NO).
1.3.3.4
Réponse métabolique et réponse neuro-hormonale
Suggérée par Ledingham et Watt (96), s’est imposée l’idée que l’activation de l’axe corticotrope pouvait jouer un rôle dans la survie des malades de réanimation. Les concepts d’insuffisance surrénalienne relative et de syndrome de résistance périphérique aux glucocorticoïdes ont été décrits au cours du choc septique (97,98). En situation septique, il est maintenant bien démontré que les médiateurs de la réponse inflammatoire sont impliqués dans l’altération de la stimulation (normalement intense et prolongée) de l’axe corticotrope (99), notamment par une action directe sur la corticosurrénale (100). Or, les glucocorticoïdes possèdent des activités anti-inflammatoires et immunorégulatrices. Ils ont un rôle majeur dans le maintien du tonus vasculaire, de l’intégrité endothéliale, de la perméabilité vasculaire et dans la contractilité myocardique (101). Plusieurs études animales et humaines démontrent l’action modulatrice des glucocorticoïdes sur la réactivité vasculaire en situation septique (102) et ont conduit au concept d’hormonothérapie substitutive au cours du choc septique, qui semble améliorer le pronostic (101,103).
La question de la balance glucose / insuline au cours du sepsis est très étudiée. Il est ainsi décrit un état d’insulinorésistance aigüe au cours du choc septique. Une glycémie élevée secondaire à l’insulinorésistance aigüe est liée à un pronostic péjoratif (104,105).
D’autres dysrégulations endocriniennes et métaboliques font l’objet de travaux de recherche (106) : aldostérone, vasopressine, dysfonction mitochondriale…
1.3.3.5
Aspects endothéliaux et coagulation
L’endothélium a un rôle clé dans la survenue de défaillances vasculaires. Au cours du sepsis, l’endothélium voit ses deux propriétés essentielles de régulation de la vasomotricité et de thrombomodulation profondément remaniées (107). Les anomalies de la vasomotricité associent une diminution de la réponse relaxante dépendante de l’endothélium et une diminution de la réponse contractile aux catécholamines (108).
Au cours du sepsis, il existe un état pro-coagulant par une baisse d’activité de la protéine C et une diminution de l’antithrombine III (109). Ces phénomènes sont corrélés à la mortalité : la protéine C activée associée à l’antithrombine III améliorerait le pronostic.
1.3.4 Principes de prise en charge
Lorsque le sepsis a été identifié, il reste à déterminer le traitement approprié. Les comorbidités, les antécédents et traitements antérieurs vont guider la prise en charge pour déterminer le service adapté, la thérapeutique à mettre en place, les examens à réaliser et le suivi à proposer. La prise en charge du sepsis implique la présence d’équipes pluridisciplinaires (cliniciens, biologistes, pharmacologues, pharmaciens) afin d’optimiser les chances de succès (69).
1.3.4.1
Précocité de la prise en charge
Il est essentiel de savoir reconnaître rapidement un syndrome septique grave afin de débuter un traitement de la manière la plus précoce possible. L’identification du sepsis et la mise en place précoce d’un traitement améliorent les résultats et permettent de diminuer le taux de mortalité lié au sepsis : chaque heure de retard à l’initiation du traitement par antibiotiques engendre un risque de surmortalité(110).
1.3.4.2
Documenter l’infection
Lorsque la situation clinique le permet, il est recommandé de documenter l’infection par les prélèvements microbiologiques adaptés qui seront réalisés avant toute antibiothérapie. La documentation microbiologique permettra de confirmer l’infection, d’identifier le germe et d’adapter l’antibiothérapie probabiliste vers une antibiothérapie ciblée. Le traitement anti-infectieux est alors plus efficace et permet une diminution de la morbi-mortalité. Devant une suspicion de septicémie, il est recommandé de prélever au moins deux paires d’hémocultures de façon systématique et rapprochée et de réaliser les prélèvements à visée bactériologique adaptés à la clinique et à l’accessibilité des sites (111). Les données épidémiologiques extraites des résultats microbiologiques permettront également une adaptation des pratiques probabilistes.
1.3.4.3
Remplissage vasculaire
Créer un accès vasculaire et pratiquer une réanimation liquidienne agressive par cristalloïdes sont des priorités lors de la prise en charge des patients atteints d’un sepsis sévère ou d’un
choc septique. Il est recommandé une épreuve de remplissage initiale chez les patients souffrant d’hypoperfusion tissulaire provoquée par un sepsis chez qui l’on soupçonne une hypovolémie, contenant au moins 30 ml/kg de cristalloïdes. Cette épreuve de remplissage doit être réalisée en continu tant que l’on observe une amélioration hémodynamique (69).
1.3.4.4
Oxygénothérapie
Dans la prise en charge du sepsis, il est nécessaire d’assurer une hématose correcte. Les paramètres cliniques et la gazométrie guideront l’oxygénothérapie : simple lunette à oxygène, masque haut débit ou ventilation mécanique.
1.3.4.5
Antibiothérapie
L’objectif du thérapeute face à un patient en sepsis sévère ou en choc septique est l’administration d’agents antimicrobiens efficaces par voie intraveineuse au cours de la première heure suivant le diagnostic (69). Chaque heure de retard dans l’administration d’antibiotiques efficaces est associée à un taux de mortalité mesurable (110). Lors de situations cliniques relevant de l’extrême urgence, les prélèvements microbiologiques ne doivent pas retarder le traitement antibiotique.
Il est recommandé un traitement initial empirique anti-infectieux comprenant l’administration d’un ou plusieurs médicaments couvrant l’ensemble des pathogènes suspectés (bactériens et/ou fongiques ou viraux), à des concentrations suffisantes et accessibles au site de l’infection (112). Lors du sepsis sévère et du choc septique, les doses prescrites doivent être maximales d’emblée, parentérales, du fait du bas débit mésentérique limitant l’absorption digestive, souvent avec une dose de charge initiale (113).
Le choix est d’abord guidé par l’orientation clinique quand il existe un foyer identifié mais aussi par :
• Les antécédents du patient, les comorbidités (insuffisance rénale ou hépato-cellulaire en particulier) et les allergies connues
• L’épidémiologie générale et locale en particulier si l’infection est hospitalière.
Il est recommandé que l’antibiothérapie soit quotidiennement réévaluée : tolérance, efficacité, adaptations aux résultats bactériologiques, relais oral. Cela permet de réduire sa toxicité, d’améliorer son efficacité, de prévenir le développement de résistance bactérienne et de réduire son coût (69).
1.3.4.6
Autres thérapeutiques
a) AminesLes recommandations de la campagne « survivre au sepsis » de 2012 préconise que le traitement vasopresseur cible initialement une PAM de 65 mmHg, et que le vasopresseur à privilégier est la noradrénaline. Elle est plus efficace que la dopamine pour corriger l’hypotension chez les patients atteints de choc septique. L’utilisation de la dopamine comme agent vasopresseur en remplacement de la noradrénaline peut s’avérer utile chez les patients dont la fonction systolique est altérée (69).
b) Corticostéroïdes
En cas de choc septique, l’administration d’hydrocortisone en intraveineuse est recommandée pour améliorer la sensibilité aux amines vasoactives et compenser l’insuffisance corticotrope relative. L’administration de corticostéroïdes est déconseillée dans le traitement du sepsis en l’absence de choc de par ses effets inhibiteurs du système immunitaire et de la réaction inflammatoire (69).
1.4
Hypophosphorémie et sepsis
L’association entre sepsis et hypophosphorémie est connue depuis des décennies puisqu’en 1969, Riedler et Scheitlin (37), reportaient déjà 22 cas d’hypophosphorémie chez 54 patients atteints de septicémie. Plus récemment, deux études ont observé que 60 à 80% des patients infectés présentaient un épisode d’hypophosphorémie au cours de leur hospitalisation contre
être plus volontiers associée aux infections à bactérie gram negatif qu’à gram positif (37). Une étude suggère que l’hypophosphorémie pourrait être un facteur de risque de décès dans le sepsis (115).
A ce jour, si l’association entre sepsis et hypophosphorémie est admise, le manque d’études fonctionnelles n’a pas permis d’établir ou de réfuter une causalité. La physiopathologie de l’hypophosphorémie dans le sepsis demande à être davantage explorée.
1.4.1 Éléments en faveur de l’implication du sepsis dans le
développement d’une hypophosphorémie
Peu d’études fonctionnelles se sont intéressées aux conséquences du sepsis sur la phosphorémie. En 1972, Doak et al. (10) ont réalisé un modèle de sepsis induit par l’inoculation de Salmonella Typhimurium, une bactérie gram négatif, chez le cochon d’Inde pour observer l’évolution de la phosphorémie. Après l’injection bactérienne, ils observaient une diminution progressive de la phosphorémie d’environ 30 à 40% en 5 à 10 jours, et ceci malgré une supplémentation en phosphore.
Une hypothèse physiopathologique est une redistribution du phosphore vers le compartiment intracellulaire sous l’action de cytokines pro-inflammatoires comme l’IL-6 et le TNF alpha (7). Il reste néanmoins difficile de distinguer l’effet propre du sepsis sur la phosphorémie, des effets des conséquences du sepsis comme l’acidose.
1.4.2 Éléments en faveur de l’implication de l’hypophosphorémie
dans le développement du sepsis
L’étude de Doak et al. (10) précédemment citée visait à évaluer, sur modèle animal, l’impact de la supplémentation en phosphore sur la survie au cours du sepsis. Une infection à Salmonella typhimurium a été induite chez deux groupes d’une soixantaine de cochons d’Inde. Après injection de l’agent infectant, les deux groupes ont reçu une supplémentation en phosphore continue au cours des 30 jours de l’étude. Le premier groupe recevait 2,5 fois moins de phosphore que le second. L’observation a montré une survie à 30 jours significativement plus importante dans le groupe fortement supplémenté (90%) que dans le
groupe faiblement supplémenté (46%). Le nombre de leucocytes à 8 jours était significativement plus important dans le groupe fortement supplémenté.
Si cette étude fait l’hypothèse que la supplémentation en phosphore pourrait améliorer la survie au cours de l’infection, l’étude de Craddock et al. (8), réalisée chez l’animal, suggère que l’hypophosphorémie pourrait également favoriser la survenue d’une infection. Vingt-huit chiens ont été dénutris pendant 4 semaines puis renutris à l’aide d’un cathéter central. Dix sujets ont été renutris avec une alimentation riche en phosphore et 18 avec une alimentation pauvre en phosphore. Treize de ces 18 sujets (72%) ont contracté une infection (infections sur cathéter, endocardites, pneumopathies) contre un sur dix (10%) dans le groupe renutris en phosphore.
Si l’on postule que l’hypophosphorémie pourrait favoriser la survenue d’une infection ou en aggraver le pronostic, deux hypothèses physiopathologiques non exclusives sont à considérer. L’hypophosphorémie pourrait avoir une action délétère sur le système immunitaire, et/ou avoir une action sur les agents infectieux.
1.4.2.1
Effet de l’hypophosphorémie sur l’immunité innée
L’étude sur l’animal de Craddock et al. (8) précédemment citée observe une plus grande fréquence d’infections dans le groupe non supplémenté en phosphore. L’analyse fonctionnelle des polynucléaires neutrophiles des sujets montre une corrélation de la fonctionnalité leucocytaire à la phosphorémie. Les polynucléaires neutrophiles des sujets en hypophosphorémie ont un chimiotactisme diminué, une capacité de phagocytose moindre et sont capables de lyser moins de bactéries.
Cette étude suggère que l’hypophosphorémie pourrait altérer les défenses immunitaires innées. Cette notion n’a pas été étayée par d’autres travaux et l’immunologie dans son ensemble ne s’est, à ce jour, pas intéressée à la phosphorémie.
1.4.2.2
Effet de la concentration en phosphore du milieu sur la bactérie :
rôle du Pho régulon
L'une des qualités remarquables des bactéries est leur capacité d'adaptation aux conditions changeantes de l'environnement. La compétition pour les nutriments avec d'autres micro-organismes, en particulier dans le sol, où les conditions nutritionnelles sont très variables, a conduit les bactéries à développer des mécanismes pour adapter rapidement leur métabolisme. Le phosphate inorganique est l’un des éléments nutritifs essentiels se trouvant fréquemment en faibles concentrations dans la nature. Les bactéries, ainsi que d'autres organismes comme les levures, ont mis au point plusieurs systèmes pour faire face à la rareté de cet élément nutritif. À ce jour, le mécanisme de réponse à un manque de phosphore le plus étudié est le régulon Phosphate (Pho régulon).
Le Pho régulon désigne un ensemble de mécanismes impliqués dans la régulation du phosphate inorganique de la bactérie. Il a été identifié initialement chez Escherichia coli puis dans de nombreuses autres espèces bactériennes (116).
C’est l'un des mécanismes de régulation les plus sensibles et les plus efficaces que possèdent les bactéries. Lorsque la concentration en phosphore dans le milieu extra bactérien est importante (>4mmol/L), le Pho régulon est inhibé. Si le phosphore vient à manquer, l’expression des gènes régulés par le Pho régulon peut être augmentée plus de cent fois (116). Les estimations quant au nombre de gènes dont l’expression est régulée par le phosphate inorganique environnemental varient considérablement. Chez E.coli, environ 400 protéines, près de 10% du protéome, seraient sous la dépendance du phosphore environnemental par l’intermédiaire du Pho régulon(117). De nouveaux gènes sous la dépendance du Pho régulon sont découverts chaque année chez différentes bactéries, mais l’ensemble des fonctions et des effets de ces modifications reste encore mal connu.
Fort logiquement, les protéines les plus couramment surexprimées par le Pho régulon sont impliquées dans les mécanismes permettant à la bactérie d'obtenir davantage de phosphore ; soit en augmentant le transport de phosphore vers la bactérie, soit en assimilant le phosphate à partir de molécules comme des phosphates organiques. Mais les modifications phénotypiques peuvent être bien plus complexes et pourraient modifier le comportement de la bactérie et influencer sa pathogénicité et sa virulence.