Design et synthèse d’inhibiteurs d’une
ectonucléotide pyrophosphatase/phosphodiestérase
de type 1 (ENPP1) et leur activité anticancéreuse
Mémoire
Carole-Anne Lefebvre
Maîtrise en chimie
Maître ès sciences (M. Sc.)
Québec, Canada
© Carole-Anne Lefebvre, 2016
iii
Résumé
La calcification de la valve aortique (CVA) est une maladie cardiovasculaire de plus en plus répandue, particulièrement en Amérique du Nord. Elle cause le rétrécissement de la valve aortique et le seul traitement actuellement disponible est le remplacement chirurgical. Des études menées par le Dr Patrick Mathieu (Institut de Cardiologie et de Pneumologie de Québec) ont montré qu’une surexpression d’une ectonucléotide pyrophosphatase/phosphodiestérase de type 1 (ENPP1) est à l’origine de cette sténose. Une solution à cette maladie serait donc de trouver un inhibiteur d’ENPP1. Inspirées des travaux du groupe de Pfizer visant ENPP1 pour le traitement de la chondrocalcinose articulaire et l’ostéoarthrite, quelques familles d’inhibiteurs de type quinazoline-4-pipéridine sulfamides (QPS) ont été synthétisés et testées in vitro. Une étude en modélisation moléculaire sur le site potentiel de liaison des inhibiteurs sur ENPP1 est en cours, en collaboration avec le Pr Patrick Lagüe (Université Laval, Département de biochimie, microbiologie et bio-informatique) et son équipe pour optimiser le design de la structure des composés.
Les composés d’une des familles, les QPS-pyrimidine, ont été testés in vitro sur quelques lignées cellulaires cancéreuses (HT-1080, HT-29, M21 et MCF-7) pour mesurer leur activité antiproliférative. Ces composés ont une inhibition de croissance médiane (IC50) de l’ordre du micromolaire et
représentent donc un point de départ intéressant pour la mise au point de nouveaux traitements anticancéreux.
v
Abstract
The calcification of the aortic valve (CAV) is a cardiovascular disease increasingly widespread, particularly in North America. It causes narrowing of the aortic valve and currently available only treatment is surgical replacement. Studies by Dr. Patrick Mathieu (Institute of Cardiology and
Pneumology of Quebec) showed that overexpression of an ectonucleotide
pyrophosphatase/phosphodiesterase type 1 (ENPP1) is the origin of the stenosis. A solution to this disease would be to find an inhibitor of ENPP1.
Inspired by Pfizer’s group works on ENPP1 for the treatment of osteoarthritis and chondrocalcinosis, some members of the quinazoline-4-piperidine sulfonamides (QPS) inhibitor family were synthesized and tested in vitro. A study in molecular modelling on the potential binding site inhibitor on ENPP1 is underway in collaboration with Prof. Patrick Lagüe (Université Laval, Department of biochemistry, microbiology and bioinformatics) and his team to optimize the design of compounds structure.
The compounds of one family, the QPS-pyrimidine, were tested in vitro on some cancer cell lines (HT-1080, HT-29, M21 and MCF-7) to measure their antiproliferative activity. These compounds have a median growth inhibition (GI50) in the micromolar range and thus represent an interesting starting point
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... xi
Liste des schémas ... xiii
Liste des abréviations ... xv
Remerciements ... xvii
Chapter 1 – Introduction ... 1
1.1. Présentation générale du projet ... 1
1.2. Inhibiteurs d’ENPP1 ... 1
1.2.1. Calcification de la valve aortique ... 1
1.2.1.1. Facteurs de la maladie ... 2
1.2.1.2. Traitement disponible ... 2
1.2.1.3. Processus de minéralisation dans les cellules valvulaires interstitielles ... 2
1.2.2. ENPP1 ... 4
1.2.2.1. Famille ENPP ... 4
1.2.2.2. Rôles d’ENPP1 ... 4
1.2.3. Inspiration de la littérature ... 5
1.2.3.1. Présentation des familles de composés ... 5
1.2.4. Modélisation moléculaire ... 7
1.3. Activité anticancéreuse ... 9
1.3.1. Antimétabolites antagonistes des pyrimidines ... 9
1.3.2. Activité antiproliférative ... 10
Chapter 2 – Synthèse ... 11
2.1. Synthèse des groupements pipéridine-sulfamide ... 11
2.1.1. Synthèse du groupement pipéridine-sulfamide avec n = 2 ... 11
2.1.2. Synthèse du groupement pipéridine-sulfamide avec n = 1 ... 12
2.2. Synthèse des composés QPS1 et QPS2 ... 13
2.3. Synthèse de la famille QPS-pyrimidine ... 14
2.3.1. Inhibiteurs d’ENPP1 ... 14
2.3.1.1. Couplage de Suzuki-Miyaura... 14
2.3.1.2. Substitution nucléophile aromatique ... 16
2.3.2. Activité anticancéreuse ... 18
2.3.2.1. Couplage de Suzuki-Miyaura optimisé ... 18
2.3.2.2. Substitution nucléophile aromatique optimisée ... 21
2.4. Synthèse du composé QPS-pipérazine ... 25
2.4.1. Première stratégie de synthèse ... 26
2.4.2. Deuxième stratégie de synthèse ... 27
2.4.3. Troisième stratégie de synthèse ... 29
2.5. Synthèse du composé QPS-triazoline ... 30
viii
2.6.1. Première stratégie de synthèse ... 33
2.6.2. Deuxième stratégie de synthèse ... 34
2.6.3. Troisième stratégie de synthèse ... 36
2.7. Modification des groupements méthoxyles ... 36
2.7.1. Première stratégie de synthèse ... 37
2.7.2. Deuxième stratégie de synthèse ... 38
2.7.3. Troisième stratégie de synthèse ... 39
Chapter 3 – Résultats biologiques ... 43
3.1. Essais enzymatiques avec ENPP1 ... 43
3.1.1. Procédure ... 43
3.1.2. Résultats ... 43
3.2. Tests antiprolifératifs ... 46
3.2.1. Procédure ... 46
3.2.1.1. Culture des lignées cellulaires cancéreuses ... 47
3.2.1.2. Essais antiprolifératifs ... 47
3.2.2. Résultats préliminaires ... 48
3.2.3. Activité antiproliférative de la famille QPS-pyrimidine ... 51
Chapter 4 – Conclusion ... 55
4.1. Conclusion générale ... 55
4.2. Perspectives et travaux futurs ... 56
Chapter 5 – Experimental section ... 57
5.1. General information ... 57
5.2. Piperidine-sulfamide groups and QPS1-2 compounds ... 57
5.3. QPS-pyrimidine compounds ... 58
5.3.1. Suzuki-Miyaura coupling ... 58
5.3.1.1. ENPP1 Inhibitors ... 58
5.3.1.2. Anticancer Activity ... 60
5.3.2. Aromatic Nucleophilic Substitution ... 66
5.3.2.1. ENPP1 Inhibitors ... 66
5.3.2.2. Anticancer Activity ... 71
5.4. QPS-piperazine compound ... 83
5.5. QPS-cyclic triazole compound ... 86
5.6. QPS-fluorine compound ... 87
5.7. Methoxyl modification ... 89
ix
Liste des tableaux
Tableau 2.1 Comparaison des rendements obtenus avec les différentes conditions réactionnelles du
couplage de Suzuki-Miyaura ... 20
Tableau 2.2 Comparaison des rendements obtenus avec les différentes conditions réactionnelles de la substitution nucléophile aromatique de la série avec n = 1 ... 23
Tableau 2.3 Comparaison des rendements obtenus avec les différentes conditions réactionnelles de la substitution nucléophile aromatique de la série avec n = 2 ... 23
Tableau 2.4 Comparaison des rendements obtenus avec la substitution nucléophile aromatique optimisée entre les séries n = 1 et n = 2 ... 25
Tableau 3.1 Résultats d’inhibition d’ENPP1-humain pour la famille QPS-pyrimidine ... 45
Tableau 3.2 Résultats d’inhibition d’ENPP1-humain pour la famille QPS-pipérazine ... 46
Tableau 3.3 Lignées cellulaires cancéreuses ... 47
Tableau 3.4 Résultats préliminaires (M, ± 5%) pour les familles QPS et QPS-styryle... 48
Tableau 3.5 Résultats préliminaires (M, ± 5%) pour la famille QPS-pyrimidine ... 50
xi
Liste des figures
Figure 1.1 Mécanisme de minéralisation dans les cellules valvulaires interstitielles ... 3
Figure 1.2 Structure des inhibiteurs proposés ... 5
Figure 1.3 Familles de composés ... 6
Figure 1.4 Structure d’ENPP1-humain ... 7
Figure 1.5 Localisation du site de liaison potentiel de QPS1 dans ENPP1 ... 8
Figure 1.6 Vue interne du site de liaison potentiel et interactions avec le ligand ... 9
Figure 1.7 Principaux antimétabolites antagonistes des pyrimidines ... 10
Figure 2.1 Structure du groupement pipéridine-sulfamide ... 11
Figure 2.2 Structure des composés de la famille QPS-pyrimidine ... 14
Figure 2.3 Groupements pyrimidine formés suite au couplage de Suzuki-Miyaura et produit secondaire majoritaire formé ... 16
Figure 2.4 Composés QPS-pyrimidine avec n = 2 ... 17
Figure 2.5 Composés QPS-pyrimidine avec n = 1 ... 18
Figure 2.6 Groupements pyrimidine formés suite au couplage de Suzuki-Miyaura optimisé ... 20
Figure 2.7 Composés QPS-pyrimidine avec n = 1, obtenus avec la méthode optimisée ... 22
Figure 2.8 Composés QPS-pyrimidine avec n = 2, obtenus avec la méthode optimisée ... 24
Figure 2.9 Structure du composé QPS-pipérazine ... 25
Figure 2.10 Structure possible du produit obtenu ... 29
Figure 2.11 Structure du composé QPS-triazoline ... 31
Figure 2.12 Structure du composé QPS-fluor ... 33
Figure 2.13 Différenciation des groupements hydroxyles de l’intermédiaire 50... 37
Figure 3.1 Structure des composés QPS1-2 ... 44
Figure 3.2 (A) Pourcentage d’inhibition d’ENPP1 de QPS1; (B) Diagramme de Dixon de QPS1 ... 44
Figure 3.3 (A) Pourcentage d’inhibition d’ENPP1 de QPS2; (B) Diagramme de Dixon de QPS2 ... 44
Figure 3.4 Structure des composés de la famille QPS-pyrimidine ... 45
Figure 3.5 Structure du composé QPS22∙HCl ... 46
Figure 3.6 Structure des composés des familles QPS et QPS-styryle ... 49
Figure 3.7 Structure des composés de la famille QPS-pyrimidine ... 50
xiii
Liste des schémas
Schéma 2.1 Voie de synthèse du groupement pipéridine-sulfamide avec n = 2 ... 11
Schéma 2.2 Voie de synthèse du groupement pipéridine-sulfamide avec n = 1 ... 12
Schéma 2.3 Substitution nucléophile aromatique menant aux composés QPS ... 13
Schéma 2.4 Couplage de Suzuki-Miyaura ... 14
Schéma 2.5 Cycle catalytique du couplage de Suzuki-Miyaura ... 15
Schéma 2.6 Substitution nucléophile aromatique menant aux composés QPS-pyrimidine ... 16
Schéma 2.7 Couplage de Suzuki-Miyaura optimisé ... 19
Schéma 2.8 Substitution nucléophile aromatique optimisée ... 21
Schéma 2.9 Première voie de synthèse menant au composé QPS-pipérazine ... 27
Schéma 2.10 Voie de synthèse du groupement sulfamide 31 ... 27
Schéma 2.11 Voie de synthèse du groupement pipérazine-sulfamide ... 28
Schéma 2.12 Substitution nucléophile aromatique menant au composé QPS-pipérazine ... 29
Schéma 2.13 Voie de synthèse du composé QPS22∙HCl ... 30
Schéma 2.14 Synthèse du produit 42 ... 31
Schéma 2.15 Voie de synthèse du composé QPS-triazoline ... 32
Schéma 2.16 Première stratégie de synthèse problématique du composé QPS-fluor ... 34
Schéma 2.17 Voie de synthèse menant au groupement 3-fluoropipéridine-sulfamide ... 34
Schéma 2.18 Substitution nucléophile aromatique menant au composé QPS-fluor... 35
Schéma 2.19 Alternative envisagée pour la réduction de l’acrylonitrile 45 ... 36
Schéma 2.20 Clivage des méthoxyles ... 37
Schéma 2.21 Différenciation des groupements hydroxyles de la molécule 50 ... 38
Schéma 2.22 Hydrolyse et clivage des méthoxyles... 38
Schéma 2.23 Différenciation des groupements hydroxyles de la molécule 53 ... 39
Schéma 2.24 Voie de synthèse utilisant la DL-méthionine ... 39
Schéma 2.25 Voie de synthèse envisagée pour l’obtention de nouveaux inhibiteurs potentiels d’ENPP1 avec une modification des groupements méthoxyles ... 40
Scheme 5.1 Suzuki-Miyaura coupling ... 58
Scheme 5.2 Optimized Suzuki-Miyaura coupling ... 60
Scheme 5.3 Aromatic nucleophilic substitution ... 66
xv
Liste des abréviations
Ac acétyle
ADN acide désoxyribonucléique
ADP adénosine diphosphate
AMP adénosine monophosphate
ARN acide ribonucléique
ATP adénosine triphosphate
Bn benzyle
Boc tert-butyloxycarbonyle
CAV calcification of the aortic valve
Cbz carboxybenzyle
CL50 concentration létale médiane
CVA calcification de la valve aortique
DCM dichlorométhane
DIPEA N,N-diisopropyléthylamine
DMA N,N-diméthylacétamide
DMAP 4-diméthylaminopyridine
DMEM Dulbecco’s Modified Eagle’s Medium
DMF N,N-diméthylformamide
DMSO diméthylsulfoxyde
DMSO-d6 hexadeutérodiméthylsulfoxyde
ENPP ectonucléotide pyrophosphatase/phosphodiestérase
ENPP1 ectonucléotide pyrophosphatase/phosphodiestérase de type 1
équiv équivalent
ESI electrospray ionization
GP groupement protecteur
HRMS spectrométrie de masse haute résolution
IC50 inhibition de croissance médiane
IR infrarouge
ITC inhibition totale de croissance
Ki constante d’inhibition
MOM méthoxyméthyle
NMR nuclear magnetic resonance
NUC nuclease-like
Pi phosphate inorganique
Piv pivaloyle
pNP-TMP para-nitrophényle thymidine 5’-monophosphate
PPi pyrophosphate inorganique
QPS quinazoline-4-pipéridine sulfamide
quant. quantitatif
RMN résonance magnétique nucléaire
SILCS Site-Identification by Ligand Competitive Saturation
xvi
TLC thin-layer chromatography
TMS tetramethylsilane ou triméthylsilyle
TP température pièce
xvii
Remerciements
Je tiens tout d’abord à remercier mon directeur de recherche, le Pr Jean-François Paquin, pour m’avoir donné la chance de compléter mes travaux de maîtrise au sein de son laboratoire. Merci pour ta grande disponibilité et tes conseils judicieux qui m’ont permis d’avancer. Je voudrais également remercier mon co-directeur le Pr Patrick Lagüe, du département de biochimie, microbiologie et bio-informatique.
Que serait un projet multidisciplinaire sans collaborateurs? Merci au Dr Patrick Mathieu, de l’Institut de cardiologie et de pneumologie de Québec, d’avoir initié le projet sur les inhibiteurs d’ENPP1. Par le fait même, je voudrais exprimer ma gratitude envers Marie-Chloé Boulanger et Elnur Elyar Shayhidin pour s’être occupées de tout le côté biochimie du projet. Pour la partie sur la modélisation moléculaire, je voudrais témoigner ma reconnaissance au Pr Patrick Lagüe et surtout à Xavier Barbeau. Enfin, pour le côté chimie organique du projet, je voudrais remercier chaleureusement ma collègue Elsa Forcellini avec qui j’ai fait la synthèse des composés et aussi notre stagiaire, Sophie Boutin. Sans vous tous, ce projet n’aurait pas pu aussi bien avancer!
Un gros merci plus spécial pour le Dr René C.-Gaudreault pour m’avoir supportée dans les démarches des essais antiprolifératifs. Merci aussi à votre équipe, tout particulièrement à Jacques Lacroix et Marie-France Côté pour tous les tests antiprolifératifs sur mes molécules (assez nombreuses!). C’est aussi vous, René, qui m’avez offert ma première opportunité de stage, lors de mon baccalauréat et je vous en suis grandement reconnaissante. Vous m’avez donné l’étincelle nécessaire pour avoir la passion pour la chimie et la recherche et c’est en partie grâce à vous si je me suis rendue aussi loin dans mon parcours académique.
Bien évidemment, j’aimerais remercier tous les membres du groupe du Pr Paquin que j’ai pu côtoyer, au cours de ma maîtrise. Merci pour l’ambiance agréable au laboratoire Pier Alexandre, Myriam, Justine, Marie-Claude, Jean-Denys, Jean-François, Mathilde, Rémy, Massaba, Thomas, Audrey et tous les stagiaires!
J’aimerais également souligner le travail exceptionnel et attentif des techniciens de laboratoire et du personnel de soutien du département de chimie, plus particulièrement ceux avec qui j’ai eu la chance de travailler : Pierre Audet, Jean Laferrière, Christian Côté, Mélanie Tremblay, Denyse Michaud et Marie Tremblay.
xviii
Je voudrais dire un énorme merci à ma famille et mes amis pour leur soutien inconditionnel. Merci à mes parents, Hélène et Denis et à ma sœur, Lisabelle, pour avoir cru en moi et pour m’avoir encouragée, tout au long de mon parcours. Merci aussi à mes amis, de l’Université ou de l’extérieur, pour m’avoir épaulée et écoutée.
Pour finir, je tiens à souligner la contribution de mon conjoint, Daniel, sur qui je pouvais compter lors de mes moments de doute. Ton fidèle soutien, ton écoute et ta patience m’ont été très précieux. Grâce à toi, j’ai eu le courage et la détermination nécessaires pour avancer. Tu m’as aidée à dépasser mes limites et à voir les choses en grand et je t’en serai toujours reconnaissante. Merci pour ta présence réconfortante, je t’aime!
1
Chapter 1 – Introduction
1.1. Présentation générale du projet
L’objectif principal de ce projet de maîtrise était de synthétiser des inhibiteurs de l’ectonucléotide pyrophosphatase/phosphodiestérase de type 1 (ENPP1) afin de contrer la calcification de la valve aortique (CVA). Pour ce faire, une approche multidisciplinaire a été employée, afin d’étudier à la fois les effets des inhibiteurs sur l’enzyme (biochimie), la structure et le site de liaison potentiel de l’enzyme (modélisation moléculaire) et le design et la synthèse des inhibiteurs (synthèse organique).
Ce projet multidisciplinaire a donc demandé d’étroites collaborations entre plusieurs experts. Tout d’abord, le Dr Patrick Mathieu, instigateur du projet, et son équipe (Marie-Chloé Boulanger et Elnur Elyar Shayhidin), de l’Institut de cardiologie et de pneumologie de Québec sont les responsables du domaine de la biochimie, incluant les essais enzymatiques. Par la suite, le Pr Patrick Lagüe et son étudiant, Xavier Barbeau, du département de biochimie, microbiologie et bio-informatique de l’Université Laval sont garants de la modélisation moléculaire. Finalement, le Pr Jean-François Paquin et son équipe (Elsa Forcellini et moi-même) s’occupent de la synthèse organique des composés. En parallèle, j’ai également travaillé sur un deuxième projet qui consiste à étudier l’activité anticancéreuse d’une famille de composés qui a été synthétisée pour le projet sur les inhibiteurs d’ENPP1. En effet, la famille QPS-pyrimidine n’a pas présenté d’activité enzymatique, mais comporte des propriétés antiprolifératives intéressantes. Des études plus approfondies ont alors été faites sur ces molécules.
1.2. Inhibiteurs d’ENPP1
1.2.1. Calcification de la valve aortique
La calcification de la valve aortique (CVA) est une maladie cardiovasculaire qui cause un rétrécissement des parois de la valve aortique. Cette maladie avance progressivement en débutant par une sclérose aortique et est suivie d’une sténose.1 Ainsi, les feuillets valvulaires commencent par subir
un épaississement et un durcissement (sclérose), puis à mesure que la maladie avance, il s’en suit d’un rétrécissement (sténose).
2
À long terme, la CVA entraîne un mauvais flux sanguin et quelques symptômes peuvent se faire sentir, tels que des douleurs à la poitrine, le souffle court et des étourdissements.2 De plus, cette maladie est
responsable d’une augmentation de 40% des risques d’infarctus du myocarde et de 50% de décès cardiovasculaire.1
La CVA ne montre pas de symptôme dès son apparition et peut progresser pendant plusieurs années avant d’être détectée. Par contre, il est possible de la repérer par une auscultation cardiaque et une échocardiographie Doppler.3
1.2.1.1. Facteurs de la maladie
Les principaux facteurs causant la CVA sont l’âge, le tabagisme, le sexe masculin, l’hypertension, un taux de cholestérol élevé, une insuffisance rénale et le diabète.2 La sclérose aortique est présente chez
25% des gens entre 65 et 74 ans et chez 50% des gens de plus de 84 ans.1
1.2.1.2. Traitement disponible
Le seul traitement actuellement disponible pour enrayer la CVA est le remplacement chirurgical de la valve aortique. C’est notamment la cause la plus commune pour cette opération, aux États-Unis, avec environ 50 000 remplacements annuels.2
Aucun traitement pharmaceutique n’est encore disponible pour guérir ou même ralentir la maladie.
1.2.1.3. Processus de minéralisation dans les cellules valvulaires interstitielles Le développement de la maladie est similaire à la formation osseuse; c’est-à-dire qu’il y a un processus de minéralisation qui a lieu dans la valve aortique. Ce dernier se déroule dans les cellules valvulaires interstitielles, qui sont le principal constituant de la valve aortique, et est déclenché par l’apoptose de celles-ci. Des études du Dr Patrick Mathieu, de l’Institut universitaire de cardiologie et de pneumologie de Québec, ont montré que l’ectonucléotide pyrophosphatase/phosphodiestérase de type 1 (ENPP1)
2 Rajamannan, N. M. Arterioscler. Thromb. Vasc. Biol. 2009, 29, 162-168.
3 Côté, N.; El Husseini, D.; Pépin, A.; Bouvet, C.; Gilbert, L.-A.; Audet, A.; Fournier, D.; Pibarot, P.; Moreau, P.;
3 est directement reliée au développement de la maladie, en élucidant le mécanisme de la calcification des feuillets de la valve aortique, illustré à la Figure 1.1. 4
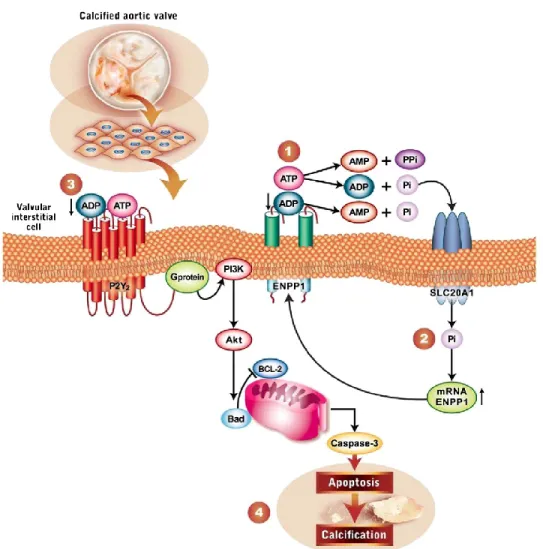
Figure 1.1 Mécanisme de minéralisation dans les cellules valvulaires interstitielles4
En premier lieu, un niveau élevé de phosphate inorganique (Pi) est produit par la surexpression d’ENPP1. Cette enzyme hydrolyse l’adénosine triphosphate (ATP) en adénosine monophosphate (AMP) et en pyrophosphate (PPi), mais aussi en adénosine diphosphate (ADP) et en Pi. Cet ADP peut être encore utilisé comme substrat par ENPP1 pour former de l’AMP et du Pi. Il est à noter que le Pi favorise la calcification, alors que le PPi l’inhibe.5 En deuxième lieu, le Pi ainsi formé est acheminé
dans l’espace intracellulaire par la protéine transmembranaire SLC20A1. Ce phénomène entraîne alors la surexpression d’ENPP1 dans une boucle de rétroaction, ce qui l’amène, en troisième lieu, à
4 Côté, N.; El Husseini, D.; Pépin, A.; Guauque-Olarte, S.; Ducharme, V.; Bouchard-Cannon, P.; Audet, A.;
Fournier, D.; Gaudreault, N.; Derbali, H.; McKee, M. D.; Simard, C.; Després, J.-P.; Pibarot, P.; Bossé, Y.; Mathieu, P. J. Mol. Cell. Cardiol. 2012, 52, 1191-1202.
4
consommer toute l’ATP restant dans les cellules valvulaires interstitielles. Le récepteur P2Y2 diminue
alors la signalisation purinergique qui mène à un arrêt de la voie PI3K/Akt, qui assure normalement la survie des cellules valvulaires interstitielles. En dernier lieu, l’apoptose est provoquée et le processus de calcification débute.
1.2.2. ENPP1
Comme mentionné dans la section précédente, l’enzyme ENPP1 est directement impliquée dans le déclenchement de la CVA. Il est possible de présumer qu’un inhibiteur de cette dernière pourrait être la solution pour enrayer la maladie.
Les sections suivantes décrivent brièvement l’enzyme.
1.2.2.1. Famille ENPP
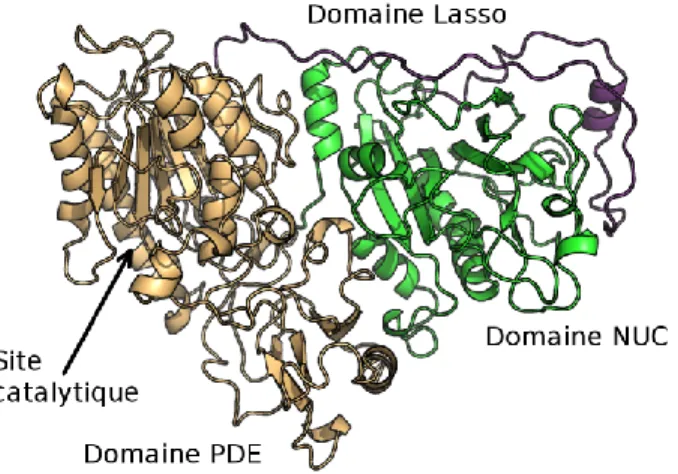
ENPP1 fait partie d’une famille d’ectonucléotides pyrophosphatases/phosphodiestérases (ENPP) comportant sept membres. Elles sont retrouvées principalement à la surface des cellules en tant que protéines transmembranaires. Leur rôle est d’hydrolyser les liens pyrophosphates ou phosphodiesters dans une variété de composés extracellulaires. Ainsi, ces protéines comportent toutes un domaine catalytique, composé de près de 400 résidus, bien spécifique à un substrat donné. Elles comportent également un domaine nuclease-like (NUC) et un domaine lasso. 6
Les ENPP jouent donc un rôle dans plusieurs processus cellulaires. Entre autres, elles interviennent dans la prolifération cellulaire, la mobilité, l’angiogenèse, la minéralisation osseuse et la digestion. De plus, elles peuvent également être responsables de quelques désordres au niveau du cancer et de maladies de résistance à l’insuline ou de calcification, telle que la CVA.6
1.2.2.2. Rôles d’ENPP1
Comme mentionné à la Section 1.2.1.3, ENPP1 est responsable de l’hydrolyse de l’ATP en AMP et en PPi. Cependant, selon la façon dont le substrat (ATP) se présente à ENPP1, il est possible d’hydrolyser ce dernier en ADP et en Pi. Par la suite, l’enzyme peut reprendre l’ADP en tant que substrat et l’hydrolyser à nouveau. Ainsi, ENPP1 est responsable de l’équilibre entre Pi et PPi.6
5
1.2.3. Inspiration de la littérature
La structure exacte d’ENPP1 chez l’humain n’est pas encore connue. Ainsi, afin de créer des inhibiteurs potentiels de cette enzyme, nous nous sommes inspirés de la littérature. Des travaux réalisés par le Dr Kablaoui, chez Pfizer ont été publiés, montrant des inhibiteurs d’ENPP1, pour le traitement de la chondrocalcinose articulaire et l’ostéoarthrite.7 Parmi les inhibiteurs proposés, la
structure montrée à la Figure 1.2 semblait être la plus prometteuse en tant qu’inhibiteur d’ENPP1. Ainsi, cette molécule, que nous avons nommée QPS (quinazoline-4-pipéridine sulfamide) a été notre point de départ pour la synthèse des composés subséquents.
Figure 1.2 Structure des inhibiteurs proposés
La molécule comportant deux atomes de carbone entre le groupement sulfamide et le groupement pyrimidine, QPS1, a été synthétisée avant mon arrivée, par Elsa Forcellini. Ce composé a ensuite été testé sur ENPP1 par l’équipe du Dr Mathieu et il a été déterminé qu’il s’agissait d’un inhibiteur non compétitif, c’est-à-dire qu’il se lie à un site allostérique sur l’enzyme.8
La molécule peut se diviser en trois sections, soient le groupement sulfamide, le groupement pipéridine et le groupement quinazoline. Chacun de ces groupements peut être modifié individuellement afin d’étudier les impacts au niveau de l’inhibition d’ENPP1 et ainsi optimiser la structure.
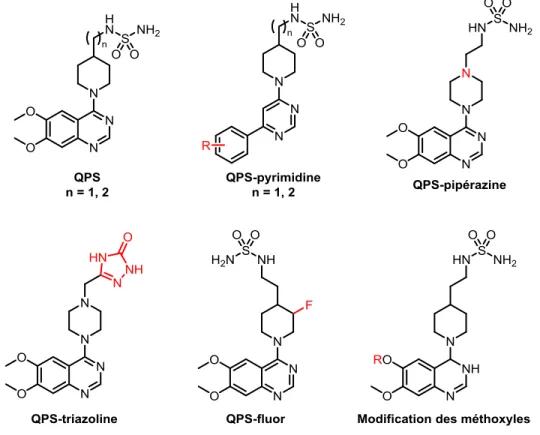
1.2.3.1. Présentation des familles de composés
Comme mentionné à la section précédente, les différents groupements de QPS ont été modifiés afin de créer de nouvelles familles de composés. La Figure 1.3 montre les composés sur lesquels j’ai travaillé au cours de ma maîtrise dans le laboratoire du Pr Paquin. Les composés de la famille QPS ont été faits
7 Patel, S. D.; Habeski, W. M.; Cheng, A. C.; de la Cruz, E.; Loh, C.; Kablaoui, N. M. Bioorg. Med. Chem. Lett. 2009, 19, 3339-3343.
8 Shayhidin, E. E.; Forcellini, E.; Boulanger, M.-C.; Mahmut, A.; Dautrey, S.; Barbeau, X.; Lagüe, P.; Sévigny, J.;
6
par Elsa Forcellini, avant mon arrivée au laboratoire. Ils ont été inclus dans le présent mémoire pour des fins de comparaison, puisqu’ils constituent le point de départ du projet.
La première série de composés, les QPS-pyrimidine, remplace le groupement quinazoline par un groupement pyrimidine. Ce motif avait été employé par le groupe de Pfizer7 et nous avons voulu
l’étudier en variant les groupements attachés à la pyrimidine.
La deuxième modification sur la structure des inhibiteurs proposés est la substitution de la pipéridine par la pipérazine. Étant donné que ces composés ne sont pas très solubles, nous avons pensé que l’ajout d’un atome d’azote pourrait augmenter leur solubilité.
Figure 1.3 Familles de composés
La troisième transformation consiste à changer le groupement sulfamide par un groupement triazoline. Il sera donc possible de comprendre le rôle de ce dernier et la place qu’il occupe dans le site de liaison d’ENPP1.
Le quatrième composé porte un atome de fluor sur le groupement pipéridine. Celui-ci permettra d’étudier les interactions avec les acides aminés avoisinants dans le site de liaison.
7 Finalement, les groupements méthoxyles de la quinazoline sont modifiés ou encore remplacés par d’autres groupements afin de bien combler tout l’espace dans le site de liaison de l’enzyme.
1.2.4. Modélisation moléculaire
La structure d’ENPP1 chez l’humain n’est pas encore connue. Par contre, afin d’optimiser la structure des inhibiteurs, des études en modélisation moléculaire ont été menées par le Pr Patrick Lagüe. La première étape de cette démarche consiste à trouver la structure d’ENPP1-humaine la plus probable. La séquence primaire d’ENPP1-humaine est disponible dans la banque de données UniProt9
et la séquence et la structure d’ENPP1 chez la souris, quant à elles, sont connues de la littérature.10
Ces deux séquences possèdent 80% d’identité.11 Avec une modélisation par analogie, il a donc été
possible d’obtenir la structure théorique d’ENPP1-humaine, qui est montrée à la Figure 1.4.
Figure 1.4 Structure d’ENPP1-humain12
Une fois que la structure d’ENPP1-humaine est prédite, il faut comprendre la dynamique de cette dernière pour savoir comment la liaison d’une molécule dans un site allostérique peut perturber le fonctionnement de la protéine. Ainsi, après six mois de calculs sur un superordinateur, il a été possible d’établir l’évolution de la position des atomes en fonction du temps. De cette manière, des réseaux
9 UniProt Consortium, UniProtKB - P22413 (ENPP1_HUMAN), URL : http://www.uniprot.org/uniprot/P22413# sequences, (accédé le17/10/2016).
10 Jansen, S.; Perrakis, A.; Ulens, C.; Winkler, C.; Andries, M.; Joosten, R. P.; Van Acker, M.; Luyten, F. P.;
Moolenaar, W. H.; Bollen, M. Structure, 2012, 20, 1948-1959.
11Buckley, M. F.; Loveland, K. A.; McKinstry, W. J.; Garson, M.; Goding, J. W. J. Biol. Chem. 1990, 265,
17506-17511.
12 Image de Xavier Barbeau (Laboratoire de Patrick Lagüe, Université Laval, Département de Biochimie,
8
d’interactions de corrélations ont été trouvés et permettent de faire la liaison entre les différents domaines de la protéine.
Enfin, un site de liaison potentiel a été trouvé dans ENPP1, à l’aide de la méthodologie SILCS
(Site-Identification by Ligand Competitive Saturation).13 Pour ce faire, des fragments de QPS1 et des
molécules d’eau ont été placés tout autour d’ENPP1, sur le logiciel NAMD.14 Par la suite, les
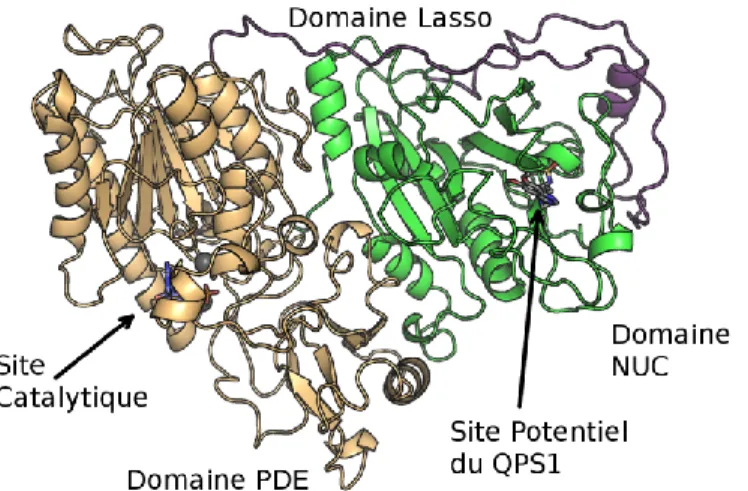
probabilités de présence, les densités de présence et les puits de potentiels ont été localisés, dans la protéine. Un site de liaison potentiel a été trouvé dans le domaine (NUC) d’ENPP1, tel qu’illustré à la Figure 1.5.
Figure 1.5 Localisation du site de liaison potentiel de QPS1 dans ENPP112
13 Guvench, O.; MacKerell, Jr., A. D. PLoS Comput. Biol. 2009, 5, 1-10.
14 Phillips, J. C., Braun, R.; Wang, W.; Gumbart, J.; Tajkhorshid, E.; Villa, E.; Chipot, C.; Skeel, R. D.; Kale, L.;
9
Figure 1.6 Vue interne du site de liaison potentiel et interactions avec le ligand12
La Figure 1.6 montre les interactions entre le ligand QPS1 et le site de liaison potentiel. Des interactions polaires se manifestent au niveau du groupement sulfamide avec les résidus HIS-747, TYR-683, THR-759 et ILE-762. Le reste de la molécule propose plutôt des interactions de type hydrophobes avec le site de liaison. Il est possible de remarquer qu’il reste de l’espace dans la cavité hydrophobe, d’où l’intérêt de créer des molécules avec les groupements méthoxyles modifiés. Ces derniers pourraient alors mieux combler cette cavité hydrophobe.
1.3. Activité anticancéreuse
Certains des composés qui ont été synthétisés au cours du projet sur les inhibiteurs d’ENPP1 n’ont pas montré d’activité enzymatique (voir Section 3.1.2). Cependant, nous avons entrepris de tester leur activité antiproliférative sur quelques lignées cellulaires cancéreuses afin d’étudier leurs autres propriétés. Notamment, nous avons choisi d’étudier la famille QPS-pyrimidine plus en profondeur.
1.3.1. Antimétabolites antagonistes des pyrimidines
Le motif pyrimidine est présent naturellement dans les bases nucléiques qui composent les brins d’acide désoxyribonucléique (ADN) et d’acide ribonucléique (ARN). En effet, la cytosine, la thymine et l’uracile sont des dérivés de la pyrimidine.
10
Les antagonistes des pyrimidines appartiennent à la classe d’agents antimétabolites, dans les traitements du cancer. On y retrouve, entre autres, le 5-fluorouracile, la gemcitabine et la cytarabine, montrés à la Figure 1.7.Leur rôle est de s’incorporer en tant que faux précurseurs dans les chaînes d’acides nucléiques composant les brins d’ADN ou d’ARN ou encore d’inhiber une enzyme qui métabolise les nucléotides.15
Figure 1.7 Principaux antimétabolites antagonistes des pyrimidines
Les composés de la famille QPS-pyrimidine pourraient donc avoir un effet antimétabolique sur des cellules cancéreuses.
1.3.2. Activité antiproliférative
L’activité antiproliférative d’un composé chimique se mesure avec différents paramètres. Tout d’abord, l’inhibition de croissance médiane (IC50) correspond à la concentration à laquelle la molécule inhibe la
croissance de la moitié de la population de cellules initiale. Ensuite, l’inhibition totale de croissance (ITC) est la concentration à laquelle la croissance de toute la population de cellules est inhibée. Finalement, il est possible de calculer la concentration létale médiane (CL50) qui coïncide avec la mort
de la moitié de la population de cellules initiale. Ainsi, la molécule aura une activité antiproliférative à des concentrations plus faibles que l’ITC et sera considérée comme cytotoxique à des concentrations plus élevées.
15 Maring, J. G.; Groen, H. J. M.; Wachters, F. M.; Uges, D. R. A.; de Vries, E. G. E. Pharmacogenomics J. 2005,
11
Chapter 2 – Synthèse
2.1. Synthèse des groupements pipéridine-sulfamide
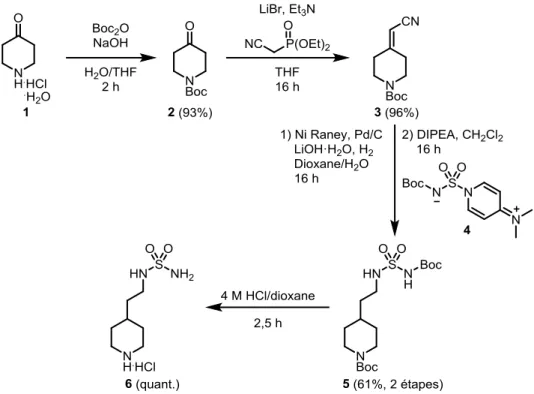
L’élaboration des voies de synthèse des groupements pipéridine-sulfamide avec n = 1 ou 2 (Figure 2.1) a été faite par Elsa Forcellini, avant mon arrivée au sein du laboratoire Paquin.8 Cette section de
molécule a été utilisée pour la synthèse des composés des familles QPS, QPS-pyrimidine et QPS-fluor.
Figure 2.1 Structure du groupement pipéridine-sulfamide
2.1.1. Synthèse du groupement pipéridine-sulfamide avec n = 2
La voie de synthèse menant au groupement pipéridine-sulfamide avec une chaîne à deux atomes de carbone est montrée au Schéma 2.1.
12
L’amine de l’hydrochlorure de 4-pipéridone monohydratée (1), disponible commercialement, a d’abord été protégée avec un groupement tert-butyloxycarbonyle (Boc), pour obtenir le composé 2, avec un rendement de 93%. Une réaction d’oléfination de type Horner-Wadsworth-Emmons a ensuite été engagée sur la cétone, afin de former l’acrylonitrile 3 à 96% avec le phosphonate correspondant. En deux étapes, 3 a été réduit dans une réaction d’hydrogénation avec le nickel de Raney, puis le groupement sulfamide a été additionné sur la molécule par une réaction de substitution nucléophile de type SN2 avec l’agent de sulfamoylation 4, préparé au préalable.16 Le rendement combiné obtenu pour
les deux étapes a été de 61%. Finalement, 5 a été déprotégé en conditions acides, pour synthétiser 6 de façon quantitative, sous forme de sel de chlorure d’hydrogène (HCl).
2.1.2. Synthèse du groupement pipéridine-sulfamide avec n = 1
La voie de synthèse menant au groupement pipéridine-sulfamide avec une chaîne à un atome de carbone est montrée au Schéma 2.2.
Schéma 2.2 Voie de synthèse du groupement pipéridine-sulfamide avec n = 1
La pipéridine-4-carboxamide (7), disponible commercialement a d’abord été protégée au niveau de l’amine secondaire avec un groupement benzyle (Bn). Une réaction avec l’hydrure d’aluminium-lithium a directement été engagée pour réduire l’amide en amine. Le produit 8, obtenu avec un rendement de
13 81% en deux étapes, a ensuite subit une substitution nucléophile de type SN2 dans les mêmes
conditions qu’utilisées pour la synthèse du groupement pipéridine-sulfamide avec n = 2 pour donner 9 à 77%. Le groupement Bn a été retiré dans des conditions d’hydrogénolyse pour laisser l’amine secondaire libre 10 avec 71% de rendement. Puis, dans les mêmes conditions acides que pour la voie de synthèse montrée précédemment, le groupement Boc a été retiré, pour donner la molécule désirée
11, sous forme de sel de HCl, de façon quantitative.
2.2. Synthèse des composés QPS1 et QPS2
Ces composés ont, encore une fois, été synthétisés par Elsa Forcellini.8 Ils sont présentés dans le
présent document pour des fins de comparaison avec les autres familles de composés QPS.
Pour former les molécules QPS1 (n = 2) et QPS2 (n = 1), il faut pratiquer une réaction de substitution nucléophile aromatique entre la 4-chloro-6,7-diméthoxyquinazoline (12), disponible commercialement et le groupement pipéridine-sulfamide correspondant (Schéma 2.3).
Schéma 2.3 Substitution nucléophile aromatique menant aux composés QPS
(a) 6, K2CO3, CH3CN, reflux, 16 h; (b) 11, K2CO3, iPrOH, reflux, 16 h
Le composé QPS1 a été obtenu dans les conditions (a) avec le groupement pipéridine-sulfamide 6 avec un rendement de 59%. Le composé QPS2, pour sa part, a été synthétisé dans les conditions (b) avec le groupement pipéridine-sulfamide 11. Le rendement de cette réaction a été de 78%. Il est à noter que seul le solvant change, entre les deux méthodes, pour une question de meilleure solubilité des molécules dans le milieu réactionnel.
14
2.3. Synthèse de la famille QPS-pyrimidine
Les composés qui font partie de la famille QPS-pyrimidine (Figure 2.2) ont été préparés de deux façons, soit une première pour le projet sur les inhibiteurs d’ENPP1, avec l’aide d’Elsa Forcellini et de Sophie Boutin, et une seconde optimisée pour les tests d’activité anticancéreuse. La Section 2.3.1 montrera la stratégie de synthèse utilisée ainsi que les produits issus de cette synthèse pour le premier projet. La Section 2.3.2 portera, quant à elle, sur la synthèse optimisée en vue de créer une bibliothèque de composés pour les études sur l’activité anticancéreuse de la famille QPS-pyrimidine.
Figure 2.2 Structure des composés de la famille QPS-pyrimidine
2.3.1. Inhibiteurs d’ENPP1
2.3.1.1. Couplage de Suzuki-Miyaura
Les composés de la famille QPS-pyrimidine diffèrent de ceux de la famille QPS par le groupement quinazoline qui est remplacé par un groupement pyrimidine. Ce dernier peut être modifié par différents groupements aromatiques, tel que montré dans le Schéma 2.4. Ainsi, à l’aide du couplage de Suzuki-Miyaura17 et de différents acides boroniques, il a été possible de préparer différents groupements
pyrimidine pour bâtir une série de composés.
Schéma 2.4 Couplage de Suzuki-Miyaura
17 Norman, M. H.; Zhu, J.; Fotsch, C.; Bo, Y.; Chen, N.; Chakrabarti, P.; Doherty, E. M.; Gavva, N. R.; Nishimura,
N.; Nixey, T.; Ognyanov, V. I.; Rzasa, R. M.; Stec, M.; Surapaneni, S.; Tamir, R.; Viswanadhan, V. N.; Treanor, J. J. S. J. Med. Chem. 2007, 50, 3497-3514.
15 L’acide boronique a été employé avec un léger excès de 4,6-dichloropyrimidine (13) (1,5 équiv). Le catalyseur utilisé a été le palladium (0) tétrakis-triphénylphosphine, à raison de 5 mol % avec le carbonate de potassium comme base, en solution 2 M dans l’eau. Deux phases ont été observées, suite à l’ajout du solvant. Un avantage à cette réaction est donc qu’elle tolère les solvants non anhydres.
Le cycle catalytique de la réaction est montré au Schéma 2.5.18 Une addition oxydante permet
l’insertion du Pd(0) sur la 4,6-dichloropyrimidine (13). Une étape de transmétallation entre le complexe de palladium et l’acide boronique survient ensuite. Puis, une élimination réductrice permet d’obtenir le produit final désiré et de régénérer le Pd(0) pour continuer le cycle catalytique.
Schéma 2.5 Cycle catalytique du couplage de Suzuki-Miyaura18
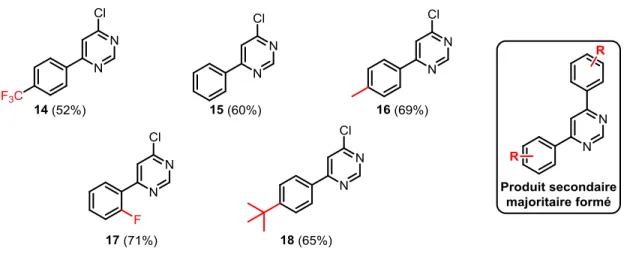
Plusieurs acides boroniques ont été utilisés pour former différents groupements pyrimidine. Ainsi, à l’issue de quelques couplages de Suzuki-Miyaura, cinq produits ont été obtenus (Figure 2.3). Parmi ces derniers, les groupements R sont un trifluorométhyle en position 4 (14), aucun substituant (15), un méthyle en position 4 (16), un atome de fluor en position 2 (17) et un groupement tert-butyle en position 4 (18). Il faut mentionner que le produit secondaire majoritaire formé était celui de di-addition, montré à la Figure 2.3. De cette manière, les rendements obtenus pour les produits désirés ont été plutôt faibles (39-76%).
16
Figure 2.3 Groupements pyrimidine formés suite au couplage de Suzuki-Miyaura et produit secondaire
majoritaire formé
2.3.1.2. Substitution nucléophile aromatique
De la même façon que pour les composés QPS, une substitution nucléophile aromatique a été faite pour obtenir les composés finaux de la famille QPS-pyrimidine (Schéma 2.6), avec l’utilisation de l’acétonitrile comme solvant. Ces produits ont été préparés, en grande partie, par Elsa Forcellini et Sophie Boutin.
Schéma 2.6 Substitution nucléophile aromatique menant aux composés QPS-pyrimidine
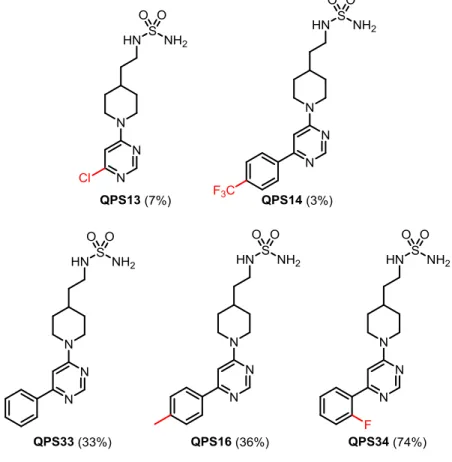
Tout d’abord, une série de cinq composés (QPS13, QPS14, QPS33, QPS16 et QPS34) (Figure 2.4) a été préparée avec le groupement pipéridine-sulfamide comportant une chaîne de deux atomes de carbone n = 2 (6) et la 4,6-dichloropyrimidine (13) seule ou les groupements pyrimidine 14, 15, 16 et
17. La purification sur colonne de silice de ces produits a été assez difficile, compte tenu des impuretés
qui restaient attachées. Ainsi, pour obtenir le niveau de pureté requis pour les essais enzymatiques, il a fallu faire plus d’une purification, ce qui a entraîné une perte de produit et donc une diminution du
17 rendement. Ce phénomène a été particulièrement éminent pour les composés QPS13-14, avec de faibles rendements de 7% et 3%, respectivement. La faible quantité de produit obtenue a été directement envoyée pour les essais enzymatiques et toutes les caractérisations sur ces produits n’ont pas pu être faites, telles les études RMN et HRMS. Les produits QPS33 et QPS16 ont aussi été difficiles à purifier et ont été obtenus avec des rendements de 33% et 36%. La molécule QPS34, quant à elle, a été synthétisée plus commodément avec 74% de rendement.
Figure 2.4 Composés QPS-pyrimidine avec n = 2
Par le même principe, une série de produits a aussi été faite avec le groupement pipéridine-sulfamide
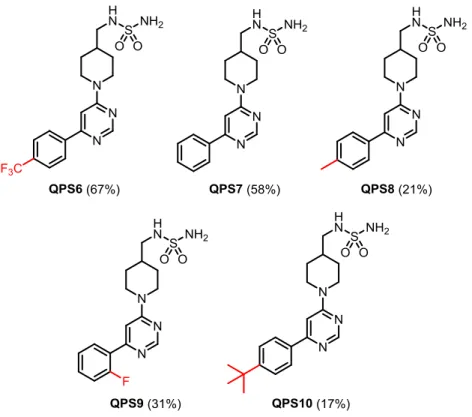
11, pour faire des composés avec une chaîne d’un atome de carbone n = 1. Les composés QPS6-10
ont été obtenus avec les tous groupements pyrimidine préparés au préalable et sont montrés à la Figure 2.5. Ils ont également de bas rendements, pour la même raison de purifications multiples sur colonne de silice. Le produit QPS10 a été le plus difficile à obtenir, avec un rendement de 17%, alors que le composé QPS6 a été atteint plus aisément avec un rendement de 67%.
18
Figure 2.5 Composés QPS-pyrimidine avec n = 1
2.3.2. Activité anticancéreuse
Compte tenu des résultats préliminaires prometteurs obtenus avec les tests antiprolifératifs (voir Section 3.2.2), nous avons décidé de pousser ces études plus loin en bâtissant une vaste librairie de composés QPS-pyrimidine. De cette manière, une tendance pourrait être établie entre la structure et l’activité des molécules.
Lors de la synthèse des composés QPS-pyrimidine pour les essais enzymatiques avec ENPP1, les rendements obtenus ont été plutôt faibles. Une légère optimisation des conditions réactionnelles a donc été réalisée pour le couplage de Suzuki-Miyaura et la substitution nucléophile aromatique.
2.3.2.1. Couplage de Suzuki-Miyaura optimisé
Les nouvelles conditions réactionnelles du couplage de Suzuki-Miyaura ont été tirées de la littérature (Schéma 2.7).19 Il s’est avéré que ces dernières ont montré de meilleurs rendements pour nos
molécules que les conditions précédentes. Le catalyseur qui a été utilisé est l’acétate de palladium (II), en présence de triphénylphosphine. La base a été changée pour le carbonate de sodium et le solvant a
19 été remplacé par le THF. De plus, la réaction s’est déroulée à une chaleur moins intense que précédemment et moins de produits secondaires ont été aperçus.
Schéma 2.7 Couplage de Suzuki-Miyaura optimisé
Les résultats préliminaires obtenus sur l’activité antiproliférative des composés QPS-pyrimidine, préparés au préalable, ont montré que le produit QPS10 est le plus actif (Section 3.2.2). Ce dernier comporte un groupement tert-butyle en para du phényle et ceci correspond au groupement le plus volumineux du groupe. Nous avons donc pensé qu’il serait intéressant de synthétiser d’autres composés avec des groupements plus volumineux, mais aussi de plus petits, à différentes positions sur le phényle.
Une chimio-thèque de groupements pyrimidine a été bâtie avec différents acides boroniques, dans les nouvelles conditions réactionnelles (Figure 2.6). Ainsi, des groupements de taille plus importante ont été faits avec des substituants tels que le naphtalène (22) et le butyle (23), avec des rendements de 73% et 68%, respectivement. De plus petits groupements ont aussi été installés à différentes positions sur le phényle, tels qu’un atome de fluor (17) ou de chlore (24-26) ou un groupement méthoxyle (20,
21). Des groupements pyrimidine avec des esters en position 4 du phényle ont également été préparés
20
Figure 2.6 Groupements pyrimidine formés suite au couplage de Suzuki-Miyaura optimisé
Certains composés ont déjà été synthétisés avec les premières conditions réactionnelles du couplage de Suzuki-Miyaura et il est possible de remarquer que les rendements ont augmenté de 15%, en moyenne, avec les secondes conditions (Tableau 2.1).
Tableau 2.1 Comparaison des rendements obtenus avec les différentes conditions réactionnelles du
couplage de Suzuki-Miyaura
Composé Conditions #1 a Conditions #2 b
14 52% 49% 15 60% 64% 16 69% 72% 17 71% 83% 18 65% 73% a Pd(PPh3)4 (5 mol %), K2CO3, CH3CN, reflux, 2-16 h
21 2.3.2.2. Substitution nucléophile aromatique optimisée
À cette étape de la synthèse, les composés étaient moins solubles et il a souvent fallu chauffer pour les mettre en solution. Ce phénomène a donc rendu certaines réactions plus difficiles. De cette manière, le solvant a été changé par le DMF, pour la réaction de substitution nucléophile aromatique et les rendements se sont vus augmenter pour certains composés. Les conditions réactionnelles de la réaction sont montrées au Schéma 2.8. Toujours dans le but de produire une vaste librairie de composés QPS-pyrimidine, deux séries ont été préparées à partir des groupements pipéridine-sulfamide 6 et 11.
Schéma 2.8 Substitution nucléophile aromatique optimisée
La Figure 2.7 montre la première série de composés qui ont été faits à partir des conditions réactionnelles optimisées pour la substitution nucléophile aromatique. Cette série de molécules a été préparée avec le groupement pipéridine-sulfamide 11 (n = 1). Dans ce cas-ci, tous les groupements pyrimidine produits avec la méthode optimisée (14-28) ont été utilisés et ont mené à une banque de 14 molécules QPS-pyrimidine.
22
Figure 2.7 Composés QPS-pyrimidine avec n = 1, obtenus avec la méthode optimisée
Les produits QPS6-10, avaient déjà été synthétisés, mais nous avons voulu comparer les rendements obtenus avec les conditions réactionnelles précédentes et celles-ci (voir Tableau 2.2). Il est à noter que les rendements ne sont pas toujours améliorés en employant les nouvelles conditions réactionnelles. Cependant, il a été remarqué au laboratoire que moins d’impuretés étaient présentes dans le produit
23 brut et donc que les purifications étaient plus pratiques. Le nombre de produits secondaires présents peut être lié au fait que la réaction ne s’est pas déroulée à reflux dans le DMF. Les conditions réactionnelles de la substitution nucléophile aromatique optimisée ont donc été conservées pour synthétiser les composés QPS23-32 et la moyenne des rendements obtenus a été de 48%.
Tableau 2.2 Comparaison des rendements obtenus avec les différentes conditions réactionnelles de la
substitution nucléophile aromatique de la série avec n = 1
Composé Conditions #1 a Conditions #2 b
QPS6 67% 46% QPS7 58% 58% QPS8 21% 51% QPS9 31% 28% QPS10 17% 51% a K2CO3, CH3CN, reflux, 16 h b K2CO3, DMF, 90 °C, 16 h
La seconde série a été préparée avec le composé 6 (n = 2) et les groupements pyrimidines 14 à 28 (Figure 2.8), sauf le 16, qui n’a pas été refait. En effet, ce groupement mène au composé QPS16, qui a déjà été synthétisé et testé pour l’activité antiproliférative. Ainsi, pour un gain de temps, nous avons décidé de ne pas reprendre la synthèse de ce composé, puisqu’il n’y avait plus assez du groupement pyrimidine correspondant. Les groupements pyrimidine avec les méthoxyles 20 et 21 n’ont pas été utilisés, non plus, pour créer de nouveaux composés. Indubitablement, ces groupements n’étaient pas très solubles; il a donc été plus ardu de les utiliser pour une étape de synthèse subséquente. En tout,
11 produits ont été préparés pour la série QPS-pyrimidine avec n = 2. Les molécules QPS14, QPS33 et QPS34 ont déjà été préparés avec la méthode précédente et les rendements comparés avec les
premières conditions de couplage sont montrés au Tableau 2.3. Il est possible de noter que les rendements n’ont pas augmentés pour tous les composés, tel qu’il a été montré avec QPS34. Cependant, les nouvelles conditions de synthèse ont montré une meilleure solubilité des réactifs et la réaction s’est produite plus facilement. Somme toute, la moyenne des rendements obtenus, suite à cette réaction de substitution nucléophile aromatique, est de 60%.
Tableau 2.3 Comparaison des rendements obtenus avec les différentes conditions réactionnelles de la
substitution nucléophile aromatique de la série avec n = 2
Composé Conditions #1 a Conditions #2 b
QPS14 3% 51%
QPS33 33% 37%
QPS34 74% 49%
a K2CO3, CH3CN, reflux, 16 h b K2CO3, DMF, 90 °C, 16 h
24
Figure 2.8 Composés QPS-pyrimidine avec n = 2, obtenus avec la méthode optimisée
Il est possible de comparer les résultats obtenus avec la substitution nucléophile aromatique optimisée entre les séries n = 1 et n = 2 (voir Tableau 2.4). De façon générale, les rendements ont été meilleurs pour la seconde série de molécules.
25
Tableau 2.4 Comparaison des rendements obtenus avec la substitution nucléophile aromatique
optimisée entre les séries n = 1 et n = 2
R n = 1 n = 2 4-CF3 46% 51% H 58% 37% 4-CH3 51% ― 2-F 28% 49% 4-t-Bu 51% 66% Naphtalène 55% 72% 4-OCH3 34% ― 2-OCH3 40% ― 4-n-Bu 50% 72% 4-Cl 36% 77% 2-Cl 46% 58% 3-Cl 61% 69% 4-CO2CH3 66% 80% 4-CO2CH2CH3 51% 26%
Tous les composés de la nouvelle banque de composés QPS-pyrimidine ont été étudiés pour leur activité anticancéreuse sur différentes lignées cellulaires cancéreuses. Les résultats sont montrés à la Section 3.2.3.
2.4. Synthèse du composé QPS-pipérazine
Pour obtenir une meilleure solubilité des produits QPS, nous avons pensé remplacer le groupement pipéridine par un groupement pipérazine pour obtenir la molécule montrée à la Figure 2.9. En effet, en ajoutant un atome d’azote, la molécule devient un peu plus polaire et donc potentiellement plus soluble. Seulement la molécule avec une chaîne carbonée n = 2 a été étudiée, puisque le composé QPS1 a montré de meilleurs résultats d’inhibition d’ENPP1, par rapport à QPS2. Plusieurs voies de synthèse ont été essayées et sont présentées dans les sous-sections suivantes.
26
2.4.1. Première stratégie de synthèse
La première stratégie de synthèse menant au composé QPS-pipérazine est décrite à travers le Schéma 2.9. Elle consiste à coupler la pipérazine (29) directement sur la 4-chloro-6,7-diméthoxyquinazoline (12) et ensuite additionner le groupement sulfamide 31, préparé préalablement. La première étape de substitution nucléophile aromatique20 s’est faite sans problème et un rendement
de 76% a été obtenu. Cependant, la préparation du groupement sulfamide 31, montrée au Schéma 2.10, a été quelque peu ardue. Tout d’abord, une réaction de substitution nucléophile de type SN2, à
partir de l’hydrobromure 2-bromoéthan-1-amine (32) et de l’agent de sulfamoylation 4 a été faite dans les mêmes conditions qu’utilisées précédemment. Par contre, il a fallu faire plusieurs purifications sur colonne chromatographique pour avoir le produit 33 pur avec un faible rendement de 19%. Ensuite, l’étape de déprotection du groupement Boc en milieu acide n’a pas semblé fonctionner de façon quantitative, comme à l’habitude. Il semblait toujours rester un peu de Boc et de dioxane, ce qui a rendu la caractérisation difficile. Ainsi, le produit 31 a été utilisé tel quel dans la réaction de couplage avec 30 sans vraiment savoir si c’était le bon. Sans grande surprise, cette réaction n’a pas bien fonctionné et le produit désiré QPS-pipérazine n’a pas été obtenu.
20 Alafeefy, A. M.; Kadi, A. A.; Al-Deeb, O. A. El-Tahir, K. E. H.; Al-jaber, N. A. Eur. J. Med. Chem. 2010, 45,
27
Schéma 2.9 Première voie de synthèse menant au composé QPS-pipérazine
Schéma 2.10 Voie de synthèse du groupement sulfamide 31
2.4.2. Deuxième stratégie de synthèse
La deuxième stratégie de synthèse consiste à effectuer la déprotection du Boc sur le groupement sulfamide 33 une fois que ce dernier est installé sur la pipérazine (29). Par la suite, le groupement
28
pipérazine-sulfamide déprotégé pourra être couplé avec la 4-chloro-6,7-diméthoxyquinazoline (12) avec la substitution nucléophile aromatique. Cette voie synthétique est montrée à travers les Schéma 2.11 et Schéma 2.12.
La pipérazine (29) a été mise en excès pour être monoprotégée avec un groupement Bn.21 Le
composé 34, obtenu avec 93% de rendement, a été engagé dans une réaction de substitution nucléophile avec le produit 33, dans les conditions habituelles et le produit 35 a été atteint avec 95% de rendement. Par la suite, ce dernier a été déprotégé au niveau de l’amine secondaire en retirant le groupement Bn dans des conditions d’hydrogénolyse typiques. La molécule 36, obtenue de façon quantitative, a été aussitôt incorporée dans les conditions acides de HCl dans le dioxane (4 M) pour retirer le groupement Boc de l’amine primaire du sulfamide. Aucune purification n’a été effectuée sur le produit 37.
Schéma 2.11 Voie de synthèse du groupement pipérazine-sulfamide
21 Peterson, Q. P.; Hsu, D. C.; Goode, D. R.; Novotny, C. J.; Totten, R. K.; Hergenrother, P. J. J. Med. Chem. 2009, 52, 5721-5731.
29
Schéma 2.12 Substitution nucléophile aromatique menant au composé QPS-pipérazine
Avec la molécule 37 en main, la substitution nucléophile aromatique a été effectuée avec la 4-chloro-6,7-diméthoxyquinazoline (12). Le produit pur ainsi obtenu à 40% n’a pas été celui désiré. En effet, ce dernier semblait posséder deux groupements quinazolines (Figure 2.10), ce qui expliquerait le faible rendement. L’étude RMN proton a montrée trois protons de trop dans la région des aromatiques ainsi que deux groupements méthoxyles en plus. De plus, en spectrométrie de masse en mode ionisation par électronébuliseur (HRMS-ESI), un pic est obtenu à [M+H]+ = 585,2215, alors que la valeur attendue
est de 397,1653. La première valeur correspond exactement au signal calculé [M+H]+ pour le produit
avec un autre groupement quinazoline. Toutefois, aucune étude plus poussée n’a été effectuée pour connaître le point d’attache de ce groupement supplémentaire sur la molécule, bien qu’il y ait une prédisposition pour l’amine primaire du groupement sulfamide.
Figure 2.10 Structure possible du produit obtenu
2.4.3. Troisième stratégie de synthèse
Une troisième stratégie de synthèse a été élaborée pour éviter l’addition d’un groupement quinazoline indésirable sur la molécule. Le chemin réactionnel est montré dans le Schéma 2.13. La réaction de substitution nucléophile aromatique avec la 4-chloro-6,7-diméthoxyquinazoline (12) a été faite directement avec le produit 36, sans exécuter la déprotection du Boc. La molécule 38 a été obtenue
30
avec un rendement de 45%. Par la suite, les conditions typiques de déprotection du Boc ont été utilisées pour avoir le produit QPS22 sous forme de sel de HCl. Ce dernier a été utilisé tel quel pour les essais enzymatiques, puisqu’il n’a pas été possible de l’obtenir sous forme neutre.
Schéma 2.13 Voie de synthèse du composé QPS22∙HCl
2.5. Synthèse du composé QPS-triazoline
Entre temps, un autre composé avec un groupement pipérazine a été imaginé, mais cette fois, avec un groupement triazoline au lieu du sulfamide, et une chaîne carbonée avec n = 1, tel qu’illustré à la Figure 2.11. Ce nouveau groupement est intéressant en raison de sa structure qui peut s’imbriquer dans le site de liaison potentiel d’ENPP1 ainsi que des interactions polaires qu’il peut offrir.
31
Figure 2.11 Structure du composé QPS-triazoline
La première étape de la synthèse a été de construire une chaîne hydrazine-carboxylate 42, qui allait être cyclisée, une fois installée sur le reste de la molécule. Cette synthèse22 est décrite dans le Schéma
2.14.
Schéma 2.14 Synthèse du produit 42
Le chloroacétonitrile (39), disponible commercialement a d’abord été mis en présence de méthanolate de sodium dans le méthanol anhydre pour obtenir l’intermédiaire réactionnel 40. Le méthyle hydrazinecarboxylate (41), a ensuite été ajouté pour former le produit désiré 42 avec 85% de rendement.
32
Schéma 2.15 Voie de synthèse du composé QPS-triazoline
Le Schéma 2.15 montre le reste de la synthèse envisagée22,23 pour atteindre le produit QPS-triazoline.
Le composé 30, déjà obtenu des travaux de synthèse du composé QPS-pipérazine a subi une réaction de substitution nucléophile avec le produit 42 pour obtenir le composé 43, avec 53% de rendement. Par la suite, plusieurs essais ont été faits pour obtenir le produit avec le groupement triazoline, mais aucun n’a semblé fonctionner. Pour aider la cyclisation de la chaîne hydrazine-carboxylate, il faut chauffer le produit. Cependant, toutes les expériences qui ont été exécutées ont mené à une dégradation du produit ou encore à des réactions incomplètes. Un chauffage avec les micro-ondes a également été expérimenté, mais sans résultat. Le point de fusion du produit 43 a été mesuré et est de 219-228 °C. Ainsi, aucun chauffage n’a été suffisamment élevé pour engendrer la cyclisation de la chaîne.
D’autres méthodes ont été essayées, mais sans succès. Par exemple, la chaîne hydrazine-carboxylate
42 a été directement cyclisée à sec, mais cela a mené à la dégradation du produit. Aussi, un couplage
entre cette chaîne et la pipérazine 29 a été tenté; nonobstant, la cyclisation ne s’est pas faite.
23 Dorn, C. P.; Finke, P. E.; Hale, J. J.; MacCoss, M.; Mills, S. G.; Shah, S. K.; Chambers, M. S.; Harrison, T.;
33 Entre temps, un site de liaison potentiel dans l’enzyme ENPP1 a été trouvé par amarrage moléculaire (Section1.2.4). Ce site n’a pas montré de cavité assez grande pour recevoir le groupement triazoline et les travaux de recherche sur ce composé ont été interrompus.
2.6. Synthèse du composé QPS-fluor
Avec le site de liaison potentiel des composés QPS dans ENPP1, nous nous sommes intéressés à l’ajout d’un atome de fluor sur le groupement pipéridine, tel que montré à la Figure 2.12. En effet, ce fluor pourrait engendrer des interactions polaires avec les acides aminés environnants et, ainsi, augmenter la force de liaison de l’inhibiteur dans le site allostérique.
Figure 2.12 Structure du composé QPS-fluor
2.6.1. Première stratégie de synthèse
Au départ, la stratégie de synthèse employée pour former QPS1 (voir Schéma 2.1) a été envisagée, en ajoutant une étape de fluoration24 suite à l’obtention du composé 2. Cette réaction consistait à le mettre
en présence de SelectfluorTM et d’acide sulfurique à 50 °C pendant 24 heures. Cependant, ces
conditions n’étaient pas viables en raison du groupement Boc installé sur la molécule 2, comme il est représenté au Schéma 2.16. Il aurait été possible d’installer un autre groupement protecteur sur l’amine de 1, comme le carboxybenzyle (Cbz), mais cela aurait nécessité une étape de déprotection supplémentaire, dans la suite de la synthèse.
24 Liu, J.; Chan, J.; Bryant, C. M.; Duspara, P. A.; Lee, E. E.; Powell, D.; Yang, H. ; Liu, Z.; Walpole, C.; Roberts,
34
Schéma 2.16 Première stratégie de synthèse problématique du composé QPS-fluor
2.6.2. Deuxième stratégie de synthèse
Une autre voie de synthèse a donc été trouvée pour installer un atome de fluor sur la pipéridine et est présentée au Schéma 2.17.
35 La première étape de protection de l’hydrochlorure de 4-pipéridone monohydratée 1 s’est faite de la même façon que précédemment pour obtenir le produit 2. Ensuite, en deux étapes, il a été possible d’installer l’atome de fluor. Tout d’abord, le carbonyle a été activé sous forme d’éther d’énol silylé,25
puis une réaction de fluoration électrophile en alpha a été engendrée par l’ajout de SelectfluorTM. Le
composé 44 a ainsi été atteint avec un rendement combiné de 93%, sur deux étapes. Le reste de la synthèse a été effectué dans les mêmes conditions que celles utilisées pour la confection du composé pipéridine-sulfamide 6. Le produit 45 a été obtenu avec 97% de rendement, suite à la réaction d’oléfination, alors que la réduction de l’acrylonitrile et la substitution nucléophile de type SN2 ont mené
au produit 46 à 66%, en deux étapes. Finalement, le groupement pipéridine-sulfamide fluoré 47 a été obtenu quantitativement, suite aux réactions de déprotection des groupements Boc.
L’étape finale consistait à faire la substitution nucléophile aromatique, dans les conditions standards, comme il est montré dans le Schéma 2.18.
Schéma 2.18 Substitution nucléophile aromatique menant au composé QPS-fluor
Le produit qui a été récupéré suite à cette réaction ne contenait pas d’atome de fluor. En effet, toutes les caractérisations qui ont été effectuées portent à croire que l’atome de fluor s’est détaché dans une étape de synthèse antérieure. Ainsi le composé 47 tel qu’illustré n’a jamais été obtenu. Cependant, comme beaucoup de réactions se sont faites les unes à la suite des autres, sans purification, la perte de l’atome de fluor n’avait pas été remarquée avant. En repassant sur chacune des étapes, les spectres RMN 19F se sont vus se détériorer à partir de l’étape d’hydrogénation menant au produit 46,
probablement en raison d’une hydrogénolyse de la liaison carbone-fluor. D’autres conditions réactionnelles plus douces ont été essayées pour réduire l’acrylonitrile 45 et sont présentées à la Section 2.6.3 ci-dessous.