ANIK PAGE
EFFETS DES ANOMALIES METABOLIQUES
ASSOCIÉES À L'OBÉSITÉ VISCÉRALE SUR LA
GÉOMÉTRIE ET LA FONCTION
VENTRICULAIRE GAUCHE DES PATIENTS
ATTEINTS DE STÉNOSE VALVULAIRE
AORTIQUE
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval dans le cadre du programme de maîtrise en Médecine expérimentale
pour l'obtention du grade de maître es sciences (M.Sc.)
FACULTE DE MEDECINE UNIVERSITÉ LAVAL
QUÉBEC
2010
Résumé
La sténose valvulaire aortique (SA) est la maladie valvulaire la plus fréquente. Elle est aussi l'atteinte cardiovasculaire la plus fréquente après la maladie coronarienne et l'hypertension artérielle dans les pays développés. À ce jour, il n'existe aucun traitement pharmacologique pour ralentir la progression de cette maladie et le seul traitement efficace est le remplacement valvulaire aortique (RVA). Les études et publications récentes sur le sujet ont démontré que la SA n'est pas une conséquence directe et inévitable du vieillissement, mais plutôt un processus actif présentant certaines similitudes avec l'athérosclérose vasculaire. À cet effet, notre groupe a démontré que les altérations métaboliques associées à l'obésité viscérale, souvent désignée sous le terme de syndrome métabolique (SMet), sont associées avec une progression plus rapide de la sténose valvulaire. L'hypothèse principale à l'origine de ce travail de maîtrise était que le SMet prédispose au développement de l'hypertrophie et la dysfonction ventriculaire gauche chez des patients avec SA. L'objectif principal de cette étude était donc d'examiner la relation entre le SMet et la géométrie et la fonction ventriculaire gauche chez des patients atteints de SA asymptomatique.
Pour cette étude, nous avons utilisé les données de l'essai clinique ASTRONOMER. Parmi les 268 patients randomisés dans cet essai clinique, aucun ne présentait d'hypercholestérolémie, de diabète ou de maladie coronarienne. Cependant, 57% des patients avaient de l'hypertension artérielle systémique et 27% avaient le SMet. Les résultats ont montré que le SMet est indépendamment associé avec une hypertrophie ventriculaire gauche concentrique plus prononcée et une altération de la fonction diastolique et systolique du ventricule gauche (VG) chez les patients avec SA. Ces données suggèrent que les altérations métaboliques liées à l'obésité viscérale peuvent non seulement accélérer la progression de la sténose valvulaire mais peuvent aussi prédisposer à une détérioration plus rapide de la géométrie et de la fonction ventriculaire gauche. L'obésité viscérale devrait être considérée comme une nouvelle cible thérapeutique chez les patients avec SA.
Avant-propos
Qui aurait cru, il y a de cela à peine 10 ans, que l'Abitibienne en moi terminerait sa course d'étudiante avec des études supérieures en médecine? Ayant toujours été curieuse de nature, mon cheminement scolaire particulier m'a amené à toujours vouloir en savoir plus et me fixer des buts tous plus élevés les uns que les autres. Ce désir de performer s'est développé et amplifié dès mes premières années de CEGEP où j'ai eu la chance de côtoyer des professeurs extraordinaires, disponibles et impliqués, qui se sont investis avec moi et ont partagé mes réussites. Attirée par les sciences, j'ai dû quitter les êtres qui m'étaient le plus chers et la plus belle région éloignée du Québec pour venir parfaire mes connaissances à l'Université Laval.
Après trois années d'études universitaires intensives, j'ai terminé avec fierté mon baccalauréat en biochimie. Ce tremplin m'a permis de nourrir de plus belle ma curiosité grandissante et mon désir de pouvoir expliquer les phénomènes de la vie au niveau cellulaire et moléculaire. Les expériences que j'avais pu vivre grâce à mon parcours étaient gratifiantes et non moins satisfaisantes, mais pas complètes. J'ai donc envisagé les études de deuxième cycle avec un but précis : faire de la recherche clinique!
Ayant déjà expérimenté le travail de terrain dans le domaine de l'environnement et le travail de scientifique en laboratoire, le côté humain en milieu de santé m'attirait particulièrement. Mes recherches m'ont guidé vers le Dr Philippe Pibarot, DVM, PhD, FAHA, FACC qui est sans aucun doute, selon moi, le plus grand chercheur que j'ai eu la chance de rencontrer. Avec des centaines de publications à son actif et tout autant de participations à des congrès prestigieux partout à travers le monde, le Dr Pibarot n'en demeure pas moins un homme simple, humble et compréhensif. Toujours disponible malgré son horaire chargé à bloc, il a su être un mentor hors pair dans ma formation et chacune de nos rencontres n'auraient pu être plus formatrices qu'elles ne l'ont été de par ses milliers de choses à partager. L'équipe de travail multidisciplinaire du laboratoire en valvulopathies de l'Institut Universitaire de Cardiologie et de Pneumologie de Québec (IUCPQ) a aussi contribué grandement au succès de ma
Remerciements
La première personne, et non la moindre, que je tiens à remercier personnellement est bien le docteur-chercheur-médecin vétérinaire Philippe Pibarot. Je ne pourrais ressentir une plus grande fierté que d'avoir pu effectuer ma maîtrise avec cette sommité mondiale du domaine des valves cardiaques. Philippe, tu m'as non seulement permis de gérer un projet de recherche clinique en médecine tel que je le souhaitais à mon arrivée, mais tu m'as aussi permis de réaliser plusieurs rêves concrètement, soit d'accueillir et prendre soin de gens malades, de côtoyer des médecins, cardiologues, chirurgiens, professionnels de la santé et étudiants tous aussi extraordinaires les uns que les autres, de même qu'assister à des chirurgies cardiaques novatrices et exceptionnelles qui resteront gravées à tout jamais dans ma mémoire. Merci de m'avoir donné l'opportunité de participer et présenter fièrement à des congrès malgré mon stress toujours bien présent. Merci de ta confiance, ton soutien et ton temps précieux et de qualité durant ces deux années et plus. Et surtout, merci d'avoir été aussi humain et compréhensif lors d'une épreuve très difficile de ma vie.
J'aimerais aussi remercier le chirurgien cardiaque qu'est le docteur Patrick Mathieu d'avoir accepté d'être mon co-directeur de recherche et qui, malgré un emploi du temps surchargé, a pris du temps pour me rencontrer afin de parler de statistiques d'un futur projet, a toujours répondu rapidement à mes demandes par courriel et a aussi toujours pris la peine de me saluer lors de nos rencontres dans les corridors de l'hôpital.
Une des premières personnes ayant contribué à la réussite de ma maîtrise, et probablement sans en être vraiment consciente, est bien Isabelle Laforest. Cette assistante de recherche exceptionnelle, douce et patiente m'a grandement aidé à me faire plus confiance dans diverses étapes de mon apprentissage dans le laboratoire. Elle a en quelque sorte jouée un rôle de grande sœur en étant toujours présente pour m'appuyer et m'encourager dans mon recrutement, s'informer et m'écouter lors de moments plus difficiles de ma vie et répondre à
mes questions aussi soigneusement que l'aurait fait Philippe. Merci Isabelle d'avoir été qui tu es!
Une autre personne que je chérie énormément, qui a su être une conseillère, une amie, voire même une deuxième mère pour moi, alors que la mienne était loin, est la perle rare de ce laboratoire, l'infirmière la plus dévouée et humaine que j'ai pu connaître Jacinthe Aube. Nous avons partagé plusieurs choses ensemble et de te côtoyer Jacinthe aura fait de moi une femme meilleure. Ta sensibilité, ta joie de vivre et ton sourire contagieux font de toi la rayonnante collègue que tout le monde apprécie et ces deux années et des poussières à tes côtés ne me laissent que du positif en souvenir. On se l'est souvent dit et je te le redis, je t'aime et t'apprécie beaucoup pour la personne que tu es chère Jacinthe. Merci pour tout ton support et tes encouragements tout au long de ce périple qu'a été ma maîtrise.
Les deux années qui viennent de passer n'auraient certes pas été les mêmes sans notre cher technicien en écho cardiaque Jocelyn Beauchemin. S'il y a une chose dont je suis certaine qui va beaucoup me manquer ce sont nos fous rire de fatigue de fin de journée. Je dois avouer que je vais même m'ennuyer de ta façon bien à toi de me taquiner et de me reprendre sur mon français constamment. Il y aura bien eu juste toi aussi pour me donner des cours de « swing » de golf dans le laboratoire avant l'arrivée d'un patient. Je te dois une grande partie de ce que je sais aujourd'hui sur l'échographie cardiaque et ce fut un grand plaisir de travailler avec toi. Merci de ton écoute et ta disponibilité tout au long de ma maîtrise.
Une autre personne que j'ai grandement appréciée et qui était présente lors de mon arrivée dans le labo est la cardiologue Zeineb Hachicha. Merci Zeineb de ton appui et tes encouragements quant est venu le temps de mes premiers contacts avec les patients qui me rendaient un peu insecure. Merci aussi de m'avoir fait ma première échocardiographie qui m'a permis de visualiser mon cœur sous un angle nouveau!
Un autre petit bout de femme extraordinaire qui a su devenir si attachante en peu de temps est notre belle Isabelle Fortin. Toujours bien mise et avec le
sourire, elle s'est intégré rapidement à notre équipe et a fait des miracles en devenant notre Isabelle Laforest n° 2! Tu as d'ailleurs fait rien de moins que des miracles en m'aidant et m'endurant lors de ma mise en page de mémoire qui nous a donné du fil à retordre. Merci Isa d'avoir été là dans les bons moments comme les moins bons, de m'avoir encouragé et supporté et d'être la boule d'énergie positive que tu dégages, malgré les obstacles que la vie te fait surmonter. Ne changes surtout pas, tu es une femme unique et le meilleur te reste à vivre.
Le labo ne serait pas complet sans notre chère Yvette Parent. Toujours impliquée et assidue dans l'organisation des événements se rapportant à l'équipe, toujours à s'informer si tout va bien et à souligner avec intérêt nos anniversaires, je retiens de toi une femme au très grand cœur Yvette. Tu as participé activement à m'aider avec mes références pour mon mémoire et je t'en suis très reconnaissante, merci pour toute ton implication!
Je tiens aussi à remercier tous les étudiants que j'ai pu côtoyer de près ou de loin lors de mon passage dans le labo, vous avez tous contribué à votre façon à mon apprentissage. Un merci spécial à Julien Magne qui a su me consacrer du temps de qualité dans la préparation de mes présentations au GRV. Une petite mention pour notre ingénieur mécanique Julio Garcia également, avec qui j'ai pu discuter du Mexique, qui nous a aussi fait partager des petites gâteries typique de son pays et qui m'a souvent donné des conseils avec mes péripéties informatiques.
Un autre merci tout spécial à la très gentille et divertissante docteure-cardiologue-échocardiographiste Haifa Mahjoub, avec laquelle j'ai partagé plusieurs bons moments et confidences. En espérant que mon départ ne rendra pas plus difficile encore le « timing » de nos sorties! Merci d'avoir réalisé les échos de mes nombreux patients en l'absence de Jocelyn.
Je remercie aussi trois infirmières de recherche disponibles, souriantes et que j'ai toujours vu de bonne humeur : Rachel Vienneau, Martine Poulin et Claire Gagnon, qui ont été là à maintes reprises pour nous dépanner lors de prises de sang de patients, malgré leur charge de travail.
Merci également à Louise Côté, infirmière et voisine de bureau pendant longtemps de Jacinthe, qui s'est toujours informé de moi, de mon cheminement et de mon père lorsque nous nous rencontrions vite fait dans différents endroits de l'hôpital, ce sont des petits gestes comme ceux-là, très appréciés, qui font souvent toute la différence pour ensoleiller nos journées.
Je ne voudrais pas oublier de faire une petite mention spéciale également pour la secrétaire médicale Martine Fleury, avec qui j'ai eu de belles discussions de corridor qui nous font décrocher un peu de la routine du quotidien.
Merci à une grande cardiologue, la docteure Marie Arsenault, d'avoir relu toutes les échos de mes patients en un temps record et d'avoir été d'une grande gentillesse avec moi lors de nos brèves discussions téléphoniques sur les progressions de patients.
Toutes mes années d'études universitaires ont aussi été égayées par une collègue biochimiste, avec qui j'ai développé une grande amitié qui j'espère durera très longtemps, et dont je ne pouvais ne pas mentionner les honneurs, soit Nancy Côté. Nancy, je ne saurais comment te dire merci pour toutes tes petites attentions, tu m'as été d'une aide précieuse pendant cette maîtrise autant de par ton amitié que de par ta rigueur scientifique.
Un petit clin d'œil aussi pour deux secrétaires sociables et dynamiques avec qui il fait toujours plaisir de prendre deux minutes pour discuter, Lyne McHugh et Lorraine Labrecque. Merci Lyne pour les petites pousses de plantes que tu m'as donné et qui mettent de la vie dans mon salon! Et que dire de la gentille Lorraine, pour qui il était important d'apprendre nos noms dès notre arrivée au centre de recherche et qui nous fournit toujours du matériel avec le sourire.
Merci à tous les patients que j'ai pu rencontrer pour votre confiance, votre participation à nos projets et votre bonne humeur tôt le matin, la recherche n'en serait rien sans vous!
Merci à deux grandes amies de longue date, Cynthia et Martine, avec qui j'ai pleuré autant que j'ai rit, avec qui j'ai partagé tant de choses et qui, malgré
la distance qui nous sépare, avez toujours été là pas très loin pour m'encourager et m'écouter, me visiter ou me recevoir. Merci aussi à Geneviève V.-T. et Geneviève B. pour votre support et vos encouragements, vous êtes toutes des femmes spéciales qui m'ont apporté beaucoup de bonheur dans ma vie chacune à votre façon. Merci à mon Franck qui m'a si souvent écouté avec mes histoires et qui a su me divertir amplement lors de nos sorties billard. Et merci à tous les autres qui ont été présents dans ma vie et que je ne peux tous nommer!
Je termine cette section en dédiant ce mémoire à ceux qui ont été les piliers de ma vie, mes parents.
À ma mère, Colombe Tremblay, qui de par son côté terre-à-terre a toujours été là pour me ramener vers l'essentiel, et qui a toujours su partager autant mes joies que mes peines. Peu importe les choix que j'ai fait tu étais là, maman, à m'appuyer et m'encourager, me donner des conseils que je ne considérais pas tout le temps bons, mais qui finissaient toujours par me servir. Je ne serais pas celle que je suis devenue si ce n'était de toi et je te suis reconnaissante pour tout ce que tu as fait pour moi.
À mon père, Jean-Pierre Page, pour qui j'ai une admiration sans fin. Papa, tu as toujours été si fier de moi, tu m'as toujours poussé à persévérer, tu m'as encouragé, tu m'as rendu visite si souvent lorsque je m'ennuyais, tu as été là pour moi à tout moment aussi simplement que ca puisse paraître. Je sais que tu aurais donné ta vie pour la mienne sans hésiter, tu m'as consacré énormément de choses que je ne pourrais toutes nommées tellement elles sont nombreuses et jamais je ne pourrai te remercier assez pour tout ce que tu as pu faire pour ta fille. Tu es un grand homme, qui a accomplie de belles choses, et la vie finira bien par te remettre ce qu'elle te doit! Je t'aime mon père, tu es un grand exemple pour moi et tu le seras à jamais.
Table des matières
Résumé II Avant-propos III Remerciements IV Liste des tableaux XII Liste des figures XIII Symboles et abréviations XVIII
Introduction 1 Revue de littérature 3
1- Notions d'anatomie 3
1-1 Le cœur 3 1-1-1 Les valves cardiaques 4
1-1-2 Le cycle cardiaque 6 1-2 La valve aortique saine 8 2- La sténose aortique 10
2-1 Prévalence de la sténose aortique et histoire naturelle 12
2-2 Etiologies de la sténose aortique 13 2-2-1 La sténose aortique congénitale 14 2-2-2 La sténose aortique rhumatismale 16 2-2-3 La sténose aortique degenerative (calcifiante) 17
2-3 Pathophysiologie 20 2-3-1 Surcharge depression 20
2-3-2 Hypertrophie ventriculaire gauche 21 2-3-3 Dysfonction ventriculaire gauche 24
- Excès de post-charge (Afterload mismatch) 27 - Épuisement de la réserve coronarienne 28 - Cardiomyopathies intrinsèques 29 2-4 Manifestations cliniques 29 2-4-1 Les symptômes 30 2.4.2 L'insuffisance cardiaque 31 2-4-3 Mort subite 32 2-5 Techniques diagnostiques 32 2-5-1 L'électrocardiographie (ECG) 32 2-5-2 L'échocardiographie-Doppler 34
- Charge hémodynamique globale : impédance valvulo-artérielle 41
- Géométrie ventriculaire gauche 44 - Fonction ventriculaire gauche systolique 49
- Fonction ventriculaire gauche diastolique 53
2-5-3 Le cathétérisme cardiaque 60 2-5-4 Les autres tests diagnostics 61
- Test à l'effort 61 - Peptides natriurétiques 62
- Tomographic axiale 65
2-6 Traitement 66 2-6-1 Les patients asymptomatiques 67
2-6-2 Les patients symptomatiques 68 2-6-3 Les patients avec dysfonction du ventricule gauche 74
3- Réponse ventriculaire gauche 76 3-1 Impact du profil métabolique sur le métabolisme, la géométrie et la fonction
ventriculaire gauche 76 3-2 Impact du profil métabolique sur la progression de la sténose aortique 83
3-3 Interaction stress hémodynamique - profil métabolique 86
Objectifs - Hypothèse 90 Sommaire de l'article et contribution de l'étudiante 91
Article publié 93 Discussion 121 Conclusion 126 Références 127
Liste des tableaux
Tableau 1 : Indices et critères proposés pour définir la sévérité de la SA 11
Tableau 2 : Indications de l'ESC pour le RVA dans la SA 70 Tableau 3 : Indications de l'ACC/AHA pour le RVA dans la SA 71
Liste des figures
Figure 1 : Coupe schématique du cœur 4 Figure 2 : Coupe schématique du cœur montrant les quatre valves cardiaques....5
Figure 3 : Le cycle cardiaque : mécanisme de fonctionnement 6 Figure 4 : Schéma de la circulation sanguine corporelle (petite et grande
circulation) 8 Figure 5 : Anatomie d'une valve aortique normale 9
Figure 6 : Image d'une valve aortique normale 9 Figure 7 : Courbe de survie sur l'histoire naturelle de la SA 13
Figure 8 : Etiologies de la SA dans deux groupes d'âge différents 14 Figure 9 : Image d'une bicuspidie vraie comportant deux feuillets ayant
approximativement la même taille 16 Figure 10 : Image d'une valve aortique bicuspide avec calcification des deux
feuillets et montrant un raphe qui fusionne deux des feuillets 16 Figure 11 : Image d'une SA calcifiée sans fusion des commissures 17 Figure 12 : Schéma montrant un feuillet d'une valve aortique normal en haut et
un feuillet avec lésion typique d'une SA degenerative en bas 19 Figure 13 : Illustration des processus potentiellement actifs dans la calcification
de la valve aortique 20 Figure 14 : Schéma montrant les quatre patrons d'hypertrophie ventriculaire
gauche 22 Figure 15 : Vue en long axe du VG montrant les différentes parties du cœur
observables et l'épaississement des parois du VG
(échocardiographique vs anatomique) 23 Figure 16 : Schéma simplifié montrant les principaux déterminants de
dysfonction ventriculaire gauche 26 Figure 17 : Schéma sur les déterminants de dysfonction ventriculaire gauche
Figure 18 : Relation entre la fraction d'éjection et le stress pariétal du VG dans un contexte de SA. Plus le stress est important et plus la fraction
d'éjection s'en trouve abaissée 28 Figure 19 : Image d'un électrocardiogramme 34 Figure 20 : Représentation schématique du débit à travers un orifice rigide et plat
montrant l'AVA et l'AVE 38 Figure 22 : Représentation schématique de l'écoulement du sang et de la
pression statique à travers la chambre de chasse du VG, la valve
aortique et l'aorte ascendante pendant la systole 42 Figure 23 : Courbes de survie en fonction des valeurs d'impédance
valvulo-artérielle (Zva) 44
Figure 24 : Image échocardiographique en 2D du VG montrant les mesures du septum inter-ventriculaire (10.8mm), du diamètre interne (48,6 mm) et
de la paroi postérieure (11,5 mm) du VG en diastole 46 Figure 25 : Image échocardiographique en 2D du VG montrant la mesure du
diamètre interne de la chambre du VG en systole (28,7 mm) 46 Figure 26 : Image échocardiographique du cœur en 2D à partir d'une fenêtre
sous-costale montrant les quatre chambres, soit l'oreillette droite, le
ventricule droit, l'oreillette gauche et le VG 47 Figure 27 : Image échocardiographique du VG à partir d'une fenêtre parasternale
montrant une image en mode-M (partie inférieure), illustrant les mesures des dimensions internes et épaisseurs des parois du VG, et une image en 2D (coin supérieur droit) afin de garantir que le mode-M est bien centré dans la chambre du VG et est perpendiculaire au long axe du ventricule. Dans ce cas-ci, l'épaisseur du septum inter-ventriculaire et de la paroi postérieure du VG en diastole sont de 10,2 mm et 11,4 mm respectivement et le diamètre interne du VG en
diastole est de 52,8 mm et 28,6 mm en systole 47 Figure 28 : Images de tracés Simpson à partir de vues échocardiographiques du
VG en quatre chambres montrant les tracés des contours de l'endocarde en fin de diastole à gauche et en fin de systole à droite. La
Figure 29 : Images de tracés Simpson à partir de vues échocardiographiques du VG en deux chambres montrant les tracés des contours de l'endocarde en fin de diastole à gauche et en fin de systole à droite. La fraction
d'éjection obtenue chez ce patient est de 47% 51 Figure 30 : Schématisation de la contraction du VG dans les 3 situations
suivantes: absence de sténose et VG de géométrie normale (images à gauche), SA modérée et hypertrophie du VG concentrique (images au milieu), SA avancée et hypertrophie du VG concentrique prononcée
(images à droite) 52 Figure 31 : Schématisation de l'imagerie par Doppler tissulaire pour le
déplacement longitudinal des parois du myocarde ventriculaire gauche au niveau septal et latéral et signal obtenu à l'ECG montrant les trois
ondes, soit l'onde S, l'onde E et l'onde A 53 Figure 32 : Image échocardiographique en Doppler puisé montrant un flux
diastolique mitral normal désigné par une vélocité de l'onde E
supérieure à celle de l'onde A 54 Figure 33 : Définitions et vélocités du flux mitral 56
Figure 34 : Image échocardiographique en Doppler puisé montrant le patron de dysfonction diastolique de grade 1 ou trouble de la relaxation où l'on observe que l'onde E est inférieure à l'onde A et que la phase de
décélération est allongée 57 Figure 35 : Image échocardiographique en Doppler puisé montrant un flux
diastolique mitral pseudo-normal (dysfonction de grade 2) qui de par l'augmentation de l'onde E apparaît comme un patron de fonction
diastolique normal 58 Figure 36 : Utilisation de la manœuvre de Valsalva en échocardiographie
Doppler afin de démasquer une dysfonction diastolique de type
pseudo-normale (grade 2) 58 Figure 37 : Image échocardiographique en Doppler puisé montrant une
dysfonction diastolique restrictive (grade 3 ou trouble de la compliance) où l'onde E est grandement augmentée, le temps de décélération est très court et l'onde A est fortement diminuée 59 Figure 38 : Données de cathétérisme cardiaque chez un patient âgé de 70 ans
présentant une SA sévère symptomatique 61 Figure 39 : Synthèse du «Brain Natriuretic Peptide» (BNP) 63
Figure 40 : Valve aortique calcifiée représentée par tomographic axiale chez un patient avec SA sévère montrant les dépôts de calcium présents sur les
3 feuillets de la valve (flèches) 65 Figure 41 : Courbes montrant la forte association curvilinéaire entre la
calcification valvulaire aortique, exprimée en score de calcium calculé par tomographic par faisceau d'électrons, et la sévérité hémodynamique de la SA, mesurée par écho-Doppler, chez 100
patients 66 Figure 42 : Figure integrative et synthétique de ce qui est présenté dans les
guides de pratique de l'ESC en ce qui concerne la gestion de la SA
sévère 72 Figure 43 : Stratégie de gestion de l'ACC/AHA pour des patients avec SA
sévère 73 Figure 44 : Définition du SMet (Panneau A) et outils cliniques utilisés pour son
dépistage (Panneau B) 77 Figure 45 : Taux d'oxydation absolu du palmitate, lactate et glucose chez les
groupes Con + SD (traits vides, rats contrôles recevant une diète standard), AC + SD (traits noirs, rats avec constriction de l'aorte recevant une diète standard), Con + WD (traits gris, rats contrôles recevant une diète occidentale) et AC + WD (traits gris hachurés, rats
avec constriction de l'aorte recevant une diète occidentale) 80 Figure 46 : Courbe de survie Kaplan-Meier montrant le taux de survie sans
événement (RVA ou décès) chez des patients atteints de SA avec un
SMet (MS, n=40) et sans SMet (No MS, n= 65) 84 Figure 47 : Taux d'incidence de calcification de la valve aortique (AVC) en
fonction du sexe chez des patients sans SMet ni diabète (noir), avec
SMet isolé (blanc) et avec diabète isolé (gris) 85 Figure 48 : Courbe de survie à la suite d'une constriction aortique chez des
souris alimentées avec une diète standard (SD fed mice, trait plein) et
une diète occidentale (HFD fed mice, trait en pointillé) 87 Figure 49 : A et B : cardiomyocytes représentés par les flèches blanches qui ont
été mesurés chez les souris avec diète standard (A) et diète occidentale (B), 28 jours après leur constriction de l'aorte. C et D : densité des capillaires mesurée chez les souris avec diète standard (C) et diète
occidentale (D), 28 jours après leur constriction de l'aorte. Les cardiomyocytes sont plus grands et la densité des capillaires est diminuée à la suite d'une constriction aortique chez les souris se
nourrissant d'une diète riche en gras 87 Figure 50 : Schéma simplifié de l'interaction du profil métabolique et du stress
hémodynamique sur la dysfonction ventriculaire gauche dans un contexte de SA, d'hypertension artérielle et d'insulino-résistance. ..89 Figure 51 : Spécimens de biopsies ventriculaires colorées à l'hématoxyline et l'éosine montrant les vacuoles présentes dans les myocytes cardiaques. Le spécimen de patient sans SMet montre des myocytes hypertrophiés sans vacuole (x600), alors que le spécimen de patient avec SMet montre un grand nombre de vacuoles présentes dans les myocytes (x600) (A). Les spécimens de patients avec SMet montrent une augmentation progressive de vacuoles dans les myocytes avec la
Symboles et abréviations AP : gradient de pression
APmai : gradient de pression transvalvulaire maximum mesuré au niveau de la vena contracta
APnet : gradient de pression transvalvulaire net mesuré après le recouvrement de pression
AA : Aortic cross-sectional Area
ACC : American College of Cardiology AHA : American Heart Association ANP : Atrial Natriuretic Peptide
ASE: American Society of Echocardiography AVA : Aire Valvulaire Anatomique
AVE : Aire Valvulaire Effective BNP : Brain Natriuretic Peptide BSA : Body Surface Area
CAS : Compliance Artérielle Systémique DC : Débit cardiaque
DRD : Durée de remplissage diastolique
EBCT : Electron-Beam Computed Tomography EOA : Effective Orifice Area
ESC : European Society of Cardiology FC: Fréquence cardiaque
FE : Fraction d'Éjection GM : Gradient Moyen
IEC A : Inhibiteur de l'Enzyme de Conversion de l'Angiotensine IMC : Indice de masse corporelle
IRM : Imagerie par Résonance Magnétique LDL : Low Density Lipoprotein
LVOT : Left Ventricular Outflow Tract LVSP : Left Ventricular Systolic Pressure
MGnet : transvalvular pressure gradient after pressure recovery MGvc : transvalvular pressure gradient at the vena contracta NYHA : New York Heart Association
PAS : Pression Artérielle Systolique
PLVOT : Pression au niveau de la chambre de chasse du VG
PR: Recouvrement de Pression Q : débit transvalvulaire
RVA : Remplacement Valvulaire Aortique SA : Sténose valvulaire Aortique
SAP : Systolic Aortic Pressure
SAPvc : Systolic Aortic Pressure at the vena contracta SC : Surface Corporelle
SMet : Syndrome Métabolique SV : Stroke Volume
Vi : Vélocité proximale de la voie de chasse V2 : Vélocité maximale dans la sténose VÉ : Volume d'Éjection
VÉi : Volume d'Éjection indexé VG : Ventricule Gauche
Introduction
La SA se trouve être la maladie cardiovasculaire la plus fréquente après la maladie coronarienne et l'hypertension artérielle. Vingt cinq pour cent (25%) des sujets âgés de 65 ans et plus ont une calcification de la valve aortique sans impact hémodynamique : c.à.d une sclérose valvulaire et 3% ont une calcification accompagnée d'obstruction hémodynamique significative : c.à.d sténose valvulaire. La prévalence de maladie valvulaire augmentera de façon marquée dans le futur en raison du vieillissement de la population. La SA est responsable à elle seule de plus de 100 000 chirurgies de RVA et 20 000 décès par année en Amérique du Nord. Les coûts estimés de cette chirurgie se situent entre 10 000 et 120 000$, dépendant du pays et de l'état/province où elle est réalisée et de la survenue de complication. Ces données soulignent l'importance du fardeau socio-économique lié à cette maladie.
Bien que le rhumatisme articulaire aigu ait longtemps été l'étiologie la plus fréquente de SA, la sclérose valvulaire dite degenerative est, de nos jours, l'étiologie prédominante dans les pays développés. Cette forme de SA a longtemps été considérée comme étant un processus dégénératif lié au vieillissement dont il était, par conséquent, difficile de modifier l'évolution. Cependant, des études récentes nous démontrent que cette maladie présente de nombreuses similitudes avec la maladie coronarienne athérosclérotique tant au niveau de la pathophysiologie que des facteurs de risques suggérant ainsi que la SA ne serait en fait qu'une des nombreuses manifestations de l'athérosclérose.1"4
Dans cette perspective, la SA degenerative ne serait donc plus à considérer comme un processus inéluctable, mais plutôt comme une pathologie dont il serait éventuellement possible de modifier l'évolution.
Le SMet est un ensemble de perturbations métaboliques associées à l'accumulation excessive de graisse viscérale. Les composantes du SMet incluent l'insulino-résistance, une dyslipidémie athérogénique ainsi qu'un état pro-inflammatoire et pro-thrombotique liés à l'insulino-résistance. Des travaux de notre équipe ont démontré que le SMet est associé à une progression plus
rapide de SA. Par contre, l'impact du SMet sur la fonction du VG des patients atteints de SA demeure inconnu.
L'hypothèse principale est que le SMet prédispose au développement d'une hypertrophie et d'une dysfonction plus sévère du VG chez les patients avec SA calcifiante.
Revue de littérature 1- Notions d'anatomie
1-1 Le cœur
Le mot cardiaque signifie « qui a rapport au cœur » et provient du mot grec cardia « cœur » qui trouve son sens dans la racine indo-européenne kèrd. Le cœur est un organe creux et musculaire d'une taille approximative d'environ 1.5 fois celle du poing fermé d'une personne. Il permet la circulation sanguine en pompant le sang grâce à des contractions rythmiques vers les vaisseaux sanguins et les différentes cavités du corps. Dans le corps humain, le cœur est situé dans le médiastin, partie médiane de la cage thoracique délimitée par les deux poumons, le sternum et la colonne vertébrale. C'est un organe creux constitué d'un muscle, le myocarde, et enveloppé par le péricarde et l'endocarde. Il comprend quatre chambres, les cavités cardiaques sont l'oreillette gauche, l'oreillette droite, le ventricule gauche et le ventricule droit. Chaque jour, plus de
100 000 battements cardiaques sont effectués pour pomper l'équivalent de 8000 litres de sang.
Cet organe central directement responsable de la circulation sanguine se compose en fait de deux cœurs côte-à-côte, mais tout-à-fait distincts l'un de l'autre, soit le cœur droit dit veineux et le cœur gauche dit artériel. Afin d'éviter le passage du sang entre ces moitiés, le septum inter-ventriculaire fait office de mur musculaire épais séparant l'oreillette gauche et le VG de l'oreillette droite et le ventricule droit. Un peu à l'image d'un moteur mécanique, des valves présentes entre les oreillettes et les ventricules permettent le passage unidirectionnel coordonné du sang depuis les oreillettes vers les ventricules. Les ventricules sont des pompes puissantes qui permettent de pousser le sang vers le corps ou les poumons. Leurs parois plus épaisses que celles des oreillettes leurs procurent une contraction plus importante afin de distribuer le sang. Le VG qui doit forcer le sang à parcourir tout le corps est beaucoup plus massif que le droit qui ne dessert que les poumons, (cf. figure 1).
veine cava supérieure oreillette droite valvule . pulmonaira valva tricuspide cordages -vantricule droit pillars -veine cava inférieure C200I c-Carëiolfiie crosse aortique tronc pulmonaire oreillette gauche valve aortique valve mitrale cordages ventricule gauche piliers apex aorte veine cava supérieure oreillette droite valvule . pulmonaira valva tricuspide cordages -vantricule droit pillars -veine cava inférieure C200I c-Carëiolfiie crosse aortique tronc pulmonaire oreillette gauche valve aortique valve mitrale cordages ventricule gauche piliers apex aorte veine cava supérieure oreillette droite valvule . pulmonaira valva tricuspide cordages -vantricule droit pillars -veine cava inférieure C200I c-Carëiolfiie
3?L
—
Hv*v
crosse aortique tronc pulmonaire oreillette gauche valve aortique valve mitrale cordages ventricule gauche piliers apex aorte veine cava supérieure oreillette droite valvule . pulmonaira valva tricuspide cordages -vantricule droit pillars -veine cava inférieure C200I c-Carëiolfiie3?L
—
Hv*v
r/f
vi_
crosse aortique tronc pulmonaire oreillette gauche valve aortique valve mitrale cordages ventricule gauche piliers apex aorte veine cava supérieure oreillette droite valvule . pulmonaira valva tricuspide cordages -vantricule droit pillars -veine cava inférieure C200I c-Carëiolfiie3?L
—
Hv*v
If
crosse aortique tronc pulmonaire oreillette gauche valve aortique valve mitrale cordages ventricule gauche piliers apex aorte veine cava supérieure oreillette droite valvule . pulmonaira valva tricuspide cordages -vantricule droit pillars -veine cava inférieure C200I c-Carëiolfiie3?L
—
Hv*v
1
5
crosse aortique tronc pulmonaire oreillette gauche valve aortique valve mitrale cordages ventricule gauche piliers apex aorteFigure 1 : Coupe schématique du cœur. Source : www.e-cardiologie.com.
1-1-1 Les valves cardiaques
Les valves du cœur sont de petites structures élastiques, non musculaires, sans innervation ni irrigation sanguine. Lorsqu'elles sont fermées, telles de petites portes, leur jointure est continente et empêche ainsi le sang de passer. Il y a quatre valves cardiaques (cf. figure 1 et 2) :
• La valve mitrale entre l'oreillette gauche et le VG;
• La valve tricuspide entre l'oreillette droite et le ventricule droit; • La valve aortique entre le VG et l'aorte;
valva tricuipida
(formé*) »■'»• pulmonair.
(ouvarta) valva aortiqu» valva pulmonaira (ouvarta) (ouvarta)
Figure 2 : Coupe schématique du cœur montrant les quatre valves cardiaques. À noter que la valve mitrale est fermée. Source : illustration adaptée de lifeisnow.com.
Leur ouverture et fermeture se font de façon tout-à-fait passives et dépendent de la différence de pression de chaque côté de la valve. Lorsque la pression en amont est supérieure à celle en aval, la valve s'ouvre pour faire écouler le sang de l'autre côté et dans le cas contraire elle se ferme. La valve mitrale, de par sa particularité, est la seule à comprendre seulement deux feuillets ancrés sur un anneau, l'anneau mitral, qui sépare l'oreillette gauche du VG. La valve tricuspide composée de trois feuillets aussi insérés sur un anneau, l'anneau tricuspidien, sépare l'oreillette droite du ventricule droit. Ces deux dernières valves sont reliées par des cordages tendineux à des piliers du muscle ventriculaire, qui servent de points d'attache pour éviter réversion des feuillets dans les oreillettes lorsque les ventricules se contractent. Les valves aortique et pulmonaire possèdent chacune trois feuillets appelés cuspides ou sigmoïdes. Leur fonction est d'empêcher le reflux de sang de l'aorte et des artères pulmonaires vers les ventricules. Une valve peut être atteinte de deux manières :
• un manque de continence à sa fermeture provoquant une fuite (également défini comme régurgitation ou insuffisance)
• ou un rétrécissement de la valve (également appelé sténose). Les deux types d'anomalie peuvent aussi coexister.
1-1-2 Le cycle cardiaque
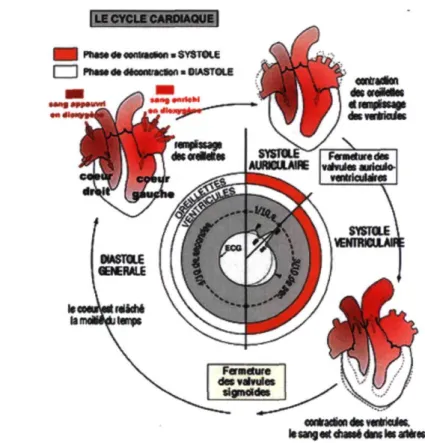
La fréquence cardiaque au repos se situe entre 55 et 80 battements par minute pour un débit de 4.5 à 5 litres de sang par minute. Au cours d'une vie, le cœur peut battre plus de 2 milliards de fois. Chaque battement entraîne une série d'événements collectifs qu'on nomme la révolution cardiaque et qui comprend trois grandes étapes majeures, soit la systole auriculaire, la systole ventriculaire et la diastole générale. Tel que le montre la figure 3, les ventricules passent 1/3 du temps en systole et 2/3 en diastole.
| LE CYCLE CAfaXAOÂJËl H b l W»** d» aantBMWn ■ SYST<XE I 1 ntMadadéeonuacton» DIASTOLE
certrâctwn des «entrnies le sang est chass* dan. te artères
Figure 3 : Le cycle cardiaque : mécanisme de fonctionnement. Source: www.e-s-c.fr/images/cyclecardiaque.gif.
Pendant la systole auriculaire, qui correspond au remplissage actif, les oreillettes se contractent afin d'éjecter le sang vers les ventricules. Une fois le sang expulsé, les valves auriculo-ventriculaires se ferment pour éviter un reflux sanguin vers les oreillettes.
La contraction des ventricules qui permet d'expulser le sang vers le système circulatoire correspond à la systole ventriculaire. Une fois le sang expulsé, les deux valves sigmoïdes (la valve pulmonaire à droite et aortique à gauche) se ferment pour empêcher le sang de retourner dans les ventricules. Au cours de cette systole, les oreillettes maintenant relâchées se remplissent de sang.
Finalement, la relaxation de toutes les parties du cœur, correspondant ici au remplissage passif des ventricules à partir des oreillettes droites et gauches depuis la veine cave supérieure et les veines pulmonaires respectivement, s'appelle la diastole.
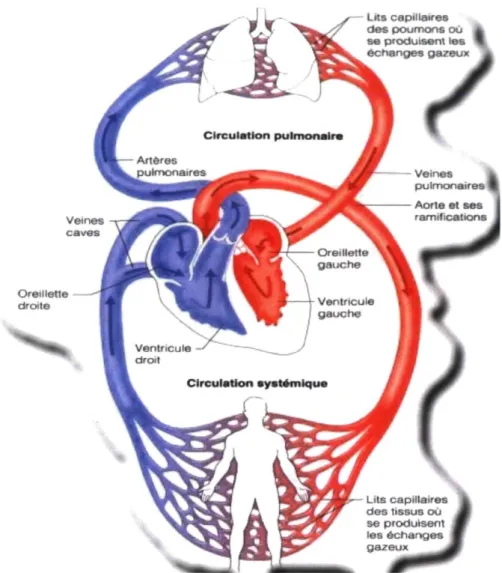
Il y a également deux types de circulation. La petite circulation ou circulation pulmonaire est irriguée par le ventricule droit qui assure l'oxygénation du sang, alors que la grande circulation ou circulation systémique reçoit le sang oxygéné dans le VG via l'oreillette gauche (cf. figure 4).1
Lits capillaires des poumons où se produisent les échanges gazeux
Figure 4 : Schéma de la circulation sanguine corporelle (petite et grande circulation). Source : cegep-ste-foy.qc.ca/profs/chebert.
1-2 La valve aortique saine
La valve aortique normale, située entre le VG et l'aorte, est constituée de trois cuspides symétriques et souples séparées par des commissures (cf. figures 5 et 6). Cette valve est formée d'un tissu élastique.2 Les feuillets sont attachés à la
média de l'aorte de façon semi-lunaire et se mobilisent de manière tout-à-fait synchrone. Les cuspides sont nommées en fonction de leur localisation par rapport aux ostia coronaires et sont séparées l'une de l'autre par les trois commissures. On les nomme : feuillets non-coronarien, coronarien droit et coronarien gauche (voir figure 5). Normalement, ces feuillets ne sont pas vascularisés et comprennent trois couches fines incluant des fibres élastiques et
du collagène, des fibroblastes et du tissu conjonctif. On retrouve du côté aortique la fibrosa, la spongiosa au centre et la ventricularis du côté ventriculaire. Ces éléments travaillent en parfaite harmonie pour s'ouvrir lors de l'éjection du sang (systole) dans la grande circulation et se fermer pendant la diastole pour éviter le reflux du sang dans le VG. Les sinus de Valsalva, présents au-dessus de chaque sigmoïde, forment une petite dilatation de la paroi aortique. Bien que leur rôle soit encore mal compris, on sait que des flots de vortex sont présents et pourraient aider à la fermeture des feuillets. Le grand Léonard de Vinci, de par son intérêt pour l'anatomie cardiaque, avait d'ailleurs illustré cet effet de tourbillon dans les sinus au 16e siècle.
Coronaire droite > ^ ^ y / * * " " Coronaire """"S,. / / gauche \ D
G
\
\^c^/
Valves aortiques normales
D: feuillet coronarien droit G: feuillet coronarien gauche NC: feuillet non-coronarien
Figure 5 : Anatomie d'une valve aortique normale. Source :
2- La sténose aortique
La SA consiste en un rétrécissement de l'orifice de la valve aortique causant ainsi une obstruction à l'éjection du sang qui passe du VG à l'aorte. Ceci amène une augmentation du gradient de pression transvalvulaire et impose une surcharge de pression sur le VG. Il s'agit d'une maladie grave observée le plus souvent chez l'adulte pour laquelle le seul traitement connu à ce jour est d'ordre chirurgical.
Au cours de l'histoire, la SA sévère a été définie initialement à partir de formules hydrauliques développées par Gorlin et al. qui montraient que le gradient de pression transvalvulaire augmentait de façon exponentielle lorsque l'aire valvulaire devenait inférieure à 0,75cm2.3 Les directives de Y «American
College of Cardiology/ American Heart Association » (ACC/AHA) proposent les critères suivant pour définir les trois niveaux de sévérité :
• Léger : aire valvulaire entre 1,5 et 2 cm2
• Modéré : aire valvulaire entre 1 et 1,5cm • Sévère : aire valvulaire < 1 cm .
Il faut par contre interpréter cette classification en fonction de la taille des sujets puisqu'une aire valvulaire de 1 cm2 peut effectivement correspondre à une
sténose sévère chez une personne de grande taille, mais à une sténose modérée chez des patients de plus petite taille. C'est la raison pour laquelle l'aire valvulaire doit être indexée par rapport à la surface corporelle. Une aire valvulaire indexée < 0,6 cm2/m2 indique que la valve est sévèrement sténosée.
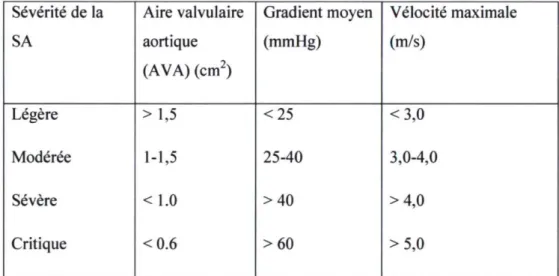
En présence d'une sténose sévère et d'un débit cardiaque normal, le gradient de pression transvalvulaire moyen peut atteindre plus de 40 mmHg. La vélocité maximale du jet aortique qui passe à travers la valve peut aussi être utilisée comme indice de sévérité de la SA. La sténose est considérée sévère lorsque cette vitesse devient supérieure à 4 m/s. Le tableau qui suit, tiré des recommandations de l'ACC/AHA, résume bien les différents critères cités et servant à définir le degré de sévérité de la SA.5
Sévérité de la Aire valvulaire Gradient moyen Vélocité maximale SA aortique (AVA) (cm2) (mmHg) (m/s) Légère >1,5 <25 <3,0 Modérée 1-1,5 25-40 3,0-4,0 Sévère <1.0 >40 >4,0 Critique <0.6 >60 >5,0
Tableau 1 : Indices et critères proposés pour définir la sévérité de la SA. Source :5.
L'apparition de symptômes chez les sujets atteints de SA sévère correspond à une indication de classe I de chirurgie de remplacement valvulaire selon les guides de pratique actuels. Par contre, bon nombre de patients avec SA sévère demeure asymptomatique, alors que d'autres ayant une SA modérée peuvent développer des symptômes. Ces discordances qui peuvent exister entre le degré de sévérité de la sténose et l'état symptomatique des patients suggèrent que des
facteurs autres que le degré de sténose valvulaire sont impliqués dans la pathophysiologie de la maladie.
2-1 Prévalence de la sténose aortique et histoire naturelle
Dans les pays industrialisés, le rétrécissement aortique calcifié constitue aujourd'hui la plus fréquente des valvulopathies cardiaques avec une prévalence de 2% après 65 ans et qui s'élève à 4% chez les patients âgés de plus de 85 ans.6
Cette prévalence augmente de façon marquée avec l'âge. La fréquence de la SA qui ne cesse d'augmenter s'explique par le vieillissement de la population, de même que la diminution des cardiopathies rhumatismales. L'amélioration des techniques diagnostiques peut aussi expliquer, en partie, cette augmentation. Bien que plus rare, cette maladie peut aussi être due à une malformation congénitale de la valve qu'on nomme bicuspidie aortique. Cette dernière touche
1% des nouveau-nés et aurait une transmission autosomique dominante à penetrance variable.7 Elle constitue d'ailleurs l'anomalie cardiovasculaire
congénitale la plus fréquente.8
Le stade précoce de sclérose aortique est caractérisé par l'épaississement et la calcification des feuillets de la valve sans causer d'obstruction de l'orifice valvulaire. Cette étape initiale de la maladie degenerative de la valve aortique conduit éventuellement au processus pathologique qu'est la SA. Le degré de calcium présent sur la valve augmente également avec l'âge. Vingt six pour cent (26%) des adultes de plus de 65 ans possèdent une sclérose aortique et cette prévalence augmente à 48% chez ceux de plus de 85 ans (31% chez les hommes vs 22% chez les femmes).9 Outre l'âge, d'autres facteurs de risque importants
ont aussi été associés à la sclérose aortique dont le sexe masculin, l'hypertension artérielle, la taille, le tabagisme, la lipoprotéine (a), le diabète et les lipoprotéines de faible densité (LDL).10
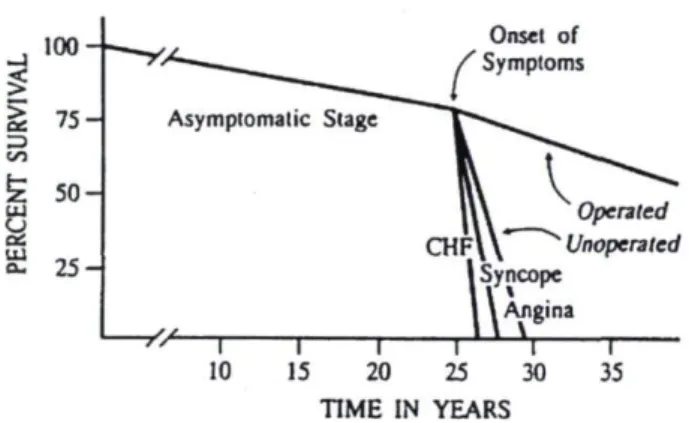
L'évolution de la SA peut résulter en une très longue période asymptomatique associée à une très faible incidence de mortalité et de morbidité (cf. figure 7)." Le pronostic en l'absence de symptômes est donc excellent. Par
traitement chirurgical est très mauvais avec une survie moyenne se situant entre
12-14
1 et 5 ans. Certaines études longitudinales ont démontré que la diminution de l'aire valvulaire pouvait être d'environ 0,1 cm2 en moyenne par année15, mais
avec une grande variabilité interindividuelle. Effectivement, cette diminution de la surface valvulaire peut atteindre dans certains cas jusqu'à 0,3 cm2 par année,
accompagnée d'une augmentation annuelle de 15 mmHg du gradient de pression transvalvulaire. D'un autre côté, chez plus de 50% des sujets atteints, la progression peut être très lente, voire même stable pendant de nombreuses années 16
Onset of / Symptoms
25 30 35 TIME IN YEARS
Figure 7 : Courbe de survie sur l'histoire naturelle de la SA. Source 12
Chez les patients asymptomatiques, le pronostic demeure excellent.17'18 Les
symptômes se développent lorsque l'aire valvulaire aortique est en moyenne autour de 0,6 cm2 et le pronostic devient alors plus sombre. Sans intervention
chirurgicale, la survie moyenne est donc de 1 à 5 ans parmi ces patients symptomatiques avec SA sévère 12-14, 19
2-2 Etiologies de la sténose aortique
L'orifice d'une valve aortique normale se situe entre 2 et 4 cm2. Lorsque
cette surface diminue sous le seuil de 1,5 cm2, il y a apparition d'un gradient de
pression transvalvulaire. Les différentes etiologies de la SA peuvent être divisées en trois grandes entités : les formes congénitales, rhumatismales et dégénératives (aussi appelées calcifiantes) (cf. figure 8).
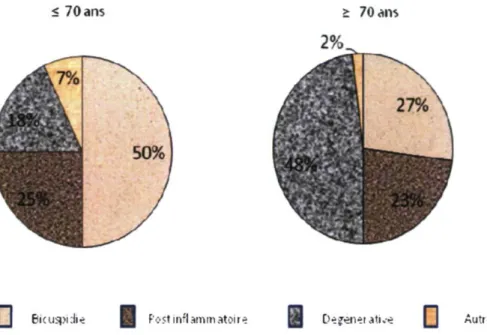
< 70 ans > 70 ans
D s
cuspii* Post inflammatoireS
Dépénei ati*eD
Autt «Figure 8 : Etiologies de la SA dans deux groupes d'âge différents (modifié d'après Passik CS, et al. Temporal changes in the causes of aortic stenosis: a surgical pathologie study of 646 cases. Mayo Clin Proc 1987;62:119-23). Parmi 646 patients ayant subi un RVA entre 1981 et 1985 pour SA pure, la calcification d'une valve aortique bicuspide représentait 50% des cas chez les patients < 70 ans (n = 324). Chez les patients > 70 ans (n = 322), la forme degenerative de la SA représentait le groupe le plus important.
2-2-1 La sténose aortique congénitale
Dans le cas des SA congénitales, la valve peut être unicuspide (1 seul feuillet), bicuspide, et voire même dans des cas plus rares quadricuspide (4 feuillets). Une valve unicuspide provoque une obstruction sévère déjà chez les enfants de moins de 1 an et constitue la malformation la plus fréquente parmi les SA infantiles fatales. La forme la plus fréquente de SA congénitale est la bicuspidie aortique avec une incidence de 1 à 2% dans la population.20 La
bicuspidie est plus prévalente chez les hommes et est également l'étiologie la plus fréquente de SA chez le sujet d'âge moyen (voir figure 8). En fonction de la sévérité de la malformation, le diagnostic et le traitement approprié peuvent se faire à des âges différents, soit de 15 à 65 ans (pour les valves unicuspides et bicuspides).
Il y a plusieurs formes de bicuspidie : 1) La bicuspidie vraie : seulement 2 feuillets ayant approximativement la même taille sont présents (cf. figure 9). Ces feuillets sont initialement souples, mais s'épaississent précocement avec les années. 2) La bicuspidie avec raphé : il y a 3 feuillets sur le plan anatomique mais seulement 2 sur le plan fonctionnel. En effet, 2 des feuillets sont fiisionnés par un raphé (cf. figure 10). D'autres malformations cardiaques peuvent être associées à ce phénotype dont la coarctation de l'aorte, un canal artériel perméable ou une communication inter-ventriculaire. Les risques d'une dilatation de la racine aortique et d'une dissection de l'aorte sont aussi accrus en sa présence. La majorité des sujets ayant une bicuspidie vont développer des changements morphologiques comparables à ceux retrouvés dans la SA calcifiante, mais à un âge plus jeune. Ainsi, il est aussi possible que des anomalies génétiques favorisent la calcification de la valve (e.g. Notch 1).
Figure 9 : Image d'une bicuspidie vraie comportant deux feuillets ayant approximativement la même taille. Source :22.
Figure 10 : Image d'une valve aortique bicuspide avec calcification des deux feuillets et montrant un raphé qui fusionne deux des feuillets. Source : Gracieuseté de Dr Sylvain Trahan du laboratoire de pathologie de l'Institut Universitaire de Cardiologie et de Pneumologie de Québec.
2-2-2 La sténose aortique rhumatismale
Dans ce type de pathologie acquise, les valves du côté gauche sont le plus souvent touchées et donc la SA rhumatismale est habituellement accompagnée d'une atteinte de la valve mitrale également. Cette forme de sténose aortique rhumatismale est aujourd'hui beaucoup plus rare dans les pays industrialisés, mais elle demeure encore la cause principale de dysfonction des valves explantées en chirurgie dans les pays en voie de développement. Chez ceux qui en sont atteints, on observe une fusion des trois commissures accompagnée de petites végétations et de fibrose, de même qu'un épaississement et une rétraction des bords libres des feuillets, ce qui donne une ouverture de la valve en forme de triangle. On remarque aussi souvent sur ces valves que des nodules de calcium
sont présents de chaque côté des feuillets, ce qui diffère de la SA d'origine degenerative où la calcification se fait plutôt au centre des feuillets sans que les commissures ne soient touchées. La différence majeure entre ces deux types d'anomalies réside donc dans la fusion commissurale. La calcification rhumatismale serait un processus régulé et stimulé par l'inflammation ainsi que l'expression et la différenciation de cellules ayant certaines caractéristiques des cellules ostéoblastiques, un processus appelé métaplasie osseuse.21 Par contre,
cette différenciation poussée n'est présente que chez environ 15% des patients. Une valve rhumatismale sténosée s'accompagne souvent d'une insuffisance aortique, ce qu'on appelle la maladie rhumatismale valvulaire.
2-2-3 La sténose aortique degenerative (calcifiante)
La maladie degenerative de la valve aortique est de loin la forme de sténose la plus fréquente et représente la majorité des SA chez la population âgée de plus de 70 ans (voir figure 8).6 Cette situation représente l'accumulation
progressive de calcium sur les feuillets d'une valve aortique normale au départ qui possède trois feuillets (cf. figure 11). La figure illustre bien la présence des nodules de calcium au centre des feuillets de la valve, plus précisément dans la fibrosa du côté aortique des feuillets, et que les commissures de la valve ne sont
pas fusionnés.
Figure 11 : Image d'une SA calcifiée sans fusion des commissures. Source : Gracieuseté de Dr Sylvain Trahan du laboratoire de pathologie de l'Institut Universitaire de Cardiologie et de Pneumologie de Québec.
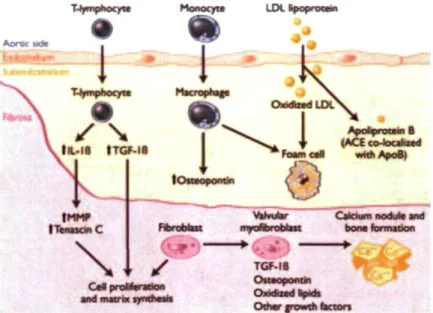
Pendant de nombreuses années, cette maladie a été considérée comme un processus purement dégénératif lié au vieillissement des tissus valvulaires. Cependant, des études récentes suggèrent que cette maladie est en fait plutôt un processus actif similaire à l'athérosclérose vasculaire. Elle est d'ailleurs caractérisée par une accumulation intracellulaire et extracellulaire de lipides et la présence de cellules inflammatoires, une différenciation ostéoblastique des myofibroblastes et des médiateurs actifs de la calcification (cf. figure 12). Plusieurs études récentes et en cours démontrent que les facteurs métaboliques et génétiques sont impliqués dans la pathogénèse de cette maladie.23"
t r i c u l a r s i d a S t e n o t i c v a l v e l e a f l e t V e n t r i c u l a r s . d * M y o f i b r o b l a s t M a c r o p h a g e T l y m p h o c y t e M a s t c e l l C a l c i f y i n g v a l v e ceil F o a m c e l l C o l l a g e n E l a s t i n C a l c i u m d e p o s i t L i p i d s
Figure 12 : Schéma montrant un feuillet d'une valve aortique normal en haut et un feuillet avec lésion typique d'une SA degenerative en bas. Source : 26. Les
dommages et perturbations qui se produisent sur I'endothelium entraînent l'infiltration de lipoprotéines circulantes et de cellules inflammatoires, tels des lymphocytes T et des monocytes, dans l'espace sous endothelial. Les LDL s'oxydent et sont phagocytées par les monocytes qui deviennent des macrophages. Ces derniers, remplis de particules de LDL oxydées hautement cytotoxiques, deviennent alors des cellules spumeuses (foam cell). Un sous-groupe de macrophages produit de l'ostéopontine, protéine impliquée dans la calcification vasculaire. Les particules de cholestérol LDL s'associent avec l'enzyme de conversion de l'angiotensine (ACE) et la transportent dans les feuillets valvulaires.25' 2Ô Les macrophages et les lymphocytes T quant à eux
relâchent des cytokines qui à leur tour agissent sur la prolifération cellulaire et le remodelage de la matrice extracellulaire. Les feuillets valvulaires endommagés sont le siège d'une néovascularisation qui augmente l'infiltration de lipides et des cellules inflammatoires. Un sous-groupe de fibroblastes valvulaires (cellules jeunes peu différenciées et précurseurs de tissu conjonctif) se différencie en myofibroblastes qui possèdent des caractéristiques de cellules musculaires lisses. Sous l'effet des cytokines inflammatoires et des LDL oxydées, ces derniers se différencient alors en ostéoblastes capables d'activer la formation de nodules de calcium et d'os. La calcification débute en des foyers
microscopiques extracellulaires qui terminent leur processus en formant de larges nodules de calcium avec des cellules inflammatoires présentes seulement en périphérie (cf. figure 13). A mesure que la calcification s'accumule, les feuillets valvulaires s'épaississent progressivement et la valve s'immobilise
T-I)»npt»«3cyta Cal proWanoon ind matrix I TGF-IB Ouaopontin Oxidtzad t f M I Olhaf jrowtn factors
Figure 13 : Illustration des processus potentiellement actifs dans la calcification de la valve aortique. Source : 6.
2-3 Pathophysiologie
2-3-1 Surcharge de pression
Une valve aortique sténosée entraîne plusieurs problèmes connexes dus à la résistance à l'écoulement du sang qui passe à travers cette valve. Cette barrière impose en premier lieu une surcharge de pression au VG.
Selon la loi de Laplace décrite ci-dessous, certains mécanismes se mettent en œuvre pour contrer cette surcharge chronique de pression. Les parois ventriculaires gauches s'épaississent (hypertrophie) au détriment de la cavité, qui elle se rétrécie, afin que le rapport de la pression sur l'épaississement demeure constant. Ceci réduit ainsi au minimum le stress pariétal et le travail du VG.
¥ . , , _ PressionVG* rayon VG
Loi de Laplace : Stress = ; -2 * épaisseur VG
De ces mécanismes compensatoires découlent :
• une augmentation de la résistance des arterioles coronaires à cause de l'augmentation de la pression intra-cavitaire et transpariétale au niveau duVG.
• une demande accrue du myocarde en oxygène à cause de l'hypertrophie ventriculaire gauche et de l'augmentation du travail du VG.
• une diminution de la réserve coronarienne à cause des 2 phénomènes cités ci-dessus.
• une dysfonction diastolique du VG à cause du développement de l'hypertrophie et de la fibrose myocardique. L'hypertrophie amène le ventricule à avoir une cavité moins compilante.
• Une éventuelle dysfonction systolique du VG résultant de l'excès de post-charge (afterload mismatch).
2-3-2 Hypertrophie ventriculaire gauche
L'hypertrophie amène le ventricule à avoir une cavité moins compliante avec des parois plus épaisses (cf. figure 14 et 15). Il existe quatre patrons d'hypertrophie du VG. Le ventricule est considéré normal lorsque la masse ventriculaire et le ratio épaisseur des parois sur diamètre interne de la cavité ne sont pas augmentés. Lorsque seul le ratio est supérieur à des valeurs normales, il y a un remodelage concentrique : la masse n'est pas augmentée mais ses parois sont épaissies au détriment du diamètre interne du VG. Dans le cas où, et la masse et le ratio sont élevés, il s'agit alors d'une hypertrophie de type concentrique. Lorsque seulement la masse du ventricule est augmentée mais pas le ratio, l'hypertrophie est de type excentrique.30
Dans le cas d'une surcharge de pression comme celle liée à la SA ou l'hypertension artérielle, le ventricule a tendance à développer une hypertrophie de type concentrique alors que dans le cas d'une surcharge de volume, l'hypertrophie est de type excentrique. Le sexe a une influence importante sur le patron d'hypertrophie chez les patients avec SA. En effet, malgré que la masse du VG soit significativement augmentée dans les deux sexes, les femmes ont tendance à avoir un VG plus petit, à parois plus épaisses et hyperdynamique,
alors que les hommes voient leur VG plus dilaté, avec des parois d'épaisseur relativement normales et hypokinétique.30"n Outre le sexe, la sévérité de la SA
et la présence d'hypertension artérielle concomitante se révélaient aussi comme étant des prédicteurs indépendants de l'hypertrophie du VG chez les patients avec SA 31
Géométrie ventriculaire gauche RPC 0,45 Remodelage concentrique Hommes : 115 g/m2 Femmes : 95 g/m2 Hypertrophie concentrique Hypertrophie excentrique MVGI
Figure 14 : Schéma montrant les quatre patrons d'hypertrophie ventriculaire gauche. Source :3 2 , 3 3. RPC : ratio épaisseur des parois sur diamètre de la cavité;
*ortic trek
P f p i l l n r j mj(
Posterior wah L«s'( vsnl' iute
Figure 15 : Vue en long axe du VG montrant les différentes parties du cœur observables et l'épaississement des parois du VG (échocardiographique vs anatomique). Source : 22. AV : valve aortique, LA : oreillette gauche, LV :
ventricule gauche, LVOT : chambre de chasse du VG, MV : valve mitrale, RVOT : chambre de chasse du ventricule droit.
Des études antérieures ont démontré qu'une altération de la géométrie ventriculaire gauche était un fort prédicteur indépendant d'événements adverses dans un contexte de cardiomyopathies par surcharge de pression. Chez des patients présentant de l'hypertension artérielle systémique, il y a une gradation du risque cardiovasculaire avec chaque patron de géométrie ventriculaire gauche altérée, où l'hypertrophie concentrique confère le risque le plus élevé suivi du remodelage concentrique et de l'hypertrophie excentrique où le risque est le plus faible.34 Chez des patients avec SA, le remodelage ventriculaire gauche
concentrique ou l'hypertrophie plus sévère ont été associés avec une fonction du myocarde altérée35"7 et une augmentation de la mortalité opératoire et tardive
suite au RVA 38,39
L'hypertrophie du VG dépend de en partie de l'augmentation de tissu fibreux et en partie d'une hypertrophie cellulaire liée à une augmentation de la taille des myocytes. Ces processus altèrent la géométrie et la fonction du ventricule. Ces anomalies amènent le ventricule à être plus rigide et moins
compliant, ce qui diminue sa capacité à se remplir sous des pressions normales. Suite à ces altérations, le ventricule dépend de plus en plus de la contraction de l'oreillette gauche pour le remplissage diastolique. L'augmentation de la taille et du nombre de myocytes, ainsi que le développement de fibrose de remplacement sont également accompagnés d'une diminution de la densité des vaisseaux coronariens (dilution artériolaire). L'élévation de la pression diastolique diminue aussi le gradient de pression de perfusion coronarienne. De plus, la SA entraîne, au stade sévère, une diminution des pressions systolique et diastolique du VG ce qui diminue encore plus le gradient de perfusion myocardique et, par
_ , r . 40 41
consequent, la reserve coronarienne. '
2-3-3 Dysfonction ventriculaire gauche Déterminants de la dysfonction ventriculaire gauche
Bien que la plupart des patients avec SA sévère développent rapidement des symptômes et subissent un RVA avant que leur fraction d'éjection ne soit affectée, environ 5% des patients montre une fraction d'éjection diminuée.42
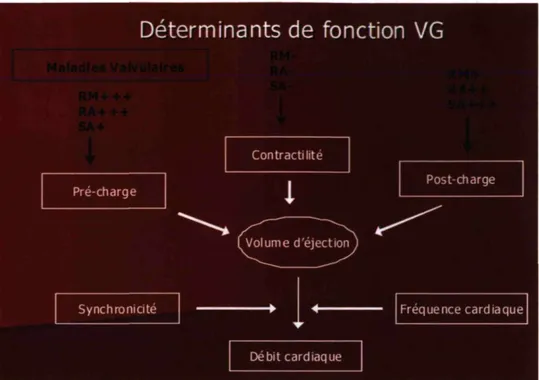
Une dysfonction ventriculaire gauche survient lorsqu'un défaut d'interaction entre les filaments d'actine et de myosine, impliqué dans la contraction musculaire, entraîne une perte de contractilité des cardiomyocytes et donc globalement une diminution de la contractilité du VG. Cette défaillance peut s'expliquer par un excès de post-charge lié à la SA, qui dépasse la limite des mécanismes compensateurs de l'hypertrophie du VG, ou encore par une cardiomyopathie intrinsèque. Il existe trois principaux mécanismes compensatoires pouvant s'activer afin de maintenir un débit cardiaque normal, soit l'activation du système nerveux sympathique, l'activation du système rénine-angiotensine-aldostérone et l'hypertrophie ventriculaire gauche. Grâce à ces changements hémodynamiques et neuro-hormonaux, le cœur est capable de maintenir un débit cardiaque malgré l'excès de post-charge lié à la SA. Cependant, ces mécanismes ne sont pas suffisants pour maintenir un débit cardiaque convenable à long terme. Il en résulte en une décompensation cardiaque et le problème à l'origine de cette défaillance doit être corrigé.
Lorsque la pathophysiologie est une SA sévère, le cœur répond tout d'abord à cette surcharge de pression en s'hypertrophiant et la fonction systolique du VG demeure préservée. L'hypertrophie du VG altère en premier lieu les propriétés de la fonction diastolique et il en résulte des pressions de remplissage plus élevées en fin de diastole, mais la puissante contraction de l'oreillette fournit le remplissage du VG requis et l'allongement des fibres nécessaires. Lorsque l'augmentation de post-charge imposée au VG ne cesse d'augmenter, le ventricule utilise deux mécanismes compensatoires; 1) augmentation de la pré-charge et 2) augmentation de la contractilité myocardique (cf. figure 16). Ces deux mécanismes contribuent à maintenir la fonction systolique normale. Une fois que les limites de la réserve de la pré-charge sont atteints (afterload mismatch) ou que la contractilité du myocarde est affaissée, il en résulte en une dysfonction systolique également. L'insuffisance cardiaque survient habituellement suite à une dysfonction systolique, mais peut aussi être le résultat d'une dysfonction diastolique.
Déterminants de fonction VG
Figure 16 : Schéma simplifié montrant les principaux déterminants de dysfonction ventriculaire gauche. RM : régurgitation mitrale; RA : régurgitation aortique; SA : sténose aortique.
Les principaux mécanismes pouvant expliquer le développement de la dysfonction diastolique et systolique du myocarde sont : l'afterload mismatch, l'épuisement de la réserve coronarienne et une cardiomyopathie concomitante (cf. figure 17).
Sténose aortique l l AVE t Pression VG systolique t Stress pariétal VG systolique f Temps d'éj«3Ction VG
l
t Consommation du myocarde en O, HVG concentrique » Capacité d'autorégulation de la circulation coronarienne Pression VG diastolique l Temps perfusion diastolique . Réserve coronarienne vasodilatatricePression intra-myocardique — t Résistance coronarienne minimale Pression Ao 1 Alimentation du myocarde en O, l Ischémie du myocarde Apoptose et fibrose des myocytes 1 Dysfonction systolique/diastolique du VG i Défail lance VG
Figure 17 : Schéma sur les déterminants de dysfonction ventriculaire gauche dans la SA.
- Excès de post-charge (Afterload mismatch)
Il est bien connu que l'augmentation de la post-charge a un effet négatif sur la contractilité cardiaque. Dans les premières phases de la maladie, l'hypertrophie concentrique du myocarde permet de limiter l'augmentation du stress pariétal et, par conséquent, la diminution de contractilité. Mais à plus long-terme, le VG ne réussit plus à s'adapter à la surcharge de pression devenue trop importante et la fraction d'éjection commence à diminuer. Chez certains patients, l'hypertrophie cardiaque est inadéquate et l'excès de post-charge survient plus rapidement dans le cours de la maladie. Plusieurs études43, u ont
montré des corrélations négatives entre le stress pariétal circonférentiel du VG et la fraction d'éjection, ou la vitesse de raccourcissement des fibres myocardiques, en l'absence d'obstruction coronaire illustrant ainsi le concept d'excès de post-charge. Les patients ayant comme étiologie de dysfonction ventriculaire l'excès de post-charge réagissent bien au RVA en comparaison avec ceux dont l'étiologie est une cardiomyopathie intrinsèque. Ce 2e groupe de patients avec
basse par rapport au niveau de stress pariétal (cf. figure 18). Ces patients ne bénéficient pas autant du RVA et l'évolution de la fraction d'éjection est variable selon les patients.
«Ô 200 25Ô 5te 3 » sfe j f e " a 'dynes x « V a "2 1
Figure 18 : Relation entre la fraction d'éjection et le stress pariétal du VG dans un contexte de SA. Plus le stress est important et plus la fraction d'éjection s'en trouve abaissée. Source : 4 .
- Épuisement de la réserve coronarienne
La réserve coronarienne se définit comme le ratio entre le flot sanguin coronarien après vasodilatation maximale du lit artériel coronarien et le flot coronarien au repos. À l'état normal, le flot sanguin peut-être augmenté par un facteur 3 ou 4 par la vasodilatation des arterioles coronaires. Cette réserve permet au cœur de s'adapter rapidement à une augmentation de la demande en oxygène. En l'absence d'obstruction coronaire, les patients avec SA présente une diminution de leur réserve coronarienne qui est inversement proportionnelle à l'aire valvulaire aortique.41 Lorsque celle-ci descend en dessous de 0.6 cm2,
elle est pratiquement épuisée (ratio proche de l).45 La réduction de la réserve
coronarienne vasodilatatrice est en grande partie responsable de l'ischémie chez les patients avec SA et cette diminution peut mener à long terme à une
dysfonction ventriculaire gauche. La sténose aortique a les effets suivants : 1) l'augmentation de la pression systolique du VG, 2) l'allongement du temps d'éjection systolique et la diminution du temps diastolique, 3) l'augmentation de la pression diastolique du VG, 4) la diminution de la pression aortique et, 5) une hypertrophie du VG. La diminution de la réserve coronarienne est due au déséquilibre entre la consommation et l'alimentation en oxygène. En présence d'une SA, plusieurs facteurs incluant l'augmentation de la pression systolique du VG et l'hypertrophie myocardique augmentent la consommation en oxygène. D'un autre côté, l'augmentation de pression systolique et diastolique du VG, l'allongement du temps d'éjection systolique et l'hypertrophie combinée à la diminution de la pression aortique provoquent une baisse du gradient de perfusion trans-myocardique, ce qui diminue l'apport sanguin coronaire et donc l'apport en oxygène au myocarde. L'hypertrophie cardiaque et le phénomène de dilution artériolaire qui y est associé ainsi que la diminution du temps diastolique contribuent également à la diminution des apports. Lorsque la réserve contractile est épuisée, le myocarde est soumis à des périodes d'ischémie répétées qui surviennent lorsque la demande en oxygène augmente (exercice physique, émotions etc.). Ceci peut amener à une altération du matériel contractile des myocytes et éventuellement l'apoptose.40,46
- Cardiomyopathies intrinsèques
Les patients avec SA ont souvent une maladie concomitante (maladie coronarienne, diabète, obésité, hypertension artérielle) qui peuvent causer une cardiomyopathie responsable en partie ou en totalité de la dysfonction ventriculaire gauche. Environ 50% des patients avec SA ont une maladie coronarienne, 30 à 40% ont une hypertension artérielle et 10 à 20% ont un diabète de type II.25,47-49
2-4 Manifestations cliniques
La SA est une maladie qui progresse graduellement de telle sorte que les patients peuvent demeurer asymptomatiques pendant plusieurs années (voir