HAL Id: dumas-01850583
https://dumas.ccsd.cnrs.fr/dumas-01850583
Submitted on 27 Jul 2018HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires
comparant son efficacité, sa tolérance, son coût par
rapport à deux traitements de rattrapage
Béatrice Rousset
To cite this version:
Béatrice Rousset. Taxol et cancer de l’ovaire : étude rétrospective comparant son efficacité, sa tolérance, son coût par rapport à deux traitements de rattrapage. Sciences pharmaceutiques. 1996. �dumas-01850583�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
Ill /Ill Ill 111111111
li/li
Ill
li
D 115 017936 2
ANNEE 1996
NlVERSITE Joseph FOURIER - GRENOBLE I
U.F.R . . DE PHARMACIE
Domaine de la Merci -La Tronche
N° D'ORDRE
MEMOIRE
DU DIPLOME D'ETUDES SPECIALISEES DE PHARMACIE HOSPITALIERE ET DES COLLECTIVITES
Soutenu le 14 Juin 1996 à 18 heures par
Mademoiselle Béatrice ROUSSET
ément aux dispositions de !'Arrêté du 04 Octobre 1988 tient lieu de: THESE
POUR LE DIPLOME D'ETAT DE
HOCTEUR EN PHARMACIE
TAXOL ET CANCER DE L'OVAIRE:
ETUDE RETROSPECTIVE COMPARANT
SON EFFICACITE, SA TOLERANCE, SON
COUT PAR RAPPORT A DEUX
TRAITEMENTS DE RATTRAPAGE
JURY Président: Madame Je Professeur A.M. Mariotte
Membres: Mademoiselle le Docteur D. Charléty Madame Je Professeur M. Mousseau _M11dame1 Meylan
Pharmacien, praticien hospitalier Médecin, praticien hospitalier Pharmacfen, chef de sen1ice [Données à caractère personnel]
ANNEE 1996
U.F.R.
DE PHARMACIE Domaine de la Merci -La TroncheN° D'ORDRE MEMOIRE
DU DIPLOME D'ETUDES SPECIALISEES DE
PHARMACIE HOSPITALIERE ET DES COLLECTIVITES Soutenu le 14 Juin 1996 à 18 heures
par
Mademoiselle Béatrice ROUSSET
Conformément aux dispositions de !'Arrêté du 04 Octobre 1988 tient lieu de : THESE
POUR LE DIPLOME D'ETAT DE
DOCTEUR EN PHARMACIE
TAXOL ET CANCER DE L'OVAIRE:
ETUDE RETROSPECTIVE COMPARANT
SON EFFICACITE, SA TOLERANCE, SON
COUT PAR RAPPORT A DEUX
TRAITEMENTS DE RATTRAPAGE
JURY Président: Madame le Professeur A.M. Mariotte Membres : Mademoiselle le Docteur D. Charléty Madame le Professeur M. Mousseau Madame 1. Meylan
Monsieur le Professeur F. Locher
Pharmacien, praticien hospitalier Médecin, praticien hospitalier Pharmacien, chef de service Pharmacien, praticien hospitalier [Données à caractère personnel]
ll mon Père, à ma <}rand-mire. Yl ma !Mère, à tf'.a fam:il!é
.9l. tous tnM amis
''! {ne faut pas fier un na'llire à une seuk ancre,
ni une
vœ
à un seuf espoir."Remerciements
à Madame le Professeur Mariotte,
qui m'a fait l'honneur d'accepter la présidence de ce jury. à Mademoiselle Charléty,
qui m'a encadrée avec compétence et disponibilité non seulement tout au long de ce travail mais aussi au cours de ma cinquième année hospitalo-universitaire et pendant mon internat.
à Madame le Professeur Mousseau,
qui a accepté avec gentillesse de me guider dans l'élaboration et la réalisation de l'étude.
à Madame Meylan,
qui m'a toujours très bien accueillie dans son service et m'a fait bénéficier de ses précieux conseils et de sa confiance lors de mon passage à la pharmacie Michallon.
à Monsieur le Professeur Locher,
qui a accepté de participer à ce jury.
à Madame Wimmer et aux laboratoires Bristol-Myers Squibb,
qui m'ont gracieusement fourni une importante documentation.
à mes amis et à tous ceux,
qui ont contribué, de près ou de loin, à l'aboutissement de ce projet.
Qu'ils trouvent ici l'expression de mes sincères remerciements et le témoignage de ma profonde reconnaissance.
Page
INTRODUCTION
11
PARTIE I:
CANCER DE L'OVAIRE
12
I - EPIDEMIOLOGIE
13
11- ETIOLOGIE
13
11.1- FACTEURS DE RISQUES 13
II.2- ORIGINE DU NEOPLASME EN FONCTION DE L'AGE 15
III- FACTEURS ANATOMO-PATHOLOGIQUES
16
III.1 - HISTOLOGIE 16
ID.2 - GRADE IDSTOLOGIQUE 18
llI.3 - FACTEURS ANATOMIQUES 18
IV - DIAGNOSTIC
20
IV.1 - CIRCONSTANCES DE DECOUVERTES 20
IV.2 - DEPISTAGE DE MASSE 21
IV.3 - MOYEN DE DIAGNOSTIC 22
V - FACTEURS PRONOSTIQUES (FP)
25
V.1 - FP AU MOMENT DU DIAGNOSTIC 25
V.2 - FP LORS DE LA REMISSION COMPLETE 28
IDSTOLOGIQUE
VI - CONCLUSION
29
PARTIE II:
I - CHIRURGIES
TRAITEMENTS DU CANCER 31
DE L'OVAIRE
Ll - CHIRURGIE INITIALE32
32I.2 - CHIRURGIE DE SECOND REGARD I.3 - CHIRURGIE DES RECIDIVES
II - CHIMIOTHERAPIES
11.1- LES CYTOSTATIQUES UTILISES: réponses objectives et toxicités
11.2 - LES TRAITEMENTS CHIMIOTHERAPIQUES
III - CHIMIOTHERAPIE INTRAPERITONEALE
IV - RADIOTHERAPIE
IV.1 - RADIOTHERAPIE EXTERNE
IV.2 - RADIOTHERAPIE INTRAPERITONEALE
V - IMMUNOTHERAPIE
VI - RADIOIMMUNOTHERAPIE
VII - CONCLUSION
PARTIE III:
PACLITAXEL
Page 33 34 34 34 46
53
55
56 5757
58
59
61
I - HISTORIQUE
62
1.1 - DECOUVERTE DU PACLIT AXEL 62
I.2- L'IF 62
I.3 - DEVELOPPEMENT DU PACLITAXEL 63
I.4 - DEVELOPPEMENT DES ESSAIS CLINIQUES 64
1.5 - PRODUCTION DE PACLIT AXEL 64
II - CHIMIE DU T AXOL
65
II.1 - STRUCTURE ET CARACTERISTIQUES CHIMIQUES 65
Il.2- RELATION STRUCTURE-ACTIVITE 66
II.3 - APPROVISIONNEMENT DU PACLITAXEL 71
Page
III - MECANISME D'ACTION
76
IV - ACTIVITE
IN VITRO
ET
IN VIVO
19
IV.1 - ACTIVITE IN VITRO 79
IV.2 - ACTIVITE IN VIVO 80
IV.3- EFFET RADIOSENSIBILISATEUR DU PACLITAXEL 81
V - MECANISME DE RESISTANCE
82V.1 - RESISTANCE AU NIVEAU TUBULINE ET 82
MICROTUBULES V.2 - RESISTANCE PLEIOTROPIQUE 82 V.3 - RESISTANCE INTRINSEQUE 83 V.4- RESISTANCE CROISEE 83
VI - PROPRIETES PHARMACOCINETIQUES
84 VI.1 - ABSORPTION 84VI.2 - DISTRIBUTION ET LIAISON AUX PROTEINES 84
PLASMATIQUES
VI.3 - METABOLISME 85
VII-TOXICITES
89
VII.1 - TOXICOLOGIE ANIMALE 90
VII.2 - MYELOSUPPRESSION 90
VII.3 - NEUROTOXICITE 95
VII.4 - REACTIONS D'HYPERSENSIBILITE (RHS) 103
VII.S - CARDIOTOXICITE 107
VII.6 - TOXICITE DIGESTIVE 110
VII.7-TOXICITE CUTANEE 111
VII.8 - TOXICITE LOCALE 112
VII.9 - AUTRES EFFETS INDESIRABLES 112
VII.10 - TOXICITE LORS DE L'ADMINISTRATION 113
INTRAPERITONEALE
VII.11 - CONCLUSION 113
VIII - INDICATIONS
114
VIII.2 - AUTRES INVESTIGATIONS
IX - INTERACTIONS MEDICAMENTEUSES
IX.1 - INTERACTIONS AVEC LES ANTI-H2 IX.2- LES SELS DE PLATINE
IX.3 - LE CYCLOPHOSPHAMIDE IX.4 - LA DOXORUBICINE
IX.5 - LA VIT AMINE A (Rétinol) IX.6 - LE KETOCONAZOLE
X - CONTRE-INDICATION
XI - PREPARATION ET MODE D'EMPLOI
XI.1 - SOLUTES DE DILUTION XI.2 - MATERIELS
XI.3 - PRECAUTIONS XI.4 - STABILITE
XII - CONCLUSION
PARTIE IV:
ETUDE RETROSPECTIVE
I - INTRODUCTION
II - PATIENTES ET METHODES
11.1- SELECTION DES PATIENTES 11.2 - METHODES D'EVALUATION
III-RESULTATS
ID.1 - DESCRIPTION DES PATIENTES 111.2 - EVALUATION DE L'EFFICACITE III.3 - EVALUATION DE LA TOLERANCE ID.4 - EVALUATION DES COUTS
Page 117 123 123 124 125 125 125 126
126
126
127 127 127 128128
130
131
131
131 136143
143 149 155 162IV - DISCUSSION
IV.1 - COMPARAISON DE L'EFFICACITE IV.2- COMPARAISON DE LA TOLERANCE IV.3-COMPARAISON DES COUTS
IV.4 - BIAIS DE L'ETUDE
V - CONCLUSION
CONCLUSION
REFERENCES BIBLIOGRAPHIQUES
ANNEXES
TABLES DES MATIERES
LISTES DES ILLUSTRATIONS
SERMENT DES APOTHICAIRES
Page
168
168 171 173 174178
179
180
193
206
220
224
INTRODUCTION
En Février 1995, le Taxol® est commercialisé en France depuis environ deux ans et se présente comme un nouveau traitement potentiellement efficace en thérapie de rattrapage du cancer de l'ovaire. C'est pourquoi, nous nous proposons d'évaluer puis de comparer l'efficacité, la tolérance et le coût d'un traitement par Taxol® avec d'autres thérapies de rattrapage par le biais d'une étude rétrospective dans le service d'oncologie médicale du Centre Hospitalier et Universitaire de Grenoble. Pour mieux comprendre le contexte de cette étude, nous faisons un rappel sur le cancer de l'ovaire et sur ses traitements actuellement possibles ou en cours de recherche. Puis nous effectuons une revue bibliographique sur le Taxol®.
PARTIE 1
CANCER DE
L'OVAIRE
I - EPIDEMIOLOGIE
Le cancer de l'ovaire, au niveau mondial, représente en fréquence le sixième cancer de la femme (4%, 18000 nouveaux cas par an aux Etats-Unis, 7000 à 8000 en France), après le sein, le côlon, l'utérus (col et corps) et l'estomac (1,2). Il est la
cinquième cause de mortalité par cancer ( 6% des décès par cancer chez la femme, soit 12000 décès par an aux Etats-Unis, 2800 en France) et la première parmi les cancers gynécologiques (52% ). Son taux moyen d'incidence, tous types histologiques confondus est de 15/100000 chez les femmes de race blanche et 9,3/100000 chez les femmes de race noire (2,3,10). Depuis 25 ans, l'incidence est en progression régulière
et le pronostic d'une telle tumeur n'a guère évolué: globalement, le taux de survie à 5 ans se situe entre 25% et 30% (l),
II - ETIOLOGIE
L'étiologie du cancer de l'ovaire est inconnue mais il est clair qu'un certain nombre de facteurs sont impliqués dans l'apparition d'une telle tumeur.
11.1- FACTEURS DE RISQUES
Les facteurs de risque sont résumés dans le tableau 1.
• Oligoparité
Pour une femme ayant eu moins de 2 grossesses, le risque de cancer de l'ovaire est multiplié par 2,5. Par contre, la multiparité, l'allaitement prolongé et l'utilisation de contraceptifs oraux diminuent ce risque. Ceci est indirectement lié à l'hypothèse que des ovulations répétées favoriseraient l'apparition d'une tumeur ovarienne par perturbation du processus de réparation de l'épithélium de surface. A cette hypothèse
s'associeraient des changements hormonaux liés à la ménopause, des facteurs environnementaux mal définis et des facteurs génétiques responsables soit de la réparation anormale, soit de l'évolution vers un carcinome (1,3).
• Antécédents familiaux de cancers ovariens
Ce facteur est mieux connu depuis 10 ans grâce à la tenue de registres. Cependant, l'incidence des cas familiaux est encore mal définie. Actuellement, il serait fait état de 5% de formes héréditaires sur l'ensemble des cancers de l'ovaire. Toutefois, dans le cas de syndrome familial de tumeurs ovariennes (transmission autosomale dominante), le risque peut approcher 40%. Dans ce cas, il serait préférable d'effectuer une annexectomie bilatérale prophylactique (après naissances des enfants désirés) avant l'âge de 35 ans (3,5,10).
Trois syndromes familiaux, chacun autosomal-dominant, ont été décrits : le cancer ovarien site-spécifique, le syndrome du cancer sein-ovaire et le syndrome du cancer de famille (11). Cependant, aucune anomalie génétique spécifique n'a encore été
découverte.
• Facteurs environnementaux
Le talc a un rôle controversé dans l'apparition de cancers de l'ovaire.
Le régime riche en viande et produits d'origine animale ainsi qu'un régime riche en galactose pourraient être associés à une augmentation de l'incidence de cancers de l'ovaire (10).
• Tumeurs ovariennes bénignes, endométriose;
• Cancer de l'endomètre, du sein ou du côlon (1);
•Age
Le risque de survenue d'un cancer de l'ovaire est augmenté chez les femmes de plus de 60 ans (5).
Tableau l: Facteurs de risques des cancers de l1ovaire (3)
Aue;mentation du risque Diminution du risque Episodes de la - Nulliparité - Multiparité
vie génitale - Infertilité - Contraception orale - Age élevé à la naissance du - Lactation
premier enfant
Facteurs - Antécédents de cancer du endocriniens sem Facteurs génétiques - Puberté précoce - Ménopause tardive - Antécédents familiaux de cancer de l'ovaire (un ou plusieurs parents au premier degré)
- Syndrome de cancers familiaux de type II de Lynch - Syndrome de Peutz-Jeghers - Dysgénésie gonadique - Carcinomes multiples basocellulaires
Facteurs liés à -Pays industrialisés
l'environne-- -Consommation de lactose ment -Exposition au talc
11.2 - ORIGINE DU NEOPLASME EN FONCTION DE L'AGE
Selon l'âge des patientes, le néoplasme peut avoir des origines préférentielles:
- chez les femmes de moins de 20 ans, l'origine est essentiellement les cellules germinales ( 60%) suivies de l'épithélium cœlomique (30% );
- chez les femmes de plus de 20 ans, l'origine est essentiellement l'épithélium cœlomique (70% entre 20 ans et 50 ans, 80% au delà de 50 ans) (1,2),
III - FACTEURS ANATOMO-PATHOLOGIQUES
III.1 - HISTOLOGIE
L'histologie la plus rencontrée est le cancer épithélial (épithélium germinatif) avec une fréquence de 85% des cancers de l'ovaire, suivi par le cancer germinal (cellules germinales) (5% à 10%), puis des tumeurs du stroma gonadique (5%) et des tumeurs métastatiques (5% ). Les sarcomes sont très rares (1,2).
111.1.1 - Les cancers épithéliaux de l'ovaire ou carcinomes
Il s'agit d'une tumeur solide, kystique (le plus souvent mi-solide, mi-kystique) dont le point de départ est le revêtement de surface de l'ovaire. En général, l'atteinte ovarienne est bilatérale et des foyers extra-ovariens au niveau du péritoine sont fréquents (2).
Les différentes formes de carcinomes rencontrées sont :
- l'adénocarcinome séreux ( 40%) qui se caractérise par la formation de papilles et la présence de calcifications ou calcosphérites dans environ un tiers des cas.
- l'adénocarcinome endométrioïde (10% à 15%) qui possède les mêmes caractéristiques histologiques que le carcinome de l'endomètre auquel, d'ailleurs, il
s'associe dans 15 à 20% des cas, rendant parfois difficile la mise en évidence d'une nature primitive ou secondaire de la tumeur ovarienne.
- l'adénocarcinome mucineux (3% à 12%) qui se différencie par un revêtement constitué de cellules mucosécrétantes de type endocervical ou intestinal. Le pseudomyxome péritonéal est une manifestation de son extension extra-ovarienne.
- l'adénocarcinome à cellules claires (6%) et les tumeurs de Brenner (1 %). - l'adénocarcinome indifférencié (15% à 40%) (1,2).
111.1.2 - Les tumeurs germinales malignes
Plus de 50% de ces tumeurs sont des dysgerminomes ou séminomes. Les autres cancers à cellules germinales sont des tératomes immatures ou embryonnaires, des choriocarcinomes, des carcinomes embryonnaires (2).
111.1.3 - Les tumeurs du mésenchyme et des cordons sexuels
Elles sont rares. Elles se développent à partir des cellules du stroma gonadique, plus ou moins différenciées soit dans le sens ovarien (cellules de la granulosa et cellules thécales) soit dans le sens testiculaire (cellules de Sertoli-Leydig). Les tumeurs à cellules granuleuses apparaissent après la ménopause, avec existence de signes d'hyperœstrogénie, et ont un faible potentiel de malignité. Par contre, la rupture de la capsule avec extension extra-ovarienne est de mauvais pronostic. Enfin, les tumeurs à cellules de Sertoli-Leydig (ou androblastomes), très rares, sont bénignes ou faiblement malignes, et peuvent être œstrogéno- ou androgénosécrétantes (2).
111.1.4 - Atteintes métastatiques de l'ovaire
Il est possible de retrouver, au niveau de l'ovaire, des métastases de cancer du tube digestif (colique, gastrique), du sein, de l'endomètre et parfois de lymphomes (1),
111.1.5 - Mode d'extension des cancers de l'ovaire
Le mode d'extension, en général, des tumeurs ovariennes est l'ensemencement des structures pelviennes, c'est à dire les structures les plus proches de l'ovaire soit le péritoine pariétal et viscéral des divers organes, l'épiploon, les coupoles diaphragmatiques, le foie et les gouttières pariétocoliques, les cellules tumorales étant véhiculées par le liquide péritonéal.
Cette diffusion peut aussi se faire par voie lymphatique rétropéritonéale (aboutissant à des adénopathies locorégionales) ou transdiaphragmatique. La diffusion par voie hématogène est plus rare et se rencontre dans les stades avancés avec atteintes métastatiques du foie voire de la plèvre (2,3).
Ill.1.6 - Cas particulier: les tumeurs "borderline"
Ce sont des tumeurs à faible potentiel de malignité (pas d'atteinte du stroma ovarien). Elles concernent 20% des tumeurs épithéliales. Elles ne peuvent être affirmées qu'en présence d'au moins deux des cinq éléments histologiques suivants:
- stratification de l'épithélium recouvrant les papilles, - épithélium avec micropapilles,
- pléïomorphisme cellulaire, - atypies nucléaires,
- augmentation de l'activité mitotique.
Leur pronostic est bien meilleur (survie à 5 ans variant de 90% à 95%) que celui des autres tumeurs ovariennes et leur traitement devra être adapté en conséquence (la chirurgie large paraît suffisante) (2,3).
III.2 - GRADE HISTOLOGIQUE
Le grade histologique tient compte du degré de différenciation architecturale de la tumeur et des atypies nucléaires. Ces grades sont présentés ci-dessous par ordre croissant de gravité et concernent les tumeurs épithéliales:
- Grade I: pour les tumeurs hautement différenciées (5% des cas); - Grade II: pour les tumeurs moyennement différenciées (20% des cas); - Grade III: pour les tumeurs moyennement indifférenciées (50% des cas); - Grade IV : pour les tumeurs hautement indifférenciées (20% des cas) (1,2).
llI.3 - FACTEURS ANATOMIQUES
La classification FIGO (classification de la Fédération Internationale de Gynécologie et Obstétrique, proche de la classification TNM ou Tumor-Nodes-Metastasis) est fonction de l'étendue tumorale et ne peut se faire qu'après une intervention chirurgicale. Elle permet de différencier les cancers de l'ovaire en 4 stades et représente un facteur pronostique important (1,2).
111.3.1 -Stade I
Il définit les tumeurs limitées aux ovaires et représente 25% des cas. Il est divisé en trois sous-stades :
- stade IA : tumeur limitée à un seul ovaire, sans ascite;
• stade IAl : pas de tumeur à la surface et capsule intacte; • stade IA2 : tumeur à la surface et/ou capsule rompue; - stade IB : tumeur des deux ovaires, sans ascite;
• stade IB 1 : pas de tumeur à la surface et capsule intacte; • stade IB2 : tumeur à la surf ace et/ou capsule rompue; - stade IC : stade IA ou IB avec ascite ou lavage péritonéal positif.
111.3.2 - Stade II
Il définit les tumeurs qui atteignent un ou deux ovaires avec extension pelvienne et concerne 20% des cas. Il est lui aussi divisé en trois sous-stades:
- stade IIA : extension et/ou métastases utérines et/ou tubulaires; - stade IIB : extension aux autres organes pelviens;
- stade IIC : stade IIA ou IIB avec ascite ou lavage péritonéal positif.
111.3.3 -Stade III
Il définit les tumeurs avec métastases au-delà du pelvis (grand épiploon et mésentère) et/ou avec extension histologique au tube digestif (grêle, côlon) ou aux viscères (à l'exception du foie) et/ou avec adénopathies métastatiques régionales (rétropéritonéales). Il représente 35% des cas. Il est divisé en trois sous-stades :
- stade HIA: métastases péritonéales microscopiques;
- stade HIC : métastases péritonéales de plus de 2 cm et/ou adénopathies régionales métastatiques.
III.3.4 - Stade IV
Il définit les métastases à distance c'est-à-dire autres que les métastases péritonéales. Il concerne 15% des cas.
A noter que la valeur de cette classification dépend beaucoup de la rigueur des explorations. Ainsi, si ces dernières sont méticuleuses, 20% des stades IA sont en fait des stades IB et 20% des stades 1 et II sont finalement des stades III (1).
IV - DIAGNOSTIC
Le diagnostic du cancer de l'ovaire est le plus souvent tardif, avec une découverte de la pathologie en stade III ou IV dans près de 75% des cas pour Chevallier B et Dessogne P (5).
IV.1 - CIRCONSTANCES DE DECOUVERTE
Pour un cancer de l'ovaire à un stade avancé (stade III ou IV) s'étendant à la cavité intra-abdominale, les circonstances de découverte sont le plus souvent (1,2,3) :
- un gonflement abdominal;
- des douleurs abdominales ou pelviennes;
- le développement d'une masse abdominale ou d'une ascite; - des irrégularités menstruelles.
Néanmoins, les circonstances de découvertes peuvent faire suite à : - un toucher pelvien systématique;
- une pollakiurie; - une perte de poids;
- une persistance ou une modification d'un kyste a priori bénin; - une découverte histologique sur pièce d'exérèse.
IV.2 - DEPISTAGE DE MASSE
Dépister une tumeur à un stade précoce est intéressant si l'efficacité de son traitement est supérieur à celui d'une tumeur à des stades plus évolués. Cette première notion se prête bien au cancer épithélial de l'ovaire.
Le dépistage d'une tumeur est alors d'autant plus intéressant que celle-ci est décelable à un stade préclinique. Or, d'une façon générale, ce n'est pas le cas des cancers de l'ovaire.
Une troisième notion est importante pour le dépistage de masse : il faut que la maladie soit suffisamment fréquente pour que le coût du dépistage ne soit pas trop important. Là encore, ce n'est pas le cas du cancer de l'ovaire.
Enfin, il faut des tests sensibles et spécifiques afin de limiter les faux négatifs et les faux positifs dans le but de réduire la morbidité et la mortalité liées aux investigations diagnostiques faisant suite à un dépistage. A l'heure actuelle, les tests de dépistage du cancer épithélial de l'ovaire existants manquent de sensibilité et de spécificité.
Donc, dans l'ensemble, les tumeurs épithéliales de l'ovaire ne se prêtent pas à un dépistage de masse.
Les Etats-Unis ont mis à l'épreuve de nombreux programmes de dépistage basés sur le dosage systématique du CA125 et sur des échographies transvaginales. La population intéressée par un tel dépistage aurait représentée 40 à 50 millions de femmes. Le coût de tels programmes aurait donc été exorbitant. De plus, chaque patiente dépistée devant subir une laparotomie en vue du diagnostic, il y aurait eu un nombre de laparotomies inutiles très important du fait du manque de spécificité des tests. Or ce geste non anodin aurait entraîné une morbidité et une mortalité accrue (3).
C'est pourquoi ces programmes de dépistages se sont révélés insatisfaisants.
Deux études de Chaudhuri et coll. (7,8) sur l'anticorps monoclonal humain, TC5, ont
été récemment publiées. Cet anticorps de 150 kilodaltons est produit par la méthode d'hybridomes humain-humain d'Olsson et Kaplan et est classé dans les immunoglobulines IgG1. La première étude montre la haute spécificité de TC5 vis à vis des antigènes de surface des cellules tumorales ovariennes puisque l'anticorps ne réagit pas avec les cellules ovariennes normales ni avec les cellules tumorales
d'autres organes (à l'exception du sein). La deuxième étude consiste à améliorer la sensibilité d'un tel anticorps ce qui est réalisé par la protection des sites de liaison antigéniques de l'anticorps TC5 (par chromatographie d'affinité au Sépharose 4B) au cours de son radiomarquage à l'or 198. Ainsi, l'anticorps monoclonal humain TC5, après un tel traitement pourrait servir au dépistage ou au diagnostic in vitro de cancers ovariens.
Néanmoins, malgré ces progrès, la fréquence des tumeurs ovariennes reste trop faible pour justifier un dépistage systématique (problème de coût).
IV.3 - MOYENS DE DIAGNOSTIC
- L'examen gynécologique fait appel à un toucher bimanuel (1).
- L'échographie abdomino-pelvienne constitue l'examen de première intention pour dépister des cancers de l'ovaire du fait de son absence d'agressivité, de son coût faible et de sa reproductibilité. Elle permet de détecter des masses solides, des lésions bilatérales, l'envahissement d'autres organes et la présence d'une ascite (1,2,3).
- La cœlioscopie et surtout la laparotomie avec lavages péritonéaux permettent un diagnostic histologique et complet. La laparotomie est donc le geste diagnostic essentiel (1,3).
- Le scanner abdomino-pelvien et l 'IRM (Imagerie par Résonance Magnétique) peuvent être utiles pour les bilans d'extension de la tumeur mais n'ont pas d'indication systématique (1).
- Les examens cytologiques au mveau du liquide d'ascite ou des masses tumorales mettent en évidence la présence de cellules tumorales (2).
- Une radiographie pulmonaire peut être utile pour mettre en évidence des métastases (5).
- Le dosage senques des marqueurs tumoraux n'a pas une grande valeur diagnostique mais permet de juger de l'efficacité d'un traitement. Lors de la chimiothérapie (lère cure), il peut se produire une lyse tumorale massive responsable
de la libération des marqueurs dans la circulation sangume pouvant donner l'impression transitoire d'échec de la thérapeutique.
Le suivi des marqueurs tumoraux en post-thérapeutique peut servir à détecter précocement une récidive ou une évolution métastatique. Afin d'optimiser la surveillance, il est recommandé d'effectuer les dosages toujours dans le même laboratoire avec la même technique (pour une patiente donnée). La fréquence des dosages est fonction du traitement. Les différents marqueurs pronostiques qui peuvent être utilisés dans le suivi du cancer de l'ovaire, selon son histologie, sont l'ACE, l'AFP, l'HCG et essentiellement le CA125 (1,2,3,9,10).
*L'ACE
Antigène carcino-embryonnaire, il s'agit d'une glycoprotéine de poids moléculaire de 180000 Daltons avec une hétérogénéité physico-chimique.
Il augmente dans les carcinomes mucineux, le taux normal étant inférieur à 5 ng/ml. Sa demi-vie moyenne est de 10 à 15 jours.
La sensibilité varie selon le stade et la différenciation de la tumeur (10%-80% ). Sa spécificité est d'environ 50%-55%. Ainsi, le tabagisme, les pathologies bénignes digestives (cirrhoses, hépatites, colites, gastrites, polypes et pancréatites) et pulmonaires (broncho-pneumopathies chroniques) et l'insuffisance rénale chronique évoluée peuvent être responsables de faux-positifs (l,2,10).
*L'AFP
Alpha-fœto-protéine, il s'agit d'une glycoprotéine de poids moléculaire de 70000 Daltons existant normalement dans le sérum f œtale, et disparaissant dans les semaines qui suivent la naissance.
Sa demi-vie moyenne est de 5 à 8 jours.
Son taux s'accroît dans les tumeurs germinales, sa normale étant de moins de 10 ng/ml. Sa sensibilité est de 30 à 90% selon le stade du cancer et sa spécificité est entachée de faux-positifs dus à des grossesses multiples, à des hépatites et des cirrhoses (1,2,10).
*L'HCG ou BHCG
Hormone chorionique gonadotrope, il s'agit d'une glycoprotéine de poids moléculaire de 39000 Daltons synthétisée par le syncytiotrophoblaste.
Sa demi-vie moyenne est de 1 jour.
Son taux normal est inférieur à 0,1 ng/ml et s'accroît dans les tumeurs germinales. Il a une très bonne sensibilité de plus de 80-90%. Il existe des faux-positifs en cas de grossesse, de cirrhose mais sa spécificité est excellente (1,2,10).
*Le CA 125
C'est le marqueur le plus intéressant dans la surveillance du cancer de l'ovaire d'histologie séreuse. Il peut servir au pronostic. C'est un cancer antigène-groupe de molécules que l'on retrouve à des taux accrus dans 75 à 80% des tumeurs non mucineuses (10).
Son dosage peut s'effectuer par deux techniques, l'une utilisant des anticorps monoclonaux de souris OC 125 radiomarqués à l'indium-111, l'autre des anticorps monoclonaux de souris B43.13 radiomarqués au technetium-99m, chacun des anticorps reconnaissant un épi tope différent de l'antigène CA 125 (11).
La demi-vie moyenne du CA 125 est de 5 jours. Son taux normal est inférieur à 35 UI/ml et le seuil d'alarme se situe à 100 UI/ml (ou plus s'il existe des épanchements). Sa sensibilité est très bonne (80 à 90%) mais sa spécificité est faible. Cependant, dans le cas particulier des masses pelviennes découvertes après la ménopause, le CA 125 peut être un bon élément diagnostique avec 97% de sensibilité et 78% de spécificité lorsque son taux dépasse 65 UI/ml. En effet, avant la ménopause, la grossesse, les endométrioses, les fibromes utérins et les maladies inflammatoires du pelvis sont sources de nombreux faux-positifs. Toutefois, le taux de CA 125 peut aussi s'élever de manière non spécifique, avant ou après la ménopause, au cours de pathologies hépatiques (cirrhose, hépatite), de pathologies des séreuses (épanchements pleuraux, péritonéaux, ascite, pancréatite et péricardite), d'insuffisances rénales et de maladies auto-immunes (2,3,10).
De plus, l'utilisation chez l'être humain d'anticorps monoclonaux de souris provoque, comme tout élément étranger, la production d'anticorps souris humain anti-idiotypiques, responsables eux aussi de faux positifs (11).
V - FACTEURS PRONOSTIQUES (FP)
V.1 - FP AU MOMENT DU DIAGNOSTIC
Le pronostic des cancers ovariens est fonction des facteurs suivants : - le stade de la tumeur (classification FIGO) et l'extension tumorale; - l'existence de reliquats ovariens après laparotomie initiale;
- la taille des reliquats ovariens;
- le type histologique (border line ou malignité franche); - le grade histologique (1).
Les facteurs suivants pourraient aussi influencer le pronostic : - l'âge des patientes au moment du diagnostic;
- le taux de CA 125; - la ploïdie tumorale;
- l'amplification du gène HER-2/Neu;
- l'expression de p21WAF1/cipl.
Le développement des facteurs pronostiques est le résultat des récentes technologies tels que l'analyse par cytométrie de flux, le développement d'anticorps monoclonaux, les techniques immunocytochimiques et l'analyse des récepteurs d'hormones stéroïdiennes (3).
V.1.1 - Stade tumoral
La classification FIGO est la plus utilisée. Le stade tumoral est défini lors de la laparotomie initiale. Les investigations ultérieures, entre autre une laparotomie de "second look", mettent en évidence un changement de stade dans 33% des cas (dont 41 % de tumeurs ovariennes initialement au stade II sont reclassées en stade III) (9).
Le degré d'extension de la tumeur est le facteur pronostique dominant. En effet, la survie des patientes est étroitement liée au stade de la tumeur ovarienne. Ainsi, la survie à 5 ans est de 60 à 90% pour le stade I, 40 à 60% pour le stade II, 10 à 15%
pour le stade III et inférieure à 5% pour le stade IV. Enfin, le traitement est basé sur le stade tumoral (1,3,9).
V.1.2 - Reliquats ovariens
C'est aussi un facteur pronostique important. Plus les reliquats ovanens après chirurgie initiale sont volumineux, plus la survie des patientes est mauvaise. Ainsi, après laparotomie initiale, les patientes présentant un résidu tumoral inférieur à 2 cm ont un meilleur pronostic que celles avec un résidu tumoral supérieur à 2 cm avec des taux de survie à 5 ans de 45% dans le premier cas et de 5% à 20% dans le deuxième. De plus, la présence ou non de reliquats ovariens va influencer la réponse à la chimiothérapie et la qualité de vie des patientes (1,9).
V.1.3 - Le type histologique
Le pronostic varie selon que la tumeur est border line ou de malignité franche; en effet, les taux de survie à 5 ans varient respectivement de 80 à 95% et de 50 à 65%
(1,9).
V.1.4 - Le grade histologique
Beaucoup d'études montrent que ce facteur pronostique à une valeur prédictive importante pour la survie, le risque de rechute et le potentiel métastatique des tumeurs ovariennes. Cependant, d'autres études indiquent que l'évaluation du grade histologique varie de façon importante chez un même observateur et/ou entre différents observateurs. Pour remédier à cet inconvénient, il faudrait disposer de méthodes plus objectives et plus reproductibles.
Ainsi, le grade histologique n'a de valeur pronostique que dans les stades précoces, son influence disparaît dans les stades avancés. Dans les stades IA à IB, les taux de survie à 5 ans varient de 100% à 60% selon que la tumeur est bien ou peu différenciée (1,9).
V.1.5 - L'âge des patientes
La découverte d'un cancer de l'ovaire est rare avant 20 ans et le pronostic chez les femmes jeunes est généralement bon. Par contre, l'âge moyen de diagnostic est de 53 ans et la possibilité de déceler une tumeur ovarienne augmente avec l'âge. De plus, le pronostic est plus mauvais chez les patientes plus âgées. Toutefois, il faudrait savoir si le meilleur pronostic chez la jeune femme est lié à des différences dans la tumeur (stade précoce, meilleure histologie, peu à pas de reliquats ovariens) ou à la possibilité d'administrer des thérapeutiques plus agressives (3,9).
V.1.7 - Le CA 125
Certains auteurs (9) ont montré récemment que le CA 125 pourrait être utilisé comme
facteur pronostique de la survie des patientes présentant un cancer ovarien. Dans cette étude, la probabilité pour que la maladie progresse est de 89% chez les patientes dont le taux de CA 125 diminue de moins de sept fois sa valeur entre le début et la fin de la chimiothérapie, alors qu'elle n'est que de 29% chez les patientes dont le taux diminue de plus de sept fois.
Ceci devra être confirmé par d'autres auteurs.
V.1.7 - La ploïdie tumorale
Par cytométrie de flux, il est montré que les tumeurs aux stades précoces (I, II) sont généralement diploïdes, alors que les tumeurs à un stade avancé (III, IV) sont plutôt aneuploïdes (73% d'aneuploïdie contre 27% de diploïdie). De plus, les patientes, dont la tumeur est diploïde, ont une survie plus longue (survie médiane de 60 mois contre 12,5 mois pour les patientes ayant une tumeur aneuploïde). Ainsi, la ploïdie tumorale serait le facteur prédictif de la survie le plus puissant.
Il reste, cependant, à effectuer d'autres études afin d'évaluer la relation entre la ploïdie tumorale et la réponse aux traitements chimiothérapiques (9).
V.1.8 - L'amplification de l'oncogène HER-2/Neu
L'HER-2/Neu (appelé aussi c-erbB-2) est un proto-oncogène localisé chez l'être humain sur le chromosome 17q. Il code pour une glycoprotéine transmembranaire de
185 kiloDaltons (= oncogène HER2/Neu) au niveau des cellules de smface. Cet
oncogène possède un domaine de liaison extracellulaire et une activité tyrosine kinase intracellulaire. Il présente une homologie avec le récepteur du facteur de croissance épidermique. En 1989, Slalom et coll. montrent que l'oncogène est surexprimé dans environ un quart des tumeurs ovariennes. Ils montrent aussi qu'il existe une relation statistiquement significative (p<0,0001) entre l'amplification du gène et la survie des patientes (plus le gène est amplifié, moins la survie est bonne)
(12).
Cependant, si certains auteurs trouvent que l'amplification de l'oncogène est d'un très mauvais pronostic dans les cancers ovariens, d'autres ne l'ont pas confirmé. Ainsi, deux études de Rubin et coll. (12) ne mettent pas en évidence une puissante
signification pronostique de la surexpression de l'HER2/Neu que ce soit dans les
stades précoces ou avancés des tumeurs ovariennes.
Une autre étude menée par Singleton et coll. (13) ne montre pas de corrélation entre
l'activation du proto-oncogène et le type histologique, le grade histologique, le stade FIGO ou le pronostique.
Cet oncogène demeure, toutefois très étudié. V.1.9 - L'expression de la protéine p21WAF1/cipl
Cet oncogène est un inhibiteur des kinases cycline-dépendantes et régule négativement la prolifération cellulaire. Des études évaluent l'expression de cet oncogène au niveau ARNm (ARN messager) et protéine dans des lignées de cellules tumorales ovariennes et des biopsies de carcinomes ovariens. L'expression de p21 WAFllcipl est très hétérogène que ce soit au niveau des lignées ou des biopsies. Toutefois, il existe une bonne corrélation entre le taux d'ARNm et le taux de p21 WAFl/cipl. En revanche, aucune relation entre prolifération cellulaire et expression de cet oncogène n'est mise en évidence dans les cellules tumorales ovariennes suggérant que si ces cellules continuent de produire du p21WAF1/cipl, ce dernier n'est plus fonctionnel (14). D'autres études devront confirmer ces résultats.
V.2 - FP LORS DE LA REMISSION COMPLETE HISTOLOGIQUE
Une analyse des facteurs pronostiques des cancers de l'ovaire, définis en rémission histologiquement complète après laparotomie de second regard, est effectuée sur 83
patientes. Toutes ont subi une exérèse optimale, smv1e de six cycles de chimiothérapie avec cisplatine ou carboplatine associé au cyclophosphamide avec ou sans doxorubicine et d'une chimiothérapie de consolidation. La majorité des patientes sont en stade III. D'une part, cette analyse montre que la survie sans rechute à 2 ans, le stade tumoral, le grade histologique et le type anatomo-pathologique ne sont pas des facteurs pronostiques significatifs. D'autre part, cette analyse met en évidence la valeur pronostique de l'âge, de la taille du résidu tumoral et de la durée de normalisation du CA 125 (avec p < 0,05). Ainsi des patientes ayant plus de 55 ans, avec des reliquats tumoraux de plus de 2 cm et une durée de normalisation du CA 125 de plus de 8 semaines ont un pronostic plus sombre (15).
VI - CONCLUSION
Le taux de mortalité du cancer de l'ovaire est tel qu'il serait important de développer la prévention, la détection et les stratégies thérapeutiques. Pour cela, la connaissance des mécanismes biologiques du cancer ovarien est primordiale. C'est pourquoi de nombreux investigateurs s'y attachent. Suite à certains travaux sur les cellules ovariennes tumorales, beaucoup de phénomènes ont été observés.
La cytométrie de flux a mis en évidence une fraction élevée de cellules tumorales en phase S, une aneuploïdie fréquente dans les stades avancés et une synthèse d'ADN avec une périodicité circadienne décalée vis à vis de celle des cellules ovariennes normales. Ce dernier fait peut être intéressant pour le développement de la chrono-chimiothérapie.
Les études cytogénétiques montrent des cellules ovariennes tumorales à caryotypes aneuploïdes complexes avec des anomalies qualitatives et quantitatives. Le chromosome 1 est le plus souvent touché mais ce défaut apparaît dans beaucoup d'autres cellules tumorales. De façon un peu plus spécifique (même si retrouvées dans d'autres tumeurs) et reproductible des délétions sur le bras court du chromosome 3 et sur le bras long du chromosome 6 sont observées. Une autre technique a permis la mise en évidence de délétions supplémentaires sur le bras court des chromosomes 11 et 17. L'hypothèse a alors été faite que ces pertes pourraient représentées une délétion des gènes suppresseurs de tumeurs.
Les oncogènes sont eux aussi très étudiés. A l'heure actuelle, plus de 50 sont identifiés. Parmi eux, les oncogènes c-myc, H-ras, K-ras et neu montrent une certaine
corrélation avec les cancers ovariens. Cependant seul l'oncogène neu semblerait lié au pronostic.
Enfin, des facteurs de croissance épidermique et/ou leurs récepteurs ainsi que les hormones stéroïdiennes sembleraient impliqués dans la prolifération des cellules tumorales par effets autocrines.
Toutefois, ces observations sont toutes à valider et le manque de modèles in vitro ou animaux bien définis limitent les recherches et rend les événements conduisant à la transformation maligne et à la prolifération encore inconnus (11).
PARTIE II
TRAITEMENTS DU CANCER
DE L'OVAIRE
I - CHIRURGIES
1.1- CHIRURGIE INITIALE
A priori, les résultats de la chirurgie initiale sont importants pour déterminer le pronostic définitif. En tous cas, la chirurgie est indispensable pour déterminer le degré d'extension du cancer ovarien et donc en établir le diagnostic anatomo-pathologique le plus complet possible.
Plusieurs études rétrospectives ont été effectuées afin de déterminer l'intérêt de la chirurgie d'exérèse initiale dans le pronostic à long-terme de patientes atteintes d'un cancer aux stades avancés. Les résultats de ces études sont contradictoires, les unes concluant à une durée moyenne de survie peu à pas augmentée, les autres concluant que la chirurgie initiale influence la durée de survie. Dans le doute, la chirurgie d'exérèse initiale reste un geste standard dans le traitement du cancer de l'ovaire d'autant qu'elle permet d'améliorer le confort de la patiente et sa qualité de vie (3,16).
Une voie d'abord xypho-pubienne permet une exploration complète de toute la cavité péritonéo-pelvienne codifiée et méthodique. Dans ces conditions, le diagnostic des cancers de l'ovaire a moins de risques d'être sous-estimé, et le stade d'extension pelvienne est diagnostiqué dans 30% des cas, l'atteinte de l'épiploon dans 22% à
33% des cas, du corps utérin dans 15% des cas et des coupoles diaphragmatiques dans 3,7% des cas. (17,18)
La chirurgie d'exérèse initiale peut être à visée curative ou palliative. Dans le premier cas, l'idéal est d'effectuer à la fois une hystérectomie totale, une annexectomie bilatérale et une omentectomie, puis une cytologie péritonéale et un prélèvement ganglionnaire iliaque et rétropéritonéal afin d'assurer une réduction tumorale optimale (5).
Il est possible d'élargir !'exérèse s'il existe une atteinte viscérale. Dans le deuxième cas, le geste chirurgical est incomplet (il s'agira alors d'une simple réduction tumorale) voire impossible et peut n'aboutir qu'à une biopsie à but diagnostique. Ces cas se présentent lorsque les lésions tumorales ne peuvent pas être atteintes par la chirurgie classique. L'intérêt d'une telle chirurgie est alors le confort de la patiente et ne doit donc pas être trop délabrante (5,17).
La chirurgie initiale doit être la plus complète possible afin de limiter au maximum les risques de rechute. Une analyse rétrospective sur des cancers ovariens de stades I illustre parfaitement cette notion puisqu'elle indique une différence significative
(p < 0,01) entre le taux de récidives des patientes ayant eu uniquement une exploration pelvienne (47%) et celles ayant eu une exploration complète (18%). Cette analyse montre aussi une différence significative (p = 0,04) entre le taux de récidive des patientes ayant subi une hystérectomie totale associée à une annexectomie bilatérale et une omentectomie (27%) et celles ayant subi une laparotomie incomplète
(19).
Globalement, un tiers des patientes bénéficie d'une exérèse carcinologiquement complète. Chez les deux autres tiers, il persiste des résidus tumoraux qui, selon leur diamètre (moins de 2 cm ou plus de 2 cm), influencent la survie des patientes et seront soumis à la chimiothérapie puis à une nouvelle exérèse (s'ils n'ont pas disparu) au cours de la laparotomie de second regard (17).
1.2 - CHIRURGIE DE SECOND REGARD
L'intervention de second regard a été introduite par Wagenstein. Elle est généralement effectuée par voie xypho-pubienne après 12 à 18 mois de monochimiothérapie ou après 6 mois de polychimiothérapie (schéma majoritaire à l'heure actuelle). Cette chirurgie permet d'évaluer l'efficacité de la chimiothérapie sachant que, chez 50% des patientes considérées en rémission complète clinique et biologique, un reliquat tumoral est découvert. Les reliquats tumoraux peuvent être réséqués lors de cette deuxième intervention. Les décisions thérapeutiques ultérieures peuvent dépendre de la chirurgie de second regard (17,18).
La rémission complète histologique peut être observée chez 80 à 90% des patientes lorsque !'exérèse initiale est complète, chez 50% des patientes ayant eu un reliquat tumoral initial de moins de 2 cm de diamètre, et chez 25% des patientes ayant eu une exérèse initiale partielle ou nulle (17).
Toutefois, l'intérêt thérapeutique et la valeur pronostique de la laparotomie de second regard sont très discutés et difficilement quantifiables. En effet, 30 à 50% des patientes avec une laparotomie de second regard négative rechutent. De plus, il n'a pas été prouvé que cette deuxième intervention améliore la durée de survie ou prolonge l'intervalle libre sans récidive (16,17,18). Selon certains auteurs, cette
I.3 - CHIRURGIE DES RECIDIVES
Elle paraît aussi importante que la chirurgie initiale et est réalisée dans les mêmes conditions. Au diamètre de la tumeur résiduelle (+/- 2 cm) s'ajoute comme valeur pronostique l'intervalle libre sans rechute, inférieur ou supérieur à 12 mois (17).
II - CHIMIOTHERAPIES
La chimiothérapie tient, de façon générale, une place essentielle dans le traitement des cancers de l'ovaire.
11.1 - LES CYTOSTATIQUES UTILISES : réponses objectives et toxicités
11.1.1 - Les agents alkylants
Ce sont des produits qui agissent sur la duplication ou la transcription de l' ADN. Les produits concernés sont le melphalan, la cyclophosphamide et l 'ifosfamide; ils font tous partie de la famille des moutardes azotées :
II.1.1.1 - le melphalan
Il est habituellement utilisé par voie orale. Le taux de réponses objectives à des doses classiques en monothérapie dans ! 'adénocarcinome de l'ovaire est de 30% à 54%
(17,20). La principale toxicité du melphalan est hématologique, dose-dépendante et
atteignant son paroxysme 2 à 3 semaines après le traitement. Elle se traduit par une hypoplasie médullaire avec leucopénie réversible de grade 2 à 3, thrombopénie cumulative et plus rarement anémie hémolytique dont le délai d'apparition se situe entre le huitième et le douzième jour. Cette myélosuppression représente le facteur limitant du melphalan.
De même, l'incidence de la toxicité digestive (dose-dépendante) de grade 1 à 2 (diarrhée, vomissements, mucite et œsophagite) et de l'alopécie (grade 1 à 2) est élevée (20,21), Celle de la toxicité hépatique et gonadique est plutôt modérée.
De façon plus rare, il peut apparaître une perturbation biologique (sécrétion inappropnee d'ADH (hormone antidiurétique)), une toxicité pulmonaire (pneumopathie interstitielle, fibrose) et une réaction d'hypersensibilité après emploi en injection intraveineuse (20,21).
Il.1.1.2 - le cyclophosphamide
Le taux de réponses objectives en monothérapie atteint 49% à 62% (17). Néanmoins, il est généralement utilisé en association avec les sels de platine.
La toxicité dépend surtout des modalités d'administration; elle est dose-dépendante. A fortes doses, les toxicités limitantes sont hématologique, cardiaque et vésicale (20).
- La toxicité hématologique, sévère (grade 2 à 3) mais transitoire, se traduit par une leucopénie et une lymphopénie lorsque le cyclophosphamide est utilisé par voie orale en continu et à dose faible, par une leucopénie 7 à 14 jours après le traitement
(20,21) et une thrombopénie lors de l'utilisation discontinue, à dose conventionnelle
par voie orale ou intraveineuse. Elle peut être limitée par la prescription simultanée d'un facteur de croissance hématopoïétique. Elle est spontanément réversible en une quinzaine de jours (20).
- La toxicité cardiaque apparaît pour de fortes doses entre J1 et JlO. Elle est dose-dépendante, et associée à la dose unitaire de cyclophosphamide, en injection intraveineuse de courte durée. Par contre, elle n'apparaît pas en perfusion continue de 6 heures (20,21). Elle se caractérise par :
• des anomalies à l'électrocardiogramme,
• une élévation de la CPK plasmatique (créatine phosphokinase ),
• une péricardite (épanchement asymptomatique) spontanément régressive après un délai de 15 jours,
• un infarctus du myocarde,
• une insuffisance cardiaque aiguë (le risque est plus élevé chez les patients ayant des antécédents d'insuffisance cardiaque ou présentant une fraction d'éjection ventriculaire gauche inférieure à 50%)
- La toxicité vésicale se traduit par un risque de cancer secondaire de la vessie, des cystites parfois hémorragiques de grade 3 à 4 et, beaucoup plus rarement, par une rétention hydrosodée qui peut être prévenue par la prescription simultanée de mesna et/ou par une hyperhydratation importante.
Les autres toxicités possibles sont l'alopécie (régressive à l'arrêt du traitement), l'aménorrhée et l'azoospermie, les nausées, vomissements précoces peu intenses et transitoires et l'élévation des taux sériques d'aminotransférases (20,21).
Il.1.1.3 - l 'ifosfamide
Le taux de réponses objectives dans le traitement du cancer de l'ovaire, en monothérapie, varie de 40% à 78%, selon les études, chez les femmes non prétraitées. Il est de 18% chez les femmes prétraitées par un sel de platine (17,20,22).
Néanmoins, deux études rapportent un taux de réponses variant de 40% à 80% en monothérapie de rattrapage. Deux essais étudiant l'association de l'ifosfamide, l'un avec le cisplatine, l'autre avec le carboplatine ne démontrent pas une activité supérieure de l'association par rapport à l'utilisation des sels de platine seuls. En ce qui concerne la résistance croisée avec d'autres agents alkylants, son degré d'importance n'est toujours pas clairement déterminé (22).
La principale toxicité de l'if osfamide est vésicale avec des cystites hématuriques chez 20% à 40% des patients après administration brève de 2 g/m2 à 3 g/m2 (20,21).
Cette toxicité peut être réduite par l'administration de mesna et par hyperhydratation simultanée (21).
De même, les toxicités suivantes ont une incidence élevée :
- toxicité hématologique avec des leucopénies de grade 3 (39% ), des neutropénies de grade 3 (19%) et des thrombopénies de grade 3 (5%), mais moindre qu'avec le cyclophosphamide (20). Ce sont des toxicités dose-dépendantes, atteignant
leur paroxysme 7 à 14 jours après le traitement, cependant réversibles en 7 jours et non cumulatives (21).
- toxicité neurologique de grade 3 (8%) avec confusion, somnolence, hallucinations, aphasie, syndrome extra-pyramidal et coma (20,21). Cette neurotoxicité
est souvent retrouvée chez les patientes souffrant d'une insuffisance rénale et/ou d'une hypoalbuminémie.
- alopécie (75%) partielle et réversible.
- nausées et vomissements (3% de grade 3) (20,21).
Plus rarement, on peut observer une toxicité rénale, une acidose métabolique, une hyponatrémie et une toxicité pulmonaire (pneumopathie interstitielle) (20,21), ainsi
qu'une hypersensibilité au produit (21).
11.1.2 -Les sels de platine
11.1.2.1 -le cisplatine
L'activité antitumorale du cisplatine en monothérapie des tumeurs ovanennes se traduit par un taux de réponses objectives variant de 30 à plus de 70% selon les auteurs (17,20). Il s'agit d'une activité effet-dose. Le cisplatine, utilisé en association
avec d'autres cytostatiques fait partie du traitement de première intention du cancer de l'ovaire (20).
Outre la toxicité hématologique qui est modérée et induite à des doses de 120 mg/m2 à 200 mg/m2, les toxicités du cisplatine sont plus sévères au niveau rénal, neurologique, auditif et digestif (20,21).
- Néphrotoxicité
*L'insuffisance rénale aiguë survient par nécrose tubulaire dans 25% à
75% des cas en dehors de toute prévention (20,21). Elle est fonction de la
concentration du platine dans l 'ultrafiltrat glomérulaire. Elle est en rapport avec la valeur du pic plasmatique du platine et sa durée (20). Elle est d'une manière générale
dose-dépendante que ce soit dose par cure ou dose totale cumulée (21). Elle est, de
plus, aggravée par l'hypovolémie et la mauvaise hydratation. Toutefois, l'insuffisance rénale n'est qu'exceptionnellement définitive (21). Elle peut être prévenue par une
bonne hydratation parentérale et orale (100 ml/h de glucose 5% additionnés de 6 g/l de chlorure de sodium), par la perfusion de mannitol (qui cependant n'a pas fait la preuve de sa supériorité par rapport au glucose 5%) et de furosémide si besoin, par fractionnement de la dose de cisplatine (20,21).
Lorsque le cisplatine est administré par voie intrapéritonéale ou intrapleurale, l'insuffisance rénale peut être prévenue par l'administration par voie périphérique de thiosulfate de sodium. Cet agent, qui ne passe pas dans le secteur péritonéal mais
semblerait se concentrer dans le tubule rénal, forme un complexe inactif avec le cisplatine, n'influence pas sa demi-vie et ne diminue pas l'efficacité antitumorale du cisplatine (17). Enfin, la coprescription d'autres produits néphrotoxiques est à éviter
(20,21).
*L'altération rénale chronique, avec diminution de 30% à 60% de la clairance de la créatinine, est fortement liée à la toxicité aiguë de chaque cycle.
*Il peut apparaître aussi une hyponatrémie de dilution, une hypomagnésémie induisant une hypocalcémie et une hypokaliémie. Ces perturbations sont prévenues par l'apport d'électrolytes et une supplémentation systématique en magnésium (20).
- N eurotoxicité
Elle est très fréquente après plusieurs cures et peut se traduire par une neuropathie périphérique, une paresthésie ou une névrite optique et rétrobulbaire uni- ou bilatérale. C'est une toxicité dose-limitante, cumulative, souvent de grade 2 et plus ou moins réversible (20,21).
- Ototoxicité
La toxicité auditive est plus fréquente chez les patients âgés ayant déjà une diminution de la fonction auditive. Elle est en rapport avec le pic plasmatique de cisplatine. Elle se traduit par une atteinte neuronale au niveau de l'organe de Corti, par des anomalies de l'audiogramme dans 24% des cas et une surdité dans 6% à 10% des cas (20). Il s'agit d'une toxicité cumulative, généralement de grade 2 à 3 et
irréversible (21).
Ainsi, la coprescription de médicaments potentiellement ototoxiques est à éviter.
- Toxicité digestive
Il s'agit d'une toxicité dose-dépendante. Les nausées et vomissements de grade 3 sont très fréquents (95%) et sévères; ils sont généralement immédiats bien que parfois tardifs (20,21). Ils peuvent être prévenus par des hautes doses de métoclopramide ou
surtout par des antisérotoninergiques ( ondansétron, granisétron, tropisétron) avec ou sans corticoïdes (20).
- Toxicité hématologique
Elle est non cumulative, à l'exception de l'anémie. Elle est réversible, de grade 1 à 2 en général et dose-dépendante. Elle atteint son maximum dans les 14 à 21 jours après le traitement (21).
L'importance de la toxicité rénale ou auditive peut entraîner l'arrêt du traitement par le cisplatine. Il est possible de le remplacer par du carboplatine, moins toxique.
11.1.2.2 - le carboplatine
L'activité antitumorale du carboplatine en monothérapie a un taux de réponse objective de 44% à 75% dans le traitement du cancer de l'ovaire (17,20). Il est
généralement employé en association avec un ou plusieurs cytostatiques ( cyclophosphamide, doxorubicine, étoposide) (20,21).
Le carboplatine est cliniquement bien toléré, mais a une toxicité hématologique dose-limitante. Cette toxicité se traduit par des neutropénies non cumulatives (grade 3 dans 9% des cas) avec nadir entre J14 et J21 et à récupération lente en 7 à 21 jours. Il s'agit surtout des thrombopénies (16% de grade 3) chrono-dépendantes, cumulatives, avec nadir entre J14 et J21 mais à récupération rapide, et des anémies (10% de grade 3)
(3,20,21,23,24,25,26,27,28).
De façon rare à modérée, il existe des nausées et vomissements, une alopécie et une neurotoxicité périphérique (20).
Plus rarement, il est possible d'observer une néphrotoxicité, une ototoxicité, un syndrome pseudo-grippal et une réaction d'hypersensibilté (érythème, fièvre et prurit) (20).
11.1.2.3 - comparaison cisplatine-carboplatine
Les nombreuses toxicités limitantes du cisplatine ont entraîné le développement d'autres dérivés du platine parmi lesquels seul le carboplatine est actuellement commercialisé. Celui-ci a fait l'objet d'essais de phase l au cours desquels il s'est
révélé dépourvu des effets toxiques du cisplatine, exceptée la toxicité hématologique limitante. Par la suite, de nombreux essais cliniques, dans lesquels le cisplatine est remplacé par du carboplatine, montrent que le carboplatine est aussi efficace que le cisplatine (équivalence du taux de réponses, de la survie globale et de la survie sans rechute) et qu'il peut remplacer le cisplatine dans tous les schémas d'association
(3,23,24,25,26,27,28). De plus, la bonne tolérance du carboplatine permet d'utiliser des
posologies plus élevées ce qui pourrait améliorer le taux de survie. Toutefois, il existe une résistance croisée entre les 2 sels de platine. Il paraît donc inutile de traiter un patient réfractaire au cisplatine par du carboplatine (16,17,22,29). La toxicité
hématologique du carboplatine fait qu'il n'est pas encore adopté par toutes les équipes bien que son utilisation semble beaucoup plus aisée que celle du cisplatine. Enfin, des études pharmacocinétiques permettent d'adapter la dose de carboplatine à
administrer en fonction des anticancéreux précédents, de la fonction rénale et de l'âge des patients (3,27).
11.1.3 -La doxorubicine ou adriamycine
La doxorubicine doit être strictement utilisée par voie intraveineuse en raison de sa forte toxicité tissulaire (20). Son activité antitumorale est modérée, avec 28% à 36%
de réponses objectives en monothérapie dans les tumeurs de l'ovaire (17,20). Elle est
généralement utilisée en association avec les sels de platine, le cyclophosphamide et l'altrétamine (schémas PAC, CHAP) dans le traitement du carcinome ovarien (20).
Les principales toxicités observées en phase immédiate sont l'alopécie, les toxicités hématologique et digestive. Il existe, de plus une toxicité retardée cumulative cardiaque.
- Hématotoxicité
Elle est fréquente, dose-dépendante, non cumulative et touche essentiellement la lignée granulocytaire avec un maximum 10 à 14 jours après le traitement et est réversible en 7 jours. Elle peut atteindre des grades 2 à 3.
- Toxicité digestive
Elle est aussi fréquente et elle se traduit par des nausées, vomissements, diarrhées et des mucites qui dépendent de la dose et du fractionnement de l'administration.
- Alopécie
Elle est complète chez 60% des patients traités à des doses dépassant 50 mg/m2.
- Cardiotoxicité
En phase aiguë, 48 heures après l'injection de doxorubicine, elle se traduit par des arythmies d'évolution favorable et des myocardiopathies particulièrement rares mais fatales. La cardiotoxicité aiguë est indépendante de la dose, du mode d'administration et de l'état du malade.
En phase chronique, quelques jours à plusieurs mois après la dernière injection de doxorubicine, la cardiotoxicité peut entraîner une défaillance cardiaque congestive irréversible, corrélée à la dose totale administrée et cumulative entre les différentes anthracyclines. Ainsi, il est important d'éviter de dépasser une dose cumulée de 550 mg/m2 (20,21).
Il existe des facteurs de risques aggravant la cardiotoxicité tels que les âges extrêmes de la vie, les antécédents cardio-vasculaires, ou l'association à d'autres médicaments cardiotoxiques (21).
11.1.4 - L'altrétamine ou hexaméthylmélamine
Elle est souvent classée comme alkylant et est uniquement administrée en discontinu par voie orale. Depuis une trentaine d'années, de nombreux essais thérapeutiques montrent l'efficacité thérapeutique de l'altrétamine, qu'elle soit utilisée seule ou en association, chez les patientes non prétraitées ainsi que chez les patientes souffrant d'un cancer ovarien résistant aux agents alkylants. Il semblerait que l'altrétamine n'ait pas de résistance croisée avec les agents alkylants habituellement utilisés. Son activité antitumorale, en monothérapie, dans l'adénocarcinome de l'ovaire (principale indication de l'altrétamine) est de 41 % de réponses objectives chez les femmes non prétraitées (stades III et IV) et de 15% à 30% de réponses objectives chez les femmes
prétraitées. L'altrétamine est généralement utilisée en association soit selon un schéma Hexa-CAF (cyclophosphamide, méthotrexate, fluoro-uracile), soit selon un schéma CHAP (cyclophosphamide, doxorubicine, cisplatine). Les résultats de trois essais cliniques mettent en évidence une survie à long terme importante lorsque l'altrétamine est utilisée en association avec le cisplatine, la doxorubicine et le cyclophosphamide chez des patientes ayant un faible résidu tumoral. Deux autres études rapportent un taux de réponses de 20% de l'altrétamine en chimiothérapie de rattrapage après échec d'un traitement à base de sels de platine (22).
L'altrétamine présente une incidence élevée de toxicités hématologique et digestive, dose-limitantes, et neurologique.
- Hématotoxicité
Il s'agit de myélosuppression observée surtout après de hautes doses et un traitement continu. Elle est réversible et non cumulative (20,21).
- Toxicité digestive
50% à 70% des patientes ont des nausées, vomissements atteignant le grade 3 dans 27% des cas après une dose de 8 mg/kg (20).
- Neurotoxicité
Elle se traduit par des troubles du sommeil, des hallucinations, une irritabilité et des neuropathies périphériques réversibles qui apparaissent surtout lors d'une administration prolongée (20,21).
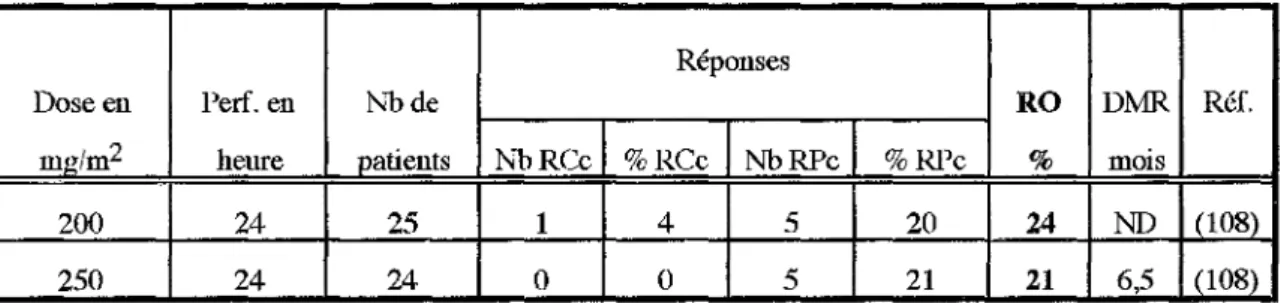
11.1.5 - Le paclitaxel
11.1.6 -Antinéoplasiques divers
Les produits suivants ont une activité modérée, surtout en terme de réponse complète, dans le traitement du cancer de l'ovaire et sont rarement utilisés en première intention.
II.1.6.1 - le fluoro-uracile (5 FU)
Le taux de réponses objectives du 5 FU en monothérapie s'élève à 32% de réponses objectives dans les tumeurs del 'ovaire (20).
L'incidence de la toxicité digestive (diarrhée, stomatite) et hématologique (réversible et non cumulative) est élevée. Celle de la toxicité cardiaque (manifestation coronarienne) et de l'alopécie est modérée. Rarement, il peut apparaître une ataxie cérébelleuse ou une conjonctivite, blépharite et lagophtalmie (20,21).
II.1.6.2 - le méthotrexate
Ce produit a une activité antitumorale moyenne dans l'adénocarcinome ovarien avec 15 à 25% de réponses objectives en monothérapie (20).
Les principales toxicités suivantes sont limitantes :
- hématologique, avec hypoplasie médullaire 5 à 15 jours après une dose unique, réversible et non cumulative;
- digestive, avec stomatite et diarrhées de grade 2 à 3; - hépatique, avec cytolyse mais sans conséquence clinique. Les toxicités suivantes ont une incidence moyenne:
- nausées, vomissements liés à la dose et généralement modérés; - alopécie après de fortes doses, généralement partielle et réversible;
- pulmonaire avec un syndrome restrictif et une granulomatose aiguë extensive, d'évolution habituellement favorable sous corticothérapie, rarement vers la fibrose. Cette toxicité impose l'arrêt du traitement.
Plus rarement, il est possible observer:
- une toxicité hépatique avec fibrose ou cirrhose à de faibles doses quotidiennes et prolongées;
- une toxicité rénale entraînant une diminution de l'excrétion du méthotrexate ce qui induit des complications pouvant être mortelles;
- une toxicité neurologique avec aphasie, parésie et crises comitiales ainsi que des leuco-encéphalites chroniques multifocales (20,21).
II.1.6.3 - les épipodophyllotoxines *le téniposide
La toxicité limitante est la myélosuppression qui se caractérise par une leucopénie et une thrombopénie dose-dépendantes, non cumulatives survenant entre 15 et 115 et réversibles en 1 à 2 semaines (20,21).
L'alopécie est constante en cas d'administration prolongée.
Environ 2 à 11 % des patients développent une hypersensibilité de type I (20).
Les nausées et vomissements sont modérés (20,21).
*I' étoposide
L'activité antitumorale, en monothérapie, del 'étoposide dans la tumeur germinale de l'ovaire s'élève à 25-35% et à 10-21 % dans l'adénocarcinome de l'ovaire chez les femmes prétraitées (20).
La toxicité hématologique est dose-limitante, dose-dépendante, non cumulative. Elle se manifeste surtout par des leucopénies et des thrombopénies survenant dans les 10 à 15 jours suivant le traitement intraveineux et est réversible en 1 à 2 semaines. Dans 3 à 17% des cas, elles atteignent le grade 3.
L'alopécie est constante dès que l'administration est prolongée, mais réversible.
La toxicité digestive est modérée. Elle se traduit dans 30 à 40% des cas par des nausées et vomissements, mais aussi par des diarrhées et stomatites.
Exceptionnellement, il peut apparaître une hypotension vasculaire, un choc anaphylactique (vraisemblablement dû à l'excipient Crémophor EL), une neuropathie