UNIVERSITE DE LILLE
ECOLE DOCTORALE BIOLOGIE - SANTE
Mémoire de Candidature au diplôme d’Habilitation à Diriger les Recherches
Soutenu le 24 Septembre 2019CARACTERISATION IMMUNOPHENOTYPIQUE
DE LA POLYPOSE NASO-SINUSIENNE
IMPLICATIONS DIAGNOSTIQUES ET THERAPEUTIQUES
Geoffrey Mortuaire
LIRIC – UMR 995Faculté de Médecine – Pôle recherche, 5e étage Centre Place Verdun 59045 Lille Cedex
Jury :
Mr le Professeur Emmanuel Babin, Président du Jury
Mme le Professeur Virginie Prulière – Escabasse, Rapporteur du mémoire
Mr le Professeur Jean-Emmanuel Kahn, Rapporteur du mémoire
Mr le Professeur Dominique Chevalier, Assesseur
Mr le Professeur Christophe Vincent, Assesseur
Mr le Professeur Jean-François Papon, Assesseur
Mr le Professeur Cyril Page, Assesseur
Garant Recherche :
Remerciements
A Mme le Professeur Virginie Prulière - Escabasse Professeur des Universités – Praticien Hospitalier,
Consultation d’ORL et de chirurgie cervico-faciale, Centre Hospitalier Intercommunal de Créteil. Je te remercie d’avoir accepté de juger mon travail. J’apprécie beaucoup nos échanges francs et directs en toute occasion. Je serai toujours ravi de collaborer avec toi sur de futurs projets en rhinologie.
A Mr le Professeur Dominique Chevalier, Professeur des Universités – Praticien Hospitalier, Service d’ORL et de chirurgie cervico-faciale, CHU Lille.
Vous me faîtes l’honneur de participer à mon jury. Je sais pouvoir compter sur vous en toute circonstance. Une nouvelle étape se franchit à vos côtés. D’autres épreuves se profileront pour le service. Je serai là pour vous aider à les surmonter.
A Mr le Professeur Christophe Vincent, Professeur des Universités – Praticien Hospitalier, Service d’Otoneurologie, CHU Lille.
Tu me fais l’honneur d’accepter de juger ce travail. Je te remercie pour tes conseils toujours très avisés. Tu peux compter sur moi pour mener à bien nos projets communs sur le plan universitaire et clinique.
A Mr le Professeur Emmanuel Babin,
Professeur des Universités – Praticien Hospitalier, Service d’ORL et de chirurgie cervico-faciale, CHU Caen.
Je te remercie de participer à mon jury et d’avoir analysé en détails mon travail de recherche. Je serai toujours très honoré de pouvoir participer avec toi à de nouveaux projets de formation pour les internes de notre inter-région.
A Mr le Professeur Jean-François Papon, Professeur des Universités – Praticien Hospitalier,
Service d’ORL et de chirurgie cervico-faciale, Hôpital Universitaire Bicêtre, Paris Sud.
Merci pour tes précieux conseils tout au long de mon cursus scientifique. Partager avec toi est toujours un réel plaisir. J’espère pouvoir toujours m’enrichir des projets de recherche que nous pourrons développer avec Virginie, Emilie, André et toi.
A Mr le Professeur Jean-Emmanuel Kahn, Professeur des Universités – Praticien Hospitalier,
Service de Médecine Interne. Hôpital Universitaire Ambroise Paré, Paris Ouest.
Je te remercie vivement d’avoir accepté d’évaluer mon travail. Cette thématique représente notre intérêt commun en recherche. Guillaume et toi pouvez compter sur moi pour continuer à porter les projets sur les éosinophiles et à partager ce que la rhinologie peut apporter à votre expertise.
A Mr le Professeur Cyril Page,
Professeur des Universités – Praticien Hospitalier,
Service d’ORL et de chirurgie cervico-faciale, CHU Amiens.
Merci infiniment Cyril de pouvoir participer à mon jury. Je sais reconnaître en toi un collaborateur et ami de premier ordre. Nous partageons beaucoup de points de vue sur la façon d’appréhender notre profession. Je serai à tes côtés pour mener la formation de nos étudiants dans notre région des Hauts de France.
Résumé en français
Avec une prévalence de 2 à 4% dans la population générale, la polypose nasosinusienne (PNS) est une entité clinique dont l’impact sur la qualité de vie est significatif. La réponse clinique à la corticothérapie locale ou générale, qui constitue à l’heure actuelle le seul traitement dont l’efficacité a été démontrée, est très variable. De nouvelles pistes thérapeutiques basées sur le blocage des voies inflammatoires pro Th2 (anti-IgE, anti- Interleukine-5, anti-Interleukine-4) sont en cours d’évaluation. Le recours à ces thérapies ciblées nécessite de bien préciser leurs indications en apportant une meilleur caractérisation endotypique des patients.
Les objectifs de recherche sont d’explorer la régulation de la réponse immunitaire liée aux éosinophiles au cours de la PNS en fonction des comorbidités qui lui sont attachées (asthme, allergie).
Les résultats des travaux prospectifs menés sur la population suivie pour une PNS réfractaire au traitement par corticoïdes permettent de souligner le lien immuno-phénotypique entre l’association à un asthme, le profil histopathologique œdémateux riche en éosinophiles et l’orientation de la réponse inflammatoire vers un profil Th2. L’asthme détermine aussi une immuno-modulation du profil d’activation des éosinophiles tissulaires régulant la réponse à l’interleukine-5. Une mise en jeu des médiateurs de la réponse immunitaire innée régulant l’activité bactéricide des macrophages, le stress oxydatif et le complément est aussi observée dans ce contexte. Les mécanismes immuno-allergiques vis-à-vis des pneumallergènes les plus fréquents (pollens de graminés, pollens d’arbres, acariens) sont pas impliqués dans ces processus de régulation de la réponse inflammatoire lié aux éosinophiles.
Les projets actuellement portés visent à préciser le profil d’activation des éosinophiles sanguins dans le contexte de la PNS associée à un asthme. Comprendre les mécanismes de régulation de cette activation et les mécanismes de domiciliation tissulaire des éosinophiles pourra aussi contribuer au choix des options thérapeutiques et de leur association.
Résumé en Anglais
Chronic rhinosinusitis with nasal polyps (so-called nasal polyposis) is a frequent disease (2 to 4% of overall population) with a significant burden on the quality of life. So far, corticosteroids are the only medical treatment with a proved efficacy on symptoms and mucosal inflammation shrinkage. New therapeutic options impeding the proTh2 inflammation pathway are on track (anti-IgE, anti-Interleukine-5, anti-interleukine-4). These targeted drugs still require further studies to clearly define their indications in nasal polyposis. A better endotyping of the inflammation response in nasal polyposis is essential.
The objectives are to explore immune regulation pathways linked to the eosinophil in nasal polyposis regarding clinical comorbidities (asthma, allergy).
The results collected from our patients followed for a nasal polyposis refractory to corticosteroids show a strong association between concomitant asthma, edematous mucosal inflammation filled with tremendous amount of eosinophils and proTh2 inflammatory markers overexpression. Down-regulation of the eosinophil response to interleukine-5 with an overexpression of innate immune response markers (macrophages activity, oxidative stress, complement activation) are observed in nasal polyps and secretions in cases of concomitant asthma. Immune response to the most prevalent aeroallergens (grass and tree pollens, house dust mite) is not directly involved in nasal polyposis inflammatory pathways related to the eosinophils.
The perspectives are to consider the analysis of eosinophil activation profile in blood which has never been done before in chronic rhinosinusitis. A further knowledge of
eosinophil activation and mucosal homing would be helpful to tailor our therapeutic options in nasal polyposis.
1
Sommaire
CURRICULUM VITAE
... 4 ETAT CIVIL ... 5 TITRES UNIVERSITAIRES ... 6 I. Cursus médical ... 6II. Cursus scientifique ... 6
FONCTIONS HOSPITALIERES ET UNIVERSITAIRES ... 6
I. Fonctions hospitalières ... 6
II. Fonctions universitaires ... 7
ACTIVITES D’INTERET GENERAL ... 7
I. Expertises nationales et internationales ... 7
II. Membres de Sociétés savantes et Associations : ... 8
ENSEIGNEMENTS ET ENCADREMENTS
... 9ENSEIGNEMENTS ... 9
I. Faculté de médecine de Lille : ... 9
II. Faculté de chirurgie dentaire : 2010- : ... 9
III. Ecole d’orthophonie : 2010- : ... 9
IV. Diplôme d’études spécialisées : ... 10
V. Développement professionnel continu : ... 10
VI. Formations paramédicales : ... 10
VII. Autres : ... 10
ENCADREMENTS D’ETUDIANTS ... 11
I. Direction de mémoires de DES d’ORL : ... 11
II. Direction de mémoires de thèse d’exercice en Médecine : ... 11
III. Encadrements de M2 : ... 12
RECHERCHE FONDAMENTALE ET CLINIQUE
... 132
RAPPELS SUR LA POLYPOSE NASOSINUSIENNE ... 15
I. Diagnostic de polypose naso-sinusienne ... 15
II. Physiopathologie de la polypose naso-sinusienne ... 18
II.A. Rôle des comorbidités ... 18
II.B. Rôle des facteurs environnementaux et des agents infectieux ... 19
II.C. Rôle de l’éosinophile ... 19
III. Les enjeux de la recherche dans la polypose naso-sinusienne : ... 22
DEFINITION DES ENDOTYPES DANS LA POLYPOSE NASO-SINUSIENNE ... 23
I. Caractérisation histo-pathologique ... 23
II. Phénotypes et endotypes ... 26
MODULATION DE LA REPONSE INFLAMMATOIRE DANS LA POLYPOSE NASO-SINUSIENNE . 30 I. Immumodulation de la réponse immunitaire acquise ... 30
II. Immunodulation de la réponse immunitaire innée ... 33
IMPACT DU PHENOTYPE SUR LE DIAGNOSTIC ET LE TRAITEMENT SYMPTOMATIQUE DE LA POLYPOSE NASO-SINUSIENNE ... 38
I. Expression clinique et paraclinique de la PNS ... 38
II. Réponse au traitement médical dans la PNS ... 40
III. Réponse au traitement chirurgical dans la PNS ... 42
RECHERCHE INSTITUTIONNELLE ET INDUSTRIELLE
... 44PROJETS DE RECHERCHE
... 46PROJET PLEIAD: “Peripheral Eosinophils phenotypes in Airway inflammatory Diseases: towards proper clustering and therapeutic targeting” ... 46
I. Description du protocole ... 46
II. Objectifs de l’étude ... 47
III. Mise en place de l’étude ... 48
IV. Bénéfices attendus de l’étude ... 48
3 PROJET SCLEROLF : « Evaluation de la prévalence des troubles olfactifs dans la sclérodermie
systémique » ... 49
I. Description du protocole ... 50
II. Objectifs de l’étude ... 50
III. Mise en place de l’étude ... 51
IV. Bénéfices attendus de l’étude ... 51
V. Encadrement d’une thèse d’exercice pour le protocole ... 51
PROJET SOPAZITHRO ... 51
I. Description du protocole ... 52
II. Objectifs de l’étude ... 52
III. Mise en place de l’étude ... 53
IV. Bénéfices attendus de l’étude ... 53
PROJET DE MISE EN PLACE D’UNE METHODE DE DETECTION DES IGE SPECIFIQUES DANS LES SECRETIONS NASALES AU COURS DE LA RHINITE ALLERGIQUE ... 53
CAPACITE A CONCEVOIR, DIRIGER, ANIMER ET COORDONNER DES
ACTIVITES DE RECHERCHE
. ... 55ETUDE ROPIPOSTOP « Impact de l’infiltration de la région du ganglion sphénopalatin par la Ropivacaïne sur les douleurs post opératoires dans le cadre de la chirurgie nasosinusienne endoscopique » ... 55
I. Rationnel de l’étude ... 55
II. Description du protocole ... 56
III. Résultats ... 57
IV. Conclusions ... 57
ETUDE EBUNEB « Efficacité du Budésonide en nébulisations manosoniques sur la cicatrisation muqueuse après traitement chirurgical de la polypose naso-sinusienne » ... 58
I. Rationnel de l’étude ... 58
II. Description du protocole ... 58
III. Objectifs de l’étude ... 59
4 ETUDE POLYSOMNO « Evaluation de l’efficacité de la chirurgie naso-sinusienne sur
l’amélioration des troubles du sommeil dans la polypose nasale en situation d’échec du
traitement médical » ... 60
I. Rationnel de l’étude ... 60
II. Description du protocole ... 60
III. Objectifs de l’étude ... 61
IV. Etat des inclusions ... 61
BIBLIOGRAPHIE.
... 62PUBLICATIONS ET COMMUNICATIONS.
... 68I. Nombre de publications par année et par catégorie : ... 68
II. Nombre de publications par année et par position : ... 68
III. Impact Factor:... 69
PUBLICATIONS ORIGINALES DANS DES REVUES INTERNATIONALES ... 69
I. Rang A ou B (lors de leur parution) : ... 69
II. Rang C à E : ... 71
PUBLICATIONS DANS DES REVUES NATIONALES ... 76
PUBLICATIONS DIDACTIQUES ET CHAPITRES D’OUVRAGE ... 76
COMMUNICATIONS EN CONGRES : ... 77
I. Congrès scientifiques nationaux :... 77
II. Congrès scientifiques internationaux : ... 81
III. Conférences sur invitation : ... 83
5
Curriculum Vitae
ETAT CIVIL
MORTUAIRE Geoffrey
Né le 21 Février 1976 à Valenciennes, Nord Nationalité française Marié, 2 enfants Coordonnées personnelles 90 rue de Besson 59274 Marquillies geoffrey.mortuaire@orange.fr Situation professionnelle
Maître de Conférences des Universités – Praticien Hospitalier
Service d’ORL et de Chirurgie Cervico-faciale - Hôpital Claude Huriez, CHU Lille Rue Michel Polonovski, 59037 Lille Cedex
geoffrey.mortuaire@chru-lille.fr
Faculté de Médecine Henri Warembourg Université de Lille
59045 Lille Cedex
geoffrey.mortuaire@univ-lille.fr
UMR 995 - LIRIC (Lille Inflammation Research International Center)
Equipe 3 « Immunity, inflammation and fibrosis in auto and alloreactivity » Université de Lille, Pôle Recherche - Hôpital Huriez
6
TITRES UNIVERSITAIRES
I. Cursus médical 2005 : DES d’ORL.
2006 : Thèse de Doctorat en Médecine (Université de Lille) « Place de la voie endonasale dans la prise en charge des papillomes inversés nasosinusiens. Stratégie thérapeutique à propos de 65 cas».
2006 : DESC de Chirurgie de la face et du cou.
II. Cursus scientifique
1996 : Certificat de Maîtrise C1 de Sciences Biologiques et Médicales, Anatomie et Organogenèse (Université de Lille 2).
1997 : Certificat de Maîtrise C2 de Sciences Biologiques et Médicales, Anatomie sérielle et Imagerie médicale (Université de Lille 2).
2003 : D.E.A. Science de la vie et de la biologie (Université de Lille 2), à l’Inserm U459 -Plate‐forme de génomique fonctionnelle « Nouvelle approche globale en protéomique : les biopuces à protéines. Techniques actuelles et applications ».
2015 : Thèse d’Université - spécialité : Physiologie, Physiopathologie, Biologie systémique médicale (Ecole Doctorale de Lille), à l’Inserm U995, EA 2686 « Modulation des mécanismes immuno-inflammatoires au cours de la polypose naso-sinusienne associée à un asthme ».
FONCTIONS HOSPITALIERES ET UNIVERSITAIRES
I. Fonctions hospitalières
2006-2010 : Chef de Clinique des Universités - Assistant des Hôpitaux, UFR de Médecine, Université de Lille. Service d’ORL et de Chirurgie Cervico-Faciale, Pr Dominique Chevalier, Hôpital Huriez, CHU Lille.
2010- : Maître de Conférence des Universités - Praticien Hospitalier en ORL, UFR de Médecine, Université de Lille. Service d’ORL et de Chirurgie Cervico-Faciale, Pr Dominique Chevalier, Hôpital Huriez, CHU Lille.
7 II. Fonctions universitaires
2010- : Coordonnateur de la garde d’ORL des étudiants hospitaliers
Responsable de l’enseignement en rhinologie à l’UFR de Médecine de Lille (MED3, MED5, MED6).
2017- : Membre du Bureau Des Examens à l’UFR de Médecine de Lille (MED5)
2016- : Membre du Comité National des Universités, sous-section ORL 55-01.
ACTIVITES D’INTERET GENERAL
I. Expertises nationales et internationales
Relectures d’articles pour des revues nationales (Annales Françaises d’ORL, Revue des Maladies Respiratoires (non indexé)) et pour des revues internationales (European Annals of Otorhinolaryngology-Head and Neck Diseases (IF=0.9), Journal of Otolaryngology and Rhinology (IF=1.07), Clinical Otorhinolaryngology (IF=2.62), The laryngoscope (IF= 2.47)).
Participation à des comités de recommandations et d’expertise scientifique :
2013 : SFORL. Recommandations pour la pratique : Vasoconstricteurs en rhinologie. 2016 : SFORL. Recommandations pour la pratique : Traitement des épistaxis (dans la
maladie de Rendu Osler, en cas de troubles de coagulation liés aux traitements anti-thrombotiques, chez l’adulte en 1ère et 2ème lignes).
2017- : Expert pour le groupe de travail ALK-Abello sur l’immunothérapie allergénique en rhinologie.
2018- : Expert pour l’attribution de la bourse de la Société Française d’ORL. 2018- : Expert pour l’attribution la bourse du Collège Français d’ORL.
8 II. Membres de Sociétés savantes et Associations :
2006- : Membre de la Société Française d’ORL. 2010- : Membre du Collège Français d’ORL.
2016- : Membre du comité d’administration de l’Association Française de Rhinologie. 2016- : Membre du Réseau Eosinophile
2018- : Membre référent ORL pour le réseau DIPANOR (Réseau multidisciplinaire de diagnostic des Déficits Immunitaires Primitifs dans le Nord-Pas de calais).
9
Enseignements et encadrements
ENSEIGNEMENTS
Score SIAPS total : 614
I. Faculté de médecine de Lille :
MED3 : - Sémiologie des affections rhino-sinusiennes (UE Appareil respiratoire) : 1h - Atelier de simulation en otoscopie (centre PRESAGE) : 3×1h30
MED4 : - Certificat optionnel EDL Maladies allergiques : 1h MED5 : - Enseignements dirigés ED1 : 4×4h
N° 85. Epistaxis
N° 86. Trouble aigu de la parole. Dysphonie N° 88. Pathologie des glandes salivaires
N° 145. Infections naso-sinusiennes de l'adulte et de l'enfant
N° 146. Angines de l'adulte et de l'enfant et rhinopharyngites de l'enfant
N° 184. Hypersensibilité et Allergies respiratoires chez l'enfant et chez l'adulte. Asthme, rhinite N° 199. Dyspnée aiguë et chronique
N° 216. Adénopathie superficielle de l'adulte et de l'enfant N° 270. Dysphagie
N° 295. Tumeurs de la cavité buccale, naso-sinusiennes et du cavum, et des voies aérodigestives supérieures.
N° 354. Détresse respiratoire aigüe du nourrisson, de l'enfant et de l'adulte - Rédaction des sujets d’examen (2 DP et 10 QI par an)
MED4/MED5 : - Enseignement intégré en stage hospitalier : 3×6h MED6 : - Réunion de synthèse du contrôle continu : 1h
- Rédaction des sujets d’examen du contrôle continu sur SIDES (QI)
II. Faculté de chirurgie dentaire : 2010- :
D5 : - Sémiologie du nez et des sinus et principales étiologies : 3h
III. Ecole d’orthophonie : 2010- :
1ère année : - Anatomie et Sémiologie du nez et des sinus (UE 2.3.3 Déglutition, phonation et articulation) : 2h
10 IV. Diplôme d’études spécialisées :
2010- : - Module de rhinologie du DES d’ORL : 3×2h
2010- : - Séances en visioconférence de l’inter-région ORL Nord-Ouest : 3×3h 2015- : - Séances bibliographiques hebdomadaires en ORL : 40h
V. Développement professionnel continu :
2008-2010 : - DU de Formation continue en médecine générale (Sinusites aigues et complications) : 2h 2008-2010 : - Capacité de Médecine d’Urgences (Epistaxis traumatiques) : 2h
2010- : - Capacité d’Allergologie (Rhinite allergique, polypose nasale, sinusites chroniques) : 3h 2010- : - DU de Traumatologie d’urgences (Epistaxis traumatiques) : 1h
VI. Formations paramédicales :
2006-2010 : - IFSI Lycée technique Valentine Labbé (Sémiologie des VADS) : 3h 2011-2012 : - Ecole d’Ostéopathie de Lille (Sémiologie naso-sinusienne) : 2h
2013-2015 : - Diplôme de délégué à l’information médicale et pharmaceutique : 2h
2015- : - DTS IMRT à Valentine Labbé (UE 2.7 Physiologie, sémiologie et pathologies vasculaires cardiaques, respiratoires, ORL) (Sémiologie radiologique des sinusites et des tumeurs
nasales) : 2h
VII. Autres :
Invitations à des séances de DPC en ORL, en Chirurgie Maxillo-faciale, en Pneumo-allergologie et en Médecine Générale lors de congrès nationaux (Société Française d’ORL, Congrès de Pneumologie de Langue Française, Congrès Francophone d'Allergologie, Journée Lilloise d’anesthésie et réanimation, Journée de la SFSCMFC), lors de réunion d’associations médicales (Formathon, Association Française de Rhinologie) ou à la demande de l’industrie (Laboratoires Medtronic, Audika, ALK-Abello, Zambon, Therabel, Les Laboratoires de la Mer).
11
ENCADREMENTS D’ETUDIANTS
I. Direction de mémoires de DES d’ORL :
2008 : Julie Giordano - « Intérêt de la corticothérapie per os avant ethmoïdectomie endonasale pour une polypose naso-sinusienne ».
2009 : Suzie Vandeville - « Evaluation de la qualité de vie des patients après ethmoïdectomie endonasale pour une polypose naso-sinusienne par le questionnaire SNOT 16 ». 2009 : Laure Guillet - « Sinusites maxillaires chroniques, écologie bactérienne ».
2011 : Baudelaire Kenne - « Sinusite frontale chronique après ethmoïdectomie endonasale pour polypose naso-sinusienne. Corrélation avec l’anatomie du canal naso-frontal ». 2011 : Claire Vandenhende - « Caractérisation immunobiologique des éosinophiles tissulaires
au cours de la polypose naso-sinusienne ».
2014 : Isabelle Gengler - « Identification des facteurs d’hyper-éosinophilie au cours de la polypose naso-sinusienne. Rôle combiné de l’interleukine-5 et de l’interleukine-9 chez les patients asthmatiques ».
2014 : Anne Sophie Thisse - « Traitement par voie endoscopique des adénocarcinomes de l’ethmoïde ».
II. Direction de mémoires de thèse d’exercice en Médecine :
2012 : Claire Szymanski - « Facteurs prédictifs de récupération de l’odorat après chirurgie endonasale pour polypose naso-sinusienne : étude prospective sur 30 patients avec le Test Olfactif Européen ».
2014 : Aurore Picry - « Caractérisation histopathologique de la polypose naso-sinusienne et corrélations clinico-histologiques ».
2016 : Isabelle Gengler - « Analyse clinique et médico-économique de la prise en charge ambulatoire en rhinologie au CHU de Lille ».
2017 : Joséphine Guislain - « Analyse du bénéfice symptomatique et morphologique de la turbinoplastie inférieure par les questionnaires NOSE et RhinoQOL, et par la rhino-manométrie antérieure».
2017 : Baptiste Hochet - « Résultats à moyen terme de la radiofréquence sous muqueuse dans le traitement des épistaxis dans la maladie de Rendu Osler ».
12 2019 : Martin Morisse - « Impact de l’infiltration de la région du ganglion sphéno-palatin par Ropivacaïne sur les douleurs post-opératoires dans le cadre de la chirurgie naso-sinusienne endoscopique ».
2019 : Thomas Bourhis - « Efficacité du budésonide en nébulisations sur la cicatrisation muqueuse après traitement chirurgical de la polypose naso-sinusienne ».
2019 : Julie Dauenhauer - « Evaluation de l’efficacité de la chirurgie naso-sinusienne sur l’amélioration des troubles du sommeil dans la polypose nasale en situation d’échec du traitement médical ».
III. Encadrements de M2 :
2011 : Claire Szymanski dans le M2 des sciences chirurgicales, Paris 12 mention Biologie Santé : « Mécanismes immuno-inflammatoires au cours de la polypose naso-sinusienne ».
2014 : Isabelle Gengler dans le M2 des sciences chirurgicales, Paris 12 mention Biologie Santé : « Rôle combiné de l’interleukine 5 et de l’interleukine 9 au cours de la polypose naso-sinusienne associée à l’asthme ».
2019-2020 : Thibault Vanderhaeghen dans le M2 de Biologie Santé, Lille : « Caractérisation immunophénotypique des éosinophiles circulants dans la polypose naso-sinusienne associée à l’asthme ».
13
Recherche fondamentale et clinique
RESUME DU PARCOURS SCIENTIFIQUE ET OBJECTIFS DE RECHERCHE
J’ai été initié à la recherche dans le cadre de mon DEA Science de la vie et de la biologie réalisé en 2003 dans le laboratoire Inserm U459 du Pr Pierre Formstecher sous la tutelle du Dr Pierre-Marie Danzé. Ce travail m’a permis de mettre au point une technique de détection de protéines de l’apoptose en faible concentration sur des lignées cellulaires immortalisées de lymphocytes T CD4 humains. En exploitant les outils des puces à ADN qui étaient alors en cours de développement à la plate-forme génomique, un protocole de protein array a été développé. Ce travail a fait l’objet d’une publication (P50) qui a obtenu le Prix Editorial de la Presse Médicale et des Professions de Santé en 2004.
Avant ma nomination en tant que Chef de Clinique des Universités – Assistant des Hôpitaux en 2006, aucune activité en recherche fondamentale et clinique dans le domaine de la rhinologie n’avait été initiée en ORL à Lille. La spécialité ne bénéficiait alors d’aucun lien scientifique avec un laboratoire de référence permettant de développer une thématique spécifique. Mon domaine de la spécialité ORL portant sur la prise en charge médicale et chirurgicale des pathologies inflammatoires naso-sinusiennes, c’est naturellement que l’analyse des mécanismes immuno-inflammatoires muqueux est apparue comme une problématique intéressante à explorer.
L’axe de recherche que j’ai pu développer répond à une problématique de caractérisation phénotypique (asthme, allergie, dysimmunité) et endotypique (profil inflammatoire biologique, activation cellulaire, présentation histologique) des rhinosinusites chroniques diffuses et en particulier de la polypose naso-sinusienne (PNS). Ce groupe de pathologies inflammatoires ne bénéficie actuellement que de traitements symptomatiques basés sur la corticothérapie et la chirurgie de drainage faute d’approche étiopathogénique. Ces traitements sont appliqués quelques soient les caractéristiques phénotypiques cliniques des patients. L’impact de l’allergie ou de l’asthme sur l’expression clinique, histologique ou biologique de la PNS, ou sur la réponse aux traitements n’est pas établi.
Cette thématique sur l’inflammation dans la PNS a été initiée après avoir établi des contacts avec le Pr Monique Capron en 2011 (équipe 3, Inserm U995, Pôle recherche –
14 Faculté de Médecine). Cet intérêt commun pour l’exploration du rôle des polynucléaires éosinophiles dans les maladies inflammatoires muqueuses chroniques m’ont permis d’encadrer un premier travail de master 2 en 2011 (Dr Claire Szymanski). Cette base de travail a favorisé mon intégration auprès de l’équipe scientifique. J’ai pu alors réaliser une thèse d’université de 2013 à 2015 sous la responsabilité du Pr Lionel Prin (EA 2686, Inserm U995, Pôle recherche – Faculté de Médecine). Durant cette période, j’ai pu encadrer un deuxième travail de master 2 en 2015 (Dr Isabelle Gengler).
Les résultats de ces travaux ont fait l’objet de présentations en congrès et de communications affichées permettant de positionner notre équipe sur cette thématique naissante à l’échelon national (ICO2, CO26, CO33, ICO4, IPA3, ICO6).
Depuis le départ en retraite du Pr Lionel Prin en 2015, l’organigramme de l’équipe scientifique a été remanié et la thématique de l’équipe 3 a été ajustée avec définition d’un axe majeur de recherche portant sur l’exploration des mécanismes immuno-inflammatoires au niveau des barrières cutanéo-muqueuses. En accord avec cette thématique et en collaboration avec le Dr Guillaume Lefèvre, MCU-PH en Médecine Interne-Immunologie et coordinateur du réseau éosinophile, Je poursuis actuellement mes travaux sur la physiopathologie de la PNS et le rôle des éosinophiles sanguins et tissulaires dans l’entretien de la réaction inflammatoire muqueuse.
Dans la continuité de ma thèse d’université soutenue en 2015, mes travaux actuels en recherche fondamentale portent toujours sur la caractérisation endotypique et phénotypique de la PNS par :
- L’analyse du profil d’expression protéique dans la PNS par analyse différentielle des cartographies protéomiques obtenues par électrophorèse bidimensionnelle sur les sécrétions nasales de patients présentant une PNS associée ou non à un asthme.
- La définition du profil d’activation des éosinophiles circulants dans la PNS par immunophénotypage membranaire (cytométrie en flux) sur prélèvements sanguins de patients présentant une PNS associée ou non à un asthme.
Je présente ici mon mémoire de synthèse de mes activités de recherche fondamentale et clinique dans le but d’obtenir l’Habilitation à Diriger les Recherches. Mes travaux de recherche seront décrits selon deux axes d’approche de la PNS :
15 - L’analyse des voies de régulation de la réponse inflammatoire dans la PNS en relation
avec le phénotype clinique et l’endotype biologique.
- L’analyse des facteurs influençant l’expression clinique de la PNS et la réponse aux traitements anti-inflammatoires et au traitement chirurgical (impact du phénotype sur l’expression de la maladie).
Le diplôme de l’HDR me permettrait d’encadrer des étudiants en Thèse et Master pour mener à bien les projets et d’asseoir le positionnement de la rhinologie au sein de mon équipe de recherche. Mes objectifs sont de parvenir à proposer une définition précise du profil inflammatoire endotypique des patients atteints de PNS en relation avec leurs caractéristiques phénotypiques. Ce projet est fondamental si l’on souhaite mieux appréhender les choix thérapeutiques qui s’offriront à nous avec l’avènement des thérapies médicales ciblées prônées par l’industrie (omalizumab, mepolizumab, dupilumab, benralizumab). Il s’agira aussi de pouvoir coordonner leur usage avec les traitements classiques médicaux et chirurgicaux en proposant une sélection plus précise des patients répondeurs. Ce projet est aussi fédérateur puisqu’il permet, grâce aux membres porteurs de projets de l’équipe de recherche, de favoriser les échanges avec les services cliniques en Pneumologie – Allergologie et en Médecine Interne – Immunologie. Des perspectives de recherche translationnelle sont ainsi à envisager dans le champ des maladies inflammatoires respiratoires.
RAPPELS SUR LA POLYPOSE NASOSINUSIENNE
I. Diagnostic de polypose naso-sinusienne :
La polypose naso-sinusienne (PNS) est une maladie inflammatoire chronique des cavités naso-sinusiennes. Elle touche 1 à 4,3 % de la population générale (1–3). Elle serait plus fréquemment observée chez l’homme entre 50 et 59 ans (4).
Le diagnostic de PNS est défini selon les critères édictés par l’EPOS 2012 (European Position Paper on Rhinosinusitis and Nasal Polyps). Le patient doit présenter au moins 2
16 symptômes rhino-sinusiens (dont l’obstruction nasale ou la rhinorrhée) évoluant depuis plus de 12 semaines. Doivent s’y associer la présence de tuméfactions inflammatoires (polypes) dans chacune des fosses nasales en endoscopie (Figure 1) et la présence d’opacités naso-sinusiennes diffuses en tomodensitométrie (TDM) (Figure 2) (4).
Figure 1: Aspect endoscopique des polypes dans une fosse nasale droite.
Tuméfactions jaunâtres et translucides occupant la fosse nasale droite entre la cloison (*) et le cornet inférieur droit (**).
Figure 2: Aspect tomodensitométrique de la PNS.
Opacités des fosses nasales (*) et des différents sinus, observées de manière diffuse et symétrique sur la coupe coronale (2A) et la coupe axiale (2B).
Des classifications ont été proposées pour quantifier l’importance de la pathologie muqueuse: le score de Lildholdt (5) permettant de mesurer en endoscopie la taille des polypes par rapport à la position des cornets moyen et inférieur (Figure 3), le score de Lund-Mackay permettant de grader en TDM la topographie et le nombre des opacités sinusiennes (Tableau 1) (6).
17
Figure 3: Score de taille des polypes selon Lildholdt.
La taille des polypes est déterminée selon la position du bord inférieur du polype le plus déclive par rapport aux reliefs turbinaux (stade 1 = ne dépasse pas le méat moyen, stade 2 = dépasse le méat moyen sans atteindre le bord inférieur du cornet inférieur, stade 3 = dépasse le bord inférieur du cornet inférieur). Un score moyen sur 3 est établi pour les 2 fosses nasales.
Tableau 1: Score tomodensitométrique de Lund-Mackay.
Sinus Droit Gauche
Maxillaire (0, 1, 2) Ethmoïde antérieur (0, 1, 2) Ethmoïde postérieur (0, 1, 2) Frontal (0, 1, 2) Sphénoïde (0, 1, 2) Méat moyen (0, 2) * Total /12 /12
Les opacités naso-sinusiennes sont cotées de 0 à 2 pour chaque fosse nasale (0 = pas d’opacité, 1 = opacité partielle, 2 = opacité complète). Un score total de 0 à 24 est établi pour les 2 fosses nasales.
* pour le méat moyen (0 = méat libre, 2 = méat obturé).
La PNS est associée à un asthme ou à une hyperréactivité bronchique dans 31 à 42% des cas (3). Le diagnostic est basé sur les épreuves fonctionnelles respiratoires et le test de provocation à la métacholine. Une intolérance à l’aspirine est observée dans 15% des cas (7). Le diagnostic est habituellement établi par l’interrogatoire. L’association de la PNS, de l’asthme et de l’intolérance à l’aspirine constitue la triade du syndrome de Widal ou Samter. L’impact fonctionnel de la PNS est majeur et peut altérer de manière significative la qualité de vie des patients sur le plan social et professionnel (8). Cette pathologie représente 18 à 22 millions de consultations par an aux Etats-Unis (9) avec une consommation de soins estimée à 2,4 milliards de dollars (10). Les conséquences socioéconomiques sont aussi significatives avec une perte de productivité et un absentéisme professionnel (11).
18 II. Physiopathologie de la polypose naso-sinusienne :
Les mécanismes étio-pathogéniques à l’origine de la PNS font l’objet de nombreux travaux de recherche à la fois sur le plan clinique, microbiologique et immunitaire. Ces études le plus souvent réalisées chez l’adulte permettent de souligner l’extrême complexité des voies de signalisations impliquées et l’intrication des facteurs causaux potentiels.
II.A. Rôle des comorbidités
Sur le plan clinique, l’asthme, l’allergie et l’intolérance à l’aspirine ont souvent été incriminés dans la genèse de la PNS. Les travaux épidémiologiques publiés montrent que ces morbidités apparaissent davantage comme des cofacteurs aggravant l’inflammation proprement liée à la PNS et non pas comme des facteurs déclenchants.
Bien que l’asthme et la PNS soient fréquemment associés, la relation de causalité existant entre ces 2 pathologies est encore mal connue (12). Les atteintes bronchiques et sinusiennes peuvent ainsi se développer simultanément ou la PNS peut précéder l’apparition de l’asthme (13).
Le rôle de l’allergie est controversé. La prévalence de la PNS chez les patients atteints de rhinite allergique est de 0,5 à 4,5%, ce qui est comparable à la prévalence de la PNS observée dans la population générale (3,4). Une étude de Bachert et al. montrait que l’importance de l’infiltration inflammatoire de la muqueuse nasale au cours de la PNS n’était pas liée à la coexistence d’une sensibilisation aux tests cutanés allergiques (14).
L’intolérance à l’aspirine et plus généralement aux anti-inflammatoires non stéroïdiens (AINS) est associée à la PNS dans 36 à 96 % des cas (7). Sur le plan métabolique, il s’agit d’une déviation de la voie de dégradation de l’acide arachidonique vers la voie de la lipo-oxygénase et des leucotriènes aux dépens de la voie de la cyclo-lipo-oxygénase. En résultent une diminution de la production des prostaglandines et une diminution de leur action inhibitrice sur le chimiotactisme et l’activation des éosinophiles tissulaires (15). La présence d’une intolérance à l’aspirine s’associe souvent à un état inflammatoire tissulaire plus sévère, aggravant l’inflammation proprement liée à la PNS par des voies métaboliques distinctes (4).
19 II.B. Rôle des facteurs environnementaux et des agents infectieux :
Sur le plan anatomique, les cavités naso-sinusiennes constituent le premier filtre de l’arbre respiratoire face aux agents agressifs de l’environnement. L’exposition aux toxines (tabac, ozone, dioxyde de sulfure, particules de diesel) est susceptible d’induire un stress oxydatif et nitrosatif à l’origine de lésions tissulaires inflammatoires altérant la barrière épithéliale (16,17). Le rôle de ces expositions dans le développement de la PNS n’est pourtant pas clair. Il n’a pas été montré de différence de prévalence de la PNS selon le mode de vie ou l’exposition professionnelle à des agents irritants (18). L’impact du tabagisme et de la pollution n’est pas non plus établi (3,18).
L’agression de l’épithélium nasal par les agents microbiens est proposée dans de nombreuses études récentes comme un facteur étio-pathogènique majeur de la PNS. Les toxines produites par Staphylococcus Aureus se comporteraient comme des super-antigènes amplifiant la réponse inflammatoire lymphocytaire T-helper 2 dépendante (Th2) à l’origine du recrutement et de l’activation des polynucléaires éosinophiles (EOs) (19). L’altération des interactions hôte-environnement au niveau naso-sinusien mettrait en jeu à la fois les mécanismes de l’immunité innée et de l’immunité acquise (ou adaptative) dans le déclenchement et l’entretien de la boucle inflammatoire tissulaire (Figure 4).
II.C. Rôle de l’éosinophile :
Les EOs sont des granulocytes circulants impliqués sur le plan muqueux dans la défense immunitaire anti-parasitaire par dégranulation de médiateurs toxiques à action enzymatique. Leur présence en grande quantité au cours des pathologies inflammatoires respiratoires chroniques (asthme, rhinite allergique) font de l’EO un pivot de la réponse inflammatoire tissulaire. Dans le cadre des rhinosinusites chroniques, l’éosinophilie sanguine et tissulaire constitue un marqueur biologique de la PNS dans la population caucasienne (4). Le recrutement, la prolifération et l’activation des EOs sont au centre de la plupart des hypothèses physiopathologiques tentant d’expliquer la PNS. Les EOs sont décrits par les partisans de la théorie fongique comme le principal acteur dans le développement des rhinosinusites chroniques (20,21). L’hypothèse bactérienne précisant le rôle super-antigénique des toxines du SA décrit aussi l’EO comme la cible principale de la production polyclonale d’IgE à l’origine de sa dégranulation (14,19,22). L’épithélium nasal concourt aussi en situation inflammatoire au recrutement des EOs(23,24). Enfin la présence d’IgA,
20 l’environnement cytokinique (IL-4, IL-5, IL-13) et le profil lymphocytaire Th2 observés au cours de la PNS favorisent la survie et l’activation des EOs (25,26).
Une fois recruté et activé, l’EO participe au développement et à l’entretien de la réaction inflammatoire au cours de la PNS. La libération par dégranulation de médiateurs toxiques (MBP (eosinophil granule major basic protein), ECP (eosinophil cationic protein), EDN (eosinophil-derived neurotoxin), EPO (eosinophil peroxidase)) entraine des lésions de l’épithélium nasal et de la matrice extracellulaire à l’origine du remodelage tissulaire (27). Les EOs produisent aussi des signaux favorisant la mobilisation des autres acteurs de la réponse immunitaire. La production d’IL-5 par les EOs au cours de la PNS permet d’auto-entretenir la boucle d’activation des EOs et concourt à l’environnement cytokinique pro Th2 favorisant la production d’IgE par les plasmocytes(28).
21 Figure 4 : Interactions des différents partenaires de la réponse immunitaire innée et acquise dans l’inflammation observée au cours de la PNS.
L’agression de la muqueuse nasale par les agents infectieux favorise l’activation des cellules épithéliales ① et la mise en jeu de la phagocytose macrophagique ②. L’épithélium recrute et active les cellules dendritiques et les lymphocytes B ③. La libération de cytokines Th2 oriente la réaction immunitaire ④ avec une production polyclonale d’igE et d’igA ⑥. La production de facteurs d’adhérence par les macrophages M2 et par l’épithélium permet le recrutement des EOs depuis le flux sanguin (les EOs s’autoactivent par production d’IL-5) ⑤. L’interaction antigène staphylococcique/anticorps favorise la dégranulation des EOs et des mastocytes (le mastocyte est lui-même directement stimulé par les agents bactériens via PRR) ⑥. La libération de peptidases et de protéines cytotoxiques participe au remodelage tissulaire (l’épithélium intervient aussi dans son propre remodelage par la production de protéases) ⑦.
22 III. Les enjeux de la recherche dans la polypose naso-sinusienne :
Les éléments de physiopathologie apportés par la littérature soulignent bien la complexité des phénomènes dysimmunitaires conduisant à pérenniser les processus inflammatoires à l’origine de la PNS. L’hypothèse staphylococcique apparaît actuellement comme la piste la plus documentée mais l’efficacité partielle de l’antibiothérapie démontre bien la probable coexistence de plusieurs facteurs étiologiques. L’éosinophilie considérée comme un marqueur quasiment pathognomonique de la PNS dans la population caucasienne est moins prononcée dans d’autres régions géographiques. Le terme de « polypose naso-sinusienne » renvoie en réalité à un éventail de situations cliniques (phénotype) et des situations inflammatoires beaucoup plus diverses et pour lesquelles le terme d’endotype a été introduit (29,30).
La caractérisation endotypique de la PNS peut s’aider de critères histologiques. La distinction entre rhinosinusite chronique sans polype et rhinosinusite chronique avec polypes a constitué l’un des premiers éléments de classification nosologique permettant de séparer les patients sur le plan clinique et de guider les options thérapeutiques (31). Au sein de la PNS, des classifications histologiques ont été proposées pour discerner les différents types de polypes sans établir de véritable lien avec les données cliniques (32,33). Une meilleure description du polype sur le plan cellulaire et architectural en relation avec les comorbidités que sont notamment l’asthme, l’allergie et l’intolérance aux AINS m’est apparu comme une première étape vers une meilleure caractérisation phénotypique des patients.
L’analyse endotypique s’appuie sur la définition du profil inflammatoire du polype en termes d’environnement cytokinique et de recrutement en effecteurs cellulaires de la réponse immunitaire (29). Comme évoqué précédemment, la PNS dans la population caucasienne se caractérise le plus souvent (80%) par une infiltration cellulaire riche en EOs avec un profil immunitaire Th2 (34). Une étude incluant 70 patients d’origine européenne traités chirurgicalement pour une PNS montrait que la présence d’IL-5 et d’IgE dans les homogénats de polypes était fréquemment associée à une PNS riche en EOs (35). A l’inverse, plusieurs autres études analysant des populations asiatiques retrouvaient un profil plutôt neutrophilique avec une réponse immunitaire Th17 et une production d’interféron gamma
23 (INFγ)(30,36). Une mise en corrélation de ces endotypes immuno-inflammatoires avec les données cliniques a constitué une seconde étape dans ma démarche scientifique.
Les voies de l’immunité innée et adaptative sont intimement intriquées dans la pérennisation de la réponse inflammatoire dans la PNS. L’identification de mécanismes de régulation de cette réponse inflammatoire en lien avec les EOs et les phénotypes des patients a été une troisième étape de ma recherche.
Enfin, dans une perspective translationnelle, l’identification de facteurs phénotypiques influençant la présentation clinique de la PNS et modifiant la réponse aux traitements symptomatiques de la PNS a constitué une part importante dans mon approche clinique de la recherche.
Le rôle des marqueurs biologiques dans le contrôle médical et chirurgical de la PNS n’a pas pour l’instant été exploré dans la littérature. La mise en corrélation des profils endotypiques immuno-inflammatoires avec l’efficacité des traitements pourrait permettre une meilleure sélection des options thérapeutiques en particulier à l’ère des thérapies ciblés qui sont actuellement évalués dans des essais de phase III dans la PNS. Cela constitue mon projet actuel de développement de la recherche à la fois dans la PNS mais également dans les autres formes de rhinosinusites chroniques.
DEFINITION DES ENDOTYPES DANS LA POLYPOSE NASO-SINUSIENNE
I. Caractérisation histo-pathologique :
La première étape de mon activité de recherche débutée lors de la thèse d’université a consisté à proposer une classification histo-pathologique des polypes dans la PNS.
Durant 6 mois, 36 patients avec une PNS résistante au traitement médical étaient inclus de manière prospective. Après un sevrage d’au moins 1 mois de tout traitement corticoïde topique et systémique, un polype était prélevé lors du geste d’ethmoïdectomie ou de polypectomie endoscopique programmé dans le cadre de la prise en charge thérapeutique.L’utilisation d’une grille de lecture standardisée sur lames colorées HES avec analyse indépendante menée par 2 observateurs entraînés en microscopie optique permettait de classer les polypes en 3 groupes sur la base de l’infiltration cellulaire du
24 chorion et de l’aspect œdémateux ou fibreux du polype (Figure 5). Le polype dit « œdémateux » principalement observé (n=23) était très riche en EOs et présentait une distension œdémateuse majeure du chorion. Le polype dit « intermédiaire » (n=10) était aussi majoritairement infiltré par des EOs et présentait un chorion composite contenant de l’œdème et une trame collagène plus prononcée. Le polype dit « fibreux » était plus rarement observé (n=3). L’infiltration cellulaire était mixte, éosinophile et lymphocytaire. Le chorion était surtout caractérisé par une trame fibreuse. La proportion relative des populations cellulaires constituant l’infiltration inflammatoire du chorion était différente selon le statut bronchique des patients. La présence d’un asthme était associée à une plus grande éosinophilie.
Cette classification a été utilisée dans la suite des travaux pour choisir les patients présentant les polypes œdémateux. Ce principe de sélection permettait de limiter les biais dans la définition des endotypes biologiques.
25
Figure 5 : Morphologie des 3 types de polypes issus de la classification (×100 and ×200)
Le polype œdémateux est caractérisé par une infiltration œdémateuse massive du chorion (*) (2A). Le polype fibreux présente une structure collagène (#) (2B). Le polype intermédiaire est riche en éosinophiles avec une composante stromale mixte (2C). Différentes caractéristiques architecturales sont observées de manière égale pour les 3 types de polypes : desquamation épithéliale complète (a) ou hyperplasie épithéliale (b), épaississement de la membrane basale (c), hyperplasie des glandes séromuqueuses (d).
26 II. Phénotypes et endotypes :
La mise en corrélation des marqueurs inflammatoires (endotypes) et des caractéristiques cliniques (phénotypes) m’est apparue comme une étape essentielle dans la classification des formes de PNS. L’impact de l’asthme et de l’allergie dans l’expression biologique de l’inflammation était à définir.
Les patients participant à cette analyse ont été inclus de manière prospective entre 2011 et 2015 dans le cadre du protocole SHE (numéro d’enregistrement : 2009-A00314-53). Il s’agissait de patients présentant une PNS réfractaire au traitement médical éligibles à une chirurgie naso-sinusienne. Les échantillons sanguins et les sécrétions nasales étaient collectés juste avant le début de l’intervention chez des patients sevrés de corticoïdes par voie générale depuis 1 mois. Les polypes étaient obtenus au début de l’intervention, sous contrôle endoscopique. L’analyse histo-pathologique du polype permettait de ne retenir que les patients présentant un polype de nature œdémateuse selon la classification précédemment établie.
Chez les patients asthmatiques, existaient une surexpression des marqueurs Th2 (IgE, IL-5) et des produits de dégranulation des éosinophiles (EDN) (Figure 6).
Chez les patients allergiques, l’ensemble des paramètres mesurés n’étaient pas différemment exprimés et ce quel que soit le profil de sensibilisation allergénique des patients (Tableau 2). L’absence d’impact de l’allergie sur l’expression de ces protéines renforce l’absence de lien physiopathologique de l’allergie avec la PNS. En revanche l’asthme très souvent considéré comme un facteur phénotypique associé à la corticorésistance et à l’échec du traitement chirurgical trouve ici son expression endotypique avec une surexpression des marqueurs associés à la survie et à l’activation des éosinophiles.
Ce travail a en partie permis d’encadrer le mémoire de Master 2 de Claire Szymanski et a été publié après la thèse d’université en 2017 (P18).
27 Figure 6. Profil endotypique avec polarisation Th2 des patients PNS avec un asthme associé.
Les taux d’IL-5 (A), and d’IgE (B) dans les sécrétions nasales étaient plus élevés chez les patients asthmatiques. Le taux d’EDN mesuré sur broyat de polype était aussi plus élevé chez les patients asthmatiques (C).
28 Tableau 2 : Caractéristiques endotypiques selon le statut allergique des patients.
Allergique (n=15) Non allergique (n=42) p Sang EOs (/mm3) 529 527 ns
IgE totales (KU/l) 302,1 117,6 0,01*
IgA totales (KU/l) 1,8 1,4 ns
ECP (ng/ml) 32,3 38,2 ns EDN (ng/ml) 77,8 75,0 ns Sécrétions nasales EOsec (%) 9,0 44,2 6,8 ns
IgE totales (KU/l) 31,6 ns
IgA totales (KU/l) 0,17 0.15 ns
ECP (ng/ml) 178,5 223,4 ns
EDN (ng/ml) 410,5 375,5 ns
IL-5 (pg/ml) 34,6 25,2 ns
Polypes EOpol (%) 16,8 16,1 ns
* Test de Mann-Whitney
ECP, eosinophil cationic protein; EDN, eosinophil-derived neurotoxin; EOs, éosinophilie sanguine; EOsec, % d’éosinophiles dans les sécrétions nasales; EOpol, % d’éosinophiles dans l’homogénat de polype; IL-5, interleukine-5; IL-9, interleukine-9; ns, non significatif
Ces caractéristiques endotypiques dans la PNS associée à l’asthme permettraient de valider l’intérêt des thérapies ciblées actuellement utilisées en pneumologie dans l’asthme cortico-dépendant. Pourtant les résultats des premiers essais publiés dans la PNS ne sont pas totalement concluants.
Une étude randomisée en double aveugle versus placebo incluant 14 patients avec une PNS résistante aux traitements corticoïdes et présentant un taux élevé d’IgE sérique n’a pas identifié de bénéfice de l’omalizumab, anticorps monoclonal recombinant dirigé contre les IgE humaines, en injection mensuelle pendant 6 mois sur le score tomodensitométrique d’opacités des sinus, sur le score endoscopique et sur le score symptomatique (37). Gevaert et al. dans un essai plus récent retrouvaient des résultats plus encourageants. Etaient inclus 24 patients avec une PNS associée à un asthme. L’omalizumab était administré à 16 patients tous les 15 jours ou tous les mois pendant 16 semaines selon le taux sérique d’IgE totales. Comparé au groupe placebo, les auteurs observaient dans le groupe traité une diminution significative de taille de polypes et des scores symptomatiques dès 8 semaines de traitement et ce quel que soit le statut allergique des patients. Le nombre limité de patients inclus, la
29 sortie d’étude de 50% des patients placebo pour une poussée inflammatoire sinusienne ou bronchique limitaient l’impact de cet essai (38).
Le mepolizumab, autorisé dans le traitement des syndromes hyper-éosinophiliques et le reslizumab, utilisé dans le contrôle de l’asthme sévère ont aussi fait l’objet d’évaluations dans la PNS associée à l’asthme. Un premier essai randomisé en double aveugle incluant 24 patients comparait le reslizumab en 1 injection au placebo. Le score de taille des polypes était amélioré à 12 semaines chez 50% des patients du groupe traité. Après 12 semaines, 4 patients du groupe traité présentaient une dégradation importante de ce score avec pour la plupart des patients un rebond du taux sanguin en EOs. Le recours à la corticothérapie était comparable entre le groupe traité et le groupe placebo (39). Un autre essai randomisé en double aveugle mené par la même équipe comparait l’effet du mepolizumab au placebo en 2 injections espacées d’un mois sur une période d’observation de 48 semaines chez 30 patients présentant une PNS associée à un asthme. Le bras traité présentait une diminution significative de la taille des polypes et du score tomodensitométrique après 8 semaines quel que soit le statut allergique des patients. Contrairement à l’étude précédente, les sujets répondeurs n’avaient pas dans les sécrétions nasales un taux initial d’IL-5 plus élevé. Ces résultats sont à mettre en balance avec le nombre limité de patients inclus et la sortie d’étude de 15 patients suite à une poussée inflammatoire nécessitant une corticothérapie ou un traitement chirurgical (40).
Dès lors, il m’est apparu intéressant de mieux comprendre les mécanismes immuno-inflammatoires liant les éosinophiles au profil Th2 et d’essayer d’identifier de potentielles explications à cet échec relatif des thérapies ciblées.
30
MODULATION DE LA REPONSE INFLAMMATOIRE DANS LA POLYPOSE NASO-SINUSIENNE
I. Immumodulation de la réponse immunitaire acquise :
Sur ce point, mon travail a consisté à analyser le profil d’expression membranaire des protéines impliqués dans l’activité inflammatoire pro-Th2 des EOs.
La pérennisation de l’infiltration de la muqueuse nasale par les EOs nécessite le recrutement de ces cellules depuis le compartiment sanguin par migration trans-endothéliale et la mise en jeu de mécanismes de survie et d’activation tissulaire. Les phénomènes de migration trans-endothéliale sont tributaires des protéines d’adhérence tissulaire décrites comme essentielles dans l’interaction des EOs avec les parois vasculaires et la matrice extracellulaire tissulaire (23,41). Les mécanismes de survie et d’activation dépendent de l’interaction de l’IL-5 avec son récepteur exprimé à la surface des EOs. L’IL-9, par son rôle de régulateur dans la signalisation IL-5 dépendante dans l’asthme (42), est un acteur potentiel de cette immuno-modulation (42). Son rôle dans la PNS n’avait pas jusque-là été étudié.
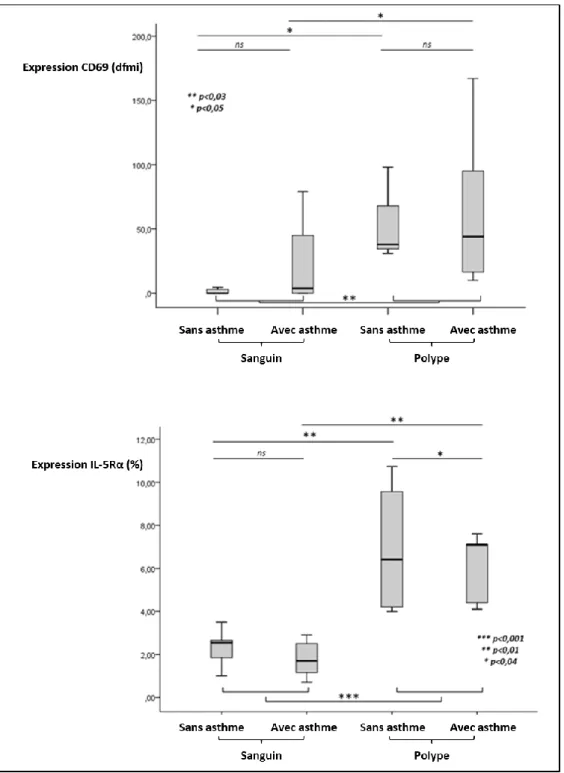
Les patients participant à cette analyse ont aussi été inclus de manière prospective entre 2011 et 2015 dans le cadre du protocole SHE (numéro d’enregistrement : 2009-A00314-53). Sélectionnés sur les mêmes critères phénotypiques clinique et histologique que dans l’analyse précédente sur les endotypes, les patients étaient prélevés en consultation après au moins 1 mois d’arrêt des corticoïdes par voie générale. Les échantillons sanguins obtenus permettaient de purifier les EOs circulants. En cours d’intervention, les polypes nasaux étaient prélevés pour une purification des EOs tissulaires. Cette purification tissulaire a nécessité une longue phase de mise au point technique qui nous permet actuellement de bénéficier d’un protocole fiable pour nos futurs travaux. Les EOs purifiés étaient analysés par cytométrie en flux et comparés en termes d’expression membranaire des protéines d’adhérence, de la protéine d’activation CD69, du récepteur à l’IL-5 (IL-5Rα) et du récepteur à l’IL-9 (IL-9Rα).
Brièvement, étaient observés chez les patients asthmatiques une diminution plus prononcé de l’expression membranaire des protéines d’adhérence (béta1 (β1) intégrines (lymphocyte function-associated antigen-1 (LFA-1 ou CD11a/CD18), les β2 intégrines (very late antigen-4 (VLA-4 ou CD49b/cd29) et le CD44) lors du passage tissulaire des EOs. Ce
31 phénomène nous permettait d’expliquer le trapping nasal des EOs circulants et la plus grande infiltration tissulaire en EOs en cas d’asthme associé. La molécule signant l’activation des EOs (CD69) était augmentée à la surface des EOs tissulaires (Figure 7). L’IL-5Rα était augmenté à la surface des EOs tissulaires. Cette expression était relativement plus faible chez les patients présentant un asthme associé à la PNS (Figure 7). En revanche, le taux d’expression de l’IL-9Rα était relativement plus élevé en cas d’asthme associé. Des tests fonctionnels in vitro sur EOs tissulaires purifiés permettaient d’observer une action synergique de l’IL-5 et de l’IL-9 sur l’expression membranaire de l’IL-5Rα.
Ces travaux confirmaient notre hypothèse d’une modulation de l’activité des EOs tissulaires dans la PNS en cas d’asthme associé. La diminution relative de l’expression membranaire de l’IL-5Rα permettrait ainsi d’expliquer l’efficacité variable de thérapies ciblées visant l’activité du récepteur à l’IL-5 dans la PNS. Ces travaux ont aussi permis de mettre en lumière le rôle de l’IL-9 dans le potentiel recyclage membranaire de l’IL-5Rα comme cela a déjà été décrit dans le compartiment bronchique au cours de l’asthme (42,43). Ce projet a en partie permis d’encadrer le mémoire de Master 2 d’Isabelle Gengler et a été publié à l’issue de la thèse d’université en 2015 (P33). Il a été présenté en communications orales et affichées dans des congrès nationaux et internationaux (ICO2, CO26, ICO4, IPA3, ICO6).
32
Figure 7. Modulation d’expression du CD69 et de l’IL-5Rα entre le compartiment sanguin (n=19) et le compartiment tissulaire nasal (n=20).
Le CD69 et l’IL-5Rα sont surexprimés sur les éosinophiles tissulaires. L’IL-5Rα est significativement moins présents sur les EOs tissulaires des patients asthmatiques.
33 II. Immunodulation de la réponse immunitaire innée :
Le rôle des acteurs de la réponse immunitaire innée dans la PNS est partiellement établi. Les macrophages M2 participent à l’élimination des pathogènes et produisent des facteurs chimiotactiques pour les lymphocytes T naïfs, les cellules dendritiques et les EOs (44). Les mastocytes sont activés par la voie classique de l’immunité innée via les récepteurs PRR (45) et par une stimulation directe via la protéine SpA du Staphylococcus Aureus (46). En plus de libérer les composants issus de granules préformés (histamine, sérines protéases) impliqués dans le remodelage tissulaire (4), les mastocytes activés libèrent également des cytokines pro-inflammatoires. Ils participent ainsi au recrutement des EOs (47) et à l’activation des lymphocytes Th2 (48).Le rôle des neutrophiles au cours de la PNS est moins précis. A côté de leur fonction classique de phagocytose des pathogènes extracellulaires, ces cellules pourraient être impliquées dans le remodelage tissulaire(49). Le complément est aussi concerné mais son rôle a peu été étudié dans la PNS (50).
La voie immunitaire innée peut être étudiée à travers l’analyse des protéines modulant l’activité des cellules précédemment citées. L’analyse de cette expression protéique selon le statut phénotypique asthmatique des patients n’a pas été réalisée dans la PNS. Dans cette perspective, j’ai développé depuis la fin de la thèse d’université une approche globale et comparative de mesure de l’expression des protéines présentes dans les sécrétions nasales. L’objectif était de pouvoir établir une analyse spectrométrique des protéines différentiellement exprimés chez les patients PNS avec ou sans asthme par électrophorèse bidimensionnelle quantitative (2D DIGE). Ce travail, débuté en 2016, a d’abord nécessité une longue phase de mise au point technique afin d’assurer une déplétion efficace de la sérumalbumine présente à plus de 80% dans les sécrétions nasales. Cette étape était nécessaire pour permettre une identification des protéines les plus faiblement concentrées dans les échantillons.
Sur la base des prélèvements de sécrétions nasales obtenues dans le cadre du protocole SHE (numéro d’enregistrement : 2009-A00314-53), 2 groupes de patients ont été définies : 15 patients avec une PNS en situation d’échec du traitement médicale sans asthme et 15 patients avec une PNS en situation d’échec du traitement médicale et un asthme. Au total, 1084 spots protéiques étaient identifiés par le logiciel SameSpots sur le standard interne issu des sécrétions nasales des 30 patients (Figure 8).
34 Figure 8 : Images représentatives de gels 2D-DIGE comparant les sécrétions nasales des sujets atteints de PNS isolée et de PNS associée à un asthme allergique.
Carte protéomique d’un sujet atteint de PNS isolée associée au fluorochrome Cy3 (8A) et d’un sujet atteint de PNS associée à un asthme allergique associée au fluorochrome Cy5 (8B). Images superposées du standard interne associé au fluorochrome Cy 2 (8C). Les spots colorés en blanc sont exprimés de manière équivalente entre les 2 groupes de sujet. Les spots colorés en vert (Cy3) sont surexprimés pour le sujet atteint de PNS isolée, les spots colorés en rouge (Cy5) sont surexprimés pour le sujet avec une PNS associée à un asthme allergique.
Au terme du protocole de 2D-DIGE comparant les 2 conditions phénotypiques, des critères de sélection strictes ont été choisis pour identifier les spots les plus différentiellement exprimés (différence > 1,4 ; p-value < 0,05 et puissance> 0,8). Trois spots étaient ainsi surexprimés chez les patients PNS sans asthme et 20 spots chez les patients PNS avec asthme (Figure 9).
Figure 9 : Identification par le logiciel SameSpots des spots différentiellement exprimés.
Sur ce gel, sont entourés les spots surexprimés en cas d’asthme associé selon un rapport de +1,4 avec un seuil de significativité statistique p≤0,05.
35 Les protéines présentes au sein de ces spots ont été extraites et soumises à une identification peptidique par spectrométrie de masse avec analyseur Orbitrap. Cette analyse en un temps a été possible grâce aux collaborations récentes qui ont été établies avec l’équipe du Dr Christian Rolando (Université de Lille - Sciences et Technologies UFR de Chimie, USR 3290 MSAP, Miniaturisation pour la Synthèse, l'Analyse & la Protéomique). Les séquences peptidiques obtenues sur les 20 spots surexprimés en cas de PNS associée à un asthme ont permis de cibler 108 protéines candidates en appliquant des critères de sélection hautement discriminants (taille de séquence, Protein Abundance Index, Posterior Error Probability score). Ces protéines ont été identifiées sur la base de données UNIPROT (https://www.uniprot.org/) et leurs rôles ont été recherchés sur les bases de données bibliographiques afin de déterminer leur pertinence dans le contexte des maladies inflammatoires respiratoires.
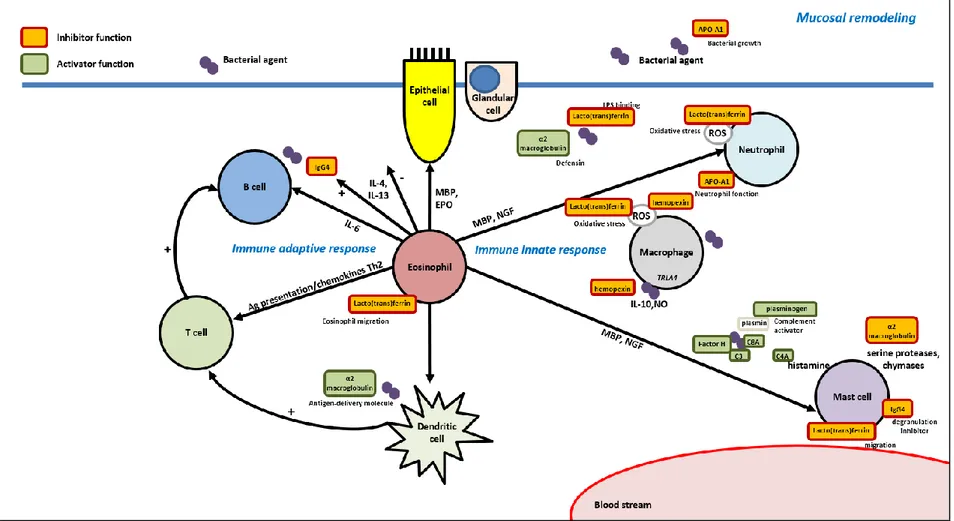
Les protéines les plus exprimées en cas d’asthme associé à la PNS sont majoritairement impliquées dans la régulation de la réponse immunitaire innée (Figure 10). Elles agissent en autres en tant qu’agents de transport et de métabolisme du fer impliqués dans la régulation du stress oxydatif dépendant des macrophages et des neutrophiles (hemo-pexine, transferrine, lactoferrine, sero-transferrine)(51–53), en tant que régulateurs du remodelage tissulaire inhibant les sérines protéases libérées par les mastocytes (α2 macroglobuline), en tant que défensines impliquées dans l’activité bactéricide (α2 macroglobuline)(54), ou en tant qu’agents antibactériens inhibant la croissance des pathogènes (apolipoprotéine A1)(55). En cas d’asthme associé, on retrouve également une augmentation de l’expression des protéines du complément (C3, C4, C8A et facteur H)(50,56,57). Le complément joue un rôle essentiel dans le chimiotactisme et l’activation des neutrophiles et des EOs (50). L’activation décrite du complément dans la PNS par la voie classique via les complexes immuns IgE ou par la voie alterne en présence de Staphylococcus Aureus montre bien l’intrication des réponses inflammatoires adaptative et innée.
L’implication prépondérante de la réponse immunitaire innée en cas d’asthme associé dans la PNS n’a jamais jusqu’ici été décrite dans la littérature. Ces nouvelles données ouvrent des perspectives dans la compréhension des relations nez-bronche, le nez pouvant se comporter comme une zone gâchette concourant à l’entretien de la réponse inflammatoire bronchique via des mécanismes de régulation innée et altérant ainsi la qualité de la réponse aux thérapies ciblant exclusivement la voie Th2.
36
Figure 10 : Schéma des protéinés surexprimées dans les sécrétions nasales des patients présentant une polypose naso-sinusienne associée à un asthme.
Sont exprimées préférentiellement des protéines impliquées dans la régulation de la réponse immunitaire innée avec une action activatrice (protéines du complément, α2 macroglobuline) ou une action inhibitrice (transferrine, apolipoprotéine A1, α2 macroglobuline) (Données non publiées).