MÉMOIRE PRÉSENTÉ
A
L'INSTITUT ARMAND-FRAPPIER COMME EXIGENCE PARTIELLE
DE LA MAÎTRISE EN MICROBIOLOGIE APPLIQUÉE
PAR
PA TRICIA LIRETIE
OPTIMISATION DE LA BIODÉGRADATION DES HYDROCARBURES AROMATIQUES POLYCYCLIQUES
TABLE DES MATIERES LISTE DES TABLEAUX LISTE DES FIGURES LISTE DE ABRÉVIATIONS SOMMAIRE
INTRODUCTION
REVUE BIBLIOGRAPHIQUE
TABLE DES MATIBRES
1. CONTAMINATION DES SOLS 1.1 Sources de contamination
1.2 Contamination par les hydrocarbures 2. HYDROCARBURES
2.1 Généralités
2.2 Hydrocarbures aromatiques polycycliques 3. NORMES
4. TRAITEMENTS BIOLOGIQUES DES SOLS 4.1 Traitements in situ
4.2 Traitements ex situ
5. MICROORGANISMES DÉGRADANT LES HYDROCARBURES 5.1 Généralités
5.2 Microorganismes dégradant les HAPs 5.2.1 Biodégradation des HAPs
5.2.2 Isolement 5.2.3 HAPs légers 5.2.4 HAPs lourds
6. VOIES MÉTABOLIQUES DES HAPs 6.1 Généralités
6.2 Fluorène 6.3 Phénanthrène 6.4 Pyrène
6.5 Chrysène
7. OPTIMISATION DE LA BIODÉGRADATION DES HAPs 7.1 Généralités 7.2 Température 7.3 pH 7.4 Humidité 7.5 oxygène 7.6 Nutriments 7.6.1 C:N:P 7.6.2 Autres nutriments
7.7 Inoculation de microorganismes adaptés 7.8 Surfactants ii i i v vi ix xii 1 6 7 7 7 8 8 9 12 14 15 16 19 19 22 22 25 27 29 30 30 32 33 35 37 39 39 40 41 42 42 44 44 46 48 50
8. DÉGRADATION DES HAPs DANS LE SOL DE LA SABLIERE THOUIN
MATÉRIEL ET MÉTHODES
1. SOL DE LA SABLIERE THOUIN
1.1 Échantillonage et conservation du sol 1.2 Caractérisation du sol 1.2.1 pH 1.2.2 Humidité 1.2.3 Rapport C:N:P 1.2.3.1 Carbone total 1.2.3.2 Azote total 1.2.3.3 Phosphore total
1.2.4 Quantification des métaux lourds 1.2.5 Huiles et graisses
1.3 Caractérisation microbiologique
1.3.1 Dénombrement des bactéries totales 1.3.2 Dénombrement des bactéries
dégradant les HAPs
53 55 56 56 56 56 56 57 57 57 58 58 59 60 60 61 2. BIODÉGRADATION EN MILIEUX LIQUIDES 62
2.1 Inoculum 62
2.2 Cultures et conditions 63
2.3 suivi de la croissance des populations
bactériennes 65
2.4 Extractions et analyses 66
2.5 Identification des intermédiaires de dégradation 68 3. ÉTUDE D'UNE SOUCHE ISOLÉE DU SOL DE LA
SABLIERE THOUIN
3.1 Isolement, identification et conservation 3.2 Spectre d'activité de la souche bactérienne 4. ÉTUDE D'UN CHAMPIGNON ISOLÉ DU SOL DE LA
SABLIERE THOUIN
4.1 Isolement et conservation 4.2 Essais en milieu liquide
5. BIODÉGRADATION DES HAPs EN MICROCOSMES 5.1 Conditions de cultures
5.2 Suivi des populations bactériennes 5.3 Extractions et analyses
5.4 Inoculation de la souche Alcaligenes en sol 6. MINÉRALISATION
7. ÉVALUATION DE L'ACTIVITÉ SURFACTANTE ET ÉMULSIFIANTE 70 70 isolée 71 72 72 72 73 73 74 74 76 76 78
RÉSULTATS 1. CARACTÉRISATION DU SOL 1.1 Chimique 1.2 Microbiologique iv 80 81 81 81
2. CULTURES EN MILIEUX LIQUIDES 83
2.1 Optimisation de la biodégradation 83 2.1.1 Cultures en erlenmeyers de 500 mL 83 2.1.2 Cultures en erlenmeyers de 250 mL 89 2.2 Identification d'intermédiaires de dégradation 97 3. ÉTUDE D'UNE SOUCHE BACTÉRIENNE ISOLÉE 100 4. OPTIMISATION DE LA BIODÉGRADATION EN MICROCOSMES 107
5. MINÉRALISATION 122 5.1 Fluorène 122 5.2 Phénanthrène 122 5.3 Pyrène 124 DISCUSSION 1. CARACTÉRISATIQUES DU SOL
2. OPTIMISATION DE LA BIODÉGRADATION DES HAPs 2.1 Milieux liquides 2.1.1 HAPs légers 2.1.1.1 Erlenmeyers de 500 mL 2.1.1.2 Erlenmeyers de 250 mL 2.1.2 HAPs lourds 2.1.3 Intermédiaires de dégradation
2.1.4 Potentiel de dégradation de la souche Alcaligenes sp.
2.2 Microcosmes sol 2.2.1 HAPs légers 2.2.2 HAPs lourds
2.2.3 Inoculation de la souche Alcaliqenes en microcosmes.
3. MINÉRALISATION DES HAPs
CONCLUSION REMERCIEMENTS BIBLIOGRAPHIE 125 126 128 130 130 130 132 137 140 141 143 143 150 151 153 154 158 160
Tableau 1. Tableau 2. Tableau 3. Tableau 4. Tableau 5. Tableau 6. Tableau 7. Tableau 8.
LISTE DES TABLEAUX
critères indicatifs de la contamination
des sols pour les HAPs (Anonyme, 1988). 13
Liste des genres et des espèces bactérien-nes isolées pour quelques HAPs {Cerniglia,
1992). 23
Caractérisation du sol de la Sablière
Thouin. 82
caractéristiques de la souche Alcaligenes sp •.
Observation de la formation de halos etjou de coloration sur milieu BH 0.025 par la
101
souche Alcaligenes sp.. 105
Enlèvement du fluorène, du phénanthrène, du pyrène et du chrysène par la souche
Alcaligenes sp. en milieu liquide BH. 106
Pourcentages d'enlèvement des quatre HAPs à l'étude dans les microcosmes avec le milieu BH supplémenté ou non après 30
jours d'incubation. 108
Pourcentages d'enlèvement du pyrène et du chrysène en milieu BH supplémenté ou non d'extrait de levures après 60 jours
Figure 1. Figure 2. Figure 3. Figure 4. Figure 5. Figure 6. Figure 7. Figure 8. vi LISTE DES FIGURES
Structures chimiques de quelques HAPs
(Wilson et Jones, 1993). 10
Schéma représentatif d'un traitement en
biopile (Samson, 1994b) • lB
Voie métabolique générale utilisée par les bactéries pour l'oxydation des HAPs
(Cerniglia, 1984). 31
Voie métabolique du fluorène proposée chez Pseudomonas F274. I, fluorène; II,
9-hydroxy-fluorène; III, 9-fluorènone; IV, l,la-dihydroxy-1-hydro-9-fluorènone; VI,a-hydroxy-3,4-benzocoumarin; VII, acide phtalique; VIII, 4,5-dihydroxyphtalate;
IX, protocatéchuate; X, 2-hydroxy-4-carboxy-cis,cis-muconique
semialdéhyde. (Grifoll et al., 1994). 34 Voie métabolique de phénanthrène chez
Pseudomonas (Cerniglia, 1984). 36 Voie métabolique du pyrène proposée chez
Rhodococcus sp. UWl. I, pyrène; IIa, 1,2-dihydroxy-pyrène; IIb, 4,5-dihydroxypyrène; IIIa, acide cis-2-hydroxy-3-(périnaphtè-none)-propénique; IIIb, acide
2-hydroxy-2-(phénanthren-5-one-4-enyl)-acétique; IVa,b, métabolite I.
(Walter et al., 1991). 38
Cinétique d'enlèvement en milieux liquides du fluorène (a) et du phénanthrène (b) par la microflore indigène en erlenmeyers de
500 mL. 84
Cinétique d'enlèvement en milieux liquides du pyrène (a) et du chrysène (b) par la microflore indigène en erlenmeyers de
Figure 9. Figure 10. Figure 11. Figure 12. Figure 13. Figure 14. Figure 15. Figure 16. Figure 17.
Courbe de croissance en milieux liquides de la population bactérienne totale et celle dégradant potentiellement le phénanthrène
en erlenrneyers de 500 mL. 87
cinétique d'enlèvement en milieux liquides du fluorène (a) et du phénanthrène (b) par la microflore indigène en erlenmeyers
de 250 mL. 90
courbe de croissance en milieux liquides de la population bactérienne totale et celle dégradant potentiellement le phénanthrène
en erlenmeyers de 250 mL. 92 Cinétique d'enlèvement en milieux liquides du fluorène (a) et du phénanthrène (b) par la microflore indigène en erlenmeyers
de 250 mL. 93
Cinétique d'enlèvement en milieux liquides du fluorène {a) et du phénanthrène {b) par la microflore indigène en erlenmeyers
de 250 mL. 94
Cinétique d'enlèvement en milieux liquides du fluorène {a) et du phénanthrène (b) par la microflore indigène inoculée selon la procédure modifiée en erlenmeyers
de 250 mL. 96
Cinétique d'enlèvement en milieu liquide BHEL.5 du fluorène (a) et du phénanthrène
(b) par la microflore indigène à diffé-rentes concentrations initiales de
bactéries totales. 98
Cinétique d'enlèvement en milieu liquide BHEL.5 du pyrène par la microflore
indigène à différentes concentrations
initiales de bactéries totales. 99 Microscopie électronique de la souche
Alcaligenes sp. en coloration négative.
Figure 18. Figure 19. Figure 20. Figure 21. Figure 22. Figure 23. Figure 24. Figure 25.
Cinétique d'enlèvement en microcosmes du fluorène (a) et du phénanthrène (b), sous
viii
agitation à 300 rpm une fois par jour. 110 Chromatogrammes obtenus en chromatographie en phase gazeuse à partir de l'éther
d'extraction de microcosmes en milieu BH après zéro (a) et 60 (b) jours
d'incubation. 113
Cinétique d'enlèvement en microcosmes du fluorène (a) et du phénanthrène (b), sous agitation à 300 rpm quatre fois par jour
(sauf indications contraires). 115 Cinétique d'enlèvement en microcosmes du
pyrène (a) et du chrysène (b), sous
agitation à 300 rpm quatre fois par jour
(sauf indications contraires). 117 cinétique d'enlèvement en microcosmes du
fluorène (a) et du phénanthrène (b), sous
agitation à 300 rpm quatre fois par jour. 118 Cinétique d'enlèvement en microcosmes du
pyrène sous agitation à 300 rpm quatre
fois par jour. 119
Cinétique d'enlèvement en microcosmes du phénanthrène (a) et courbe de croissance de la population bactérienne totale et de celle dégradant potentiellement le phénan-thrène (b) en milieu BHEL.5 sous agitation à 300 rpm quatre fois par jour. 121
Production de
co
2 marqué (14c)
et pourcen-tage résiduel du fluorène (a), du phénan-thrène (b) et du pyrène (c), en microcosmes contenant le milieu BHEL.5. 123AM BH BH 0.025 BHALEL.1 BHEL.l BHEL.25 BHEL.S
LISTE DES ABRÉVIATIONS
Amidon
Milieu Bushnell-Haas
Milieu BH solide supplémenté de 0.025% (p/v) de protéose peptone, d'extrait de levures et d'amidon. Milieu BH supplémenté d'alcanes (AL) (300 ppm) et de
O.l%(p/v) d'extrait de levures (EL).
Milieu BH supplémenté de 0.1% (p/V) d'extrait de levures.
Milieu BH supplémenté de 0.25% (p/V) d'extrait de levures.
Milieu BH supplémenté de 0.5% (p/v) d'extrait de levures.
BHLIS.2 : Milieu BH supplémenté de 0.2% (v/v) de lisier de porc.
BHLISl Milieu BH supplémenté de 1.0% (v/v) de lisier de porc.
BHSAL Milieu BH supplémenté de salicylate (100ppm).
BHTWEL.l Milieu BH supplémenté de Tween 80 (TW) (200 ppm) et de 0.1% (p/V) d'extrait de levures.
BHVITMIN Milieu BH supplémenté d'un mélange de vitamines (VIT) et de minéraux (MIN).
CMC Concentration critique des micelles CPM Coups par minute
EL Extrait de levures
HAM Hydrocarbure aromatique monocyclique HAP Hydrocarbure aromatique polycyclique
PCA pp
Plate Count Agar Protéose peptone
SOMMAIRE
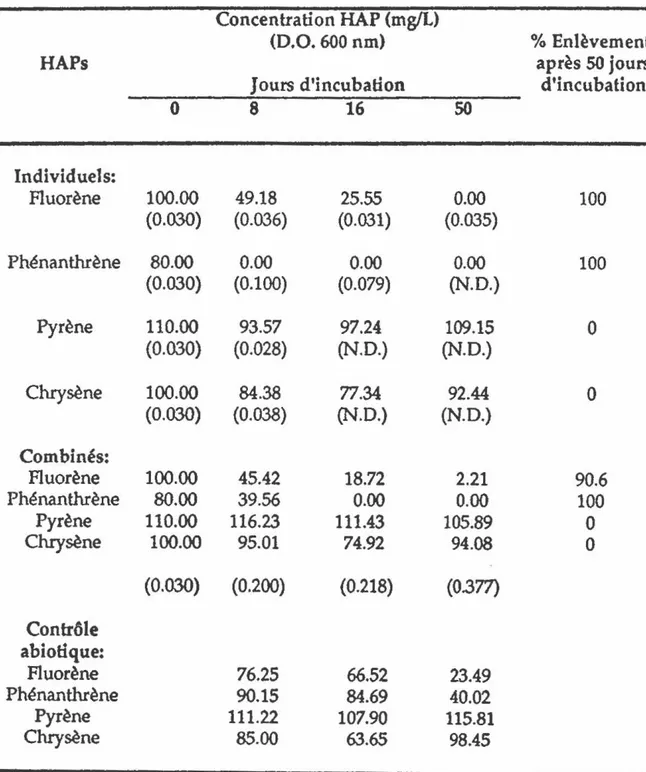
Suite à la caractérisation chimique et microbiologique du sol de la Sablière Thouin, la microflore indigène a été récupérée suivant une première méthode pour être ensuite inoculée en milieu liquide BH en présence des quatre HAPs fluorène, phénanthrène, pyrène et chrysène à raison de 100 mg/L chacun. Des pourcentages d'enlèvement significatifs ont été obtenus sous ces conditions pour les HAPs légers fluorène (85%) et phénanthrène (90%) après 16 jours d'incubation, mais aucun enlèvement significatif des HAPs lourds (pyrène et chrysène) n'a été obtenu. Le milieu liquide BH supplémenté d'extrait de levures à
o. 5% (p/v) a permis d'obtenir un enlèvement plus
rapide du fluorène et du phénanthrène. Le suivi de la population bactérienne totale a été effectué sur ces cultures et a démontré une population plus élevée lorsque le milieu BH était supplémenté d'extrait de levures (109 à comparer à 107 UFC/mL) qu'en milieu BH. Des résultats semblables ont été obtenus pour la population bactérienne dégradant potentiellement le phénanthrène. De plus, la concentration d'extrait de levures a pu être réduite à des valeurs en-dessous de 0.5% (p/v), à condition que du surfactant Tween (200 ppm) ou un mélange d'alcanes (300 ppm) soit ajouté au milieu. L'ajout de lisier de porc a permis d'obtenir des résultats comparablesxii à ceux obtenus avec l'ajout d'extrait de levures.
Une modification de la méthode de récupération des microorganismes a été effectuée, de sorte à obtenir un inoculum plus important et plus représentatif. Cette modification a permis l'enlèvement d'un HAP lourd, soit le pyrène. Des résultats semblables ont été obtenus avec l'inoculation d'une plus forte concentration de bactéries indigènes, soit 106 UFC/mL.
Une souche bactérienne indigène du sol a été isolée à partir d'une culture liquide en milieu BH et a démontré la capacité de former un halo et;ou une coloration typique de la présence d'intermédiaires en présence de plusieurs HAPs soit le fluorène, le phénanthrène, le pyrène, l'acénaphtylène, le dibenzofurane, le dibenzothiophène, l'anthracène, le fluoranthène, le biphényl, le naphtalène et le benzanthracène. Son activité d'enlèvement du fluorène et du phénanthrène a été confirmé en milieu liquide BH avec ces HAPs comme seule source de carbones. Par contre, 1' inoculation de cette souche en microcosmes n'a pas permis d'optimiser l'enlèvement des HAPs.
La recherche d'intermédiaires de dégradation du fluorène et du phénanthrène a été effectuée en milieu liquide BH supplérnenté de 0.5% (p/v) d'extrait de levures et inoculés avec
la microflore indigène. Cependant, aucun intermédiaire potentiel n'a été identifié suite à ces expériences.
En microcosmes, la microflore indigène du sol est capable de dégrader presqu'entièrement le fluorène et le phénanthrène, après 30 jours d'incubation avec une agitation quotidienne à 300 rpm pendant 5 minutes. Sous ces conditions, le pyrène et le chrysène ont été enlevés à 60 et 33%, respectivement, après 60 jours d'incubation. Une augmentation du pourcentage d'enlèvement des quatre HAPs a été observée en microcosmes contenant le milieu BH et agités quatre fois par jours à 300
rpm pendant 5 minutes.
Cependant, l'ajout d'extrait de levures à 0.5% (pjv) au milieu BH en microcosmes a ralenti, voir même complètement inhibé, l'enlèvement du fluorène, du pyrène et du chrysène. De plus, ce ralentissement a été proportionnel à la concentration d'extrait de levures ajoutée. Toutefois, l'extrait de levures n'a pas influencé l'enlèvement du phénanthrène de façon significative. L'ajout de lisier de porc (1% (vjv)), de Tween 80 (200 ppm) ou de salicylate (100 ppm), n'a pas permis d'optimiser l'enlèvement des HAPs en microcosmes.
Le remplacement du milieu BH par de l'eau distillée dans un sol avec le rapport
c:
N ajusté à 100: 10, a permis dexiv démontrer que les éléments présents dans ce milieu ne sont pas essentiels pour l'enlèvement du fluorène et du phénanthrène, mais qu'ils le sont pour l'enlèvement du pyrène et du chrysène. La réduction du volume de milieu BH (double concentration) à 12 mL au lieu de 27 mL a conduit à l'inhibition quasi complète de
l'enlèvement des quatre HAPs à l'étude.
Le suivi de la population bactérienne totale et de celle dégradant potentiellement le phénanthrène en microcosmes contenant le milieu BH supplémenté de 0.5% (p/v) d'extrait de levures, a été effectué. Les résultats obtenus, après 30 jours d'incubation, indiquent une augmentation de la population totale de 105 à 107 UFC/g, en plus d'un enrichissement de la population dégradant le phénanthrène, qui est passée de 19 à 40% de la population totale.
Des microcosmes ont été incubés en présence des HAPs fluorène, phénanthrène ou pyrène, marqués radioactivement au carbone 14. Ces expériences ont permis de démontrer une minéralisation de ces HAPs jusqu'au
co
2 , après 30 ou 60 jours d'incubation. Toutefois, cette minéralisation a été beaucoup moins intense pour le pyrène.2 La contamination d'un sol cause de graves problèmes à l'écosystème dont il fait partie. Le biotraitement est maintenant reconnu parmi les procédés de restauration de ces sols contaminés. Le biotraitement est en fait la stimulation des microorganismes indigènes dégradant les composés xénobiotiques (Bourquin, 1990). Sans cette stimulation, le temps nécessaire pour obtenir une biodégradation efficace peut être long. Le but du biotraitement est donc de réduire la durée de cette période en optimisant les paramètres (Morgan et Watkinson, 1989) •
Les composés les plus importants dans la contamination des sols sont les hydrocarbures (Anonyme, 1990). Les hydrocarbures forment une famille de composés comprenant, entre autres, les hydrocarbures aromatiques polycycliques ou HAPs. Les HAPs sont en général des composés très toxiques, avec des propriétés cancérigènes et mutagènes (Cerniglia, 1993; Jacob et al., 1986; Miller et Miller, 1981). De par leur composition chimique, les HAPs sont d'autant plus récalcitrants que le nombre de noyaux aromatiques est élevé (Leahy et Colwell, 1990). Même si plusieurs microorganismes sont capables de dégrader les HAPs, leur taux de biodégradation dans le sol est lent (Manilal et Alexander, 1991; Jones et al., 1989; Bossert gt al., 1984). Ce
faible taux de dégradation dans le sol suggère que l'activité microbienne y est restreinte. Cependant, peu d'informations
sont connues sur ce sujet et les résultats rapportés dans la littérature sont parfois contradictoires. Il semble que plusieurs facteurs peuvent affecter le rendement d'un biotraitement, et il est évident que mieux connaître les microorganismes impliqués dans ce processus ainsi que leurs besoins, est essentiel.
La littérature rapporte quelques microorganismes, par exemple le genre Pseudomonas, capables d'utiliser les HAPs comme le fluorène et le phénanthrène. Par contre, ces microorganismes sont souvent incapables de dégrader un mélange complexe de polluants tel que l'on en retrouve dans les sols contaminés (Cutright et Sunggyu, 1994). Étant donné que les produits de dégradation des HAPs d'un microorganisme peuvent servir de source de carbone et d'énergie pour un autre grâce au co-métabolisme ou la complémentarité des voies métaboliques, l'usage de cultures mixtes est un avantage (Cutright et Sunggyu, 1994).
L'optimisation de la biodégradation des HAPs peut se faire par l'intermédiaire de plusieurs paramètres, incluant l'humidité, le pH, l'oxygène et l'ajout de nutriments ou de microorganismes adaptés (Brodkorb et Legge, 1992; sims, 1990). Parmi les nutriments utilisés, on retrouve l'extrait de levures, le protéose peptone et le glucose (Keuth et Rehm,
4 1991). A notre connaissance, aucune étude ne rapporte l'utilisation de lisier de porc comme source d'azote afin de rendre le rapport C:N favorable aux microorganismes et ainsi optimiser la biodégradation des HAPs.
L'utilisation de microcosmes sol, c'est-à-dire de modèles miniatures de bioréacteurs, est importante afin de mieux évaluer les rendements préliminaires obtenus par inoculation en milieux liquides de la microflore indigène récupérée du sol. En effet, il est reconnu que la capacité de dégradation en sol peut être différente de celle obtenue en culture liquide (Manilal et Alexander, 1991). Le suivi de la population microbienne totale et de celle dégradant potentiellement les HAPs est aussi importante. A notre connaissance, aucune étude ne rapporte un suivi détaillé d'une population microbienne mixte en sol conjointement à une étude de dégradation d'un mélange d'HAPs.
Dans ce travail, l'objectif principal était d'optimiser la dégradation aérobie des HAPs par la microflore indigène d'un sol contaminé par des hydrocarbures, en l'occurence celui de la Sablière Thouin. L'étude des différents paramètres a été effectuée dans l'optique de pouvoir transposer nos connaissances à un éventuel traitement par biopile. Dans un premier temps, nous avons effectuer une caractérisation
chimique et microbiologique du sol de la sablière Thouin. La microflore indigène a ensuite été récupérée pour être inoculée dans différents milieux liquides. A partir d'une de ces cultures, une souche bactérienne a été isolée et son potentiel de dégradation des HAPs a été déterminé. La recherche d'intermédiaires de dégradation de certains HAPs a aussi été effectuée en milieu liquide. Finalement, des microcosmes ont été utilisés sous différentes conditions se rapprochant des conditions retrouvées dans les biotraitements de sols à grande échelle. L'acquisition de connaissances concernant la biodégradation des HAPs est indispensable pour le développement éventuel d'un biotraitement optimal.
#
1. CONTAMINATION DES SOLS 1.1 sources de contamination
L'origine de la contamination des sols est multiple. La production de déchets, l'activité industrielle, comme par exemple les industries pétrolières et de pâtes et papiers, l'épandage de pesticides et le déversement de diverses substances
pollution. complique
dangeureuses sont des sources importantes de De plus, l'intensification de l'activité humaine la situation. Différents polluants sont ainsi répertoriés dans les sols contaminés tels des métaux, des composés phénolés, des pesticides, des composés aromatiques monocycliques volatils, des hydrocarbures chlorés et des hydrocarbures aromatiques polycycliques (Anonyme, 1988).
1.2 contamination par les hydrocarbures.
Chaque année, des quantités importantes de pétrole et de produits pétroliers sont déversées
l'environnement. La contamination
accidentellement des sols par
dans les hydrocarbures peut aussi résulter du raffinement, du transport et de l'entreposage du pétrole (Anonyme, 1990; Heitkamp, 1987;
Bossert et al., 1984). En 1993, le Ministère de l'Environnement et de la Faune du Québec {MEF) répertoriait plus de BOO terrains contaminés dont 60% par des hydrocarbures (Samson, 1994a). Parmi les classes d'hydrocarbures, les hydrocarbures aromatiques polycycliques {HAP) sont les principaux
8 contaminants et ce, dans les 2/3 de ces sites. Récemment, le Ministère des Ressources Naturelles évaluait à plus de 50 000
le nombre de réservoirs enfouis au Québec; plus du tiers d'entre-eux laisseraient échapper des hydrocarbures (Samson,
1994a). Les hydrocarbures représentent donc la source la plus importante de contamination des sols. Des cas de sols contaminés par les hydrocarbures ont aussi été signalés dans le Grand Nord Québécois (Anonyme, 1990).
2. HYDROCARBURES. 2.1 Généralités
Les hydrocarbures représentent un ensemble de composés regroupés en quatre classes: les aliphatiques, les asphaltènes, les résines et les aromatiques (Leahy et Colwell, 1990; Walker et Colwell, 1976). Les aliphatiques sont des composés à longues chaînes de carbones linéaires, ramifiés ou cycliques et sont considérés èomme les composés les plus rapidement éliminés par les microorganismes (Atlas, 1981). Les asphaltènes sont des composés à longues chaine de carbones de haut poids moléculaire. Ils regroupent des acides carboxyliques, des cétones, des esters et des porphyrines. Ils sont considérés comme étant plus récalcitrants à 1 'attaque microbienne. Les résines regroupent entre autres des pyridines, des sulfoxides et des amides (Walker et Colwell, 1976).
Les hydrocarbures aromatiques sont caractérisés par la présence de un ou plusieurs noyaux aromatiques. On parle d'hydrocarbures aromatiques monocycliques lorsqu'il n'y a qu'un seul noyau et de polycycliques ou HAPs lorsqu'il y a 2 noyaux et plus. Ils peuvent être disposés de façon linéaire, en angle ou en amas (Figure 1) (Wilson et Jones, 1993; Cerniglia, 1992; Cerniglia, 1984; Sims et Overcash, 1983). Ils peuvent aussi contenir des substituants alkylés et azotés ou être considérés comme des molécules hétérocycliques par la substitution d'un atome de carbone dans le noyau aromatique par un azote, un oxygène ou un soufre. (Cerniglia, 1984).
Le nombre de noyaux aromatiques permet de les classer en deux sous-groupes soit les HAPs légers de trois noyaux aromatiques et moins, et les HAPs lourds de quatre noyaux aromatiques et plus.
2.2 Hydrocarbures aromatiques polycycliques
Les HAPs sont des composés universels résultant de la combustion de la matière organique (Cerniglia, 1984) mais aussi de différents procédés industriels. Les principales sources d'HAPs sont donc les feux de forêts et de prairies, les cendres volcaniques 1 les émissions des moteurs des véhicules 1 les rejets industriels tels que les effluents des industries pétrochimiques, le pétrole brut, la pollution urbaine, la fumée
00
Naphthalène PhénanthrènePyrène
Benzo( s]pyrène J'igure 1. 10 Aœnaphthy1ène Fluorène Anthracène Fluoranthène Benz(s]anthracàne Oibenz(a]anthracèneCoronène
Structures chimiques de quelques HAPs (Wilson et Jones, 1993).
de tabac et de cigarettes, la nourriture fumée ou cuite sur charbon, 1' incinération des déchets,
préservatifs du bois ainsi que
le créosote et autres la transformation, l'entreposage, la combustion et le déversement accidentel du pétrole (Wilson et Jones, 1993; Cerniglia, 1992; Heitkamp, 1987; Cerniglia, 1984; Sims et Overcash, 1983; LaFlamme et Hites, 1978; Giger et Blumer, 1974).
Avec 1 'augmentation de 1 'utilisation du charbon et des hydrocarbures par l'homme, les concentrations de ces composés dans l'environnement - spécifiquement les HAPs de trois à cinq noyaux - ont augmenté. Les hydrocarbures sont maintenant considérés comme des polluants communs (Grosser et al., 1995).
Les HAPs sont des composés hydrophobes qui ont tendance à s'accumuler dans l'environnement (Cerniglia, 1992; Heitkamp, 1987; MacKay et Shiu, 1977). De plus, plusieurs HAPs sont génotoxiques, cancérigènes et possèdent des capacités mutagènes (Cerniglia, 1993; Jacob et~., 1986; Miller et Miller, 1981). Ces caractéristiques s'amplifient avec l'augmentation du nombre de noyaux aromatiques, principalement pour ceux ayant quatre cycles aromatiques et plus (Cerniglia, 1992) . Ceci explique la présence des HAPs sur la liste des polluants prioritaires dans "The Canadian Environmental Protection Act (CEPA)" et dans "l'U.S. Environmental Protection Agency" (Meek et al., 1994).
12 Une fois dans l'environnement, les HAPs peuvent être altérés par la volatilisation, la photooxidation, l'oxydation chimique, la bioaccumulation, l'adsorption à la matière organique du sol et la biodégradation (Cerniglia, 1992). La biodégradation est basée sur la capacité des microorganismes d'utiliser les xénobiotiques comme source de carbone et d'énergie (Murray et al., 1994; Lewis, 1993; Atlas, 1990). Elle est reconnue comme étant le processus clé de la dégradation des HAPs dans l'environnement (Cerniglia, 1992; Atlas, 1990). Dans la présente étude, nous nous sommes intéressés spécifiquement à la biodégradation des HAPs.
3. NORMES
Le MEF a établi des critères indicatifs de contamination des sols. Ces critères portent sur la concentration des métaux, des polluants minéraux, des pesticides, des huiles et graisses, des composés aromatiques monocycliques volatils, des composés phénoliques, des hydrocarbures chlorés et des hydrocarbures aromatiques polycycliques • Ces critères permettent de classer les sols sous les valeurs-seuils A, B et
c,
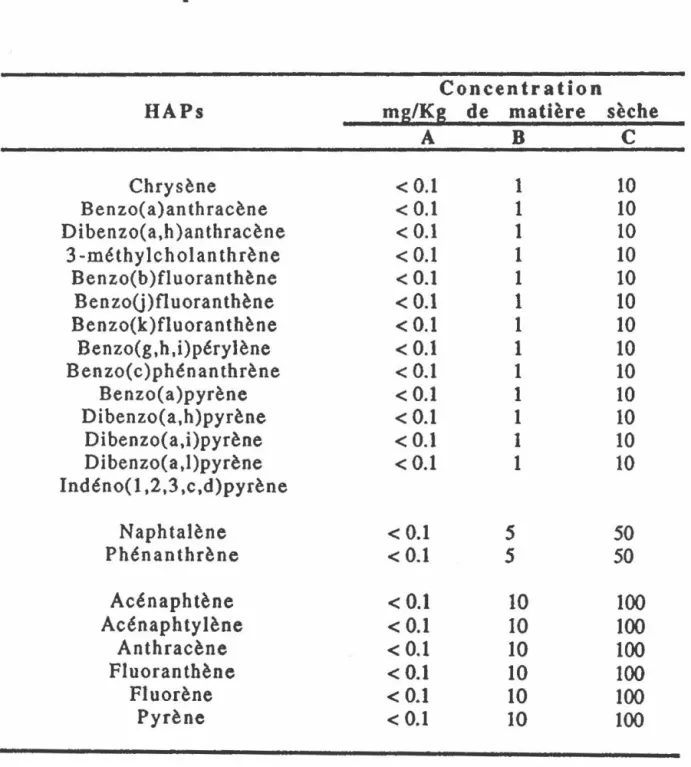
et ainsi déterminer trois plages d'intervention A-B, B-C etC (Anonyme, 1988).Le Tableau 1 représente la grille des critères indicatifs pour les HAPs et illustre les valeurs-seuils A, B et
c
pour ce type de composés. Les concentrations pour le seuil A sont lesTableau 1 Critères indicatifs de la contamination des sols pour les HAPs.
Concentration
HAPs mg/Kg
de
matière sècheA B
c
Chrysène < 0.1 1 10 Benzo(a)anthracène < 0.1 1 10 Dibenzo(a,h)anthracène < 0.1 1 10 3 -méthylcholan thrène < 0.1 1 10 Benzo(b)fluoranthène < 0.1 1 10 Benzo(j)fluoranthène < 0.1 1 10 Benzo(k)fluoranthène < 0.1 1 10 Benzo(g,h,i)pérylène < 0.1 1 10 Benzo(c)phénanthrène < 0.1 1 10 Benzo(a)pyrène <0.1 1 10 Dibenzo(a,h)pyrène < 0.1 1 10 Dibenzo(a,i)pyrène <0.1 1 10 Dibenzo(a,l)pyrène < 0.1 1 10 lndéno( 1,2,3 ,c,d)pyrène Naphtalène < 0.15
50
Phénanthrène < 0.15
50
Acénaphtène < 0.1 10 100 Acénaphtylène < 0.1 10 100 Anthracène < 0.1 10 100 Fluoranthène < 0.1 10 100 F1uorène < 0.1 10 100 Pyrène < 0.1 10 100 (Anonyme, 1988)14 plus faibles, soit inférieures à 0.1 ppm, et elles atteignent les valeurs les plus élevées, soit de 10 à 100 ppm, pour le seuil
c.
La plage A-B regroupe des sols faiblement contaminés où des travaux de décontamination ne seront pas nécessaires. Ces sols peuvent convenir à des constructions de type résidentiel. La plage B-C regroupe des sols contaminés qui feront l'objet de travaux de décontamination seulement s'il y a un impact des contaminants sur la nappe phréatique (Anonyme, 1988) • Ces sols peuvent être utilisés tels quels pour des usages industriels ou commerciaux. Finalement, la plagec
regroupe des sols qui sont plus fortement contaminés et où tous les usages y sont restreints, c'est-à-dire qu'ils devront obligatoirement être décontaminés avant d'être utilisés.4. TRAITEMENTS BIOLOGIQUES DES SOLS
Les composés xénobiotiques et toxiques que l'on croyait résistants à l'attaque microbienne et aux processus naturels sont maintenant reconnus comme étant biodégradables depuis plusieurs années. L'intérêt de procéder à un biotraitement des sols contaminés a, du même coup, beaucoup augmenté. Les biotraitements, contrairement aux traitements physiques et chimiques, sont économiques et surtout respectueux envers l'écosystème déjà en place. Ils offrent donc une solution permanente en transformant les polluants en composés moins toxiques, pouvant aller jusqu'à leur minéralisation complète en
co
2 et H2o
(dégradation aérobie) et parfois en CH4 {dégradation anaérobie) (Providenti et al., 1993; Morgan et Watkinson,1989).seulement aux États-Unis, une centaine de sites contaminés font l'objet de projets de biotraitement. Au Québec, la politique de réhabilitation des terrains contaminés favorise les solutions définitives, c'est-à-dire qui permettent l'élimination du contaminant (Anonyme, 1990). Cependant, la complexité d'un mélange de polluants peut affecter le rendement du biotraitement.
Les procédés biologiques de décontamination peuvent s'appliquer ex situ et in situ. Les technologies in situ sont utilisées sur le site même, c'est-à-dire sans aucune excavation, tandis que les technologies ex situ nécessitent l'excavation des sols. Dans ce cas, le biotraitement peut avoir lieu sur le site même ou ailleurs (Samson, 1994a).
4.1 Traitements in situ
Les biotechnologies in situ doivent nécessairement être utilisées lorsqu'il y a risques de contamination de la nappe phréatique ou lorsqu'il est impossible d'excaver le sol. Les traitements possibles peuvent se faire en milieu saturé d'eau, en milieu sec ou par percolation • Étant donné que ce type de biotraitements n'est pas le propos de ce travail, nous nous
16 contenterons de suggérer les références sui vantes : Samson (1994a), Wilson et Jones (1993), Morgan et Watkinson (1992, 1990, 1989) et Siros (1990).
4.2 Traitements ex situ
Il y a cinq principaux traitements ex situ, soit l'épendage contrôlé, la bioventilation, les bioréacteurs de type "boues activées", les bioréacteurs à sol statique et le traitement en biopiles (Samson, 1994b).
L'épendage contrôlé consiste à étendre le sol contaminé sur une surface imperméable et de favoriser 1 'activité des microorganismes présents dans le sol par l'ajout de nutriments
(azote et phosphore). Le sol est aéré par mélange mécanique.
La bioventilation sert à extraire les hydrocarbures légers de sols contaminés par aspiration d'air à travers la pile et à les acheminer par la suite à un biofiltre (ex. :tourbe ou compost) où se produisent les réactions de biodégradation.
Les bioréacteurs avec boues activées utilisent le sol contaminé mélangé à l'eau dans des bassins. Différents éléments y sont ajoutés (ex.: o2 , nutriments, agents tensioactifs). Cependant, ce type de biotraitement produit beaucoup d'effluents qu'il faut traiter par la suite, ce qui augmente
son coftt d'opération.
Les bioréacteurs à sol statique ne contiennent pas de phases liquides. Ce sont des contenants rotatifs où le sol est amendé de nutriments et d'agents structurants (brans de scie, tourbe, etc ••• ) pour réduire l'agglomération des particules. L'humidité est aussi contrôlée. Cette technologie est coûteuse et surtout utilisée en Europe. Cependant, elle a 1 1 avantage
d'être utile en climats nordiques car on peut contrôler la température.
Le traitement en biopile est simplement la mise en pile du sol excavé sur une surface imperméable. L'aération se fait en aspirant l'air à travers le sol. L'eau et les nutriments sont ajoutés par arrosage. La Figure 2 illustre les différents éléments impliqués dans la formation d'une biopile. Le traitement par biopile est le moins coûteux et il est relativement efficace. Cependant, les limitations de cette méthode font que 1 1 obtention de concentrations d' HAPs
rencontrant les normes en vigueur demandent un temps significativement plus long. L'optimisation de la biodégradation des HAPs, particulièrement les HAPs lourds, devient èssentielle afin de rendre la méthode par biopile plus compétitive. L'étude en laboratoire que nous avons effectuée avait comme objectif de préciser certains paramètres
t
Filtre
J'igure 2.
Sol
+
support
inerte
ou organique
---
---
-Max
1.5m
Copeaux
+-de
bois
schéma représentatif d'un traitement en biopile (Samson, 1994b).
l - ' 0>
applicables à un traitement en biopile afin de permettre une dégradation optimale des HAPs.
5.0 MICROORGANISMES DÉGRADANT LES HYDROCARBURES 5.1 Généralités
Le biotraitement d'un sol contaminé est basé sur la capacité des microorganismes du sol à utiliser les polluants comme source de carbone et d'énergie. Parfois certains microorganismes peuvent procéder par co-métabolisme, c'est-à-dire que certains composés ne sont métabolisés qu'en présence d'autres sources de carbone. Ces réactions co-métaboliques sont dues à l'attaque de ces molécules par des enzymes de faible spécificité. Certains auteurs ont aussi démontré une acclimatation croisée, c'est-à-dire que l'exposition à un composé entraine un accroissement du métabolisme envers un autre composé (Bauer et Capone, 1988; Kerr et Capone, 1988).
La population microbienne influence directement le succès d'un biotraitement d'un sol contaminé par les HAPs. La proportion des microorganismes capables d'utiliser les HAPs varie d'un sol à l'autre dépendamment des sources de carbones disponibles et des propriétés physico-chimiques de ce sol. La proportion de la population microbienne métaboliquement active dans un sol est relativement faible. Les bactéries constituent les principaux microorganismes actifs. Pour la population
20 totale, des valeurs de 106 à 109 bactéries par gramme de sol sont fréquemment observées (Kerry, 1993; Morgan et Watkinson, 1989). La proportion de bactéries dégradant les hydrocarbures varie selon les conditions du sol et se situe générallement à des valeurs entre 5 et 50% de la population totale (Grosser et al., 1995; Bogardt et Hemmingsen, 1992; Oudot et~., 1987)
La proportion et la diversité des microorganismes utilisant les hydrocarbures par rapport à la flore indigène peuvent augmenter sui te à la contamination du sol par des hydrocarbures. On rapporte dans plusieurs études que la microflore indigène a la capacité de s'adapter et ainsi d'augmenter son potentiel de dégradation des hydrocarbures
(Tabak et al., 1991; Leahy et Colwell, 1990; Spain et
u
.
,
1980). La proportion de microorganismes utilisant les hydrocarbures reflète donc généralement le degré de contamination d'un écosystème.Les bactéries, les cyanobactéries, les algues et les champignons jouent un rôle important dans le métabolisme des hydrocarbures dans les sols et les environnements aquatiques (Cerniglia, 1984). Cependant, peu d'études relatent l'étendue de la participation de chacun de ces groupes dans la biodégradation des hydrocarbures. Les variations sont dues aux différents écosystèmes et à l'environnement local. Il est
reconnu, par contre, que les hydrocarbures sont dégradés majoritairement par les bactéries et les champignons (Leahy et Colwell, 1990). Les champignons semble~aient être plus efficaces dans la dégradation des hydrocarbures car ils s'adaptent mieux aux conditions extrêmes de pH et de déficience en eau et en nutriments que l'on retrouve souvent dans le sol. De plus, des valeurs de pH acide sélectionnent les champignons mais, sous des conditions plus neutres, la contamination en hydrocarbures favorise la croissance bactérienne (Morgan et Watkinson, 1989).
Dans le sol, les genres bactériens les plus importants sont Alcaligenes, Pseudomonas, Arthrobacter, Nocardia, Acinetobacter, Corynebacterium, Flavobacterium et Mycobacterium
{Cerniglia, 1993; Leahy et Colwell, 1990; Atlas, 1981). Dans le cas des champigons dégradant les hydrocarbures, ce sont les genres Trichoderma, Mortierella, Aspergillus, Penicillium, Phanerochaete et Cunninghamella que 1 'on retrouve le plus
fréquemment (Barr et Aust, 1994; Brodkorb et Legge, 1992; Leahy et Colwell, 1990; Atlas, 1981). Des levures telles que Candida
et Rhodotorula ont aussi été identifiées (Leahy et Colwell,
5.2 Microorganismes dégradant les HAPs 5.2.1 Biodégradation des HAPs
22
Généralement, le taux de dégradation des HAPs est inversement proportionnel au nombre de noyaux aromatiques (Cerniglia, 1992). L'isolement de microorganismes dégradant des HAPs légers tel que le naphtalène, le phénanthrène et l'acénaphtène, de même que les voies métaboliques utilisées ont été rapportés (Cerniglia, 1992; Pothuluri et al., 1986; Cerniglia, 1984; Gibson et Subramanian, 1984; Shocken et Gibson, 1984). Par contre, il y a peu d'informations sur les microorganismes capables de métaboliser les HAPs de hauts poids moléculaires comme le chrysène, le pyrène et le benzopyrène (Kelley et Cerniglia, 1991; Walter et al., 1991; Mueller et al., 1990; Weissenfels et al., 1990,1991; Heitkamp et Cerniglia, 1988a,1989; Heitkamp et al., 1988; Barnsley, 1975). La liste des genres et des espèces bactériennes qui ont été isolées pour quelques HAPs est présentée au Tableau 2. La différence de la dégradabilité des HAPs lourds et légers est réflétée par le nombre d'espèces bactériennes isolées pour ces deux types de HAPs. Par exemple, leur nombre est de beaucoup inférieur pour le pyrène et le chrysène, qui sont deux HAPs plus résistants à l'attaque microbienne, par rapport au naphtalène qui n'a que deux noyaux aromatiques (Cerniglia, 1992).
Tableau
2:
Hydrocarbures aromatiques polycycliques oxidés par différentes espèces bactériennes.Composés
Phénanthrène Fluoranthène Pyrène Chrysène (Cerniglia, 1992)Organismes
Aeromonas sp., Alcaligenes faecalis, Alcaligenes denitrificans. Arthrobacter polychromogenes, Beijerinckia sp., Micrococcus sp., Mycobacterium sp., Pseudomonas putida, Pseudomonas paucimobilis, Rhodococcus sp., Vibrio sp., Nocardia sp., Flavobacterium sp., Streptomyces sp., Streptomyces griseus, Acinetobacter s p. Alcaligenes denitrificans, Mycobacterium sp .• Pseudomonas putida, Pseudomonas paucimobilis, Pseudomonas capacia, Rhodococcus sp., Pseudomonas sp. Alcaligenes denitrificans, Mycobacterium sp., Rhodococcus sp. Rhodococcus sp.Références
Kiyohara "'-.a.L. 1976,1982,1990; Weissenfels ~a.t.
1990,1991; Keuth et Rehm 1991: Jerina tl.a.l. 1976; Colla~ru,. 1959; West ~al. 1984; Kiyohara et Nagao 1978; Heitkamp et Cerniglia 1988a;
Guerin et Jones 1988,1989; Treccani k.1
at.
1965; Foght et Westlake 1988; Mueller ~al. 1990; Sutherland ~al.. 1990; Ghosh et Mishra 1983; Savinoet Lollini 1977; Trower ~al.
1988; Barnsley 1983
Kelley et Cerniglia 1991; Walter ~il. 1991; Weissenfels
tl .al. 1991 ; Fo ght et W es tl ake 1988; Mueller ~Al. 1989,1990
Heitkamp ~ru.. 1988; Walter t.La!. 1991; Weissenfels ~.al.
1991 ; Grosser t.L al. 1991
24 Beaucoup d'études en laboratoire sur la biodégradation des HAPs ont utilisé des composés purs pour minimiser le nombre de variables. Peu de choses sont connues à propos de l'effet d'un HAP sur la biodégradabilité d'un autre. Cela est d'autant plus important étant donné que les HAPs existent sous forme de mélanges complexes dans les environnements contaminés (Tiehm et Fritzsche, 1995). L'utilisation d'un HAP comme substrat pour la croissance en présence d'autres HAPs a été rapportée chez quelques microorganismes (Boldrin et al., 1993; Weissenfels et ll·, 1990}.
La compétition métabolique entre différents HAPs chez des souches de Pseudomonas suggère que ce phénomène serait commun chez plusieurs microorganismes (Stringfellow et Aitken, 1994}. Quand le fluorène, le phénanthrène et le pyrène sont ensemble dans une cul ture pure de Mycobacterium sp. , une dégradation simultanée se produit (Tiehm et Fritzsche, 1995). Cependant, cette dégradation se fait selon des cinétiques différentes par rapport aux HAPs étudiés individuellement. De plus, dans le sol, un HAP de haut poids moléculaire est plus résistant à la dégradation quand il est seul plutôt que dans un mélange complexe de composés (Sims, 1990).
Jusqu'à présent, la dégradation des HAPs a principalement été étudiée en conditions aérobies. L'oxygène moléculaire sert
non seulement d'accepteur d'électrons mais est aussi incorporé au cycle aromatique. Cependant, la biodégradation des HAPs sous des conditions anoxiques ou anaérobiques retient de plus en plus l'attention car plusieurs environnements pollués contiennent peu d'oxygène et les processus aérobies y sont alors inhibés (Leahy et Colwell, 1990}. La biodégradation des HAPs peut survenir en conditions dénitrifiantes, comme l'ont démontré Mihelcic et Luthy (1988) avec le naphtalène et l'acénaphtène.
La revue de littérature portera entièrement sur la biodégradation aérobie car notre étude a été effectuée sous ces conditions.
5.2.2 Isolement
Étant donné que dans notre projet intéressés principalement à la flore rapporterons dans les lignes suivantes
nous nous sommes bactérienne, nous les connaissances concernant ces microorganismes. L'isolement de la flore bactérienne dégradant les HAPs peut se faire de différentes façons. Certains auteurs utilisent une technique d'enrichissement en milieu liquide pour sélectionner, parmi la microflore indigène, les microorganismes dégradant les HAPs. Ceci est dû au fait que ces microorganismes ne sont généralement pas dominants dans le sol. De plus, plusieurs de
26 ces microorganismes isolés du sol sont à croissance lente (Horowitz et al., 1975). Les microorganismes sont cultivés en présence du HAP agissant comme pression sélective. Des échantillons sont prélevés à intervalles réguliers et réinoculés dans le même milieu frais. Après un certain nombre de passages, il y aura possibilité d'augmentation de la proportion de microorganismes dégradant ce composé
(Weissenfiels et al., 1990; stucki et Alexander, 1987).
Une autre technique consiste à inoculer les microorganismes du sol sur une gélose et d'y vaporiser le HAP préalablement solubilisé dans un solvant volatil. Après quelques jours d'incubation, la formation de zones d'éclaircissement autour des colonies qui utilisent ce HAP est observée (Kiyohara et al., 1982). cette technique est efficace et aussi plus rapide pour isoler des microorganismes intéressants. Elle permet aussi d'effectuer le dénombrement de la population microbienne présente dans le sol. Cependant, MacGillivray et Shiaris ( 1993) ont observé que la formation d'un halo n'indique pas nécessairement que le microorganisme est capable de minéraliser le HAP en question. En effet, sur 13
levures formant des halos en présence de phénanthrène, seulement 5 étaient capables de minéraliser le phénanthrène marqué au carbone 14. Ils ont aussi observé que la capacité de formation d'un halo sur HAP peut ne pas se conserver après
repiquages successifs sur milieu solide.
Une modification de cette technique consiste à incorporer 1' inoculum de microorganismes et le HAP solubilisé dans une couche d'agar qui est déposée sur la surface d'un milieu minéral solide (Bogardt et Hemmingsen, 1992). Cependant, les techniques sur milieu solide peuvent sous-estimer la population de microorganismes présents puisqu'il est reconnue qu'environ 5% seulement des microorganismes peuvent former des colonies sur milieu gélosé {Frostegard et al., 1993; Cerniglia, 1993).
5.2.3 HAPs légers
La revue de littérature se limitera au fluorène et au phénanthrène qui sont les deux HAPs légers que nous avons utilisés dans cette étude. Le fluorène est un HAP tricyclique dont l'un des cycles a cinq liens. L'utilisation du fluorène comme seule source de carbone a souvent été rapportée dans la littérature. Des souches bactériennes pures ont même été isolées de différents environnements contaminés aux hydrocarbures etjou aux HAPs, pour leur capacité à dégrader ce HAP. Ces dernières ont été identifiées comme Pseudomonas sp. F27 4, Pseudomonas vesicularis, Staphylococcus auri cul ans et Arthrobacter sp. Fl01 (Grifoll et al., 1994; Monna l l gl., 1993; Grifoll et
ll·,
1992; Weissenfels ~ al., 1990) • Le fluorène est aussi utilisé par co-métabolisme par deux souches28 de Mycobacterium sp. et par une souche de Rhodococcus sp.
(Bouchez et g1., 1995; Tiehm et Fritzsche, 1995; Boldrin ~
al., 1993) • Kastner et al. ( 1994) ainsi que Stieber et gl. (1994) ont rapporté la dégradation du fluorène dans différents sols contaminés par ce composé.
Sphingomonas sp. obtenues de
Récemment, cinq souches de 1' "American Type Culture Collection" ont démontré leur capacité de former des zones d'éclaircissement sur le fluorène (Fredrickson et al., 1995).
Le phénanthrène est un HAP à trois noyaux aromatiques largement répandu dans l'environnement (Cerniglia, 1984). Sa solubilité dans l'eau est de 1.3 mgjL. sa structure de base est retrouvée dans plusieurs HAPs beaucoup plus problématiques comme le benzanthracène. Il sert donc souvent de modèle pour 1' étude de la biodégradation des HAPs (Okpokwasili et
ru._.,
1986; Sims et overcash, 1983). La demi-vie du phénanthrène en sol se situe généralement entre 4 et 18 semaines {Cerniglia, 1992). Les microorganismes dégradant le phénanthrène comme source de carbone ou par co-métabolisme sont nombreux (Sherrill et sayler, 1980). Plusieurs genres bactériens tels que Pseudomonas, Beijerinckia, Aeromonas, Flavobacterium, Alcaligenes, Micrococcus, Nocardia, Bacillus et Mycobacterium, pour n'en nommer que quelques uns, sont rapportés dans la littérature (Yang et li_., 1994: Singleton, 1994; Heitkamp, 1987; Sims et Overcash, 1983; Kiyohara ~ gl., 1982; Wodzinskiet Johnson, 1968).
5.2.4 HAPs lourds
La revue de littérature se limitera au pyrène et au chrysène qui sont les deux HAPs lourds que nous avons utilisés dans cette étude. Comme nous l'avons déjà mentionné, il existe beaucoup moins de bactéries isolées dégradant les HAPs de quatres noyaux et plus. Le pyrène et le chrysène sont deux HAPs lourds possédant quatre noyaux mais avec des propriétés chimiques très différentes. Le pyrène est un HAP de quatre noyaux aromatiques ayant une très faible solubilité dans l'eau, soit 0.141 mg/L. Sa demi-vie en sol est beaucoup plus longue et se situe entre 34 et 90 semaines (Cerniglia, 1992). Les quelques souches bactériennes isolées dégradant le pyrène comme seule source de carbone sont Mycobacterium sp. Pyr-1, Rhodococcus sp. IJW1, Alcaligenes àenitrificans, Crinipellis stipitaria, Mycobacterium sp., Mycobacterium sp. VF 1 et Gordona sp. BP 9 (Tiehm et Fritzsche, 1995; Kastner et al.,
1994; Lambert~ gl., 1994; Boldrin et gl., 1993; Grosser et gl., 1995; Walter et al., 1991; Heitkamp et al., 1988). La dégradation par co-métabolisme a aussi été démontrée chez une souche de Rhodococcus sp. (Bouchez et al., 1995) .
Le chrysène est aussi un HAP à quatres noyaux aromatiques mais sa solubilité dans l'eau (0.002 mg/L) est de beaucoup
30 inférieure à celle du pyrène (0.141 mg/L). Une seule souche bactérienne, identifiée comme Rhodococcus sp. UW1, a été testée pour sa capacité à dégrader le chrysène (Walter et al., 1991).
6. VOIES METABOLIQUES DES HAPS 6.1 Généralités
Chez les bactéries, la première étape de la voie métabolique générale consiste en une oxydation de la molécule d'HAP par une dioxygénase qui incorpore deux atomes d'oxygène moléculaire sur un cycle pour former un cis-dihydrodiol (Figure 3). Une déhydrogénase conduit par la suite à la molécule de cathécol, puis une dioxygénase provoque l'ouverture du noyau aromatique en position ortho ou méta (Dagley,1981). De cette façon, les bactéries peuvent oxyder une grande variété de composés aromatiques allant du benzène au benzopyrène (Cerniglia, 1993,1984). La voie métabolique la plus connue est celle du naphtalène, un HAP à deux noyaux aromatiques. Par exemple, chez Pseudomonas putida PpG7, les gènes codant pour les enzymes impliquées dans cette voie métabolique sont situés sur un plasmide contenant deux opérons: l'opéron nah et 1 'opéron sal. Le premier opéron comprend les gènes de la première partie de la voie métabolique soit du naphtalène au salicylate et le deuxième opéron comprend les gènes pour la deuxième partie qui oxyde le salicylate en catéchol. L'induction de ces deux opérons nah et sal est contrôlée par le
c=
R NJde ga. ga-MuoonlqueA
·
a...a.,
~/
NAD+~1
OH\y:/~=-"
.
g:
~
""'\
e~OH
R~
\~
R~
R H \ + + Celllchol Owerture Cyde~
CHOÇt:
..omdque NADH +H ~~i9U1"• 3. Voie métabolique générale utilisée par les bactéries pour l'oxydation des HAPs
(Cerniqlia, 1984). R 2~ ~ 4,..> t-'
32 salicylate (Cerniglia, 1993; Zylstra et Gibson, 1991; Haigler et Gibson, 1990). Cette voie est donc aussi nommée la voie du salicylate.
Étant donné que la structure de base, soit le noyau aromatique, est la même pour tous les HAPs, il est probable que les voies métaboliques soient similaires. En effet, si une bactérie utilise un HAP de quatre noyaux aromatiques comme le pyrène, des HAPs de moins de quatre noyaux pourraient être dégradés par cette dernière (Kiyohara et gl., 1992; Kiyohara et Nagao, 1978).
A titre de comparaison, les champignons oxydent les HAPs via le cytochrome P-450 monooxygénase et l'époxyde hydrolase catalyse la réaction jusqu'au trans-dihydrodiol ( Cernigl ia, 1984) . Il semblerait que les champignons hydroxylent les HAPs pour conduire à une détoxification tandis que les bactéries oxydent les HAPs en molécules dihydroxylées pour conduire à la fission du cycle et à l'assimilation de la molécule (Dagley, 1981) .
6.2 Pluorène
La voie métabolique du fluorène chez Arthrobacter F101 transforme le fluorène en 9-fluorènol et ensuite en 9H-fluorènone. Ce dernier intermédiaire s'accumule dans le milieu.
Une autre voie supporterait la croissance cellulaire en procédant à une coupure d'un noyau aromatique en méta conduisant au 3,4-dihydrocoumarin (Grifoll et gl., 1992). La suite de la voie métabolique peut suivre la voie générale des HAPs. Chez la souche Pseudomonas F274 (Figure 4), la première étape de la voie métabolique suggérée est une monohydroxylation à la position 9 pour donner le 9-hydroxyfluorène qui est ensuite déhydrogéné en une cétone correspondante, soit le 9-fluorènone. Une dioxygénase le transforme en 1,1a-dihydroxy-1-hydro-9-fluorènone, un alcool tertiaire. Il ne peut donc pas y avoir de déhydrogénation comme on s'y attendrait. Cette souche procède alors à une coupure du cycle à cinq liens entre les deux noyaux aromatiques pour finalement obtenir le phtalate. Selon les auteurs, ce dernier serait ensuite dioxygéné et décarboxylé en protocatéchuate. Une autre dioxygénase transformerait ensuite le protocatéchuate en 2-hydroxy-4-carboxy-cis, cis-muconic semialdéhyde (Grifoll rt al. , 1994; Ribbons et Evans, 1962). Puis, la dégradation du fluorène suit la voie métabolique générale des HAPs.
6.3 Phénanthrène
La voie métabolique du phénanthrène chez les bactéries a fait l'objet de plusieurs études, particulièrement chez Pseudomonas. L'oxydation du phénanthrène se fait soit en position ortho (carbones 3 et 4) ou en position méta (carbones
1
0::0
...
u
Ill IV0:;0
-
---
CçO-~
0 0-lcWl
VI
1
(M)
[Cf>2]
0 011•
+
Métabolisme
central
-··· 0-
~-
_!
OIICcoo·
'*
y .
011·nooo·
110coo·
•
~~o:
œo·
œo·
:Figure.c.
X
IX
VIII
vu
Voie métabolique du fluorène proposée chez
Pseudomonas F27 4 • I, fluorène; II,
9-hydroxytluorène; III, 9-tluorènone; IV, l,la-dihydroxy-1-hydro-9-fluorènone; VI, 8-hydroxy-3,4-benzocoumarin; VII, acide phtalique; VIII, 4,5-dihydroxyphtalate; IX, protocat~chuate; X, 2-hydroxy-4-carboxy-cia,cis-muconic
semialdéhyde. (Grifoll ~Al·, 1994).
Lù
J:-1 et 2) pour former soit le
cis-3,4-dihydroxy-3,4-dihydrophénanthrène ou le
cis-1,2-dihydroxy-1,2-dihydrophénanthrène (Figure 5) (Cerniglia, 1984; Jerina et gl.,
1976; Evans gt al., 1965) . Une déhydrogénase transforme le
3,4-dihydrophénanthrène en 3, 4-dihydroxyphénanthrène qui est
métabolisé en acide 1-hydroxy-2-naphtoïque. Une décarboxylase le transforme en 1, 2-dihydroxynaphtalène qui suit la voie métabolique du naphtalène conduisant au catéchol {Cerniglia,
1984). Certaines souches bactériennes tel que Aeromonas,
utilisent une autre voie convertissant l'acide 1-hydroxy-2-naphtoïque à l'acide protocatéchuïque (Kiyohara et Nagao, 1978).
6.4 Pyrène
Jusqu'à maintenant, seulement deux études ont porté sur l'élucidation de la voie métabolique du pyrène. La première a été effectuée avec une souche de Mycobacterium sp. (Heitkamp et
al., 1988) • Ces auteurs ont identifié le pyrène-4, 5-dihydrodiol comme un produit initial de l'oxydation du pyrène et l'acide 4-phénanthroïque comme le métabolite majeur de dégradation. Aucun intermédiaire possédant un cycle ouvert n'a été identifié
{Heitkamp et gl., 1988).
La voie métabolique du pyrène chez Rhodococcus sp. UW1
H
Piqure 5.
(a)
Voies métaboliques du phénanthrène chez
Pseudomonas
(Cerniqlia, 1984).position 4 et 5 pour former le dihydroxypyrène (Figure 6) (Walter et g!_. , 1991) . Cette étape est analogue à celle du phénanthrène par une souche de Pseudomonas (Evans et li. , 1965). Il peut donc y avoir deux positions possibles pour l'attaque par la dioxygénase étant donné que la structure du pyrène est très symétrique et compacte. C'est cette faible spécificité de la dioxygénase qui permettrait à cette bactérie de dégrader plusieurs autres HAPs comme le chrysène. La suite de la voie métabolique transforme le dihydroxypyrène en effectuant la coupure du cycle entre les deux groupements hydroxy (Walter et g!., 1991). Cependant, ces intermédiaires n'ont pas été identifiés. Cela suppose qu'ils seraient métabolisés rapidement. La suite de cette voie métabolique n'est pas encore élucidée (Walter et al., 1991). on peut supposer qu'elle suivrait la voie métabolique générale des HAPs pour en arriver au cathécol et finalement à la minéralisation.
6.5 Cbrysène
Aucun intermédiaire n'a été isolé afin d'élucider la voie métabolique du chrysène chez les bactéries. Le chrysène ayant une structure semblable au phénanthrène, on peut supposer que la voie métabolique du chrysène suivrait des étapes similaires à celles de la voie métabolique du phénanthrène.
Ub
Piqure ' · 38Ha
ma
Na
Voie métabolique du pyrène proposée chez Rhodococcus sp. UW1. I, pyrène; IIa, 1,2-dihydroxy-pyrène; lib, 4,5-dihydroxypyrène; Ilia, acide cis-2-hydroxy-3-(pêrinaphtènone)-propénique; IIIb, acide
2-hydroxy-2-(phênanthren-5-one-4-enyl)-acêtique;
7.0 OPTIMISATION DE LA BIODEGRADATION DES HAPs 7.1 Généralités
Même si plusieurs microorganismes ont déjà été isolés pour leur capacité de dégrader les HAPs, le taux de biodégradation de ces composés dans le sol et les sédiments est lent (Manilal et Alexander, 1991; Jones et gl., 1989; Bossert ~ gl., 1984). Cela suggère que dans de tels environnements, l'activité microbienne est limitée. Bien que le biotraitement de sites contaminés avec des résidus pétroliers soit possible, 1 'optimisation de la biodégradation est encore au stade du développement (Providenti ~ al., 1993). Le concept d'optimisation par un seul facteur ne semble pas être favorable dans le cas d'une population hétérogène de microorganismes étant donné qu'il est possible que plusieurs espèces soient requises pour dégrader entièrement un composé. Il est important de prendre en considération que chacune d'elles a ses besoins spécifiques de croissance (Sundaram ~ gl., 1994; Swindoll et g,l., 1988).
Même si la population microbienne est capable de dégrader les polluants comme les HAPs, le temps nécessaire pour que la population soit assez nombreuse pour être efficace peut être long (Cerseuil et Weber, 1994) • Les critères fondamentaux requis pour la croissance cellulaire doivent être satisfaits pour permettre quelque dégradation que ce soit. Il est donc
40 essentiel d'optimiser les paramètres influençant la croissance afin de s'assurer que l'activité métabolique est maximale
(Lapinskas, 1989).
Plusieurs facteurs peuvent influencer la biodégradation des HAPs. La température, le pH, l'humidité, les nutriments incluant l'azote et le phosphore, les microorganismes adaptés à la dégradation de ces polluants et les agents tensioactifs (Grosser et al., 1995; Zhou et Crawford, 1995; Singleton, 1994; Providenti ~al., 1993; Wilson et Jones, 1993; Brodkorb et Legge, 1992; Cerniglia, 1992; Leahy et Colwell, 1990; Morgan et Watkinson, 1989; Atlas, 1981,1977).
7.2 Température
La température influence le métabolisme microbien et la composition de la microflore. Peu d'études ont porté sur l'influence de la température sur la biodégradation des HAPs en sol. En général, le taux de dégradation diminue avec l'abaissement de la température. La température optimale de la dégradation des HAPs se situe entre 20 et 30°C. Ces températures favorisent les microorganismes mésophiles. Coover et Siros (1987) ont étudié l'influence de la température sur la dégradation de 16 HAPs dans un sol et ont démontré que l'augmentation de la température de 10 à 30°C favorisait la dégradation des HAPs légers mais avait peu d'effets sur la
dégradation des HAPs lourds. Une autre étude a démontré que la dégradation du fluorène et du pyrène ajoutés dans un sol est favorisée en augmentant la température de 10 à 25°C
(Maliszewska-Kordybach, 1992) . Toutefois, une étude norvégienne a situé la température optimale aux environs de 18°C (Oudot et al., 1987). Cependant, il existe quand même des microorganismes capables de dégrader les hydrocarbures à des températures plus basses. Cela suggère qu'il pourait y avoir un changement de la population active à travers les saisons (Atlas, 1981; Atlas et Bartha, 1973). La température affecte aussi la nature physique des HAPs comme par exemple leur viscosité et leur volatilisation (Atlas, 1981).
7.3
tm
Il a été démontré que la minéralisation des hydrocarbures s'effectue plus rapidement à des valeurs de pH entre 6.5 et 8.0 (Morgan et Watkinson, 1989; Dibble et Bartha, 1979; Jones et al., 1970). Selon les nutriments métabolisés, le pH peut varier pendant l'incubation. Une diminution ou une augmentation rapide du pH peut diminuer ou même inhiber complètement la population dégradant les HAPs (Erickson et al., 1993). Cela s'explique par la détérioration des enzymes dans la cellule. Grâce à son contenu en carbonate généralement élevé, le sol est reconnu comme ayant un bon pouvoir tampon à pH neutre ( Brodkorb et Legge, 1992).Le pH influence aussi la solubilité des HAPs et
42 l'adsorption aux particules de sol (Providenti, 1993). Le pH doit donc être bien contrôlé.
7.4 Humidité
L'eau est un des éléments les plus importants. Le degré de saturation en eau d'un sol influence la probabilité pour un microorganisme d'entrer en contact avec la molécule de substrat. De plus, un manque d'hydratation inhibe les métabolismes enzymatiques et limite ainsi la dégradation des HAPs. Le transport des HAPs dans un sol peu hydraté est aussi très réduit (Providenti gt al. , 1993). Etant donné que les HAPs sont accessibles aux microorganismes seulement quand ils sont solubilisés dans l'eau et que cette solubilité est très faible, la dégradation des HAPs est directement influencée par l'humidité du sol. Des valeurs se situant entre 30 et 90% de saturation du sol en eau permettent d'obtenir un taux de dégradation optimal (Cooney, 1984). La dégradation des HAPs par la méthode en bioréacteur de type "boues activées", tel que mentionné précédemment, consiste à mettre généralement 20% de sol et 80% d'eau et permet une dégradation plus rapide des HAPs (Samson, 1994b). Cependant, ces conditions s'éloignent de celles retrouvées sur le terrain.
7.5 oxygène