Évaluation de modèles prévisionnels de la fusariose de
l’épi chez le blé sous les conditions de culture du
Québec
Mémoire
Marie-Ève Giroux
Maîtrise en biologie végétale
Maître ès sciences (M. Sc.)
Québec, Canada
Résumé
La fusariose de l’épi est une maladie fongique des cultures céréalières au Québec. Les objectifs de ce projet étaient de vérifier l’influence de quatre facteurs (météorologie, cultivar, date de semis, fongicide) sur les rendements et la qualité du blé et d’évaluer les performances de neuf modèles à prédire l’incidence de cette maladie. Pendant deux ans, à quatre sites expérimentaux au Québec, des essais de blé de printemps et d’automne ont été implantés pour amasser un jeu de données météorologiques, phénologiques et épidémiologiques. L’application d’un fongicide a réduit la teneur en désoxynivalénol des grains dans neuf essais sur douze et a augmenté les rendements dans sept essais. De plus, les modèles prévisionnels américains et argentins ont eu de meilleures performances que les modèles canadiens et italiens quand leur seuil de décision était ajusté et que le développement du blé était suivi au champ.
Abstract
Fusarium head blight (FHB) is a fungal disease of cereal crops in Quebec. The objectives of this project were to check the influence of four factors (weather, cultivar, seeding date, fungicide application) on wheat yield and quality, and to evaluate the performance of nine forecasting models of FHB. During two years, at four experimental sites in Quebec, trials of spring and winter wheat have been implemented to establish a set of meteorological, phenological and epidemiological data. A fungicide application reduced deoxynivalenol content in grains in nine out of twelve trials and increased yields in seven trials. In addition, the American and Argentinean forecasting models performed better than the Canadian and Italian models when their decision threshold was adjusted and the development of wheat was observed in the field.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ...ix
Liste des figures ...xi
Remerciements ... xiii Avant-propos ...xv 1. Introduction ... 1 2. Revue de littérature ... 3 2.1 Fusariose de l’épi ... 3 2.1.1 Signes et symptômes ... 3 2.1.2 Agents pathogènes ... 3 2.1.3 Épidémiologie ... 6 2.1.4 Mycotoxines ... 12 2.1.5 Moyens de lutte ... 14 2.2 Modèles prévisionnels ... 18
2.2.1 Modélisation de la fusariose de l’épi ... 18
2.2.2 Critères recherchés chez un modèle prévisionnel ... 18
2.2.3 Types de modèles ... 19
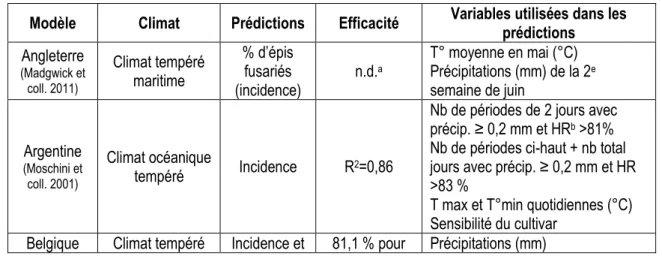
2.2.4 Modèles prévisionnels à l’étude ... 22
2.2.5 Limites à l’implantation et à l’adoption d’un modèle ... 30
3. Hypothèses et objectifs ... 33
3.1 Hypothèses ... 33
3.2 Objectifs ... 33
4. Le cultivar, la date de semis et l’application de fongicide influencent les rendements de blé et l’intensité de la fusariose de l’épi ... 35
Résumé ... 35
Cultivar, Seeding Date and Fungicide Application Influence Wheat Yield and Fusarium Head Blight Intensity 37 Abstract ... 37
Introduction ... 37
Materials and Methods... 39
Description of Sites and Treatments... 39
Data Collection ... 40
Statistical Analyses ... 41
Spring Wheat ... 41
Winter Wheat ... 49
Correlations between Disease Intensity and Yield ... 50
Conclusion ... 50
Acknowledgements ... 51
References ... 52
5. Évaluation de modèles prévisionnels de la fusariose de l’épi chez le blé sous les conditions de cultures du Québec ... 69
Résumé ... 69
Evaluation of Forecasting Models for Wheat Fusarium Head Blight under Growing Conditions of Quebec, Canada ... 71
Abstract ... 71
Introduction ... 71
Materials and Methods ... 73
Data Collection and FHB Predictions ... 73
Statistical Analyses ... 75
Selection of Best Decision Threshold ... 76
Results ... 77
Frequency Distributions and Damage Thresholds ... 77
ROC Curve Analyses ... 77
Selection of Best Decision Threshold ... 79
Discussion ... 80
Acknowledgements ... 83
References ... 84
6. Discussion générale ... 97
6.1 Hypothèses – volet agronomique ... 97
6.2 Hypothèses - volet modélisation ... 100
6.3 Améliorations et perspectives ... 102
7. Conclusion ... 105
Bibliographie ... 107
Annexe A – Données météorologiques ... 115
Liste des tableaux
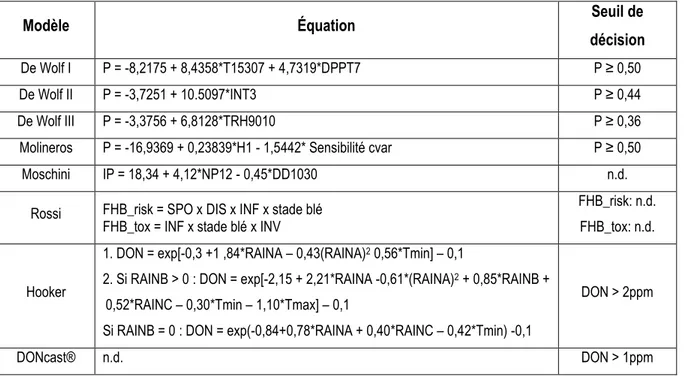
Tableau 1 - Description de certains modèles de la fusariose de l'épi ... 19 Tableau 2 - Équations et seuils de décision des modèles prévisionnels étudiés ... 24 Table 3 - Experimental sites, location, degree-days, soil type, plot dimensions and cereal production zone in
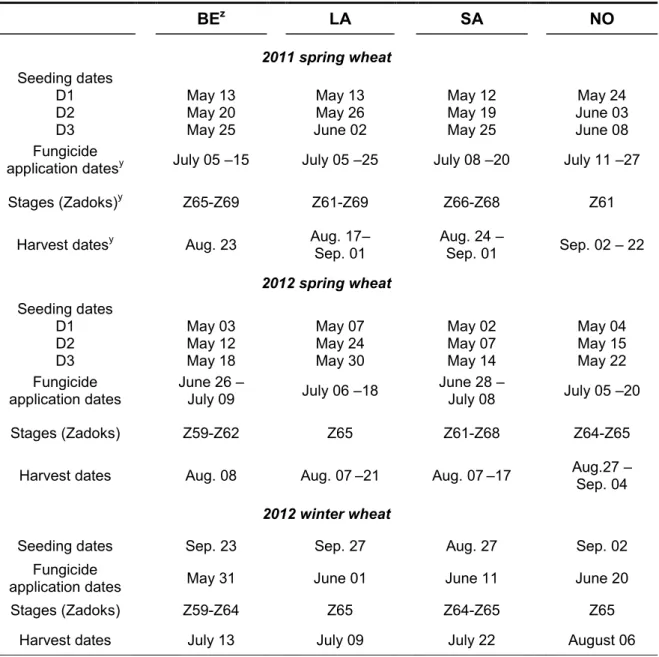
Quebec, 2011-2012. ... 55 Table 4 - Seeding and harvesting dates, dates and phenological stages of fungicide applications at all sites for
spring and winter wheat in 2011 and 2012. ... 56 Table 5 - Monthly temperatures and precipitation for each site in 2011 and 2012 and 30-yr average in Quebec.
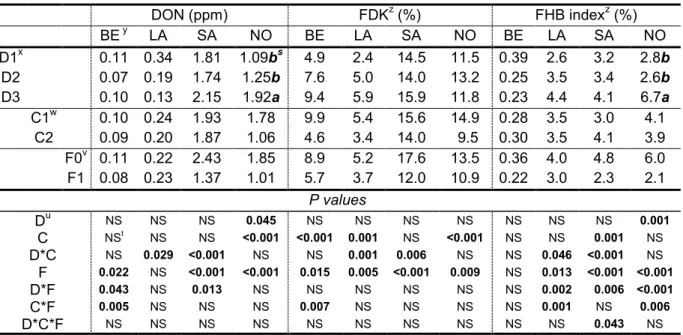
... 57 Table 6 - Deoxynivalenol content (DON), Fusarium-damaged kernels (FDK), and Fusarium head blight (FHB)
index for different seeding dates, cultivars, and fungicide applications in spring wheat trials at four experimental sites in 2011. ... 58 Table 7 - Deoxynivalenol content (DON), Fusarium-damaged kernels (FDK), and Fusarium head blight (FHB)
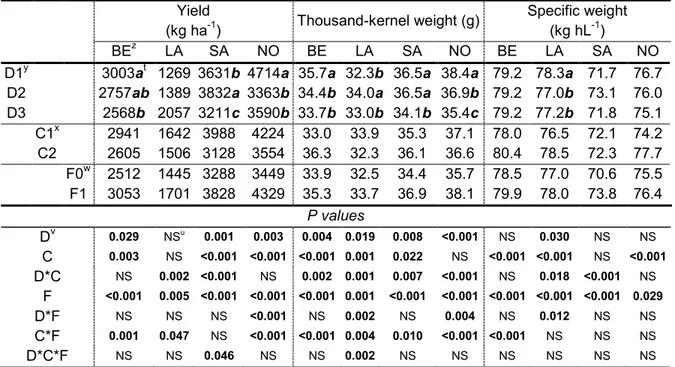
index for different seeding dates, cultivars, and fungicide applications in spring wheat trials at four experimental sites in 2012. ... 59 Table 8 - Yield, thousand-kernel weight (TKW), and specific weight for different seeding dates, cultivars, and
fungicide applications in spring wheat trials at four experimental sites in 2011. ... 60 Table 9 - Yield, thousand-kernel weight (TKW), and specific weight for different seeding dates, cultivars, and
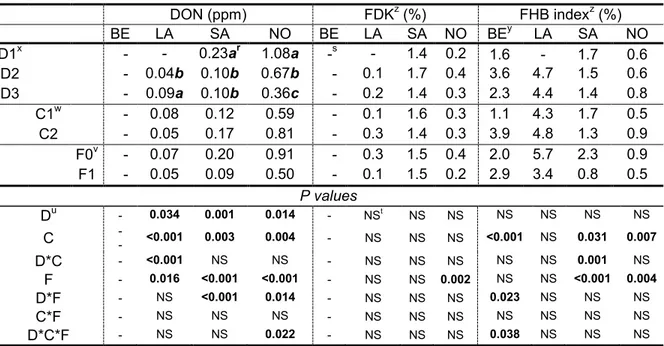
fungicide applications in spring wheat trials at four experimental sites in 2012. ... 61 Table 10 - Location and fungicide application effects on deoxynivalenol (DON) content, Fusarium-damaged
kernels (FDK), and Fusarium head blight (FHB) index for winter wheat in four experimental sites in 2012. ... 62 Table 11 - Location and fungicide application effects on yield, thousand-kernel weight (TKW), and specific
weight for winter wheat in four experimental sites in 2012. ... 63 Table 12 - Prevalence of cases and controls in 2011 and 2012 samples for different Fusarium head blight
(FHB) indicators. ... 87 Table 13 - Area under the receiver operating characteristic curve (AUC), and comparison with the line of
no-information for each forecasting model using observed phenological stages with DON and FDK as damage indicators. ... 88 Table 14 - Performance parameters for adjusted threshold of forecasting models using observed phenological
stages with DON ≥ 1 ppm as damage indicator. ... 89 Table 15 - Area under the receiver operating characteristic curve (AUC), and comparison with the line of
no-information for each forecasting model using predicted phenological stages with DON and FDK as damage indicators. ... 90 Table 16 - Performance parameters for the adjusted threshold of forecasting models using predicted
Table 17 - Likelihood ratios of positive prediction LR+ and of negative prediction LR- for the adjusted and published decision threshold of each model using observed phenological stages with DON ≥ 1 ppm as damage indicator. ... 92 Table 18 - Likelihood ratios of positive prediction LR+ and of negative prediction LR- for the adjusted and
published decision threshold of each model using predicted phenological stages with DON ≥ 1 ppm as damage indicator. ... 93
Liste des figures
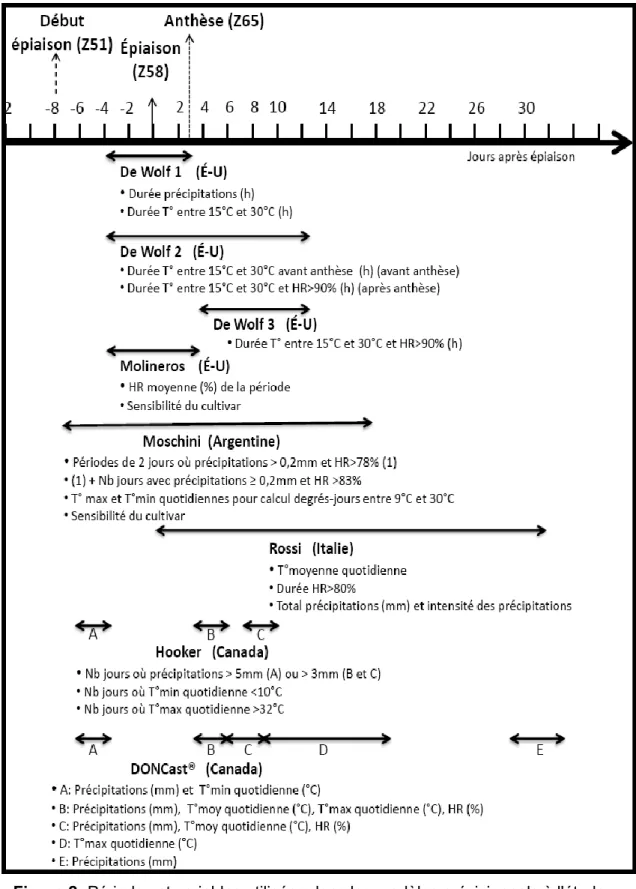
Figure 1- Cycle épidémiologique de la fusariose de l'épi. ... 6 Figure 2- Périodes et variables utilisées dans les modèles prévisionnels à l'étude ... 23 Figure 3 - Deoxynivalenol (DON) content, Fusarium-damaged kernels (FDK), yield, thousand-kernel weight
(TKW), and specific weight of the cultivars Torka and AC Barrie for early (D1), intermediate (D2), and late (D3) wheat seedings at L’Acadie and Saint-Augustin-de-Desmaures (2011).. ... 64 Figure 4 - Yield and thousand-kernel weight (TKW) of early (D1), intermediate (D2), and late (D3) wheat
seedings with (F1) or without fungicide (F0) at Normandin (2011). ... 65 Figure 5 – Yield and thousand-kernel weight (TKW) of the cultivars Torka and AC Barrie with (F1) or without
fungicide (F0) at Saint-Mathieu-de-Beloeil, L'Acadie, and Normandin (2011). ... 66 Figure 6 - Regression curve for the relationship FDK = 2.267+4.887 DON (R2=0.42) with 95% confidence
interval and 95% prediction interval for spring and winter wheat observations. ... 67 Figure 7 - Distribution of samples in the data set of deoxynivalenol (DON) content, Fusarium-damaged kernels
(FDK), and Fusarium head blight (FHB) index. ... 94 Figure 8 - Receiver operating characteristic (ROC) curves obtained for observed phenological stages and for
predicted phenological stages, using damage indicators DON ≥ 1 ppm, FDK ≥ 1.5%, and
Remerciements
Tout d’abord, je tiens à remercier ma directrice de recherche, Anne Vanasse, qui a cru en moi pour ce projet. Sa confiance, son soutien et sa passion m’ont permis de développer mes compétences en recherche et d’améliorer ma confiance en moi. Je tiens également à remercier Gaétan Bourgeois, mon co-directeur, pour sa confiance et son appui tout au long du projet. Grâce à lui, j’ai pu développer mon sens critique et mes compétences informatiques qui ont été fort utiles dans un projet portant sur la bioclimatologie et la modélisation. Leurs expertises complémentaires n’ont pu qu’enrichir le déroulement de ma maîtrise du début à la fin.
Je désire également remercier tous ceux qui ont contribué de près ou de loin à ce projet collaboratif. Tout d’abord, je voudrais remercier l’équipe de recherche du département de phytologie de l’Université Laval, sans qui les essais n’auraient pas eu lieu à Saint-Augustin-de-Desmaures : Valérie Bélanger et Marie-Eve Bernard, professionnelles de recherche, Francis Gagnon, Éric Lemay et Marc Bourgeois, techniciens à la ferme de recherche. J’adresse mes remerciements particuliers à Hélène Munger qui a compilé les données de la première année d’expérimentation d’une façon exemplaire, ce qui a m’a grandement facilité la tâche pour la suite. Un merci spécial à Annie Brégard qui a été d’un grand secours et d’un soutien inébranlable lors des analyses statistiques. Je tiens également à remercier l’équipe de recherche de Gaétan Bourgeois au Centre de recherche et de développement en horticulture d’Agriculture et Agroalimentaire Canada à Saint-Jean-sur-Richelieu, plus particulièrement Danielle Choquette et Dominique Plouffe pour leur patience et leur dévouement à me montrer le fonctionnement de divers logiciels lors de mon stage ainsi que Nathalie Beaudry pour la programmation finale des modèles prévisionnels. Je remercie l’équipe du CÉROM à Saint-Mathieu-de-Beloeil et à Québec : Yves Dion, Sylvie Rioux, Christelle Danjou et Nicole Bourget pour avoir apporté une expertise de haute qualité. Merci à Denis Pageau et Isabelle Morasse d’Agriculture et Agroalimentaire Canada à Normandin pour leur collaboration au projet. Finalement, je tiens à remercier tous les étudiants qui ont pu aider à la collecte des données dans les quatre stations de recherche.
Mes prochains remerciements sont pour mes parents, Louise Melançon et Mario Giroux. Merci d’avoir toujours cru en moi et de m’avoir toujours encouragé à me dépasser et à réaliser mes rêves. Ma réussite est indissociable de votre soutien et votre amour inconditionnels. Aussi, je veux adresser un merci spécial à Laetitia, Marie-Christine, Noémie et Valérie qui, lors de nos rencontres de «club social», m’ont permis de me sentir moins seule et m’ont donné de la motivation pour poursuivre jusqu’à la fin. Finalement, je ne peux terminer sans remercier mon conjoint, Gabriel Vermette, qui m’a suivie et supportée pendant cette aventure. Sans ton écoute, ta patience et tes encouragements, le parcours aurait été probablement beaucoup plus difficile.
Avant-propos
Le présent mémoire est composé de sept chapitres. Le chapitre 1 met en contexte la problématique de la fusariose de l’épi, plus particulièrement dans la culture du blé au Québec. Le chapitre 2 relève les éléments importants de la littérature concernant cette maladie ainsi que ceux des modèles prévisionnels s’y rattachant. Les hypothèses et les objectifs du projet sont énoncés dans le chapitre 3. Le chapitre 4, quant à lui, traite de l’impact du cultivar, de la date de semis et de l’utilisation d’un fongicide à la floraison sur les rendements et l’infection par la fusariose de l’épi chez le blé. Ce chapitre est écrit sous forme d’article scientifique dans le but d’être éventuellement soumis à la revue «Canadian Journal of Plant Science» de l’Agricultural Institute of Canada. Marie-Ève Giroux en est l’auteure principale avec Anne Vanasse, Gaétan Bourgeois, Yves Dion, Sylvie Rioux et Denis Pageau comme co-auteurs. Le chapitre 5 constitue le chapitre principal du mémoire et relate les résultats de l’évaluation des modèles prévisionnels de la fusariose de l’épi sous les conditions de culture du Québec. Ce chapitre est également écrit sous forme d’article scientifique qui sera éventuellement soumis à la revue «Plant Disease» de l’American Phytopathological Society. Marie-Ève Giroux en est aussi l’auteure principale et est secondée par Gaétan Bourgeois, Anne Vanasse, Yves Dion, Sylvie Rioux et Denis Pageau dans la rédaction de cet article. Le retour sur les hypothèses de départ et sur les objectifs est réalisé dans la discussion générale du chapitre 6. Finalement, les conclusions générales du projet sont résumées à l’intérieur du chapitre 7.
Les résultats du projet ont été présentés lors des journées d’information scientifique en grandes cultures organisées par le Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ) en février 2013 et 2014 à Drummondville, au 81e congrès annuel de l’Association francophone pour le savoir (ACFAS) en mai 2013 à Québec, aux concours de présentations étudiantes lors de la réunion annuelle de la Société de protection des plantes du Québec (SPPQ) en juin 2013 à Québec et des journées du centre SÈVE en novembre 2013 à Wendake sous forme de présentations orales. Ils ont également été présentés sous forme d’affiche lors de la journée des portes ouvertes du CÉROM en juillet 2012 à Saint-Mathieu-de-Beloeil, lors du 12th European Fusarium Seminar en mai 2013 à Bordeaux, en France, et lors de la journée de la recherche de la Faculté des sciences de l’agriculture et de l’alimentation (FSAA) en novembre 2013 à Québec.
Le projet n’aurait pu avoir lieu sans le soutien financier d’Agriculture et Agroalimentaire Canada via le programme de réduction des risques liés aux pesticides et la coordination de la Fédération des producteurs de cultures commerciales du Québec (FPCCQ). Le Conseil de recherches en sciences naturelles et en génie du Canada m’a octroyé une bourse me permettant de compléter la seconde année de recherche sans souci financier. Plusieurs autres organismes et institutions, par leur programme de bourses étudiantes, m’ont
également fourni un financement d’appoint : le réseau Innovagrains, la Société de protection des plantes du Québec, l’Université Laval et le centre SÈVE.
1. Introduction
La fusariose de l’épi est une maladie fongique affectant les céréales à paille et le maïs. Elle peut affecter sévèrement un champ à haut potentiel de rendement à l’intérieur de quelques semaines (McMullen et coll. 1997). Les pertes dans le blé sont principalement liées à la stérilité des fleurs et au faible poids des grains, en plus des toxines produites par le champignon qui, la plupart du temps, rend le blé impropre à la consommation humaine et animale (Bailey et coll. 2004). Il s’agit de facteurs qui causent le déclassement et qui diminuent le prix de vente des grains. La fusariose peut s’attaquer à toutes les céréales, mais sa présence occasionne surtout des pertes dans le blé panifiable qui possède une plus grande valeur marchande. Elle peut infecter autant le blé de printemps que le blé d’automne, deux cultures présentes au Québec et au Canada.
Dans les années 80, la maladie était surtout présente au Québec, en Ontario et dans les Maritimes. Depuis le début des années 90, elle est aussi devenue un problème dans les Prairies canadiennes. Au Manitoba, des pertes annuelles de 50 millions de dollars sont enregistrées (Bailey et coll. 2004). En 1992, toujours au Manitoba, près du quart des champs de blé échantillonnés étaient atteints de fusariose de l’épi avec une sévérité de 10 % et plus (McMullen et coll. 1997). Cette épidémie a causé des pertes d’environ 4,8 millions de tonnes métriques de blé. Les pertes économiques y étant reliées ont eu des répercussions autant sur les producteurs agricoles que dans leurs communautés (McMullen et coll. 1997). La fusariose de l’épi est également un problème dans le restant de l’Amérique du Nord et en Amérique centrale. Seulement entre 1998 et 2002, les pertes reliées à cette maladie se chiffraient à 2,7 milliards de dollars (Leplat et coll. 2013). Au Québec, en 2012, on peut estimer la production de blé à 183 300 tonnes, dont 24 850 tonnes en blé d’automne. La production totale de blé dans cette province représente 0,5 % de la production canadienne, ce qui la classe au 5e rang des provinces productrices de blé, loin derrière la Saskatchewan, l’Alberta, le Manitoba et l’Ontario (Statistique Canada 2013). Même si les récoltes sont moins importantes au Québec, l’impact de la fusariose demeure aussi préoccupant que pour les autres provinces canadiennes.
Plusieurs moyens de lutte sont déjà connus et exploités pour réprimer la maladie : la sélection de cultivars de blé tolérants à la fusariose, une rotation avec des plantes non hôtes pour briser le cycle de la maladie et l’enfouissement des résidus de culture. Malgré ces alternatives, de plus en plus de chercheurs se penchent sur ce fléau et tentent de trouver des outils pour aider à gérer le risque lié à la fusariose de l’épi. L’approche qui gagne en popularité est l’utilisation de modèles mathématiques prédisant le risque d’infection ou le risque de contamination des grains de blé. En effet, la fusariose de l’épi est une maladie appropriée pour la modélisation dans cette culture. La période de sensibilité du blé est courte, les pertes économiques associées aux mycotoxines sont élevées et la sévérité de la maladie est grande (Prandini et coll. 2009). Les différentes étapes du cycle épidémiologique sont, la plupart du temps, la base des modèles de prévision (De Wolf et Isard
2007). Bien que plusieurs chercheurs en aient conçus à travers le monde, aucun modèle n’a encore été développé ou évalué au Québec. L’évaluation de l’efficacité des modèles développés au Canada, aux États-Unis, en Amérique du Sud et en Europe, sous les conditions agroclimatiques québécoises, est essentielle pour établir la base d’un outil d’aide à la gestion de la fusariose de l’épi qui sera utilisé par les producteurs et les intervenants agricoles dans une approche de lutte intégrée.
2. Revue de littérature
2.1 Fusariose de l’épi
2.1.1 Signes et symptômes
Les symptômes de la fusariose de l’épi sont généralement assez similaires et faciles à identifier chez toutes les cultures céréalières (Parry et coll. 1995). Chez le blé de printemps ou d’automne, la maladie est caractérisée par un blanchissement et un dessèchement prématuré des épillets, qui deviennent souvent stériles (Sutton 1982; Bailey et coll. 2004). Les symptômes peuvent se limiter à quelques épillets dans un champ lors d’une épidémie de faible intensité, mais peuvent aussi se répandre aux épis de la culture entière lorsque les conditions sont favorables à l’infection. Quand la maladie attaque le rachis de l’épi de blé, les grains au-dessus du point d’infection sont souvent peu remplis. Quant aux grains formés dans les épillets infectés, ils sont la plupart du temps ratatinés, légers et, à l’occasion, blanchâtres ou roses. On qualifie ce type de grains comme étant fusariés ou momifiés (Bailey et coll. 2004). Finalement, lorsque les conditions environnementales sont propices, on observe le développement de mycélium superficiel blanc avec des reflets orange à rosés (Bailey et coll. 2004). Ces signes peuvent apparaître autant sur les épis, le rachis ou les semences infectés (Sutton 1982).
2.1.2 Agents pathogènes
La fusariose de l’épi du blé peut être causée par au moins 17 espèces de Fusarium. Toutefois, trois espèces sont particulièrement dominantes : Fusarium graminearum Schwabe [téléomorphe : Giberella zeae (Schwein.) Petch], Fusarium culmorum (Wm.G. Smith) Sacc. et Fusarium avenaceum [télémorphe : Giberella avenacea R.J. Cook] (Parry et coll. 1995). Le genre Giberella est généralement saprophyte et parasite facultatif, c’est-à-dire qu’il peut attaquer des hôtes de différentes espèces qui sont soit vivants, soit sénescents (Liddel 2003). D’autres organismes, comme Fusarium poae, Fusarium sporotrichioides et Microdochium nivale sont des espèces assez répandues et causent aussi la fusariose de l’épi (Osborne et Stein 2007). La plupart du temps, on retrouve un complexe d’agents pathogènes en association dans les tissus infectés (Parry et coll. 1995). L’identification morphologique des espèces à l’intérieur du complexe est une tâche ardue, vu la grande ressemblance entre plusieurs espèces du genre Fusarium (Gale 2003). Au cours du XXe siècle, plusieurs études sur la composition des populations de Fusarium ont été basées sur la morphologie des espèces, ce qui a conduit à de mauvaises identifications (Liddel 2003). Avec les méthodes phylogénétiques et les marqueurs moléculaires disponibles aujourd’hui, l’identification des Fusarium avec la systématique conventionnelle peut être confirmée grâce à ces outils de haute précision (Gale 2003; Liddel 2003). Ainsi, une classification adéquate des espèces et des isolats présents dans l’inoculum primaire d’une région permet une meilleure
compréhension de la distribution, de la toxicologie et de l’épidémiologie des agents responsables de la fusariose (Liddel 2003).
On observe de la variabilité dans la répartition des espèces causant la fusariose de l’épi. Une étude réalisée en Europe a démontré que la localisation géographique des Fusarium est reliée aux conditions météorologiques prévalant dans cette région (Xu et coll. 2007). En effet, la distribution géographique de chaque espèce est attribuable à ses exigences de température et d’humidité, car ce sont principalement ces paramètres qui influencent le développement de la fusariose de l’épi et de son inoculum (Parry et coll. 1995). Toutefois, les populations régionales de Fusarium ne sont pas statiques dans le temps : elles s’adaptent et réagissent aux variations climatiques annuelles de leur milieu. Par exemple, une espèce prédominante dans une région généralement pluvieuse peut se retrouver au 3e ou 4e rang en importance lors d’une année exceptionnellement sèche (Gale 2003; Bourdages et coll. 2006). Bref, F. graminearum, F. culmorum,
F. avenaceum et F. poae se distinguent notamment par leurs exigences environnementales.
F. graminearum est particulièrement dominant dans les régions chaudes et humides (Xu et coll. 2007). Cette
espèce est la principale cause de la fusariose au Canada, aux États-Unis, en Europe centrale, en Chine et dans certaines régions de l’hémisphère Sud, comme l’Australie (Sutton 1982; Parry et coll. 1995; Desjardins 2006; Osborne et Stein 2007). Au Québec, F. graminearum est également l’espèce la plus importante : elle a été retrouvée dans 41 % des échantillons d’orge récoltés dans douze régions administratives pendant trois années consécutives. Sa présence est particulièrement marquée dans les régions au sud du fleuve St-Laurent (Bourdages et coll. 2006; Bérubé 2010). Les résultats de Bourdages et coll. (2006) et de Bérubé (2010) concordent avec ceux de Xu et coll. (2007) qui mettent en évidence les besoins en chaleur et en humidité de
F. graminearum par rapport aux autres espèces causant la fusariose. Une autre particularité de cette espèce
est sa capacité à produire du désoxynivalénol (DON), une mycotoxine appartenant à la famille des trichothécènes. Cette dernière augmenterait la virulence de F. graminearum, ce qui lui confère un net avantage sélectif et explique en partie sa prédominance sur la planète (Desjardins 2006). De plus, l’intensité de sa virulence varierait en fonction de la nature de dérivés acétylés de DON produits. En effet, deux types de
F. graminearum ont été identifiés : ceux produisant du 3 acétyl-désoxynivalénol (3-ADON) et ceux produisant
du 15 acétyl-désoxynivalénol (15-ADON) (Vujanovic et coll. 2012). Les souches du chimiotype 3-ADON sont reconnues comme étant plus agressives, car elles produisent plus de trichotécènes, se multiplient plus rapidement et survivent à des écarts de température plus grands que les souches du chimiotype 15-ADON (Ward et coll. 2008; Vujanovic et coll. 2012). Toutefois, le rôle du groupement acétylé dans la reproduction du champignon n’a pas encore été établi (Schmale et coll. 2011). Au Canada, la proportion du chimiotype 3-ADON par rapport à celui de 15-3-ADON augmente d’ouest en est. Elle constitue 6 % de la population de
peu présente aux États-Unis : seulement 6 % des souches analysées étaient du chimiotype 3-ADON dans une enquête réalisée en 2006 dans six états différents (Schmale et coll. 2011). D’autres analyses sont nécessaires pour évaluer la vitesse de remplacement de la souche 15-ADON par celle 3-ADON (Schmale et coll. 2011).
On retrouve F. culmorum dans les régions plus froides, humides et pluvieuses (Parry et coll. 1995; Osborne et Stein 2007; Xu et coll. 2007). Cette espèce est particulièrement dominante au Royaume-Uni et en Europe du Nord, mais on la retrouverait aussi au Canada (Osborne et Stein 2007). Au Québec, on la retrouve dans une proportion inférieure à 2 % dans la culture d’orge, ce qui la place au 7e rang des espèces retrouvées dans tous les sites et les années étudiés par Bourdages et coll. (2006). De plus, elle possède le même avantage sélectif que F. graminearum, soit la capacité de produire du DON (Bailey et coll. 2004; Desjardins 2006). Ce sont donc les deux espèces les plus virulentes qui causent la fusariose de l’épi (Parry et coll. 1995).
F. avenaceum a été retrouvé dans plusieurs régions climatiques, mais en plus faibles proportions que F. graminearum et F. culmorum (Parry et coll. 1995). Cependant, elle est une des espèces les plus retrouvées
au Québec, après F. graminearum et F. poae (Bourdages et coll. 2006). Cette espèce proliférerait dans le même type de conditions que F. culmorum, c’est-à-dire fraîches, humides et pluvieuses. Au Québec, on retrouve F. avenaceum dans les régions situées à l’est de la province (Bourdages et coll. 2006; Bérubé 2010). Toutefois, elle ne produit pas de désoxynivalénol (Desjardins 2006). Dans l’Ouest canadien, cette espèce était la cause première de la fusariose pendant les années 80, mais elle est remplacée graduellement par F.
graminearum, espèce beaucoup plus virulente et dommageable pour les récoltes. De 1993 à 1998, F. avenaceum a reculé d’est en ouest pour faire place à F. graminearum (Clear et Patrick 2000; Turkington et
coll. 2011). Ce changement pourrait être expliqué par l’augmentation des précipitations pendant la floraison dans les Prairies, mais aussi par un raccourcissement de la période de maturation des ascospores de F.
graminearum (Clear et Patrick 2000).
En ce qui concerne F. poae, il serait favorisé par des conditions chaudes et sèches, contrairement aux autres
Fusarium (Xu et coll. 2007). Il a été identifié dans 23,2 % des échantillons d’orge entre 2000 et 2002, ce qui
fait de F. poae la deuxième espèce en importance au Québec. Elle est présente plus particulièrement au nord du fleuve St-Laurent (Bourdages et coll. 2006).
2.1.3 Épidémiologie
Bien que plusieurs agents pathogènes soient responsables de la fusariose, l’épidémiologie décrite dans les sections suivantes est essentiellement détaillée pour F. graminearum. D’ailleurs, la figure 1 présente son cycle épidémiologique.
Figure 1- Cycle épidémiologique de la fusariose de l'épi (Adapté de Schmale et Bergstrom, 2003).
Les différentes espèces causant la fusariose de l’épi peuvent se reproduire de façon sexuée ou asexuée (Figure 1). Ce sont ces deux types de spores qui sont responsables de la propagation de la maladie. On reconnaît les périthèces, fructifications formant les spores sexuées (ascospores), par leur couleur noire à violacée. Elles sont produites par la forme téléomorphe du champignon. Les sporodochies orange, qui sont des coussinets de spores asexuées (macroconidies), peuvent être visibles à la surface du blé attaqué par la fusariose (Bailey et coll. 2004).
Plantule fusariée Grain infecté
Épi, tige et feuille-étendard infectés Source d’inoculum primaire :
Résidus de culture (blé, maïs, riz, etc.) avec périthèces et sporodochies
2.1.3.1 Sources d’inoculum
Les propagules qui constituent l'inoculum peuvent être des ascospores, des macroconidies, des chlamydospores ou des fragments d'hyphes. Les ascospores de G. zeae (anamorphe : F. graminearum) sont responsables de l’infection primaire (Sutton 1982). Les débris provenant de plantes hôtes de la fusariose de l’épi, comme l’orge, le blé et le maïs, sont les principaux réservoirs d'inoculum au champ (Sutton 1982; Bailey et coll. 2004). Francl et coll. (1999) a pu mesurer plus d’inoculum de G. zeae dans les champs de blé de printemps qui avaient des résidus de maïs ou de blé en surface, en comparaison avec ceux qui n’en avaient pas. Cependant, le sol, les semences, les mauvaises herbes et certaines plantes indigènes peuvent être d'autres sources de propagules (Sutton 1982; Bailey et coll. 2004). En effet, il existe quatorze genres de graminées, deux genres de légumineuses et un genre de cucurbitacées qui sont susceptibles d’abriter et de propager les pathogènes responsables de la fusariose de l’épi (Shaner 2003). En général, F. graminearum survit plus longtemps sur les tissus qui résistent à la décomposition, principalement sur les grains, les épis et les tiges (Sutton 1982). L’abondance des résidus ainsi que la présence de pourriture de l’épi vont déterminer le potentiel à la survie de F. graminearum et sa capacité à propager l’infection la saison suivante, en particulier pour le maïs (Shaner 2003). De plus, Francl et coll. (1999) a observé que la fréquence d’inoculation des épis de blé était 75 % moindre dans les champs à plus de 0,5 km de résidus ou d’une épidémie de fusariose, que dans les champs rapprochés d’une telle source d’inoculum.
Les conditions environnementales influencent également la quantité de propagules dans la culture de blé. Généralement, on peut dire que la production d’inoculum est supérieure dans des conditions chaudes et humides (Sutton 1982). Les températures et les quantités d’humidité nécessaires à la production des spores sexuées et asexuées sont différentes pour chacune d’elles. Rossi et coll. (2002b) ont essayé de déterminer quels étaient les effets de régimes de température sur la production de macroconidies, ou spores asexuées, de quatre espèces causant la fusariose de l’épi (F. graminearum, F. culmorum, F. avenaceum et M. nivale). Toutes les espèces ont produit des spores dans l’intervalle de température de 5 à 35 °C. Les variations de température n’ont pas favorisé un patron de production particulier de macroconidies. En revanche, certaines espèces se sont montrées plus efficaces en s’adaptant à l’environnement et en atteignant plus rapidement leur production maximale de spores. L’espèce la plus performante était F. avenaceum, suivie de M. nivale, de F.
graminearum et de F. culmorum. Leurs températures optimales de sporulation étaient respectivement 28, 26
et 32 °C pour les deux dernières espèces. Ces observations correspondent à celles d’Andersen (1948), qui avait déterminé que la température optimale pour la production de macroconidies de F. graminearum était de 32 °C. Dans l’étude de Rossi et coll. (2002b), les précipitations et l’humidité relative n’avaient pas un effet significatif sur la production de macroconidies.
Les ascospores sont produites dans des structures spécialisées que l’on appelle périthèces. Pour que le développement et la maturation des périthèces s’effectuent correctement, les débris doivent être en conditions humides pendant une période de temps prolongée (Gilbert et Fernando 2004). Certains seuils de température doivent également être atteints. Dans une étude réalisée dans l’état du Michigan aux États-Unis, des résidus de maïs et de blé ont été amassés dans différents champs pour étudier le développement et la maturation des périthèces. Ces derniers n’ont pas été détectés avant le début mai et sont devenus assez fréquents à la mi-juin, soit au moment de la floraison du blé dans cette région (Shaner 2003). Cette période de l’année est aussi caractérisée par une hausse graduelle des températures, c’est-à-dire une augmentation propice à la production de périthèces. On peut retrouver plusieurs intervalles différents dans la littérature qui expliquent l’apparition de ces structures spécialisées. Parry et coll. (1995) propose un écart de température assez large se situant entre 16 et 31 °C. On peut comparer ces valeurs à celles de Gilbert et Fernando (2004) : aucun développement de périthèce ne se produit sous 15 °C et au-delà de 30 °C. Finalement, toujours pour la production de périthèces, une étude d’Osborne et Stein (2007) est plus conservatrice et propose plutôt 20 et 24 °C comme seuils optimaux de température pour la maturation de ces structures. En ce qui concerne le développement des ascospores, la température optimale se situe entre 25 et 28 °C (Sutton 1982). Bref, on peut conclure de ces observations que G. zeae ne survit pas à l’hiver sous forme de périthèces et d’ascospores, car ces derniers apparaissent seulement lorsque les températures sont à la hausse au printemps (Shaner 2003). Le pathogène survivrait plutôt sous forme de mycélium ou de périthèces immatures (Shaner 2003; Osborne et Stein 2007; Marshall 2009).
2.1.3.2 Dispersion de l’inoculum
Chaque type de spore possède son propre mode de dispersion. En ce qui concerne les spores asexuées de
F. graminearum, c’est-à-dire les macroconidies, elles sont principalement dispersées par les éclaboussures de
pluie (Bailey et coll. 2004). Ce sont les gouttes d’eau qui tombent et qui font exploser les sporodochies, leur permettant ainsi de libérer les spores pour les répandre dans l’environnement. Après le début des précipitations, le nombre de macroconidies dans l’air augmente et demeure élevé tant que l'humidité relative est élevée. Ainsi, la quantité de pluie tombée, son intensité et sa durée influencent à la hausse le nombre de spores dénombrées (Rossi et coll. 2002a). Les distances parcourues par les macroconidies sont variables et dépendent de la taille de celles-ci. On peut observer les différences de morphologie des espèces à la figure 1. Par exemple, pour F. culmorum, les macroconidies peuvent atteindre une distance horizontale de 100 cm et une hauteur de 60 cm quand elles sont éclaboussées par une goutte d’eau, mais vont en moyenne à 14 cm de hauteur et à 12 cm de longueur. En ce qui concerne F. avenaceum, les spores ne se rendent seulement qu’à 90 cm horizontalement et 45 cm verticalement, bien que la majorité d’entre elles se retrouvent entre 17 cm de distance et 4,5 cm de haut (Shaner 2003). Ainsi, les spores courtes et épaisses de F. culmorum peuvent avoir des déplacements aussi bien en hauteur qu’en longueur, tandis que les spores étroites et allongées de F.
avenaceum se déplacent plus facilement à l’horizontale. Sans égard à leur morphologie et à l’espèce, peu de
macroconidies peuvent ainsi passer directement du sol à l’épi par éclaboussures; elles doivent transiter par les feuilles pour y arriver (Sutton 1982; Osborne et Stein 2007).
Quant aux ascospores, la pluie est nécessaire au développement et à la maturation des périthèces, mais pas à leur dissémination dans l’environnement (Paulitz 1996). Dans l’étude de Paulitz (1996), les observations ont démontré que pendant les jours de précipitations ou d’humidité relative élevée (>80 %), la détection des spores sexuées dans l’air était grandement diminuée, voire nulle. Cette affirmation pourrait expliquer les résultats de Schmale et coll. (2005) dans leur étude sur les patrons de déposition des spores aériennes (sexuées et asexuées) de G. zeae dans les champs de blé. Dans cette expérience, des plats de Pétri ont été placés à 30 cm au-dessus des épis de blé pour collecter les spores viables provenant de l’atmosphère. Le patron formé par les spores récoltées en temps pluvieux était aléatoire et manquait de clarté, ce qui pourrait être expliqué par la disparition subite des spores occasionnée par la pluie (Schmale et coll. 2005). Le pic d’éjection des ascospores survient plutôt entre deux et quatre jours après l’épisode de précipitations (Paulitz 1996). Ces conclusions concordent avec celles de Shaner (2003). Toutefois, cette relation n’a pu être clairement établie dans l’étude de Francl et coll. (1999), car la méthode d’échantillonnage n’a pu permettre de mesurer adéquatement le phénomène d’augmentation de l’inoculum après un épisode de pluie. En revanche, toujours dans cette étude, très peu d’ascospores ont été observées lors d’un épisode prolongé de sécheresse, ce qui appuie le fait que les périthèces ont besoin d’eau pour se développer complètement et amener l’inoculum à maturité (Francl et coll. 1999). Or, la libération des ascospores est déclenchée par la différence entre l’humidité relative faible du jour et celle généralement plus élevée du soir à des températures se situant entre 11 et 30 °C (Paulitz 1996). Une fois relâchées, elles sont emportées par le vent et les courants d’air sur de plus ou moins longues distances (Schmale et Bergstrom 2003; Bailey et coll. 2004).
Pour mesurer l’ampleur de ce phénomène, une étude réalisée en Ontario et au Québec a évalué la distance d’infection par rapport à une source de spores sexuées ou asexuées de G. zeae placée artificiellement dans des parcelles expérimentales. L’inoculation de macroconidies a causé une infection qui s’est propagée jusqu’à 4,8 m de la source, autant dans la direction du vent que contre cette dernière. Avec l’inoculation d’ascospores, l’infection s’est répandue jusqu’à 22 m sous le vent et jusqu’à 19 m dans la direction opposée. Le gradient d’infection observé est de type exponentiel négatif et est plus allongé dans la direction du vent (Fernando et coll. 1997). Ces observations montrent que les spores sexuées sont plus facilement disséminées par les courants d’air que les spores asexuées qui, quant à elles, sont principalement dispersées par la pluie. Les ascospores sont deux fois plus petites que les macroconidies, ce qui peut expliquer leur facilité à être transportées par le vent (Sutton 1982). Le gradient trouvé par Fernando et coll. (1997) peut décrire l’infection
près de la source, mais ne peut être appliqué à de plus grandes distances, car les observations ont eu lieu dans des parcelles carrées d’une longueur variant entre 10 et 50 m.
Pour vérifier si le transport des ascospores était possible à plus grande échelle, Maldonado-Ramirez et coll. (2005) ont vérifié leur présence dans la couche de l’atmosphère qui s’étend de 50 m à 1 km au-dessus du sol, laquelle est caractérisée par des courants d’air puissants. Dans cette étude réalisée dans l’état de New-York entre 1999 et 2002, des spores viables ont été collectées en abondance à toutes les heures du jour et de la nuit à 60 m au-dessus de champs de blé commerciaux (Maldonado-Ramirez et coll. 2005). Ces résultats suggèrent donc que les ascospores peuvent se déplacer sur de longues distances via le transport dans les couches d’air supérieures et, par le fait même, être une source d’inoculum non négligeable à l’intérieur d’une région. Dans le même ordre d’idées, Francl et coll. (1999) ont trouvé de l’inoculum à des endroits où aucune source de G. zeae n’était connue, ce qui porte à croire que la distance de dispersion peut s’étendre jusqu’à 10 km. D’ailleurs, dans un volet d’une étude sur deux années menée pour caractériser la contribution de l’inoculum aérien, des boîtes de Pétri avec un médium sélectif pour Fusarium spp. étaient placées à l’intérieur et à l’extérieur d’essais de blé dans deux régions du Québec et étaient orientées soit vers le haut, soit vers le bas pour capter les propagules infectieuses de la fusariose de l’épi (Bérubé 2010). À chaque jour, les unités formant une colonie (UFC) ont été dénombrées sur les boîtes incubées. Dans la majorité des cas, le nombre d’UFC retrouvées dans les boîtes de Pétri vers le haut était significativement supérieur à celui des boîtes de Pétri vers le bas. Ces résultats supportent le fait qu’une partie importante de l’inoculum provient de l’extérieur du champ et est transporté par voie aérienne (Bérubé 2010). Une fois de plus, on constate que les conditions météorologiques, telles que la pluie ou le vent, jouent un rôle important dans cette partie du cycle épidémiologique de la fusariose de l’épi.
2.1.3.3 Processus d’infection
La fusariose se développe quand les ascospores ou les conidies sont transportées sur l’épi et que les conditions sont chaudes et humides avant et pendant la période de sensibilité du blé. L’épi est le plus sensible au moment de la floraison, c’est-à-dire à la sortie des étamines (Bailey et coll. 2004). Cette courte période de réceptivité fait en sorte qu’un seul cycle de la maladie est possible par année (Sutton 1982). Il s’agit également de la seule fenêtre (stades Z61 à Z65 de l’échelle de Zadoks et coll. (1974)) pour que l’application d’un fongicide soit efficace contre la fusariose de l’épi, ce qui correspond à une ou deux journées selon les conditions météorologiques (Rioux et coll. 2010). Toutefois, d’autres voies d’entrée potentielles ont été répertoriées dans la littérature, mais sont généralement peu documentées : les stomates, la fente entre la glumelle supérieure et inférieure, l’ouverture temporaire de l’épillet lors de la déhiscence du grain ainsi que la base des glumes où la couche sous l’épiderme n’a pas d’épaississement secondaire (Bushnell et coll. 2003). Ces voies pourraient expliquer les infections post-floraison, comme celles observées dans une expérience où
des parcelles étaient inoculées artificiellement avec un mélange de Fusarium. Les parcelles inoculées jusqu’à 17 jours après la floraison ont montré des symptômes plus sévères que ceux du témoin sans inoculation (Gourdain et Rosengarten 2011). Cependant, les auteurs mentionnent que d’autres études en conditions naturelles sont nécessaires pour valider ces conclusions.
La quantité d’inoculum atteignant l’épi est aussi un facteur déterminant pour l’infection. Les ascospores sont généralement considérées comme étant responsables de l’infection primaire, tandis que les macroconidies seraient la cause des infections secondaires (Sutton 1982). Cependant, à densité équivalente, les macroconidies et les ascospores causent une sévérité similaire des symptômes de la maladie (Stack 1989). Par conséquent, les conclusions d’une expérience impliquant des inoculations de macroconidies peuvent être généralisées et transposées pour les ascospores. Plusieurs études ont tenté d’évaluer le nombre de spores nécessaires (sexuées ou asexuées) pour que la fusariose de l’épi se développe, mais elles ne sont pas arrivées à une conclusion commune. Dans une expérience d’évaluation de différents cultivars résistants à la fusariose, Bai (1995) soutient que deux macroconidies par épillet central peuvent causer 20 % d’épis fusariés, ou une incidence de 20 %, tandis qu’une dose augmentée à 2000 macroconidies par épillet central résulte en une incidence de 100 %. Francl et coll. (1999), quant à eux, tirent une conclusion plus générale. Ils affirment qu’un épillet doit être exposé à plus de 50 propagules efficaces dans une proportion supérieure à 10 % et ce, dans un environnement favorable au développement de la fusariose de l’épi, pour qu’il y ait une infection. Ainsi, les inoculations multiples (> 50 propagules) contribuent à augmenter la sévérité de la maladie (Francl et coll. 1999). Les régions ayant de telles conditions d’inoculum subissent souvent des épidémies de fusariose de modérées à sévères (Moschini et coll. 2004). En bref, la quantité de spores nécessaire pour induire la maladie est difficile à évaluer et n’est pas en elle seule garante de maladie (Shaner 2003).
Certaines conditions météorologiques sont essentielles pour favoriser la germination des spores et le développement des symptômes de la fusariose de l’épi. La température et l’humidité relative favorisant l’infection sont variables et interdépendantes. En effet, c’est plutôt la combinaison des facteurs du temps d'incubation, des espèces causant la fusariose et de la température qui est la plus significative quant à la fréquence d'infection (Rossi et coll. 2001). Pour F. graminearum, pas ou peu d’infection a lieu à des températures inférieure à 15 °C (Parry et coll. 1995; Rossi et coll. 2001). En effet, dans une expérience en conditions contrôlées, les symptômes de la fusariose commencent à se développer à partir de 14 °C, et ce, peu importe la durée de mouillure de l’épi de blé (Martínez et coll. 2012). L’incidence de la fusariose de l’épi augmente quand la température se situe entre 20 et 30 °C (Rossi et coll. 2001). Ces températures ne seraient pas le facteur limitant à l’infection, car elles sont fréquentes lors de la floraison du blé. Ce sont plutôt la quantité de précipitations ainsi que l’humidité relative pendant cette période qui sont déterminantes pour le développement de la maladie (Shaner 2003). En effet, Parry et coll. (1995) ont déterminé qu’à des
températures supérieures à 15 °C, la période d’humidité nécessaire pour que l’infection ait lieu augmente avec la diminution de la température, variant ainsi entre 24 et 72 h. Les travaux de Rossi et coll. (2001) l’ont également démontré: la période d’humidité nécessaire est de 24 h à 25 °C, mais augmente entre 36 à 72 h à 20 °C. De plus, si on compare la germination des ascospores de G. zeae et des macroconidies de
F. graminearum, les premières germent plus rapidement et ont besoin d’une humidité relative moins élevée
que les secondes pour infecter l’épillet et y produire du DON. Ce phénomène peut s’expliquer par le fait que les macroconidies ont besoin de la pluie pour atteindre les épis et que cette dernière serait aussi nécessaire pour la germination des spores (Beyer et coll. 2005). En d’autres mots, plus les conditions sont chaudes et humides lors de la floraison du blé, plus les risques d’infection sont élevés en présence suffisante d’inoculum.
L’interaction blé-Fusarium spp. lors de l’infection est une étape critique de la propagation de la maladie. Une fois entré et bien établi dans l’épillet, le champignon colonise l’ovaire, le stigmate et les anthères restantes pour se propager ensuite aux autres épillets par le système vasculaire ou par la paroi extérieure de l’épi lorsque les conditions sont humides. Plus précisément, il pénètre l’épillet de façon intercellulaire lors des deux premières journées de l’infection et établit ainsi une relation biotrophe avec le blé. Cependant, plus l’ovaire est développé, moins il est susceptible d’être colonisé par le pathogène (Bushnell et coll. 2003). Par la suite, le champignon envahit l’intérieur des cellules et l’interaction devient alors nécrotrophe. On pense que les mycotoxines produites par certaines espèces de Fusarium pourraient avoir un rôle à jouer dans ce changement de relation hôte-pathogène (Bushnell et coll. 2003).
2.1.4 Mycotoxines
Le terme mycotoxine est utilisé pour décrire les métabolites secondaires produits par un champignon qui causent des effets indésirables chez les humains et les animaux qui y sont exposés (Prandini et coll. 2009). Leur production peut être une réponse adaptative à des conditions de stress (Vujanovic et coll. 2012). En fonction de l’espèce de Fusarium qui cause la fusariose de l’épi dans la culture de blé, une ou plusieurs mycotoxines seront produites dans les grains à la suite de l’infection. La plus commune est le désoxynivalénol ou DON. On l’appelle aussi vomitoxine, à cause de ses effets toxiques sur les humains et les animaux (Commission canadienne des grains 2008). Le DON fait partie de la famille des trichothécènes, un type de toxine très répandu chez les ascomycètes. Celle-ci donne un avantage sélectif aux agents pathogènes qui la produisent, soit F. graminearum et F. culmorum, en augmentant leur virulence (Desjardins 2006). D’ailleurs, l’accumulation de DON est corrélée positivement à la présence de ces deux espèces (Kriss et coll. 2012). Cependant, l’avantage sélectif ne serait pas démontré lors de la phase saprophyte de Fusarium spp. (Leplat et coll. 2013). Les autres mycotoxines principalement produites par F. graminearum sont le nivalénol (NIV) et la zéaralénone (ZEN) (Magan et coll. 2002). Enfin, F. sporotrichioides produit deux mycotoxines hautement toxiques qui se doivent d’être mentionnées : la HT-2 et la T-2 (Magan et coll. 2002; Desjardins 2006; Tremblay
et coll. 2012). Certaines souches de F. poae peuvent aussi produire la T-2, mais c’est surtout la mycotoxine diacétoxyscirpénol (DAS) qui est associée à ce pathogène (Desjardins 2006).
Au Canada, la teneur en DON des grains est règlementée par la Commission canadienne des grains. Cette dernière a établi plusieurs classes qui correspondent à des niveaux de qualité, donc de rémunération, pour les récoltes de l’Ouest et de l’Est du Canada. Pour le blé destiné à la consommation humaine, les minoteries acceptent des lots non nettoyés ayant une teneur maximale de 2 ppm (Agence canadienne d’inspection des aliments 2012). Pour limiter les effets néfastes du DON et des autres mycotoxines sur la santé des troupeaux, l’Agence canadienne d’inspection des aliments (2012) recommande également des seuils à ne pas dépasser dans les rations des animaux. Le porc est le plus sensible à la vomitoxine : le maximum permis est de 1 ppm dans les aliments servis. Même à cette très faible dose, on peut observer des refus et des pertes d’appétit chez les porcelets. De plus, la limite de ZEN est de 0,25 ppm et celle de T-2 est de 1 ppm pour l’alimentation du porc. La zéaralénone affecte le système reproducteur et la T-2 le système immunitaire chez la plupart des animaux (Tremblay et coll. 2012). Par mesure de précaution, le plafond de 1 ppm de DON est recommandé pour les chevaux, car les effets du désoxynivalénol sont inconnus chez cet animal (Agence canadienne d’inspection des aliments 2012). Pour la volaille, les bouvillons et agneaux d’engraissement, la teneur maximale en DON est établie à 5 ppm et celle en HT-2 est à 0,1 ppm. Ces animaux semblent assez tolérants au DON et peu d’effets sur le gain de poids et sur la santé ont été observés quand ils ingéraient des rations contaminées. Cependant, la teneur maximale de DON acceptée par l’industrie avicole est de 1 ppm (Vanasse 2012). Toujours pour la volaille, la teneur maximale recommandée pour la T-2 est fixée à 1 ppm, car cette toxine peut causer des problèmes sur leur système immunitaire (Agence canadienne d’inspection des aliments 2012). Les bovins laitiers, quant à eux, ont un seuil maximal recommandé de 1 ppm pour le DON (Commission canadienne des grains 2008), 1,5 ppm pour les ZEN et 0,025 ppm pour la HT-2 (Agence canadienne d’inspection des aliments 2012). Bref, l’effet des mycotoxines n’est pas à sous-estimer dans les rations animales et dans l’alimentation humaine, car elles sont toutes néfastes pour la santé.
Les conditions météorologiques sont déterminantes pour le développement de la fusariose de l’épi : elles expliquent plus de 30 % de la variabilité de la maladie (Schaafsma et Hooker 2007; Landschoot et coll. 2012). En ce qui concerne les conditions favorisant l’accumulation de désoxynivalénol, elles ne sont pas clairement établies dans la littérature. L’accumulation de DON est liée à plusieurs interactions entre les différentes variables météorologiques (Landschoot et coll. 2012). Une analyse des relations entre les facteurs environnementaux et différents symptômes de la fusariose de l’épi sur le blé d’automne réalisée en Europe par Kriss et coll. (2012) a montré que le DON était corrélé positivement avec les mesures d’humidité relative, de précipitations et de mouillure du feuillage, plus particulièrement dans la période débutant cinq jours avant la floraison du blé, jusqu’à un mois après cette dernière. Landschoot et coll. (2012) tirent les mêmes conclusions
à la suite d’une étude similaire. Par contre, l’impact de la température est différent dans les deux analyses. Elle a une corrélation négative avec l’accumulation du DON selon l’étude de Kriss et coll. (2012) ou positive, plus particulièrement pendant la croissance végétative du blé d’automne, selon l’étude de Landschoot et coll. (2012). En conclusion, on peut noter des différences entre les conditions météorologiques liées à l’accumulation de DON et les périodes les plus significatives en fonction de la région du monde ou du climat étudié.
2.1.5 Moyens de lutte
Plusieurs moyens peuvent être employés pour réprimer la fusariose de l’épi, mais ce sont principalement les conditions météorologiques qui vont influencer la présence ou l’absence de maladie (Schaafsma et Hooker 2007; Landschoot et coll. 2012). En effet, dans l’étude de Schaafsma et coll. (2001), elles expliquaient 48 % de la teneur en DON observée dans la récolte de blé. Dans cette étude, la tolérance du cultivar et le précédent cultural étaient le deuxième et le troisième facteur d’influence sur l’accumulation de cette mycotoxine, ce qui peut être un guide quant aux moyens à appliquer pour diminuer l’incidence de la fusariose de l’épi au champ. Parry et coll. (1995), quant à eux, ont plutôt identifié trois grandes lignes directrices pour lutter efficacement contre cette maladie dans leur revue de littérature portant sur la fusariose de l’épi. Ils recommandent de diminuer la quantité d’inoculum, d’empêcher sa dispersion et de prévenir l’infection des épis de blé.
Les deux premiers éléments peuvent être contrôlés grâce à la rotation, au système de travail du sol et à la date de semis. Une rotation qui inclut des cultures non hôtes de la fusariose de l’épi avant le blé, tels que le soya, la luzerne ou le trèfle, permet de diminuer les risques d’infection en brisant le cycle de la maladie (Parry et coll. 1995; McMullen et coll. 1997; Leplat et coll. 2013). Le précédent cultural pouvait expliquer entre 14 et 28 % de la teneur en DON mesurée à la récolte de blé dans l’étude de Schaafsma et coll. (2001). L’inoculum primaire survit sur les résidus de culture, donc des précédents culturaux sensibles à la maladie, comme les céréales et le maïs, augmentent le réservoir d’inoculum pour la culture suivante (Leplat et coll. 2013). Plusieurs études rapportées par Leplat et coll. (2013) ont également démontré que l’incidence de la fusariose de l’épi chez le blé était plus élevée lorsqu’il était cultivé sur un retour de maïs ou de blé dur, car la quantité et la composition des résidus étaient plus favorables à la survie du complexe de pathogènes. Toutefois, plusieurs études n’ont pas réussi à observer cet effet de façon significative sur l’incidence de la fusariose de l’épi (Gilbert et Fernando 2004; Ván ová et coll. 2009) ou sur la composition des espèces de Fusarium y étant associées (Klix et coll. 2008). Pour le système de travail du sol, un système laissant plus de résidus en surface fait augmenter les risques de fusariose de l’épi, car ces derniers sont une source majeure d’inoculum (Gilbert et Fernando 2004). Les travaux de Dill-Macky et Jones (2000) ont démontré que, peu importe le précédent cultural, le labour était associé à une diminution de l’incidence et de la sévérité de la maladie chez le blé en comparaison avec le travail réduit ou le semis direct. Dans une autre étude réalisée en France, on a
également observé que le labour permettait de diminuer la teneur en DON des grains lorsqu’on le comparait au semis direct (Champeil et coll. 2004). Dans un système de travail réduit du sol, la décomposition lente des résidus laissés en surface rend plus d’éléments nutritifs disponibles pour F. graminearum ce qui favorise sa survie (Leplat et coll. 2013). Un travail du sol qui inverse la couche arable, tel que le labour, permet de diminuer la dispersion par le vent ou par la pluie de l’inoculum de la fusariose de l’épi (Dill-Macky et Jones 2000; Champeil et coll. 2004). De plus, le labour permet d’enfouir les résidus en profondeur, ce qui accélère leur décomposition et diminue le temps de survie du champignon, en plus de réprimer des mauvaises herbes qui pourraient être une source supplémentaire d’inoculum (Leplat et coll. 2013). Plusieurs travaux n’ont pu observer le lien entre la fusariose de l’épi et le système de travail du sol (Gilbert et Fernando 2004; Klix et coll. 2008; Ván ová et coll. 2009). Schaafsma et coll (2001), quant à eux, ont évalué que l’effet du système de travail du sol expliquait moins de 3 % de l’incidence d’une épidémie de fusariose de l’épi dans un champ donné. Bref, l’effet du travail du sol semble être variable d’une étude à l’autre.
Finalement, une date de semis tardive augmente les probabilités d’infection. En effet, le développement du blé semé tardivement se fait dans des conditions environnementales souvent plus chaudes et humides, donc plus propices au développement de la fusariose (Castonguay et Couture 1983; Champeil et coll. 2004). Dans une étude menée en Ontario, un semis de blé tardif a mené à une augmentation de la teneur en DON et du pourcentage de grains fusariés (Ma et coll. 2013). Cet effet était plus marqué dans le blé poussant dans les sols à texture grossière que celui poussant dans un sol à texture fine (Ma et coll. 2013). L’effet de la date de semis devrait être considéré avec le temps de maturité du cultivar de blé utilisé. Les blés hâtifs ont tendance à être plus résistants à la fusariose de l’épi que les blés tardifs (Champeil et coll. 2004). En fonction de la date de semis, un cultivar plus ou moins hâtif peut être sélectionné afin de diminuer les risques que la floraison coïncide avec des conditions chaudes et humides. Le temps de croissance du blé et la période de floraison, tout comme la fusariose de l’épi, dépendent fortement des conditions climatiques régionales (Champeil et coll. 2004). Toutefois, peu de publications analysent l’effet de la date de semis sur la maladie. C’est pourquoi des études sur une longue période devraient être traitées pour conclure quel cultivar doit être semé et à quelle période dans une région donnée pour diminuer les risques de fusariose de l’épi (Champeil et coll. 2004). Bref, la rotation, le système de travail du sol et la date de semis sont des facteurs clés de répression de la fusariose de l’épi, car ils diminuent la quantité d’inoculum au champ ainsi que son abondance lors de la floraison du blé.
Pour prévenir l’infection, plusieurs moyens peuvent être employés. Premièrement, le choix du cultivar est primordial, car les caractéristiques de résistance génétique de l’hôte ainsi que sa tolérance aux stress environnementaux sont déterminants quand la maladie est présente. La tolérance du cultivar à la maladie peut expliquer jusqu’à 27 % de l’incidence de la fusariose de l’épi dans un champ et il s’agit du deuxième facteur en importance qui explique l’intensité de la maladie (Schaafsma et coll. 2001; Schaafsma et Hooker 2007;
Landschoot et coll. 2012). Dans une expérience menée dans les conditions climatiques du Québec, il a effectivement été démontré qu’il s’agit d’un facteur déterminant quant à la présence de la maladie au champ (Bérubé 2010). D’ailleurs, les cultivars réagissent différemment à la pression de la fusariose de l’épi en fonction de la région où ils sont cultivés. Ce type d’interaction a été identifié dans plusieurs travaux de recherche et peut être expliqué par les conditions climatiques très variables d’une région à l’autre (Klix et coll. 2008; Lackermann et coll. 2011). Bien que plusieurs types de résistance à la fusariose de l’épi aient été détectés dans différents cultivars de blé, il est encore difficile aujourd’hui de produire des variétés résistantes qui seraient commercialisables (Dill-Macky 2003). La résistance est associée à plusieurs gènes et leur transmission est complexe et souvent associée à de faibles rendements (Miller et coll. 2013). Étant donné l’importance de la tolérance du cultivar dans la répression de la fusariose de l’épi, ceux qui sont hautement sensibles devraient être retirés du marché (Mesterházy 2003).
Deuxièmement, l’utilisation de fongicides peut également contribuer à prévenir l’infection de la fusariose de l’épi quand ils sont appliqués correctement et au bon stade phénologique. C’est ce dernier point qui limite l’efficacité des traitements, étant donné que la fenêtre d’application est très courte (Parry et coll. 1995). L’utilisation de buses adéquates, qui couvrent l’épi sur les deux faces en même temps, sont recommandées pour assurer l’efficacité du traitement (Mesterházy 2003). Plusieurs matières actives sont homologuées au Canada pour la répression de la fusariose de l’épi : le metconazole, le prothioconazole, le tébuconazole et le chlorothalonil (SAgE pesticides 2013). Leur efficacité n’est pas constante d’une région à l’autre, car des interactions entre la formulation du fongicide, l’environnement, les populations locales des pathogènes et la culture modifient le niveau de répression de la fusariose de l’épi (Paul et coll. 2008). Dans une méta-analyse regroupant des résultats de plus de 100 études différentes sur l’efficacité des fongicides qui ont été menées dans 14 états des États-Unis, Paul et coll. (2008) ont pu palier à ce problème et ont évalué l’efficacité de triazoles utilisés seuls ou en mélange. Pour diminuer la sévérité de la fusariose de l’épi, c’est un mélange de prothioconazole et de tébuconazole qui s’est avéré le plus efficace en réduisant en moyenne de 52 % les symptômes. Parmi les autres matières actives homologuées au Canada qui ont été évaluées par cette étude, on retrouve le metconazole, le prothioconazole seul et le tébuconazole seul qui diminuent la sévérité de la fusariose de l’épi de 50, 48 et 40 % respectivement (Paul et coll. 2008). Les résultats obtenus pour la diminution de la teneur en DON sont un peu différents. Le metconazole permet une réduction moyenne de 45 % de la teneur en DON des grains, le prothioconazole seul ou le mélange de prothioconazole et de tébuconazole engendre une diminution de 43 et 42 %, tandis que le tébuconazole seul diminue la teneur en DON de 23 % (Paul et coll. 2008). Ces diminutions sont cohérentes avec celles rapportées par Magan et coll. (2002) : un mélange de metconazole et tébuconazole réduit la teneur en DON d’un maximum de 50% par rapport à une parcelle n’ayant pas eu une application de fongicides au moment de la floraison. De plus, lors
les applications de prothioconazole ou d’un mélange de prothioconazole et de tébuconazole qui ont permis la plus grande réduction de la teneur en DON chez le blé, soit une diminution moyenne de 46 % (Rioux et coll. 2012). L’application de tébuconazole n’a pas été aussi efficace et a permis une réduction de la teneur en DON de 30 % (Rioux et coll. 2012). Ces résultats se rapprochent de ceux de la méta-analyse de Paul et coll. (2008). Dans le cas d’épidémies sévères, la teneur en DON ne sera pas nécessairement diminuée sous le seuil de 2 ppm avec une application de fongicide (Paul et coll. 2008; Rioux et coll. 2012). En ce qui concerne les fongicides à base de chlorothalonil, ils ne sont pas très utilisés au Québec (Dion et coll. 2010). Malgré que cette matière active soit homologuée au Canada contre la fusariose de l’épi, son efficacité à réprimer la maladie n’a pas été observée dans plusieurs études (Milus et Parsons 1994; Siranidou et Buchenauer 2001). Ainsi, les triazoles sont les plus efficaces pour limiter l’accumulation de mycotoxines dans les grains et ont tous le même mode d’action (inhibiteurs de stérols) sur les agents pathogènes de la fusariose de l’épi. Gérer la maladie avec une seule famille de fongicide augmente grandement les risques de développement de la résistance (Miller et coll. 2013). Néanmoins, l’application des traitements fongicides pourrait être optimisée avec un meilleur système de prévision des risques de maladie (McMullen et coll. 1997; Osborne et Stein 2007). En conclusion, pour gérer le plus efficacement les conséquences de la fusariose de l’épi comme les mycotoxines, l’application de fongicide doit être exécutée soigneusement dans les bonnes conditions en plus d’être combinée à un cultivar le plus résistant possible (Miller et coll. 2013).
Des agents de lutte biologique pourraient également être utilisés pour lutter contre la fusariose de l’épi. Des souches bactériennes isolées de plants de blé pourraient s’avérer efficaces, mais les recherches se poursuivent pour développer une formulation adéquate (Gilbert et Fernando 2004; Miller et coll. 2013). Plus particulièrement, une souche du mycoparasite Clonostachys rosea (ACM941) s’est avérée être un antagoniste actif pour réprimer la croissance de G. zeae (Xue et coll. 2008). Dans une étude comparant l’efficacité au champ d’ACM941 à une application de tébuconazole, ACM941 était aussi efficace que le tébuconazole pour réduire la croissance mycélienne, la germination des spores et le développement de périthèces de G. zeae. Cette souche a également permis de diminuer la teneur en DON entre 10 et 28 %, les grains fusariés entre 33 et 68 % ainsi que les épillets fusariés entre 44 et 51 % (Xue et coll. 2008). Malgré ces pourcentages intéressants, ACM941 était moins efficace que le tébuconazole pour réduire ces dernières variables à l’étude (Xue et coll. 2008). Néanmoins, étant donné son potentiel, cette souche a été intégrée à une formulation de biofongicide : CLO-1 (Xue et coll. 2013). Lors d’essais au champ, cette formulation a inhibé la production de périthèces sur tous les types de résidus de culture. Les résultats obtenus ne sont pas significativement différents de ceux obtenus avec le traitement au tébuconazole (Xue et coll. 2013). Toutefois, dans des essais réalisés au Québec entre 2009 et 2011, le produit CLO-1 n’a eu aucun impact sur la teneur en DON des grains après la récolte (Rioux et coll. 2012). Bref, bien que le CLO-1 semble être un biofongicide prometteur