Évaluation de l'inhibition de l'activité des anti-protéases et
la digestibilité des nutriments issus de farines de larves
de mouches soldats noires (Hermetia illucens) soumises à
différents traitements thermiques chez la truite arc-en-ciel
(Oncorhynchus m
ykiss)
Mémoire
Bakary Diarra
Maîtrise en sciences animales - avec mémoire
Maître ès sciences (M. Sc.)
Évaluation de l’inhibition de l’activité des anti-protéases et la digestibilité
des nutriments issus de farines de larves de mouches soldats noires
(Hermetia illucens) soumises à différents traitements thermiques chez la
truite arc-en-ciel (Oncorhynchus mykiss)
Mémoire
BAKARY DIARRA
Sous la direction de :
Grant W. Vandenberg
Résumé
Riches en protéines et énergie, les larves de mouches soldats noires (MSN, Hermetia
illucens) démontrent un fort potentiel comme aliments alternatifs pour l'industrie aquacole.
Toutefois, la présence de facteurs antinutritionnels (ex. anti-protéases) pourrait limiter l'inclusion des farines de larves de MSN chez les salmonidés, notamment, la truite arc-en-ciel (Oncorynchus mykiss), une espèce importante pour l’industrie aquacole québécoise. Des traitements thermiques généralement utilisés pour réduire la charge bactérienne et permettre l’entreposage prolongés sont proposés pour désactiver les facteurs anti-protéolytiques et augmenter la digestibilité des nutriments présent dans la farine de MSN. Ainsi, cette étude propose la comparaison de différents traitements thermiques (séchées au four à 60°C pendant 12h (LB); ébouillantées (100°C) et séchées au four à 60°C pendant 6h (LE); séchées au four à 130°C pendant 2 h (LS) sur 1) la réduction de l'activité anti-protéolytique in vitro des farines de larves de 5, 10, 15 jours post-éclosion traités avec des extraits d’enzymes digestives de truites arc-en-ciel juvéniles et 2) la digestibilité des nutriments in vivo des farines de larves de 10 jours (stade de récolte commercial).
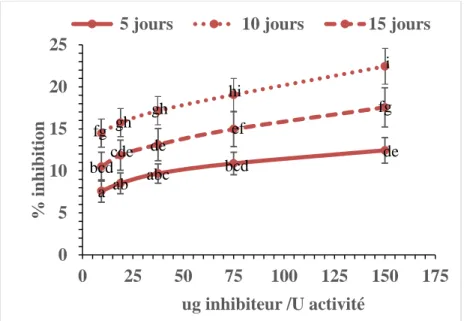
Lors des essais in vitro, nous avons observé que l'activité anti-protéolytique des farines de MSN varie entre les différents stades larvaires (p<0,001) et est maximale chez les farines de larves de 10 jours post-éclosion (inhibition = 22,4 ± 3,7%). Lors des essais de digestibilité, les diètes ont été formulées en remplaçant 30% d’un régime de référence pour les salmonidés avec l’ajout de 1% d’un marqueur indigeste (SipernatTM50). Deux méthodes analytiques
(cendres insolubles à l’acide (AIA) et fluorescence X à dispersion d’énergie (EDXFR) ont été utilisées et comparées pour doser le marqueur indigeste et déterminer les coefficients de digestibilité apparente (CDA). De plus, des traitements thermiques ≥ 100°C (LE et LS) permettent d’inhiber complètement l’activité anti-protéolytique. Une plus grande variabilité dans l’estimation des CDA des différents nutriments ainsi que la mise en évidence de valeur CDA inférieurs ont été obtenues par la méthode AIA que par la méthode EDXFR. Quel que soit le procédé de transformation (LB. LE et LS) aucune différence significative n’a été observée avec les protéines réelles, lipides bruts, matière sèche. Les larves stérilisées (LS) ont obtenu des CDA inférieurs aux deux autres traitements (LB et LE) pour l’acide gras C16 :1 et l’acide aspartique, et la lysine. De plus l’acide glutamique s’est montré plus digeste
avec les larves ébouillantées (LE) que les deux autres traitements (LB et LS). Les acides gras C12, C17 :0 des farines brutes se sont avérés moins digestes que ceux des farines ébouillantées (LE) et stérilisées (LS). Les minéraux tels que : le phosphore, le calcium se n’ont pas été digérés quel que soit le procédé de transformation, alors que le fer n’a pas été digéré pour les traitements LB et LS. Et le zinc s’est montré plus digeste avec les traitements LB et LS. Malgré les traitements la chitine reste une composante qui n’a pas été digéré chez la truite arc-en-ciel. Compte tenu de l’absence d’études de digestibilité dans la littérature, les résultats obtenus par fluorescence X à dispersion d’énergie (EDXRF) n’ont pas pu être été discutés. Toutefois, c’est une méthode qui a montré moins de variabilités entre les données plus rapide et potentiellement plus précise qui permet de déterminer le silicium, mais aussi d’autres minéraux dans les échantillons tels que le phosphore, calcium, zinc et fer. Et les digestibilités obtenues avec les différents traitements proposés se sont montrés plus efficaces que la méthode standard (AIA).
Mots clés : Mouche soldat noire (MSN), traitements thermiques, protéases intestinales,
coefficient de digestibilité apparente (CDA), méthodes analytiques, cendres insolubles à l’acide (AIA), fluorescence X à dispersion d’énergie (EDXFR), truite arc-en-ciel.
Abstract
Rich in protein and energy, black soldier fly larvae (BSF, Hermetia illucens) have a great potential as alternative feed ingredients for the aquaculture industry. However, the presence of antinutritional factors (e.g. antiproteases) could limit the inclusion of insect larvae meals for salmonids, including those for rainbow trout, an important species for the Quebec aquaculture industry. Heat treatments usually used to reduce the bacterial load to allow prolonged storage, could also deactivate antiproteases and increase the protein digestibility. The objective of this study was to compare different heat treatments (oven-dried at 60 °C for 12h (LB); scalded (4 minutes in 100°C water) and dried at 60 °C for 6h (LE); oven-dried at 130 °C for 2h (LS) on: 1) the inhibition of the anti-proteolytic activity in vitro of meal from larvae grown to 5, 10, 15 days post-hatching using digestive enzymes extracts of juvenile rainbow trout and 2) the digestibility of nutrients in vivo from 10-day larvae meal (standard commercial harvest age).
In in vitro evaluations, we observed that the anti-proteolytic activity of BSF meals varies between the different larval stages (p <0.001) and is maximal in meals from 10-day post-hatching BSF (inhibition = 22,4 ± 3.7%). In digestibility tests, the diets were formulated by replacing 30% of a reference diet for salmonids with the addition of 1% of an indigestible marker (Sipernat50™). Two analytical methods (acid-insoluble ash (AIA) and energy
dispersive X-ray fluorescence (EDXFR)) were used and compared quantification of the indigestible marker and determine the coefficients of apparent digestibility (CDA). In addition, heat treatments ≥ 100 ° C (LE and LS) completely inhibited the antiprotease
activity. Greater variability in the estimation of CDA of the various nutrients as well as the demonstration of lower CDA values were obtained by the AIA method than by the EDXFR
method. Irrespective of processing method (LB, LE and LS) no significant difference was observed for proteins, crude lipids, dry matter. The sterilized larvae (LS treatment) demonstrated lower CDAs than the other processing treatments (LB and LE) for C16: 1 fatty acid, aspartic acid, and lysine. In addition, glutamic acid was more digestible with scalded larvae (LE) versus the other two treatments (LB and LS). Also, the fatty acids C12, C17: 0 of raw insect meals were less digestible than those of scalded and sterilized meals. Minerals including phosphorus and calcium were indigestible irrespective of the processing treatment; Iron was indigestible for LB and LS treatments, whereas zinc was more digestible with LB and LS treatments. Under all processing methods, chitin remained indigestible. Despite the absence of digestibility studies in the literature, employing EDXRF to measure external digestibility markers, this approach is a chemical free, faster and potentially more accurate method for determining silicon, but also other minerals in samples such as phosphorus, calcium, zinc and iron. The digestibilities obtained with the different treatments were higher using the EDXRF method versus the standard method measuring AIA. Ultimately, this work should enable insect producers and aquafeed manufacturers meet the specific nutritional of aquaculture species.
Key words: Black soldier fly (BSF), heat treatments, fish proteases, apparent digestibility
coefficient (CDA), analytical methods, acid insoluble ash (AIA), energy dispersive X-ray fluorescence (EDXFR), rainbow trout
Table des matières
Résumé ... ii
Abstract ... iv
Listes des tableaux... ix
Listes des figures ... xi
Liste des abréviations, sigles, acronymes ... xii
Dédicace... xiv
Remerciements ... xv
Avant-propos ... xvii
Introduction générale ... 1
1 Chapitre 1 : Revue de littérature ... 3
1.1 Situation mondiale de l’aquaculture et aliments alternatifs ... 3
1.1.1 Production mondiale de poissons d’aquaculture ... 3
1.1.2 Production aquacole canadienne et québécoise ... 3
1.1.3 La truite arc-en-ciel ... 5
1.2 Les besoins nutritionnels de la truite arc-en-ciel ... 11
1.3 Le développement d’aliments alternatifs écoresponsables ... 13
1.3.1 Les insectes comestibles comme aliments alternatifs chez les poissons ... 14
1.4 Les larves de mouches soldats noires : cycle de vie, compositions proximales et transformation ... 15
1.4.1 Cycle de vie ... 15
1.4.2 Compositions proximales des farines de mouches soldats noires ... 16
1.4.3 Les procédés de transformation ... 20
1.5 Prétraitement et procédés de transformation des larves de mouches soldats noire ... 21
1.5.1 Ébouillantage et séchage à air chaud ... 21
1.5.2 Stérilisation... 22
1.6 Approche de détermination de la présence d’anti-protéases ... 22
1.7 Mesure de la digestibilité des nutriments ... 23
1.8 Digestibilités des principaux ingrédients contenus dans un régime de base de la truite arc-en-ciel 24 1.8.1 Digestibilité de la farine de larves de mouches soldats noires et des diètes contenant des farines de MSN chez la truite arc-en-ciel ... 25
1.9.1 Température d’élevage ... 27
1.9.2 Procédés de transformation ... 28
1.9.3 Effets des méthode détermination des indicateurs indigestes ... 28
1.9.4 Les facteurs antinutritionnels ... 29
1.9.5 Chitine ... 29
1.9.6 Anti-protéases... 29
1.10 Hypothèse et objectifs ... 30
1.10.1 Hypothèse ... 30
1.10.2 Objectifs ... 30
2 Chapitre 2 : Évaluation in vitro de l’inhibition des activités des anti-protéases des larves de mouches soldats noires (MSN ; Hermetia illucens) traitées par la chaleur chez la truite arc-en-ciel (Oncorhynchus mykiss) ... 32
2.1 Résumé ... 32
2.2 Abstract ... 34
2.3 Introduction ... 35
2.4 Matériels et méthodes ... 37
2.4.1 Détermination de la croissance et de l'évolution des stades larvaires ... 37
2.4.2 Évaluation in vitro de l’inhibition des protéases par les extraits farines de larves de mouches soldats noires traitées ou non par la chaleur ... 38
2.4.3 Quantification des protéines de l’extrait enzymatique ... 39
2.4.4 Préparation des extraits inhibiteurs ... 39
2.4.5 Activité protéolytique de l’extrait enzymatique ... 40
2.4.6 Inhibition des extraits ... 40
2.4.7 Analyses statistiques ... 41
2.5 Résultats ... 42
2.5.1 Détermination des stades larvaires de mouches soldats noires ... 42
2.5.2 Inhibition des protéases digestives par les farines de mouches soldats noires ... 44
2.6 Discussion ... 46
2.6.1 Essai in vitro ... 47
2.7 Conclusion ... 48
3 Chapitre 3 : Étude de la digestibilité in vivo des farines de larves de mouches soldats noires (MSN, Hermetia illucens) chez la truite arc-en-ciel (Oncorhynchus mykiss)... 49
3.1 Résumé ... 49
3.3 Introduction ... 53
3.4 Matériel et méthodes ... 56
3.4.1 Matériel biologique ... 56
3.4.2 Diètes expérimentales ... 57
3.4.3 Conditions d’élevage des truites... 58
3.4.4 Collectes des fèces ... 59
3.4.5 Analyses proximales des farines d’insectes, des diètes et des fèces ... 59
3.4.6 Calculs des coefficients de digestibilité apparents des nutriments ... 61
3.4.7 Analyses statistiques ... 69
3.5 Résultats ... 69
3.5.1 Les différences d’estimation du marqueur avec différentes méthodes analytiques des CDA. 69 3.5.2 Différences entre les CDA pour les diètes de MSN issues de différents procédés thermiques ... 71 3.6 Discussion ... 80 3.6.1 Matières sèches ... 80 3.6.2 Protéines ... 81 3.6.3 Lipides ... 81 3.6.4 Énergie ... 82 3.6.5 Chitine ... 82 3.6.6 Cendres et minéraux ... 83 3.6.7 Acides aminés ... 83
3.6.8 Impacts des mesures analytiques sur la détermination des CDA ... 84
3.7 Conclusion ... 84
3.8 Discussion générale ... 86
3.8.1 Essais in vitro et in vivo ... 86
Conclusion générale ... 87
Annexes ... 89
Listes des tableaux
Tableau 1-1: La pêche et aquaculture : production (millions de t) et consommation (kg) ... 3
Tableau 1-2: Les caractéristiques des principales enzymes digestives de l'estomac (E), des tissus pancréatiques exocrines (PE), de l'intestin (I) et de la bordure en brosse (BB). ... 10
Tableau 1-3: Besoins nutritionnels de la truite arc-en-ciel (adapté de la NRC, 2011) ... 12
Tableau 1-4: Compositions proximales des larves de MSN rapportées dans la littérature. ... 17
Tableau 1-5: Contenus en acides gras des larves de MSN rapportés dans la littérature ... 18
Tableau 1-6: Compositions en acides aminés (% MS) des larves de MSN rapportées dans la littérature. ... 20
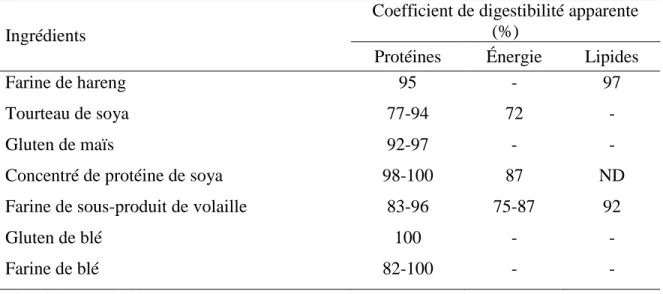
Tableau 1-7: Coefficients de digestibilité apparente (CDA%) des protéines, énergies et lipides pour les principaux ingrédients du régime de référence développé pour la truite arc-en-ciel. ... 25
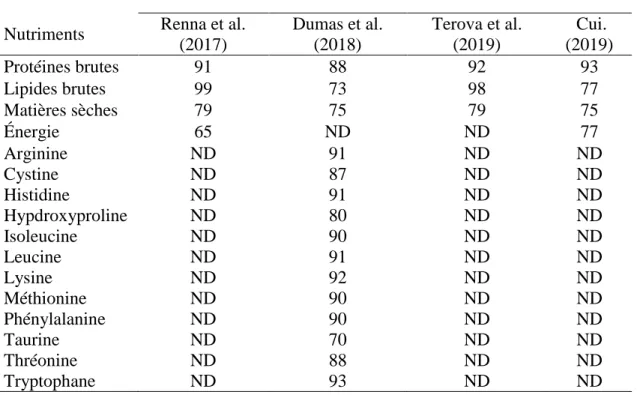
Tableau 1-8: Coefficients de digestibilité apparente (CDA, %) des farines de MSN chez la truite arc-en-ciel. ... 26
Tableau 1-9: Coefficients de digestibilité (CDA, %) des diètes contenant des farines de larves de mouches soldats noires chez la truite arc-en-ciel. ... 27
Tableau 2-1: Évolution des paramètres de couleurs lors de la croissance (jours post-éclosions) des larves de mouches soldats noires sur un régime Gainesville ... 43
Tableau 3-1: Formulation et composition chimique des diètes expérimentales. ... 58
Tableau 3-2: Composition proximale des farines de mouches soldats noires issues des différents procédés de séchages. ... 64
Tableau 3-3: Composition en acides gras (g/100g d’acides gras totaux) des farines de larves de mouches soldats noires issues des différents procédés de séchages. ... 65
Tableau 3-4: Composition en acides gras (g/100g d’acides gras totaux) des diètes expérimentales 66 Tableau 3-5: Composition en acides aminés des farines de mouches soldats noires issues des différents procédés de séchages. ... 67
Tableau 3-6: Compositions en acides aminés des diètes de larves de mouches soldats noires. ... 68
Tableau 3-7: Coefficients de digestibilité apparente (CDA, % MS) des nutriments de farines de MSN ayant subies différents de séchages chez la truite arc-en-ciel avec la méthode de cendre insoluble à l'acide (AIA) et la méthode de dosage de la silice par fluorescence à X à dispersion d’énergie (EDXFR). ... 72
Tableau 3-8: Coefficient de digestibilité apparentes (CDA, %) des différents nutriments de farines larves de MSN chez la truite arc-en-ciel avec la méthode (AIA) et la méthode de dosage de la silice par fluorescence à X à dispersion d’énergie (EDXFR). ... 73
Tableau 3-9: Coefficients de digestibilité apparente (CDA, %) des acides gras saturés de farines de MSN ayant subies différents procédés de séchages chez la truite avec la méthode (AIA) et la méthode de dosage de la silice par fluorescence à X à dispersion d'énergie ... 74
Tableau 3-10: Coefficients de digestibilité apparente (CDA, %) des acides gras mono et polyinsaturés de farines de MSN ayant subies différents procédés de séchages chez la truite avec la méthode (AIA) et la méthode de dosage de la silice par fluorescence à X à dispersion d'énergie ... 76
Tableau 3-11: Coefficients de digestibilité apparente (CDA, % MS) des acides aminés essentiels de farines de MSN ayant subies différents procédés de séchages chez la truite arc-en-ciel avec la méthode (AIA) et la méthode de dosage de la silice par fluorescence à X à dispersion d’énergie (EDXRF). ... 77
Tableau 3-12 : Coefficients de digestibilité apparente (CDA, % MS) des acides aminés non essentiels de farines de MSN ayant subies différents procédés de séchages chez la truite arc-en-ciel avec la méthode (AIA) et la méthode de dosage de la silice par fluorescence à X à dispersion d’énergie (EDXRF). ... 79 Tableau 3-13: Coefficients de digestibilité apparente (CDA, % MS) des nutriments des diètes avec 30% d’inclusion de farines de MSN ayant subies différents de séchages chez la truite arc-en-ciel avec la méthode de cendre insoluble à l'acide (AIA) et la méthode de dosage de la silice par
fluorescence à X à dispersion d’énergie (EDXFR). ... 90 Tableau 3-14: Coefficients de digestibilité apparente (CDA, % MS) des acides gras saturés des diètes avec 30% d’inclusion de farines de MSN ayant subies différents de séchages chez la truite arc-en-ciel avec la méthode de cendre insoluble à l'acide (AIA) et la méthode de dosage de la silice par fluorescence à X à dispersion d’énergie (EDXFR). ... 91 Tableau 3-15 : Coefficients de digestibilité apparente (CDA, % MS) des acides gras mono et polyinsaturés des diètes avec 30% d’inclusion de farines de MSN ayant subies différents de
séchages chez la truite arc-en-ciel avec la méthode de cendre insoluble à l'acide (AIA) et la méthode de dosage de la silice par fluorescence à X à dispersion d’énergie (EDXFR). ... 93 Tableau 3-16 : Coefficients de digestibilité apparente (CDA, % MS) des minéraux des diètes avec 30% d’inclusion de farines de MSN ayant subies différents de séchages chez la truite arc-en-ciel avec la méthode de cendre insoluble à l'acide (AIA) et la méthode de dosage de la silice par
fluorescence à X à dispersion d’énergie (EDXFR). ... 94 Tableau 3-17: Coefficients de digestibilité apparente (CDA, % MS) des acides aminés essentiels des diètes avec 30% d’inclusion de farines de MSN ayant subies différents de séchages chez la truite arc-en-ciel avec la méthode de cendre insoluble à l'acide (AIA) et la méthode de dosage de la silice par fluorescence à X à dispersion d’énergie (EDXFR)... 95 Tableau 3-18: Coefficients de digestibilité apparente (CDA, % MS) des acides aminés non
essentiels des diètes avec 30% d’inclusion de farines de MSN ayant subies différents de séchages chez la truite arc-en-ciel avec la méthode de cendre insoluble à l'acide (AIA) et la méthode de dosage de la silice par fluorescence à X à dispersion d’énergie (EDXFR). ... 96
Listes des figures
Figure 1-1: Évolution de la production piscicole au Québec de 1980 à 2011 ... 4 Figure 1-2 : Cycle de vie de la mouche soldat noire. Tiré de
https://www.nutrition-technologies.co.uk/black-soldier-fly ... 16 Figure 2-1: Évolution des stades larvaires de la mouche soldat noire par approche visuelle. ... 42 Figure 2-2: Inhibition (%) des protéases digestives de truites arc-en-ciel juvéniles lorsque mises en présence de concentrations croissantes (g inhibiteur/U activité) de farines de larves de 5, 10 et 15 jours post-éclosions après séchage à 60°C pendant 12h (LB). ... 44 Figure 2-3: Inhibition (%) in vitro des protéases digestives de truites arc-en-ciel juvéniles à 150 g inhibiteur/U activité des farines de larves de 5, 10 et 15 jours post-éclosions obtenues après séchage à 60°C pendant 12h (LB), lyophilisation (LL), ébouillantage 4 min à 100°C et séchées à 60°C pendant 6h (LE). ... 45 Figure 2-4: Inhibition (%) in vitro des protéases digestives de truite arc-en-ciel juvéniles à 150 g inhibiteur/U activité des farines de larves de 10 jours post-éclosion obtenues après séchage à 60°C pendant 12h (LB), lyophilisation (LL), ébouillantage à 4 min à 100°C séchage à 60°C pendant 6h (LE) et séchage à 130°C pendant 20 min (LS). ... 46 Figure 3-1: Schéma représentant les différentes étapes de production des farines de mouches soldats noires utilisées lors des essais in vivo. R = régime de référence ; LB = larves brutes séchées à 60°C pendant 12h; LE = larves ébouillantées 4 minutes et séchées à 60°C séchées pendant 6h ; LS = larves stérilisées à 130°C pendant 20 min. ... 57 Figure 3-2: Schéma du protocole expérimental utilisé lors des essais in vivo. R = régime de
référence ; LB = larves brutes séchées à 60°C pendant 12h; LE = larves ébouillantées 4 minutes et séchées à 60°C séchées pendant 6h ; LS = larves stérilisées à 130°C pendant 20 min. ... 63 Figure 3-3: Corrélation linéaire entre le pourcentage de cendres insolubles à l’acide (AIA) et le pourcentage de silice estimé par analyse EDXRF pour quantifier le marqueur indigeste dans les farines (n = 3), diètes (n= 4) et fèces (n=12). ... 70 Figure 3-4: Coefficients de variations de la digestibilité des nutriments par la méthode AIA et la méthode de dosage de la silice par fluorescence à X à dispersion d'énergie (EDXRF). ... 71 Figure 3-5: Évolution des paramètres physico-chimiques du régime Gainesville observés pendant l’évolution des stades larvaires ... 89
Liste des abréviations, sigles, acronymes
ACIA Agence canadienne d’inspection des aliments AIA Cendre insoluble à l’acide
ANOVA Analyse de variance
CDA Coefficient de digestibilité apparente EDXRF Fluorescence X à dispersion d’énergie
FAO Organisation des Nations unies pour l’alimentation et l’agriculture g Gramme
g/kg Gramme / kilogramme h Heure
HI Hermetia illucens
LARSA Laboratoire de recherche en sciences aquatiques de l’Université Laval LB Larves séchées au four à 60°C pendant 12 h
LE Larves ébouillantées à 100°C pendant 4 min puis séchées au four à 60 °C /6h LL Larves lyophilisées
Log Logarithme
LS Larves séchées au four à 130 °C pendant 20 min min Minute
MAPAQ Ministère de l’agriculture, des pêcheries et de l’alimentation de Québec MSN Mouche soldat noire
MS Matière sèche ND Non déterminé NR Non requis NT Non testé
Dédicace
Remerciements
Tout d’abord, je remercie le programme de Formation pour la Sécurité Alimentaire au Mali (FASAM) pour leur soutien financier qui m’a donné l’opportunité de venir me former au sein du département des sciences animales de la faculté des sciences de l’agriculture et de l’alimentation de l’Université Laval et aussi un remerciement particulier l’Institut Polytechnique Rural de Formation et de Recherches Appliquées de katibougou (IPR/IFRA) d’avoir cru à ma modeste personne. Je remercie aussi les ministères de l’Agriculture, des
Pêcheries et de l’Alimentation du Québec et Agriculture et Agroalimentaire Canada, pour
leur soutien financier à travers le « Programme Innov'Action agroalimentaire, programme
issu de l’entente Cultivons l’avenir 2 ». Je remercie le personnel du Laboratoire de recherche en sciences aquatiques (LARSA) et celui du Groupe de recherche en physiologie et sciences animales (GRIPHA) pour leur appui pendant les phases expérimentales et analytiques de ce
projet.
La réussite de ce travail, je la dois à ma direction de recherche, à commencer par mon directeur de recherche le professeur Grant W. Vandenberg, qui m’a accueilli au sein de son laboratoire et qui a été toujours à mes côtés avec des critiques, suggestions et encouragements pour l’amélioration de ce travail. Je tiens à remercier le Dre Marie-Hélène Deschamps qui a été toujours disponible pour m’aider à toutes les étapes du projet (de la mise en place du protocole expérimental jusqu’à la rédaction de ce mémoire) avec des critiques et recommandations pertinentes pour l’amélioration de ce manuscrit. Je remercie également Yolaine Lebeuf pour son accompagnement tout au long de l’acquisition des résultats dans le laboratoire. Yolaine, à travers toi, j’ai découvert beaucoup de techniques qui me serviront tout au long de ma vie. Je tiens aussi à remercier les techniciennes Nancy Bolduc et Annick Rioux pour leur accompagnement.
Je remercie spécialement Serena Saffiedine, auxiliaire de recherche au sein de notre laboratoire, pour son aide les fins de semaine pendant la phase expérimentale de ce projet. Je remercie également les stagiaires Maude Laurendeau, Cynthia Langevin et Thibault Perouma du Cégep de La Pocatière ainsi que Mariève Dallaire-Lamontagne pour leur aide précieuse durant la phase expérimentale. Leur accompagnement a rendu mes analyses au laboratoire plus rapides. Je tiens à remercier Waly Ndianco Ndiaye, doctorant, pour son aide ainsi que
l’ensemble de mes camarades au sein de notre laboratoire, M’ballou Cissé, Mahamoudou Koné, Jennifer Larouche, Justine Richard-Giroux et Julian Beniers pour leur encouragement.
Je tiens à remercier mes amis Souleymane Dabo et Talagbé Gabin Akpo de m’avoir accompagné pendant les analyses statistiques. Je vais aussi remercier mes amis Maty Sokhna Ndiaye, Halimatou Diallo, Naren Keita, Ousmane Z Traoré, Soumaïla Bagayoko, Raghad Soufan, Ousmane Magassa, Aïssatou Cissé, Rokiatou Diallo, Kadidiatou Diallo, Piterson Floradin pour leur soutien moral.
Enfin, je vais remercier ma famille, à commencer par mon père M’pè Diarra, ma mère Kadidiatou Samaké, mes sœurs Sirantou, Fatoumata, Néné, mon frère Salif, mon oncle Seydou, mes tantes oumou, Bintou pour leur soutien moral et leur accompagnement tout au long de mon séjour à Québec.
Avant-propos
Depuis 30 ans années, l’aquaculture fait partie des secteurs agricoles qui a une des plus importantes croissances et sa production a été estimée à 151 millions de tonnes en 2016 (FAO, 2016). Avec cette croissance galopante, cette industrie fait face à deux défis majeurs. Le premier défi sera de répondre à la demande en poisson compte tenu que la population humaine mondiale sera estimée à 12,3 milliards de personnes en 2100 (Gerland et al., 2014). Le deuxième défi sera la transition des ressources marines (farines et huile de poissons) actuellement utilisées en aquaculture vers des ressources terrestres (Lazzarotto et al., 2015). Avec une raréfaction des ressources marines et l’augmentation des prix de farines de poissons. En 2013, la FAO a proposé les insectes comestibles comme éventuelles sources de protéines alternatives pour les animaux (FAO, 2013). Les farines d'insectes ont des valeurs nutritionnelles similaires aux farines de poisson en ce qui concerne leur composition en protéines et en acides aminés essentiels (Ayoola, 2010). Ce projet porte sur l’utilisation des farines de larves de mouches soldats noires comme sources de protéines alternatives pour l’alimentation de la truite arc-en-ciel. Il a vu le jour sur la base des idées du professeur Grant W. Vandenberg, accompagné par d’autres chercheurs de la Faculté des sciences de
l’agriculture et de l’alimentation (FSAA) de l’Université de Laval. Ce projet a été réalisé
grâce à l’aide financière du Programme Innov'Action agroalimentaire, « un programme issu
de l’entente Cultivons l’avenir 2 conclue entre le ministère de l’Agriculture, des Pêcheries et de l’Alimentation du Québec et Agriculture et Agroalimentaire Canada ».
Ce projet a conduit à la réalisation de deux études :
1) Évaluation in vitro de l’inhibition des activités des anti-protéases des larves de mouches soldats noires (MSN; Hermetia illucens) traitées à la chaleur chez la truite arc-en-ciel (Oncorhynchus mykiss).
2) Étude de la digestibilité in vivo des farines de larves de mouches soldats noires (MSN,
Introduction générale
La production mondiale de poissons destinés à la consommation humaine a considérablement augmentée dans les dernières décennies, passant de 67% de la production totale de poissons dans les années 60, à 87%, soit plus de 146 millions de tonnes en 2014 (FAO, 2016). Quant à la production piscicole mondiale en 2017, elle a été estimée à 53,4 millions de tonnes pour une valeur monétaire avoisinant les 139,7 milliards de $US (FAO, 2019).
Au Canada, la production aquacole représente un marché estimé à ~1,3 milliards $ qui génère près de 76000 emplois (Pêches et Océans Canada, 2020). Elle est dominée par la production de salmonidés tels que le saumon atlantique et la truite arc-en-ciel qui sont de gros consommateurs d’aliments protéinés. Parmi les sources de protéines utilisées, les aliments des poissons carnivores, on retrouve les farines de poissons Elles constituent une excellente source de protéines et d’énergie hautement digestibles et d’acides aminés essentiels (Oliva-Teles, Enes, & Peres, 2015). Au Canada, les niveaux d’inclusion des farines de poissons ont été estimés entre 19-23% (Sarker et al., 2013).
Depuis quelques années, la disponibilité des farines de poissons est limitée à cause de la surexploitation des ressources marines, pêchés expressivement pour la production de farine et d’huile de poissons (Cui, 2019). De plus, sur le plan éthique et moral, ces aliments de grande qualité pourraient être mieux dirigés directement vers l’alimentation humaine (Cui, 2019). Enfin, une forte demande de la farine de poisson pour le secteur d’élevage en général a contribué à la hausse du prix de la farine de poisson en 2013 (FAO, 2014). L’augmentation de la demande et du prix ont favorisé l’utilisation de sources de protéines alternatives pour l'alimentation piscicole.
En 2013, la FAO a proposé les insectes comme éventuelles protéines alternatives pour les animaux d’élevage (FAO, 2013). Les farines d'insectes ont des valeurs nutritionnelles similaires aux farines de poisson en ce qui concerne leur composition en protéines et en acides aminés essentiels (Ayoola, 2010). À l’heure actuelle, quelques espèces d’insectes comestibles ont été proposées pour l'alimentation des poissons d'élevage telles que le ténébrion meunier (Rema et al, 2019) ainsi que la mouche domestique (Musca domestica) et la mouche soldat noire (van Huis et al., 2014). Les larves de mouches soldats noires (MSN,
matières organiques, leur cycle de vie relativement court (Li et al., 2011) et leur contenu élevés en protéines (42%) et matières grasses (29% ) (Wang et Shelomi, 2017). Elles offrent ainsi l’opportunité d’introduire un modèle d’économie circulaire par la valorisation de matières organiques résiduelles pour produire des aliments qui sont utilisés à leur tour dans l’alimentation animale (Barragan-Fonseca et al, 2017).
Une forte inclusion de farine de larves MSN dans les moulées commerciales peut toutefois compromettre les performances de croissance chez de la truite arc-en-ciel (Barroso et al., 2014). La présence de chitine et de facteurs antinutritionnels pourrait expliquer ces faibles performances de croissance en affectant la digestibilité de certains nutriments. Toutefois, peu d’études sur la digestibilité des farines de MSN sont, à l’heure actuelle, disponibles. Or, des travaux réalisés au sein de notre laboratoire ont démontré la présence de facteurs antinutritionnels in vitro chez la truite arc-en-ciel et que ceux-ci variaient en fonction de l'âge de récolte des larves (Deschamps et al., 2018).
Des procédés de transformation adéquats pourraient toutefois augmenter la digestibilité des protéines. En effet, des études récentes ayant remplacé 20-25% des farines de poissons par des farines de MSN (Renna et al., (2017), Terova et al., (2019) ; Dumas et al., (2018)) ont démontré que la digestibilité des protéines pouvait être augmentée avec une dé-lipidation partielle des larves. Il a été précédemment montré que les traitements thermiques des moulées avaient la capacité de dénaturer les protéines et d’inactiver les anti-protéases, notamment chez les protéines végétales (Moyano al., 1999).
En vue de développer de nouvelles moulées à base de produits d'insectes pour la truite arc-en-ciel, notre projet visait 1) à estimer in vitro la teneur en anti-protéases dans les farines de MSN. Et propose l’évaluation in vivo de la digestibilité des nutriments chez la truite arc-en-ciel lorsqu’elles sont alimentées avec des aliments à base de farine de MSN récoltées à différents stades larvaires et ayant subies différents traitements thermiques.
1 Chapitre 1 : Revue de littérature
1.1 Situation mondiale de l’aquaculture et aliments alternatifs 1.1.1 Production mondiale de poissons d’aquaculture
La production aquacole demeure mondialement importantes, qu’il s’agisse de l’alimentation, de la nutrition, des revenus (FAO, 2016). En 2014, la consommation mondiale de poisson a atteint plus de 20 kg par habitant, et ce, grâce à une forte croissance de l’aquaculture qui fournit aujourd’hui plus de la moitié de poissons destinés à la consommation humaine (FAO, 2016). Alors que l’aquaculture représentait environ 7% de l’offre en 1974. Sa proportion est passée à 26 % en 1994 et à 39 % en 2004 (FAO, 2016). La Chine est à la base de cette croissance et il faut noter qu’environ 80 % de sa production de poissons était issue de l’aquaculture en 2008. Le tableau 1, tiré du rapport de la FAO (2016), présente la production aquacole et son utilisation pour la consommation humaine entre 2009 et 2014.
Tableau 1-1: La pêche et aquaculture : production (millions de t) et consommation (kg)
2009 2010 2011 2012 2013 2016 Total Pêche 90,2 89,1 93,7 91,3 92,7 93,4 Total aquaculture 55,7 59,0 61,8 66,5 70,3 73,8 Consommation de poissons par personne 18,1 18,5 8,6 19,3 19,7 20,1 Estimations provisoires sans plantes aquatiques (les chiffres ont été arrondis au dixième près) (FAO, 2016).
1.1.2 Production aquacole canadienne et québécoise
L’aquaculture est l’élevage de poisson, de mollusques et crustacés, de plantes aquatiques, en eau douce ou salée (Pêches et Oceans Canada, 2019). .La production aquacole canadienne est dominée par les salmonidés (saumon et truite). Plus spécifiquement, la production de truite était estimée à 149 418 tonnes avec une valeur monétaire d’environ 1,3 milliards $CAN en 2018 (Pêches et Oceans Canada, 2019).
Au Québec, la production aquacole en eau douce est dominée par l’élevage des poissons (MAPAQ, 2019a). Cette filière pourrait jouer un rôle plus important dans la croissance économique de toute la province avec 10% du territoire recouvert d’eau douce.
Toutefois, la production aquacole de la province n’était estimée qu’à 994 tonnes, dominée par la truite arc-en-ciel en 2018, avec une valeur monétaire de 8,4 millions $CAN (Pêches et Oceans Canada, 2019).
Depuis 2018, le plan d’action ministériel 2018-2025 pour l’industrie des pêches et de l’aquaculture commerciale du Québec (MAPAQ, 2018)a mis des mécanismes en place pour doubler la production d’ici 2025 (MAPAQ, 2018). Notamment en encourageant des projets visant l’augmentation et la diversification de la production piscicole des entreprises ; en appuyant des techniques novatrices qui facilitent une meilleure performance de environnementales des entreprises et, soutenant des initiatives qui visent à promouvoir le secteur et à améliorer de positionnement de la filière auprès des consommateurs.
La figure 1-1 représente l’évolution de la production des salmonidés (truites, ombles, saumons) au Québec de 1980 à 2011. Depuis 1999, on observe une diminution de la production piscicole. Cela s’explique par l’implantation de mesures environnementales en matière de rejet du phosphore qui a contraint plusieurs entreprises piscicoles à fermer.
1.1.3 La truite arc-en-ciel
La truite arc-en-ciel (Oncorhynchus mykiss) est une espèce indigène de la côte ouest de l’Amérique du Nord (Gautier, 2011). Sa répartition d’origine va du nord-ouest du Mexique à la rivière Kuskowim, en Alaska (Crawford et Muir, 2008). Au Québec, elle a été introduite au début du 20ie siècle (MAPAQ, 2019). Cette espèce a la capacité de se nourrir d’insectes
aquatiques et terrestres, elle s’adapte très facilement à un nouvel environnement et fait partie des principales espèces de poissons utilisées dans l’aquaculture québécoise (Gautier, 2011).
La truite fait partie des principaux groupes d’espèces dans le commerce mondial de poisson, et de produits à base de poisson en 2016 (FAO, 2018). La production de truites des stades juvéniles à adulte est bien maitrisée et leur alimentation s’effectue avec des granulés secs (MAPAQ, 2019).. Elle est principalement utilisée pour la consommation et l’ensemencement dans certains plans d’eau ou l’espèce est autorisé. Comparativement à l’omble de fontaine (Salvelinus fontinalis), son élevage est plus facile, c’est une espèce qui est plus résistante aux maladies (MAPAQ, 2019). L’approvisionnement en œufs est possible durant toute l’année et elle supporte un niveau d’entassement plus élevé en bassin.
1.1.3.1 La truite arc-en-ciel comme modèle biologique en nutrition
La truite est une espèce euryphage carnivore (Hardy et Halver, 2002), c’est-à-dire qu’elle a des régimes alimentaires variés. Cette caractéristique rend cette espèce tout indiquée pour développer de nouveaux régimes alimentaires à base d’ingrédients qui ont des faibles impacts environnementaux tels que les insectes comestibles (van Huis, 2013). La truite arc-en-ciel se nourrit naturellement d’insectes (Józefiak et al., 2019). De plus, elle fait partie des espèces pour laquelle la compréhension de son système digestif et ses besoins nutritionnels est bien caractérisée, ce qui s’avère essentiel à la compréhension de la digestibilité des produits d’insectes.
1.1.3.1.1 Les processus de digestion chez la truite
Les poissons ont besoin de nourriture pour leur croissance, leur activités physiologiques et chimiques. Le système digestif du poison est composé d’une bouche, d’un estomac, d’un intestin proximal, de caeca pyloriques et d’un intestin distal (Çalta, 2016). . La vésicule biliaire et le foie sont aussi rattachés à l’intestin proximal ce qui permet la sécrétion de bile dans le chyme intestinal (Bakke et al., 2010).
La première étape de digestion après l’ingestion des aliment débute au niveau de l’estomac et se termine au niveau de l’intestin avec l’absorption des nutriments (Çalta, 2016). La digestion dépend de l’espèce, l’âge, la température environnementale et le type d’aliments (Windell et al., 1978b). La truite arc-en-ciel est une espèce dont le système digestif se développe avec l’âge pour devenir pleinement fonctionnel (Hardy et Halver, 2002). Le temps de rétention de l’aliment est un aspect important pour la digestion chez les poissons. Il a été montré que les larves des poissons carnivores ont un temps de rétention d’aliments court dans l’intestin (Çalta, 2016). Chez les truites juvéniles (96,9 g nourries avec 3,24% du poids vif et élevées à 15°C), la digestion gastrique et l’évacuation au niveau du duodénum commence généralement 4 heures après l’alimentation. Le quart des nutriments ingérés est libéré dans l’intestin au bout de 8 heures. L’évacuation totale étant estimée à 24 heures (Windell et al., 1969) .
1.1.3.1.1.1 La digestion gastrique
La digestion des protéines et des lipides débute dans la lumière de l’estomac à travers l’activité de la pepsine et de la lipase gastrique (Borey et al., 2017). La pepsine est synthétisée sous forme de pepsinogène qui va hydrolyser les liaisons peptidiques des acides aminés au niveau du radical aromatique tandis que la chymotrypsine hydrolyse la liaison carboxyle des acides aminés (Márquez et al., 2013).Les protéases comprennent également la trypsine, la chymotrypsine, l’élastase et la collagénase (NRC, 2011). Ce sont des protéases à serine qui brisent les liaisons peptidiques engageant de la lysine ou de l’arginine pour la trypsine, des acides aminés aromatiques pour la chymotrypsine et des acides aminés aliphatiques pour l’élastase. La digestion dans l’estomac provoque aussi une émulsification permettant une hydrolyse des lipides en diglycérides, monoglycérides et en acides gras libres. Enfin, certains minéraux (calcium, potassium, du magnésium, sodium) qui se dissolvent à pH acide sont absorbés dans l’estomac (Bucking et Wood, 2007). L’arrivée d’acides gras au niveau de duodénum stimule le processus de sécrétion pancréatique (Bakke et al., 2010).
1.1.3.1.1.2 Sécrétion des enzymes pancréatiques
Le tissu pancréatique participe à la synthèse et la sécrétion d’enzymes et de bicarbonates qui sont activés dans la lumière intestinale pour assurer le processus de digestion des aliments. Les cellules pancréatiques endocrines se trouvent sous le foie au niveau des corps de Brockmamm (Jönsson, 1991) alors que les cellules pancréatiques exocrines ont la
particularité d’être diffuses au sein du tissu adipeux des caeca pyloriques (Sahlmann et al., 2015). Les cellules pancréatiques synthétisent plusieurs enzymes tels que des protéases (trypsinogène, chymotrypsinogène et élastase) et lipidases (lipase pancréatique, estérase et phospholipase) (Kurtovic et al., 2009). Les poissons ajustent leurs sécrétions digestives en fonction du niveau alimentaire et de la qualité des nutriments ingérés (Buddington et al., 1997). Ainsi, une augmentation de l’activité de la lipase est associée à une augmentation des niveaux de lipides des aliments chez la truite arc-en-ciel (Ducasse-Cabanot et al., 2007).
1.1.3.1.1.3 Secrétions biliaires
La bile est composée de sels biliaires tels que les acides cholique et allocholique ainsi que la biliverdine et le pigment bilirubine (Grosell et al., 2000). Ces deux dernières proviennent du catabolisme de l’hème des globules rouges qui donne la couleur verte de la bile (Grosell et al., 2000). Une vésicule remplie de bile de couleur verte à noire indique une durée relativement élevée de stockage qui pourrait être expliquée par une absence prolongée de la prise alimentaire (McCormick et Podoliak 1984). Les sels biliaires, la bilirubine, et la biliverdine activent la lipase pancréatique et émulsionnent les lipides en chylomicrons. Les chylomicrons seront absorbés au niveau des entérocytes. Romarheim et al., (2008), ont montré que la durée et la source alimentaire des truites arc-en-ciel peuvent réduire la concentration des sels biliaires.
1.1.3.1.1.4 Digestion intestinale
C’est au niveau du mucus intestinal de l’épithélium digestif que les protéines hydrolysées en peptides seront découpées en dipeptides par des exopeptidases membranaires des entérocytes à partir des acides aminés ayant une extrémité aminée libre (Halver et Hardy, 2002). Les activités lipolytiques sont élevées au niveau de l’intestin proximal et des caeca pyloriques (Tocher, 2003). L’émulsification des lipides en micelles par les sels biliaires (Tocher, 2003) facilite l’hydrolyse des triglycérides par la lipase pancréatique à partir des liaisons sn-1 et sn6 des esters glycérol ce qui génère des mono et des di-acylglycérol (Canaan et al., 1999).
Malgré une alimentation naturelle en crustacés, les poissons carnivores tels que la truite sont peu enclin à digérer la chitine (Krogdahl et al., 2005). La raison peut être la faible
solubilité des polysaccharides, faible production de chitinase ou une faible absorption de N-acétyle- glucosamine, qui est le produit de l’activité de la chitinase (Gutowska et al., 2004).
1.1.3.1.1.5 Absorption intestinale
Le transport des nutriments de la lumière intestinale vers les entérocytes se fait par pinocytose, simple diffusion, transport actif ou par échange d’ions (minéraux) (NRC, 2011a)(NRC, 2011a)d’endocytose qui permet le transport des composés complexes et qui sont ensuite digérés par voie intracellulaire (Halver et Hardy, 2002). Elle transporte aussi des enzymes digestives. Quant au transport par diffusion, il est entraîné par des gradients de concentration des nutriments entre la lumière intestinale et les entérocytes (Smith, 1989). Le transport actif se fait à l’aide du transporteur membranaire PepT1, les acides aminés et les dipeptides libérés au niveau de la bordure des brosses des entérocytes vont rejoindre le cytosol des entérocytes (Santiago et al., 2008). Le transport par échange d’ions est sélectif et maintient le potentiel électrique des tissus. Par exemple, l’absorption des ions monovalents dans le système intestinal passe par les échanges Na+/H+ et Cl-/HCO3-. Quant au Na+, il est
absorbé en échange avec le H+ et Cl- ou le HCO3- (Hardy et Halver, 2002). L’assimilation
des protéines chez les larves et les poissons adultes peut entrainer une pinocytose et une digestion intracellulaire dans l’intestin (Watanabe, 1981).En outre, les peptides peuvent être absorbés directement (Buamrucker et al., 1989). La truite arc-en-ciel possède des transporteurs de peptides. Il y a été montré que la composition du régime alimentaire chez la truite arc-en-ciel pourrait affecter l’action des PepT1 (Ostaszewska et al., 2010).
Les lipides les plus importants dans les diètes pour les poissons sont les tri-acylglycérols et les phospholipides (Higgs et Fuiman, 2000).La biodisponibilité des lipides dépend de la longueur de la chaine des acides gras et de leur degré de saturation. Les acides gras à longues chaines (plus de 12 carbones), hydrolysés par la lipase et émulsifiés par les sels biliaires sous forme de micelles (Halver, et Hardy 2002),sont absorbés par pinocytose (Smith, 1989) à travers la bordure en brosse des entérocytes des caeca pyloriques de la
partie distal de l’intestin proximal (Tocher, 2003). Le tableau 1-2 montre les caractéristiques des principales enzymes, les organes de synthèse, les substrats ainsi que les produits : peptides, les acides.
Tableau 1-2: Les caractéristiques des principales enzymes digestives de l'estomac (E), des tissus pancréatiques exocrines (PE), de
l'intestin (I) et de la bordure en brosse (BB).
Enzyme Synthèse
Lieu
d'activité pH Substrat Produit
Pepsine E lumière E acide endoprotéase non spécifique peptides
Trypsine PE lumière I neutre endoprotéase spécifique de liaisons peptides
peptidiques engageant des aa basiques
Chymotrypsine PE lumière I neutre endoprotéase spécifique de liaisons peptides
peptidiques engageant des aa hydrophobes
Élastase PE lumière I neutre endoprotéase spécifique de liaisons peptides
peptidiques engageant la glycine ou l'alanine
Collagénase PE lumière I neutre collagène peptides
Leucine I BB neutre exopeptidase
peptides et leucine
aminopeptidase N
Carboxypeptidase PE et I BB neutre exopeptidase
peptides et acides aminés
Gastrique lipase E lumière E acide triacylglycérol diacylglycerol et
monoglycerol
Pancréatique
lipase PE lumière I acide lipides
Phospholipase PE lumière I neutre phospholipides acides gras
1.2 Les besoins nutritionnels de la truite arc-en-ciel
Lors de la production aquacole, le stade juvénile est le stade le plus long du cycle de vie de la truite arc-en-ciel (Borey et al., 2017). À ce stade, compte tenu de la faible capacité de la truite arc-en-ciel à utiliser les glucides alimentaires (Hardy, 2005), l’alimentation des truites se doit d’être riche en protéines et en lipides (Hamre et al., 2013). La diète alimentaire d’une truite juvénile doit constituer environ 4200 Kcal d’énergie digestible (NRC, 2011). Le
tableau 1-3 comporte les exigences minimales pour une croissance maximale des truites
arc-en-ciel juvéniles dans des conditions considérées comme optimales
.
Les besoins nutritionnels en protéines des truite arc-en-ciel entre 20-200 g sont estimés à 38-40% de la diète (voirtableau 1-3). Les sources de protéines doivent apporter dix acides aminés essentiels (voir tableau 1-3). De plus, deux acides semi-essentiels (cystéine et la tyrosine) ne peuvent être
synthétisées qu’à partir des acides aminés essentiels que sont la méthionine et la phénylalanine, respectivement. Les besoins en phosphore chez la truite arc-en-ciel sont estimés à 0,60 mg/kg. Les besoins en magnésium, fer, cuivre, zinc sont non déterminés et le calcium est considéré comme non requis.
Tableau 1-3: Besoins nutritionnels de la truite arc-en-ciel (adapté de la NRC, 2011)
Énergie digestible (Kcal/kg de diète) 4200
Protéine digestible (%) 38 Acides aminés (%) Arginine 1,5 Histidine 0,7 Isoleucine 1 Leucine 1,6 Lysine 2,2 Méthionine 0,7 Méthionine +cystéine 1,1 Phénylalanine 0,9 Phénylalanine +tyrosine 1,8 Thréonine 1,1 Tryptophane 0,3 Valine 1,2 Taurine NT Acides gras (%) 18 : 3n-3 1 n-3 LC-PUFA 1 18 : 2n-6 1 Cholestérol (%) ND Phospholipides (%) ND Minéraux (mg/kg) Calcium NR Magnésium ND Minéraux (mg/kg) Phosphore 0,60 Cuivre ND Fer ND Zinc ND
1.3 Le développement d’aliments alternatifs écoresponsables
La consommation humaine de poisson est estimée à 20 kg de poisson par habitant, dont plus de la moitié est fournie par l’aquaculture (FAO, 2016). Pour répondre à la demande croissante, une augmentation de la production mondiale issue de l’aquaculture qui respecte l’environnement est nécessaire. Les farines de poissons ont été longtemps considérées comme les principales sources de protéines, d’acides aminés et de gras essentiels comme les oméga-3 chez les poissons carnivores (Huang et al., 2019). Bien que de nombreux efforts ont été consentis ces dernières années pour la recherche d’ingrédients alternatifs, il reste encore 10-15 % de farines de poissons dans les régimes pour les poissons (Burel et Médale, 2014). Au Canada, les niveaux d’inclusion sont de l’ordre de 19-23% pour la formulation des diètes chez les salmonidés (Sarker et al., 2013).
Ces farines proviennent de la pêche de poissons pélagiques dont 30% des prises sont utilisées pour nourrir des animaux, ce qui constitue un détournement d'aliments qui pourraient autrement être consommés directement par les humains (Brits, 2017; FAO, 2016). Depuis quelques années, on assiste à une augmentation du prix des farines et des huiles de poisson, qui est due à la raréfaction de la ressource halieutique et d’une demande croissante en farine de poissons (Brits, 2017; FAO, 2016; Merino et al., 2012). Compte-tenu de la croissance exponentielle de la production aquacole, l’utilisation de farines de poissons ne peut plus être considérée comme durable.
Les recherches sur de potentielles sources de protéines alternatives pour l’alimentation des poissons au cours des dernières décennies se sont focalisées sur le remplacement partiel ou complet de la farine de poisson (Mariod, 2020). De nombreuses sources d’aliments alternatifs sont actuellement à l’étude (protéines végétales, algues, coproduits agricoles, etc.). Selon un récent rapport de la FAO (2013), un intérêt croissant se manifeste pour l’utilisation des farines d’insectes comestibles pour remplacer les farines de poisson dans la formulation des moulées des poissons d’élevage.
1.3.1 Les insectes comestibles comme aliments alternatifs chez les poissons
Bien que les insectes ont été présentés comme une denrée alimentaire d’intérêt il y a environ 45 ans (Barroso et al., 2014; Teotia et Miller, 1974), l'utilisation d'insectes dans les régimes piscicoles est récente (Barroso et al., 2014). Ce sont les farines d’insectes comme le ténébrion meunier (Rema et al., 2019), la mouche domestique et la mouche soldat noire (van Huis, 2013) qui ont été les plus étudiés.
L’utilisation de larves de mouches soldats noires comme aliment pour les poissons devrait être sérieusement envisagée, en raison de leur faible impact environnemental, de leur capacité à se nourrir de déchets organiques, leur conversion alimentaire élevée et leur faible émission de gaz à effet de serre (van Huis, 2013). Les larves d’insectes sont particulièrement intéressantes compte-tenu que leur production utilise peu d’espace comparativement aux autres productions animales car ces larves peuvent être produites en masse dans de petites installations (Olsen et Hasan, 2012). De plus, dans une étude réalisée sur l’utilisation des farines insectes comme composante des régimes de poissons, les résultats ont démontré que les farines d’insectes sont très riches en protéines (50-82%), en acides aminés essentiels (Henry et al., 2015) comparables aux farines de poissons (Diener et al., 2009). Les insectes contiennent de 31 à 43% de lipides en fonction des conditions d’élevages des insectes et des traitements utilisés pour l’obtention des farines d’insectes (Meneguz et al., 2018). Les farines de larves de MSN sont également riches en fer, zinc, potassium, phosphore, manganèse et en magnésium (Henry et al., 2015). D’un autre point de vue les larves de MSN sont particulièrement intéressantes en raison de leur capacité à convertir les déchets alimentaires (légumes, fruits) en protéines de haute qualité. À ce titre, sa production à l’échelle mondiale a augmenté au cours des dernières années surtout en Europe avec des entreprises comme Yinsect (France) et Protix aux Pays-Bas.
Depuis quelques années, des études ont été réalisées sur l’utilisation des farines de MSN comme ingrédient dans les régimes pour certaines espèces de poissons d’élevages. Chez le saumon, le remplacement des farines de poissons par les farines de larves de MSN ont montré qu’un remplacement de 40% de farines n’a pas d’effet sur la digestibilité des acides gras et des acides aminés des diètes (Lock et al., 2016). Une autre étude chez le saumon, un remplacement de 30 % de farines de poissons par les farines de MSN n’a pas affecté la digestibilité des protéines, de l’énergie et des lipides (Fischer et al., 2020). Chez la
truite arc-en-ciel, une étude sur l’évaluation des farines de larves comme ingrédients alternatifs a montré qu’un remplacement entre 25 et 50 % de farines de poissons n’a pas d’effet sur la digestibilité en énergie, tandis que les digestibilités en matière sèche et protéines brutes étaient significativement inférieures avec 50 % d’inclusion comparée à 25%. (Renna et al., 2017). Dans une étude sur l’effet de l’utilisation des larves de MSN sur les performances de croissances, l’efficacité alimentaire, la déposition des nutriments et la digestibilité des lipides chez la truite arc-en-ciel, les résultats ont montré qu’avec un remplacement de 20% de farines de poissons par les farines de MSN, il n’y a pas de différence significative entre la digestibilité des protéines, matières sèches et des acides aminés tels que l’arginine, la cystine, l’histidine, l’isoleucine, la leucine, la lysine, la méthionine, la phénylalanine, la taurine et la thréonine Terova et al., 2019). La même étude a aussi démontré qu’il n’y a pas de différence significative entre la digestibilité des nutriments quels que soient les niveaux d’inclusions (10-30%) des farines de MSN et que le niveau de digestibilité en protéines était supérieur à 90 % pour tous les traitements.
1.4 Les larves de mouches soldats noires : cycle de vie, compositions proximales et transformation
1.4.1 Cycle de vie
Le cycle de vie des mouches soldats noires est relativement court et larves passent par 6 stades incluant le stade pré-pupe, puis le stade pupe (Barros-Cordeiro et al., 2014). L’éclosion des œufs sous une température de 24°C peut aller jusqu’environ 105 h (Li et al., 2011). Hall et Gerhardt (2002) estiment que les larves de MSN, dans des conditions optimales, passent par 6 stades en 14 jours. Après le stade sixième stade , l’exosquelette de la larve passe d’une couleur blanche à une couleur marron foncé (phénomène de mélanisation) (Sheppard et al., 2002) (voir figure 1-2).
Le stade pré-pupe est le plus utilisé en alimentation animale à cause de leur composition nutritionnelle (Liu et al., 2017). À la récolte, les larves de mouches soldats ont idéalement une longueur d’environ 27 mm avec une largeur de 6 mm (Makkar et al., 2014). L’atteinte du stade pré-pupes prend jusqu’à 2 semaines à 30°C (Furman et al., 1959) en fonction des conditions d’élevage. Une alimentation limitée peut toutefois rallonger le stade pré-pupe jusqu’à 4 mois (Furman et al., 1959). C’est au stade pré-pupe que la mouche soldat noire arrête de s’alimenter, vide son tube digestif, développe un gras qui va servir d’énergie
pour sa migration et la nymphose vers le stade adulte (Sheppard et al., 1994). La phase de pupaison prend généralement deux semaines avant l’émergence de l’adulte (Park, 2016).
Figure 1-2 : Cycle de vie de la mouche soldat noire. Tiré de
https://www.nutrition-technologies.co.uk/black-soldier-fly
1.4.2 Compositions proximales des farines de mouches soldats noires
Le stade larvaire peut avoir des effets sur la composition nutritionnelle de la mouche soldat noire. Giannetto et al. (2020) ont en effet démontré que la teneur en protéines brutes, en lipides bruts et en acides gras saturés de pré-pupes MSN était supérieure aux autres stades larvaires. Liu et al., (2017) ont aussi observé une fluctuation dans la composition nutritionnelle des MSN produites dans la moulée de volaille tout au long de son cycle de vie. La composition en gras insaturés des larves est supérieure à celle des pré-pupes. Le contenu en acide laurique est quant à lui plus élevé chez les pré-pupes que chez la larve. Ce sont ces deux stades (larvaires et pré-pupes) qui sont utilisées dans l’alimentation des poissons.
Le contenu nutritionnel des larves/pré-pupes varie également en fonction de leur régime alimentaire et des procédés de transformation qui sont appliqués lors de la production des farines (Giannetto et al., 2020). Différentes valeurs nutritionnelles ont ainsi été rapportées
chez les larves MSN (tableau 1-4 à 1-6) avec des compositions sur une base sèche variant en protéines brutes (43,30 à 55,5% MS), lipides bruts (17,97 à 26,20% MS), matières sèches (89,92- 98,18% MS), énergie (24,37- 25,86% MS), cendres (8,00-19,80% MS) et chitine (2,73-5,00% MS). Les niveaux d’acides gras monosaturés sont plus élevés qu’en acides gras polyinsaturés (Liland et al., 2017). Le contenu en lipides est dominé par des gras saturés tel que l’acide laurique (C12 :0) (51,39-58,59g/100 de gras totaux) et l’acide palmitique (C16 :0) (12,03-12,43g/100 de gras totaux). Les compositions en acides aminés essentiels rapportées dans la littérature sont variables (voir tableau 1-6) : arginine (1,5-4,2%), histidine (1,0-2,4%), isoleucine (1,6-3,6%), leucine (2,4-6,0%), méthionine (0,6-2,1%) et thréonine (1,4-3,1%).
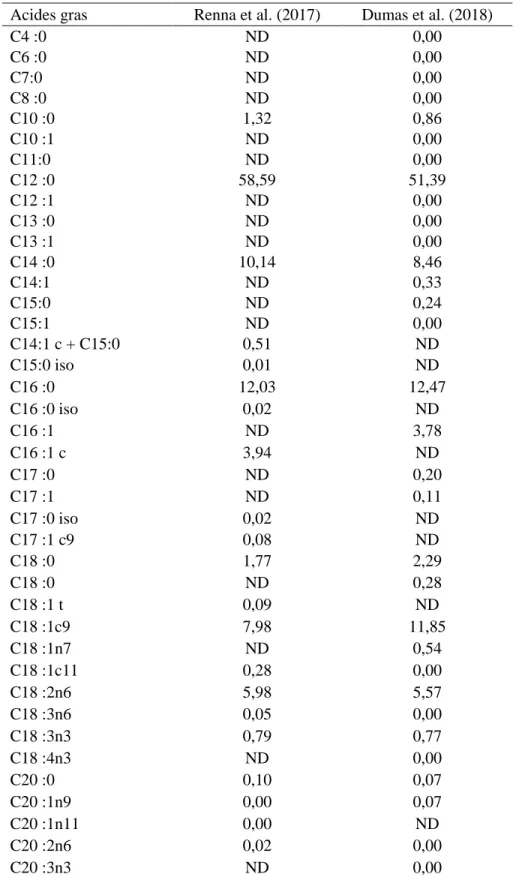
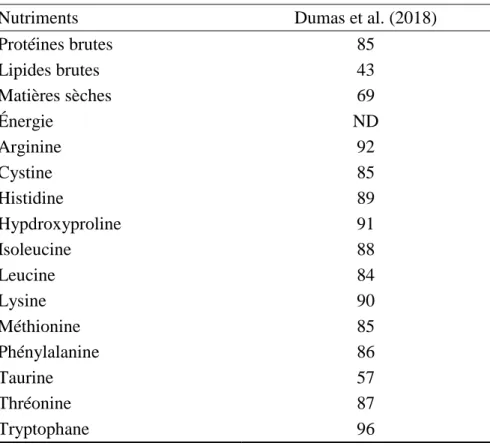
Les larves de MSN contiennent également de la chitine, un polymère linéaire d’unités N-acétyle glucosamine, qui est une composante majeure de l’exosquelette. Dumas et al., (2018) ont montré que la farine de MSN peut contenir 2,73% de chitine alors que Renna et al., (2017) et Tevora et al. (2019) mentionnent des teneurs de 5 %.
Tableau 1-4: Compositions proximales des larves de MSN rapportées dans la littérature.
Farines de MSN Compositions proximales (% MS) Renna et al. (2017) Dumas et al. (2018)
Terova et al. Cui (2019) Józefiak et al. (2019) -2019 Matières sèches 98,18 96,06 89,92 ND ND Cendres 7,12 12,57 8,74 19,8 8 Protéines brutes 55,34 47,09 48,62 43,3 45,05 Lipides brutes 17,97 20,29 20,58 26,2 20,08 ADF ND 5,1 ND ND ND Chitine 5,00 2,73 4,96 ND ND Énergie (MJ/kg, MS) 24,37 ND 25,86 24,6 ND Macro-élements Calcium ND ND ND ND 1,57 Magnésium ND ND ND ND ND Phosphore ND ND ND ND 1,12
Tableau 1-5:Contenus en acides gras des larves de MSN rapportés dans la littérature
Acides gras Renna et al. (2017) Dumas et al. (2018)
C4 :0 ND 0,00 C6 :0 ND 0,00 C7:0 ND 0,00 C8 :0 ND 0,00 C10 :0 1,32 0,86 C10 :1 ND 0,00 C11:0 ND 0,00 C12 :0 58,59 51,39 C12 :1 ND 0,00 C13 :0 ND 0,00 C13 :1 ND 0,00 C14 :0 10,14 8,46 C14:1 ND 0,33 C15:0 ND 0,24 C15:1 ND 0,00 C14:1 c + C15:0 0,51 ND C15:0 iso 0,01 ND C16 :0 12,03 12,47 C16 :0 iso 0,02 ND C16 :1 ND 3,78 C16 :1 c 3,94 ND C17 :0 ND 0,20 C17 :1 ND 0,11 C17 :0 iso 0,02 ND C17 :1 c9 0,08 ND C18 :0 1,77 2,29 C18 :0 ND 0,28 C18 :1 t 0,09 ND C18 :1c9 7,98 11,85 C18 :1n7 ND 0,54 C18 :1c11 0,28 0,00 C18 :2n6 5,98 5,57 C18 :3n6 0,05 0,00 C18 :3n3 0,79 0,77 C18 :4n3 ND 0,00 C20 :0 0,10 0,07 C20 :1n9 0,00 0,07 C20 :1n11 0,00 ND C20 :2n6 0,02 0,00 C20 :3n3 ND 0,00
C20 :3n6 0,00 0,00 C20 :4n6 0,00 0,00 C20 :4n3 ND 0,00 C20 :5 n3 0,00 0,00 C22 0,03 0,00 C21 ND 1,11 C22 :1n11 ND 0,00 C22 :1n9 0,00 0,00 C22 :2n6 ND 0,00 C22 :5n3 0,00 0,00 C22 :6 n3 0,00 0,00 C24 :0 ND 0,00 C24 :1n9 ND 0,00 Ʃ gras saturés 80,28 ND
Ʃ gras mono saturés 12,88 ND
Ʃ gras polyinsaturés 6,84 ND
Ʃ gras polyinsaturés/ Ʃ
gras mono saturés 0,09 ND
Ʃ n3 0,79 0,77
Ʃ n6 6,05 5,54
Tableau 1-6: Compositions en acides aminés (% MS) des larves de MSN rapportées dans la littérature. Farine de MSN Renna et al. (2017) Dumas et al. (2018) Józefiak et al. (2019) Cui (2019) Arginine 3,9 2,19 4,26 1,58 Cystine 0,1 ND ND ND Histidine 2,2 1,06 2,49 1,03 Isoleucine 3,3 1,92 3,62 1,62 Leucine 5,2 3 6,03 2,4 Lysine 3,8 2,79 3,66 2,29 Méthionine 2,1 0,63 ND 0,72 Phénylalanine 3 1,79 ND 1,56 Thréonine 3,1 1,67 ND 1,45 Tryptophane ND 0,54 0,83 ND Valine ND ND 4,52 ND Phénylalanine +tyrosine ND ND 4,86 ND Méthionine +cystine ND ND 1,27 ND Alanine 6,2 ND ND 2,71 Acide aspartique 6,7 ND ND 3,43 Glycine 4,2 ND ND 1,99 Cystéine+cystine ND ND ND 0,33 Acide glutamique 8,8 ND ND 3,87 Proline 5,5 ND ND 1,99 Serine 3,7 ND ND 1,45 Tyrosine ND ND ND 2,82
ND signifie non déterminé.
1.4.3 Les procédés de transformation
Les larves de MSN séchées et entières de la compagnie Enterra (Vancouver, Colombie-Britannique) ont été accréditées pour l’alimentation des salmonidés par l’Agence
Canadienne d’Inspection des Aliments en 2017 (ACIA, 2018). Elles font partie de la
catégorie des nouveaux aliments et doivent subir des traitements pour l’innocuité et être exemptes de bactéries pathogènes comme le Salmonella (ACIA, 2018) puisque lors de la production, les insectes comestibles sont exposés à divers microorganismes et pathogènes (FAO, 2013). Les larves de MSN fraiches sont hautement périssables en raison de leur teneur en eau qui varie entre 78-84%, de leur pH proche de la neutralité (6-9) (Wynants et al., 2019)
et de leur charge microbienne élevée dominée par des bactéries aérobies mésophiles totales (8,95 log ufc/g), bactéries lactiques (8,25 log ufc/g), Pseudomonas spp (8,41 log ufc/g),
Listeria spp (7,48 log ufc/g) et Escherichia coli (7,19 log ufc/g) (Cisse et al., 2019).Ainsi, un processus de transformation pour réduire les risques sanitaires et permettre leur conservation lors de l’entreposage est fortement recommandé. Suite à la production d’insectes, il est nécessaire de trouver des procédés de transformation adaptés pour faciliter l’inclusion des coproduits d’insectes dans l’alimentation des poissons (Van Huis, 2013).
1.5 Prétraitement et procédés de transformation des larves de mouches soldats noire
1.5.1 Ébouillantage et séchage à air chaud
L'ébouillantage est un prétraitement utilisé pour la réduction de la charge microbienne d’un produit (Purschke et al, 2018). Il sert également à inactiver les enzymes qui causent la dénaturation de la couleur d’un produit, sa saveur ou sa valeur nutritive (Purschke et al, 2018). L’ébouillantage est dit efficace s’il est réalisé à des températures comprises entre 65°C et 100°C (Purschke et al., 2018).
Le séchage est, quant à lui, une technique de conservation des aliments qui consiste à réduire la quantité d’eau pour éviter la prolifération des microorganismes (Bazinet et Castaigne, 2011).Le séchage ralentit la dégradation des produits alimentaires et en réduit la masse, ce qui facilite le transport et leur entreposage. Il existe plusieurs types d’appareils de séchage et notamment, le four à air chaud, le sécheur à plateau et le tunnel de séchage (Bazinet et Castaigne, 2011).
Dans une étude réalisée au sein de notre laboratoire, Cisse et al., (2019) ont démontré qu’un prétraitement par ébouillantage de 4 min suivi d’un séchage à air chaud à 60°C était optimal pour maintenir la qualité nutritionnelle des larves et réduire leur charge microbienne. Ces résultats ont montré une diminution des charges en bactéries lactiques et les aérobies mésophiles totales dont les valeurs observées étaient en dessous de la norme autorisée par le MAPAQ (≤ 6 log).
1.5.2 Stérilisation
La stérilisation est un procédé de transformation des aliments qui détruit tous les microorganismes capables de se développer sur un aliment pendant la période d’entreposage (Bazinet et Castaigne, 2011). Elle permet également de détruire les enzymes provoquant la détérioration des produits alimentaires et ainsi prolonger la vie des aliments. Toutefois, lors de la stérilisation, il se passe des changements conséquents sur les protéines (ex. : hydrolyse en polypeptides et en acides aminés) et la réduction de la valeur nutritive (Bazinet et Castaigne, 2011). Le procédé de stérilisation joue en effet sur la biodisponibilité des acides aminés (Bazinet et Castaigne, 2011). Ce procédé utilisé pour répondre aux normes de la communauté européenne.
1.6 Approche de détermination de la présence d’anti-protéases
Il existe plusieurs facteurs antinutritionnels dans l’alimentation des animaux tels que les anti-protéases, les phytates et les tanins. Certains de ces facteurs antinutritionnels sont des inhibiteurs de protéases appelés aussi anti-protéases. Ces facteurs ont la capacité de réduire les activités protéolytiques des enzymes secrétées dans la lumière intestinale des poissons (Moyano al., 1999). Pour déterminer la présence et l’activité des anti-protéases, une méthode a été développée par Moyano et al., (1999). Elle consiste à extraire les enzymes digestives des poissons et à les mettre en contact avec des extraits inhibiteurs obtenus à partir d’ingrédients finement broyés. Un mélange de l’extrait d’enzymes et de volumes variables d’extraits d’inhibiteurs sont pré-incubés à température pièce pendant 60 minutes dans l’eau distillée. L’activité enzymatique résiduelle est évaluée par une nouvelle incubation de ce mélange pendant 30 minutes dans une solution caséine (0,5%). Le niveau d’inhibition dépend de l’espèce de poissons et des ingrédients utilisés (Moyano et al., 1999). Une grande sensibilité des protéases digestives (niveaux d’inhibition d’environ 40%) à la présence d’anti-protéases dans de nombreux ingrédients (farine de soya délipidée, gluten de maïs et le son de blé) a été observée chez différentes espèces de poissons. C’est pourquoi il est très important de vérifier la présence et les effets des anti-protéases des nouveaux ingrédients avant leur utilisation dans l’alimentation des poissons puisque ces facteurs peuvent affecter l’efficacité des enzymes digestives et ainsi la digestibilité des aliments.