HAL Id: dumas-01700871
https://dumas.ccsd.cnrs.fr/dumas-01700871
Submitted on 5 Feb 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Altération de la fonction contractile chez les patients
drépanocytaires : analyse de la cohorte ETENDARD
Leïla Piorunowski
To cite this version:
Leïla Piorunowski. Altération de la fonction contractile chez les patients drépanocytaires : analyse de la cohorte ETENDARD. Médecine humaine et pathologie. 2017. �dumas-01700871�
N° 2017ANTI0183
THESE
Présentée et soutenue publiquement à la Faculté de Médecine Hyacinthe BASTARAUD des Antilles Et examinée par les Enseignants de la dite Faculté
Le 26 juin 2017
Pour obtenir le grade de DOCTEUR EN MEDECINE
Par PIORUNOWSKI Leïla
Jury
Président : Professeur NEVIERE Rémi
Membres : Professeur VENISSAC Nicolas
Professeur BOURGUET Patrick
Docteur INAMO Jocelyn
Altération de la fonction contractile chez les patients
drépanocytaires :
2
Le Président de l'Université des Antilles : Jacky NARAYANINSAMY Doyen de la Faculté de Médecine : Raymond CESAIRE
Vice-Doyen de la Faculté de Médecine: Suzy DUFLO
Professeurs des Universités - Praticiens Hospitaliers
Bruno HOEN Maladies Infectieuses
CHU de POINTE- À -PITRE/ABYMES
Pascal BLANCHET Chirurgie Urologique
CHU de POINTE- À -PITRE/ABYMES
André-Pierre UZEL Chirurgie Orthopédique et Traumatologie CHU de POINTE-A-PITRE/ABYMES
Pierre COUPPIE Dermatologie
CH de CAYENNE
Thierry DAVID Ophtalmologie
CHU de POINTE-A-PITRE/ABYMES
Suzy DUFLO ORL – Chirurgie Cervico-Faciale
CHU de POINTE-A-PITRE/ABYMES
Eustase JANKY Gynécologie-Obstétrique
François ROQUES Chirurgie Thoracique et Cardiovasculaire CHU de FORT- DE - FRANCE
Jean ROUDIE Chirurgie Digestive
CHU de FORT- DE - FRANCE
Jean-Louis ROUVILLAIN Chirurgie Orthopédique
CHU de FORT- DE - FRANCE
André CABIE Maladies Infectieuses
CHU de FORT- DE - FRANCE
Philippe CABRE Neurologie
CHU de FORT- DE - FRANCE
Vincent MOLINIE Anatomopathologie
CHU de FORT- DE - FRANCE
Raymond CESAIRE Bactériologie-Virologie-Hygiène option virologie CHU de FORT- DE - FRANCE
Professeurs des Universités - Praticiens Hospitaliers
(Suite)Philippe DABADIE Anesthésiologie/Réanimation
CHU de POINTE- À -PITRE/ABYMES
Maryvonne DUEYMES-BODENES Immunologie
4
Régis DUVAUFERRIER Radiologie et imagerie Médicale CHU de FORT- DE - FRANCE
Annie LANNUZEL Neurologie
CHU de POINTE- À -PITRE/ABYMES
Louis JEHEL Psychiatrie Adulte
CHU de FORT- DE - FRANCE
Mathieu NACHER Epidémiologie, Economie de la Santé et Prévention CH de CAYENNE
Guillaume THIERY Réanimation
CHU de POINTE-A-PITRE/BYMES
Magalie DEMAR - PIERRE Parasitologie et Infectiologue CH de CAYENNE
Vincent MOLINIE Anatomie Cytologie Pathologique
CHU de FORT DE FRANCE
Philippe KADHEL Gynécologie-Obstétrique
CHU de POINTE-A-PITRE/ABYMES
Michel DEBANDT Rhumatologie
CHU de FORT- DE - FRANCE
Jeannie HELENE-PELAGE Médecine Générale
Karim FARID Médecine Nucléaire CHU de FORT- DE - FRANCE
Mehdi MEJDOUBI Radiodiagnostic et imagerie Médicale
CHU de FORT- DE - FRANCE
Rémi NEVIERE Physiologie
CHU de FORT- DE - FRANCE
Christian SAINTE-ROSE Radiodiagnostic et imagerie Médicale CHU de FORT- DE - FRANCE
Professeurs Associés de Médecine Générale
Franciane GANE-TROPLENT Médecine générale Cabinet libéral les Abymes
Maître de Conférences des Universités - Praticiens Hospitaliers
Christophe DELIGNY Médecine Interne
CHU de FORT- DE - FRANCE
Jocelyn INAMO
Cardiologie
CHU de FORT- DE - FRANCE
6
CHU de POINTE- À -PITRE/ABYMES
Marie-Laure LALANNE-MISTRIH Nutrition
CHU de POINTE- À -PITRE/ABYMES
Sébastien BREUREC Bactériologie &Vénérologie CHU de POINTE- À -PITRE/ABYMES
Narcisse ELENGA Pédiatrie
CH de CAYENNE
Moana GELU-SIMEON Gastroentérologie hépatologie
CHU de POINTE-A-PITRE/ABYMES
Chefs de Clinique des Universités - Assistants des Hôpitaux
BANCEL Paul ORL/Chirurgie maxillo faciale
CHU de Pointe-à-Pitre
BORJA DE MOZOTA Daphné Gynécologie-Obstétrique
CHU de POINTE- À -PITRE/ABYMES
DARCHE Louis Chirurgie Digestive et Viscérale
CHU de Martinique
DE RIVOYRE Benoit Ophtalmologie
DEBBAGH Hassan Chirurgie thoracique CHU de Martinique
DOURNON Nathalie Maladies infectieuses
CHU de Pointe-à-Pitre
GALLI-DARCHE Paola Neurologie
CHU de Martinique
Chefs de Clinique des Universités - Assistants des Hôpitaux
(Suite)
GHASSANI Ali Gynécologie-Obstétrique
CHU de Pointe-à-Pitre
JACQUES-ROUSSEAU Natacha Anesthésie-Réanimation CHU de Pointe-à-Pitre
MARY Julia Rhumatologie
CHU de Martinique
MOINET Florence Rhumatologie-médecine interne
CHU de Martinique
MONFORT Astrid Cardiologie
CHU de Martinique
MOUREAUX Clément Urologie
8
NABET Cécile Parasitologie et Mycologie
CH “Andrée ROSEMON” de Cayenne
PARIS Eric Réanimation
CHU de Pointe-à-Pitre
PIERRE-JUSTIN Aurélie
Neurologie
CHU de Pointe-à-Pitre
SAJIN Ana Maria Psychiatrie
CHU de Martinique
SEVERYNS Mathieu Chirurgie orthopédique
CHU de Martinique
Chefs de Clinique des Universités – Médecine Générale
CARRERE Philippe
Médecine Générale
CHU de Pointe-à-Pitre /Cabinet
PLACIDE Axiane Médecine Générale
CHU de Martinique / Cabinet
NIEMETZKI Florence Médecine Générale
CH « Andrée Rosemon » de Cayenne/Cabinet
MOUNSAMY Josué Médecine Générale
Professeurs EMERITES CHARLES-NICOLAS Aimé
Psychiatrie Adulte
Georges JEAN-BAPTISTE Rhumatologie
CHU de FORT- DE - FRANCE
Serge ARFI Médecine interne
CHU de FORT- DE – France
Bernard CARME Parasitologie
10
Dédicaces
A mes maitres
Le Docteur Inamo, mon dicteur de thèse, merci de m’avoir épaulé dans ce travail. Et surtout merci encore de m’avoir formé à cette discipline passionnante qu’est la cardiologie.
Monsieur le Professeur Remi Nevière, merci de m’avoir fait l’honneur d’être le président de mon jury. Merci pour ton implication dans ma formation , les cours du mardi matin ,la formation en épreuve d’effort et surtout ta gentillesse et ta disponibilité.
Monsieur le professeur Bourguet, merci de m’avoir fait l’honneur d’être dans mon jury. J’espère que la lecture de cette thèse aura pu vous apporter quelques connaissance sur la drépanocytose. Et merci pour votre bonne humeur.
Monsieur le professeur Venissac, merci de m’avoir fait l’honneur d’être dans mon jury. La cohésion entre l’équipe de chirurgie cardiaque et celle de cardiologie est très forte et j’espère qu’elle le restera.
A ma famille
Papa, maman, merci encore pour m’avoir soutenue pendant c’est 11 très longues années. Il y eu des hauts, des bas mais surtout pleins de bons moments. Merci d’avoir été à mes côté tout ce temps-là. Merci de vos sacrifices qui m’ont permis de faires ces très longues études sans jamais manqué de rien. J’espère vous rendre fiers aujourd’hui. Votre fille qui vous aime.
A mes collègues
Merci à toutes l’équipe de cardiologie de Martinique. Vous m’avez connu baby interne, vous devrez maintenant me supporter en tant que chef. Vous m’avez permis de grandir. J’espere poursuivre encore un bon moment l’aventure avec vous. Un merci particulier à Mme Baron, pour sa gentillesse et son professionalisme remarquable. Merci à Mathilde Baudet, ma CCA de Larib’ au top du top, ma myocarditologue préférée.
A mes amis
Merci à mes deux princesse Sofia et Clem.
Sofia, le destin a fait qu’on vive la même galère en même temps ! Même à l’autre bout du monde on reste synchro !!! Depuis cette fameuse soirée où tu m’as accueilli on ne
s’est plus quittée. Tu me manques et j’ai hâte de débuter cette nouvelle étape de grande avec toi.
Clem, 2017, sera pour toi aussi une grande année, un beau mariage et je suis fière d’être a tes côté ce jour-là.
Mes morues Nîmoises !!!!! 10ans cette année qu’on se connait !! 10 ans de conneries absolue et des milliers d’heures de soirée de rigolades !!!! Vous en êtes toutes absolument cinglées et c’est pour ça que vous êtes mes amies !!
Anaïs merci de toujours être là dans les moments difficiles ! et surtout merci des moments de rigolades comme jamais. 1 h avec toi c’est comme une séance d’abdo fois mille. Embrasse fort Geoff pour moi aussi et buvez un planteur pour moi
Violaine, la nana la plus rafraichissante que je connaisse ! Garde ta bonne humeur et ton sourire !
Samia, tu arrives à être presque aussi râleuse que moi ! La globe trotteuse. La fan incontestée des Punk à chien !
Mélissa, avec ton caractère inimité ! Promis je reviens bientôt en métropole et on se fait une orgie de gauffre et bière !
Merci Virginie, ma licorne préférée, et ma marraine ! Merci Elo, tous ces bons souvenirs d’externat !
Ludi, on a en eu des aventures ensemble autant pro qu’en dehors du boulot. Je me souviens de nos premiers jours d’interne… On va dire qu’on a progressé 😉
Merci à Aude, on se connaissait externe et on s’est découvert interne. Et quelle rencontre !! J’ai hâte de revenir te voir son ton île (quoi la Guyane n’est pas une île !!??)
Merci à toi Emeline, ma coloc préférée de Gwada. Tu reprendras bien un peu de tzatzíki ?
Mes derniers co-internes : guillaume mon padawan préféré, aniss, tkt tout est cadré, et Victor le raleur fou ! Merci pour la rigolade du dernier semestre, on a fait la guerre mais on a survécu !
Merci thomas, de me soutenir dans cette dernière ligne droite. Ca doit pas être facile tous les jours mais promis je me rattraperai après.
Merci à la coloc de la Madiacase : anais, bruno , bérengère , lolo et manon !
Merci a mes amis d’enfances : Letty , nos voyages en corses inoubliables, laeti ma nouvelle parisienne préférée. Louloute, on a la rue de gallargues qui comprends le plus de docteur au mètre carré !
12
Merci à tous les autres : Aude la blonde préférée, Karim d’être aussi sympa, JB pour ces 6mois partagés en Gwada. A ma margot adorée, ma sous colleuse préférée !
Table des matières
I- Introduction ... 16 1. Définition ... 16 2. Physiopathologie ... 17 3. Epidémiologie ... 22 4. Complications cliniques ... 255. Contexte clinique et échographique ... 27
Hyper débit cardiaque et augmentation diamètre télédiastolique ... 27
Hypertrophie ventriculaire gauche ... 28
Dysfonction diastolique ... 28 Capacités fonctionnelles ... 30 Hypertension pulmonaire : ... 31 II – Méthode ... 34 Population ... 34 Critères d’exclusion ... 34
Recueil des données ... 34
Démographiques ... 34 Biologiques ... 35 Echocardiographiques ... 35 Cliniques ... 37 III - Résultats : ... 39 Population de l’étude ... 39
Profil épidémiologique des patients : ... 41
Critères d’anémie et d’hémolyse : ... 42
Données échocardiographiques : ... 43
Sévérité clinique et biologique : ... 45
IV - Discussion :... 46 Situation du problème ... 46 Implications cliniques ... 48 Limites ... 48 Généralisation ... 49 V - Conclusion ... 51 VI - Bibliographie : ... 53
14
Liste de des abréviations
BNP : Brain Natriuretic Peptide
BSA : Body Surface Area
DC : Doppler Continu
DRBC : Dense Red Blood Cell
DNN : Dépistage Néonatal
DOM : Département d’Outre-Mer
DP : Doppler Pulsé
ECG : Electrocardiogramme
FEVG : Fraction d‘Ejection Ventriculaire Gauche
HbF : Hémoglobine Fœtale
HbS : Hémoglobine S
HTA : Hypertension artérielle
HTP : Hypertension pulmonaire
IMC : Indice de Masse Corporelle
ITV : Intégrale Temps-Vitesse
MCHC : Concentration Cellulaire Moyenne en Hémoglobine
MPE : Mesure de Perception à l’Effort
NYHA : New York Heart Association
OD : Oreillette Droite
OG : Oreillette Gauche
PAD : Pression Artérielle Diastolique
PAPm : Pression Artérielle Pulmonaire Moyenne
PAPO : Pression Artérielle Pulmonaire d’Occlusion
PAPs : Pression Artérielle Pulmonaire Systolique
PAS : Pression Artérielle Systolique
POD : Pression dans l’Oreillette Droite
PSGA : Parasternale Grand Axe
SCD : Sickle Cell Disease
STA : Syndrome Thoracique Aigu
SVo2 : Saturation Veineuse en Oxygène
TDI : doppler tissulaire
TRV : Intégrale-Temps Vitesse de l’Insuffisance Tricuspide
VD : Ventriculaire droit
VG : ventriculaire gauche
VGM : Volume Globulaire Moyen
VCAM : Vascular cell adhesion molecule
VTDVG : Volume Télé Diastolique Ventriculaire Gauche
VTSVG : Volume Télé Systolique Ventriculaire Gauche
I- Introduction
1. Définition
La drépanocytose est une maladie de structure de l’hémoglobine causée par une mutation du gène situé sur le chromosome 11, codant pour un des deux types de protéines formant l’hémoglobine : la -globinei. La substitution d’un glutamate par une valine est responsable de la formation de l’hémoglobine S, la substitution par une Leucine de la formation de l’hémoglobine C.
Il existe plusieurs formes : chez l'hétérozygote, l'allèle S étant codominant, les deux allèles s'expriment (l'anormal et le normal). Cette forme est appelée (S/A). On ne constatera pas de symptômes, sinon des hématies falciformes, ou plus ou moins sujettes à la falciformation, on pourrait la considérer comme une forme atténuée ou latente. Ces hématies ne contiennent pas nécessairement un mélange en proportion égale d'HbA et d'HbS.
Chez l'homozygote, les deux allèles sont S, c'est la forme dite (S/S). Il s'agit d'une forme symptomatique s'exprimant, entre autres, par des crises douloureuses.
Il existe aussi des hétérozygotes dits composites ou hétérozygotes doubles, associant drépanocytose et une autre hémoglobinopathie (hémoglobine C, D, E, thalassémie...) : formes S/C, S/thalassémie. Les formes homozygotes et hétérozygotes double sont dites drépanocytoses majeures, contrairement aux formes hétérozygotes simples dites mineures.ii
Pour résumer, les syndromes drépanocytaires majeurs comprennent : ● Les formes homozygotes S/S, forme la plus fréquente et la plus sévère ● Hétérozygotes composites : S/βºthalassémie et S/β+thalassémie
● Hétérozygotes composites SDPunjab, SOarab, SAntillesC ● Les hétérozygotes symptomatiques SAntilles, plus rares
2. Physiopathologie
La transmission est autosomale récessive. La substitution d’un acide glutamique par une valine augmente la rigidité de l’hémoglobine. Cette chaîne est appelée hémoglobine S, HbS pour Sickle cell disease en anglais.iii Sa capacité à transporter l’oxygène diminue et sa forme désoxygénée se polymérise en chaînes, qui lui donnent sa forme dite en « faucille ». Les facteurs influençant ce phénomène de polymérisation
18
sont les épisodes d’hypoxie, d’acidose, déshydratation, de troubles hormonaux, la concentration moyenne cellulaire en hémoglobine (MCHC), ainsi que le contenu érythrocytaire en hémoglobine fœtale (HbF) car tous influencent la vitesse de polymérisation de l'HbS.
La présence d’hémoglobine fœtale dans le réticulocyte réduit la concentration d’HbS et diminue la polymérisation.
Ces globules rouges déformés (drépanocytes) sont plus fragiles, ont une durée de vie plus courte et subissent une destruction anormale et élevée d'où l'anémie chez les malades. En effet leur durée de vie passe alors de 120 jours à environ 20 jours.
Cette déformation, d’abord réversible si le globule rouge est réoxygéné à temps, devient irréversible après plusieurs transformations, et les cellules devenues rigides provoquent une obstruction des petits vaisseaux, surtout dans les os ou les articulations, entraînant de très vives douleurs, appelées crises vaso-occlusives.
L'occlusion des capillaires pulmonaires mène à une cascade qui fait se succéder inflammation locale, coagulation intravasculaire et formation de thrombi avec micro-infarctus pulmonaires. Une des conséquences de ce cycle d’ischémie/reperfusion intra
cellulaire est une activation de la cascade de l’inflammation.iv
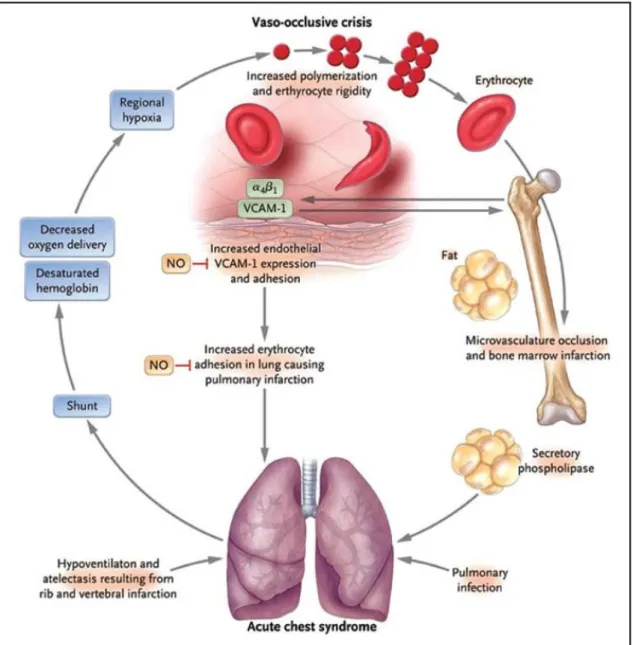
L’adhésion des globules rouges à l’endothélium dépend d’interactions moléculaires entre l’antigèneVLA-4 (Very Late Activation antigen) exprimé sur le globule rouge et les molécules d’adhésion VCAM-1 (Vascular Cell Adhesion Molecule-1) présentes sur les cellules endothéliales. Faiblement exprimée en condition basale, VCAM-1 est surexprimée sous l’influence de certaines cytokines pro-inflammatoires (IL-1, TNF-) et
de l’hypoxie. D’autres facteurs contribuent à l’occlusion des vaisseaux capillaires par les hématies falciformes. Il peut s’agir d’interactions avec les leucocytes, d’une augmentation des micro-thromboses ou de lésions endothéliales.
Figure 2 : Physiopathologie de la vaso occlusion. L’illustration montre le rôle des molécules adhésion cellulaire. (TSP=Thrombospondin, vWF=von Willebrand factor, FN=Fibronectin, VCAM=Vascular cell adhesion molecule)
L’hémolyse chronique favorise par ailleurs la libération accrue d’arginase érythrocytaire, qui facilite la transformation de l’arginine en ornithine, diminuant ainsi le substrat requis pour la synthèse de NO, et diminuant l’activité biologique du NO. La réduction de la biodisponibilité du NO provoquée par l’hémolyse chronique intravasculaire favorise un état de dysfonction endothéliale, augmente la
20
vasoconstriction et provoque une prolifération cellulaire anormale au sein de la paroi vasculaire, aboutissant à un remodelage vasculaire pulmonaire chronique.
Une de ces conséquences est un remodelage vasculaire à l’origine de l’HTP. Il en
résulte une dysfonction endothéliale à l’origine de phénomènes de vasoconstriction locale et de libération de facteurs de croissance et inflammatoires. Ces phénomènes sont responsables d’une prolifération anormale de l’ensemble des composants cellulaires de la paroi vasculaire pulmonaire. L’occlusion vasculaire est provoquée par une hypertrophie de la média, une prolifération des cellules musculaires lisses et des cellules endothéliales ainsi que par une fibrose intimale.
22
3. Epidémiologie
C’est la maladie génétique la plus fréquente dans le monde.v
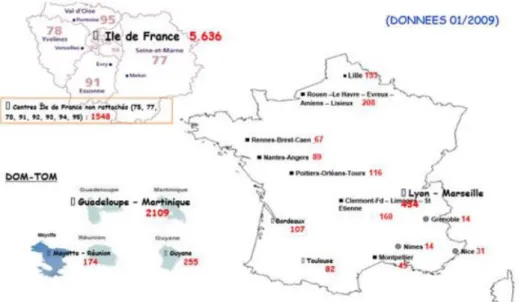
Près de 5% de la population mondiale est porteuse des gènes de la drépanocytose ou de la b thalassémie. Elle est l’hémoglobinopathie la plus fréquente en France. Elle concerne 50 millions de personnes dans le monde, soit plus de 300000 naissances par an, en France elle touche environ 7000 personnes. En 2013, 441 enfants drépanocytaire ont vu le jour soit une prévalence d’un enfant pour 1900 naissances. Cette prévalence est beaucoup plus importante dans les départements d’outre-mer (DOM). La drépanocytose est une maladie qui touche particulièrement la population antillaise.
L’incidence des syndromes drépanocytaires majeurs à la naissance est de 12/343 en Martinique, 1/297 en Guadeloupe et 1/227 en Guyanevi. La fréquence des porteurs du trait du drépanocytaire est de 5.2% pour l’ensemble des DOM contre 2.7% pour la métropole pour la période 2006-2010. On estime en Martinique, 1500 malades adultes et enfants porteur du trait drépanocytaire, soit 10 pourcent de la population. C’est une priorité de santé publique depuis 1984, avec la mise en place d’un dépistage néonatal (DNN)vii
Figure 4 : Répartition de la population drépanocytaire en France métropolitaine et DOM
24
Figure 6 Evolution du taux de dépistage néonatal de drépanocytose en fonction du temps en Guadeloupe.
En effet l’Hémoglobine S a un effet protecteur contre le Paludismeviii, lié à l’interruption du développement du parasite dans les hématies. L’étude de recherche Portugaise démontrait en 2011, que la drépanocytose augmente l’expression de l’hème-oxygénase-1(OH-1) dans les cellules hématopoïétiques, via un mécanisme d’involution du transcripteur du facteur NF-EF2 (NRF2). Le monoxyde d’azote, un produit du catabolisme de l’hème par HO-1, prévient l’accumulation de l’hème circulante avec l’infection par F. Falciparum, en supprimant alors la pathogénicité. Les populations originaires du pourtour méditerranéen ou Africaines sont donc plus touchées par cette maladie. ix
Le nombre de décès annuels augmente régulièrement, de 13 par an en moyenne en 1981-1985 à 40 par an en 2001-2005, l’Île-de-France et les départements d’outre-mer concentrant 70% des effectifs de décès. Sur la période 2004-2009, 7 355 patients
porteurs de drépanocytose ont été hospitalisés en moyenne tous les ans, avec une augmentation moyenne du nombre d’hospitalisations de 3,5% par an.x
La mortalité liée à la maladie est importante. L’espérance de vie chez le drépanocytaire augmente grâce aux traitements, dont l’Hydroxyurée. Cependant elle reste une maladie grave, la mortalité des patients reste élevée avec une espérance de vie de 42 ans pour les hommes et de 48 ans pour les femmes.
Le pic d’incidence de décès s’est déplacé vers les tranches d’âge plus élevées, notamment avec l’amélioration de la prise en charge pluridisciplinaire et la mise en place du diagnostic néonatal. Nous sommes passés d’une maladie mortelle de l’enfant à une maladie chronique de l’adulte.xi
L’âge au décès est plus élevé dans les DOM qu’en France métropolitaine (31 ans contre 38 ans). Il diffère aussi selon les DOM : 33 ans pour la réunion, 47 ans pour la Martinique et 45 ans en Guadeloupe et 18.5 ans pour la Guyane.
50% des décès surviennent en réanimation et la principale cause d’admission est le syndrome thoracique aigu.xii
4.
Complications cliniques
Les complications sont nombreuses et les atteintes multiples.
Les différents types d’atteintes sont :
26
● Une anémie hémolytique chronique avec des épisodes d’aggravation aigue
● Des phénomènes vaso occlusifs.
Les accidents vaso-occlusifs hyperalgiques entraînent une ischémie des tissus conduisant à des douleurs aiguës et chroniques ainsi qu’à la défaillance de tissus ou d’organes, à l’origine de complications osseuses, ostéo-articulaire, d’ulcères cutanés, priapisme, hépatobiliaires, ophtalmologiques et rénales. Les occlusions vasculaires peuvent être de différentes origines : emboles graisseux, thrombus.
Le syndrome thoracique aigu est défini par un infiltrat pulmonaire radiologique qui peut apparaitre 24 à 48heures après un des signes suivant : fièvre (80%), toux (62%), douleur thoracique (42%), polypnée (45%), dyspnée (41%), hypoxie et anomalies auscultatoires (crépitant, souffle tubaire et diminution du murmure vésiculaire). La drépanocytose est caractérisée par la survenue de phénomènes d’ischémie tissulaire aigus, plutôt rares, ou chroniques insidieux, quasi constants.
Il est probable que le cœur ne soit pas épargné. Plusieurs études anatomopathologiques confirment la présence de lésions de fibrose et de nécrose myocardique.xiiixiv
Des cas cliniques ont décrit des anomalies électrocardiogramme (ECG)xv, scintigraphie
myocardique de perfusionxvi et en imagerie de résonnance nucléairexvii, ainsi qu’une
L’absence de sténose des artères coronaires suggère que c’est la microcirculation qui est oblitérée par les hématies falciformées, par le contexte rhéologique et pro-thrombogène.
Ces cicatrices myocardiques peuvent se compliquer de troubles du rythme.
Figure 7 Complications liées à la drépanocytose
5. Contexte clinique et échographique
Hyper débit cardiaque et augmentation diamètre télédiastolique
Les complications cardiaques de la drépanocytose sont généralement la conséquence de l’état d’anémie chronique et des phénomènes de vaso occlusion.
28
L’adaptation circulatoire à l’anémie chronique se caractérise par un hyper-débit, une tachycardie et une fonction ventriculaire gauche longtemps préservée.
Cette élévation du débit cardiaque se fait au dépend du volume d’éjections systolique (VES) et peu par l’augmentation de la fréquence cardiaque. Le VES augmente avec la dilatation du diamètre télédiastoliquexixet le degré de dilatation du diamètre télé-diastolique est corrélé au degré d’anémie.xx
Hypertrophie ventriculaire gauche
Pour compenser l’augmentation du diamètre télé-diastoliquexxi, et donc l’augmentation du stress pariétal, il y a une augmentation de la masse ventriculaire gauche. En effet selon la loi de Laplace la tension de la paroi du ventricule est directement proportionnelle à la pression et au diamètre VG, et inversement proportionnelle à l’épaisseur de la paroi. On parle d’hypertrophie ventriculaire gauche pour un épaississement pariétal du ventricule gauche supérieur à 11mm ou masse ventriculaire supérieure à 125g/m² chez l’homme et 110g/m² chez la femme. Cette hypertrophie est dite excentrique, c'est-à-dire que le rapport H/R est inférieur à 0,45. H définissant l’épaisseur du ventricule et R son rayon.
Dysfonction diastolique
En analysant les données des études écho cardiographiquesxxii, on retrouve une variation significative de la prévalence de la dysfonction diastolique.
En échocardiographie doppler l’onde E correspond au remplissage rapide du ventricule gauche. La vitesse de l’onde E dépend du gradient de pression entre l’oreillette gauche et le ventricule gauche juste après l’ouverture de la valve mitrale. L’onde A quant à elle, suit l’onde E et correspond à la contraction auriculaire. Donc plus elle est importante (vitesse onde A élevée), plus la contraction auriculaire va être importante et va jouer un rôle dans le remplissage du VG.
Une fois ces 2 vitesses mesurées, on peut établirle profil mitral : c’est le rapport de la vitesse de l’onde E sur la vitesse de l’onde A (E/A).Physiologiquement le remplissage rapide (onde E) représente 70% du remplissage du VG et la contraction auriculaire (onde A) en représente 30%, le rapport E/A est de 1 à 2 chez les sujets normaux. Le doppler tissulaire de l’anneau mitral permet de mesurer la vitesse de l’onde Ea ou E’ qui reflète l’allongement des fibres dans le plan longitudinal donc le déplacement de l’anneau mitral vers le VG en protodiastole. L’onde Ea est un indice de la relaxation qui est indépendant de la précharge lorsque la relaxation est anormale. L’intérêt est de pouvoir faire la distinction entre un remplissage normal ou pseudo-normal ou restrictif. Il permet aussi d’évaluer les pressions de remplissage du ventricule gauche en complément de l’évaluation du profil mitral et surtout lorsque le profil mitral E/A n’est pas réalisable. Sa valeur normale est supérieure à 15 cm/s sur la partie latérale de l’anneau mitral et supérieure à 10 cm/s sur la partie médiale de l’anneau mitral. Lorsqu’elle est inférieure à 8 cm/s, elle témoigne d’une dysfonction diastolique du VG.
On calcule alors le rapport E/Ea (vitesse de l’onde E en doppler pulsé mitral sur la vitesse de l’onde Ea en DTI mitral) qui va permettre d’évaluer la précharge.
30
En effet l’onde E dépend à la fois de la précharge (gradient OG-VG) et de la relaxation et l’onde Ea dépend uniquement de la relaxation. Mathématiquement si on divise les deux :
E/Ea> 13-15 = élévation des pressions de remplissage du ventricule gauche (équivaut à
PAPO > 15mmHg).
E/Ea< 8 = pressions de remplissage du ventricule gauche basses.
Le ration E/E’ supérieur à 15 est admis comme facteur prédictif d’augmentation des pressions de remplissages gauches (PRVG) et donc de dysfonction ventriculaire gauche. xxiii
Capacités fonctionnelles
L’échelle de Borg ou la mesure de perception de l'effort (MPE) est une mesure quantitative de la perception de l'effort durant un exercice physique, introduite vers 1970 par le professeur Gunnar Borg. La mesure est une cote sur une échelle de 6 à 20 rattachée à différents mots d'appréciation : effort « très léger, difficile, pénible… ». Cette mesure globale, basée sur les sensations physiques et psychiques de la personne, tient compte de la condition physique, des conditions environnementales et du niveau de fatigue générale.
Le test de marche de 6 minutes est une évaluation globale de la capacité fonctionnelle à l’exercice. Même s’il est demandé au sujet de marcher le plus possible pendant 6 minutes, le rythme de la marche est librement choisi. Aussi, le test de marche de 6 minutes évalue-t-il le plus souvent la capacité fonctionnelle à un niveau sous-maximal,
en dessous du seuil ventilatoire. Dans les études la distances parcourue est en moyenne 458 mètres +/- 91mètres. La réduction du test de marche en 6 minutes est indépendamment associée avec une dysfonction diastolique et une élévation des pressions pulmonaires.xxivxxv
Hypertension pulmonaire :
Dans de nombreuses études, l’HTP est une complication fréquence de la drépanocytose. Elle est définie par une augmentation de la pression pré capillaire en l’absence de dysfonction ventriculaire gauche, antécédents thromboembolique et pathologie pulmonaire sous-jacente.
La prévalence de l’HTP retrouvée dans les études est de 30%xxvi. Dans ces études le diagnostic n’est pas confirmé de façon systématique pour cathétérisme droit. L’étude de F. Parent a retrouvé une prévalence de 6% après confirmation par méthode invasivexxvii.
Le diagnostic d’HTP est suspecté en échographie par une intégrale temps vitesse maximale de l’insuffisance tricuspide (TRV) supérieure à 2,5 mètre. La vélocité maximale du jet systolique de l’IT est fonction du gradient de pression qui règne en systole entre le VD et l’OD. L’équation simplifiée de Bernoulli établit la relation entre la vélocité et la pression où ∆P est le gradient de pression entre le VD et l'OD et Vmax la vélocité maximale de l’IT. La pression de l’OD est estimée (10 mmHg en moyenne) ou mesurée par la PVC. En l’absence de lésion au niveau de la chambre de chasse droite et
32
de la valve pulmonaire, la pression systolique du VD est égale à la pression systolique
de l’AP. L’équation devient : PAPs = 4 (Vmax IT)2 + POD.xxviii Le diagnostic de certitude
repose sur le cathétérisme droit. Celui-ci permet en effet de confirmer le diagnostic, différencier une HTP pré-capillaire ou post capillaire liée à une dysfonction ventriculaire gauche.
L’hypertension artérielle pulmonaire est définie par une élévation de la pression pulmonaire (PAP) moyenne (PAPm) supérieure ou égale à 25 millimètres de mercure (mmHg) au repos.
Les principaux paramètres mesurées ou calculés au cours du cathétérisme droit permettent de distinguer les différents profils hémodynamique : fréquence cardiaque, pression de l’oreillette droite (POD) , pression systolique, diastolique et moyenne de l’artère pulmonaire (PAP), pression artérielle pulmonaire occluse (PAPO) qui est le reflet de la pression capillaire pulmonaire, pression auriculaire gauche , reflet de la pression télé diastolique du ventricule gauche, débit cardiaque , résistance vasculaire systémique et pulmonaire ainsi que la saturation veineuse en oxygène au niveau de l’artère pulmonaire (SvO2).
On parle d’hypertension artérielle pré-capillaire si la PAPm est supérieure ou égale à 25mmHg et la PAPO inférieure ou égale à 15mmHg, un débit cardiaque normal ou augmenté. Dans ce groupe sont compris les HTP du groupe 1, 3, 4, 5.
L’HTP post capillaire est définie par une PAPm supérieure ou égale à 25mmHG, une PAPO supérieure à 15mmHG et un débit cardiaque normal ou diminué. Elle concerne uniquement le groupe 2 dans la classification, l’HTP des cardiopathies gauches.
Le développement d’une HTP dans la drépanocytose, reste un tournant dans la maladie. L’étude ETENDARD a prouvé qu’une TRV maximale supérieure à 2,5 mètres était un facteur prédictif de mortalité à 3ans xxix.
Cette HTAP est classée HTAP stade 5 de la classification révisée.xxx
6- Objectif de l’étude
Il a été récemment montré, dans l’étude de T. Damy xxxique la présence d’une dysfonction ventriculaire gauche avec une fraction d’éjection ventriculaire gauche (FEVG) < 55% s’accompagnait d’un excès de mortalité chez les patients drépanocytaires.
L’objectif de cette étude est de caractériser chez les patients drépanocytaires de l’étude ETENDARD, les paramètres démographiques, biologiques d’anémie et d’hémolyse, écho cardiographiques et leur retentissement clinique et biologique chez les patients présentant une dysfonction ventriculaire gauche inférieure à 55%.
34
II – Méthode
Population
Nous avons analysé la cohorte multicentrique française ETENDARD. Mise en place entre 1999 et 2011, elle avait pour but d’analyser la prévalence de l’hypertension artérielle pulmonaire. Ont été inclus les patients drépanocytaires, stables (c’est-à-dire sans syndrome thoracique aigu ou crise vaso occlusive dans l’année), d’un âge supérieur à 18ans, de type SS ou S-β(0)-Thalassémique.
Ont été inclus les patients suivis dans un des centres de référence suivant : Hôpital T, Centre Hospitalo-Universitaire Henri-Mondor à Créteil, Tenon et Kremlin-Bicêtre à Paris, ainsi que le centre Hospitalo-Universitaire de Martinique. Ils devaient réaliser une échographie trans thoracique et des tests sanguins dans l’année. Les patients n’étaient pas traités par Hydroxurée.
Critères d’exclusion
Les critères d’exclusion étaient un génotype autre que les formes SS ou S-b thalassémique, une grossesse ou une chirurgie valvulaire. Ont aussi été exclus les patients atteints de dysfonction sévère rénale, hépatique, ou pulmonaire.
Recueil des données
Démographiques
Pour chaque patient, nous avons recueilli de manière prospective : l’âge, le sexe, le poids en kilogramme (Kg), la taille (en mètre) et l’indice de masse corporel (IMC) en kg/m², ainsi que les pressions artérielles systolique et diastolique.
Biologiques
Les tests sanguins étaient effectués lors de contrôles de routine.
Pour chaque variable la moyenne d’un à trois tests a été utilisée. Les prélèvements ont été réalisés à distance d’un épisode aigu, c’est-à-dire 1 mois après une infection, un syndrome thoracique aigu, crise vaso-occlusive ou une hospitalisation. Après une transfusion sanguine, il fallait attendre trois mois.
Nous avons collecté les données suivantes : la concentration en hémoglobine (Hb en g/dl), hématocrite, le volume globulaire moyen (VGM), le pourcentage d’hémoglobine fœtale (HbF), le pourcentage de globule rouge de haute densité, défini par les globules rouges ayant une densité supérieure à 1.11, le taux de réticulocyte.
Les tests génétiques sur l’ADN de leucocytes sanguins périphériques ont été utilisés pour diagnostiquer l’-thalassémie.
Echocardiographiques
Les échographies trans-thoraciques ont été réalisées selon les recommandations de la société Américaine d’échographie, sur un appareil Vivid 5 ou 7 (General Electric). Chaque mesure a été effectuée sur la moyenne de trois cycles cardiaques consécutifs.
Les modes deux dimensions (2D), Temps-mouvement (TM), doppler pulsé (DP) et doppler continu (DC) ont été utilisés en fenêtre parasternale grand axe (PSGA), petit axe (PSPA), apicale 4 et 5 cavités.
Le volume télé-diastolique du ventricule gauche (DTDVG) et le diamètre de l’oreillette gauche (OG) ont été mesurés en mode TM. Ils ont été indexés à la surface corporelle, body surface area (BSA).
36
La fraction d’éjection ventriculaire gauche a été mesurée en Simpson Biplan. Le critère de dysfonction ventriculaire gauche utilisé a été celui utilisé par la société Européenne de cardiologie, soit une FEVG inférieure à 55%.
Le diamètre de la chambre de chasse du ventricule gauche a été recueilli sur la coupe parasternale grand axe, permettant d’estimer la surface de la chambre de chasse. Le doppler pulsé a été utilisé pour estimer l’ITV de la chambre de chasse en fenêtre apicale 5 cavités.
Le débit cardiaque a donc été calculé comme l’ITV de la chambre de chasse multiplié par la surface de la chambre de chasse multiplié par la fréquence cardiaque. Celui indexé à la surface corporelle nous permet de définir l’index cardiaque en l/min/m².
En doppler pulsé en ont été recueilli les valeurs de remplissage passif du ventricule gauche : l’onde E mitrale (cm/s), et de remplissage actif par la contraction de l’auricule gauche : l’onde A mitrale (cm/s), permettant de calculer le rapport E/A.
Les valeurs de doppler tissulaire à l’anneau mitral septal et latéral ont été estimées (E’ en cm/s), permettant de calculer le ratio E/E’.
En doppler continu la valeur ITV de la fuite tricuspide (TRV) a été mesurée.
Cliniques
La dyspnée a été quantifiée par l’échelle New York Heart Association (NYHA)xxxii :
● Stade 1 : Aucune gêne fonctionnelle ; capacité d'effort physique normale pour l'âge.
● Stade 2 : Gêne fonctionnelle nulle au repos, mais apparaissant dans l'exercice d'une activité physique normale pour l'âge du sujet.
● Stade 3 : Gêne fonctionnelle nulle au repos, mais apparaissant dans l'exercice d'une activité physique moindre que la normale pour l'âge du sujet.
● Stade 4 : Gêne fonctionnelle apparaissant au moindre effort et/ou présente au repos.
Le test de marche en 6 minutes a été réalisé, il évaluait :
• La distance parcourue en 6minutes.
• La saturation en oxygène au début et la fin du test.
• Le pourcentage de distance parcourue par rapport à la théorique (selon l’âge et
le sexe, le poids et la taille)xxxiii :
- Pour les hommes : (7,57 X taille en cm) – (5,02 X âge) – (1,76 X poids en Kg) – 309 mètres.
- Pour les femmes : (2,11 X taille en cm) – (5,78 X âge) – (2,29 X poids en Kg) + 667 mètres.
38
Analyse statistique :
Les données ont été collectées de manière prospective.
Les analyses statistiques ont été effectuées de manières rétrospectives. Les données ont été exprimées en moyenne ou en pourcentage.
III -
Résultats :
Population de l’étude
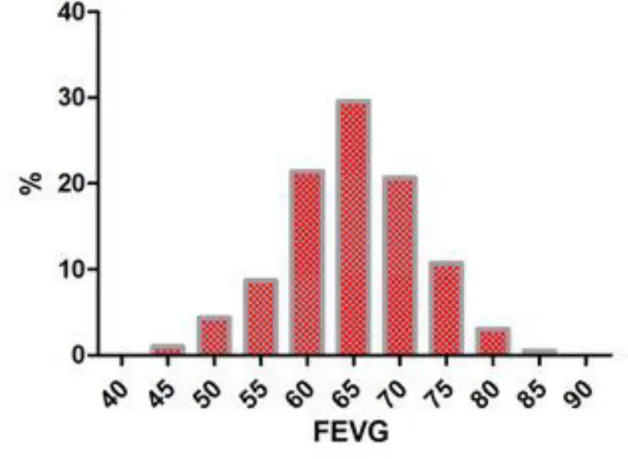
392 patients drépanocytaires stables de type SS ou S-β(0)-thalassémique ont été inclus. 37 patients présentaient une FEVG inférieure à 55% et 355 une FEVG supérieure à 55%.
40
Profil épidémiologique des patients
:L'âge moyen des patients étaient respectivement de 35 et 34ans dans le groupe FEVG <55% et dans les groupe FEVG> 55%.
Dans les groupe altération de la FEVG il y avait 15 femmes soit 40.54% et dans les groupe FEVG > 55% il y avait 220 femmes soit 61.97%. La différence n’était pas significative avec un p=0.014. Il n'a pas été retrouvé de différence significative cliniquement que ce soit pour l'hypertension artérielle, avec 10,81% des patients ayant une FEVG altérée présentant une HTA contre 4,79% (p=0,125). La Pression Artérielle systolique (PAs) médiane était de 118,05mmHg +/- 13.8mmHg contre 116,7mmHg+/- 13.4mmHg (p=0.59) et la Pression Artérielle diastolique (PAd) de 67,30 +/- 6.9mmHg contre 66,03 +/- mmHg(p=0.80), pour la fréquence cardiaque avec une médiane de72 +/-11 bpm contre 74 +/- 10bpm (p=0,7). L'indice de masse corporelle (IMC) médian des patients était de 21,89 +/- 3.3 kg/m² contre 21,7 +/- 3.0 kg/m² (p=0,34) et la clairance de la créatinine de 126,53 (mmol/ml/min) contre 130,73 (p=0,67).
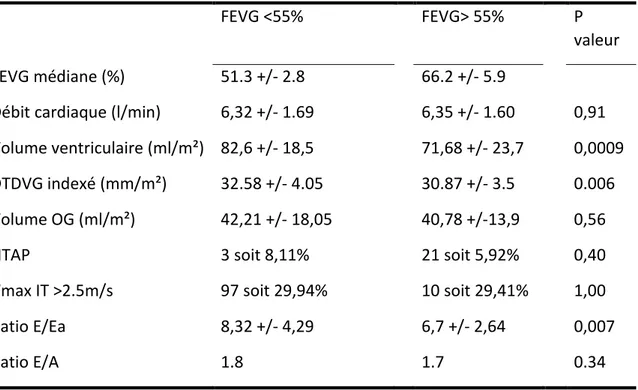
Tableau 1 : Données descriptives de la population
FEVG <55% FEVG> 55% P valeur
Nombre de patients 37 355
Age (en année) 35.04 34.00 0.56
Nombre de femme (%) 40.4 Soit 15 patientes 61.9 Soit 220 patientes 0.014
IMC (Kg/m²) 21.89 21.7 0.34
Fréquence cardiaque (bpm) 72 74 0.9
PAs (mmHg) 118.09 116.7 0.549
PAd (mmHg) 67.30 66.03 0.42
42
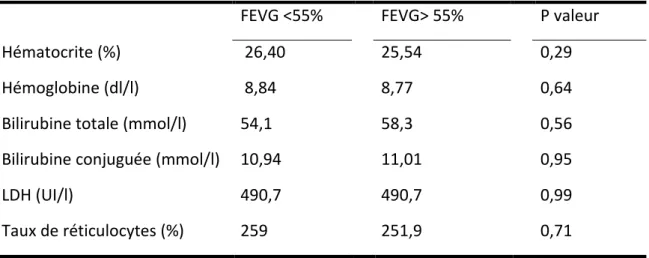
Critères d’anémie et d’hémolyse :
Le taux d'hémoglobine était de 8,84 +/- 1.47g/dl dans le groupe FEVG<55% contre 8,77 +/- 1.49 g/dl dans le groupe FEVG>55% (p=0,64) et d'hématocrite 26,4 +/- 4.8% contre 25,54 +/- 4.8% (p=0,71). Les taux de bilirubine totale (mmol/l), conjuguée (mmol/l), LDH (UI/l) et réticulocytes (/L) étaient respectivement de 54,01mmol contre 58,3mmol/l (p=0,56), 10,94mmol/l contre 11,01mmol/l (p=0,95), 490,7UI/l contre 490,4UI/l ( p=0,99) et 259X10^9/l contre 251,9X10^9/l (p=0,71).
Tableau 2 : sévérité de l’anémie et de l’hémolyse
FEVG <55% FEVG> 55% P valeur Hématocrite (%) 26,40 25,54 0,29 Hémoglobine (dl/l) 8,84 8,77 0,64 Bilirubine totale (mmol/l) 54,1 58,3 0,56 Bilirubine conjuguée (mmol/l) 10,94 11,01 0,95
LDH (UI/l) 490,7 490,7 0,99
Données échocardiographiques :
La valeur médiane de la FEVG retrouvée respectivement dans les groupes FEVG altérée et conservée était de 51.3 +/ 2.7 % contre 66.3 +/- 5.9 %.
Le volume ventriculaire gauche indexé (en ml/m²) était de 82,6 +/- 23 ml/m² dans le groupe FEVG <55% contre 71,68+/- 18.5ml/m² (p=0,0009), le diamètre télé diastolique ventriculaire gauche (DTDVG) indexé était de 32.58 +/- 4.05mm² contre 30.87 +/- 3.5mm/m² (p= 0.006)
Au niveau de la fonction diastolique et des pressions de remplissages, il était retrouvé avec un rapport E/Ea à 8,32 contre 6,7 (p=0,007) et un ratio E/A à 1.8 contre 1.7 soit p=0.34.
Pour les données suivantes : débit cardiaque en ml/min, volume oreillette gauche indexé en ml/m² et le nombre de patients présentant une vitesse maximale de ITV tricuspide (critère définissant une HTAP) il n'y avait pas de différence significative. Les données retrouvées étaient de : 6,32 +/- 1.69 ml/min contre 6,35 +/- 1.60 ml/min (p=0,91), 42,21 ml/m² contre 40,78ml/m² (p=0,56), 10 patients soit 29% contre 97 soit 29% (p=1,0).
44
Tableau 3 : paramètre échographiques
FEVG <55% FEVG> 55% P valeur FEVG médiane (%) 51.3 +/- 2.8 66.2 +/- 5.9
Débit cardiaque (l/min) 6,32 +/- 1.69 6,35 +/- 1.60 0,91 Volume ventriculaire (ml/m²) 82,6 +/- 18,5 71,68 +/- 23,7 0,0009 DTDVG indexé (mm/m²) 32.58 +/- 4.05 30.87 +/- 3.5 0.006 Volume OG (ml/m²) 42,21 +/- 18,05 40,78 +/-13,9 0,56
HTAP 3 soit 8,11% 21 soit 5,92% 0,40
Vmax IT >2.5m/s 97 soit 29,94% 10 soit 29,41% 1,00 Ratio E/Ea 8,32 +/- 4,29 6,7 +/- 2,64 0,007
Sévérité clinique et biologique :
Dans le groupe FEVG altérée, 5 patients présentaient une dyspnée de classe NYHA 3 soit 13,51% contre 24 patients (6,76%) (p= 0,175).
La distance moyenne parcourue au test de marche était de 523 +/-76 mètres contre 512 +/-88mètres (p=0,50), avec un score de Borg à 2,01 contre 2,66 (p=0,77). La saturation en oxygène de départ et de fin était de 96% puis 91,34% contre 95,34% puis 91% avec des p value respectives de 0,15 et 0,77. Le logBNP était de 1,74 contre 1,83 (p=0,37).
Tableau 4 : sévérité clinique
FEVG < 55% FEVG > 55% P valeur
Classe NYHA 1 ou 2 32 Soit 86.4% 331 soit 93.2%
Classe NYHA 3 ou 4 5 Soit 13.5% 24 Soit 6.7% 0.175
Distance parcourue (mètres) 523 +/- 76 512 +/- 88 0.50
Classe de Borg 2,66 +/- 1,8 2,01 +/- 1,81 0,07 Spo2 de départ (en %) 95 +/-3 96 +/- 3 0,15 Spo2 de fin (en %) 91 +/- 7 91 +/- 5 0,77
Log BNP 1,83 1,77 0,37
46
IV - Discussion :
L’altération de la FEVG reste rare chez les patients drépanocytaires. Dans notre étude seuls 9.4% des patients présentaient une altération de la FEVG. Ils ne présentaient pas plus de comorbidités que les patients ayant une fonction ventriculaire gauche conservée. L’âge, le ratio homme/femme, le taux de patients hypertendus ainsi que la fonction rénale étaient identiques dans les deux groupes.
Pour les critères d’hémolyse et d’anémie aucune différence significative n’était retrouvée avec une hémoglobine à 8.7g/dl versus 8.8g/dl dans le groupe FEVG altérée.
Le taux d’hématocrite était identique, comme la valeur de la bilirubine libre et conjuguée, ainsi que le taux de LDH. Dans les deux groupes l’anémie était régénérative avec un taux de réticulocyte respectivement à 259 contre 251.9 10^9 Xml.
En échographie chez les patients ayant une FEVG altérée ou conservée le débit cardiaque, le volume de l’oreillette gauche ainsi que le pourcentage de patient ayant une HTAP étaient identiques. Seuls le volume ventriculaire gauche et le diamètre télediastolique étaient augmentés de manière significative dans le groupe FEVG altérée.
Situation du problème
Le mécanismexxxivxxxv de la dysfonction ventriculaire gauche dans la drépanocytose est une question posée depuis de nombreuses années car le pronostic vital et fonctionnel du patient drépanocytaire est grevé par l’atteinte cardiovasculaire. Celui ci est
probablement multifactoriel associant l’anémie chronique, l’ischémie myocardique et la dilatation ventriculaire gauche.
Chez la majorité des patients la fonction ventriculaire gauche est préservée. Les critères de dysfonction ventriculaire sont définis par une FEVG inférieure à 50% en échographie trans-thoracique par la société européenne de cardiologie.
- Si la FEVG est comprise entre 40 et 49% : on parle d’insuffisance cardiaque à FEVG modérément altérée
- Si la FEVG est inférieure à 40% : on parle d’insuffisance cardiaque sévèrement altérée.
La majorité des études retrouvent une incidence de la dysfonction ventriculaire gauche faible. Dans l’étude de T. Damy l’incidence de la dysfonction ventriculaire gauche était de 8.5% et seuls 3 patients avaient une dysfonction ventriculaire gauche inférieure à 35%.
Une étude menée en Guadeloupexxxvi chez les patients drépanocytaires retrouvait une dysfonction VG modérée (FEVG entre 55-50%) chez seulement 3.6% des patients de l’étude.
Avec l’arrivée de nouvelles techniques telles que le strain longitudinal, on espérait mettre en évidence de nouvelles différences, des marqueurs précoces d’altération de la FEVG. Là encore les études n’ont pas retrouvé de différences significatives. xxxviixxxviii
48
Implications cliniques
L’étude de T. Damy a démontré qu’une altération de la FEVG et une HTAP était un facteur prédictif de mortalité important avec un taux de survie à 5 ans de 20%.
Dans notre étude, les patients qui avaient une dysfonction systolique ventriculaire gauche identifiée, présentaient un phénomène de remodelage ventriculaire gauche avec une augmentation du volume ventriculaire (82.6ml/m² contre 71.68ml/m²).
Ces phénomènes de dilatation ventriculaire gauche sont bien connus dans les cardiopathies valvulaires et ischémiques mais peu étudiés dans la drépanocytose.
Dans cette étude l’augmentation du débit cardiaque attendue chez le patient présentant une anémie (Hémoglobine à 8.7 et 8.8g/dl), se fait essentiellement pour l’augmentation du volume ventriculaire gauche. En effet la fréquence cardiaque est identique dans les deux groupes (72 et 74 bpm).
Les implications cliniques en termes de surmortalité de ce remodelage ventriculaire restent donc à explorer.
Limites
Les limites de cette étude sont le faible nombre de patients de patients présentant une dysfonction ventriculaire gauche. En effet seuls 37 patients présentent une dysfonction ventriculaire. Il est donc difficile de mettre en évidence des différences statistiquement significatives.
De plus nous avons pris comme définition de la dysfonction ventriculaire gauche, une FEVG inférieure à 55%, or les critères de l’ESC sont une FEVG inférieure à 49%. En utilisant les critères stricts le nombre de patients était quasi nul.
De plus les patients présentant une insuffisance rénale, ou hépatique sévère ont été exclus. Il est probable que la maladie touche à la fois le rein, le foie et la fonction cardiaque. Les patients les plus graves étant exclu, il est possible que ce soit dans cette population qu’on retrouve le taux le plus élevé de dysfonction ventriculaire gauche.
Cette étude a été réalisée avec les seuls génotypes SS ou S-β(0)-thalassémique. Les autres génotypes n’ont pas été étudiés.
Dans cette étude nous n’avons pas analysé le pourcentage de dense red blood cells (DRBC), or dans l’étude heamatological determinants of cardiac involment in adults with sickle cell disease, les patients présentant le plus haut taux de DRBC avaient un volume de l’oreillette et du ventricule gauche significativement plus élevé. Il serait intéressant d’étudier la dysfonction ventriculaire gauche dans ce groupe particulier de patient.
Généralisation
Les patients inclus dans cette étude étaient tous des patients suivis en France, dans un centre de référence et donc mieux suivi et probablement mieux traité que la population drépanocytaire en général.
La drépanocytose est une maladie qui touche principalement l’Afrique subsaharienne et l’Inde, des zones géographiques où l’accès aux soins est plus difficile.
50
La population incluse est donc mieux traitée et mieux suivie que la majorité des patients atteints.
V - Conclusion
L’altération de la fonction ventriculaire gauche reste peu fréquente chez les patients drépanocytaires. Dans cette étude seuls 9.4% des patients présentaient une altération modérée de la fonction ventriculaire gauche. Elle reste cependant un facteur associé à une mortalité importante.
Il n'a pas été retrouvé de différence clinique, épidémiologique ou fonctionnelle chez ces patients pouvant expliquer le sur risque de mortalité liée à une altération de la FEVG chez ses patients. Les critères d'anémie et d'hémolyse étaient les mêmes dans les deux groupes.
Au niveau échocardiographie il a été mis en évidence une augmentation du volume ventriculaire gauche chez les patients ayant une FEVG altérée ainsi que des anomalies de la fonction diastolique.
VI - Bibliographie :
i.
Fatima Dahmani et al., « Etude de l’hémogramme dans la drépanocytose homozygote: à propos de 87 patients », The Pan African Medical Journal 25 (20 décembre 2016), doi:10.11604/pamj.2016.25.240.11118.ii. D. Labie, « [Genetic aspects of sickle cell anemia] », La Revue Du Praticien 42, no 15 (1 octobre 1992): 1879‑84.
iii. Martin H. Steinberg et Paola Sebastiani, « Genetic Modifiers of Sickle Cell Disease », American journal of hematology 87, no 8 (août 2012): 795‑803, doi:10.1002/ajh.23232.
iv. Athanasios Aessopos et al., « Endothelial Function and Arterial Stiffness in Sickle-Thalassemia Patients », Atherosclerosis 191, no 2 (avril 2007): 427‑32, doi:10.1016/j.atherosclerosis.2006.04.015.
v. Josiane Bardakdjian et Henri Wajcman, « Épidémiologie de la drépanocytose : Drépanocytose », La Revue du praticien 54, no 14 (2004): 1531‑33.
vi. « La drépanocytose dans les départements français d’outre-mer (Antilles », consulté le 4 juin 2017, http://la-reunion.foxoo.com/video,drepanocytose-
dans-departements-francais-d’outre-mer-antilles,guyane,reunion,mayotte,nx12070511564524222.html.
vii. Nathalie Couque et al., « Improvement of Medical Care in a Cohort of Newborns with Sickle-Cell Disease in North Paris: Impact of National Guidelines », British Journal of Haematology 173, no 6 (juin 2016): 927‑37, doi:10.1111/bjh.14015.
viii. Pablo Bartolucci, « [Hemoglobin disorders: an advantage against malaria, but the risk of severe disease] », La Revue Du Praticien 64, no 8 (octobre 2014): 1110‑11.
ix. Ana Ferreira et al., « Sickle Hemoglobin Confers Tolerance to Plasmodium Infection », Cell 145, no 3 (29 avril 2011): 398‑409, doi:10.1016/j.cell.2011.03.049.
x. Jérôme Cecchini et al., « Outcomes of Adult Patients with Sickle Cell Disease Admitted to the ICU: A Case Series* », Critical Care Medicine 42, no 7 (juillet 2014): 1629‑39, doi:10.1097/CCM.0000000000000316.
xi. Florence Suzan et Annie-Claude Paty, « Études descriptives de la mortalité et des hospitalisations liées à la drépanocytose en France », consulté le 4 juin 2017,
http://invs.santepubliquefrance.fr/fr../layout/set/print/Publications-et-54
outils/BEH-Bulletin-epidemiologique-hebdomadaire/Archives/2012/BEH-n-27-28-2012.
xii. M. de Montalembert et al., « Myocardial Ischaemia in Children with Sickle Cell Disease », Archives of Disease in Childhood 89, no 4 (avril 2004): 359‑62.
xiii. Ishak A. Mansi et Fred Rosner, « Myocardial Infarction in Sickle Cell Disease »,
Journal of the National Medical Association 94, no 6 (juin 2002): 448‑52.
xiv. A. Maisel et al., « Continuous Electrocardiographic Monitoring in Patients with Sickle-Cell Anemia during Pain Crisis », Clinical Cardiology 6, no 7 (juillet 1983): 339‑44.
xv. S. Norris, C. S. Johnson, et L. J. Haywood, « Sickle Cell Anemia: Does Myocardial Ischemia Occur during Crisis? », Journal of the National Medical Association 83, no 3 (mars 1991): 209‑13.
xvi. Nghia C. Dang et al., « Myocardial Injury or Infarction Associated with Fat Embolism in Sickle Cell Disease: A Report of Three Cases with Survival »,
American Journal of Hematology 80, no 2 (octobre 2005): 133‑36,
doi:10.1002/ajh.20385.
xvii. M. A. Varat, R. J. Adolph, et N. O. Fowler, « Cardiovascular Effects of Anemia »,
American Heart Journal 83, no 3 (mars 1972): 415‑26.
xviii. L. A. Lester et al., « Cardiac Abnormalities in Children with Sickle Cell Anemia »,
Chest 98, no 5 (novembre 1990): 1169‑74.
xix. Nadjib Hammoudi et al., « Left Atrial Volume Is Not an Index of Left Ventricular Diastolic Dysfunction in Patients with Sickle Cell Anaemia », Archives of
Cardiovascular Diseases 108, no 3 (mars 2015): 156‑62,
doi:10.1016/j.acvd.2014.09.010.
xx. Monica C. Caldas, Zilda A. Meira, et Marcia M. Barbosa, « Evaluation of 107 Patients with Sickle Cell Anemia through Tissue Doppler and Myocardial Performance Index », Journal of the American Society of Echocardiography:
Official Publication of the American Society of Echocardiography 21, no 10
(octobre 2008): 1163‑67, doi:10.1016/j.echo.2007.06.001.
xxi. Leigh A. Callahan et al., « Cardiopulmonary Responses to Exercise in Women with Sickle Cell Anemia », American Journal of Respiratory and Critical Care
Medicine 165, no 9 (1 mai 2002): 1309‑16, doi:10.1164/rccm.2002036.
xxii. Anastasia Anthi et al., « Hemodynamic and Functional Assessment of Patients with Sickle Cell Disease and Pulmonary Hypertension », American Journal of
Respiratory and Critical Care Medicine 175, no 12 (15 juin 2007): 1272‑79,
doi:10.1164/rccm.200610-1498OC.
xxiii. Mark T. Gladwin et al., « Pulmonary Hypertension as a Risk Factor for Death in Patients with Sickle Cell Disease », The New England Journal of Medicine 350, no 9 (26 février 2004): 886‑95, doi:10.1056/NEJMoa035477.
xxiv. Florence Parent et al., « A Hemodynamic Study of Pulmonary Hypertension in Sickle Cell Disease », The New England Journal of Medicine 365, no 1 (7 juillet 2011): 44‑53, doi:10.1056/NEJMoa1005565.
xxv. Lawrence G. Rudski et al., « Guidelines for the Echocardiographic Assessment of the Right Heart in Adults: A Report from the American Society of Echocardiography Endorsed by the European Association of Echocardiography, a Registered Branch of the European Society of Cardiology, and the Canadian Society of Echocardiography », Journal of the American Society of
Echocardiography: Official Publication of the American Society of
Echocardiography 23, no 7 (juillet 2010): 685-713; quiz 786-788,
doi:10.1016/j.echo.2010.05.010.1
xxvi. Thibaud Damy et al., « Haematological Determinants of Cardiac Involvement in Adults with Sickle Cell Disease », European Heart Journal 37, no 14 (7 avril 2016): 1158‑67, doi:10.1093/eurheartj/ehv555.
xxvii. Gerald Simonneau et al., « [Updated clinical classification of pulmonary hypertension] », Turk Kardiyoloji Dernegi Arsivi: Turk Kardiyoloji Derneginin
Yayin Organidir 42 Suppl 1 (octobre 2014): 45‑54.
xxviii. Damy et al., « Haematological Determinants of Cardiac Involvement in Adults with Sickle Cell Disease ».
xxix. Brent A. Williams et al., « Agreement between Heart Failure Patients and Providers in Assessing New York Heart Association Functional Class », Heart &
Lung: The Journal of Critical Care, 27 mai 2017,
doi:10.1016/j.hrtlng.2017.05.001.
xxx. P. L. Enright et D. L. Sherrill, « Reference Equations for the Six-Minute Walk in Healthy Adults », American Journal of Respiratory and Critical Care Medicine 158, no 5 Pt 1 (novembre 1998): 1384‑87, doi:10.1164/ajrccm.158.5.9710086. xxxi. B. S. Denenberg et al., « Cardiac Function in Sickle Cell Anemia », The American
Journal of Cardiology 51, no 10 (juin 1983): 1674‑78.
xxxii. W. Covitz et al., « The Heart in Sickle Cell Anemia. The Cooperative Study of Sickle Cell Disease (CSSCD) », Chest 108, no 5 (novembre 1995): 1214‑19.
xxxiii. Louis Igor Ondze-Kafata et al., « [Echocardiographic aspects of sickle cell disease in Guadeloupe] », The Pan African Medical Journal 18 (2014): 45, doi:10.11604/pamj.2014.18.45.3820.
xxxiv. Homaa Ahmad et al., « Evaluation of Myocardial Deformation in Patients with Sickle Cell Disease and Preserved Ejection Fraction Using Three-Dimensional Speckle Tracking Echocardiography », Echocardiography (Mount Kisco, N.Y.) 29, no 8 (septembre 2012): 962‑69, doi:10.1111/j.1540-8175.2012.01710.x.
xxxv. Shantanu P. Sengupta et al., « Left Ventricular Myocardial Performance Assessed by 2-Dimensional Speckle Tracking Echocardiography in Patients with
56
Sickle Cell Crisis », Indian Heart Journal 64, no 6 (décembre 2012): 553‑58, doi:10.1016/j.ihj.2012.07.021.
Serment d’Hippocrate
Au moment d’être admis à exercer la médecine, en présence des maîtres de cette école et de mes condisciples, je promets et je jure d’être fidèle aux lois de l’honneur et de la probité qui la régissent.
Mon premier souci sera, de rétablir, de préserver ou de promouvoir la santé dans tous les éléments physiques et mentaux, individuels collectifs et sociaux. Je respecterai toutes les personnes, leur autonomie et leur volonté, sans aucune discrimination selon leur état ou leurs convictions. J’interviendrai pour les protéger si elles sont affaiblies, vulnérables ou menacées dans leur intégrité ou dignité. Même sous la contrainte, je ne ferai usage de mes connaissances contre les lois de l’humanité.
J’informerai les patients de décisions envisagées, de leurs raisons et de leurs conséquences. Je ne tromperai jamais leur confiance et n’exploiterai pas le pouvoir hérité des circonstances pour forcer leurs consciences.
Je donnerai mes soins à l’indigent et à quiconque me les demandera. Je ne me laisserai influencer ni par la recherche du gain ni par la recherche de la gloire.
Admis dans l’intimité des personnes, je tairai les secrets qui me sont confiés. Reçu à l’intérieur des maisons, je respecterai les secrets des foyers. Et ma conduite ne servira pas à corrompre les mœurs.
Je ferai tout pour soulager les souffrances, sans acharnement. Je ne provoquerai jamais la mort délibérément. Je préserverai l’indépendance nécessaire à l’accomplissement de ma mission. Que je sois modéré en tout, mais insatiable de mon amour de la science. Je n’entreprendrai rien qui ne dépasse mes compétences ; je les entretiendrai et les perfectionnerai pour assurer au mieux les services qui me seront demandés.
J’apporterai mon aide à mes confrères ainsi qu’à leurs familles dans l’adversité. Que les hommes et mes confrères m’accordent leur estime si je suis fidèle à mes promesses, Que je sois déshonoré et méprisé si j’y manque.
58
NOM ET PRENOM : PIORUNOWSKI LEILA
SUJET DE LA THESE : Left ventricular dysfunction in patients with sickle cell disease
Qualification : Médecine Spécialisée ANNEE : 2017
NUMERO D’IDENTIFICATION : 2017ANTI0183 Résumé
In this study, we analyzed the frequency and clinic characteristics of LVD in the French SCD multicentric cohort initiated from 1999 to 2011 to measure the prevalence of pulmonary hypertension.
Patients included had SS or S-β Thal SCD and were in stable condition. Patients with severe renal, hepatic or pulmonary dysfunction were excluded. The study variables were collected prospectively.
Results :
The French cohort included 392 patients. Thirty seven patients (9,4%) had a LVEF < 55%. Their average age was similar to those without LVD (35 vs. 34 years p= 0.55). Sex-ratio was also identical. No significant difference was found in the frequency of systemic hypertension (10,8% vs. 4,7%), systolic (118,05mmHg vs. 116,7mmHg) or diastolic blood pressure (67,3mmHg vs. 66,0mmHg), or heart rate (72 vs. 74), all p>0,15. BMI (21,89 vs. 21,7kg/m² (p=0,34) and creatinine clearance (126 vs.130 ml/min) were also similar (all p>0.10). LV diastolic volume (82,6 vs. 71,7ml/m²) and E/E’ ratio (8,3 vs 6,7) were increased (all p<0,001), but not cardiac output (6.3 vs. 6.3 l/min), left atrial volume (42,2 vs. 40,8 ml/m²), and the maximal velocity of tricuspid regurgitation (all p>0.10).
Frequency of class 3 NYHA (13,5 vs. 6,8%), 6 minutes walk test distance (523 ± 76 vs. 512 ± 88 m), Borg score (2,0 vs 2,7), BNP value (log expressed, 1,74 vs. 1,83), were similar (all p>0,10).
Conclusion :
LV dysfunction is uncommon in patients with SCD and is not associated with clinical or biological differences which could explain the excess mortality previously observed. It does not result in functional impairment. However a similarly high cardiac output is observed, owing not to an increase in heart rate in those with LV dysfunction, but rather to a LV dilatation whose prognostic value needs further assessment.
JURY : Président : Professeur Rémi Nevière Juges : Professeur Patrick Bourguet
: Professeur Nicolas Venissac : Docteur Jocelyn Inamo
Mots Clefs: Drépanocytose, altération de la fonction ventriculaire gauche, échographie trans thoracique