Étude du potentiel du formatage temporel d’impulsions
laser pour les thérapies rétiniennes sélectives
Mémoire
Pascal Deladurantaye
Maîtrise en biophotonique
Maître ès sciences (M.Sc.)
Québec, Canada
© Pascal Deladurantaye, 2016
Étude du potentiel du formatage temporel d’impulsions
laser pour les thérapies rétiniennes sélectives
Mémoire
Pascal Deladurantaye
Sous la direction de :
Patrick J Rochette, directeur de recherche
Ozzy Mermut, codirectrice de recherche
Résumé
Dans les thérapies rétiniennes sélectives (TRS) au laser, on vise à confiner les dommages produits par le laser à l’épithélium pigmentaire rétinien (EPR). L’objectif poursuivi est de générer des effets thérapeutiques équivalant à ceux de la photocoagulation classique sans toutefois provoquer la destruction des photorécepteurs. La stratégie des TRS consiste à miser sur des durées d’exposition au laser plus courtes (~ 1 µs), ce qui limite la conduction de la chaleur vers les photorécepteurs. Cette réduction des temps d’exposition coïncide avec la transition du régime thermique d’endommagement des cellules à un régime photomécanique, où la microcavitation intracellulaire devient le principal phénomène responsable des dommages créés. La microcavitation correspond à la formation de bulles de vapeur transitoires autour de pigments cellulaires chauffés par le laser. Dans les TRS, il importe de contrôler la taille maximale de ces bulles pour éviter d’endommager les photorécepteurs par voie photomécanique et ainsi profiter d’une réelle sélectivité. Notre étude vise à évaluer le potentiel du formatage temporel d’impulsions laser en tant que méthode permettant d’assurer une diffusion minimale de la chaleur autour des pigments avec un contrôle simultané de la taille des bulles de microcavitation. Afin de réaliser une première preuve de concept, nous nous sommes principalement intéressés aux mécanismes physiques impliqués pour le cas de pigments de mélanine isolés en suspension dans l’eau, et ce tant expérimentalement que théoriquement. Nous présentons également quelques résultats obtenus lors d’expériences préliminaires réalisées ex vivo avec des feuillets d’EPR provenant d’yeux de lapin. Il s’agit là de premières étapes essentielles s’inscrivant dans une démarche qui pourra par la suite examiner la réponse biologique des tissus rétiniens à différents formats d’impulsions, dans le but d’établir les conditions d’irradiation permettant d’optimiser la sélectivité et la fenêtre thérapeutique des TRS.
Abstract
The rationale of selective retina therapies (SRT) is to confine laser-induced damages to the retinal pigment epithelium (RPE) in order to produce therapeutic effects equivalent to those generated in classical photocoagulation, while sparing the photoreceptors. For this purpose, SRT use shorter irradiation times (~ 1µs) to reduce thermal conduction to the neural retina. At these time scales, a transition from thermal to photomechanical cellular damage mechanisms occurs. Indeed, intracellular microcavitation inside RPE cells was shown to be a dominant mechanism leading to cell death in SRT. Microcavitation is a phenomenon where transient vapor bubbles are generated around laser-heated cellular pigments. The control of the maximum size of these bubbles is of paramount importance in SRT to avoid photomechanical alterations of the photoreceptors, which would compromise the selectivity of the treatment. The goal of this study is to evaluate the potential of temporal laser pulse formatting as a mean of ensuring minimal heat conduction around cellular pigments while controlling the size of the bubbles at the same time. In order to conduct a first proof of concept, the focus was kept on the physical mechanisms involved for the case of isolated melanin pigments suspended in water, both experimentally and theoretically. The outcomes of preliminary experiments conducted with leporine RPE sheets ex vivo are also presented. The results of this study represent crucial initial steps in a program that will thereafter examine the biological response of retinal tissues to various pulse formats in order to determine irradiation conditions that will optimize the selectivity and the therapeutic window of SRT.
Table des matières
RÉSUMÉ ... III ABSTRACT ... IV TABLE DES MATIÈRES ... V TABLE DES FIGURES ... VIII REMERCIEMENTS ... XI AVANT-PROPOS ... XII
INTRODUCTION ... 1
LA VUE, UN SENS FORMIDABLEMENT COMPLEXE ... 1
LE LASER COMME OUTIL DE TRAITEMENT ... 1
STRUCTURE DU MÉMOIRE ... 2
CHAPITRE 1 ... 3
ÉLÉMENTS D’ANATOMIE ET DE PHYSIOLOGIE DE L’ŒIL ... 3
CHAPITRE 2 ... 11
LA MÉLANINE ET LES MÉLANOSOMES DE L’EPR ... 11
STRUCTURE DE LA MÉLANINE ET DES MÉLANOSOMES ... 11
DISTRIBUTION DES MÉLANOSOMES À L’INTÉRIEUR DES CELLULES DE L’EPR ... 13
INTERACTION DES MÉLANOSOMES AVEC LA LUMIÈRE ET SES EFFETS ... 14
CHAPITRE 3 ... 19
LA PHOTOCOAGULATION CLASSIQUE ... 19
RÉTINOPATHIES ... 20
Rétinopathie diabétique ... 20
Dégénérescence maculaire liée à l’âge (DMLA) ... 23
Choriorétinopathie séreuse centrale ... 26
PHOTOCOAGULATEURS ... 28
Histoire ... 28
Spectre d’émission ... 29
Mode d’administration du laser ... 31
Domaine temporel ... 32
CHAPITRE 4 ... 35
THÉRAPIES RÉTINIENNES SÉLECTIVES ... 35
ORIGINES ... 35
VAPORISATION ... 36
Diagramme de phase de l’eau ... 37
Vaporisation hors de l’équilibre thermodynamique ... 38
Sites de nucléation ... 39
Croissance et effondrement des bulles ... 40
CONFINEMENT DES DOMMAGES INDUITS PAR MICROCAVITATION ... 41
Conditions recherchées pour les TRS... 41
Effet de la durée des impulsions sur le confinement thermomécanique ... 42
DOSIMÉTRIE ... 46
Technique de détection photoacoustique... 46
Techniques de détection optique des bulles de microcavitation ... 47
SYSTÈMES D’IRRADIATION EMPLOYÉS DANS LES TRS ... 48
Laser déclenché (Q-switch) ... 48
Balayage spatial d’un laser émettant en régime continu ... 50
CHAPITRE 5 ... 51
TECHNOLOGIE LASER À IMPULSIONS PROGRAMMABLES ... 51
PRÉSENTATION GÉNÉRALE DE LA PLATEFORME ... 51
Oscillateur maître ... 51
Chaîne d’amplification optique ... 52
Génération de seconde harmonique ... 54
Effets de l’amplification et de la conversion de fréquence sur la forme temporelle des impulsions ... 55
CONFIGURATIONS UTILISÉES DANS CETTE ÉTUDE... 56
Laser à fibre nanoseconde ... 56
Laser à fibre avec mode « Picoburst » ... 58
CONTEXTE ET OBJECTIFS DE L’ÉTUDE ... 62
CHAPITRE 6 ... 64
ARTICLE EN RÉVISION POUR PUBLICATION ... 64
TITRE DE L’ARTICLE :ON THE IMPACT OF THE PULSE SHAPE ON NANOSECOND AND PICOSECOND LASER-DIRECTED MICROCAVITATION AROUND MELANOSOMES AND MELANIN GRANULES. ... 64
RÉSUMÉ ... 64
ON THE IMPACT OF THE PULSE SHAPE ON NANOSECOND AND PICOSECOND LASER-DIRECTED MICROCAVITATION AROUND MELANOSOMES AND MELANIN GRANULES. ... 65
INTRODUCTION ... 66
MATERIALS AND METHODS ... 68
Melanin granules sample preparation ... 68
Preparation of melanosome suspensions ... 69
Pump-probe setup ... 70
Determination of the radiant exposure ... 72
Measurement of melanin attenuation ... 73
Thermal modeling ... 75
RESULTS ... 78
Measurement of melanin absorption coefficient ... 78
Cavitation threshold-experimental results ... 79
Threshold modeling – surface temperature vs melanin particle radius ... 83
DISCUSSION ... 89
Melanin absorption ... 89
Cavitation threshold – semi-quantitative interpretation ... 90
Cavitation threshold – thermal modeling ... 95
Bubble size vs radiant exposure ... 99
Practical implementation for laser therapeutics – consequences and perspectives ... 104
CONCLUSION ... 105
ACKNOWLEDGMENTS ... 105
REFERENCES ... 106
CHAPITRE 7 ... 109
EXPÉRIENCES PRÉLIMINAIRES SUR FEUILLETS D’EPR DE LAPIN ... 109
SEUIL DE MICROCAVITATION ... 109
Méthodologie... 109
Résultats ... 110
Discussion ... 111
ESSAIS À DES EXPOSITIONS ÉNERGÉTIQUES SUPÉRIEURES AU SEUIL ... 111
CONCLUSION DU CHAPITRE ... 112
CONCLUSION GÉNÉRALE ... 113
Table des figures
Figure 1. Aperçu à haut niveau de l’anatomie de l’oeil humain . ... 3
Figure 2. Aperçu à haut niveau de la structure de la rétine. ... 4
Figure 3. Détail des couches de la rétine. ... 5
Figure 4. Distribution spatiale des cônes et des bâtonnets. ... 6
Figure 5. Structure générale des photorécepteurs. ... 7
Figure 6. Illustration des rôles de l’EPR. Inspiré de Strauss. ... 8
Figure 7. Illustration du transport, via l’EPR, de molécules entre la rétine neurale et la choroïde. ... 9
Figure 8. La phototransduction implique l’isomérisation du rétinal... 9
Figure 9. Illustration des principales étapes de la synthèse de la mélanine. ... 11
Figure 10. Spectre d’absorption de l’eumélanine. ... 12
Figure 11. Photos prises au microscope électronique de mélanosomes d’EPR de boeuf et de veau. ... 13
Figure 12. EPR humain normal et couche de cellules d’EPR de porc. ... 14
Figure 13. Seuils de dommage aux tissus en fonction du temps d’interaction. ... 15
Figure 14. Microcavitation intracellulaire induite par laser, menant à la désintégration d’une cellule d’EPR. ... 17
Figure 15. Vue au microscope d’une brûlure créé au laser à argon sur une rétine de lapin ... 19
Figure 16. Illustration des problèmes vasculaires associés à la rétinopathie diabétique. ... 21
Figure 17. Simulations montrant les effets de la rétinopathie diabétique sur la vision. ... 21
Figure 18. Photocoagulation panrétinienne (PPR) pour le traitement de la RD. ... 22
Figure 19. Traitement de l’œdème maculaire avec un laser focalisé. ... 22
Figure 20. Application d’une grille de brûlures dans la region de la macula. ... 23
Figure 21. Illustration des désordres rétiniens associés aux deux formes de DMLA. ... 24
Figure 22. Images OCT d’une rétine normale et de la rétine d’un patient atteint de CRSC. ... 27
Figure 23. Photocoagulateur à arc au xénon. ... 28
Figure 24. Différentes générations de photocoagulateurs.. ... 29
Figure 25. Spectres d’absorption des principaux pigments oculaires. ... 30
Figure 26. Lampe à fente. ... 31
Figure 27. Différents modes d’administration du laser utilisés dans les traitements de photocoagulation. ... 32
Figure 28. Le système Pascal permet de diminuer les dommages à la rétine neurale et à la choroïde. ... 33
Figure 29. Schéma explicatif du principe du système micropulse. ... 33
Figure 30. a) Distributions de température calculées pour différentes durées d’impulsion. ... 36
Figure 31. Représentation schématique du diagramme de phases de l’eau. ... 37
Figure 32. Illustration des paramètres importants pour le contrôle de la microcavitation dans les TRS. ... 42
Figure 33. Seuils de microcavitation rapportés dans la littérature (longueur d’onde: 530 +/- 3 nm). ... 43
Figure 34. La dynamique de cavitation dépend de la durée des impulsions.. ... 43
Figure 35. Dynamique de cavitation observée par Neumann et Brinkmann. ... 44
Figure 36. Exemples de signaux acoustiques détectés dans des expériences d’irradiation d’EPR ... 47
Figure 37. Exemple de detection d’une bulle de microcavitation par réflectométrie. ... 48
Figure 38. Formes d’impulsion typiques produites par les lasers déclenchés utilisés dans les TRS. ... 49
Figure 39. Comparaison: laser impulsionnel vs laser continu balayé.. ... 50
Figure 40. Spectres d’émission et d’absorption typiques de fibres de silice dopées à l’ytterbium. ... 53
Figure 42. Exemple de distorsions d’une forme temporelle rectangulaire, induites par l’amplification. ... 55
Figure 43. Exemple de distorsion d’une impulsion laser due au processus de conversion de fréquence. ... 56
Figure 44. Schéma-bloc d’un des deux lasers utilisés dans cette étude... 57
Figure 45. Exemples de formats d’impulsions générés avec le laser de la Fig. 44. ... 57
Figure 46. Technologie permettant de générer des trains d’impulsions picoseconde. ... 58
Figure 47. Exemple de format d’impulsion généré avec la configuration décrite dans la Fig. 46. ... 59
Figure 48. Second laser utilisé dans cette étude. ... 60
Figure 49. Exemple de fibre microstructurée. ... 61
Figure 50. Seuil de microcavitation mesuré avec des explants d’EPR de lapin ... 110
Figure 51. Forme typique du signal sonde observé durant les experiences avec des explants d’EPR. ... 111
À mon fils et à sa mère
« Keep your eyes on the stars, and your feet on the ground. » Theodore Roosevelt
Remerciements
Merci à Pierre Galarneau pour avoir appuyé ce projet et pour avoir contribué à fournir les ressources à la mesure des objectifs poursuivis. Je remercie Pierre, de même qu’Ozzy Mermut et Pascal Gallant, d’avoir consenti à ce que j’entreprenne une maîtrise en biophotonique en synergie avec mon emploi de chercheur à l’INO. Je suis reconnaissant pour votre ouverture, votre souplesse et votre appui dans la conciliation des exigences académiques et professionnelles. Il s’agissait pour moi d’une opportunité exceptionnelle.
Je tiens également à remercier Yves Taillon, gestionnaire du programme systèmes lasers à l’INO, pour le prêt d’un laser à impulsions programmables et pour avoir rendu disponibles des membres de son équipe pour m’appuyer techniquement dans la réalisation d’un prototype de laser programmable dernier cri. À ce propos, je remercie Louis Desbiens, Vincent Roy et Marc Deladurantaye. Je remercie également Frédéric Émond, technologue à l’INO, pour sa contribution majeure au projet, notamment au niveau de la réalisation des bancs de tests et des expériences. Merci également à Patrick Paradis, technologue à l’INO, qui a contribué à l’installation des bancs de test.
Merci à Christian Salesse, directeur de l’unité de recherche en ophtalmologie à l’université Laval, pour avoir appuyé la collaboration avec l’INO, et pour son implication dans l’évaluation de mon séminaire de maîtrise. Je remercie mon directeur, Patrick Rochette, pour m’avoir accueilli dans son équipe, pour sa grande disponibilité et pour ses encouragements. Merci également à ses étudiants pour leur accueil, en particulier à Justin Mallet, qui a donné un coup de main dans les dissections. Merci à Sébastien Méthot, qui a participé aux dissections, à l’installation des bancs de test et aux expériences d’irradiation. Un merci spécial à Solange Landreville, chercheure, et à son équipe, pour leur contribution dans certains essais réalisés avec des cellules en culture.
Finalement, un immense merci à ma conjointe Jacqueline et à mon fils Alexis, pour leur appui inconditionnel, leurs encouragements et pour avoir accepté de composer avec ma disponibilité réduite.
Avant-Propos
Ce projet a été initié dans la perspective d’étendre au domaine thérapeutique l’exploitation d’une technologie laser initialement développée par l’Institut National d’Optique (INO) pour les applications industrielles de traitement fin des matériaux par laser. Le projet a été conduit dans le contexte d’une collaboration entre l’INO et le Centre Universitaire d'Ophtalmologie (CUO) – Recherche de l’Université Laval. En tant qu’étudiant, j’ai développé les bancs de test laser et les protocoles d’irradiation sous la supervision du Dr. Patrick Rochette (Université Laval), mon directeur, et du Dr. Ozzy Mermut (INO), ma co-directrice, et avec le support technique de personnel technique de l’INO. L’exécution proprement dite des expériences d’irradiation a été conduite soit directement par moi, soit par Frédéric Émond (INO), soit par Sébastien Méthot (Université Laval), sous ma supervision. La préparation des échantillons de mélanosomes et d’explants rétiniens a été supervisée par Patrick Rochette et exécutée soit par moi, soit par Sébastien Méthot. J’ai entièrement développé la modélisation informatique et pris en charge le traitement des données expérimentales, avec le support occasionnel de Sébastien Méthot et de Frédéric Émond.
Au moment de soumettre ce mémoire, le manuscrit d’article rédigé en anglais et inséré au chapitre 6 était en cours de révision par Patrick Rochette et Ozzy Mermut. J’ai rédigé ce manuscrit dans son intégralité et j’apparais comme premier auteur. Dans la liste des coauteurs figurent Ozzy Mermut, Sébastien Méthot et Patrick Rochette, dont les implications dans le projet ont été décrites précédemment. Ozzy Mermut est gestionnaire du programme de biophotonique à l’INO. Patrick Rochette est professeur-chercheur spécialisé en biologie moléculaire à l’université Laval, il dirige les activités d’un laboratoire de recherche en ophtalmologie situé à l’hôpital du Saint-Sacrement à Québec. Figure également dans cette liste le nom de Pierre Galarneau, expert en laser et vice-président et chef de la technologie à l’INO. Pierre pilote le programme de recherche interne de l’INO, duquel faisait partie le projet qui nous intéresse dans ce mémoire. Les références originales de l’article ont été regroupées à la fin du mémoire.
Introduction
La vue, un sens formidablement complexe
Le fait de voir représente une prouesse extraordinaire, résultant de millions d’années d’évolution. La perception de la lumière remontrait à plus de 500 millions d’années (début de l’ère cambrienne), conséquence de l’apparition d’une proto-opsine ancestrale1,2. Les pressions évolutives ont par la suite favorisé l’émergence
d’une panoplie de systèmes visuels adaptés aux différents environnements des très nombreuses espèces ayant fait leur apparition au cours de la période dite de l’explosion cambrienne. Chez les vertébrés, la perception visuelle implique non seulement l’œil mais aussi le cerveau, au niveau du cortex visuel. Chez l’humain, près de la moitié du cortex cérébral est impliqué dans le traitement de l’information visuelle et on estime que 70% des récepteurs sensoriels de l’organisme sont situés dans les yeux. Ces attributs du système visuel en font le sens le plus développé chez l’humain3. La perception et le décodage des signaux lumineux
qui nous parviennent nécessite la participation de nombreux mécanismes physiologiques souvent très complexes. C’est notamment le cas de la phototransduction, qui permet la conversion de l’énergie des photons en signal électrique au niveau des photorécepteurs. Le maintien de la fonction des photorécepteurs implique d’assurer un apport suffisant en oxygène et en nutriments de même que l’élimination des déchets résultant de leur renouvellement. Ceci mobilise plusieurs tissus environnants au sein desquels se déroulent simultanément une multitude de mécanismes qui participent à la régulation du cycle visuel.
Le laser comme outil de traitement
Divers dysfonctionnements de ces mécanismes et tissus sont à l’origine de pathologies rétiniennes pouvant entraîner la dégénérescence des photorécepteurs et du coup une perte de fonction visuelle. Paradoxalement, la destruction délibérée d’une partie du tissu rétinien à l’aide d’un laser peut dans certains cas ralentir, voire freiner la dégénérescence. La compréhension de l’origine des effets thérapeutiques générés par cette destruction dans les traitements au laser de certaines pathologies rétiniennes demeure encore très partielle. La photocoagulation classique, qui consiste littéralement à créer des brûlures au niveau du fond de l’œil, apparaît de plus en plus comme une approche de type force brute, pour laquelle les effets escomptés ne sont obtenus qu’au prix d’une perte significative de fonction visuelle. Depuis l’an 2000, une approche thérapeutique au laser permettant de mieux préserver les fonctions visuelles a été développée par des équipes allemandes et américaines. Cette approche, nommée thérapie rétinienne sélective (TRS, en anglais selective retina
therapy, SRT), mise sur des durées d’exposition plus courtes et s’est avérée apparemment efficace dans le traitement de la rétinopathie diabétique4 et de la choriorétinopathie séreuse centrale (CRSC)5,6. Le
développement des TRS a permis de mettre en lumière le fait qu’il semble possible de concevoir des traitements au laser moins invasifs et aussi efficaces que la photocoagulation classique, la clé résidant dans le choix de conditions d’irradiation permettant de mieux confiner les dommages créés par le laser autour des sites d’absorption du rayonnement. C’est dans cette perspective que s’inscrivent les travaux réalisés dans la présente étude, dont l’objectif est de réaliser une première évaluation du potentiel pour les TRS d’une stratégie consistant à exercer un contrôle fin du profil d’amplitude des impulsions laser dans le domaine temporel, à l’échelle des nanosecondes et des picosecondes. Cette technique, appelée formatage temporel d’impulsions laser, procure une grande flexibilité pour ajuster les taux de couplage de l’énergie du laser dans les tissus rétiniens. Clairement, on veut savoir si cette flexibilité peut permettre une amélioration significative du contrôle du confinement des dommages par rapport aux lasers utilisés jusqu’ici dans les TRS.
Structure du mémoire
Avant d’entrer dans le vif du sujet, nous croyons utile de discuter plus amplement de l’anatomie et de la physiologie de l’œil, en insistant particulièrement sur la rétine. Cela constitue l’objet du premier chapitre de ce mémoire. Au deuxième chapitre, nous discutons brièvement des caractéristiques et propriétés de la mélanine et des mélanosomes de l’épithélium pigmentaire rétinien, avant d’enchaîner au troisième chapitre avec une revue de la photocoagulation classique et des principales pathologies rétiniennes couramment traitées avec cette approche. Le quatrième chapitre est quant à lui consacré aux thérapies sélectives rétiniennes, suivi au cinquième chapitre d’une présentation de la technologie laser utilisée dans nos travaux. Un manuscrit d’article présentant l’essentiel des travaux réalisés dans cette étude avec des particules de mélanine et des mélanosomes constitue le corps du chapitre six. Le septième chapitre porte sur des expériences préliminaires réalisées avec des explants de rétine de lapin, suivi d’une conclusion générale de l’étude.
Chapitre 1
Éléments d’anatomie et de physiologie de l’œil
Le bulbe de l’œil est une structure creuse de forme approximativement sphérique (Figure 1). La partie avant, appelée segment antérieur, est séparée de la partie arrière ou segment postérieur, par le cristallin, la « lentille de l’œil ». L’œil est rempli de liquides, ce qui assure le maintien de sa forme. Dans le segment postérieur, le liquide est plutôt gélatineux et se nomme le corps vitré. Ce dernier transmet la lumière tout en contribuant à la pression intraoculaire, ce qui permet de soutenir l’arrière du cristallin et de maintenir la rétine neurale en place. Le segment antérieur est rempli d’humeur aqueuse, un liquide transparent contenant du glucose qui sert de source d’énergie entre autres pour la cornée et le cristallin. La paroi du globe oculaire comporte plusieurs couches de tissus ou tuniques. L’enveloppe externe, appelée tunique fibreuse, est composée de tissu conjonctif dense et peu vascularisé. Dans son sixième antérieur, les fibres de collagène de cette enveloppe sont disposées de manière régulière, ce qui confère sa transparence à la cornée. Cette disposition régulière n’existe pas dans le reste de la tunique fibreuse, appelé sclère. La sclère est opaque et d’un blanc brillant, c’est un tissu résistant de texture tendineuse qui assure une bonne protection au bulbe de l’œil.
Figure 1. Schéma anatomique de l’oeil humain7 .
La couche suivante (en partant de l’extérieur vers l’intérieur du globe oculaire), qui est pigmentée, se nomme la tunique vasculaire ou encore l’uvée. Elle comprend la choroïde, le corps ciliaire et l’iris. Tissu de couleur brun foncé, la choroïde occupe les cinq sixièmes postérieurs de la tunique vasculaire. Elle est fortement vascularisée, ce qui permet l’irrigation de l’ensemble des tuniques de l’œil. Son pigment brun, la mélanine, est produit par des cellules appelées mélanocytes. La mélanine absorbe fortement la lumière
parvenant à la choroïde, empêchant sa diffusion et sa réflexion à l’intérieur de l’œil, lesquelles nuiraient à la vision. À l’avant, la choroïde forme le corps ciliaire, qui est un anneau principalement composé de faisceaux musculaires entourant le cristallin. Ces faisceaux musculaires ont pour fonction de changer la forme du cristallin pour permettre l’accommodation. Le corps ciliaire comporte aussi des plis appelés procès ciliaires, dont les capillaires sécrètent l’humeur aqueuse. Le corps ciliaire est par ailleurs rattaché à la partie postérieure de l’iris, qui joue le rôle de diaphragme grâce à l’action des cellules musculaires lisses dont il est composé.
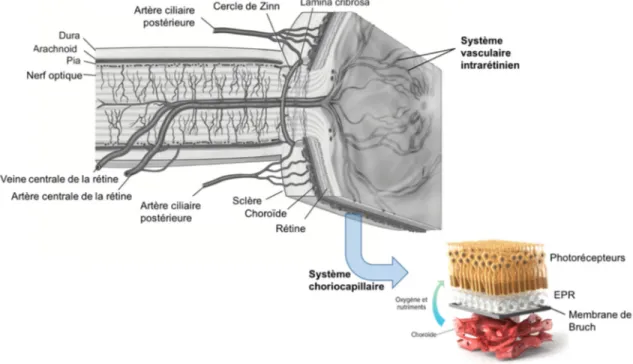
La tunique interne de l’œil, appelée la rétine, est formée de deux parties principales, soit l’épithélium pigmentaire rétinien (EPR) et la rétine neurale. D’une épaisseur typique de 500 µm, la rétine reçoit son apport sanguin par un double système : la choriocapillaire et un système d’artères intrarétiniennes émanant de l’artère centrale de la rétine (Figure 2). La première assure la vascularisation des couches externes (notamment les photorécepteurs) par diffusion à travers la membrane de Bruch, alors que la seconde prend en charge l’apport artériel aux couches internes de la rétine. La membrane de Bruch se situe entre l’EPR et la choroïde, elle joue le rôle d’un filtre semi-perméable gérant la diffusion des biomolécules entre ces deux couches.
Figure 2. Représentation schématique de la structure de la rétine. Adapté de Anand-Apte et Le Fol8,9 .
La rétine neurale est transparente, on peut la considérer comme une émergence des cellules nerveuses du cerveau. On y retrouve plusieurs types de cellules nerveuses (Figure 3) jouant des rôles distincts. On
distingue principalement les cellules photoréceptrices ou photorécepteurs (qui comprennent les cônes et les bâtonnets), les cellules bipolaires et les cellules ganglionnaires10. Les signaux électro-chimiques produits par
les photorécepteurs par phototransduction sont conduits aux cellules bipolaires puis aux cellules ganglionnaires. C’est au sein de ces dernières que sont engendrés les potentiels d’action qui assurent l’acheminement des informations sensorielles au cortex visuel. Il existe plusieurs types de cellules ganglionnaires dont certaines possèdent une photosensibilité intrinsèque11,12 et innervent différentes régions
du cerveau impliquées entre autres dans les fonctions circadiennes13–17, le réflexe pupillo-moteur13,14, la
modulation des fonctions cognitives16 et les paramètres du sommeil13,14,16.
Figure 3. Détail des couches de la rétine. Adapté des références 9,10.
Les cellules horizontales sont reliées à plusieurs cônes, bâtonnets et cellules bipolaires. Elles jouent un rôle d’inhibition sélective des cellules avoisinantes, ce qu’on nomme l’inhibition latérale. Le rôle de l’inhibition latérale est d’augmenter le contraste et la définition du stimulus visuel en supprimant la transmission du signal des photorécepteurs qui sont moins bien illuminés18. Les cellules amacrines relient quant à elles les cellules
bipolaires et les cellules ganglionnaires, ce lien constituant une route indirecte alternative entre celles-ci. Ces cellules semblent avoir plusieurs fonctions (formation de sous-unités fonctionnelles dans les champs réceptifs de cellules ganglionaires, contribution à la communication verticale à travers les différentes couches rétiniennes, certaines fonctions paracrines, etc.), la plupart demeurant cependant inconnues18.
Les photorécepteurs sont des neurones modifiés3 et constituent le siège de la phototransduction. Il en
existe deux types principaux : les cônes et les bâtonnets. Les bâtonnets sont plus nombreux que les cônes, ils interviennent principalement au niveau de la vision périphérique et de la vision crépusculaire. Leur photosensibilité est plus grande que celle des cônes, par contre les images qu’ils génèrent sont moins nettes et sont dépourvues d’information relative aux couleurs. En revanche, les cônes sont optimisés pour fonctionner en pleine lumière et permettent une perception très précise des couleurs. Il en existe trois types chez l’humain, qui se différencient par leur réponse spectrale. Les cônes sont surtout concentrés sur la fovéa, une région spécialisée du centre de la rétine, d’environ 1.5 mm de diamètre, située dans le prolongement de l’axe optique (Figure 4A et 4B).
Figure 4. Distribution spatiale des cônes et des bâtonnets19. A) Vue d’ensemble avec position de la fovea et du
nerf optique. B) Courbes de distribution des cônes et des bâtonnets. C) Acuité visuelle en function de la position angulaire par rapport à l’axe optique.
Les photorécepteurs comportent un segment externe (leur partie photosensible) et un segment interne (Figure 5)20. Le segment interne contient de nombreuses mitochondries qui fournissent l’énergie nécessaire à
la synthèse des molécules servant au renouvellement constant des disques du segment externe des photorécepteurs. Le segment interne est relié au corps cellulaire, qui contient le noyau. Enfin, la partie la plus interne est constituée d’une terminaison synaptique qui établit des jonctions synaptiques avec les cellules bipolaires. Les photopigments (la rhodopsine, dans le cas des bâtonnets) sont contenus dans des structures en forme de disques formés par des invaginations de la membrane plasmique au niveau du segment externe.
Cette configuration permet de maximiser la surface (et donc la probabilité) de détection de la lumière. Chez les mammifères, chaque segment externe est formé d’une pile de 1000 à 2000 disques membranaires20.
L’exposition constante des photorécepteurs à la lumière provoque d’autre part en leur sein l’augmentation progressive de la concentration de protéines et de lipides ayant subi des dommages photo-induits21. Afin de
maintenir la structure et la fonction des protéines et des membranes desquelles dépendent la photosensibilité des photorécepteurs, le segment externe est constamment renouvelé, suivant un rythme circadien. À la fin de chaque nuit, de nouveaux disques s’ajoutent du côté proximal (côté du corps cellulaire), ce qui pousse l’empilement à avancer vers la périphérie. Les disques les plus externes se fragmentent alors puis sont phagocytés par les cellules de l’EPR le matin, suivant la première exposition à la lumière22.
Figure 5. A) Structure générale des photorécepteurs chez les vertébrés. B) Image prise au microscope électronique montrant les details de la rétine chez la souris (IS: segment interne, ROS: segment externe). Adapaté de Palczewski et al20.
L’EPR est une monocouche de cellules fortement pigmentées qui adhère à la membrane de Bruch du côté externe tout en étant maintenue en liaison étroite mais précaire avec le segment externe des photorécepteurs. Chez l’humain, ces cellules ont un diamètre variant typiquement entre 7 et 10 µm23. L’EPR
joue de multiples et très importants rôles pour maintenir la fonction des photorécepteurs, incluant l’absorption de la lumière, le transport de molécules, la phagocytose des segments externes, le maintien des concentrations d’ions à des niveaux optimaux et la sécrétion d’une variété de facteurs assurant l’intégrité de la rétine (Figure 6)24. Tout dysfonctionnement de l’EPR peut mener à une dégénérescence de la rétine,
entraînant du coup une perte d’acuité visuelle ou carrément la cécité. Certains avancent qu’ensemble, l’EPR et les photorécepteurs peuvent être considérés comme une seule et même unité fonctionnelle21.
Figure 6. Schématisation des rôles de l’EPR. SE: segment externe, MV: microvillosités. Inspiré de Strauss21.
Comme mentionné plus haut, l’EPR intervient dans le cycle de renouvellement du segment externe (SE) des photorécepteurs22. Les SE y sont digérés et d’importantes molécules, comme le rétinal (une des trois
formes de la vitamine A) et l’acide docosahexaenoïque (DHA, un acide gras qui entre dans la composition des membranes neuronales), sont retournées aux photorécepteurs. La phagocytose des SE doit être étroitement coordonnée entre les photorécepteurs et l’EPR, sans quoi la longueur des SE ne pourrait être gardée constante.
La présence de jonctions occlusives entre ses cellules fait de l’EPR une barrière hémato-rétinienne externe. Le transport de l’eau, des nutriments et d’une grande variété d’ions entre les photorécepteurs et le système choriocapillaire est de fait majoritairement assuré par l’EPR (Figure 7). La structure, la distribution des organites de même que l’organisation des protéines membranaires des cellules de l’EPR possèdent une asymétrie selon l’axe reliant leur côté apical (côté des photorécepteurs) et leur côté basolatéral (côté choriocapillaire)25–38. La pompe Na+ -K+ –ATPase, située du côté apical, permet le transport
transépithélial31,34,35,37–43. Dans la direction allant du côté apical au côté basal, le transport de l’eau revêt une
importance particulière. De grandes quantités d’eau sont en effet produites par l’activité métabolique intense des photorécepteurs. Cette eau doit être évacuée de la rétine, ce qui est en partie accompli par l’EPR. Ce transport permet d’ailleurs de garantir une certaine adhérence de la rétine à l’EPR44–46. Dans la direction
opposée, l’EPR gère le transport du glucose, du rétinol et de l’acide docosahexaenoïque en provenance de la circulation sanguine.
Figure 7. Représentation schématique du transport, via l’EPR, de molécules entre la rétine neurale et la choroïde. Adapté de Strauss21.
Grâce à ses fonctions de transport, l’EPR permet d’assurer l’homéostasie des ions au niveau de la rétine externe. De manière analogue aux cellules gliales, l’EPR participe par ailleurs, avec les cellules de Müller47–49,
à la compensation de changements abrupts des concentrations d’ions pouvant s’y produire50. C’est
notamment le cas du potassium suite à l’excitation des photorécepteurs par la lumière.
Figure 8. La phototransduction implique l’isomérisation du rétinal51. A : isomère 11-cis. B : isomère
L’EPR joue également un rôle capital dans le cycle visuel. La phototransduction implique l’isomérisation du rétinal de sa forme 11-cis vers sa forme tout-trans-rétinal3 (Figure 8). Les photorécepteurs ne possèdent
pas la fonction d’isomérase cis-trans permettant la régénération de la forme tout-trans-rétinal en isomère 11-cis suite à la transduction de photons en impulsions électriques52,53. Cette ré-isomérisation se produit plutôt
dans l’EPR, ce qui implique une circulation du rétinal entre l’EPR et la rétine neurale sans laquelle l’excitabilité des photorécepteurs ne pourrait être maintenue. Cette circulation est rendue possible par le fait qu’il y a photolyse du rétinal suite à l’absorption d’un photon, ce qui permet ensuite sa libre circulation jusqu’à l’EPR.
L’EPR intervient aussi dans le maintien de l’intégrité structurelle et fonctionnelle de la rétine et du système choriocapillaire par la sécrétion d’une variété de facteurs. Par exemple, l’un de ces facteurs, le PEDF (Pigment epithelium-derived factor), agit comme neuroprotecteur pour la rétine neurale en prévenant l’apoptose induite par l’hypoxie54–56. Ce facteur stabilise également le système chroriocapillaire en jouant un rôle
antiangiogénique57–59. Un autre facteur sécrété par l’EPR, le VEGF (Vascular endothelial growth factor),
permet, à faible dose, de maintenir intact l’endothélium des choriocapillaires en prévenant l’apoptose des cellules endothéliales60. La sécrétion par l’EPR de PEDF et d’autres facteurs comme bFGF (Basic fibroblast
growth factor) ou CNTF (Ciliary neurotrophic factor) ayant un rôle neuroprotecteur serait par ailleurs stimulée en cas de dommages à la rétine54,61–64.
Finalement, l’absorption de lumière par les pigments de l’EPR contribue à la netteté de la vision en limitant la propagation de lumière diffusée partout dans le globe oculaire. Cette absorption protège de plus l’EPR contre le stress photo-oxydatif causé par l’exposition à la lumière dans l’environnement riche en oxygène dans lequel il se trouve. La présence d’espèces réactives d’oxygène produites par la digestion des segments externes des photorécepteurs augmente par ailleurs le risque de dommages photo-induits. Pour se prémunir contre ce type de dommages, l’EPR contient des mélanosomes, organites à l’intérieur desquels est stockée la mélanine. La mélanine est un pigment qui absorbe fortement la lumière et ainsi peut limiter l’activité photo-oxydative en agissant comme écran protecteur. On estime que l’EPR absorbe de 34 à 60 % de la lumière qui lui parvient, dans la région de la fovéa23. Dans la région paramaculaire, cette proportion est de
l’ordre de 21 à 40 % alors qu’elle s’établit à 26 à 57 % dans la région équatoriale23. Vu leur importance par
rapport au sujet de la présente étude, nous dédions dans la suite un chapitre à la mélanine et aux mélanosomes de l’EPR.
Chapitre 2
La mélanine et les mélanosomes de l’EPR
La mélanine désigne une classe de macromolécules agissant comme pigment responsable de la coloration de nombreux tissus biologiques. L’œil en contient deux types, soit l’eumélanine et la phéomélanine. Les mélanosomes de l’EPR renferment surtout de l’eumélanine, de couleur brun foncé ou noire. Dans ce chapitre, nous nous attardons à la structure, à la composition et à la distribution des mélanosomes de l’EPR. Nous abordons également la question de l’interaction des mélanosomes avec la lumière, car au-delà des fonctions physiologiques concernées, ce sujet revêt une importance cruciale pour interpréter ce qui se produit lorsqu’un faisceau laser est dirigé sur l’EPR à des fins thérapeutiques.
Structure de la mélanine et des mélanosomes
À l’échelle moléculaire, la mélanine peut être considérée comme un biopolymère dérivé de l’oxydation de la tyrosine (eumélanine) ou de la tyrosine et de la cystéine (phéomélanine), réaction catalysée par l’enzyme tyrosinase (Figure 9). Dans la suite, nous discuterons exclusivement de l’eumélanine, composante principale (dans une proportion dépassant 99%) de la mélanine à l’intérieur des mélanosomes de l’EPR65–67.
L’eumélanine possède plusieurs propriétés particulières dont une insolubilité presque totale dans tous les solvants. Très hétérogène au niveau moléculaire et supramoléculaire, l’eumélanine est de nature amorphe. Son spectre d’absorption (Figure 10) est monotone et exempt de signatures distinctives, à part une forte absorption dans la région de l’ultraviolet (ce qui lui permet par ailleurs d’assurer un rôle photoprotecteur). Ces caractéristiques ont rendu remarquablement ardue l’entreprise d’étudier sa structure fondamentale, si bien que cette dernière demeure encore incertaine.
Figure 10. Spectre d’absorption de l’eumélanine. Graphique réalisé à partir des données de la réf. 68.
Les mélanosomes de l’EPR sont des organites de nature granulaire qui séquestrent la mélanine à l’intérieur d’une membrane bilipidique. Pour plusieurs espèces, incluant l’humain, le rat et le bœuf, leur forme est souvent allongée (Figure 11), pouvant rappeler celle d’un cigare65,69,70. Les dimensions et la forme varient
selon l’espèce et l’âge. Chez le bœuf, la longueur du grand axe se situe entre 0.6 et 2.9 µm alors que celle du petit axe varie de 0.5 à 0.8 µm65. Chez l’humain, ces dimensions sont typiquement de 1 à 2 µm et de 0.8 à 1
µm respectivement67,71. Toujours chez l’humain, la mélanogénèse dans l’EPR débute dans les premières
semaines de gestation et se terminerait vers l’âge de 2 ans. Il n’y aurait donc pas de renouvellement de la pigmentation de l’EPR la vie durant72,73. Ceci est cohérent avec la diminution observée de la concentration de
mélanine dans l’EPR alors que l’âge avance, contrairement à ce qui prévaut pour la mélanine de la choroïde qui elle est renouvelée23,69,74,75. La population de mélanosomes de forme allongée diminue également avec
l’âge dans l’EPR, au profit de mélanosomes plus sphériques. Cette évolution s’accompagnerait d’un remplacement progressif des mélanosomes par des complexes granules-lysosomes et mélano-lipofuscine69,76,77.
Figure 11. Photos prises au microscope électronique de mélanosomes d’EPR de boeuf (A, à gauche) et de veau (B, à droite)65 .
Les mélanosomes possèdent une sous-structure constituée de granules quasi-sphériques d’un diamètre typique d’une trentaine de nanomètres78,79 alignés sur une matrice protéinique. Chaque granule peut contenir
environ 2.5 millions d’unités de base de mélanine (elles-mêmes constituées d’oligomères comportant un mélange de 3 à 6 monomères de 5,6-dihydroxyindole (DHI) et d’acide 5,6-dihydroxyindole-2-carboxylique (DHICA))80,81 dont la cohésion semble dépendre de l’organisation de la matrice protéinique. Leur arrangement
s’apparente physiquement à un réseau désordonné82 résultant de mécanismes d’agrégation demeurant
largement inconnus. Ce réseau aurait une structure fractale, c’est-à-dire invariante d’échelle83,84.
Distribution des mélanosomes à l’intérieur des cellules de l’EPR
Les mélanosomes sont distribués de manière asymétrique dans les cellules de l’EPR (Figure 12), se concentrant davantage du côté apical et particulièrement au niveau des microvillosités, tout près des segments externes des photorécepteurs23. Fait intéressant, il a été démontré que la concentration de mélaninede l’EPR chez les individus de race noire est la même que ceux de race blanche23, par opposition à ce qui
prévaut au niveau de l’épiderme.
Cette proximité des mélanosomes par rapport aux photorécepteurs permet l’absorption de la lumière non absorbée par ces derniers, ce qui améliore la qualité des images en minimisant la diffusion et les réflexions. Elle serait également cohérente avec l’hypothèse selon laquelle les mélanosomes joueraient un rôle actif dans la digestion des fragments des segments externes. En effet, la surface des mélanosomes contient de la cathepsine D, qui est l’hydrolase principalement impliquée dans la protéolyse des opsines présentes dans les fragments de segments externes phagocytés par l’EPR85. Ce possible rôle est également suggéré par
l’observation de fusions entre les mélanosomes et les phagosomes ainsi que par le résultat d’expériences menées avec des cellules en culture démontrant une accumulation accrue de segments externes non digérés dans le cas de cellules non pigmentées86.
Figure 12. Gauche: image prise au microscope électronique d’un EPR humain normal. bm: membrane de Bruch, zk: noyau cellulaire, pg: mélanosomes, as: segments externes des photorécepteurs. Droite: image prise au microscope électronique d’une couche de cellules d’EPR de porc. La coupe a été faite de manière approximativement parallèle à la membrane de Bruch. Le coin supérieur gauche montre la distribution des mélanosomes dans la partie supérieure (apicale) d’une cellule, alors que le coin inférieur droit montre la region du noyau des cellules87.
Interaction des mélanosomes avec la lumière et ses effets
La mélanine absorbe l’énergie lumineuse sur une grande plage de longueurs d’onde couvrant l’ensemble du spectre visible (Figure 10). La nature monotone de ce spectre s’interprète assez bien lorsque l’on assimile la mélanine à un assemblage hétérogène de chromophores pouvant interagir électroniquement. Bien que les mélanosomes puissent diffuser la lumière (comme n’importe quelle autre particule microscopique), cette contribution à l’atténuation totale serait négligeable88. De plus, la fluorescence émise par l’eumélanine s’avère
extrêmement faible, plus de 99.9% de l’énergie absorbée étant convertie suivant des voies non-radiatives89.
En somme, l’énergie lumineuse interceptée par les mélanosomes serait presqu’entièrement convertie en chaleur, un processus appelé conversion photon/phonon (conversion interne). Un phonon est un quantum d’énergie vibrationnelle, étroitement associé à des caractéristiques comme la capacité calorifique et la vitesse du son dans une substance. Le rôle protecteur des mélanosomes tire son origine de cette capacité exceptionnelle qu’ils possèdent de convertir la lumière en chaleur, ce qui permet de limiter la quantité
d’énergie lumineuse disponible pour les réactions photochimiques pouvant produire des radicaux toxiques. Ceci suppose bien entendu une dissipation efficace et rapide d’une quantité de chaleur relativement modeste, ce qui est généralement le cas pour les conditions d’illumination habituelles auxquelles la rétine est exposée.
Dans le cas d’expositions accidentelles ou délibérées (par exemple lors de traitements au laser de la rétine) à des doses de lumière inhabituellement élevées, les effets sur la rétine de l’absorption de l’énergie radiative par les mélanosomes dépendront fortement du taux de couplage de l’énergie en fonction du temps. Clairement, les tissus qui environnent les mélanosomes pourront être endommagés par différents mécanismes à partir d’une certaine exposition énergétique Hseuil (J/cm2). Ces mécanismes incluent la
dénaturation pure et simple des protéines et autres structures attribuable à une élévation de température d’au moins 10 C90–96, la vaporisation explosive du milieu cytoplasmique entourant le mélanosome (cavitation), et la
rupture des tissus par des ondes de choc acoustiques. Tous ces phénomènes peuvent en principe opérer peu importe la rapidité avec laquelle l’énergie lumineuse est délivrée, par contre le mécanisme associé au seuil de création des dommages dépendra en général de ce taux de couplage. La Figure 13 permet de comprendre ce qui explique cet état de fait. On constate que le seuil d’exposition énergétique à partir duquel chaque mécanisme peut créer des dommages varie différemment en fonction de la durée caractéristique du couplage de l’énergie, E. Le mécanisme qui le premier peut créer des dommages lorsque l’énergie augmente peut
donc changer en fonction de E.
Figure 13. Représentation schématique des seuils de dommage aux tissus en fonction du temps d’interaction. Les lignes pointillées désignent des conditions pour lesquelles les dommages sont produits pour des expositions énergétiques supérieures au seuil d’endommagement. Par exemple, pour des durées longues des dommages peuvent être générées par des bulles de cavitation, par contre ceci se produit à des expositions supérieures au seuil de dommage thermique. Inspiré de Faraggi et al.97.
La chaleur se propage à raison d’environ 1 µm/µs dans les tissus98. Pour les durées de l’ordre de la
seconde, la chaleur a le temps de se propager très loin du site d’absorption, ce qui fait que le volume de tissu subissant des dommages peut être important si l’exposition énergétique dépasse le seuil permettant une élévation de température de 10C ou plus. Ce seuil diminue lorsque le temps d’interaction est réduit, parce qu’alors moins de chaleur a le temps de diffuser pendant la durée de l’irradiation, ce qui permet une élévation plus importante et plus localisée de la température pour une dose d’énergie donnée. Réduire le temps d’interaction permet donc un meilleur confinement des dommages thermiques et nécessite moins d’énergie. Le seuil thermique diminue avec E jusqu’à un temps caractéristique Ther, en-deçà duquel il se stabilise à une
valeur constante. En effet, lorsque que l’apport d’énergie se fait significativement plus rapidement que le taux de perte associé à la diffusion de la chaleur, l’atteinte de la température d’endommagement nécessite le même budget énergétique peut importe la durée, car la déperdition de chaleur devient négligeable pendant cette durée.
Comme on le voit sur la Figure 13, pour E > Ther le seuil minimal d’exposition énergétique provoquant
des dommages correspond au seuil de création des dommages thermiques. Pour ces durées, il est possible de vaporiser le tissu mais cela nécessite plus d’énergie que le niveau suffisant à créer des dommages d’origine thermique. Comme le seuil thermique, le seuil d’endommagement par cavitation diminue avec la durée de l’interaction, sauf que pour E < Ther ce dernier continue à diminuer alors que le seuil thermique se
stabilise. Le seuil critique d’exposition énergétique devient alors déterminé par le seuil de cavitation. La vaporisation explosive du tissu nécessite une augmentation de température de plus de 100 C autour des mélanosomes. Pour E < Ther , cette augmentation peut être réalisée localement (c’est-à-dire près de la
surface des mélanosomes) avec moins d’énergie qu’il n’en faut pour générer une augmentation de température globale du tissu menant à des dommages purement thermiques. Autrement dit, des points chauds sont créés dans la cellule, c’est-à-dire des gradients de température importants mais localisés autour des mélanosomes. Ces points peuvent devenir assez chauds pour initier la vaporisation du cytoplasme alors que la température moyenne de la cellule peut demeurer sous le seuil d’endommagement thermique. On appelle ce phénomène microcavitation. L’expansion de bulles de vapeur transitoires (temps de vie typique allant de moins de 100 ns à quelques microsecondes) génère des forces mécaniques de compression et de traction au sein des tissus de la rétine, forces qui endommagent les cellules de l’EPR (Figure 14) et possiblement la choroïde et les photorécepteurs si les bulles possèdent assez d’énergie pour s’y propager. On parle alors de dommages photomécaniques. Le volume de tissu endommagé dépend de la taille maximale atteinte par les bulles de vapeur, à la fin de leur phase d’expansion. Ces questions seront traitées plus en détail aux chapitres 4 et 6.
À mesure que diminue le temps d’interaction, l’atteinte de la température de vaporisation à la surface des mélanosomes nécessite de moins en moins d’énergie, parce que la quantité de chaleur qui a le temps de quitter les mélanosomes pendant l’interaction devient de moins en moins importante. Le seuil s’abaisse jusqu’à atteindre une valeur approximativement stable pour des durées plus courtes qu’un temps caractéristique Cav.
Figure 14. Microcavitation intracellulaire induite par laser, menant à la désintégration d’une cellule d’EPR99.
Pour des durées encore plus courtes, c’est la formation d’ondes de choc supersoniques qui déterminerait le seuil de dommage. L’augmentation de température consécutive à l’absorption d’énergie lumineuse par les mélanosomes provoque l’expansion thermoélastique de ces derniers. Si cette expansion est plus rapide que la vitesse du son dans le mélanosome et son environnement, elle produit une onde de choc de manière similaire au phénomène de bang supersonique qu’un avion produit lorsqu’il dépasse la vitesse du son. Les ondes de compression et de traction associées à ce choc peuvent entraîner des déplacements importants de matière au sein des tissus, déplacements pouvant causer suffisamment de stress pour provoquer la rupture d’organites ou de membranes, compromettre certaines fonctions biologiques et éventuellement tuer les cellules. Comme pour le seuil thermique et le seuil de dommages causés par microcavitation, le seuil associé aux ondes de choc diminue avec le temps d’interaction et atteint une valeur relativement constante pour des durées plus courtes qu’un certain temps caractéristique (désigné par Choc dans la Figure 13). Pour E < Choc, l’énergie
acoustique n’a plus le temps de significativement diffuser hors du mélanosome, ce qui explique l’atteinte d’une valeur constante du seuil pour ces durées.
Bien que le schéma explicatif général présenté ici apparaisse simple, ce qui se passe réellement au niveau de l’EPR, de la rétine et de la choroïde exposés à des doses inhabituellement élevées de lumière peut
dans la réalité s’avérer beaucoup plus complexe et encore incertain. Par exemple, un doute subsiste concernant l’origine la diminution du seuil d’endommagement observée pour des durées inférieures à 1 ns. D’aucuns proposent que la microcavitation demeurerait le mécanisme de dommage dominant dans ce régime79, et que le confinement thermoélastique évoqué plus haut contribuerait à diminuer la quantité
d’énergie requise pour initier la vaporisation du cytoplasme. Les courbes schématiquement représentées à la Figure 13 illustrent d’une manière générale le principe selon lequel différents mécanismes peuvent intervenir au seuil de dommage à la rétine, le mécanisme dominant dépendant du taux de couplage de l’énergie dans le temps. En plus d’être caractérisés par différentes échelles de temps, ces mécanismes peuvent provoquer des dommages de nature, de gravité et d’étendue qui leur sont propres. D’autres phénomènes résultant de l’exposition des mélanosomes à la lumière pourraient également concourir à l’altération des cellules de l’EPR. À certaines doses et pour certaines longueurs d’onde, certains radicaux pourraient être produits, avec des conséquences phototoxiques100.
Chapitre 3
La photocoagulation classique
La photocoagulation est une technique employée depuis plusieurs décennies pour le traitement de certaines pathologies de la rétine. Elle implique d’exposer la rétine au rayonnement d’un laser pendant une durée suffisante (typiquement de 50 à 100 ms) pour provoquer une hyperthermie jusqu’à ce qu’un blanchiment soit observé au point d’incidence. Ce blanchiment résulte d’un changement de la réflectivité des tissus associé à la dénaturation des protéines consécutive à l’augmentation locale de température. La chaleur émanant des mélanosomes de L’EPR irradie à travers ce dernier, provoquant éventuellement sa destruction ainsi que celle des photorécepteurs avoisinants. La rétine interne de même que la choroïde peuvent être relativement bien préservés, pour autant que la dose ne soit pas excessive (Figure 15).
Figure 15. Vue au microscope d’une brûlure créé au laser à argon sur une rétine de lapin101. La rétine externe et
l’EPR ont été coagulés et les photorécepteurs sont absents, alors que la rétine interne est demeurée relativement intacte. RPE: épithélium pigmentaire rétinien (EPR), CC: choriocapillaires, CV: grands vaisseaux choroïdiens. Photographie prise deux semaines après l’irradiation.
Ce chapitre présente quelques éléments essentiels concernant d’importantes pathologies de la rétine pour lesquelles la photocoagulation laser constitue une option de traitement. La rationnelle et les limitations du traitement sont discutées dans le cas de conditions telles que la rétinopathie diabétique, l’œdème maculaire d’origine diabétique, la dégénérescence maculaire liée à l’âge et la choriorétinopathie séreuse centrale. Un bref survol des technologies laser employées pour la photocoagulation est également effectué.
Rétinopathies
Le vieillissement de la population conjugué à une progression épidémique des cas de diabète à travers le monde sont à l’origine d’une forte tendance à la hausse de l’incidence et de la prévalence des pathologies de la rétine telles la rétinopathie diabétique (RD), l’œdème maculaire diabétique (OMD) et la dégénérescence maculaire liée à l’âge (DMLA). Ces désordres peuvent réduire le champ de vision et l’acuité visuelle et éventuellement mener à une cécité complète, dû entre autres au développement anormal de néovaisseaux (néovascularisation) qui finissent par envahir, perturber puis endommager la rétine. Les nombreux mécanismes et la physiopathologie associés à ces maladies complexes ne sont pas totalement compris, notamment au niveau biomoléculaire. Dans le cas de la RD, la néovascularisation résulte du développement de foyers hypoxiques dans le tissu rétinien, lesquels fournissent un stimulus menant à une régulation positive de facteurs induisant l’angiogenèse, tels le facteur de croissance endothélial vasculaire (VEGF) et les angiopoïétines (Ang1, Ang2). L’induction de facteurs angiogéniques conduit à une prolifération de cellules endothéliales et ultimement à la formation de néovaisseaux.
Rétinopathie diabétique
Des taux anormalement élevés de sucre dans le sang favorisent l’augmentation de la perméabilité des vaisseaux sanguins, notamment des capillaires rétiniens. Les capillaires se détériorent progressivement, ce qui provoque des hémorragies et des exsudats. Il peut également y avoir occlusion de certains vaisseaux. Comme le réseau de capillaires n’accomplit plus aussi bien sa fonction de transport de l’oxygène, il s’ensuit une ischémie (défaut d’oxygénation) de la rétine, laquelle peut stimuler la régulation positive des facteurs conduisant à une néovascularisation rétinienne (NVR). On distingue la rétinopathie diabétique non proliférative (RDNP) et la rétinopathie diabétique proliférative (RDP, Figure 16). Dans la première, les vaisseaux sanguins existants sont atteints (hémorragies, micro-anévrismes) alors que dans la seconde, il y a colonisation de la rétine et du corps vitré par des néo-vaisseaux peu fonctionnels et également sujets à des hémorragies (NVR). Lorsque la macula est atteinte, les conséquences sur l’acuité visuelle au centre du champ de vision peuvent être graves (Figure 17). Dans environ la moitié des cas de RD, il y a accumulation d’œdème maculaire, on parle alors d’œdème maculaire diabétique (OMD). Au Canada, on estime qu’environ 2,5 % des 2,4 millions de Canadiens diabétiques, soit près de 60 000 personnes, vivent avec une perte de vision causée par l’OMD, ce qui en fait l’une des principales causes de perte de vision chez les adultes102.
Figure 16. Illustration des problèmes vasculaires associés à la rétinopathie diabétique103 .
Figure 17. Simulation montrant la même scène perçue avec une vision normale (image de gauche), avec la rétinopathie diabétique à un stade avancé (image du centre) et avec de l’oedème maculaire (image de gauche)104.
Depuis des décennies, la photocoagulation de la rétine demeure une approche privilégiée pour traiter la rétinopathie diabétique. Dans le cas de la RDP, la procédure employée se nomme photocoagulation panrétinienne (PPR). Elle consiste à créer de 1000 à 2000 brûlures (diamètre approximatif = 500 µm) au laser dans la région périphérique de la rétine (Figure 18). Le laser est injecté par voir transpupillaire. Ce traitement peut permettre de freiner la prolifération des néovaisseaux de manière durable105 mais, en contrepartie, il
implique de sacrifier des photorécepteurs dans le champ périphérique, avec pour conséquence inéluctable une diminution de la fonction visuelle. Des douleurs transitoires peuvent être ressenties pendant l’application du laser. L’apparition d’œdème maculaire consécutive au traitement figure également dans la liste des effets secondaires possibles de la PPR, au même titre qu’une sensibilité accrue à l’éblouissement106 ainsi qu’un
Figure 18. Photocoagulation panrétinienne (PPR) pour le traitement de la RD112.
Dans les cas d’OMD, le fluide s’accumulant dans la macula provient soit de micro-anévrismes, soit de la diffusion à travers les capillaires rétiniens. Les micro-anévrismes peuvent être traités avec un laser focalisé (Figure 19), tandis que dans le cas de l’accumulation de fluide par diffusion à travers les capillaires on recourt à l’application d’une grille de brûlures (Figure 20) disposée de manière à permettre la préservation de la fovéa106. Ces brûlures ont un diamètre habituellement compris entre 50 et 200 µm113. Les effets secondaires
incluent l’apparition de petits points noirs dans la région centrale du champ de vision de même qu’une diminution de la perception des couleurs106.
Figure 19. Traitement de l’œdème maculaire avec un laser focalisé. L’angiographie montre une zone présentant des fuites provenant de vaisseaux anormaux (flèche sur l’image de gauche). Les brûlures au laser (représentées par les cercles sur la figure de droite) sont appliquées dans la région en question106.
Figure 20. Dans le cas de fuites diffuses dans la region de la macula (flèches sur l’image de gauche), on procède à l’application d’une grille de brûlures (image de droite)106.
Bien que la compréhension de l’origine de ses effets thérapeutiques pour le traitement de la RD demeure incomplète, les effets anatomiques de la photocoagulation ont été assez bien caractérisés, notamment au niveau de la perte de photorécepteurs et du renouvellement de l’EPR114–116 aux sites des lésions laser. On a
longtemps supposé101 que le remplacement de photorécepteurs par des cellules gliales pauvres en
mitochondries faciliterait la diffusion de l’oxygène en provenance de la choroïde sous-jacente vers la rétine interne, y augmentant du coup la tension d’oxygène101. Ultimement, cet accroissement du transport de
l’oxygène couplé à une demande métabolique réduite permettrait de limiter l’hypoxie et donc la production des facteurs de croissance vasculaire. Cette hypothèse tient par contre de moins en moins la route, au regard des résultats positifs obtenus ces dernières années avec des régimes d’irradiation n’induisant pas de dommages visibles à la rétine neurale116,117. Une théorie de plus en plus populaire associe l’efficacité du traitement à son
effet sur l’EPR, et questionne, sinon réfute, la nécessité de sacrifier la rétine neurale118.
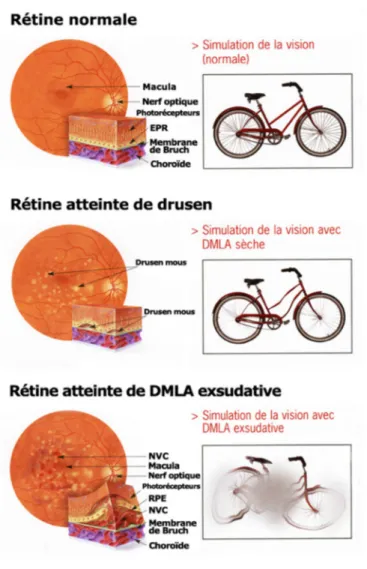
Dégénérescence maculaire liée à l’âge (DMLA)
La dégénérescence maculaire liée à l’âge (DMLA) est à l’origine de 8.7% de tous les cas de cécité à travers le monde et représente la cause la plus fréquente de cécité dans les pays développés, particulièrement chez les gens âgés de plus de 60 ans119. Sa prévalence devrait augmenter dans les prochaines années à cause du
vieillissement de la population. Le désordre survient en fait sous la rétine (Figure 21), dans la région centrale (macula), qui finit par être endommagée soit par l’accumulation de débris cellulaires jaunâtres appelés druses (forme atrophique, ou « sèche », qui représente 80-90% des cas) causant l’atrophie de l’EPR et la perte de cellules photoréceptrices, soit par la prolifération anormale de néovaisseaux choroïdiens (forme exsudative
"humide", représentant 10-20 % des cas mais 80-90 % des cas de cécité) accompagnées de saignements causant également des dommages irréversibles aux cellules photoréceptrices. La forme humide est la plus sévère et peut constituer une évolution de la forme sèche.
Figure 21. Illustration des désordres rétiniens associés aux deux formes de DMLA et de leurs effets sur la vision120.
Bien que certains facteurs de risque aient été identifiés121, on sait bien peu de choses à propos des
causes précises de la DMLA, qui seraient multifactorielles et polygéniques122. Il est plausible qu’une altération
progressive des fonctions de l’EPR avec l’âge contribue à la pathogénèse de cette condition. Cette altération proviendrait d’une augmentation du stress oxydatif causée par une réduction des mécanismes protecteurs et/ou d’une augmentation de la concentration d’espèces réactives phototoxiques123–125. L’accumulation de
lipofuscine126–128 serait l’un des premiers indicateurs d’une cascade d’événements associés à l’évolution de la
préservation de la couche épithéliale129–131. Cette réduction pourrait être le résultat d’une apoptose déclenchée
suite à l’accumulation de substances toxiques. La phagocytose des segments externes riches en lipides et en protéines oxydés est à l’origine d’un stress oxydatif constant pour l’EPR, stress qui à la longue finirait par l’empoisonner. Les cellules restantes seraient ainsi amenées à phagocyter davantage de segments externes pour compenser, ce qui du coup augmenterait leur stress oxydatif et accélèrerait leur perte, dans un cercle vicieux conduisant éventuellement à l’atrophie de vastes portions d’EPR123,124,132. Par rapport aux autres
parties de la rétine, la macula serait davantage affectée par ce processus à cause d’une plus grande activité phagocytaire124,125,133 possiblement attribuable à des taux d’absorption de photons plus importants132,134. Par
ailleurs, la décroissance après 70 ans135 des niveaux de -tocophérol (vitamine E), l’un des plus importants
antioxydants, exacerberait les effets de la pression oxydative sur l’EPR. À cela s’ajoute des changements touchant la pigmentation, tel que discuté au chapitre 2, notamment une réduction du nombre de mélanosomes par cellule, une augmentation du nombre de granules de lipofuscine23,69,74,76 et l’apparition de complexes
granules-mélano-lysosomes et mélano-lipofuscine69,76,77 résultant respectivement d’une dégradation de la
mélanine et d’une accumulation de lipofuscine dans les mélanosomes77. Ces modifications sont de nature à
réduire l’efficacité du rôle de photoprotection des mélanosomes et à perturber leur implication dans la phagocytose des segments externes (voir chapitre 2).
La lipofuscine contient plusieurs composantes issues de la dégradation incomplète de phagosomes dans le cycle de renouvellement des photorécepteurs, composantes susceptible de générer un stress oxydatif. Ceci inclut certains fluorophores comme le pyridinium bis-retinoid (A2E). Il a été démontré que l’irradiation d’A2E par de la lumière bleue ou ultraviolette peut mener à la formation d’espèces réactives d’oxygène et de peroxyde d’hydrogène causant un stress oxydatif susceptible de créer des dommages à l’EPR91,136–146.
L’augmentation de la concentration en espèces réactives d’oxygène déstabilise les lysosomes et les mitochondries, provoquant du coup une diminution de l’efficacité métabolique, ce qui conduit à une production accrue de lipofuscine et d’espèces réactives d’oxygène. Il y donc un effet boule de neige. L’importance de la phototoxicité d’A2E en tant que mécanisme générateur d’espèces réactives d’oxygène conduisant au développement de la DMLA chez l’humain n’a toutefois pas été entièrement démontrée21,147,148. D’autres
composantes de la lipofuscine joueraient un rôle prépondérant dans la production de ces espèces par voie photo-induite149,150. Des voies toxiques impliquant A2E sans exposition à la lumière pourraient par ailleurs
contribuer à la pathogénèse de la DMLA140,141,151. Par exemple, A2E peu inhiber la digestion complète par
l’EPR des phospholipides des segments externes à l’intérieur d’un délai de 24 heures151. Comme la
phagocytose des segments externes s’effectue selon un rythme circadien (voir chapitre 1), ce processus conduirait à l’accumulation de phospholipides non dégradés, source d’espèces réactives d’oxygène et de