UNIVERSITÉ MOHAMMED V FACULTÉ DES SCIENCES Rabat N° d’ordre : 2834 D7
Thèse de Doctorat
Présentée parMohamed TRICHA
Discipline : PhysiqueSpécialité : Mécanique des Fluides Sur le Thème :
MODELISATIONS ANALYTIQUE ET NUMERIQUE DE LA DISPERSION DE PARTICULES DANS UN ECOULEMENT SANGUIN EN CONDUITE
ELASTIQUE.
APPLICATION AU RESEAU CARDIOVASCULAIRE
Soutenue le 16 janvier 2016, devant le jury composé de :
Président :
Gamal ZEGGWAGH PES à la Faculté des Sciences de Rabat
Examinateurs :
Mohammed Ouadi BENSALAH PES à la Faculté des Sciences de Rabat Kamal GUERAOUI PES à la Faculté des Sciences de Rabat Ahmed MZERD PES à la Faculté des sciences de Rabat Bennasser BAHRAR PES à l’ENSET de Mohammedia
Abderrahim SAMAOUALI PES à la Faculté des Sciences de Rabat
À
SA MAJESTÉ LE ROI
MOHAMMED VI
Chef Suprême et Chef d’État-major Général
des Forces Armées Royales.
À
SON ALTESSE ROYALE
LE PRINCE HÉRITIER
MOULAY EL HASSAN
Que Dieu le garde
À
Monsieur le Général de Corps d’Armée
Bouchaib ARROUB
Inspecteur Général des Forces Armées Royales
et Commandant la Zone Sud.
En témoignage de notre grand respect
et notre profonde considération.
À
Monsieur le Médecin Général de Brigade
Abdelkarim MAHMOUDI
Professeur de Réanimation.
Inspecteur du Service de Santé des Forces Armées Royales.
En témoignage de notre grand respect
À
Monsieur le Médecin Colonel Major
HDA ABDELHAMID
Professeur de Cardiologie.
Directeur de l’HMIMV–Rabat.
En témoignage de notre grand respect
À
Monsieur le Médecin Colonel
MUSTAPHA ELABBASSI
Spécialiste en Médecine Physique et Réadaptation.
Chef de service de Médecine Physique et Réadaptation.
l’HMIMV–Rabat.
En témoignage de notre grand respect
et de notre profonde considération
À notre Maître
Monsieur le Professeur Abderrahim DOUDOUH
PES à la Faculté de Médecine de Rabat
Vous avez été, tout au long de ce travail, un guide dont les qualités scientifiques
et humaines, n’ont d’égal que votre disponibilité.
À
notre Maître le Professeur Saïd AMZAZI
Président de l'Université Mohammed V
À
Notre Maître le Professeur Mourad EL BELKACEMI
Doyen de La Faculté des Sciences Rabat
À
notre Maître le Professeur Mohamed LFERDE
Directeur du Centre d'Études Doctorales "Sciences et Technologies"
Faculté des Sciences-Université Mohammed V
Vous avez été, tout au long de ce travail, un guide dont les qualités
scientifiques et humaines, n’ont d’égal que votre disponibilité.
À
Mes chères consœurs et chers confrères du Service
de Médecine physique et réadaptation.
À ceux qui me sont chers
À ceux qui ont toujours cru en moi
À ceux qui m’ont toujours encouragé
À
mon très cher père
Ahmed TRICHA
Ce modeste travail est le fruit de tant de sacrifices
déployés pour notre éducation.
Vous avez toujours souhaité le meilleur pour nous.
Vous avez fourni beaucoup d’efforts aussi bien
physiques que moraux à notre égard.
Vous n’avez jamais cessé de nous encourager et de
prier pour nous.
C’est grâce à vos préceptes que nous avions appris à
compter sur nous-mêmes.
Vous méritez sans conteste qu’on vous décerne le
prix «Père Exemplaire».
Père, je vous aime et j’implore le Tout Puissant pour
qu’il vous accorde une bonne santé et une vie heureuse.
À
ma très chère mère
Halima ZOUINE
Affable, honorable, aimable, tu représentes pour moi le
symbole de la bonté par excellence, la source de tendresse et
l’exemple de dévouement, qui n’a pas cessé de m’encourager et
de prier pour moi.
Ta prière et ta bénédiction m’ont été d’un grand secours
pour mener à bien mes études.
Aucune dédicace ne saurait être assez éloquente pour
exprimer ce que tu mérites pour tous les sacrifices que tu n’as
cessés de me donner depuis ma naissance, durant mon enfance
et même à l’âge adulte.
Tu as fait plus que ce qu’une mère puisse faire pour que
ses enfants suivent le bon chemin dans leur vie et leurs études.
Je te dédie ce travail en témoignage de mon profond
amour. Puisse Dieu, le tout puissant, te préserver et t’accorder
santé, longue vie et bonheur.
À
Ma chère épouse Lousana ABDELHAQ
et
à ma petite princesse Loujine
Merci mon épouse pour tes mots doux, pour ton sourire,
pour ta bonne humeur, pour ta grande patience avec moi, pour
ton écoute et pour la confiance que tu me portes…
L’amour que je te porte est sans égal, tes conseils et ton
amour m’ont soutenu tout au long de mes études, et tes
encouragements ont été pour moi d’un grand réconfort.
Tu es mon ange gardien et mon fidèle compagnon dans les
moments les plus délicats de cette vie mystérieuse.
Je vous dédie ce travail avec tous mes vœux de bonheur, de
santé et de réussite.
À
mes chères sœurs Loubna, Rajae et Meryem
ainsi qu’à vos époux
mes frères Rabie, Younes et Achraf
ainsi qu’à vos épouses
Pour votre soutien et vos encouragements durant toutes mes
années d’études.
Puisse ce travail être le témoignage de ma gratitude et de
mon amour pour vous tous.
Je prie Dieu le tout puissant pour qu’il vous donne bonheur
et prospérité.
Je vous aime.
À
mes nièces Hafsa, Ines, Ghita, et Rim
mes neveux Adam et Iwan.
À
Mes chers beaux parents Ousaifa et Mustapha
Que Dieu vous accorde santé et longue vie
Mes Beaux frères Oussama et Iyad.
Ma belle-sœur Imane.
Leurs enfants Sherine, Nayel, Amira, et Yazan
Pour vous mon cher cousin
Monsieur le Wali Hadj Mohamed TRICHA
Pour votre épouse
Hadja Houria.
Et pour vos enfants
Hind, Hafsa, Otmane et Ali
Aucune dédicace ne peut exprimer l’estime
que je réserve pour vous dans mon cœur.
Votre encouragement est d’une grande utilité
pour moi.
Permettez-moi de vous témoigner ma grande
admiration, mon estime et mon affection.
REMERCIEMENTS
À notre Maître et Président de thèse
Monsieur le Professeur Gamal ZEGGWAGH
PES à la Faculté des Sciences de Rabat
Nous sommes très sensibles à l'honneur que vous nous faites en acceptant
la présidence de notre jury de thèse.
Votre culture scientifique, votre compétence et vos qualités humaines ont
suscité en nous une grande admiration, et sont pour vos élèves un exemple à
suivre.
Durant notre formation, nous avons eu le privilège de bénéficier de votre
enseignement et d'apprécier votre sens professionnel.
Veuillez accepter, cher Maître, l'assurance de notre estime et notre
profond respect.
À notre Maître et juge de thèse
Monsieur le Professeur Ahmed MZERD
PES à la Faculté des sciences de Rabat
Nous avons eu le privilège de travailler parmi votre équipe et d'apprécier
vos qualités et vos valeurs.
Votre sérieux, votre compétence et votre sens du devoir nous ont
énormément marqués.
Veuillez trouver ici l'expression de notre respectueuse considération et
notre profonde admiration pour toutes vos qualités scientifiques et humaines.
Ce travail est pour nous l'occasion de vous témoigner notre profonde
gratitude.
À notre Maître et juge de thèse
Monsieur le Professeur Kamal GUERAOUI
PES à la Faculté des Sciences de Rabat
Vous nous faites l’honneur d’accepter avec une très grande amabilité de
siéger parmi notre jury de thèse.
Veuillez accepter ce travail Maître, en gage de notre grand respect et de
notre profonde reconnaissance.
À notre Maître et juge de thèse
Monsieur le Professeur Bennasser BAHRAR
PES à l’ENSET de Mohammedia
Nous avons le privilège et l'honneur de vous avoir parmi les membres de notre
jury.
Veuillez accepter nos remerciements et notre admiration pour vos
qualités d'enseignant et votre compétence.
À notre Maître et juge de thèse
Monsieur le Professeur Mohammed Ouadi BENSALAH
PES à la Faculté des Sciences de Rabat
Vous nous faites l’honneur d’accepter avec une très grande amabilité de
siéger parmi notre jury de thèse. Veuillez accepter ce travail Maître, en gage
de notre grand respect et notre profonde reconnaissance.
À notre Maître et juge de thèse
Monsieur le Professeur Abderrahim SAMAOUALI
PES à la Faculté des Sciences de Rabat
Vous nous avez fait le grand honneur d’accepter de siéger parmi le jury
de cette thèse.
Merci pour votre générosité, soyez assuré de notre sincère gratitude.
2 Table des matières
Liste des figures ... 4 Résumé ... 6 Abstract ... 7 Liste des publications ... 8 Introduction générale ... 9 Chapitre 1 : Généralités ... 15 I. Introduction ... 16 II. L'appareil circulatoire ... 16 1. Le sang - Composition et fonctions ... 16
a. Caractères généraux du sang ... 16 b. Composition du sang ... 18
2. Les éléments figurés du sang et leurs rôles ... 18 III. La paroi vasculaire ... 21
1. Architecture de base d’un vaisseau sanguin ... 21
2. L’intima ... 22 3. La média ... 23 4. L’adventice ... 24 5. L’innervation ... 25 6. Structure des différents vaisseaux ... 25 7. Les artères ... 26 8. Les artérioles ... 28 9. Les veines et veinules ... 28 10. Les capillaires ... 29 IV. Modélisation rhéologique du sang ... 30
1. Choix des modèles rhéologiques ... 30 2. Quelques modèles des lois de comportement ... 30
V. Conclusion ... 33
Chapitre II : Formulation mathématique ... 34 I. Introduction ... 35 II. Mise en équations ... 35 1- Comportement rhéologique de la paroi ... 35
3
2- Comportement rhéologique du fluide ... 36
2.1- Introduction ... 36
2.2- Équation de continuité ... 36
2.3- Équation de quantité de mouvement ... 39
3- Adimensionnalisation et simplification des équations ... 42
3.2- Adimensionnalisation de l’équation de quantité de mouvement ... 44
3.3- Système d’équations intégrales ... 47 4- Dynamique de la particule ... 48
III. Conclusion ... 50 Chapitre III : Méthode de résolution... 52 I. Introduction ... 53 II. Principe de base de la méthode des volumes finis... 53 a.Cas unidimensionnel ... 53 III. Conclusion ... 63 Chapitre IV : Résultats et discussion ... 64 I. Introduction ... 65 I. Processus de résolution ... 65 II. Teste de convergence ... 65 III. Données du programme ... 66 IV. Résultats et commentaires ... 66 1. Grandeurs globales ... 66 2. Grandeurs locales ... 72 V. Conclusion ... 78
Conclusion générale ... 79 Liste des références ... 82
4
Liste des figures
Figure 1 : Architecture des vaisseaux Figure 2 : Représentation schématique de la structure en coupe transversale de la paroi de vaisseaux
Figure 3 : Fluide plastique (Bingham) Figure 4 : Géométrie de la conduite
Figure 5 : Schéma de maillage d’un élément de volume de contrôle en 1D Figure 6 : Schéma de maillage d’un élément de volume de contrôle en 2D
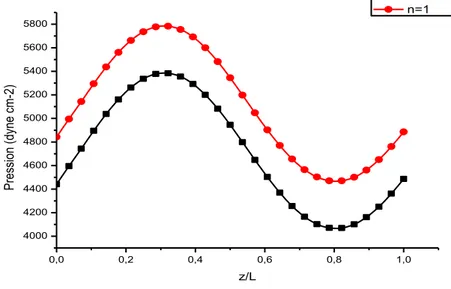
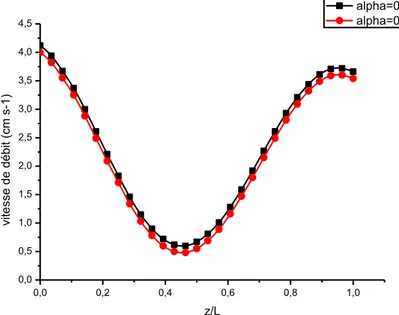
Figure 7 : Profils de la pression en fonction de la variable axiale, z/L, à l’instant T/2 pour deux valeurs de l’indice de comportement du fluide, n
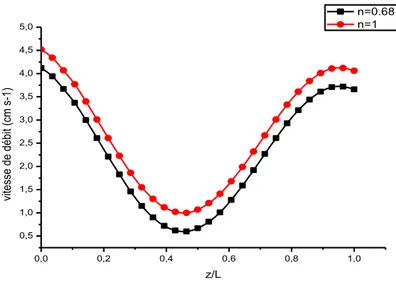
Figure 8 : Profils de la vitesse de débit en fonction de la variable axiale, z/L, à l’instant T/2 pour deux valeurs de l’indice de comportement du fluide, n
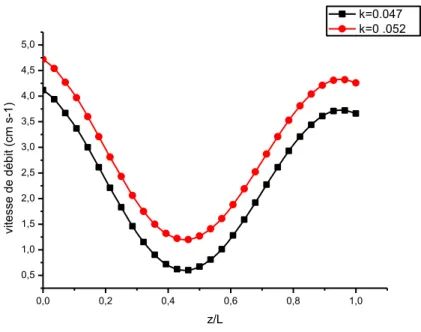
Figure 9 : Profils de la pression en fonction de la variable axiale, z/L, à l’instant T/2 pour deux valeurs de la consistance du fluide, K
Figure 10 : Profils de la vitesse de débit en fonction de la variable axiale, z/L, à l’instant T/2 pour deux valeurs de la consistance du fluide, K
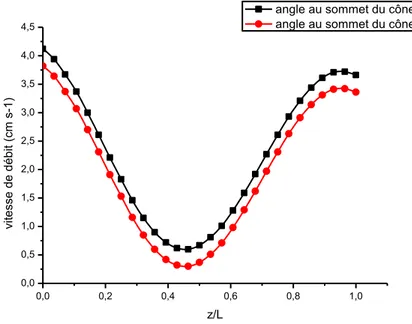
Figure 11 : Profils de la pression en fonction de la variable axiale, z/L, à l’instant T/2 pour deux valeurs de l’angle au sommet du cône, Ψ
Figure 12 : Profils de la vitesse de débit en fonction de la variable axiale, z/L, à l’instant T/2 pour deux valeurs de l’angle au sommet du cône, Ψ
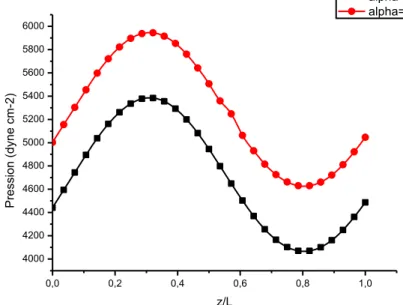
Figure 13 : Profils de la pression en fonction de la variable axiale, z/L, à l’instant T/2 pour deux valeurs du coefficient d’élasticité de la paroi, α
Figure 14 : Profils de la vitesse de débit en fonction de la variable axiale, z/L, à l’instant T/2 pour deux valeurs du coefficient d’élasticité de la paroi, α
Figure 15 : Profils de la vitesse axiale en fonction de la variable radiale, r/R, à l’instant T/2 pour deux valeurs de l’indice de comportement du fluide, n
5
Figure 16 : Profils de la vitesse radiale en fonction de la variable radiale, r/R, à l’instant T/2 pour deux valeurs de l’indice de comportement du fluide, n
Figure 17 : Profils de la vitesse axiale en fonction de la variable radiale, r/R, à l’instant T/2 pour deux valeurs de la consistance du fluide, K
Figure 18 : Profils de la vitesse radiale en fonction de la variable radiale, r/R, à l’instant T/2 pour deux valeurs de la consistance du fluide, K
Figure 19 : Profils de la vitesse axiale en fonction de la variable radiale, r/R, à l’instant T/2 pour deux valeurs de l’angle au sommet du cône, Ψ
Figure 20 : Profils de la vitesse radiale en fonction de la variable radiale, r/R, à l’instant T/2 pour deux valeurs de l’angle au sommet du cône, Ψ
Figure 21 : Profils de la vitesse axiale en fonction de la variable radiale, r/R, à l’instant T/2 pour deux valeurs du coefficient d’élasticité de la paroi, α
Figure 22 : Profils de la vitesse radiale en fonction de la variable radiale, r/R, à l’instant T/2 pour deux valeurs du coefficient d’élasticité de la paroi, α
6
Résumé
Le but principal du présent travail est de mettre en évidence le rôle du comportement rhéologique du sang et de la paroi artérielle sur les écoulements sanguins au niveau de la microcirculation, grâce à l’étude d’écoulements pulsés de fluides d’Ostwald en conduites élastiques à paroi mince.
L’approche du phénomène s’effectue par voie analytique et numérique. Il s’agit d’établir un code numérique, à l’aide du langage Fortran, qui permet d’analyser les écoulements sanguins en conduites souples en tenant compte simultanément du comportement non-newtonien du fluide, des termes d’inertie, des caractères pulsés et bidimensionnel de l’écoulement, de la dispersion des particules et du caractère élastique de la paroi de la conduite.
Mots clés :
Fluide d’Ostwald - paroi élastique - dispersion des particules - méthode des volumes finis - méthode de Runge-Kutta
7
Abstract
The main purpose of this work is to highlight the role of rheological properties of blood and the arterial wall on the blood flow in the microcirculation, through the study of pulsed law of an Ostwald fluid through elastic pipes with thin wall.
The approach of the phenomenon is made using analytical and numerical way. This is to establish a numerical code, using the FORTRAN language, which can analyze blood flow in flexible pipes by recognizing simultaneously the non-Newtonian behavior of the fluid, terms of inertia, pulsed and two-dimensional flow, and the dispersion of the particles and the elastic nature of the wall of the pipe.
Keywords :
Ostwald fluid - elastic wall - particle dispersion - finite volume method - Runge -Kutta method
8
Liste des publications
1.
Mohamed Tricha, Kamal Gueraoui, Gamal Zeggwagh, Ahmed Mzerd
New Numerical and Theoretical Approaches to Study the Blood Flows at Microcirculation Level. International Review of Mechanical Engineering (IREME), Vol. 8, N° 6, pp. 1043-1046, November 2014
DOI: http://dx.doi.org/10.15866/ireme.v8i6.2725
2.
M. Tricha, K. Gueraoui, A. Elbouzidi, B. Bahrar, A. Mzerd, G. Zeggwagh Two-phase pulsed flow of a non Newtonian fluid in pipe with elastic wall . Applied Mathematical Sciences, vol. 9, 2015, no. 24, 1189-1200 http://dx.doi.org/10.12988/ams.2015.411986
3.
M. Tricha, K. Gueraoui, A. Elbouzidi, B. Bahrar, A. Mzerd, G. Zeggwagh
Analytical and numerical modeling of the dispersion of particles in blood flow through elastic pipe. Soumis à International Review of Mechanical Engineering (IREME)
9
Introduction générale
10
Ces dernières années, de nombreuses études concernant des problèmes réels à l’écoulement du sang ont été menées.
L’écoulement du sang a intéressé de nombreux chercheurs, la grande majorité des travaux relatifs aux écoulements des fluides en conduites déformables a eu pour but de le modéliser en différents sites du réseau vasculaire. Il s’avère que l’étude du comportement sanguin en conduites implique la séparation du domaine d’investigation au préalable en trois grands domaines physiques : la macrocirculation, la microcirculation et la micro polarité [13].
En macrocirculation, les écoulements sanguins étudiés ont lieu dans les gros vaisseaux (aorte par exemple) où les effets dû aux régimes pulsés et au caractère élastique de la paroi jouent un rôle essentiel sur l’écoulement, dans les vaisseaux de taille moyenne (artères et veines), le comportement rhéologique du sang a une influence non négligeable [11].
En microcirculation (artérioles, capillaires et veinules), l’aspect diphasique de l’écoulement et les propriétés de filtration de la paroi ainsi que son caractère viscoélastique doivent être pris en compte pour une modélisation convenable.
La modélisation de l’écoulement du sang, bien que tenant compte souvent d’hypothèses simplificatrices, conduit à des équations très complexes. Ces complexités peuvent provenir d’une part, de la loi de comportement du fluide étudié ainsi que de son type d’écoulement (permanent, oscillatoire ou pulsé) et d’autre part, de la nature de la paroi artérielle (rigide, élastique ou viscoélastique, ou encore imperméable ou poreuse) [9].
Un grand nombre de travaux théoriques et expérimentaux montrent que le comportement rhéologique du sang obéit soit à la loi de Newton, soit à des lois non-newtoniennes du type Casson, Ostwald, ou Quemada, par exemple, suivant
11
la gamme des gradients de vitesse considérée et la taille des vaisseaux. Notons aussi, que le caractère non-newtonien intervient dans la grande circulation de manière marquée dans le système veineux, et de manière moins sensible dans la grande circulation artérielle [9], [12].
Au niveau de la grande et la petite circulation, le caractère non permanent de l'écoulement est à prendre en compte pour une modélisation plus fine de ce dernier. On considère, en général, le cas où la pression se propage le long du vaisseau sanguin sous forme d'onde progressive. Ce type de propagation stipule que l'onde ne subit pas de réflexion et se retrouve totalement amortie à l'infini aval [2].
L'objet du présent travail consiste à modéliser l’écoulement du sang grâce à l'étude d'écoulements non permanents de fluides à comportement non-Newtonien en conduites souples. L’approche du travail s'effectue par voie théorique. Notons toutefois, qu'il ne concerne que la modélisation d'écoulements sanguins au niveau de la grande et de la petite circulation; par contre, au niveau de la microcirculation capillaire, où le diamètre du vaisseau peut être inférieur à celui du globule rouge, l'écoulement est essentiellement fonction de la rhéologie
de ce dernier [9], [12]. . Les premières études relatives aux modélisations des écoulements sanguins
en hémodynamique telles que celle de Womersley [5] et Lambossy [6] ont concerné la résolution de systèmes des équations linéarisés. Mais, l'importance des termes convectifs d'accélération, notamment en macrocirculation où les valeurs prises par les nombres de Reynolds des écoulements sont importants, a conduit à l'élaboration des théories non linéaires. Dans le cadre de l'unidimensionnalité des écoulements; ceux-ci sont régis par un système d'équations intégrales faisant intervenir les grandeurs globales de l'écoulement : la pression, la section et le débit [4]. .
12
Les différentes approches de résolution de ces équations non linéaires sont basées sur des hypothèses simplificatrices, souvent arbitraires, portant soit sur les termes convectifs soit sur l'évaluation de la contrainte pariétale de l'écoulement [9]. . En 1993, Streeter et Coll, [7] supposent une répartition de vitesses uniforme dans toute section de la conduite et proposent un facteur de correction de débit égal à l'unité. Cette approximation a été largement utilisée par la suite, bien qu'elle ne prenne pas en compte les effets de viscosité du fluide qui sont justifiés
par l'observation de profils de vitesses quasi-plats pour les écoulements artériels. Une autre approche, consiste à considérer le facteur de correction du débit égal à
4/3. Cette valeur, n'est valable que pour un écoulement permanent en conduite rigide et circulaire. Bien qu'elle tienne compte des effets de viscosité du fluide, elle n'est en toute rigueur valable que pour des écoulements à profils de vitesses paraboliques. La contrainte pariétale de l'écoulement, quant à elle, est généralement déduite de la loi de Poiseuille. Zagzoule et coll [8]; en privilégiant les termes instationnaires dans les équations, établissent à partir de développements asymptotiques une expression de cette grandeur tenant compte aussi bien de l'instationnarité de l'écoulement que de la déformabilité des parois du conduit.
Kerroum et coll [9] ont étendu ce résultat aux écoulements diphasiques rencontrés en microcirculation.
Une autre approche de résolution, est celle développée par Ling et Atabek [10] qui, pour résoudre le système des équations locales, introduisent sans justification une hypothèse portant sur le profil de vitesses afin d'évaluer certains termes dans ces équations. Ils proposent alors la détermination des vitesses axiales et radiales mais uniquement dans une section du tube où la pression et le gradient de pression sont connus. La justification des hypothèses introduites est
13
faite à posteriori et se base sur la confrontation entre les résultats théoriques obtenus et l'expérience.
Une dernière approche, qui bien que nécessitant d'importants moyens de calculs ne fait pas intervenir d'hypothèses à priori sur les solutions est une approche itérative du type de celle utilisée par Buthaud [11]. Cette méthode de résolution numérique consiste à se donner un profil de vitesse initial, qui permet de démarrer les calculs; les équations sont alors résolues, en couplant le système des équations locales au système des équations intégrales; au terme de chaque itération, les grandeurs initiales sont corrigées jusqu'à convergence du processus.
Dans le premier chapitre de ce travail, il nous a paru utile de rappeler quelques données sur l’appareil circulatoire et de faire une présentation générale des différentes lois régissant le comportement rhéologique aussi bien du fluide que de la paroi.
Dans le deuxième chapitre, nous présentons la formulation mathématique de note problème en introduisant le modèle adapté à l’écoulement non permanent et pulsé d’un fluide incompressible non newtonien obéissant à la loi puissance d’Ostwald.
La mise en équations de notre problème met en évidence deux types de systèmes : le système des équations locales et le système des équations intégrales.
Les systèmes des équations locales et intégrales précédemment obtenus sont alors résolus, dans le troisième chapitre, par la méthode numérique des volumes finis. Les équations sont discrétisées à l’aide de cette méthode et les calculs sont amorcés à l’aide d’un profil initial vérifiant les conditions aux limites.
14
Les résultats et leurs interprétations sont présentés dans le quatrième chapitre.
15
Chapitre 1 : Généralités
16
I. Introduction
Dans le but d’établir un modèle permettant de comprendre et de définir les facteurs essentiels influençant l’écoulement sanguin dans une artère, il faut tenir compte du caractère non-newtonien du sang, qui est essentiellement rhéofluidifiant.
De nombreuses études ont été effectuées sur l’écoulement sanguin dans le système artériel, avec des données physiologiques et pathologiques, dans le but de trouver des réponses à des maladies et complications cardiovasculaires. Divers travaux consacrés à l’analyse du sang, liés à la recherche d’un modèle rhéologique, montrent que la suspension sanguine obéit à des lois non- newtoniennes et peut présenter une contrainte seuil [12].
II.
L'appareil circulatoireL’appareil circulatoire est composé du cœur, des vaisseaux sanguins et du sang. Il permet d’irriguer tous les organes de notre corps et apporte, par l’intermédiaire du sang, l’oxygène à toutes nos cellules [13].
1. Le sang - Composition et fonctions
a. Caractères généraux du sang- C'est un liquide qui circule dans un système clos. Un homme de 70 kg a environ 5 à 6 litres de sang (≈ 8 % du poids de son corps).
- C’est le seul tissu liquide de l’organisme. Il est dépourvu de fibres élastiques et collagènes, mais renferme des protéines dissoutes.
- C’est un liquide visqueux et opaque, au goût métallique et salé. D’un rouge écarlate s’il est riche en oxygène, ou rouge sombre dans le cas où il est pauvre en oxygène. Son pH est légèrement alcalin (entre 7,35 et 7,45). Sa température est de 38°C.
17
Le sang est constitué :
d’un liquide : le plasma.
d’éléments figurés : les globules rouges, les globules blancs, les plaquettes sanguines.
Les fonctions du sang : Le Transport
Rôle nutritif : transport et répartition des éléments nutritifs issus de la digestion vers les cellules.
Rôle respiratoire : fixation et transport de l'O2 et du CO2 par les hématies. C'est
l'intermédiaire entre les poumons et les tissus.
Rôle d'épuration : tous les déchets résultant du métabolisme des cellules sont rejetés dans le sang et la lymphe pour y être amenés au niveau des organes excréteurs chargés de leurs élimination (hors de l’organisme)
Rôle hormonal : transport des hormones des glandes endocrines aux organes cibles [14].
La Régulation
Régulation thermique : la circulation du sang à la surface de la peau favorise la dissipation de l’excédent de température corporelle.
Régulation du pH : indispensable au bon fonctionnement des tissus
Régulation du volume de liquide : le volume de sanguin doit toujours être suffisant pour assurer l’irrigation de tout le corps [14].
18
La Protection
D’arrêt de l’écoulement sanguin est mis en place : c'est la coagulation
Prévention de l’infection : c’est grâce au transport des anticorps, des leucocytes qui défendent l’organisme contre les corps étrangers.
b. Composition du sang
À 45% solide (éléments figurés) et à 55% liquide. Le rapport partie solide sur la partie liquide représente l’hématocrite.
Le plasma :
Cette partie liquide du sang est composée de 90 % d'eau et de 10 % de substances "dissoutes" (éléments minéraux, protides, lipides, anticorps, hormones…).
Le plasma est de couleur jaunâtre et sert au transport des substances nutritives, des hormones, des anticorps, des gaz dissous et à l'évacuation des déchets. Toute modification de la composition du plasma entraîne de graves troubles de la santé [14].
2. Les éléments figurés du sang et leurs rôles
a. Les globules rouges ou érythrocytes ou hématies
On en trouve 5 millions par mm3 de sang. Ils se présentent sous la forme de disques biconcaves (diamètre 7µm, épaisseur 2µm). Ces cellules dépourvues de noyau, contiennent de l'hémoglobine. Ce pigment rouge joue un rôle primordial dans le transport des gaz respiratoires :
L'oxygène forme une combinaison dissociable, l'oxyhémoglobine.
19
Le gaz carbonique forme une combinaison dissociable, la carboxyhémoglobine.
Les hématies naissent dans la moelle rouge des os (os plat du tronc, des ceintures et dans les épiphyses proximales de l’humérus et du fémur). Ils se renouvellent environ trois fois par an. Leur durée de vie est de 120 jours.
Le processus de formation de globules rouges s’appelle l’érythropoïèse. Ce mécanisme est stimulé par une hormone : l’érythropoïétine ou EPO (naturellement par les reins).
Les globules rouges sont détruits principalement dans les petits vaisseaux sanguins de la rate. Ils sont « digérés » par les phagocytes. L’un des déchets de la dégradation des globules rouges est la bilirubine [14].
b. Les plaquettes
Elles sont au nombre de 250 000 par mm3 de sang. Ce sont des fragments de cellules dépourvues de noyau (taille 3 µm). Elles sont formées dans la moelle rouge des os. Leur durée de vie n'excède pas 10 jours. Elles ont un rôle antihémorragique très important par agglutination et contribution à la formation d'un caillot [15].
c. Les globules blancs ou leucocytes
On en trouve 7 000 par mm3 de sang. Il en existe différentes catégories. Ils sont incolores (diamètre 7µm, épaisseur 2µm).
Ils sont formés dans la moelle rouge des os et jouent un rôle dans la défense de l’organisme. Leur durée de vie est limitée à quelques jours.
Ces cellules peuvent s’échapper des capillaires sanguins selon un processus appelé diapédèse pour accomplir leurs fonctions de défense [14].
20
Il en existe trois types :
i- Les polynucléaires (≈ 65%) sont des cellules dont le noyau à plusieurs lobes. Ces cellules renferment des granulations cytoplasmiques visibles au microscope optique, d’où leur appartenance au groupe des granulocytes. Ces cellules se rendent sur les lieux de l'agression microbienne pour détruire les microbes par phagocytose.
ii- Les lymphocytes (≈ 25%) sont des cellules à noyau sphérique. Ils ne renferment pas de granulations cytoplasmiques visibles au microscope optique, d’où leur appartenance au groupe des agranulocytes.
iii- Les monocytes (≈ 10%) sont des cellules à noyau non sphérique. Ils ne renferment pas de granulations cytoplasmiques visibles au microscope optique, d’où leur appartenance au groupe des agranulocytes [15].
d. Coagulation du sang et hémostase
Le sang reste normalement fluide à l’intérieur des vaisseaux sanguins, mais lorsqu’il s’épanche à l’extérieur, au contact de l’air il se prend en gelée en une dizaine de minutes, on dit qu’il coagule. Ce mécanisme peut être accéléré par la vitamine K.
L’hémostase est l’ensemble des mécanismes qui assurent le maintien du sang à l’intérieur des vaisseaux sanguins, elle se déroule en trois temps :
le temps pariétal ou vasculaire consiste à une vasoconstriction des vaisseaux lésés (abîmés) afin de diminuer la fuite de sang, accompagnée d’une accumulation de plaquettes autour de la plaie afin de former un bouchon de colmatage appelé caillot blanc ou clou plaquettaire.
le temps plasmatique ou coagulation à proprement dite consiste à une activation des facteurs de coagulation contenus dans le plasma. La
21
thrombine va transformer le fibrinogène en fibrine. Cette substance fortement coagulante va former un réseau de filaments autour de la plaie qui prendra dans ses fibres les hématies, formant ainsi le caillot rouge,
le temps post-coagulation se déroule en deux actions :
la rétraction du caillot : le caillot se rétracte et laisse exsuder du sérum. Cette phase se produit en quelques heures.
la dissolution du caillot : elle survient à l’état normal au bout de 72 heures.
La coagulation sanguine est examinée de différentes façons :
par le temps de saignement : temps pendant lequel saigne un sujet après une coupure superficielle. Temps normal entre 2 et 5 minutes. par le temps de coagulation : temps d’apparition du caillot sanguin
après prélèvement du sang. Temps normal voisin de 7 minutes.
III.
La paroi vasculaireComme tous les vaisseaux de la microcirculation, la paroi artérielle est organisée en trois tuniques concentriques.
1. Architecture de base d’un vaisseau sanguin
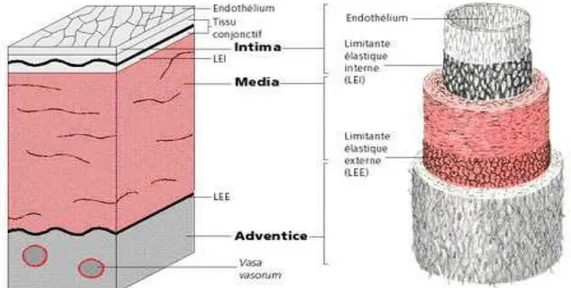
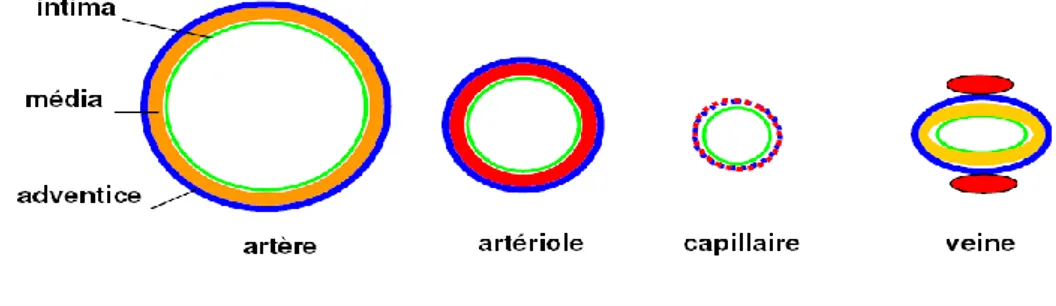
Les vaisseaux sanguins possèdent tous une architecture de base commune. Ils sont formés de trois tuniques morphologiquement distinctes, de l’intérieur vers l’extérieur du vaisseau : l’intima, la média et l’adventice (figure 1). Chacune de ces tuniques est constituée d’un type cellulaire différent et d’une matrice extracellulaire (MEC) spécifique. L’importance et la complexité de
22
ces trois tuniques dépendent du vaisseau sanguin et peuvent être très importantes ou réduites à une simple mono-couche cellulaire. Les vaisseaux, comme tous les autres organes sont vascularisés (Vasco vasorum) et innervés [15].
Figure 1 : Architecture des vaisseaux
2. L’intima
L’intima, partie la plus interne de la paroi, est principalement constituée de l’intérieur vers l’extérieur, d’une monocouche de cellules endothéliales et d’une fine couche de tissu conjonctif appelée lame basale. Quel que soit le diamètre de la paroi, il y a toujours une seule couche de cellules endothéliales. Ces cellules endothéliales sont en forme de losange et leur juxtaposition constitue une mosaïque. Leur grand axe est allongé dans le sens de l’écoulement sanguin et cette orientation est déterminée par les forces de cisaillement appliquées à leur surface.
Ces cellules endothéliales sont directement en contact avec le sang circulant et donc avec les métabolites, les hormones, les facteurs neuro humoraux, et tout ce que peut transporter le sang. Elles assurent le rôle de filtre en permettant le
23
passage sélectif de différents composants de la circulation sanguine. Ces cellules sécrètent de nombreuses substances vasodilatatrices (oxydenitrique ou NO, prostacycline, bradykinine), vasoconstrictrices (endothéline, angiotensine, thromboxane A2), antiagrégantes (prostacycline) et fibrinolytiques (activateur du plasminogène) ainsi que des facteurs de croissance [15]. Grâce à ces propriétés et à son revêtement impropre à l’adhésion plaquettaire et à la coagulation, l’endothélium constitue une barrière protectrice contre la thrombose et est au centre de la régulation du tonus vasomoteur artériel.
3. La média
La média, partie intermédiaire de la paroi est séparée de l’intima par la limitant élastique interne (LEI). C’est la partie la plus épaisse de la paroi vasculaire. Elle contient exclusivement des cellules musculaires lisses (CML) et une matrice extracellulaire constituée majoritairement d’élastine, de collagène. Les cellules musculaires lisses vasculaires sont des cellules allongées généralement fusiformes avec des extrémités pointues et parfois bifides. Les cellules sont organisées en feuillet et sont parallèles les unes aux autres, et associées entre elles par une charpente de tissu conjonctif. Elles ont un mode de contraction relativement différent des autres types de cellules musculaires (cardiaques et squelettiques). Elles sont responsables du tonus vasculaire. Elles sont également capable de remodeler en permanence les vaisseaux en proliférant et en produisant de la matrice extracellulaire. Les cellules musculaires lisses de la media ont un double rôle, contractile et sécrétoire.
Cette partie centrale de la paroi est très variable selon les différents territoires vasculaires, l’importance relative et l’organisation des éléments matriciels et cellulaires varient selon la fonction des vaisseaux. Les grosses artères sont
24
surtout formées d'éléments élastiques (artères élastiques) tandis que les artères de moyen et de petit calibre sont surtout riches en fibres musculaires (artères musculaires).
La média est la partie structurante de la paroi des vaisseaux. Elle est responsable de la fonction vasomotrice et de la fonction d’amortissement qui sont en rapport avec les propriétés élastiques de la matrice extracellulaire et de l’état de contraction des cellules musculaires lisses. Elle assure à la fois la souplesse et la résistance des vaisseaux. La média est séparée de l’adventice par la limitante élastique externe (LEE).
4. L’adventice
L’adventice, partie la plus externe de la paroi est peu ou très présente selon le type de vaisseaux. Son organisation est à peu près la même quel que soit le type de vaisseau. Cependant, dans les veines, la média et l’adventice sont souvent difficiles à distinguer. L’adventice est constitué de fibroblastes et d’un tissu conjonctif lâche, formé de fibres de collagène et de quelques fibres élastiques épaisses.
Les vaisseaux, comme tous les autres organes, sont constitués de cellules qui doivent recevoir des nutriments, de l’oxygène et rejeter des déchets. La proximité immédiate du sang circulant fait que la plupart du temps, les cellules vasculaires effectuent directement leurs échanges avec le sang circulant. Pour les vaisseaux de gros diamètre, la nutrition des cellules constituant la paroi vasculaire est assurée par le sang circulant dans le vaisseau mais aussi à partir de petits vaisseaux nourriciers de la paroi artérielle nommés vasa vasorum. L’adventice des artères est parcouru par ce système capillaire qui apporte les nutriments aux cellules les plus éloignées de la lumière du
25
vaisseau. L’adventice permet par ailleurs la fixation des vaisseaux aux tissus de voisinage.
5. L’innervation
Les vaisseaux sont innervés par des nerfs vasomoteurs qui dépendent du système nerveux végétatif et dont les afférences aboutissent à la limite de la média et de l’adventice. Les uns sont constricteurs (système sympathique), les autres dilatateurs (système parasympathique), et leur action se fait surtout au niveau des petites artères. Cette action joue sur la pression artérielle, la dilatation diminuant la pression, et la constriction l'augmentant. Selon le modèle proposé par Burnstock et coll [15], l’arborisation terminale de l’axone forme un réseau péri-vasculaire qui va faire que toute la tunique musculaire va répondre à un stimulus et non pas chaque CML individuellement [16]. Ces fibres nerveuses agissent directement sur les CML de la couche la plus externe de la média puis la transmission de l’excitation se fera de proche en proche par couplage électrique entre les cellules. La densité de l’innervation est inversement corrélée à la taille du vaisseau mais aussi à la résistance du vaisseau. Ainsi, ce sont les petites artérioles pré-capillaires qui sont les plus innervées, ce qui en fait les principales responsables de la résistance vasculaire périphérique. Si la plupart des nerfs vasomoteurs sont noradrénergiques, des terminaisons cholinergiques existent également.
6. Structure des différents vaisseaux
La répartition du sang dans l’organisme impose une structure allant des plus gros vaisseaux aux plus fins. Globalement cinq types de vaisseaux sanguins peuvent être distingués : les artères, les artérioles, les vaisseaux capillaires, les veinules et les veines. La composition à la fois en cellules aussi
26
bien qu’en matrice extracellulaire, et la présence ou non de CML varie en fonction de ces différents territoires vasculaires. Les vaisseaux pulmonaires de part leur fonction et leur localisation présentent quelques différences morphologiques avec les vaisseaux systémiques mais possèdent une structure similaire.
7. Les artères
Les artères sont les vaisseaux sanguins transportant le sang du cœur aux autres organes.
Il existe deux types d’artères : les artères élastiques, qui sont des vaisseaux de 1 à 2 cm de diamètre, très élastiques du fait de leur composition élevée en élastine (environ 40 %) et les artères musculaires, beaucoup moins élastiques (seulement 10 % d’élastine), avec un diamètre de 1 mm à 1 cm, contenant comparativement une plus grande proportion de CML arrangées de façon concentrique.
a. Les artères élastiques
Les artères de gros calibre tel que l’aorte, le tronc de l’artère pulmonaire, les artères carotides, et les artères pulmonaires principales dites artères de conduction sont plus riches en fibres élastiques. Dans les artères élastiques, la résistance à l’écoulement est faible, la média est constituée de plusieurs lames élastiques concentriques entre lesquelles se retrouvent les CML. Le nombre de ces lames élastiques est fonction du diamètre de l’artère. Les CML et les lames élastiques forment une unité lamellaire [17].
Le nombre d’unités lamellaires est proportionnel au diamètre du vaisseau. Cette organisation en structure lamellaire n’existe que dans les artères élastiques, les artères musculaires ne possédant pas cette architecture.
27
La notion d’unité lamellaire a été complétée en 1985 par celle plus précise de feuillet musculo-élastique [18]: c’est un groupe de cellules enveloppé par une matrice constituée d’une lame basale et de fibrilles de collagène, le tout enveloppé dans un tapis de fibres élastiques.
Le tronc de l’artère pulmonaire et les artères pulmonaires principales sont des artères élastiques mais ont une paroi 2 à 3 fois plus mince que les vaisseaux systémiques de même taille. Les artères pulmonaires intra-pulmonaires périphériques sont également élastiques et conservent cette structure jusqu’aux artères de 1 à 0,5 mm de diamètre. Les assises élastiques disparaissent progressivement ne laissant subsister que les limitantes élastiques interne et externe, à ce stade les artères pulmonaires sont musculaires.
b. Les artères musculaires
Les artères de moyen calibrent entre 500 et 100 µm de diamètre comme les artères des membres, les artères viscérales qui sont le siège de la vasomotricité sont plus riches en CML. Les artères musculaires possèdent une limitante élastique interne et externe et quelques lamelles élastiques entre les différentes couches de CML. Comme les artères pulmonaires élastiques, les artères pulmonaires musculaires ont une paroi plus mince que les artères systémiques de même calibre. L’épaisseur du média des artères pulmonaires musculaire représente 4 à 5% du diamètre externe contre 15 à 20% pour les artères systémiques. Ces artères se divisent pour former le réseau artériolaire.
28
8. Les artérioles
Ceux sont des vaisseaux importants dans la régulation de la pression artérielle, d’un diamètre plus petit que les artères (diamètres compris entre 10 et 100 µm), mais avec une composition relativement semblable à celle des artères musculaires. Dans les artérioles, il n’y a généralement pas de lamelles élastiques [19], et les couches de CML sont beaucoup moins nombreuses mais toujours arrangées de façon concentrique (1 à 2 couches de CML). Les artérioles restent en permanence en semi-contraction et leur résistance est nécessaire à la production de la pression sanguine. Il est à noter que les artérioles pulmonaires sont peu ou pas muscularisées. Les plus petites artérioles déversent leur contenu dans le réseau capillaire.
9. Les veines et veinules
Les veinules (diamètre de 20 à 500 µm) et les veines (diamètre de 1 à 3 cm), contrairement aux autres vaisseaux, possèdent des valves anti-reflux qui permettent au sang de ne circuler que dans un seul sens : des organes vers le cœur. Dans les veinules et certaines veines, les CML et les fibres élastiques sont plutôt organisées de façon longitudinale, selon l’axe du vaisseau. Dans les veines, les deux types d’organisations coexistent avec plus ou moins d’importance selon le type de veines [20]. Les veinules de plus gros diamètre et les veines sont similaires structurellement aux artères, mais elles ont une paroi plus mince par rapport à leur diamètre et cette paroi contient plus de tissu conjonctif que de tissu musculaire. Elles sont donc plus extensibles que les artères. La vitesse d’écoulement du sang y est très faible et la pression basse.
29
En conclusion, on peut dire que la structure des vaisseaux sanguins change au fur et à mesure que l'on s'éloigne du cœur : la composante élastique, d'abord majoritaire, diminue en importance au profit de la couche musculaire (figure 2). Cette particularité permet d'absorber la pulsatilité de l'écoulement sanguin, résultant du battement cardiaque et de le rendre parfaitement continu à l'entrée dans les capillaires.
Figure 2 : Représentation schématique de la structure en coupe
Les propriétés rhéologiques du sang sont gouvernées par celles des globules rouges vu leur supériorité numérique qui permet de négliger les autres éléments. Le sang est un fluide non-newtonien dont la viscosité varie avec le cisaillement auquel il est soumis, cette propriétés est due à la fois à l’agréabilité des globules rouges à faible cisaillement, à leur déformabilité et à leur alignement à fort cisaillement [21].
10. Les capillaires
Les capillaires sont de très fins vaisseaux d’environ 5 à 8 µm de diamètre, constitués uniquement d’une couche de cellules endothéliales avec une lame basale et quelques fibres de collagène. Le réseau capillaire est extrêmement ramifié, très résistif et peu adaptable. C’est au niveau des capillaires que vont se faire tous les échanges entre le sang et les tissus
30
vascularisés. Les capillaires sont aussi le lien entre le système artériel et veineux. Ils ne possèdent pas de CML, tout comme les veinules post-capillaires.
IV. Modélisation rhéologique du sang
1. Choix des modèles rhéologiques
Il est bien évident que le comportement rhéologique du sang présente, sous certaines conditions d’écoulement, un aspect non-newtonien. C’est un fluide complexe, dit à "seuil" et "rhé fluidifiant", c'est-à-dire qu’il se comporte comme un solide aux faibles contraintes de cisaillement, et qu’ensuite il se comporte comme un fluide visqueux dont la viscosité diminue au fur et à mesure que la contrainte de cisaillement augmente. La variation de la viscosité sanguine dépend de plusieurs paramètres, tels que la température et la déformabilité des globules rouges, mais elle est étroitement liée à la variation du pourcentage d’hématocrites (pourcentage occupé dans le sang par les globules rouges). Dans cette partie de l’étude, nous avons modélisé le comportement rhéologique du sang par le modèle d’Ostwald.
2. Quelques modèles des lois de comportement a. Fluide Newtonien
Le fluide newtonien est à la base de la théorie de Navier-Stokes.son modèle est représenté par une relation linéaire entre le tenseur des contraintes σ et le tenseur des taux de déformation
où µ0 est un coefficient dépendant essentiellement de la température appelé
coefficient de viscosité dynamique, I le tenseur unité et p la pression hydrostatique [12].
31
b. Fluides Newtoniens généralisés
Les fluides inélastiques ou fluides purement visqueux, ont une loi de comportement dans laquelle la contrainte à un instant t ne dépend que de l’état de déformation à cet instant. Pour un fluide incompressible, cette loi de comportement est définie par :
Où p est la pression hydrostatique et (α0, α1) deux scalaires, fonction du 2ème et
3eme invariant de ID, et
c. Fluide plastique (fluide non-Newtonien) Fluide de Bingham :
Un cas particulier du comportement rhéofluidifiant est l’existence d’une contrainte seuil d’écoulement : si la contrainte appliquée au fluide est inférieure à cette contrainte seuil, aucune déformation ne se produit, le fluide ne coule pas. Un exemple courant de fluide à seuil est la pâte dentifrice : elle ne peut sortir du tube sous l’effet de son propre poids, il faut lui appliquer une contrainte nettement supérieure pour qu’elle s’écoule. La représentation la plus simple d’un fluide à seuil est le modèle de Bingham qui donne la relation suivante entre la contrainte τ et le taux de cisaillement .
.
où est la contrainte seuil et la viscosité plastique. En pratique le modèle de Bingham ne s’applique que dans une gamme limitée de taux de cisaillements et la contrainte seuil, obtenue par extrapolation du rhéogramme à = 0, est souvent difficile à déterminer correctement.
32
Figure 3 : Fluide plastique (Bingham) [23]
Loi d’Ostwald-de Waele
est un modèle mathématique simple permettant de modéliser facilement un fluide non-newtonien sans seuil en reliant la contrainte de cisaillement τ au taux de cisaillement :
Où :
K est une constante appelée indice de consistance ;
n un nombre sans dimension appelée indice d’écoulement. La viscosité dynamique apparente, ηa, est alors donnée par :
. Ainsi, si :
0 < n < 1, le fluide est rhéofluidifiant ou pseudoplastique ; n = 1, il est newtonien ;
n > 1, il est rhéoépaississant ou dilatant.
Cette modélisation est approximative puisqu’elle n’est valide que dans une gamme de cisaillement dont l’intervalle dépend du fluide lui-même. Elle omet les deux plateaux newtoniens (η0 et η∞) qui sont bien modélisés par la loi de
Carreau-Yasuda [22]. Toutefois, elle modélise bien le comportement des polymères fondus sur une large gamme de taux de cisaillement correspondant
33
aux valeurs typiques de l'injection plastique, et est donc fréquemment utilisée dans ce domaine [22].
V. Conclusion
À partir du contenu de ce chapitre apparaît l’importance de faire une étude plus profonde sur l’écoulement du sang. L’étude que nous allons entreprendre comporte deux approches ; une première approche analytique et une deuxième approche numérique. Cette étude fera l’objet des chapitres qui vont suivre.
34
35
I. Introduction
La modélisation des écoulements sanguins s’avère très délicate par le fait que dans ces écoulements intervient un grand nombre de paramètres de natures diverses. L’étude de ces écoulements conduit souvent à des équations très complexes. Ces complexités peuvent provenir d’une part de la loi de comportement du fluide étudié (Newtonien, non Newtonien,…) ; ainsi que des conditions hydrodynamiques et d’autre part de la nature de la paroi (rigide, élastique ou viscoélastique,…).
II. Mise en équations
1- Comportement rhéologique de la paroi
Notre conduite est un tube axisymétrique, souple à paroi mince, isotrope et imperméable, de longueurL0, de rayon en mouvement R, d’axe de révolution
OZ, de masse p et de rayon au reposR0. z
e
Figure 4 : Géométrie de la conduite
r
r z t
u , , Z
z t R , 0 R z e r e
r z t
w , ,
r z t
u , , Z
z t R , 0 R z e r e O O
r z t
w , ,36
La symétrie de la conduite autour de l’axe OZ entraîne l’indépendance de toutes les variables par rapport à la coordonnée azimutale. La déformation de la paroi sera décrite par l’équation suivante :
RR0
PPext
où : P est la pression à l’intérieur de la conduite, Pextla pression extérieure et α le
coefficient de rigidité de la paroi.
2- Comportement rhéologique du fluide
2.1- Introduction
On peut décrire le mouvement d’un fluide tel que le sang par un ensemble d’équations aux dérivées partielles déduites des lois fondamentales de la mécanique, c'est-à-dire les lois de conservation de la masse (équation de continuité), de la quantité de mouvement (équation de quantité de mouvement). Pour poser de façon complète un problème en dynamique des fluides, il convient d’ajouter aux équations du mouvement des conditions initiales et des conditions aux limites (ou conditions aux frontières). Dans le cadre de notre étude, le fluide sera considéré incompressible, non newtonien et l’écoulement laminaire non permanent.
2.2- Équation de continuité
La loi de continuité exprime la conservation de masse de l’écoulement du fluide, c'est-à-dire le fait qu’il n’y a ni création ni destruction de masse pendant le mouvement des fluides. Pour démontrer l’équation de continuité, on considère une surface Sperméable et fixe, délimitant le système ouvert de volume, où
vreprésente la vitesse, n, le vecteur unitaire normal à la surface élémentaire
37
Le volume arbitraire,, appelé volume de contrôle et dont la forme dans le système cartésien des variables x, y, z est indépendant du temps t, il est immobile dans l’espace, la masse de fluide à l’intérieur du volume au temps t
est :
t d
m
À l’instantt, la masse de fluide a été déplacée hors du volume de sorte que le nouveau volume ~
tt
contient la massem~
tt
.La conservation de la masse du fluide suppose que le taux de variation de m est nul. Compte tenu de la dérivée particulaire on peut écrire :
0 m Dt
D
La masse du nouveau volume ~
tt
, bien que conservée, se compose de deux termes ; le premier terme, m
tt
représente la masse dans le volume fixe, à l’instant
tt
et le deuxième terme, la masse nette du fluide qui représente la différence entre la quantité du fluide qui sort et celle qui entre :
t t
m
t t
m t m sLe terme msreprésente le débit massique net à travers la surfaceS.
d’autre part par définition :
t t m t t m lim m Dt D ~ 0 t d’où : (II.1) (II.2) (II.3) (II.4)38
S S 0 t S 0 t m t m m t t m t t m lim t t m t m t t m lim Dt Dm avec :
d t d t t mLe débit massique élémentaire,d mS, à travers la surface élémentaire dS a comme
expression : dS n v dS v m dS . n. ...
où vn est la projection de v
d’après la normalen, par conséquent :
S S vndS m d’où :
S vndS d t Dt Dm 0 alors :
S vndS d t . 0 qui représente la forme générale ou intégrale de l’équation de continuité dans l’écoulement du fluide.
Si on applique les formules de Gauss on obtient :
v d dS n v S .
(II.5) (II.6) (II.7) (II.8) (II.8) (II.9) (II.10)39 d’où :
0 . . . v d t
. 0 . v t qui s’écrit en coordonnées cylindriques :
0 1 w z u r r r t Dans le cas d’un fluide incompressible, cette dernière équation devient : 1
0 w z u r r r (II.13)2.3- Équation de quantité de mouvement
La quantité de mouvement d’une particule fluide, I
t , est définie par le produit de la masse de la particule, m, et de son vecteur vitessev. Dans le cas général d’un volume de contrôle , à un instant t, on détermine la quantité de mouvement grâce à l’équation :
t m t dv vd
I
D’après la deuxième loi de Newton, le taux de variation de la quantité de mouvement, I
t , est égal à la résultante de toutes les forces F agissant sur la massem, à la surface S et à l’intérieur de celle-ci, par conséquent :
F
Dt I
D
Dans un intervalle de tempst, la masse m se meut avec le fluide et, par définition, la dérivée particulaire devient :
(II.11)
(II.12)
(II.14)
40
t t I t t I Dt I D t ~ 0 limoù la quantité de mouvement du fluide se trouvant dans le volume mobile ~ à l’instant
tt
obéit à la formule :
2 1
~ t t I t t I I I où
I2 I1
représente la différence nette des quantités de mouvement qui entrent dans le volume et qui en sortent pendant l’intervalle du tempst, on l’exprime
par l’intégrale :
I I
vn
v tdS S
1 2 d’où :
t F I I t t I t t I Dt I D t 1 2 0 lim
S vn vdS F t I Dt I D alors :
F dS v n v d v t S La résultante de toutes les forces
F agissant sur la masse m du volume de contrôle se compose des forces massiques et des forces de surface :
F Fm FSLes forces massiques Fm
représentent la somme de toutes les forces internes, comme les forces gravitationnelles et les forces électromagnétiques (s’il y a lieu), on peut les exprimer sous la forme :
(II.16) (II.17) (II.18) (II.19) (II.20) (II.21) (II.22) (II.23)
![Figure 3 : Fluide plastique (Bingham) [23]](https://thumb-eu.123doks.com/thumbv2/123doknet/2198606.12243/56.892.325.617.142.298/figure-fluide-plastique-bingham.webp)