THESE
PRESENTEE A L'ECOLE DES GRADUES DE L'UNIVERSITE LAVAL POUR L'OBTENTION DU GRADE DE
DOCTEUR ES SCIENCES PAR
RICHARD TAILLON
B.A., B.Sc. (Université Laval)
ETUDE DE L'HYDROLYSE DE QUELQUES IONS METALLIQUES EN PRESENCE D'AMMONIAC, DE METHYLAMINE ET DE
A Sylvie, Annie
Je veux exprimer ma plus vive reconnaissance à mon directeur de thèse, M. le professeur A.O. GUbeli, pour l'aide précieuse qu'il m'a apportée pendant l'élaboration de cette thèse. Son encouragement et ses directives m'ont permis de mener à bien ce travail.
Mes remerciements les plus sincères vont également à mes collè gues de laboratoire, MM. P.A. Côté, G. Paillard, J. Piuze et J.P. Retel, pour leur amitié et leur généreuse collaboration.
Je tiens à témoigner ma plus profonde gratitude à mon épouse pour 1'encouragement, la persévérance et la compréhension qu'elle m'a accordés au cours des dernières années.
Je remercie le Ministère de 1'Education, le Collège et le CEGEP de La Pocatière pour leur aide financière au cours des années 1968 à 1971.
Enfin, je remercie tous ceux qui, de près ou de loin, ont con tribué à la réalisation de ce travail.
TABLE DES MATIERES
INTRODUCTION Page
Généralités ... 1
Critères pour l'étude des complexes par la méthode de solubilité... 2
Nature et objet de la thèse... 3
CHAPITRE 1: THEORIE Introduction ... 4
Développement mathématique ... 4
Identification des complexes ... 7
Etude des complexes polynucléaires en solution... 10
Calcul des constantes ... 14
CHAPITRE 2: PARTIE EXPERIMENTALE GENERALE Introduction ... 16
Mode opératoire... 17
Appareillage ... 17
Mesure du pH et sa correction... 18
CHAPITRE 3: CONSTANTES DE DISSOCIATION DE NH*, Œ NH^ ET (hoœ2œ2)3nh+ Introduction ... 21
Développement mathématique... 21
Partie expérimentale... 23
HYDROXO-METHYLAMINE-COMPLEXES DU CADMIUM EN EQUI LIBRE AVEC Cd(OH)2(s)
Introduction... 32
A - Hydroxo-complexe s Méthode expérimentale ... 33
Résultats... 34
Identification des complexes... 34
Calcul des constantes... 41
Discussion a) Produit de solubilité de Cd(OH)2... 42
b) Hydroxo-complexes... 42
B - Ammine- et hydroxo-ammine-complexes Méthode expérimentale ... 44
Résultats... 44
Identification des complexes ... 44
Calcul des constantes ... 50
Courbes calculées ... 54 Discussion a) Ammine-complexes... 55 b) Hydroxo-ammine-complexes... 55 C - Methylamine- et hydroxo-méthylamine-complexes Méthode expérimentale ... 58 Résultats... 58
VI
Calcul des constantes ... 66
Discussion a) Methyl amine -complexe s... 69
b) Hydroxo-méthylamine-complexes... 70
CHAPITRE 5: DETERMINATION DES CONSTANTES DE FORMATION DES HYDROXO-, METHYLAMINE- ET HYDROXO-METHYLAMINE- COMPLEXES DU CUIVRE EN EQUILIBRE AVEC CuO(s) Introduction ... 73
A - Hydroxo-complexes Méthode expérimentale ... 74
Résultats... 76
Identification des complexes... 76
Calcul des constantes... 79
Discussion a) Produit de solubilité de CuO... 80
b) Hydroxo-complexes ... 82
B - Methylamine- et hydroxo-méthylamine-complexe s Méthode expérimentale ... 83
Résultats... 83
Identification des complexes ... 84
Calcul des constantes... 91
Discussion... 93
CHAPITRE 6: DETERMINATION DES CONSTANTES DE FORMATION DES HYDROXO- ET HYDROXO-TRIETHANOLAMINE-COMPLEXES DE L'ALUMINIUM EN EQUILIBRE AVEC Al(OH)3(s) EN MILIEU NEUTRE ET ALCALIN
A - Hydroxo-complexes
Méthode expérimentale... 104
Résultats et identification des complexes... 105
Calcul des constantes... 105
Discussion... 109
B - Hydroxo-triéthano1amine-complexes Méthode expérimentale ... 110
Résultats... 110
Identification des complexes... 111
Calcul des constantes... 111
Courbes calculées ... 118 Discussion... 119 RESUME ... 124 APPENDI CE A... 126 APPENDICE B... 127 BIBLIOGRAPHIE ... 128
Vlll
Liste des principaux symboles
% a0H A dil E 4) g ccy gi(3h) G2^ i ka kaOH K ^sxy L : activité de l'ion H+. : activité de l'ion OH .
: coefficient affectant les constantes de stabilité dans 1'équation représentant la concentration totale de métal en solution.
: milieu ionique plus dilué que 0.01 mole/litre. : force électromotrice en millivolts.
: fraction titrée. : fonction de. : V(kat y •
: ([ïNHj] - y EZCd]f) gfiy. : [ECH3NH2] g(aH).
: ([ETEA] - y [EAl]f) g(a^).
: nombre de constantes de stabilité à calculer. : constante de dissociation de LH .
: constante de dissociation du groupement hydroxyle alcoolique de la triéthanolamine.
: constante d'équilibre reliée au titrage des hydroxo-complexes par H+: M^OH)^2 x + H+ ^—* n Mz+ + x HgO.
: produit ionique de l'eau.
: produit de solubilité de M(0H)z ou M0^y2»
3*”X : constante de solubilité apparente de l'espèce Al (OH) x (TEA) ^ : ligand différent de OH et en particulier NH^, CH^NH^ et
(Li)ao^ m M n N P pH p[£M]£ R (s) T TEA TEA var x X
y
Y z cxM ^nxyconcentration de lithium variable et de perchlorate cons tante (méthode du self-milieu).
nombre entier exprimant un indice de multiplicité, espèce métallique en solution.
degré d'association: n = 1 pour les espèces mononucléaires n >, 2 pour les espèces polynucléaires. valeur maximale de n.
opérateur (-log).
*f* cologarithme de l'activité de l'ion H .
cologarithme de la concentration métallique attribuable aux complexes contenant le ligand L.
%s0 4 ^ '
phase solide.température en degré Celsius, ligand (HOQ^CH^N.
(hoq-i2ch2)2n (ch2ch2o").
force ionique variable ou non contrôlée. nombre de ligands OH dans un complexe. valeur maximale de x.
nombre de ligands L dans un complexe. valeur maximale de y.
valence de l'ion métallique. nombre (a) de moles par litre.
constante de formation cumulative apparente de 1'espèce
Mh(OH)x(L)y="X.
X
U : force ionique.
a : écart type trouvé à l'aide des courbes de distribution. £ : opérateur sommation.
En solution aqueuse, les ions métalliques existent sous forme d'aquo-complexes. Des espèces nouvelles sont susceptibles de s'y former par suite d'échanges entre des molécules d'eau liées et certains ligands préférentiels.
L'étude des complexes inorganiques en solution présente un grand intérêt pour la compréhension de la chimie des solutions (1) et partant, des interactions entre l'ion métallique, les ligands et le solvant (2) et (3). De plus, la connaissance des espèces en solution permet de décrire adéquatement la distribution des diverses formes solubles et insolubles en termes de la loi d'action de masse. Ces renseignements contribuent gran dement à l'élucidation de la composition chimique des eaux naturelles.
Le choix de la méthode de solubilité pour l'étude des complexes simples et mixtes en milieu hétérogène apparaissait donc pertinent, si l'on songe à 1'influence prépondérante des phases solides en contact avec les eaux naturelles. En outre, les aspects théoriques et pratiques de cette méthode, mis en application dans notre laboratoire par Ste-Marie (4), Mehra (5) et Hébert (6), nous permettaient d'entrevoir des résultats inté ressants , spécialement en milieu alcalin où la format im des espèces mixtes est favorisée.
2 Les constantes de formation déterminées à l'aide de la méthode de solubilité peuvent se référer à des précipités fraîchement préparés. Les données obtenues dans de telles conditions sont très importantes pour des études comme celles de l'usage d'Al3+ comme agent coagulant. Cependant, les travaux relatifs à la solubilité des solides âgés sont habituellement plus intéressants pour la compréhension des équilibres hétérogènes dans les eaux naturelles.
Critères pour l'étude des complexes par la méthode de solubilité
L'emploi de la méthode de solubilité pour l'étude des complexes en solution présuppose la vérification de trois conditions.
D'abord, la force ionique doit être maintenue constante afin que les coefficients d'activité demeurent invariants dans toutes les solutions étudiées et qu'en conséquence on puisse appliquer la loi d'action de masse en utilisant des concentrations plutôt que des activités. A cet effet, nous avons utilisé le perchlorate de sodium, ses ions ne formant habituel lement pas de complexes avec les ions métalliques étudiés (7). De plus, lorsque la concentration d'un cation devenait non négligeable par rapport à celle de Na+, nous avons maintenu la concentration de CICfj constante. Les travaux de Biedermann et Sillén (8) confirment en effet que les coefficients d'activité des cations sont affectés principalement par les anions et vice versa.
En second lieu, la nature du solide doit demeurer inchangée selon le pH et l'excès du ligand présent en solution. On peut vérifier cette con dition par l'examen des courbes de solubilité.
technique qui nous a semblé la plus appropriée pour l'étude de ces com plexes , soit la méthode potentiométrique proposée par Sillén (9).
Nature et objet de la thèse
C'est en tenant compte des limitations mentionnées précédemment et des travaux antérieurs effectués par Ste-Marie (4) et Hébert (6) que nous avons entrepris l'étude de la solubilité des complexes formés en présence de quelques ligands simples.
Ainsi avons-nous déterminé la solubilité de Cd(II) en présence d'ammoniac ou de méthylamine, de Cu(II) en équilibre avec la méthylamine et de Al(III) en présence de la triéthanolamine.
CHAPITRE 1
THEORIE
Introduction
Si un métal forme des complexes en solution, sa concentration to tale est égale à la somme de la concentration de l'ion métallique simple et de celles de tous les complexes de ce métal en solution, chacune étant multipliée par le nombre d'atomes métalliques présents dans le complexe.
La méthode de solubilité consiste à introduire dans cette somme les constantes de stabilité des espèces et à exprimer la concentration métallique totale, [ZM], en fonction de 1'activité de H+, a^. La con centration de chacun des complexes dépendant de celles des ligands et de l'ion métallique, on doit donc exprimer ces dernières par des fonctions de ai r
Développement mathématique
Lorsqu'on précipite un hydroxyde ou un oxyde métallique en présence d'une base faible, L, pouvant servir de ligand, les divers équilibres en solution et leurs constantes respectives peuvent être représentés de la
LH+ ^ L + H+
k =
[L] aH [LH ]
b) précipitation de M(OH)z ou :
M(OH)z(s) MZ+ + z OH" MO^/gCs) + z/2 HgO
Ks0 = [mZ+] aOH
c) formation des complexes :
n Mz+ + x OH" + y L M^OH) (L)^Z~X 'x' 'y [^(ŒfyL)^"*] 3n^= [Mz+]n a^CLf ' d) dissociation de l'eau: (1-1) (1-2) (1-3) (1-4) (1-5) (1-6) h2° Ke " % a0H H + OH a™, = 10-14 (1-7) (1-8)
La plupart de ces constantes, faisant intervenir à la fois des activités et des concentrations, sont appelées constantes de formation apparentes ou constantes de Brdnsted.
La concentration totale de métal en solution s'exprime par [ZM] = Z Z Z n 8 [M^f aL [bf ,
6 où N, X et Y sont les valeurs maximales de n, x et y.
En y introduisant le produit de solubilité de 1'hydroxyde ou de l'oxyde précipité (K q) et le produit ionique de l'eau (Ke), on obtient:
[EM] = Z Z Z n 3 Kg Kx_nz agz_x [L]y . (1-10)
n=l X=0 y=0 nxy SU e n
La concentration totale de base faible en solution peut s'écrire:
[EL] = [L] + [LH+] + [Llliê , (1-11)
où est la concentration totale du ligand dans les complexes.
Dans les régions où la solubilité du métal est faible comparative ment à la concentration totale de ligand, on peut négliger le dernier ter me de l'équation (1-11) et exprimer [L] par la relation
[L] = [ZL] {(ka/(ka + %)} = [EL] g(aH). (1-12)
L'équation (1-10) devient:
[ZM]= Z Z % n 3 Kg ^"^^^[ZLf g^). (1-13)
n=l x=0 y=0 mcy su e n
La résolution de cette équation exige un système comprenant autant d'équations que d'inconnues, chaque inconnue représentant la constante d'équilibre d'une espèce possible en solution. Puisque, par définition, les valeurs des constantes doivent être positives, on peut éliminer du sys tème les espèces pour lesquelles les valeurs des constantes sont nulles ou négatives et ainsi obtenir une image réelle des équilibres présents en so lution. Malgré les avantages apparents de cette méthode, elle exige la
résultats.
Pour éviter ces difficultés, Ste-Marie (4) a proposé une solution analytique à cette équation. Cette solution, appelée méthode des pentes, permet l'élimination des termes négligeables de la somme par une identi
fication préalable des complexes en concentration prédominante en solu tion.
Identification des complexes
La méthode des pentes est basée sur le fait que la concentration totale de métal en solution est égale, à toutes fins pratiques, à la som me des concentrations d'un nombre limité de complexes. En posant qu'elle correspond à la concentration de l'espèce prédominante Mn(OH)x(L)^z x, il est possible de calculer les pentes théoriques de la courbe de solubilité qui sont caractéristiques de ce complexe en équilibre avec 1'hydroxyde ou l'oxyde précipité.
Si, dans une région de pH et de p[EL], les variations de la pente de la courbe de solubilité en fonction du pH et de p[EL] obtenues expéri mentalement correspondent à celles calculées pour un complexe donné à
l'aide des définitions des constantes de formation, on peut alors poser que ces variations identifient cette espèce et que la concentration totale de métal en solution est égale à celle de ce complexe.
L'équation générale (1-13) devient
nz-x
Après l'avoir exprimée sous forme cologarithmique, on peut dériver cette équation selon le p[EL] et le pH. On obtient
8 = y pour tout pH (1-15) 3p[ZL]/pH et ap[zM] \ 3pH /p[ZL] 3p/(%) nz-x + ---9pH (1-16)
La dérivée de pg(a^) par rapport au pH s'exprime différemment selon que la valeur du pH est inférieure ou supérieure au pka de LH+ (tableau 1-1)•
Tableau 1-1
Dérivation de pg(a^) en fonction du pH
Région gy(aH) 3PSy (%)
9pH
pH < pka Cka/al/
-y
pH > pka 1 0
En introduisant ces valeurs dans l'équation (1-16), on obtient finalement:
( ^ = nz-x-y, si pH < pk (1-17)
\ 9pH / p[£L]
Les pentes théoriques, représentées au tableau (1-2), correspondent aux espèces de formule générale M^(OH)^(L)^ x et elles sont reliées à la charge des espèces prédominantes.
Tableau 1-2
Pentes caractéristiques de 1'espèce de formule générale
^(QH^L)^"* Pente Région pH < pka pH > pka /9p[EM] ' X 9pH )p[EL] nz-x-y nz-x ZdpCEM] \9p[EL] )pH
y
y
Le produit de solubilité étant une constante, la concentration de l'ion métallique est toujours fixée par le pH. On obtient donc une équation à deux inconnues, n et x. Il est alors impossible d'avoir suffisamment de données de solubilité pour déterminer 1'influence des espèces polynucléaires. Ces dernières auront les mêmes combinaisons de pentes théoriques que les espèces mononucléaires si elles possèdent la
10
même charge ou, en d’autres termes, si la différence entre leurs formules est égale à une ou plusieurs unités M(OH)z (10).
Dans certains cas particuliers, la méthode de solubilité pourrait indiquer la présence d1espèces condensées en solution si les pentes obser vées étaient incompatibles avec les complexes mononucléaires : par exemple, des pentes supérieures à (+2) en fonction du pH dans le cas de 1'hydroxyde d'un métal bivalent.
De façon générale, ce traitement s'applique seulement aux espèces mononucléaires et 1' influence des espèces polynucléaires doit être négli geable à moins qu'elle puisse être déterminée par une autre méthode.
Si n est égal à 1, les équations des dérivées partielles donnent les valeurs des pentes caractéristiques des complexes mononucléaires sim ples et mixtes représentées au tableau (1-3). Chaque espèce possède une combinaison différente de pentes de telle sorte qu'il est possible, en étudiant les régions de pH où le précipité existe et un intervalle assez étendu de concentration de ligand L, d'identifier les complexes se for mant en concentration prédominante en solution.
Etude des complexes polynucléaires en solution
On peut vérifier 1'hypothèse que n est égal à 1, en adjoignant à la méthode de solubilité une technique permettant la détermination des complexes polynucléaires. Plusieurs auteurs, dont Byé (11), Carpéni et Souchay (12), Lefebvre (13), Sillén (9) et Carpéni (14),ont proposé pour l'étude des espèces condensées en solution des méthodes distinctes mais
Pentes de la courbe de solubilité caractérisant les complexes 2 —■y
de formule générale M(OH)^(L)^ pour un métal de coordination six Espèce 2-x-y 2-x y m2+ 2 2 0 M(OH)+ 1 1 0 M(OH)2 0 0 0 M(OH)g -1 -1 0 M(ŒT)2--2 -2 0 M(OH)^~ -3 -3 0 M(OH)g" -4 -4 0 M(L)2+ 1 2 1 M(L)2+ 0 2 2 M(L)f -1 2 3 M(L)f -2 2 4 -3 2 5 M(L)f -4 2 6
12 Tableau 1-3 (suite) Espèce 2-x-y 2-x
y
M(OH) (L)+ 0 1 i M(OH)(L)^ -1 1 2 M(OH)(L)^ -2 1 3 M(OH) (L)J -3 1 4 M(OH) (L)g -4 1 5 M(OH)g(L) -1 0 1 MCOPOgCL)^ -2 0 2 M(OH)g(L)g -3 0 3 MCŒO^CL)^ -4 0 4 M(OH)^(L)" -2 -1 1 M(OH)^(L)2 -3 -1 2 M(OH)g(L)^ -4 -1 3 M(OH)^(L)^ -3 -2 1 M(OH)^(L)^ -4 -2 2 M(OH)5(L)3™ -4 -3 1calcul de Sillén nous paraissaient les plus adéquates, nous avons appliqué cette dernière approche aux solutions d'équilibre ne contenant pas le li gand L.
L'acidification des échantillons prélevés dans les solutions en équilibre avec l'hydroxyde ou l'oxyde précipité peut être représentée par 1'équation
M^COH)112 x + x H+ x
n MZ+ + x H20. (1-19)
Si on définit la constante d'équilibre de cette réaction par l'expression
K =
[MZV
[Mn(OH)"Z~X][H+]X (1-20)
les concentrations totales de métal et de ligand sont données respective ment par [EM] = [Mz+] + NE n=l E n [M (OH)nZ-x] = [Mz+] + E E n [Mz+]n K-1CH+]~X x=l n=l x=l (1-21) et [EOIQ = [OU
] +
N E n=l E x [M (OH)nZ"X] = [OU ] + E Ex [MZ+]n K'1[H+] X. x=l n x n=l x=l (1
-22
)E E x CM ]n K"1 [H ] n=l x=l (1-23) - _ [EOH] - [OH"] CMZ+] + E En [Mz+]n K"1 [H+] x n=l x=l
Qn constate alors que L est fonction seulement de [H+] lorsque les deux conditions suivantes sont remplies:
a) si [Mz+] n'est pas négligeable par rapport à [EM], il est né- cessaire que les sommes soient du premier ordre selon [M ], de telle sorte que [M ] puisse être éliminé. Cela signifie que n est toujours égal à 1 et que les complexes sont mono nucléaires .
b) si [Mz+] est négligeable par rapport à [EM], [Mz+] peut être éliminé de 1'équation (1-23) à la condition qu'une seule va leur de n existe. Alors les complexes doivent être mono
nucléaires ou homonucléaires, i.e. de formule générale M (0H)^Z x. dans laquelle la valeur de n est constante et celle de x,
variable.
Les courbes 17 = g(-log[H+], [EM]) seront donc significatives de l'état du système puisque la présence d'espèces mononucléaires se traduira par la coïncidence de ces courbes, tandis que les complexes polynucléaires produiront une série de courbes décalées, dont le déplacement par rapport à l'axe (-log[H+]) sera fonction de la composition de ces complexes.
Calcul des constantes
solu-s'agit alors de résoudre à l'aide de i points expérimentaux plusieurs systèmes de i équations linéaires à i inconnues, représentant les cons tantes d'équilibré des espèces identifiées.
La distribution des valeurs obtenues, après la résolution de nom breux systèmes d'équations différents, permet de choisir la valeur la plus probable pour chaque constante. Ces résultats, introduits dans 1'équation (1-13), doivent reproduire les courbes de solubilité en fonction du pH et de l'excès de ligand présent en solution. Par itération, on obtient les valeurs des constantes les plus appropriées au système étudié. On peut ensuite trouver au moyen des courbes de distribution l'écart type, a, pour chacune des constantes.
CHAPITRE 2
PARTIE EXPERIMENTALE GENERALE
Introduction
L'étude de l'action d'un ligand, L, sur un hydroxyde ou un oxyde métallique en solution aqueuse hétérogène en fonction du pH suppose la
connaissance de la stabilité des hydroxo-complexes en fonction de la même variable. En effet, la concentration métallique totale présente dans une solution contenant le ligand L est égale à la somme des concen trations de l'ion métallique et de celles des complexes formés: complexes simples contenant OU ou L et complexes mixtes constitués de ces deux li gands. On peut représenter [EM] par 1'équation:
N X ^ N Y nz [EM] = [Mz ] + E En [MfOH)^Z_x] + E E n [M (L] ] n=l x=l n x n=l y=l n y N X Y + E E E n [M (OH) fL^z"x]. (2-1) n=l x=l y=l n x y
Une étude préliminaire du système solution—M(OII) (s) en absence du ligand L permet de déterminer les deux premiers termes du membre de droite
Mode opératoire
Les solutions d'équilibre pour l'étude des complexes en solution furent préparées à partir d'une solution de perchlorate du métal étudié, à laquelle on ajouta de 1'hydroxyde de sodium afin de précipiter le cation métallique sous forme d'hydroxyde ou d'oxyde. A ces solutions, on addition na, selon le cas, un excès connu constant de ligand L et une quantité dé
terminée de NaClO. afin de maintenir un milieu de force ionique unitaire. Après avoir ajusté le pH avec HC1CC ou NaOH, ces solutions furent agitées pendant les premiers jours, puis laissées au repôs durant quelques se maines. Par la suite, des échantillons de ces solutions furent prélevés de façon à déterminer la concentration métallique totale. Cette analyse quantitative fut effectuée au moyen de titrages complexométriques ou de méthodes spectrophotométriques.
Le pH fut mesuré à l'aide d'une électrode de verre et d'une élec trode au calomel saturée reliées par un pont d'agar-agar (5% dans NaClO^ 1 M).
Appareillage
Les lectures spectrophotométriques furent prises à l'aide d'un ap pareil Unicam SP-600 et les mesures potentiométriques furent faites au moyen d'un pH-mètre Corning, modèle 12, à échelle étendue.
18
Mesure du pH et sa correction
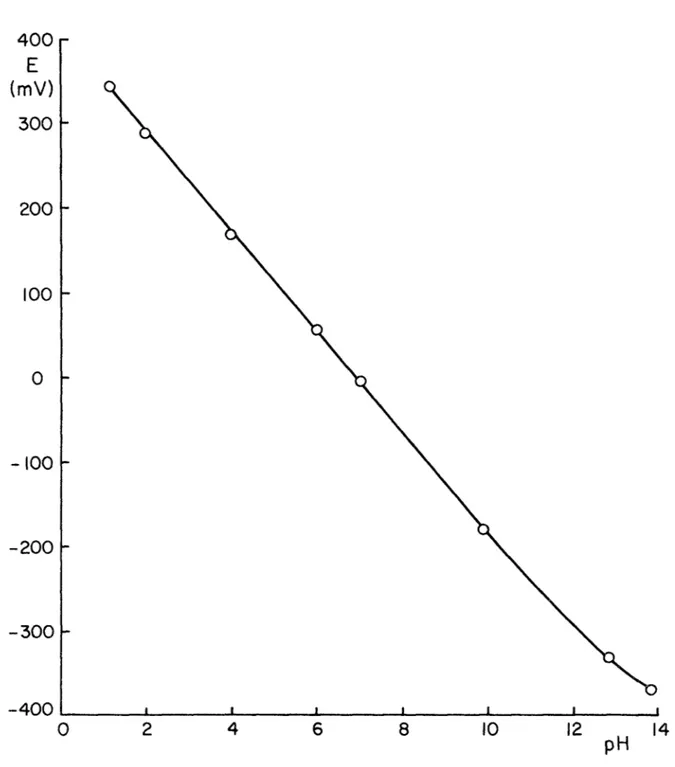
Les électrodes furent étalonnées au moyen de solutions-tampons commerciales pour la région de pH comprise entre 4 et 10. Pour les extré mités acide et alcaline, on utilisa respectivement des solutions de HCl et de NaOH, pour lesquelles le pH a été calculé à l'aide des coefficients d'activité moyens (15). On donne au tableau (2-1) et à la figure (2-1) un exemple d'étalonnage d'une électrode de verre.
Pour appliquer la méthode de Sillén (9) à la détermination des espèces polynucléaires, les pH mesurés (-log a^) furent transformés en
(-log[H+l). A cet effet, on a mesuré le pH d'une série de solutions d'acide perchlorique (NaClO^ IM) de concentration variant entre 10“1 et 10~5 M. Les résultats expérimentaux sont présentés au tableau (2-2). De ces données, on peut obtenir la relation suivante:
Etalonnage de 1'électrode de verre
Solution HCl 0.1M
HCl 0.01M
Tampon Tampon Tampon Tampon NaOH 0.1M NaOH IM pH 1.09 2.04 4.00 6.00 7.00 10.00 12.88 13.83 E(mV) 340 285 169 54 -5 -180 -330 -369 Tableau 2-2
Etalonnage de la concentration analytique en H
Solution
HC104 (M) 0.1 0.01 0.001 0.0001 0.00001
E(mV) 358 300 240 183 125
•log[H+] 1.00 2.00 3.00 4.00 5.00
20
400 r
-200
-300
-400
NH*, CHgNH* et (HOCH^CHJ 3NH+
Introduction
Le calcul des constantes de formation des ammine-, méthylamine- et triethanolamine-complexes métalliques simples et mixtes exige la connais sance des constantes de dissociation des acides conjugués de ces ligands dans un milieu de force ionique unitaire.
Leur détermination a été effectuée à l'aide de courbes de titrages potentiométriques. Cette méthode permet d'employer les mêmes conditions expérimentales que celles utilisées pour l'étude des complexes métalliques et d'obtenir des précisions sur le degré d'association de ces ligands en solution.
Développement mathématique
Pour la réaction
n LH+ Ln + n H+, (3-1)
22
et ([EL](1-*) n-1), si 4 correspond à la fraction titrée. Puisque la cons tante de dissociation, kQ, est définie par l'expression
n ka = cy % [LH+]n~ (3-2) on peut écrire : % ka n 4>n C2L]n (1-4) [%L] (3-3)
En considérant cette équation, on peut facilement voir que, pour une frac tion titrée donnée, sera fonction de [EL] seulement si n > 1. On ob tiendrait alors un réseau de courbes de neutralisation à différentes con centrations où pH = g(4, [EL]).
Cependant, lorsque les différentes courbes représentées par la fonction pH = g(<f>, [EL]),se réduisent à une seule (sauf aux extrémités où l'écart est dû à l'hydrolyse ou à la dissociation), on peut conclure que n = 1 et que les équilibres font intervenir des espèces non associées seu lement. L'équation (3-3) devient alors
%
ka *
(1-4)Sous forme cologarithmique, on obtient
(3-4) pH
Pka + P
4 (1“4) et pour 4 = 0.5, pH = pka. (3-5) (3-6)des valeurs de pk se situant entre 3 et 11. L'erreur maximale sur <j) est de ±0.02 en tenant compte de la dilution durant le titrage.
Partie expérimentale
Des séries de solutions ayant une concentration totale constante en ligand et une fraction titrée variable ont été préparées dans NaClO^ IM. Les solutions avaient la composition suivante:
r ml L 1.0M dans NaClO^ IM,
s ml HCIO^ 0.1M dans NaClO^ IM et (25-r-s) ml NaClO^ IM.
Dans chaque série, la valeur de r a été maintenue constante et une courbe de titrage pour deux [EL] différents a été réalisée pour chaque ligand soit NH3, CH^NH. et NCCH^CH^OH) , à 25 °C.
Les solutions d'ammoniac et de triéthanolamine ont été préparées
à partir de produits de pureté analytique^ dilués avec de l'eau bidistillée. Celles de méthylamine ont été obtenues selon une méthode analogue à celle de Brown et Bartholomay (17): le chlorure de méthylammonium a été dissous dans une solution contenant un excès de KOII, puis la méthylamine a été en traînée à l'aide d'un courant d'azote dans de l'eau bidistillée.
Résultats et discussion
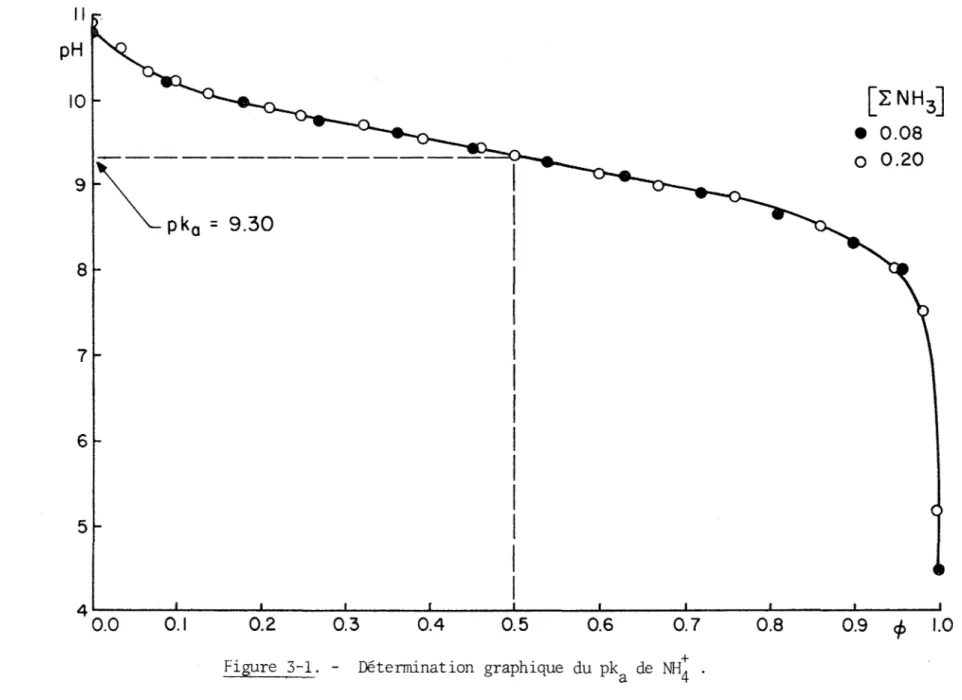
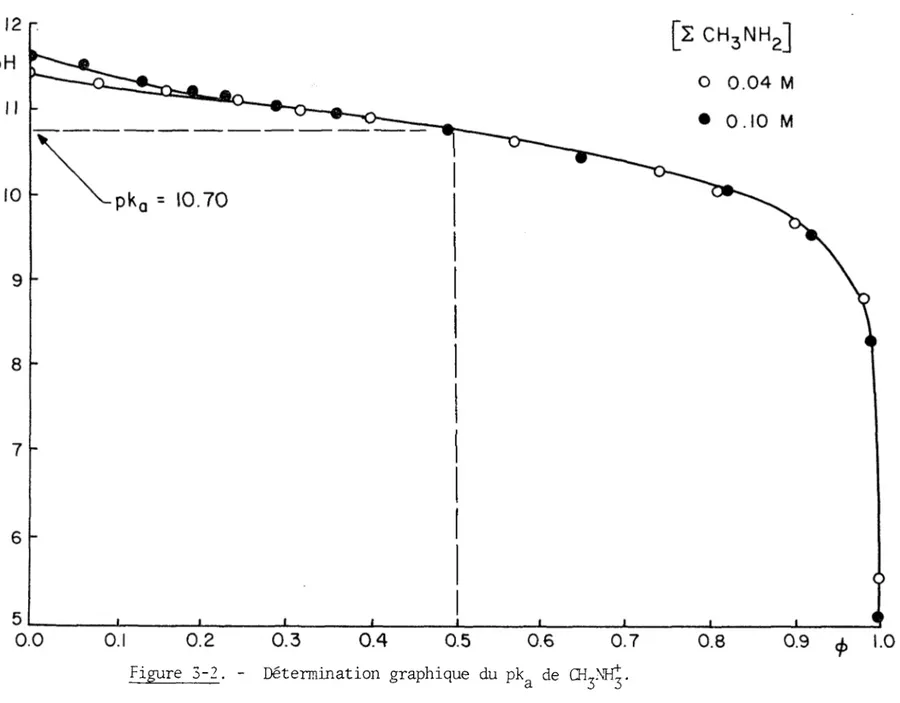
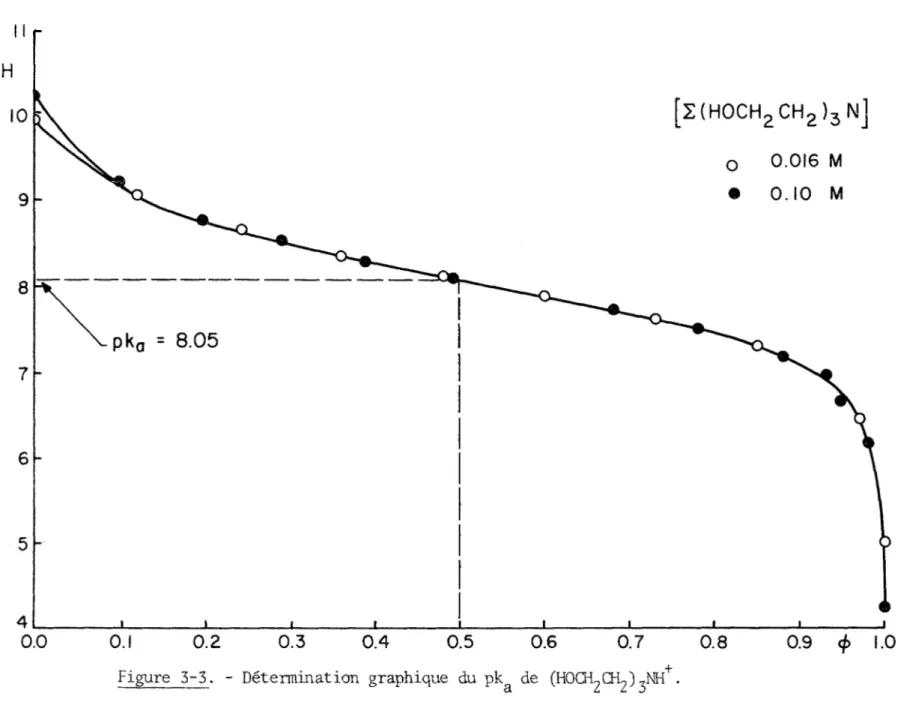
Les résultats expérimentaux présentés aux tableaux (3-1), (3-2) et (3-3) et aux figures (3-1), (3-2) et (3-3) permettent d'abord de conclure
24
que 1'association de ces ligands en solution est nulle ou négligeable dans 1'intervalle de concentration étudié, puisque les courbes de titrages à diverses concentrations sont superposables. On peut ensuite déterminer graphiquement le pk& de chacun des acides conjugués de ces bases faibles.
a) Ammoniac
Les mesures potentiométriques obtenues lors du titrage de
NH,
, pré sentées au tableau (3-1) et à la figure (3-1) , attribuent à la constante de dissociation deNüt
une valeur de5
x 10"10 (pka = 9.30) .b) Methylamine
Les données expérimentales pour la détermination du
pk
deCILNII?
apparaissent au tableau (3-2) et à la figure (3-2). Celle-ci nous per met d'obtenir une valeur de 2 x 10"11 (pk& = 10.70).c) Triethanolamine
La valeur de la constante de dissociation de
(HOCILQL) JUI^,
pka=8.05, a été déterminée à l'aide des résultats expérimentaux apparais sant au tableau (3-3) et à la figure (3-3).
Ces trois valeurs de pk& se comparent très bien à celles que l'on retrouve dans la littérature chimique (18). Le tableau (3-4) présente d'ailleurs des comparaisons pour les valeurs les plus récentes.
Titrages potentiometriques de NIL par HCIO^ 0 . IM à 2 5°C [ZNH-] = 0.08M [INH31 = 0.2M 4> pH <P pH 0.00 10.74 0.00 10.87 0.09 10.17 0.03 10.57 0.18 9.95 0.07 10.34 0.27 - 9.74 0.10 10.19 0.36 9.57 0.14 10.07 0.45 9.40 0.21 9.88 0.54 9.24 0.25 9.80 0.63 9.07 0.32 9.64 0.72 8.88 0.39 9.48 0.81 8.66 0.46 9.38 0.90 8.30 0.50 9.31 0.95 7.99 0.60 9.11 1.00 4.48 0.67 8.97 0.76 8.78 0.85 8.51 0.96 7.85 0.98 7.51 1.00 5.21
[
inh3]
• 0.08
O 0.20
Figure 3-1. - Détermination graphique du pk de NH
Titrages potentiométriques de par IICIO^ 0 . IM à 2 5°C [ZCH3Mi2] = 0.04 M [ZCHgNHg] = 0.1M 4> pH pH 0.00 11.41 0.00 11.60 0.08 11.32 0.06 11.49 0.16 11.18 0.13 11.37 0.24 11.06 0.19 11.22 0.32 10.94 0.23 11.15 0.40 10.84 0.29 11.06 0.49 10.70 0.36 10.93 0.57 10.57 0.49 10.70 0.65 10.43 0.65 10.43 0.73 10.26 0.82 10.00 0.81 10.02 0.92 9.50 0.90 9.62 0.98 8.25 0.98 8.76 1.00 5.02 1.00 5.50
O 0.04 M
• 0.10 M
pkQ = 10.70
Titrages potentiométriques de N(CHgCH^OH) 3 par HCIO^ 0 . IM à 2 5°C [EN(CH2CH2OH)3] = 0.016M <î> PH 0.00 9.91 0.12 9.04 0.24 8.64 0.36 8.34 0.48 8.08 0.60 7.84 0.73 7.58 0.85 7.24 0.97 6.41 1.00 5.00 [EN(CH2CH2OH)3] = 0.1M <t> pH 0.00 10.22 0.09 9.23 0.19 8.76 0.29 8.51 0.39 8.27 0.49 8.08 0.68 7.70 0.78 7.46 0.88 7.15 0.93 6.91 0.95 6.67 0.98 6.16 1.00 4.18
Il
pH
0.016 M
0.10 M
pka = 8.05
0.9
<j>
1.0
Différentes valeurs du pkQ de NH^, CH^NH^ et (HOCH^CH^) ^NH^
Espèce b T(°C) Pka Référence
NH^ 0.2 23
9.25 Chatt et Gamlen (19) 0.03 25 9.1 Pearson et Williams (20) 0 25 9.24 Christensen, Izatt, Wrathall
et Hansen (21) 1 25 9.3 Ste-Marie (4) 0.5 30 9.16 Fisher et Hall (22) 1 25 9.30 Présent travail CH3NH3 0.2 23 10.74 Chatt et Gamlen (19) 0.03 25 10.55 Pearson et Williams (20) 0 25 10.66 Perrin (23) 0 25 10.6 Evstratova, Goncharova et Solomko (24)
0 25 10.64 Christensen, Izatt, Wrathall et Hansen (21) 1 25 10.70 Présent travail (HOCH?CH?)^nh+ 0 25 7.76 Bates et Allen (25) 0.5 25 7.9 Bjerrum et Refn (26) 0 22 7.82 Hall et Sprinkle (27) 0.5 30 7.83 Fisher et Hall (22) 0 25 7.86 Douhéret et Pariaud (28) 0 25 7.76 Perrin (23) 0 25 7.77 Gowland et Schmid (29)
0 25 7.76 Christensen, Izatt, Wrathall et Hansen (21)
CHAPITRE 4
DETERMINATION DES CONSTANTES DE FORMATION DES HYDROXO-, AMMINE-, HYDROXO-AMMINE-, METHYLAMINE- ET HYDROXO-
METHYLAMINE-COMPLEXES DU CADMIUM EN EQUILIBRE AVEC Cd(OH)3(s).
Introduction
L'hydroxyde de cadmium ayant une solubilité relativement faible sur une assez grande étendue de l'échelle du pH, il est possible d'appliquer la méthode de solubilité à la détermination des constantes de formation des complexes en équilibre avec 1'hydroxyde précipité.
Les constantes de stabilité des espèces hydroxylées simples, ob tenues dans un premier temps, faciliteront par la suite 1'interprétation des résultats obtenus en présence d'ammoniac ou de méthylamine.
Même si l'étude des complexes du Cd(II) avec les ligands OH-,
NHg et CH^NH. a été effectuée par d'autres chercheurs (16) et (31-40), il nous apparaissait intéressant de reprendre cette étude à l'aide d'une mé thode permettant la détermination des espèces mixtes.
Les solutions d'équilibre furent préparées à partir d'une solution de Cd(C10^)2 qui provenait de la dissolution de CdCO^(s) dans HC10. dilué, suivie d'un entraînement du CO^ par de l'azote à 60°C pendant 24 heures.
Après la précipitation de 1'hydroxyde de cadmium par NaOH, les pH furent fixés approximativement avec NaOH ou HC10., puis tous les échan tillons furent portés à un volume connu en présence de NaClO^ IM.
Agitées durant les premiers jours, les solutions furent ensuite lais sées au repos afin que le précipité pût se déposer complètement au fond des récipients. Après 7 à 8 jours d'équilibre, la concentration totale de cadmium en solution fut déterminée et le pH fut mesuré selon la méthode décrite au chapitre 2.
Pour les concentrations supérieures à 10"3M, l'analyse quantitative du cadmium fut effectuée volumétriquement avec EDTA,à pH 10, en présence de 1'indicateur noir ériochrome T. Pour les concentrations plus faibles, on utilisa une extraction par la dithizone, méthode mise au point par
Saltzman (30). Elle consiste à agiter, dans une fiole à extraction, 50 ml d'une solution contenant entre 1 et 10 yg de cadmium, 10 ml d'une solution aqueuse d'acide tartrique à 2% et 5 ml de chloroforme. Après décantation de la phase organique, l'élimination du chloroforme est rendue plus com plète par entraînement avec de l'azote. A la solution aqueuse résultante, on ajoute 0.3 ml d'hydroxylamine à 20% dans l'eau, 15 ml de dithizone
34
0.05% en KCN. La densité optique de la phase organique est mesurée à 518 nm dans des cuvettes de deux centimètres par rapport à un témoin contenant les réactifs. La courbe d'étalonnage se rapportant à cette méthode est donnée à la figure (4-1).
Résultats
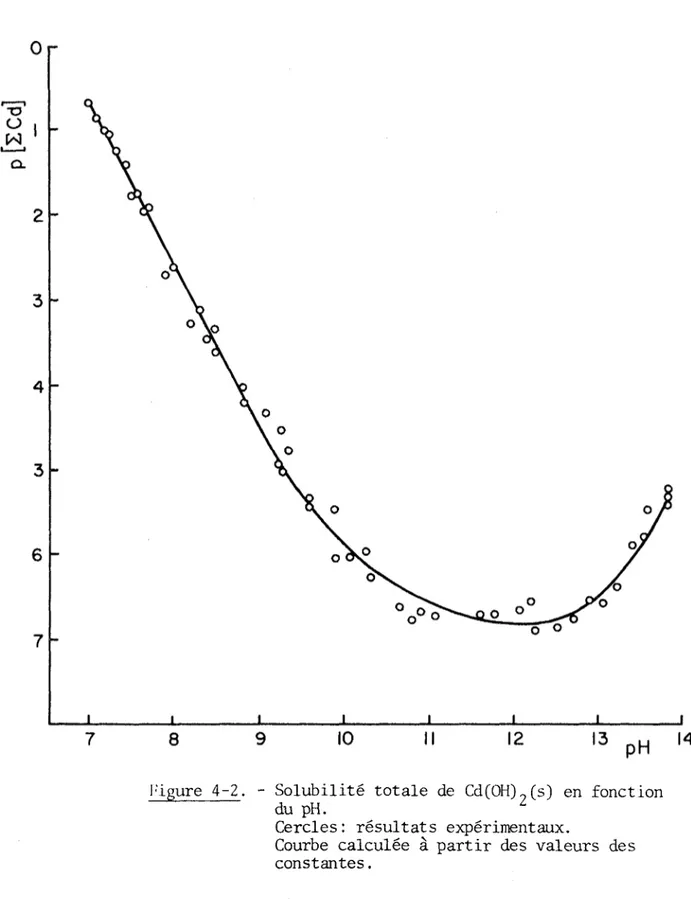
Les valeurs de solubilité totale du cadmium(II), p[ECd], en fonc tion du pH apparaissent au tableau (4-1) et sont représentées à la fi
gure (4-2). Cette dernière montre successivement des pentes de (+2), (+1) , (0) et (-2) indiquant la présence en solution d'espèces de charge cor
respondant à ces valeurs.
Identification des complexes
Dans la région de pente (+2), il est possible de vérifier par des titrages potentiométriques si 1'espèce de charge (+2) est reliée à Cd2+ ou à Cd(Cd(0H)2)j^2' Pour appliquer la méthode de Sillén à la détermination des espèces polynucléaires, nous avons prélevé des échantillons des solu tions en équilibre avec CdfOH^fs) à pH 7, 7.1 et 7.2. Ceux-ci furent ti trés par HCIO^ 0.025M.
Quelques exemples peuvent illustrer la technique utilisée pour la courbe [XCd] = 0.1M à pH = 7.2. Les solutions étaient mélangées de la façon suivante:
Dens
ité
o
p
ti
q
u
e
01
2345
6789
10
fi.g Cd
0436 Solubilité de CdfïH^Cs) en fonction du pH Tableau 4-1 pH p[£Cd] pH p[ECd] 7.00 0,71 9.10 4.31 7.10 0.85 9.27 4.96 7.20 1.00 9.30 4.51 7.25 1.06 9.30 5.00 7.35 1.24 9.40 4.75 7.45 1.42 9.60 5.40 7.50 1.85 9.60 5.46 7.60 1.76 9.90 5.42 7.65 1.92 9.90 6.05 7.70 1.90 10.10 6.00 7.85 2.81 10.30 5.92 8.00 2.66 10.30 6.26 8.20 3.29 10.70 6.64 8.30 3.08 10.80 6.77 8.40 3.43 10.90 6.67 8.50 3.28 11.10 6.70 8.50 3.60 11.60 6.70 8.50 3.60 11.75 6.67 8.80 4.00 12.05 6.57 8.85 4.22 12.24 6.47
pH p[£Cd] 12.30 6.85 12.50 6.85 12.70 6.75 12.88 6.55 12.90 6.53 13.03 6.57 13.20 6.38 pH p[ECd] 13.40 5.85 13.50 5.73 13.55 5.95 13.77 5.27 13.84 5.40 13.85 5.32
38
Figure 4-2. - Solubilité totale de Cd(OH)?(s) en fonction du pH.
Cercles : résultats expérimentaux.
Courbe calculée à partir des valeurs des constantes.
Point #2: 10 ml de solution saturée à pH 7.2, 0.2 ml HCIO. 0.025M dans NaClO. 1M, 0.8 ml NaClO^ 1M, etc..
Le pH de chacune de ces solutions fut mesuré 48 heures après leur prépa ration.
Un nombre suffisant d'échantillons fut préparé de façon à avoir une courbe bien définie du pH obtenu en fonction de la quantité de HCIO. ajoutée. Afin de calculer la valeur de L, on a tracé une courbe de réfé rence à partir de données sur une solution contenant seulement du NaClO. IM. La différence entre la courbe de référence et les courbes de titrages en présence de cadmium a servi de mesure pour déterminer la concentration d'ions hydroxyde liés, ([£OH]-[OH ]). Cette valeur, divisée par la concen tration métallique totale, a donné les résultats, ïï en fonction de
(-log[H+]), présentés au tableau (4-2).
Ces données expérimentales montrent que le taux d'hydrolyse de l'ion Cd2+ est très bas, puisque la valeur maximale de T est approximative ment 0.005. Cet effet tampon très faible entraîne beaucoup d'imprécision sur les valeurs de U, de telle sorte que les courbes de L en fonction de
(-log[H+]) sont à toutes fins pratiques peu significatives. Toutefois, ces résultats sont suffisants pour confirmer la prédominance de l'ion Cd2+ dans cette région de la courbe de solubilité.
La concentration totale de cadmium en solution étant beaucoup plus faible dans les régions de pente (+1), (0) et (-2), on a interprété les
40
Tableau 4-2
Valeurs calculées de L en fonction de (-log[H+])
Solution #1 a Solution #2 a Solution #3 a
(pH = 7.00) (pH = 7.10) (PH = 7.20)
L (-log[H+]) L (-log[H+l) L (-logClf])
0.0030 3.22 0.0035 3.17 0.0024 3.07 0.0040 3.44 0.0035 3.27 0.0028 3.14 0.0045 3.82 0.0035 3.37 0.0027 3.22 0.0050 5.17 0.0040 3.42 0.0037 3.37 0.0043 3.82 0.0037 3.49 0.0040 3.67 0.0048 4.42
échantillon prélevé dans la solution de pli correspondant du tableau (4-1)
Calcul des constantes
L1identification des espèces prédominantes en solution nous permet d'écrire:
„2 + 2
-[ECd] = [Cd ] + [CdOH ] +- [Cd(GH)2] + [Cd(OH)4 ] ; (4-1)
et à l'aide de l'équation (1-13), on obtient:
[ECd] = % Kg Ks0 + % Ke Ks0 310 + Ks0 02O + Ke Ks0 g40^4
Puisque n est égal à 1 pour ce système, nous avons posé que et g sont identiques. Si nous définissons *0 = 1— 1 M
S
1__ 1 (4-3) 2 -2 (4-4) *00 = % Ke -*10 = ' (4-5) -2 2 (4-6) et A4q = =H Ke-1'équation (4-2) deviento
>
II>
00 Ks0 + *10 Ks0 310 + Ks0 ^20 + *40 Ks0 B40 ' (4-7)Pour chaque point expérimental, on peut calculer les valeurs des différents coefficients A de 1 'équation (4-7). Au moyen de ceux-ci, il est possible de former des systèmes de quatre équations à quatre inconnues
42
dont la résolution fournit les valeurs des quatre constantes.
On obtient comme valeurs les plus probables à 2 5°C:
pKs0 = 14.6 (a = ±0.1), log 810 = 4.7 (a = ±0.2), log 320 = 7.8 (a = ±0.2) log 340 = 9.7 (a = ±0.2).
Ces constantes introduites dans l’équation (4-2) nous ont permis de tracer la courbe apparaissant à la figure (4-2).
Discussion
a) Produit de solubilité de Cd(OH)^
Le produit de solubilité de 1'hydroxyde de cadmium, comme celui de la plupart des hydroxydes ou oxydes métalliques, n'atteint une valeur cons tante qu'après un certain vieillissement du précipité. Bien que ce der nier ne montre pas de différence morphologique significative avec l'âge de
la préparation (31), la diminution de la valeur du serait attribuable à des effets cinétiques (32). On trouve donc dans la littérature chimique des valeurs de pK^ variant de 12.77 à 14.58 (18).
La valeur recommandée par Schindler (32) pour la forme inactive à p = 3,soit 14.4, s'approche de celle que nous avons trouvée à p = 1, soit 14.6.
b) I Iydroxo-complexes
[ECd] > 0.1M. Ces résultats se comparent aux nôtres, puisque le taux d'hydrolyse très faible que nous avons trouvé peut être attribué à l'es pèce CdOH+ pour des concentrations totales de cadmium se situant entre 0.1 et 0.01M. Enfin, l'hypothèse d'espèces mononucléaires pour expliquer
2 +
l'hydrolyse de Cd est également préconisée par Marcus (34).
Les résultats obtenus pour les différentes constantes de stabilité des hydroxo-complexes coïncident partiellement avec les valeurs données en littérature (18), (35) et (36). Les valeurs trouvées pour CdOH+ et
2 —
Cd(OH)^ se comparent avec les constantes publiées, cependant les diffé rents auteurs attribuent une constante assez divergente à Cd(OH)2. Bien que Gayer et Woontner (37), Dyrssen et Lumme (38) et Ryan, Dean et
Cassidy (36) attribuent une constante de formation à 1'espèce Cd(0H)~, celle-ci ne se retrouve pas en concentration prédominante dans les con ditions expérimentales utilisées dans nos travaux.
44
B- Ammine- et hydrôxo-ammine-complexes
Méthode expérimentale
Les solutions d’équilibre pour l’étude de 1'action de 1’ammoniac sur l'hydroxyde de cadmium ont été préparées et analysées de la même façon que dans le cas de 1'hydroxyde seul, mais une quantité déterminée et
constante d'ammoniac a été ajoutée à chacune après la précipitation de 1'hydroxyde par NaOH.
Résultats
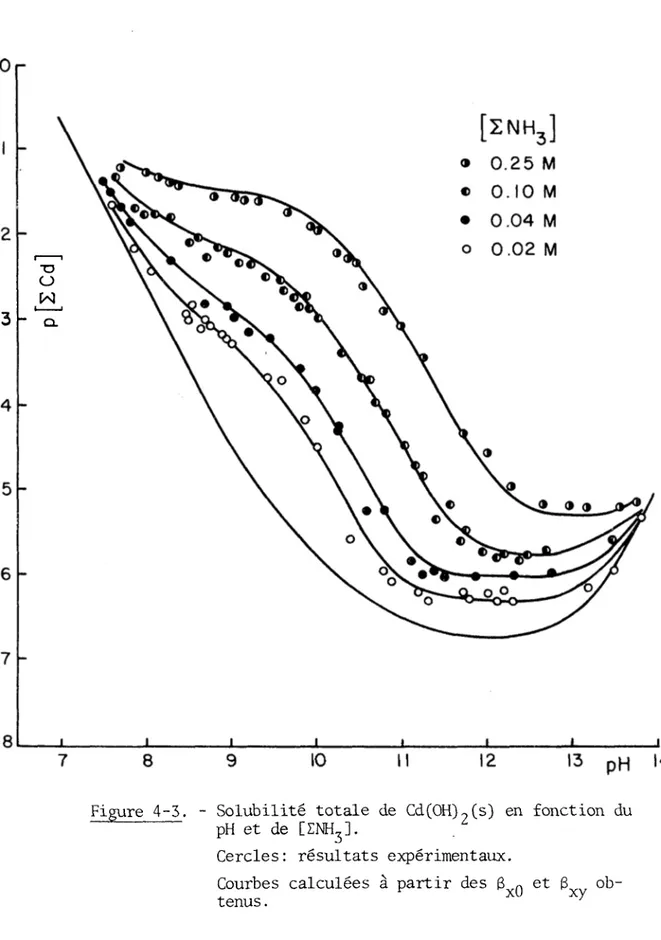
Les valeurs expérimentales obtenues lors de l'étude de la solubilité de Cd(OH)2(s) en présence de NH^ sont groupées aux tableaux (4-3),
(4-4), (4-5) et (4-6). Les courbes correspondantes apparaissent à la figure (4-3).
Identification des complexes
Aux faibles concentrations d'ammoniac, les résultats expérimentaux représentés à la figure (4-3) coïncident en milieu neutre et aux pH très alcalins avec ceux de 1'hydroxyde seul. De plus, on note un accroissement de solubilité à mesure qu'on augmente la concentration d'ammoniac en so lution. Ces deux faits s'expliquent respectivement par la présence du même solide dans tous les cas étudiés et par la formation d'espèces ami nées ou hydroxo-amminées. Comme le taux d'hydrolyse est extrêmement fai ble pour l'hydroxyde seul et que la présence de 1' ammoniac en excès com plique énormément les titrages potentiométriques, nous avons fait l'hy pothèse que seules des espèces mononucléaires étaient présentes en solution.
Solubilité de CdCOH^Cs) en fonction du pH et en présence de NH_ 0.02M pH p[ZCd] p[ECd]f pH p[ZCd] p[ECd]f 7.60 1.64 2.17 10.00 4.50 4.52 7.90 2.15 2.53 10.40 5.58 5.71 8.05 2.49 2.94 10.80 5.95 6.13 8.44 2.93 3.09 10.90 6.06 6.27 8.50 2.96 3.09 11.20 6.19 6.41 8.54 2.81 2.88 11.30 6.27 6.52 8.65 3.08 3.16 11.70 6.19 6.35 8.68 3.00 3.06 11.75 6.27 6.47 8.75 3.06 3.11 12.00 6.16 6.30 8.90 3.15 3.18 12.10 f 6.30 6.50 8.95 3.19 3.22 12.20 6.14 6.27 9.00 3.28 3.31 12.30 6.30 6.50 9.40 3.70 3.72 13.20 6.09 6.49 9.60 3.71 3.72 13.50 5.96 — 9.85 4.20 4.21 13.85 5.31
46
Tableau 4-4
de NH5 0.04M
Solubilité de CdCOH^Cs) en fonction du pH et en présence
pH pCZCd] p[£Cd]f pH pCEGd] p[ZCd]: 7.50 1.35 1.71 10.25 4.34 4.35 7.56 1.45 1.79 10.25 4.31 4.31 7.70 1.66 1.93 10.55 5.31 5.36 7.82 1.80 2.00 10.80 5.25 5.28 8.25 2.28 2.35 11.10 5.87 5.97 8.70 2.92 2.96 11.25 6.00 6.12 8.91 2.85 2.86 11.40 5.97 6.07 9.00 3.01 3.02 11.50 6.07 6.19 9.20 3.15 3.16 11.90 6.07 6.18 9.40 3.27 3.27 12.35 6.00 6.09 9.80 3.55 3.55 12.75 5.95 6.04 10.00 3.81 3.81
de NH3 0.3M
Solubilité de Cd(OH)2(s) en fonction du pH et en présence
pH p[£Cd] p[ECd]£ PH p.[£Cd] p[SCd]£ 7.62 1.36 1.53 10.56 3.64 3.64 7.85 1.75 1.90 10.60 3.65 3.65 8.00 1.75 1.81 10.70 3.93 3.93 8.07 1.76 1.81 10.80 4.09 4.09 8.30 1.77 1.78 11.05 4.47 4.47 8.50 2.13 2.14 11.25 4.82 4.82 8.56 2.08 2.09 11.20 4.70 4.70 8.70 2.30 2.31 11.40 5.30 5.32 8.85 2.15 2.15 11.55 5.10 5.11 8.90 2.22 2.22 11.70 5.54 5.57 9.10 2.38 2.38 11.75 5.42 5.44 9.23 2.31 2.31 11.95 5.73 5.77 9.40 2.39 2.39 12.10 5.75 ' 5.90 9.57 2.50 2.50 12.15 5.70 5.74 9.60 2.62 2.62 12.35 5.78 5.83 9.75 2.66 2 .66 12.50 5.83 5.89 9.83 2.79 2.79 12.70 5.70 5.75 9.85 2.70 2.70 13.50 5.54 5.67 9.90 2.82 2.82 10.00 2.90 2.90 10.30 3.40 3.40
48
Tableau 4-6
de NH_ 0.25M
Solubilité de CdCOH^Cs) en fonction du pH et en présence
PH p[ECd] p[£Cd]f pH p[ECd] p[ECd]
7.70 1.25 1.33 10.55 2.59 2.59 8.00 1.27 1.29 10.80 2.92 2.92 8.15 1.33 1.34 11.00 3.05 3.05 8.28 1.39 1.39 11.25 3.35 3.35 8.37 1.41 1.41 11.75 4.27 4.27 8.77 1.52 1.52 12.00 4.57 4.57 9.05 1.56 1.56 12.30 4.90 4.90 9.15 1.57 1.57 12.65 5.15 5.16 9.30 1.61 1.61 12.95 5.23 5.25 9.65 1.73 1.73 13.15 5.21 5.24 9.90 1.92 1.92 13.55 5.27 5.44 10.00 1.93 1.93 13.73 5.15 5.28 10.20 2.23 2.23 10.35 2.27 2.27 10.45 2.32 2.32
p
[Z
C
d
Figure 4-5. Solubilité totale de Cd(OH)?(s) en fonction du pH et de [ZNH31.
Cercles: résultats expérimentaux. Courbes calculées à partir des tenus.
ob-50
De plus, pour faciliter 1 * interprétation des courbes de solubilité, nous avons représenté à la figure (4-4), en fonction du pH, les valeurs de
f
24-pEECd] résultant de la soustraction du cadmium attribuable à Cd et aux espèces hydroxo-simpies du pEECd] de la figure (4-3).
Les courbes de la figure (4-4) présentent des paliers en milieu al calin et, dans la même région de pH, une pente de (+1) selon le pESNHj]. Ces deux observations nous permettent d’identifier l'espèce Cd(OH)
Après le pka de NH^, soit 9.30, et pour pEECd] > 3.5, on observe une pente de (+2) selon le pH et une pente passant de (+2) à (+3) puis à (+3.7) selon le pEENH_]. Les seuls complexes pouvant justifier de telles
2+ 2 +
variations des courbes de solubilité sont Cd(NH^)^ , Cd(NIL)3 et Cd(NHg)^.
Enfin, avant le pka et pour EENHj] = 0.02 et 0.04M, bien que ne soit pas négligeable par rapport à [ENH^l, la seule espèce pouvant donner une pente entre 0 et (+1) selon le pH et de (+1) selon le
2 +
p[ENHg] est CdNH^ , puisque la diminution de EMI^] avec 1’augmentation de EECd] entraînerait une pente de plus en plus négative pour tous les autres complexes mononucléaires simples et mixtes en fonction du pH.
Calcul des constantes
La connaissance des espèces en solution permet d’écrire:
EECd]f = ECdNH^] + ECd(NH3)2+3 + ECd(NH3)3+] + ECdENiy^]
p
[S
C
d
]
7
8
Figure 44.-9
10
II
12
13 pH 14
Solubilité différentielle de Cd(0H)?(s) en fonction du pH et de [ENH^].
A l'aide des définitions des différentes constantes d'équilibre, on ob tient : [CdNH^] = [Cd2+][NH31 |301 = R 3Q1 [NHj], (4-9) [Cd(NH3)2+] = CCd2+][NH3l2 B02 R 3q2 [NHj]2 (4-10) [Cd(NH3)2+] = [Cd2+][NH3]3 eQ3 = R 303 [NHg]3 (4-11) [Cd(NH3)2+] = [Cd2+][NH3]" BQ, = R 6^^ [NH^" (4-12) et [Cd(OH) 2M131 = [Cd2+] a^H [NHg] 321 = Kg() 3^ CNHj] , (4-13)
La concentration totale d'ammoniac en solution s'exprime par la re lation (1-11) où (NH^lié est donné par:
CNH3]lié = [CdM4+3 + 2 (Cd(NH3)2+] + 3 [Cd(NH3)2+] + 4 [Cd(NH3)2+]
[Cd(OH) 2MÏ3]. (4-14)
+
,2+
Bien que [CdNIIj ] soit le seul terme nécessairement non négligeable dans cette somme, puisqu'il est le seul complexe identifié dans une région où est important, nous avons considéré également les autres concen trations afin d* appliquer le calcul à un plus grand nombre de points expé rimentaux.
Les termes de l'expression (4-14) ne peuvent être évalués sans la connaissance des constantes de stabilité des espèces mentionnées. Mais en se limitant aux régions de pH où 1'identification des complexes prédominants
où y = 1, 2, 3 ou 4 selon l'espèce présente en solution. En combinant les équations (1-11) et (4-15) avec 1'équilibre de dissociation de NH^ , on obtient:
[NH31 = (CZNH33 - y CZGd)f) g(aR) = G(a^). (4-16)
En remplaçant [NHj] par cette expression dans les équations (4-9) à (4-13) et en définissant Aq = [£Cd]f , (4-17) Aq1 = R G(aH) , (4-18) Aqg = R (a^) , (4-19) = R G^y , (4-20) A04 = R G\y - (4-21) et A^^ = Ksq G(a^), (4-22) 1'équation (4-8) devient
% = ^01^01 + ^02^02 + A03^03 + A04^04 + A21P21* (4-23)
Si l'on choisit des points expérimentaux dans les régions où la pré dominance des différents complexes est la mieux définie, on peut calculer les coefficients A de 1'équation (4-23) et former plusieurs systèmes de cinq équations à cinq inconnues permettant la détermination des constantes de stabilité.
54
Après avoir résolu me centaine de systèmes d’équations différents à l'aide d'un ordinateur IBM 360, on obtient les valeurs les plus probables suivantes à 2 5 0 C : log 801 = 3.1 (a = ±0.2) , lOg Bgg = 5.2 (a = ±0.3) , log BQ3 = 6.5 (a = ±0.3) , 8o4 = 7.8 (a = ±0.2) log 8,1 = 9.85 (a = ±0.05). Courbes calculées
Les valeurs des constantes de stabilité des espèces amminées per mettent le calcul des courbes de solubilité apparaissant à la figure (4-3). Cependant, dans les régions où la solubilité du métal est élevée, [NH^l ne peut être calculé à l'aide de la constante de dissociation de NH^ seu lement, car n'est pas négligeable par rapport à [ENH^l. Pour effectuer sa détermination, on peut exprimer [ECd]^ par la relation sui vante:
[ZCd]f = (R 301 + Ks0 B21)ENH3] + R 6q2 CNH^f + R 603 [Nfÿ3
+ R B04 [My4. (4-24)
Les différents coefficients de [NH^] peuvent être calculés facile ment en fonction du pH et la résolution de 1'équation (4-24) donne la con centration d'ammoniac libre en solution pour un [ENH^] présent en solution. La connaissance de [NH^] pennet l'obtention des valeurs de [NH^] et de
moniac calculée et celle réellement présente en solution, on a ajusté f
[ECd] afin d'obtenir la valeur expérimentale.
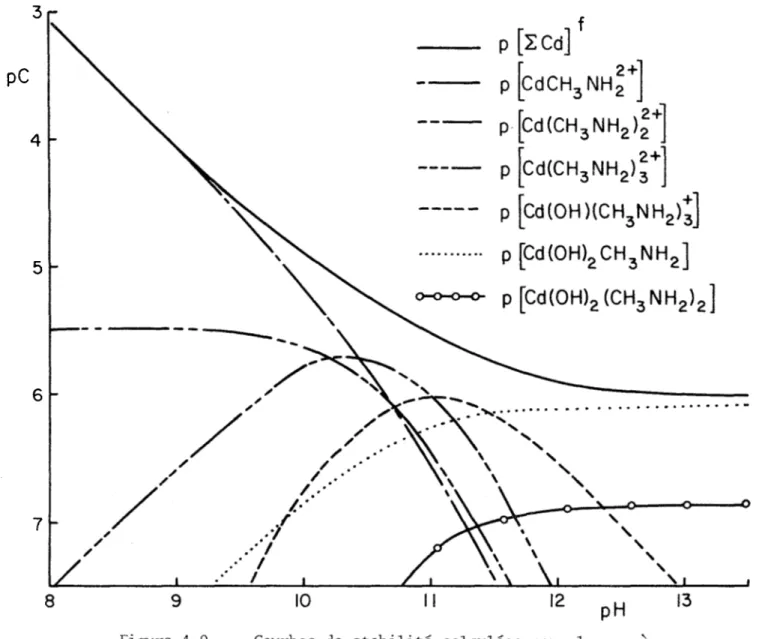
L'addition du cadmium attribuable à Cd2+ et aux espèces hydroxylées simples (équation (4-2)) à [ECd]^ donne les courbes représentées à la fi gure (4-3). De plus, 1'introduction des valeurs de [NII^] dans les équa tions (4-9) à (4-13) permet le calcul des courbes de formation indivi duelles des espèces identifiées. Ces dernières sont reproduites pour [ENHg] = 0.02M et 0.25M aux figures (4-5) et (4-6).
Discussion
a) Ammine-complexes
On remarque que les valeurs des constantes obtenues pour les espèces ammméessimples,log3g^ = 3.1, log - 5.2, log = 6.5 et log 3^ = 7.8, sont légèrement supérieures aux résultats publiés (18) et (39). Même si ces déterminations n'ont pas toutes été effectuées dans des conditions expérimentales identiques, cette différence peut être attribuée à la cor rection que nous avons apportée à la concentration du ligand en solution par 1'évaluation de puisque la diminution de [NH^] entraîne une augmentation des constantes de formation.
b) I ïydroxo-ammine-complexes
Bien que l'existence de complexes mixtes avec NH^ n'ait pas
été
pro posée ailleurs, nous sommes arrivés à identifier et à déterminer la cons tante de stabilité de l'espèce CdfOLf^NH^.56
13 pH 14
Figure 4-5. - Courbes de stabilité calculées pour les espèces13 pH 14
- Courbes de stabilité calculées pour les espècesidentifiées à [ENH7] = 0.25M. Figure 4-6.
58
C- Méthylamine- et hydroxo-méthylamine-complexes
Méthode expérimentale
Les solutions d’équilibre ont été préparées en ajoutant un excès connu de méthylamine à de 1'hydroxyde de cadmium préalablement précipité par NaOH.
Par la suite, une quantité déterminée de NaClO^ a été additionnée de façon à maintenir un milieu de force ionique unitaire et le pH a été ajusté à la valeur désirée. Nous pouvions donc écrire pour ces solutions:
[ZGH3NH21 = tM ,
[NaC104] = (l-r)M et [CH3NH2-HC104] = rM.
Selon la série, la valeur de t a été gardée constante à 0.05, 0.1M, 0.25 et 0.43M et la valeur de r a été calculée à partir du diagramme
logarithmique de concentrations de la méthylamine. La concentration totale de cadmium en solution étant toujours négligeable par rapport à [NaC104] et à [CH3NH2«MC104], nous n'en avons pas tenu compte dans le calcul de la force ionique.
Après 7 à 8 jours d'équilibre, ces solutions ont été analysées au moyen des méthodes utilisées lors de l'étude de 1'hydroxyde seul.
Résultats
Les résultats expérimentaux obtenus de l'étude de la solubilité de Cd(01I)2(s) en présence des différents excès de méthylamine sont présentés
pité demeure Cd^H)^. Par ailleurs, 1 ’augmentation de la concentration métallique en présence de mêthylamine indique la formation d'espèces con tenant ce ligand.
Identification des complexes
Afin de faciliter l'identification des espèces formées en présence de mêthylamine, nous avons soustrait de la concentration métallique totale
2+
déterminée en présence de CII^NI^, celle attribuable à Cd et aux espèces hydroxylées simples. Les valeurs résultantes, p[ZCd]^, représentant la solubilité des espèces aminées, apparaissent aux tableaux (4-7), (4-8),
(4-9) et (4-10) et à la figure (4-8).
Les courbes de la figure (4-8) présentent en milieu fortement alcalin des paliers indiquant la présence en solution d'espèces pour lesquelles x = 2 (tableau (1-2)). Dans la même région de pH, on observe une pente selon le pCECH^NI^] passant de (+1) à (+2). Cette dernière fixe la valeur de y à 1 et 2 et confirme l'existence des espèces CdfOlQ^CHgNHg) et Cd (OH) 2(01^ y %.
Dans la région située après le pkQ de CH^NH*, soit 10.70, et pour
-P
[ECH^NI^) = 0.25 et 0.43M, les variations de p[£Cd] par rapport au pli et au pCECH^NHg] sont respectivement de (+1) et de (+3). En introduisant ces valeurs dans les équations des pentes théoriques, on identifie l'espèce Cd(OH) (Q-I3NH2)y
Entre pH = 8.5 et 10 et aux faibles excès de ligand, les courbes de p[ECd]"^présententdes pentes de (+1) selon le pH et le pHEGI^NI^l. En
60
Tableau 4-7
Solubilité de CdCOH^Cs) en fonction du pH et en présence de CH-NHg 0.05M pH pClCd] pCZCd] 8.35 3.10 3.62 8.60 3.46 3.80 8.75 3.70 4.01 9.20 4.35 4.50 9.76 5.00 5.16 9.90 5.15 5.30 10.20 5.50 5.67 10.40 5.75 5.97 10.50 5.85 6.09 10.65 5.85 6.02 PH pCECd] p[ECd] 10.95 5.85 5.96 11.10 5.87 5.97 11.15 5.96 6.08 11.20 6.10 6.27 11.30 6.00 6.12 12.00 6.10 6.21 12.25 6.10 6.21 12.45 6.05 6.15 12.88 6.10 6.26 13.20 6.00 6.29
de CH3NH2 O.IM
Solubilité de Cd(OH) 2(s) en fonction du pH et en présence
PH p[£Cd] p[ECd] 8.75 3.40 3.53 9.00 3.80 3.91 9.15 4.00 4.10 9.40 4.35 4.44 9.50 4.40 4.47 9.60 4.53 4.60 9.70 4.53 4.59 9.75 4.56 4.61 10.00 4.86 4.91 10.25 5.00 5.04 10.50 5.15 5.16 10.75 5.40 5.44 pH p[ECd] p[ZCd] 11.00 5.48 5.52 11.15 5.40 5.43 11.30 5.45 5.48 11.45 5.55 5.58 11.65 5.67 5.71 11.75 5.80 5.85 11.95 5.80 5.85 12.20 5.92 5.99 12.35 5.95 6.05 12.70 5.92 6.00 12.85 5.97 6.08
62
Tableau 4-9
de CH3NH2 0.25M
Solubilité de CdfOH^Cs) en fonction du pH et en présence
pH p[ECd] p[£Cd] 8.10 2.57 — 8.60 3.08 3.19 9.35 3.80 3.83 9.50 3.91 3.93 9.60 4.00 4.02 9.72 4.00 4.01 9.85 4.23 4.25 10.00 4.24 4.25 10.05 4.24 4.25 10.40 4.40 4.40 10.60 4.40 4.40 10.85 4.54 4.54 11.05 4.50 4.50 11.15 4.50 4.50 pH p[ECd] p[ECd] 11.15 4.40 4.40 11.20 4.53 4.53 11.35 4.50 4.50 11.50 4.66 4.66 11.70 4.70 4.70 11.85 5.15 5.16 12.15 5.20 5.21 12.35 5.54 5.57 12.50 5.46 5.48 12.80 5.57 5.60 13.05 5.50 5.55 13.30 5.34 5.40 13.60 5.23 5.43 13.84 5.13
de CH3NH2 0.43M
Solubilité de CdCOH^Cs) en fonction du pH et en présence
pH p[£Cd] p[£Cd]f pH p[£Cd] pCZCd] 10.00 3.61 3.61 11.50 4.03 4.03 10.12 3.60 3.60 11.65 4.17 4.17 10.25 3.70 3.70 11.85 4.27 4.27 10.42 3.75 3.75 12.05 4.33 4.33 10.45 3.65 3.65 12.23 4.70 4.70 10.65 3.66 3.66 12.55 5.00 5.00 10.85 3.70 3.70 12.75 5.05 5.06 11.07 3.80 3.80 13.10 5.03 5.05 11.20 4.03 4.03 13.20 5.10 5.12 11.32 4.00 4.00 13.40 5.00 5.05
2
0.43 M
9
0.25 M
•
0.10 M
O 0.05 M
Figure 4-7. - Solubilité totale de Cd(0H)?(s) en fonction du pH et de [ZŒ^].
Cercles: résultats expérimentaux.
p
[2
C
d
]
JB__ O13 pH
Figure 4-8. - Solubilité différentielle de Gd(QH)?(s) en fonction du pH66
remplaçant y par sa valeur dans 1'équation (1-17), on obtient 2-x-l=l, où la valeur de x doit être nulle. L'espèce prédominante dans cette région est donc Cd(CH3IS]H2)2+.
Au pkQ, on observe une pente selon le pCZCH^NH^] passant de (+2) à (+3) indiquant la présence en solution de complexes contenant deux et trois
.p
molécules de mêthylamine. Dans l'autre dimension, la variation de p[ZCd] en fonction du pH montre que le domaine de prédominance de ces espèces est
2.
limité vers les pH plus acides par Cd(CH^NH^) et, vers les pH plus alca lins, par Cd(OH) Ces pentes de (+2) à (+3) selon le pCZCH^NH^] pourraient signifier les espèces: Cd(CH^NH^)2+, Cd(OH)(ŒLNH^t,
Cd(OH)2 (CH^NHg)2, Cd(CH3NH2)3 et Cd(OH) (Œ^NH^)Parmi ces complexes possibles, deux d'entre eux ont déjà été identifiés dans d'autres régions de la courbe de solubilité.
2~i~
L* espece Cd^CH^NH^)^ est caractérisée par la pente de (+3) selon le p[ZCH3NH2]. Entre Cd(CH3NH2)2+ et Cd(OH)(CH3NH2)2, nous devons choi
sir le complexe simple, car la pente selon le pH est égale ou supérieure à 0.
En résumé, si on précipite 1'hydroxyde de cadmium et qu'on le pla ce ensuite en présence de méthylamine, on trouve en plus de Cd2+ et des hydroxo-complexes simples, les espèces Cd(CH3NH2)2+, Cd(Œ3NH2)2+,
Cd(CH3NH2)2+, Cd(OH)(CH3NH2)3, Cd(OH)2 (CH^) et Cd(QH)2(Œ3NH )2_
Calcul des constantes
Les constantes de formation de ces complexes peuvent être calculées à partir des données expérimentales. En effet, on sait que:
+ [Cd(OH)2(CH3NH2)2]. (4-24)
A l'aide de et de Kg, on peut exprimer chacun de ces termes en fonc tion d'a^ et de [Cd(Œ3NH2)2+] = [Cd2+]CCH3NH2] BQ1 = R B01 [CI-^Niy, (4-25) [Cd(CH3NH2)2+] = [Cd2+][CH3NH2]2602 = R BQ2 [CH^]2 , (4-26) [Cd(CH3NH2)2+] [Cd2+]CCH3NH2]3B03 = R BQ3 [Oyfly3 , (4-27) [Cd(OH)(CH3NH2)3] = [Cd2+] aOHCCH3NH2]3ei3=313Ks0CCH3NH2]3KëlaH’ (4-28) CCd(OH)2(CH3NH2)] = [Cd2+] a^CCH^] ^21=^21^0^3^2^ (4-29) et [Cd(01I)2(CTI3NII2)2] = [Cd2+] a2H[ai3NH2]2B22=B22Ks0[CII3MI2]2, (4-30)
R
=
r
2et 0^ = B%y.
La concentration totale de mêthylamine en solution est donnée par la relation
[ZCH3NH2) = [CH3NH21 + [CH3NH3] + [Œ3NH2]liê. (4-31)
Le dernier terme de cette expression est négligeable puisque la solubilité du métal est toujours très faible comparativement à l'excès de
méthyl-68
amine en solution. On peut donc poser que
[GH3NH21 = [ZŒ3NH2] g(aH) = G1(aH). (4-32)
La valeur de k& introduite dans g(a^) est 2 x 10-11 (cf. chapi tre 3) .
En remplaçant [CH3NH2] par cette dernière équation dans les expres sions (4-25) à (4-30) et en posant Aq = [ECd]f , (4-33) A01 = R G1(3h) » (4-34) *02 = * ^(8%) , (4-35) *03 = * 5^(3%) , (4-36) *13 = ^0 ^ ' (4-37) *21=%s0 (4-38)
^ *22 = ^s0 ^ W '
(4-39)
1'équation (4-24) devient *0 = *01601 + *02^02 + *03^03 + *13^13 + *21^21 + *22^22' (4-40)Les résultats obtenus de chacune des solutions d'équilibre permet tent le calcul des coefficients A. Il est ensuite possible de former de nombreux systèmes de six équations à six inconnues dont la résolution four nit les valeurs des constantes de stabilité.
Les valeurs les plus probables des g à 25°C sont
log 813 = 9.1 (a = ±0.2), log e21 = 9.5 (a = ±0.2) et log $22 =9.7 (o = ±0.2).
L'addition de [£Cd]^, calculée à l'aide de ces constantes introduites dans 11 équation (4-40) , au cadmium attribuable à Cd2+ et aux espèces
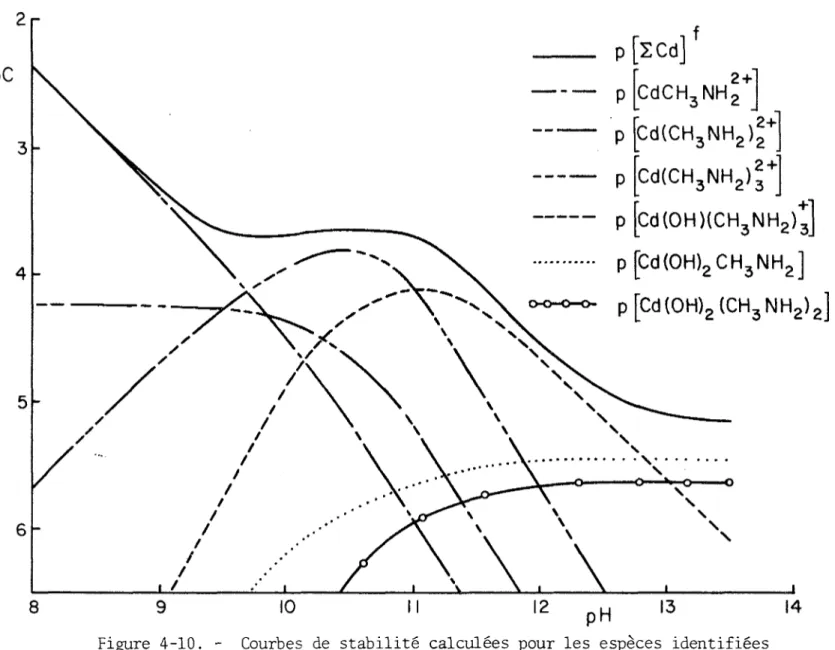
hydroxylées simples permet de tracer les courbes reproduites à la figure (4-7). Enfin, 1'insertion des valeurs des constantes de formation dans les équations (4-25) à (4-30) rend possible le calcul des courbes de sta bilité des espèces identifiées. Ces dernières sont présentées pour
[ECHgNHg] = 0.1 et 0.43M aux figures (4-9) et (4-10),
Discussion
a) Méthylamine-complexes
2 + Une étude de la stabilité des complexes formés entre l'ion Cd
et la méthylamine a été effectuée par Spike et Parry (40). Les constantes qu'ils attribuent aux espèces méthylaminées simples, log Bq^ = 2.74,
log $02= 4.8, log 8q3 = 5.93 et log 6^ = 6.54 à y = 0, correspondent à peu près aux nôtres.
La valeur extrapolée qu'ils accordent à la constante de formation de 1'espèce Cd(CH3NH2)^+ nous permet de confirmer que cette espèce ne peut prédominer dans les conditions expérimentales utilisées pour nos tra vaux.
b) Hydroxo-methylaxnine-complexes
Nous sommes les premiers à avoir identifié les espèces mixtes Cd(OH)(ai3NH2)J, Cd(OH)2(CH3NH2) et Cd(OH)2(GH3Nti2)2 et à avoir déter miné leurs constantes de formation.
Cd (OH)(CH,NH
Figure 4-10. - Courbes de stabilité calculées pour les espèces identifiées
METHYLAMINE- ET HYDROXO-METHYLAMINE-COMPLEXES DU CUIVRE EN EQUILIBRE AVEC CuOÇs).
Introduction
La littérature chimique (6), (18) et (42-45) présente de nom breuses études sur la solubilité de CuO(s). Cependant, les résultats pu bliés sont plus ou moins divergents dépendant des conditions expérimen
tales utilisées pour les obtenir. C'est pourquoi, il nous est apparu important de redéterminer le produit de solubilité de CuO et les cons tantes de formation des espèces hydroxylées simples dans des conditions expérimentales identiques à celles utilisées pour l'étude de la stabilité des méthylamine-complexes en équilibre avec CuO(s).
La détermination des constantes de formation des complexes du cuivre (II) avec la méthy lamine n'ayant pas fait l'objet de recherches an térieures devenait d'autant plus intéressante.
A- Hydroxo-complexes
Methode expérimentale
L'oxyde cuivrique, CuO, fut préparé par addition de NaOIi à une solu tion de perchlorate de cuivre.
Des fractions de ce solide humide furent ensuite placées dans des fioles jaugées et le pH de ces solutions contenant du NaClO. IM fut fixé approximativement avec HClO^ou NaOH, de façon à permettre l'étude des ré gions du pH où le précipité existe.
Trois semaines après la préparation, des échantillons de ces solu tions furent prélevés afin de déterminer la concentration totale de cuivre et de mesurer le pH.
L'analyse quantitative du cuivre fut réalisée par colorimétrie au moyen du réactif bis(hydroxyéthyl-2) dithiocarbamate, ou cuprethol, pré paré en additionnant à une solution de diéthanolamine (2% dans CH^OH) un volume égal d'une solution de CS^ (1.5% dans QI^OII).
Cette méthode, décrite par Woelfel (41), consiste à ajouter à un échantillon de 50 ml contenant entre 0.05 et 0.5 mg/1 de cuivre, 0.5 ml de HCl 6M et une quantité suffisante d'une solution saturée d'acétate de sodium pour obtenir un pH entre 5 et 6. Après cinq minutes, on introduit 1.0 ml de cuprethol. La densité optique de cette solution aqueuse est mesurée dans des cuvettes de 1 cm, dix minutes après 1'addition du réactif colorimétrique, à 435 nm par rapport à un témoin contenant les réactifs. La courbe d'étalonnage relative â cette méthode apparaît à la figure (5-1).
Densité
o
p
tiq
u
e
4 Cu mg/litre
76
Pour les concentrations métalliques inférieures à 10-6M, les échantillons des solutions à l’équilibre furent d’abord acidifiés et en suite concentrés par électrolyse sous une tension de trois volts pendant douze heures à la température de la pièce et avec agitation constante. Le cuivre déposé sur le fil de platine fut dissous dans l’acide nitrique 6M et sa détermination quantitative fut effectuée par la suite au moyen du cuprethol.
Résultats
Les données expérimentales obtenues de l'étude du système hétéro gène, solution-CuO(s), apparaissent au tableau (5-1) et à la figure (5-2). La courbe de solubilité présente des pentes de (+2), (0), (-1) et (-2) qui permettent d'identifier les espèces prédominantes possédant des char ges égales aux valeurs de ces pentes.
Identification des complexes
Dans la région de pente (+2), nous avons vérifié par des titrages potentiométriques si cette espèce de charge (+2) correspondait au complexe
Cu(Cu(OII)2)^-1 ou ^ l'ion Cu2+. A cet effet, nous avons titré des échan tillons de deux solutions en équilibre avec CuO(s). La technique utilisée est la même que celle employée lors de l'étude des hydroxo-complexes du cadmium (chapitre 4-A).
Les résultats présentés au tableau (5-2) montrent que les titrages des solutions contenant du cuivre coïncident, en dedans de 1’erreur expé rimentale, avec celui de NaClO. IM.
![Figure 4-7. - Solubilité totale de Cd(0H)?(s) en fonction du pH et de [ZŒ^].](https://thumb-eu.123doks.com/thumbv2/123doknet/3724310.111300/74.1192.107.1011.126.811/figure-solubilité-totale-cd-h-fonction-ph-zœ.webp)
![Figure 5-3. - Solubilité totale de CuO(s) en fonction du pH et de [ECTLNFL].](https://thumb-eu.123doks.com/thumbv2/123doknet/3724310.111300/99.1192.151.1026.132.820/figure-solubilité-totale-cuo-fonction-ph-ectlnfl.webp)