LISA BARIL-GRAVEL
ETUDE DE L'IMPACT DE DIFFERENTES HUILES
SUR LES BIOMARQUEURS INFLAMMATOIRES
CHEZ DES SUJETS À RISQUE DE MALADIES
CARDIOVASCULAIRES
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l'Université Laval dans le cadre du programme de maîtrise en nutrition
pour l'obtention du grade de Maître es sciences (M.Sc.)
DEPARTEMENT DES SCIENCES DES ALIMENTS ET DE NUTRITION FACULTÉ DES SCIENCES DE L'AGRICULTURE ET DE L'ALIMENTATION
UNIVERSITÉ LAVAL QUÉBEC
2012
RESUME
L'inflammation chronique de faible intensité, favorisée par un excès de tissu adipeux, est maintenant reconnue pour jouer rôle actif dans le développement des maladies cardiovasculaires (MCV). Plusieurs marqueurs inflammatoires tels la protéine C-réactive (CRP), l'interleukine-6 (IL-6), et l'adiponectine ont été associés avec le risque de MCV. Certains facteurs alimentaires semblent influencer les concentrations de marqueurs inflammatoires. Les études d'interventions cliniques contrôlées concernant l'effet des différents acides gras sur l'inflammation génèrent des résultats hétérogènes. Ce mémoire présente les résultats d'une étude d'intervention clinique contrôlée évaluant l'impact de différentes huiles sur les marqueurs inflammatoires de sujets à risque de MCV. Les résultats montrent que l'huile de canola enrichie en acide docosahexaénoïque (DHA), un acide gras polyinsaturé (AGPI) oméga-3 de source marine, entraîne une diminution d'IL-6 et une augmentation d'adiponectine comparativement à l'huile témoin. Les marqueurs inflammatoires ne semblent pas influencés par les acide gras monoinsaturés ou AGPI oméga-3 et -6 végétaux.
AVANT-PROPOS
Au cours de ma maîtrise, j'ai eu la chance de participer à la réalisation d'un important projet de recherche clinique en nutrition. Ce projet baptisé COMIT, ou FLAX pour les intimes, visait à étudier l'impact des huiles de lin et de canola dans la modulation de la fonction endothéliale et des facteurs de risque de maladies cardiovasculaires. Il s'agissait d'un ambitieux projet multicentrique en collaboration avec l'Université du Manitoba à Winnipeg, PennState University en Pensylvannie, ainsi que l'Université de Toronto. Ce projet d'intervention nutritionnelle entièrement contrôlé comportait un total de cinq diètes, de nombreux tests, plus de 130 participants, dont 58 sujets recrutés à l'INAF. Ma participation à ce projet m'a permis d'acquérir d'innombrables compétences, telles la gestion et suivi au quotidien d'un nombre important de participants, recrutement de sujets à un rythme effréné, gestion d'une cuisine, communication efficace dans une équipe et entre équipes distantes. C'est sans compter l'apprentissage humain et de moi-même à travers ce très grand défi que représentait ce projet. J'ai commencé à écrire cet avant-propos longtemps avant la fin de ma maîtrise dans le but de trouver les mots justes pour décrire mon expérience, et surtout pour accepter la fin de ma maîtrise. Je me souviendrai longtemps des personnes autour de moi pendant cette belle aventure.
Je tiens tout d'abord à remercier mon directeur Benoît Lamarche. Benoît m'a fait découvrir la recherche scientifique pendant mes études au baccalauréat et a allumé une petite flamme pour la recherche, qui s'est traduit en une volonté de fer à réaliser une maîtrise. Merci pour ta confiance, ton accueil chaleureux, ton support et ta motivation contagieuse. Merci pour ta disponibilité surhumaine parfois, et de m'avoir offert de si belles opportunités. Faire parti de la Team Lamarche a été un plaisir! Merci à Dr Patrick Couture, mon co-directeur, pour son rôle omniprésent pendant la réalisation du projet.
Amélie Charest. Je t'écrirais un mémoire de remerciements. Tu es vraiment tombée du ciel à mes yeux il y a trois ans. Merci pour ton dévouement, ta grande expérience, et ton aide
s'embarquer dans ce projet avec Amélie? Jamais, jamais, jamais, nous n'aurions réussi à réaliser ce projet sans toi. Merci pour ton dynamisme, ton énergie, ton travail acharné, ton amitié. Je vous aime pas mal les filles!
Pour leur généreuse aide dans les moments difficiles, un grand merci à Iris Gigleux et Emilie Lacroix. Pour son savoir et son organisation ingénieuse, ainsi que sa patience, je remercie Johanne Marin, sans qui la gestion des échantillons aurait été impossible. Je remercie Marie-Ève Paradis pour son dévouement à la coordination et aux communications de COMIT entre les équipes. Je remercie les infirmiers, Steeve Larouche, Danielle Aubin, Myriam Bouchard, qui ont côtoyé, charmé et pris soin de nos participants et de nous pendant cette année très chargée. Je remercie grandement Caroline Richard et Marie-Ève Labonté pour leurs conseils et leur aide au niveau des analyses statistiques et détails techniques de tous les jours. Je remercie du fond de mon cœur les indispensables et merveilleuses techniciennes dans la cuisine métabolique, Sandra Gagnon, Stéphanie Ouellet, Marie-Pier Devost, Emilie Martel, Catherine Blouin. Merci de votre excellent travail rapide et précis, ainsi que de votre patience face à nos demandes spéciales. J'ai passé des moments merveilleux en votre compagnie (et celle de vos bedainesl). Merci à notre petite armée d'étudiants, 16 au total, ayant travaillé périodiquement avec nous pendant la réalisation du projet. Vous étiez pas mal uniques et magnifiques!
Je désire remercier chaleureusement tous les participants de FLAX qui ont généreusement accepté d'embarquer avec nous dans ce monstre. Ils ont été exceptionnellement disponibles, patients, méticuleux et dévoués. Certains sont devenus des amis et m'ont appris énormément. Merci!
Un merci tout joyeux à ma « Team méthode » : Audrey Cyr, Catherine Dufour et Éliane Morissette, pour tous les moments de plaisir! Grace à elles, je ne me suis jamais sentie seule. Merci à mes amis, ma famille, mon copain et mes parents pour leur amour et soutien!
Pour ma grand-maman, Alice Richard-Baril
TABLE DES MATIERES
RÉSUMÉ m AVANT-PROPOS V
TABLE DES MATIÈRES IX LISTE DES TABLEAUX XI LISTE DES FIGURES XIII LISTE DES ABBREVIATIONS XV
CHAPITRE I : INTRODUCTION GÉNÉRALE 1
CHAPITRE II : PROBLÉMATIQUE 3 1. LES MALADIES CARDIOVASCULAIRES 3
1.1 Prévalence et conséquences 3 1.2 Facteurs de risque traditionnels 3 1.3 Le syndrome métabolique 4
2. L'INFLAMMATION 4 2.1 Rôle du tissu adipeux dans le développement de l'inflammation 5
2.2 L'inflammation dans le développement de l'athérosclérose 7
2.2.1 Rôle des lipoprotéines dans l'athérosclérose 8
2.3 Biomarqueurs inflammatoires 9 2.3.1 Protéine C-réactive 10 2.3.2 Interleukine-6 11 2.4.2 Adiponectine 12 2.3.3 Autres biomarqueurs inflammatoires 13
2.4 Différents facteurs modulant l'inflammation 13 3. LES ACIDES GRAS DE L'ALIMENTATION ET LEURS IMPACTS 14
3.1 Les acides gras polyinsaturés (AGPI) 15 3.1.1 Acide éicosapentaénoïque et acide docosahexaénoïque (EPA/DHA) 16
3.1.1.1 EP A/DHA et risque de MCV 17 3.1.1.2 EPA/ DHA et les lipides sanguins 17 3.1.1.3 EPA/DHA et l'inflammation 18
3.1.2 Acide alpha-linolénique 19
3.1.2.1 ALA et le risque de MCV 19 3.1.2.2 ALA et les lipides sanguins 20 3.1.2.3 ALA et l'inflammation 20
3.1.3.3 Acide linoléique et l'inflammation 23
3.1.4 Mécanismes des AGPI dans l'inflammation 24
3.2 Les acides gras monoinsaturés 25 3.2.1 Les acides gras monoinsaturés et le risque de MCV 26
3.2.2 Les acides gras monoinsaturés et les lipides sanguins 26 3.2.3 Les acides gras monoinsaturés et l'inflammation 27
3.3 Les acides gras saturés 27 3.3.1 Les acides gras saturés et le risque de MCV 28
3.3.2 Les acides gras saturés et les lipides sanguins 28 3.3.2 Les acides gras saturés et l'inflammation 28
3.4 Les acides gras trans 29
3.5 Le cholestérol 30
4. OBJECTIFS ET HYPOTHÈSES 31 CHAPITRE III : IMPACT DE DIFFÉRENTES HUILES SUR LES CONCENTRATIONS
PLASMATIQUE DE BIOMARQUEURS INFLAMMATOIRES ET D'ADIPONECTINE : UNE
ÉTUDE CLINIQUE CONTRÔLÉE RANDOMISÉE EN CHASSÉ-CROISÉ À DOUBLE-INSU 33
RÉSUMÉ 34 TITLE PAGE 35 ABSTRACT 36 INTRODUCTION 37 SUBJECTS AND METHODS 38
RESULTS 43 DISCUSSION 45 REFERENCES 50 TABLES AND FIGURES 54
FIGURE LEGEND 58
CHAPITRE IV : CONCLUSION 61
LISTE DES TABLEAUX
Tableau 1. Critères diagnostiques du syndrome métabolique selon 1TDF. Tableau 2. Catégories de risque de MCV en fonction de la valeur de CRP.
LISTE DES FIGURES
Figure 1. Impact du tissu adipeux et rôle dans le développement de l'inflammation et des maladies cardiovasculaires.
Figure 2. Représentation schématisée du développement de l'athérosclérose dans la paroi d'une artère.
Figure 3. Proportions des acides gras de différentes huiles végétales et d'une huile d'origine marine.
Figure 4. Processus d'élongation des acides gras polyinsaturés.
Figure 5. Mécanismes par lesquels les acides gras oméga-3 influencent la production de molécules inflammatoires via l'activation des PPAR.
LISTE DES ABBREVIATIONS
AA : Acide arachidoniqueALA : Acide alpha-linoléique AGMI : Acides gras mono-insaturés AGPI : Acides gras polyinsaturés AGS : Acides gras saturés
AGT : Acides gras trans
AÉT : Apport énergétique total
CRP: Protéine C-réactive (C-reactiveprotein)
DB2 : Diabète de type 2
DHA : Acide docosahéxaénoïque (Docosahexaenoic acid) EPA : Acide éicosapentaénoïque (Eicosapentaenoic acid) HDL : Lipoprotéines de haute densité (High density lipoproteins)
Hs-CRP: Protéine C-réactive de haute sensibilité (High sensitivity C-Reactive protein) IDF: Fédération internationale du Diabète (International Diabetes Federation)
IL-6: Interleukine-6 IL-8 : Interleukine-8
ry
IMC : Indice de masse corporelle (kg/m )
INAF: Institut des nutraceutiques et aliments fonctionnels
LA : Acide linoléique (Linoleic acid)
LDL : Lipoprotéines de faible densité (Low density lipoproteins)
MCV : Maladies cardiovasculaires MMPs : Métalloprotéinases matricielles
NCEP ATP III: National Cholesterol Education Program Adult Treatment Panel III PPAR: Récepteur activé par les proliférateurs de peroxyxomes (Peroxyxomes
proliferator-activated receptors)
SynMet: Syndrome métabolique
TNFa : Facteur nécrosant de tumeur-a (Tumor necrosis factor-a)
TG : Triglycérides
VCAM: Molécule d'adhésion des cellules vasculaires ( Vascular cell adhesion molecule)
CHAPITRE I : Introduction générale
Les maladies cardiovasculaires (MCV) représentent 29 % de la mortalité au Canada et sont la deuxième cause de décès après le cancer (1, 2). Le développement progressif de l'athérosclérose sur des décennies est une composante importante de leur incidence (3, 4). Il est maintenant reconnu que le taux de lipides sanguins n'est pas le seul joueur impliqué dans la progression de l'athérosclérose, l'inflammation systémique de faible niveau jouerait aussi un rôle proéminent dans la pathogénèse des MCV(3). L'inflammation est un processus de défense du corps normalement autorégulé, s'étant ajouté comme facteur permettant de mieux préciser le risque de MCV. De nombreuses études ont observé une association positive entre certains marqueurs inflammatoires et l'incidence de MCV. La protéine C-réactive (CRP) et l'interleukine-6 (IL-6) sont des marqueurs inflammatoires fréquemment mesurés dans les études cliniques et associés au risque de MCV (5). Bien que controversée, certaines organisations recommandent la mesure en pratique clinique de la CRP dans l'évaluation du risque de MCV (6).
On estime que neuf canadiens sur dix présentent un facteur de risque de MCV (1), l'obésité étant un de ces facteurs de risque majeur. Le tissu adipeux, présent en quantité excessive chez les personnes obèses, est reconnu pour être un tissu actif sécrétant de nombreuses molécules (7). L'adiponectine est une hormone circulante exclusivement produite par le tissu adipeux dont la présence est inversement liée à plusieurs facteurs de risque de MCV (8). De plus, le tissu adipeux jouerait un rôle dans l'inflammation systémique de faible niveau par la sécrétion de cytokines inflammatoires (7).
La qualité de l'alimentation est connue comme un facteur de protection des MCV (6). On considère généralement que les acides gras saturés (AGS) et trans (AGT) sont associés à des effets délétères sur les facteurs de risque de MCV. Les acides gras monoinsaturés (AGMI) quant à eux ont été associés à des effets bénéfiques sur certains facteurs de risque de MCV. Les acides gras polyinsaturés (AGPI), de type oméga-6 et oméga-3, diffèrent par leurs structures, mais semblent être protecteurs des MCV. Les AGPI oméga-3 d'origine
possiblement dans leurs effets sur l'inflammation. Toutefois, les études d'intervention sont peu nombreuses et contradictoires concernant l'impact d'apports élevés en oméga-3 d'origine marine ou végétaux sur les différents marqueurs de l'inflammation et l'adiponectine. De plus, les résultats et méthodes sont hétérogènes. Dans le même ordre d'idée, peu d'études d'intervention contrôlées se sont intéressées au véritable effet de l'acide linoléique (LA) ainsi que l'acide oléique sur les différents marqueurs inflammatoire, et ce dans un contexte isoénergétique entièrement contrôlé.
Cette étude fait partie d'un projet de recherche multicentrique, l'étude COMIT (Canola OU Multicenter Intervention Trial) ayant comme objectifs généraux d'investiguer les effets des huiles de canola et de lin sur la fonction endothéliale et les biomarqueurs du risque de MCV. L'objectif spécifique de ce projet de maîtrise était d'évaluer les effets de différentes huiles sur les certains biomarqueurs inflammatoires ainsi que sur l'adiponectine chez des sujets à risque de maladies cardiovasculaires. Cinq huiles avec des profils en acides gras différents ont donc été étudiées dans le contexte d'une étude d'intervention nutritionnelle strictement contrôlée. Cette étude a été réalisée à l'unité d'investigation clinique de l'Institut des nutraceutiques et aliments fonctionnels (INAF) à l'université Laval ainsi qu'à l'université du Manitoba à Winnipeg, à la PennState University en Pennsylvannie, et des analyses ont été effectuées à l'Hôpital St-Michael's à Toronto.
Le présent mémoire est divisé de la façon suivante. Suite à l'introduction, le deuxième chapitre présentera la problématique générale. Il y sera discuté des MCV, de l'inflammation, des différents facteurs de risque de MCV et marqueurs de l'inflammation. Les acides gras retrouvés dans l'alimentation seront présentés, ainsi que les évidences actuelles concernant leurs effets sur le risque de MCV, le profil lipidique et l'inflammation. Le troisième chapitre consiste en un article scientifique rédigé suite aux résultats de ce projet de recherche. Cet article présente en détail la méthodologie de l'étude, ainsi que les principaux résultats. Le quatrième chapitre discutera des résultats de l'étude réalisée et de l'apport aux connaissances. Finalement, les perspectives de recherche seront abordées en guise de conclusion.
CHAPITRE II : PROBLEMATIQUE
1. LES MALADIES CARDIOVASCULAIRES
1.1 Prévalence et conséquencesLes MCV représentent la deuxième cause de mortalité ainsi qu'un fardeau économique important pour la société. Au niveau mondial ainsi qu'au canada, les MCV représentent environ 30 % de toutes les causes de mortalité et justifient à 15,8 % des hospitalisations (1, 9). Environ 5 % des adultes canadiens vivent avec un diagnostic de MCV. La mortalité suite aux MCV n'a que tout récemment commencé à diminuer au Canada suite à une meilleure prise en charge et aux changements des habitudes de vie. Toutefois, dans le contexte d'une population vieillissante et considérant qu'une personne sur deux présente un surpoids ou de l'obésité, l'Agence de santé publique du Canada mentionne que les efforts de prévention sont à poursuivre. En termes de coûts, les MCV représentent des pertes de plus de 22,2 milliards de dollars au Canada, dont 7 milliards sont dépensés en soins de santé. Les conséquences des MCV au Canada sont principalement en termes de vie humaine, mais aussi au niveau de la perte de fonction et d'autonomie, perte de productivité, coûts directs et indirects à la société.
1.2 Facteurs de risque traditionnels
Plusieurs éléments sont bien établis comme étant des facteurs de risque importants de MCV. Les habitudes de vie peuvent avoir un impact sur certains facteurs de risque que l'on qualifie comme étant modifiables tels : l'obésité, le tabagisme, une mauvaise qualité alimentaire, l'inactivité physique, une consommation excessive d'alcool, des taux abaissés de HDL, l'hypertriglycéridémie, l'hypercholestérolémie, l'hypertension artérielle ainsi que la présence de diabète de type 2 (DB2) (10). Toutefois, d'autres facteurs de risque sont non-modifiables, soient : l'âge, le sexe, l'hérédité.
Le syndrome métabolique (SynMet) est décrit comme étant une constellation d'anomalies métaboliques reliée à l'incidence de MCV et DB2 (11). Différentes définitions du syndrome métabolique ont été proposées par l'Organisation mondiale de la santé, le NCEP ATP III et la Fédération internationale du diabète (IDF). Les critères du syndrome métabolique selon 1TDF sont présentés dans le tableau ci-dessous. Le SynMet représente un outil pratique et intéressant pour détecter facilement les personnes à risque de MCV. En effet, une méta-analyse révèle que le SynMet est associé à une augmentation du risque, soit un risque relatif de mortalité totale de 1,35, d'incidence de MCV de 1,53 et de mortalité par MCV de 1,74 (12). Selon 1TDF, le SynMet est caractérisé par la présence d'une obésité abdominale, soit une circonférence de taille au-delà de 94 et 80 cm pour les hommes et femmes respectivement, ainsi que la présence d'au moins deux des autres anomalies métaboliques. Les critères et valeurs précises sont présentés dans le tableau 1.
Tableau 1. Critères diagnostiques du syndrome métabolique selon 1TDF (13).
Définition : Circonférence de tailh ; élevée + au moins 2 autres critères atteints. Circonférence de taille * Homme : > 94 cm Femme : > 80 cm
Triglycérides > 1,7 mmol/L Glycémie à jeun > 5,6 mmol/L
HDL Homme : < 1,03 mmol/L Femme : < 1,29 mmol/L Tension artérielle Systolique > 130 mmHg Diastolique > 85 mmHg
* La valeur seuil de circonférence de taille est déterminée selon l'ethnie. Valeurs présentées pour population caucasienne européenne.
2. L'INFLAMMATION
L'inflammation est un processus naturel de défense du corps humain. Un processus inflammatoire aigu sera déclenché en réponse à une infection ou agression physique entraînant des élévations importantes de certains molécules circulantes, nommés aussi biomarqueurs inflammatoires (14). Outre l'inflammation aiguë, on peut retrouver des processus inflammatoires pathologiques dans lesquels il y a perte de contrôle de la
régulation (ex. maladies auto-immunes, arthrite rhumatoïde, maladies intestinales inflammatoires). De plus, on reconnaît maintenant l'existence de l'inflammation chronique de faible intensité (low grade systemic inflammation). L'inflammation chronique de faible intensité est caractérisée par une élévation chronique des marqueurs inflammatoires en circulation (3) et serait présente chez ceux atteints de maladies coronariennes, diabète de type 2 (DB2), ou du SynMet (5).
L'athérosclérose est un processus complexe impliquant beaucoup d'acteurs. Cette section présentera en premier lieu le rôle du tissu adipeux dans le développement de l'inflammation chronique. En deuxième lieu, le mécanisme de l'athérogenèse sera décrit en ciblant le rôle de l'inflammation. Les différents marqueurs inflammatoires seront revus, ainsi que le rôle des lipides sanguins dans le développement des MCV.
2.1 Rôle du tissu adipeux dans le développement de l'inflammation
L'obésité est caractérisée par une accumulation excessive de tissu adipeux (15). Le tissu adipeux est de plus en plus reconnu pour son rôle dans le développement des maladies cardiométaboliques ainsi que pour son rôle pro-inflammatoire. L'inflammation chronique de faible intensité serait la clé reliant l'excès de tissu adipeux et les complications cardiométaboliques telles que la résistance à l'insuline et l'athérosclérose (14). La figure 1 illustre les nombreuses interactions entre les différents organes impliqués dans le développement des maladies cardiovasculaire et le tissu adipeux. On sait maintenant que le tissu adipeux est un tissu actif sécrétant entre autres des hormones, dont l'adiponectine, et la leptine, ainsi que des médiateurs inflammatoires, telles des cytokines, chémokines et protéines de phase aigûe. Tel qu'illustré dans la figure 1, il a été démontré que les macrophages ont la capacité d'infiltrer le tissu adipeux. Les auteurs d'une étude ont observé que le tissu adipeux viscéral de sujets obèses présentait une quantité plus importante de macrophages que celui de sujets minces (16). Aussi, le tissu adipeux viscéral abdominal avait une production plus importante de cytokines et chémokines (17) ce qui en ferait le tissu adipeux le plus nuisible comparativement au tissu adipeux sous-cutané. Les cellules du système immunitaire seraient recrutées initialement auprès des adipocytes afin de se
les macrophages présents peuvent se différencier en deux types, soit ceux de type Ml (classiques) ou M2 (alternatifs). La différenciation en macrophages Ml est stimulée par la présence d'AGS ou de bactéries, tandis que la différenciation en macrophages de type alternatif est stimulée par les AGPI. Les macrophages de type Ml participeraient activement à la sécrétion de molécules pro-inflammatoires. Finalement, les adipocytes, plus nombreux et volumineux chez un sujet obèse, peuvent individuellement sécréter des molécules pro-inflammatoires tels que le facteur de nécrose tumorale (TNFa), IL-6, IL-1, IL-8, IL-18, prostaglandines E2, MCP-1 (7, 18).
Les mécanismes par lesquels l'inflammation causerait des dommages sont connus. Une augmentation de l'inflammation est associée à une augmentation concomitante de la résistance à l'insuline (14). Les médiateurs de l'inflammation auraient la capacité d'altérer le fonctionnement des cascades de signalisation de l'insuline dans les cellules (19). La résistance à l'insuline a comme conséquences une augmentation du glucose et des acides gras en circulation. Au niveau vasculaire, la présence d'un taux anormalement élevé de glucose entraîne des dommages à la paroi endothéliale favorisant la progression des MCV.
Figure 1. Impact du tissu adipeux et rôle dans le développement de l'inflammation et des maladies cardiovasculaires.
I
Fonctions card iovasculaires Tension artérielle î fonction endothéliale i coagulation T Stimulation -\ Inhibition Inflammation Muscle Adiponectine TNFa IL6 MCP-1 Foie£*
Excès de tissu adipeux S e n s j b j N t e à
l'insuline 4
Pancréas
Macrophages
Adipocytes
2.2 L'inflammation dans le développement de l'athérosclérose
Le processus du développement de l'athérosclérose dans les vaisseaux sanguins se nomme athérogénèse. L'athérogénèse se décrit brièvement comme étant un long processus silencieux résultant en un épaississement et durcissement de la paroi des artères du corps, une accumulation de lipides dans la paroi, suivi d'un rétrécissement de la lumière artérielle pouvant mener à une rupture de la plaque et formation de caillots sanguins (3, 4). La figure 2 montre les différentes étapes marquant le développement de l'athérosclérose dans les vaisseaux sanguins. Les prochains paragraphes de cette section décriront le fil des événements.
Figure 2. Représentation schématisée du développement de l'athérosclérose dans la paroi
Initiation de l'athérome
Plaque vulnérable 'f • Accumulation de Ipidevu J Î W j l
• Capuchon fibreux mince ' •Cellules inflammatoires nombreuses d'une artère. h f r r a M«di.i Advertitia / ■■ / Plaque stabilisée ' • Faible accumulation de lipides. • Capuchon fibreux épais /•Grande lumière artérielle
Guérisonde la rupture • Lumière rétrécie •Intima fibreuse
Rupture de la p l a q u e ' \ ^ J ^ ' ' 4 Formation dun caillot
•
L'athérosclérose est initiée à la surface de la couche de cellules endothelials recouvrant la surface intérieure des vaisseaux (20). Tout d'abord, les cellules endothelials produisent des molécules d'adhésion cellulaire, telle VCAM-1 ou ICAM, facilitant l'attachement des cellules du système immunitaire (Monocytes et lymphocytes T) circulantes (21, 22). La sécrétion de ces molécules d'adhésion est entres autres stimulée par certaines facteurs de risque tels l'hyperlipidémie et l'hypertension artérielle (20) ainsi que par des cytokines inflammatoires (23). Le déplacement des leucocytes recrutés sur 1'endothelium est accéléré par des molécules d'attraction chimique (ex. MCP-1, IL-8)(3). Parallèlement au recrutement des leucocytes, des changements au niveau de la couche de cellules endothéliale facilitent le passage de particules (ex. lipoprotéines de faible densité (LDL)) vers l'intérieur de la paroi artérielle (24). C'est à cet endroit que les particules LDL seront modifiées. Éventuellement, les monocytes recrutés se différencieront en macrophages capable de capter les LDL modifiés. Ces macrophages formeront des cellules spumeuses et sécréteront plusieurs molécules, dont certaines cytokines inflammatoires (25) et des métalloprotéinases matricielles (MMPs) (26). Le développement de la plaque se poursuit par une migration de cellules musculaires lisses de la paroi externe du vaisseau vers l'intima. Ces cellules musculaires lisses forment alors une couche fibreuse (capuchon fibreux tel qu'illustré sur la figure 2) au-dessus de la strie lipidique.
Les manifestations cliniques importantes de l'athérosclérose apparaîtront majoritairement lorsque qu'il y aura rupture de la couche fibreuse, constitué de cellules musculaires lisses, de cellules endothéliales et d'une matrice de collagène (3). La présence de MMPs, produites par les cellules spumeuses, favorise la friabilité de la couche fibreuse et augmente donc le risque de rupture (26). Cette rupture engendrera la formation d'un caillot qui ira se loger dans un vaisseau périphérique ou bloquant une artère irrigant le cœur causant une ischémie cardiaque et autres manifestations cliniques.
2.2.1 Rôle des lipoprotéines dans l'athérosclérose
Les anomalies du métabolisme des lipides constituent un facteur de risque traditionnel important de MCV. L'étude internationale LNTERHEART a démontré que le tabac et
l'hyperlipidémie étaient les deux plus importants facteurs de risque de MCV au niveau mondial (10). Les lipoprotéines de très faible densité (VLDL) sont produites au foie et contiennent en majorité des triglycérides (TG) et une petite proportion de cholestérol. Les LDL sont issues de l'hydrolyse des VLDL et la majeure partie des lipides qu'elles transportent sont des esters de cholestérol. Le rôle des LDL est de desservir les différents tissus en cholestérol (27). Les LDL et le cholestérol total sont des facteurs importants de risque de MCV (28). Un taux plasmatique de LDL plus élevé que 4,15 mmol/L a été associé à un risque relatif augmenté d'événements cardiaques de 1,74 et 1,68 chez les hommes et les femmes de la Framingham Heart Study (29). Tel que présenté précédemment, les LDL pénètrent dans la paroi artérielle et sont captées par les macrophages. Différents processus contribuent à la formation de LDL oxydées qui favorisent l'inflammation (30). On retrouve aussi dans la circulation les lipoprotéines de haute densité (HDL) qui participent au transport inverse du cholestérol et sont considérées comme ayant un rôle protecteur des MCV. Une étude longitudinale auprès de 12 000 personnes initialement non atteintes de MCV, a montré que les HDL sont inversement associées au risque relatif de MCV sur 10 ans, indépendamment des autres lipides sanguins (31). De plus, un faible niveau de HDL serait aussi associé à des concentrations plus élevées de la molécule inflammatoire TNFa (32). Finalement, on peut aussi mesurer la quantité de TG présents dans la circulation (33). Une hypertriglycéridémie reflète une anomalie au niveau du métabolisme des lipides (33). Des études ont montré qu'un taux de TG élevé a été associé à un risque significatif de MCV (34, 35), tandis que d'autres études n'ont pas observé d'associations indépendantes (36).
2.3 Biomarqueurs inflammatoires
Plusieurs marqueurs inflammatoires peuvent être examinés dans le contexte de l'étude de l'inflammation. Toutefois, dans le contexte de ce mémoire ils ne seront pas tous examinés en détail. Une attention spécifique sera portée à la CRP, IL-6 et l'adiponectine puisque ce sont les marqueurs mesurés dans l'article issus de ce projet.
2.3.1 Protéine C-réactive
La CRP est un marqueur systémique de phase aiguë de l'inflammation. La production et sécrétion de cette protéine au foie sont régulés par la présence de cytokines inflammatoires, dont 1TL-6 (37). Au niveau méthodologique, il a été démontré que le dosage à haute sensibilité était la méthode la plus appropriée pour la mesure de la CRP (37). Des niveaux plus élevés de CRP ont été observé en lien avec l'IMC (18), le tissu adipeux viscéral et sous-cutané (38), ainsi que la présence du SynMet (39).
Tableau 2. Catégories de risque de MCV en fonction de la valeur de CRP (40).
Estimation du risque CRP Faible < 1 mg/L
Intermédiaire > 1 à < 3 mg/L Élevé > 3 mg/L Évaluation clinique requise pour autre > i Q mg/L
condition médicale
Plusieurs études ont fortement associé la CRP avec le risque de MCV(41, 42). Dans la première étude longitudinale étudiant ce marqueur, la CRP était positivement corrélée au risque de mortalité cardiovasculaire chez des sujets fumeurs à haut risque de MCV (43). En outre, une étude prospective chez 15 000 femmes de plus de 45 ans et en santé, a estimé un risque relatif augmenté d'événements cardiovasculaires de 2,38 et 2,98 chez les femmes ayant une CRP dans les 4e et 5e quintiles (médiane de 2,93 et 6,62 mg/L respectivement)
(44). De plus, des taux élevés de cholestérol non-HDL, d'apolipoprotéine-BlOO, des ratios cholestérol total : HDL ainsi que d'apoB : apo-Al élevés représenteraient un risque relatif additionnel chez des sujets présentant une CRP dans le tertile supérieur, comparativement à ceux ayant un CRP plus basse. Des auteurs appuient l'idée que la CRP augmente la précision dans l'estimation du risque de MCV. Le tableau 2 ci-haut décrit la classification du risque selon la valeur de CRP. Dans une cohorte multiethnique de 1250 hommes et femmes, il a été montré que 22 % des personnes initialement catégorisé à faible risque de MCV (< 10 % selon le calcul du risque de Framingham) présentaient une valeur de CRP > 3 mg/L (45), les classant plutôt à risque élevé (40). Selon cette analyse, la mesure de la
11
CRP permettrait une classification plus adéquate du risque de MCV. La grande étude d'intervention JUPITER a suivi pendant 2 ans environ 17 000 hommes et femmes présentant des taux de LDL inférieurs aux recommandations, mais avec une CRP > 2 mg/L, qui ont reçu une statine ou un placebo (46). Chez ces sujets à faible risque de MCV selon les critères traditionnels (<10% de risque selon Framingham), mais présentant une élévation de la CRP, les auteurs ont observé une diminution du risque de MCV suite à la prise de la statine. Cette étude soulevait que la prévention auprès de personnes présentant une CRP élevée entraîne un effet bénéfique sur leur risque de MCV. Bien que la CRP soit souvent associée au risque de MCV, certaines études mentionnent que sa mesure ajoute peu à la prédiction de l'incidence de MCV (42, 47, 48), puisque la CRP est aussi associée au sexe, à l'âge, l'hypertension artérielle, LDL, HDL et au DB2 (47). De plus, les plus récentes mises à jour des lignes directrices de la Société canadienne de cardiologie ne recommandent plus la mesure systématique pour tous de la CRP dans l'estimation du risque(49).
2.3.2 Interleukine-6
L'interleukine-6 (IL-6) est une cytokine inflammatoire ayant de multiples fonctions. Elle est produite par les cellules T, les macrophages, les cellules endothéliales ainsi que par le tissu adipeux. L'un de ses rôles est de propager la réponse inflammatoire, entre autre par la stimulation de la production hépatique de la CRP (37). LTL-6 a été associée à la quantité de tissu adipeux viscéral et sous-cutané, ainsi qu'à l'IMC (18, 38). Aussi, de grandes quantités d'IL-6 sont retrouvées dans l'athérome (50). Une analyse de l'étude Physicians' Health Study démontre une association entre les concentrations d'IL-6 et le risque d'infarctus du myocarde chez des sujets à risque de MCV (51). Cette association était significative même après ajustement pour différents facteurs de risque traditionnels. Plusieurs autres études ont associé des niveaux élevés d'IL-6 avec un risque augmenté d'événements cardiovasculaires (52, 53). Une étude prospective cas-témoin a montré que différents marqueurs de l'inflammation (CRP, IL-6, fibrinogène) étaient prédicteurs du risque d'un premier événement coronarien, 1TL-6 semblait même être plus discriminatoire des sujets à risque que les autres marqueurs (41). Dans la cohorte de 4500 hommes de l'étude cardiovasculaire de Québec, les auteurs montrent qu'un score de l'inflammation
incluant 1TL-6 et le fibrinogène permet d'améliorer la capacité de prédiction du risque de MCV (53).
Ainsi, la CRP et 1TL-6 ont souvent été associées au risque de MCV dans les études épidémiologiques. Toutefois, les études d'intervention dans le but d'abaisser ces marqueurs par les habitudes de vies ne sont pas toujours concluantes. Une étude d'intervention chez des hommes adultes légèrement hypercholestérolémiques n'a pas montré d'effet bénéfique de changements de l'alimentation et de l'activité physique sur 1TL-6 et la CRP (54, 55). Dans cette étude d'une durée de 6 mois, 157 hommes étaient assignés à l'une des quatre interventions (n=40/groupe), soient : une intervention ciblant l'amélioration de l'alimentation, une seconde intervention ciblant l'augmentation de l'exercice physique, une troisième combinant une saine alimentation avec l'exercice physique, et un groupe témoin ne recevant aucun conseil. Malgré une diminution de l'IMC et une réduction du risque de MCV, aucun changement n'a été observé au niveau de la CRP et 1TL-6, et ce pour toutes les interventions.
2.4.2 Adiponectine
L'adiponectine est une protéine exclusivement sécrétée par le tissu adipeux faisant partie de la famille des adipokines. À l'opposé de la CRP et de 1TL-6, l'adiponectine est inversement associée au risque de MCV. Les concentrations d'adiponectine sont généralement plus élevées chez les femmes que les hommes (56). Des concentrations inférieures sont observées chez des sujets obèses (57), avec le SynMet (57) et DB2 (58). Au niveau populationnel, des concentrations basses d'adiponectine ont été associées à un risque accru de MCV (59), mais une absence d'association a aussi été rapportée (60). L'adiponectine aurait un effet anti-inflammatoire par son action inhibitrice du récepteur nucléaire NF-KP,
ce dernier modulant l'expression de plusieurs médiateurs inflammatoires au niveau cellulaire (61). L'adiponectine aurait aussi un potentiel effet protecteur de l'athérosclérose par sa capacité à inhiber la migration des cellules musculaires lisses (62) et l'expression de molécules d'adhésion cellulaire à la surface de l'endothélium (63). La production de l'adiponectine dans le tissu adipeux serait en partie régulée par les récepteurs activés par les proliférateurs de perixyxomes (PPAR-y) (64). Les niveaux d'adiponectine ont été
13
inversement reliés aux concentrations plasmatiques de CRP et du TNFa. Aussi, l'adiponectine corrèle inversement avec les TG, l'IMC, la circonférence de taille et positivement avec les taux de HDL (8). Finalement, l'analyse de la mesure de l'adiponectine pourrait être affectée par la méthode de dosage utilisée. Il semblerait que l'adiponectine de poids moléculaire élevé soit biologiquement plus active que l'adiponectine totale (65).
2.3.3 Autres biomarqueurs inflammatoires
Différentes molécules sont mesurées dans les études examinant les processus inflammatoires dans l'athérosclérose. Le TNFa est fréquemment mesuré dans les études. Il est aussi responsable en partie de la stimulation de la production de CRP (18). Il serait aussi soupçonné de favoriser l'expression de N F - K B , et ainsi augmenter la présence de molécules
d'adhésion cellulaire et de cytokines, dont 1TL-6. Le fibrinogène, précurseur de la fibrine dans la coagulation sanguine, serait impliqué dans l'athérosclérose en favorisant entre autre la migration de cellules lisses musculaires (37). Cependant, les évidences sont contradictoires quant au lien entre le fibrinogène et le risque de MCV (37).
2.4 Différents facteurs modulant l'inflammation
Les maladies chroniques sont influencées par une variété de facteurs de risque, lesquels influencent aussi certains marqueurs inflammatoires. La pratique fréquente d'activité physique est généralement considérée comme un facteur abaissant les marqueurs inflammatoires, bien qu'en phase intense d'exercice physique, il y ait une augmentation locale d'IL-6 au niveau du muscle (14). Un IMC augmenté a été directement associé à des concentrations augmentées de CRP. De même, une étude a observé que ceux ayant un tour de taille et une accumulation de tissu adipeux viscéral dans les quintiles supérieurs avaient des taux de CRP plus élevés (66). Il est bien établi qu'une perte de poids améliore le profil inflammatoire. Une diminution de la taille des adipocytes expliquerait cette diminution de la sécrétion des marqueurs inflammatoires (14). L'âge serait aussi positivement associé aux concentrations de marqueurs inflammatoires (14). Une étude a observé dans une cohorte de sujets âgés en moyenne de 81 ans, une concentration de TNFa supérieure à celle de sujets
jeunes (67), cette concentration élevée étant néanmoins associée à un diagnostique d'athérosclérose. Cette élévation peut donc être le reflet de co-morbidités plus fréquentes avec l'âge. Il est connu qu'en état postprandial certains marqueurs de l'inflammation sont augmentés pendant quelques heures. Une étude a observé l'effet d'un repas riche en lipides chez des hommes et femmes et a observé une augmentation de 1TL-6 à 4 et 8 heures, une réduction du TNFa, mais sans changement du CRP (68). Cet état, très fréquent dans une journée, jouerait possiblement un rôle dans la résistance à l'insuline et l'athérosclérose (14).
3. LES ACIDES GRAS DE L'ALIMENTATION ET LEURS IMPACTS
L'alimentation a un impact sur le risque de maladies cardiovasculaires. Les fruits et légumes, les grains entiers, les poissons, les noix, les produits laitiers à teneur réduite en matières grasses et les huiles d'origine végétale sont reconnus comme ayant un rôle protecteur sur l'incidence de MCV (69). Également, une faible consommation de viandes rouge transformées, de matières grasses hydrogénées, d'acides gras trans (AGT), d'alcool, de breuvages et aliments riches en sucres raffinés, ainsi qu'une saine balance énergétique contribuent à la santé cardiovasculaire (69). Au niveau des lipides, il semblerait que l'impact du type de matières grasses serait plus important que la quantité totale de matières grasses dans l'alimentation sur le risque de MCV (70). De surcroît, certains éléments d'une alimentation saine sont connus pour influencer à la baisse l'inflammation. Le végétarisme (71) et la diète méditerranéenne (72, 73) ont fréquemment été associés à des taux abaissés de CRP. Une consommation élevée de fruits et légumes variés, ainsi que d'antioxydants, a entraîné une diminution de la CRP dans plusieurs études d'intervention. Les noix, les fibres, les flavonoïdes et un apport modéré en alcool auraient un potentiel anti-inflammatoire selon certaines études d'intervention. Les données concernant l'effet des grains entiers, du soya, de peptides laitiers, de la vitamine D, du fer et des probiotiques sur l'inflammation systémique de faible intensité sont encore peu concluantes (14).
15
3.1 Les acides gras polyinsaturés (AGPI)
Les AGPI sont des acides gras à longueur de chaîne variable, contenant au moins deux doubles liaisons. Ils sont constitués de deux classes : les oméga-3 ainsi que les oméga-6, qui se différencient par la position de leur première double liaison sur le 3 e carbone ou sur
le 6e carbone respectivement à partir du carbone terminal du groupement méthyle (74).
Figure 3. Composition en acides gras de différentes huiles végétales et d'une huile d'origine marine. Canola M a i s Un Olive Arachide Saumon Légende: Açj^alpha-ljnplçiawç [ | Addelinpléiaue N'sroirsaturés Saturés
□
EPA DHAChez l'humain, une cascade de réactions permet l'élongation des acides gras essentiels à chaîne plus courte en leurs dérivés à chaînes plus longues, tel qu'illustré dans la figure 4. Cependant, ce processus d'élongation et de désaturation est en partie limité par la compétition entre l'acide linoléique (LA) et l'acide alpha-linolénique pour deux enzymes, la A6-désaturase et A5-désaturase.
Figure 4. Processus d'élongation des acides gras polyinsaturés.
15 12 9 Acide linoléique C18:2 n-6
1
C22:5 n-6 Acide arachidonique C20:4 n-6i
C24:4 n-61
C24:5 n-6 ^ ^ Élongase ^ > ^tf-désaturas^> Acide alpha-linolénique C18:3n-3 ^ls-desaruras^> ^ ^ Élongase ^ > <û5-désaturase> M \Z=^ 17 14 11 Acide éicosapentaénoique C20:5 n-3 C24:5 n-3 C24:6 n-3I
Acide docosahexaénoïque C22:6 n-33.1.1 Acide éicosapentaénoïque(EPA) et acide docosahexaénoïque (DHA)
L'EPA et le DHA sont des acides gras polyinsaturés à chaînes longues (20 et 22 carbones) principalement issus des poissons et fruits de mer. Les recommandations mondiales conseillent des apports en EPA et DHA conjointement d'au moins 250 mg quotidiennement, les évidences ne permettant pas d'établir de recommandations précises séparément (75). Dans l'optique de prévention des MCV, les recommandations américaines de VAmerican Heart Association suggèrent de consommer au moins 2 portions de poissons par semaine en prévention primaire, ainsi que 1 g d'EPA+DHA sous forme de supplément en prévention secondaire (76).
17 3.1.1.1 EPA+DHA et risque de MCV
L'intérêt des oméga-3 en prévention des MCV est issu des données recueillies chez les populations Inuits à la fin des années 1970 qui associaient un faible taux de MCV à une consommation élevée de produits marins (77). Les études épidémiologiques ont souvent associé les AGPI de type oméga-3 à une réduction de l'incidence de MCV (14, 78, 79). Deux méta-analyses d'études cliniques ayant investigué l'effet de la prise de suppléments d'huile de poisson regroupant plus de 30 000 personnes montrent un rapport de cotes significatif de 0,80 et 0,87 en faveur de la réduction du risque de mortalité par MCV (80, 81). Une étude chez des patients en attente d'une chirurgie cardiaque a observé une incidence de plaque athéromateuse plus stable chez ceux ayant reçu un supplément de 1,4 g d'EPA+DHA (82). De plus, l'étude JELIS auprès de 19 000 hommes et femmes japonais hypercholestérolémiques traités avec une statine a montré que l'ajout d'un supplément de 1,8 g d'EPA pendant 5 ans entraînait une diminution de l'incidence de MCV comparativement au groupe recevant uniquement la médication (83). À l'opposé, une étude récente n'a montré aucun effet bénéfique de la prise de 1 gramme d'EPA+DHA pendant plus de 6 ans auprès de 12 000 patients diabétiques à risque élevé de MCV (84).
3.1.1.2 EPA+ DHA et les lipides sanguins
Il est maintenant bien établi que les acides gras d'origine marine abaissent les taux de TG élevés lorsque consommés en quantités importantes (33). Des études cliniques ont montré qu'un supplément d'EPA+DHA d'environ 4 g engendre une diminution d'environ 30 % des TG chez des sujets ayant des taux élevés (85, 86), mais provoque aussi une légère augmentation des LDL (86). Une méta-analyse confirme l'effet hypotriglycéridémiant des oméga-3 à chaînes longues, tout en soulignant un effet modéré sur les HDL et LDL (87). De plus, un supplément de 2 g d'EPA+DHA a entraîné une diminution de la tension artérielle systolique et diastolique (-2,7 et -1,3 mm Hg) chez des sujets hypertriglycéridémiques avec ou sans SynMet, ce qui suggère aussi un effet hypotenseur (88).
3.1.1.3 EPA+DHA et l'inflammation
Les oméga-3 d'origine marine sont généralement perçus pour avoir un rôle anti-inflammatoire. À ce sujet, plusieurs études sur des modèles cellulaires (89) et animaux (90) démontrent l'effet anti-inflammatoire des AGPI de type oméga-3 à chaîne longue. En contre partie, une récente revue de la littérature mentionne qu'il existe une certaine confusion par rapport à l'effet véritable des acides gras oméga-3 à chaîne longue sur les marqueurs de l'inflammation chez l'humain (79). Du côté des études d'intervention, les résultats et protocoles diffèrent. Une étude en chassé-croisé auprès d'adolescents obèses a observé une diminution de 1TL-6 et TNFa, mais sans changement de la CRP, suivant la prise de 1,2 g d'EPA+DHA sous forme de capsules pendant 3 mois (91). Un nombre limité d'auteurs ont observé une diminution des marqueurs inflammatoires suite à des apports élevés en EPA+DHA (92). Une étude contrôlée en chassé-croisé, comprenant 3 phases de 8 semaines espacées d'un repos de 6 semaines, chez 26 hommes et femmes hypertriglycéridémiques n'a observé aucun changement au niveau de la CRP, IL-6, IL-ip, TNFa, suite à la consommation de suppléments de 0,85 g et 3,4 g d'EPA+DHA (93). D'autres études d'intervention chez des sujets sains (94, 95) ainsi qu'avec antécédents de MCV (96) n'ont pas observé d'effets bénéfiques d'apports élevés en EPA+DHA sur l'inflammation. D'un autre côté, une étude s'intéressant uniquement aux effets du DHA a observé une diminution de la CRP et de 1TL-6 (-1 7 % et i 20 %), une diminution des neutrophiles circulants, mais sans changement des autres cytokines et molécules d'adhésion cellulaire. Dans cette étude, les sujets hypertriglycéridémiques consommaient un supplément de 3 g de DHA pendant 90 jours (97). La diminution de la CRP était significative uniquement après 90 jours de prise du supplément, et non à 45 jours, ce qui suggère un impact de la durée de l'intervention. Parallèlement, les AGPI oméga-3 sont des ligands naturels pour le PPAR-y impliqué dans l'expression de l'adiponectine. La consommation quotidienne de 125 g de saumon pendant 4 semaines a entraîné une augmentation de l'adiponectine (98). Une augmentation a aussi été observée suite à un apport de 1,8 d'EPA uniquement pendant 12 semaines chez des sujets avec SynMet. Chez 60 adultes dyslipidémiques, un supplément de 1,5 g d'EPA+DHA pendant 3 semaines a entraîné une augmentation non significative de l'adiponectine. L'augmentation était
19 significative dans le groupe combinant le supplément d'huile de poisson avec 2 g/ jour de sterols végétaux (92). Plusieurs autres auteurs n'ont pas observé d'effet de l'EPA/DHA sur l'adiponectine (99). En somme, les évidences des études cliniques ne permettent pas de conclure hors de toute que l'EPA et DHA ont des effets anti-inflammatoires, ni l'amplitude de cet effet.
3.1.2 Acide alpha-linolénique
L'acide alpha-linolénique (ALA) est un AGPI provenant des végétaux, essentiel au corps humain puisque qu'il n'y est pas synthétisé. Les recommandations nutritionnelles sont une consommation d'ALA d'au moins 0,5 % de l'apport énergétique total (AÉT), se situant entre 0,6 à 1,2 % de l'AÉT (75). L'ALA est très faiblement converti en EPA et DHA. De plus, la conversion de l'ALA en EPA et DHA varie selon le sexe, de même que le statut initial en AGPI à chaînes longues (100). Un supplément d'huile de lin (doses 1,2, 2,4, 3,6 g par jour) pendant 12 semaines n'a pas occasionné d'augmentation du DHA dans les membranes cellulaires, contrairement à l'EPA qui a légèrement augmenté (101).
3.1.2.1 ALA et le risque de MCV
D'un point de vue épidémiologique, l'impact de l'ALA sur le risque de MCV est moins défini que celui des AGPI à chaîne longue. Mozaffarian et coll. ont montré que des apports élevés en ALA étaient associés à diminution de 58 % et 47 % des événements coronariens et de l'incidence de mortalité par MCV, uniquement chez les hommes ayant de très faibles apport en EPA et DHA, suggérant un effet bénéfique des oméga-3 végétaux chez ceux ne consommant que très peu de produits marins (78). D'autres auteurs ont aussi associé les apports en ALA à un risque cardiovasculaire diminué (102-106). La Lyon Diet Heart Study, une étude d'intervention en prévention secondaire a montré une diminution d'environ 70% de la mortalité totale et cardiovasculaire suite à la consommation d'une margarine enrichie en ALA pendant 4 ans et ce, sans changement du profil lipidique (107). Cependant, de nombreuses autres composantes de l'alimentation peuvent avoir influencé ces résultats. D'un autre côté, certains n'ont pas observé d'association entre l'ALA et les MVC (108). Une récente analyse d'une étude réalisée auprès d'une cohorte Danoise de 3400 personnes
suivie sur plus de 20 ans n'ont pas observé d'association entre l'ALA et le risque de MCV ischémiques (109). De plus, l'étude MARGARIN conclut qu'un apport en ALA trois fois plus élevé que celui de la Lyon Diet Hearth Study, n'a pas d'effet significatif sur l'estimation du risque de MCV sur 10 ans (110). Les évidences sont donc contradictoires et insuffisantes à savoir si l'ALA a un effet bénéfique ou non sur le risque de MCV, mais montrent un potentiel effet protecteur.
3.1.2.2 ALA et les lipides sanguins
Les auteurs de l'étude MARGARIN ont observé chez des sujets à risque de MCV une augmentation peu désirable du ratio cholestérol total : HDL, une diminution du HDL, ainsi qu'une augmentation des TG suite à la consommation pendant 2 ans d'une margarine riche en ALA avec un suivi nutritionnel (110). D'autres auteurs ont observé une diminution des TG suite à une intervention riche en ALA (111, 112). Ces résultats sont contraires à ceux de de Lorgeril n'ayant pas vu de changement des lipides (107), ainsi qu'à plusieurs études n'ayant pas vu d'effet de l'ALA sur les lipides sanguins (113).
3.1.2.3 ALA et l'inflammation
Les évidences in vitro et in vivo montrent un potentiel effet bénéfique des AGPI d'origine marine sur l'inflammation (14), et plusieurs études d'observation ont aussi investigué le lien entre l'ALA et différents marqueurs inflammatoires. Une étude observationnelle chez un petit échantillon de la population japonaise a observé une corrélation inverse entre des apports élevés en ALA et les niveaux de CRP, association significative seulement chez les hommes. La concentration de CRP étant 47 % plus basse chez les hommes dans le quintile supérieur d'apports en ALA (114). Une autre étude auprès de 180 paires de jumeaux a observé une association inverse entre les apports alimentaires d'ALA avec les concentrations sérique du récepteur soluble de 1TL-6, sans toutefois voir d'association avec 1TL-6, CRP et TNFa (115). De plus, une étude auprès de 1100 personnes de tous âges, a associée de façon inverse les concentrations d'ALA plasmatiques avec les concentrations de CRP, mais sans voir d'association avec 1TL-6 (116). À l'opposé, des auteurs n'ont
21 observé aucune association entre l'ALA et divers marqueurs inflammatoires dans un échantillon représentatif de la population américaine (117). Ainsi les études d'observation présentent des résultats hétérogènes, mais semblent toutefois montrer un effet anti-inflammatoire très modéré de l'ALA.
Du côté des études d'intervention, il existe une grande hétérogénéité de résultats, et des méthodes, au niveau de la dose d'ALA, la forme consommée (ex. huile, noix, suppléments, aliments enrichis), ainsi que la durée des interventions. Une étude contrôlée incluant trois phases expérimentales d'une durée de 6 semaines chacune, a observé une diminution des marqueurs de l'inflammation chez 23 sujets obèses légèrement hypercholestérolémiques (111). La diète riche en ALA (6,5 g/jour ALA + 10,6 g LA), consommé sous forme de noix et d'huile de lin et d'huile de noix, a entraîné une réduction plus marquée de la CRP (475% vs 443%) que la diète riche en LA (3,6 g/jour ALA + 3,6 g/jour LA). Ils ont aussi observé une diminution des molécules d'adhésion cellulaire VCAM, ICAM et E-sélectine. Une seconde étude d'intervention auprès de 76 sujets dyslipidémiques a observé une diminution de la CRP, IL-6 et du SAA (respectivement 4 38 %, 10,5 %, 23,1 %) suite à la prise d'un supplément d'huile de lin pendant 12 semaines (8 g/jour d'ALA) (118). D'autres études ont observé une diminution de la CRP (119, 120), IL-6 (120), TNFa (121) suite à des apports augmentés en ALA ou à un supplément, tandis que d'autres n'ont pas vu de changement (122-124). Finalement, peu d'études d'intervention se sont intéressées à l'effet de l'ALA sur l'adiponectine. Chez 18 sujets dyslipidémiques, l'ajout de 8,1 g d'ALA par jour pendant 12 semaines provenant d'huile de lin a entraîné une diminution de l'adiponectine de 16 %. Ils ont aussi observé une augmentation concomitante du TNFa par rapport à aux concentrations initiales, mais sans changement significatif comparativement à l'huile riche en LA (125). Une autre étude a observé une diminution de l'adiponectine avec un apport plus élevé en ALA ~11,9 g/jour pendant 8 semaines (126). Ainsi, il semblerait que l'ALA aurait un effet bénéfique sur certains marqueurs inflammatoires, tandis que l'effet sur l'adiponectine est à préciser, mais suggère une diminution non favorable de ce marqueur.
3.1.3 Acide linoléique
L'acide linoléique est un AGPI de type oméga-6 que l'on retrouve en grande quantité dans l'alimentation principalement dans les huiles de canola, tournesol, maïs et les noix et les graines. Tel que montré dans la figure 3, il est précurseur de l'acide arachidonique (AA), composant essentiel des membranes cellulaires. Des apports importants en LA favoriseraient une plus grande incorporation de l'AA dans les membranes cellulaire par une monopolisation des enzymes de désaturation.
3.1.3.1 Acide linoléique et le risque de MCV
Certains auteurs suggèrent qu'il ne semble pas y avoir d'évidence que LA serait associée à un risque augmenté de MCV (78, 127). De plus, une analyse de la Nurses' Health Study a montré une association inverse entre les apports en LA et le risque d'un futur infarctus du myocarde, le risque relatif d'incidence de MCV étant de 0,77 dans le quintile supérieur d'apport en LA (128). Cette association inverse a aussi été observée dans d'autres études (106, 129). La consommation d'AGPI de type oméga-6 végétaux semblerait donc inversement associée avec le risque de MCV.
3.1.3.2 Acide linoléique et les lipides sanguins
L'acide linoléique a globalement un impact positif sur le profil lipidique, principalement sur le taux de cholestérol total. Des apports élevés en LA entraînerait une diminution du cholestérol total (118). Une méta-analyse de 13 études s'intéressant à l'effet des noix de grenoble révèle une diminution du cholestérol total et LDL, et ce sans impact sur les TG et HDL (130). Les noix sont des aliments très riches en LA, mais aussi en fibres, magnésium, et antioxydants, ce qui ne permet pas nécessairement d'attribuer l'effet hypocholestérolémiant à LA uniquement.
23 3.1.3.3 Acide linoléique et l'inflammation
Tout d'abord, une étude d'observation a inversement associé les apports en LA avec la CRP dans une population d'hommes japonais (114). Ce qui semblent aller dans le même sens que les études épidémiologiques supportant un rôle protecteur, ou non néfaste de LA sur le risque de MCV. Il est à mentionner que dans plusieurs études LA est utilisé en tant qu'intervention témoin. Très peu d'étude s'intéressent aux effets de LA comme objectif principal. Dans une première étude d'intervention, la consommation d'un supplément d'huile de tournesol fournissant 11 g de LA n'a entraîné aucun changement au niveau de la CRP, IL-6 et SAA chez 76 sujets dyslipidémiques (118). Liou et coll. ont évalué chez 24 adultes sains l'effet d'une diminution de LA au profit d'une augmentation de l'acide oléique pendant 10 semaines et n'ont observé aucun changement sur la CRP et 1TL-6 (131). Une autre étude chez des sujets hypertriglycéridémiques a observé une tendance vers la diminution de la CRP suite à une diète riche en LA, ainsi qu'une diminution significative de molécules d'adhésion cellulaire comparativement à une diète riche en ALA qui diminuait significativement la CRP (132). Il est difficile d'expliquer pourquoi LA un AGPI de type oméga-6 précurseur d'AA et d'éicosanoïdes pro-inflammatoires entraîne une diminution des marqueurs inflammatoires. Les auteurs suggèrent que la présence d'AGPI de type oméga-3 dans l'alimentation contrebalancerait l'effet redouté de LA et de l'AA (voir section 3.1.4). Cette observation est appuyée par une étude sur des cellules humaines ex vivo qui a observé une diminution de 1TL-6 suite à une diète riche en EPA+DHA, mais dont l'amplitude de cette diminution favorable n'était pas affectée par l'ajout de LA (133). Fait intéressant, une étude chez des sujets en surplus de poids a montré que la consommation d'un repas riche en LA (margarine + huile de tournesol) entraînait des concentrations postprandiales de TNF, IL-6, IL-8 plus basses qu'un repas riche en beurre (134). À notre connaissance, il ne semble pas y avoir d'études rapportant un effet délétère de la consommation de LA sur l'inflammation. Le fait de diminuer ou d'augmenter les apports en LA ne semble pas influencer à la hausse les paramètres inflammatoires.
En ce qui concerne l'AA, peu ou pas d'études d'intervention chez l'humain ont investigué l'impact de l'AA sur les différents marqueurs inflammatoires bien qu'il soit le précurseur
d'éicosanoïdes associés aux processus inflammatoires. Toutefois, selon une étude observationnelle, il semblerait que les concentrations plasmatiques d'AA ne seraient pas associées aux différents marqueurs de l'inflammation, sauf pour une association inverse avec 1TL-6 (116).
3.1.4 Mécanismes des AGPI dans l'inflammation
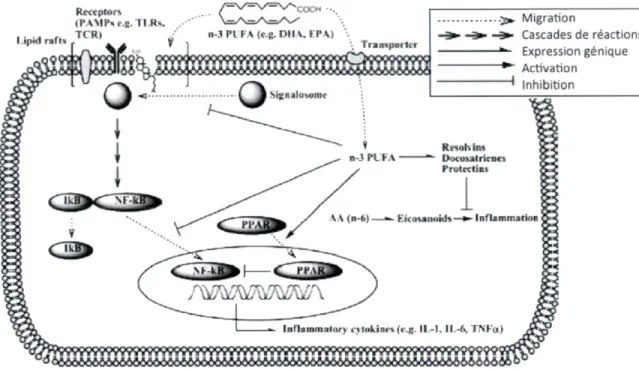
Les apports en acides gras influencent la composition des phospholipides des membranes cellulaires. Une consommation importante d'AGPI de type oméga-3 entraînerait le déplacement de l'AA, et une plus grand disponibilité cellulaire des AGPI de type oméga-3 (79). Il existe deux chemins par lesquels les AGPI de type oméga-3 exerceraient leur effets anti-inflammatoires observés dans les modèles cellulaires et animaux, et parfois chez les humains. En premier lieu, les oméga-3 seraient des ligands naturels d'une protéine nommée couramment PPAR-y, récepteur activé par les proliférateurs de peroxysomes, qui agît comme facteur de transcription de plusieurs gènes. Activé par la présence d'oméga-3, PPAR-y aurait la capacité d'inhiber l'activité du facteur de régulation NF-Kp, ce qui diminuerait l'expression de molécules pro-inflammatoires. La figure 5 présente cette chaîne de réaction. En second lieu, les AGPI à chaîne de 20 carbones sont des précurseurs pour une famille de molécules nommés éicosanoïdes. L'AA par l'action de d'enzymes cyclo-oxygénases sera transformée en prostaglandins, leukotriènes et thromboxanes actifs, dits de séries 2 et 4, modulant plusieurs composantes de la réponse inflammatoire (effets pro- et anti-inflammatoires)(135). De l'autre côté, l'AGPI de type oméga-3 à chaînes de 20 carbone (EPA) seraient précurseur de leukotriènes métaboliquement peu actifs, ainsi que de résolvines, ayant un rôle anti-inflammatoire (79).
25
Figure 5. Mécanismes par lesquels les acides gras oméga-3 influencent la production de molécules inflammatoires via l'activation des PPAR.
Rtctplor* <PAMP*r.e.TI.Rs I ipld r»fl< f T C R> ^ y /=\/=v=v--c o c*,... \ = A = A = A / n-3 PI'F* (e.g. DM V, KP\) A ] 1 I J ( s | I II I I t ( lôô^ÂôcW 6tMAbiMààô66&6^^ MgllilluMMIV .-2» Migration - * ■ Cascades de réactions - * - Expression génique ~*~ Activation "• Inhibition K. - ■ il, in* l> v u v i l r ;> 1:. Protcctins -6) — » - Kkus«ii<ikli—fc- Inflammation ( nflan»m:ilnrv i'UokifH'S {f.g. I I . - I . Il -t-. 1 M r i yçççççç SP
Figure adaptée de Chapkin et coll. Prostaglandins Leukot Essent Fatty Acids. 2009 (136)
3.2 Les acides gras monoinsaturés
Les acides gras monoinsaturés (AGMI) sont des acides gras à chaîne moyenne ne présentant qu'une seule double liaison. L'acide oléique (AO) est l'AGMI le plus prévalent dans l'alimentation (137). On en retrouve en grande quantité dans les huiles végétales (olive, canola, tournesol riche en acide oléique), les noix, les avocats et en plus petites quantités dans les viandes et produits laitiers.
3.2.1 Les acides gras monoinsaturés et le risque de MCV
Les AGMI sont considérés comme ayant un rôle protecteur des MCV. Ils ont initialement été associé à un rôle bénéfique puisque les pays du pourtour méditerranéen, qui ont de très faibles taux de MCV, sont de grands consommateurs d'huile d'olive (137). De nombreuses études épidémiologiques ont d'ailleurs associé l'alimentation méditerranéenne à une diminution de l'incidence de MCV. Dans le même ordre d'idée, une analyse de la Nurses' Health Study a montré une association inverse entre l'apport en AGMI et le risque de maladies coronariennes (138). Toutefois, selon une analyse de plusieurs études de cohortes, il semblerait qu'augmenter l'apport en AGMI en remplacement des acides gras saturés ne représenterait pas un avantage au niveau du risque d'incidence de MCV (139). De surcroît, une méta-analyse récente de Mozaffarian et coll. suggère que le remplacement de 5 % de l'AÉT provenant des AGS par des AGMI augmente le risque de maladies coronariennes (RR=1,19, [1,00;1,42])(140).
3.2.2 Les acides gras monoinsaturés et les lipides sanguins
En premier lieu, les AGMI sont généralement associés à une amélioration du bilan lipidique. Une méta-analyse de 60 études montre que le remplacement iso-calorique de glucides par des AGMI diminue le ratio cholestérol total/ HDL, les LDL, les TG et l'apoB (141). Comparativement à une diète riche en AGS (18 % AÉT), une diète riche en AGMI (21 % AÉT) a entraîné une diminution des LDL et TG, sans effet sur les HDL, chez des sujets sains (86). Par contre, une récente méta-analyse de 12 études contrôlées randomisées d'une période de plus de 6 mois n'a pas observé d'effet d'une diète à teneur « élevée » en AGMI sur le cholestérol total, LDL, HDL ni TG, comparativement à des diètes à teneur « faible » en AGMI (faible teneur en lipides, riche en AGPI ou en AGS, diète à haute teneur en glucides ou protéines, ou à indice glycémique élevé ou faible) (142).
27
3.2.3 Les acides gras monoinsaturés et l'inflammation
Peu d'études décrivent l'impact des AGMI sur le profil inflammatoire. La méta-analyse de Schwingshackl et coll. n'ont pas vu d'effet d'interventions riches en AGMI sur les taux de CRP (142). En contrepartie, plusieurs auteurs auraient observé une diminution de la CRP, IL-6 et molécules d'adhésion cellulaire avec un mode alimentaire de type méditerranéen riche en huile d'olive, noix, fruits et légumes et grains entiers (14). On ne peut malheureusement pas isoler l'élément nutritif ayant joué un rôle bénéfique dans ce contexte puisqu'il s'agit d'un mode alimentaire. Aussi, une alimentation riche en amandes, dont 20 % de F AÉT provenait des AGMI, pendant 4 semaines a entraîné une diminution de la CRP (44,5 %) ainsi que E-sélectine (-7,8 %), sans changement de 1TL-6 chez des sujets sains (143). Le même problème persiste, d'autres nutriments présents dans les amandes peuvent être responsables de cet effet. Dans une étude clinique contrôlée, la diète très riche en AO (-62 g/jour) n'a entraîné aucun changement au niveau de 1TL-6, CRP, fibrinogène, E-sélectine, mais présentait des concentrations plus basses de différents marqueurs, comparativement aux diètes riches en AGT et/ou AGS (144). Du côté de l'adiponectine, une intervention en chassé-croisé chez 11 sujets obèses comparant trois diètes riches en AGS, AGMI, et glucides n'a pas observé de variation dans l'adiponectine suite à la diète riche en AGMI (145). Par contre, une étude en chassé-croisé entièrement contrôlée chez 164 sujets hypertendus a montré une augmentation plus importante de l'adiponectine suite à une diète riche en AGMI (20 % AÉT) comparativement à des diètes riches en protéines et glucides (146). Les auteurs suggèrent que la redistribution des graisses, sans perte de poids, peut expliquer cette augmentation favorable. Cette étude a aussi observé une association positive entre le changement de l'adiponectine et le HDL. En somme, les évidences sont peu nombreuses et peu concluantes concernant le rôle isolé des AGMI sur l'inflammation, mais suggèrent possiblement un effet bénéfique en ce qui concerne l'adiponectine.
3.3 Les acides gras saturés
Les AGS sont des acides gras à chaînes de carbone de longueurs variables dont le niveau de saturation en hydrogène est complet. Il existe différents types d'acides gras saturés qui différent dans la longueur de la chaîne de carbone, et différent possiblement dans leurs
effets sur les marqueurs de risque de MCV (141). Selon les plus récentes données disponibles de l'Enquête sur la santé et la collectivité du Canada, les AGS représentent 10 % de l'AÉT des Canadiens. Les recommandations du NCEP ATP III visent un apport de <7% de l'énergie totale provenant des AGS (147). Dans le contexte de l'étude réalisée et présentée dans ce mémoire, la diète et les huiles contenaient des quantités très similaires d'AGS, ainsi les évidences seront brièvement revues.
3.3.1 Les acides gras saturés et le risque de MCV
Depuis la Seven Countries Study (148), les études épidémiologiques ont traditionnellement associé les gras saturés à un risque augmenté de MCV (149-151), toutefois cette association reste controversée. Une récente méta-analyse regroupant 22 études épidémiologiques de grande envergure a semé la controverse en concluant qu'il n'y a pas d'évidence que les AGS ont un impact sur le risque d'événements coronariens et AVC (152). D'autres meta-analyses corroborent cette absence d'association (153). En contrepartie, la diminution des AGS au profit d'une consommation augmentée d'AGPI se révèle avantageux sur le risque de MCV selon Jakobsen et coll. (139).
3.3.2 Les acides gras saturés et les lipides sanguins
A l'opposé des récentes études épidémiologiques et méta-analyses, les études d'intervention démontrent clairement un effet nuisible sur la lipémie des AGS (141, 154). Mensik et coll. ont montré que remplacer 1 % de l'apport énergétique sous forme de glucides par des AGS entraînait une nette augmentation au niveau du cholestérol total et LDL. Toutefois, remplacer des glucides par des AGS n'affecterait pas le ratio cholestérol total/ HDL, puisque les AGS sont associés avec une augmentation des HDL.
3.3.2 Les acides gras saturés et l'inflammation
Un nombre limité d'études observationnelles a examiné si les AGS étaient associés aux marqueurs de l'inflammation. Une analyse de l'enquête NHANES aux États-Unis n'a pas observé d'association entre les AGS et la CRP lorsque les apports en AGS étaient ajustés pour les facteurs de risque principaux de MCV (155). Du côté des études d'intervention,
29 une étude clinique contrôlée en chassé-croisé chez 50 participants en bonne santé de Baer et coll., a observé une augmentation significative des marqueurs inflammatoires suite à différentes diètes riche en AGS. Les concentrations de fibrinogène, IL-6 et E-sélectine ont augmenté suite aux diètes riches en AGT et AGS. Malgré son effet individuel peu hypercholestérolémiant, l'acide stéarique aurait aussi fait augmenter les concentrations d'IL-6 (144). Les AGS semblent généralement associés à des concentrations plus élevées de marqueurs inflammatoires (156), mais le peu d'évidences ne permet pas de conclure à un effet pro-inflammatoire.
3.4 Les acides gras trans
Les AGT sont un types d'acides gras possédant une seule double liaison, tout comme les AGMI, mais se distinguent par la configuration de type trans, différent par l'oriention de la chaîne de carbone. Ils sont principalement retrouvés dans les produits alimentaires transformés ainsi qu'une petite quantité dans la viande et les produits laitiers. Les huiles végétales hydrogénées par la transformation industrielle sont la principale source d'AGT. Les huiles végétales sont riches en acides gras insaturés et sans AGT lorsque non-transformées.
Plusieurs études épidémiologiques ont démontré une forte association entre les AGT et le risque de mortalité (157) . L'OMS recommande de limiter la consommation d'AGT à < 1% de AÉT (158). Selon une méta-analyse, les AGT ont un impact négatif sur le profil lipidique, notamment par l'augmentation du ratio cholestérol total/ HDL et de l'apoB. Remplacer les AGT par les AGPI ou AGMI et même par des AGS est associé à une diminution du risque de mortalité (141).
Les effets des AGT sur l'inflammation ont aussi été investigués dans des études épidémiologiques et d'intervention. Dans une cohorte de 730 femmes issues de la Nurse 's Health Study, les auteurs ont rapporté des concentrations significativement plus élevées de CRP, IL-6, E-sélectine, ICAM-1 et VCAM-1 dans le quintile supérieur d'apports en AGT comparativement au quintile inférieur (159). L'étude d'intervention de Baer et coll., mentionnée précédemment, a aussi montré une augmentation de la CRP suite à des apports