i SAMIA MELLAOUI
RÔLE DE LA PROTÉINE FMRP DANS LA FORMATION
ET LE DYNAMISME DES GRANULES À ARN
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l’Université Laval dans le cadre du programme de maîtrise en biologie cellulaire et moléculaire
pour l’obtention du grade de Maître ès Sciences (M.Sc.)
DÉPARTEMENT DE BIOLOGIE CELLULAIRE ET MOLÉCULAIRE FACULTÉ DE MÉDECINE
UNIVERSITÉ LAVAL QUÉBEC
2012
i
RÉSUMÉ
La protéine de liaison à l’ARN, Fragile Mental Retardation Protein (FMRP) est une protéine conservée dans l'évolution et particulièrement abondante dans le cerveau en raison de sa forte expression dans les neurones. L'absence de FMRP est responsable du syndrome du X Fragile, première cause du retard mental héréditaire. Cette protéine semble jouer un rôle important dans la régulation de la traduction des ARNm, puisqu’elle se retrouve sur les polyribosomes en traduction active. Elle se retrouve également dans des structures contenant des ARNm sous forme réprimée ce qui suggère qu’elle se comporte plutôt comme une protéine ayant un rôle de répresseur traductionnel.
Il a déjà été montré que la surexpression de la protéine FMRP chez les mammifères peut induire la formation de granules cytoplasmiques d'ARN qui ressemblent aux granules neuronaux et aux granules de stress. Les mécanismes de formation de ces granules FMRP et leur dynamisme sont cependant totalement inconnus. Contrairement à FMRP chez les mammifères qui a deux homologues (FXR1 et FXR2), la drosophile possède un seul gène codant pour dFMRP. L'utilisation de ce modèle simple nous a permis d’étudier la formation des granules dFMRP et le rôle de dFMRP dans la formation des granules de stress. Nous avons pu montrer que l'expression de dFMRP dans les cellules de la drosophile induit la formation de granules dynamiques. La formation de ces granules dFMRP se fait sans activation d’une réponse générale au stress et leur mécanisme de formation ne ressemble pas à celui des granules de stress. La formation de ces granules implique le domaine de dimérisation de dFMRP. Ce domaine ne semble cependant pas important pour le recrutement de la protéine dans les granules de stress. Nos expériences de FRAP montrent que le domaine de dimérisation de dFMRP est plutôt nécessaire à la mobilité de la protéine entre les granules de stress et le cytoplasme. Dans l'ensemble, nos études suggèrent que la dimérisation de dFMRP est un événement important pour l’induction des granules-dFMRP et permet le trafic de dFMRP entre les granules à ARN et le cytoplasme.
ii
REMERCIEMENTS
C’est avec beaucoup de volonté et détermination que j’ai commencé mon aventure en biologie cellulaire et moléculaire, un domaine tout à fait inconnu pour moi vu que je suis diplômée en médecine vétérinaire et que je retourne aux études après plusieurs années de vie professionnelle.
Je souhaite en premier adresser mes remerciements les plus sincères à toutes les personnes qui m'ont apporté leur aide et qui ont contribué à l'élaboration de ce modeste travail ainsi qu’à la réussite de cette formidable formation.
L’environnement et l’encouragement que j’ai eu au laboratoire du Dr Rachid Mazroui m’ont permis d’évoluer et découvrir un domaine très passionnant qu’est la recherche. J’aimerai d’abord remercier mon directeur de recherche Dr Rachid Mazroui de m’avoir accepté dans son laboratoire et surtout de m’avoir fait confiance malgré mon background différent. Je tiens aussi à remercier Dr Yves Labelle pour ses précieux conseils. Je remercie également la professionnelle de recherche Marie-Josée Fournier pour sa disponibilité et son aide malgré son temps chargé. Je n’oublie pas mes collègues et amis au laboratoire : Laetitia Coudert, Cristina Gareau et David Martel pour la belle ambiance et l’environnement agréable que j’ai eu le plaisir de partager au sein du laboratoire.
Gros merci aussi à d’autres amis et collègues à l’hopital Saint François d’Assise avec qui j’ai partagé de beaux souvenirs.
Enfin, j'adresse mes plus sincères remerciements à tous mes proches spécialement mes parents, qui m'ont toujours soutenue et encouragée au cours de la réalisation de ce mémoire.
iii
TABLE DES MATIÈRES
RÉSUMÉ... i
REMERCIEMENTS... ii
TABLE DES MATIÈRES... iii
LISTE DES TABLEAUX... v
LISTE DES FIGURES ...vi
LISTE DES ABRÉVIATIONS... viii
1. INTRODUCTION...1
1.1 Généralités...1
1.2 Le gène FMR1...2
1.3 La famille FXR...………..4
1.4 Les domaines fonctionnels de la protéine FMRP………..6
1.4.1 Les domaines de liaison à l’ARN...6
1.4.2 Le domaine d’interaction protéine-protéine (PPID)...6
1.4.3 Le NLS et le NES...7
1.4.4 Domaine de phosphorylation...7
1.4.5 Le mutant I304N...8
1.5 Fonction de FMRP...8
1.5.1 Rôle dans la régulation de la traduction... 8
1.5.2 FMRP dans les neurones... 11
1.6 Les granules à ARN...12
1.6.1Les granules neuronaux……….….12
1.6.2 Les granules de stress...13
1.6.2.1 Composition des granules de stress...14
1.6.2.2Mécanisme de formation des granules de stress...16
1.6.2.2.1 Dépendamment de la phosphorylation du facteur eIF2α...16
1.6.2.2.2 Indépendamment de la phosphorylation du facteur eIF2α...17
1.6.2.3 Dynamique des granules de stress...18
1.6.2.4 Fonction des granules de stress...18
a. Stockage, triage et stabilisation des ARNm...18
b. Les granules de stress et la régulation physiologique...19
1.6.3 Similitudes entre les granules de stress et les granules neuronales...20
1.6.4 Similitudes entre les GS et les granules FMRP...20
1.7 Problématique...21 2. MATERIEL ET METHODES...22 2.1 Lignées cellulaires ...22 2.2. Stress...22 a - Traitement à l’arsénite ...22 b - Choc thermique ...23 2.3 Manipulation de l’ADN...23 2.4 Immunofluorescence...24
2.5 L’hybridation in situ en fluorescence (FISH) ...26
iv
2.7 L’analyse des polyribosomes...27
2.8 Imagerie et FRAP...27
2.9 L’extraction des protéines et immunobuvardage...28
a - Extraction des protéines ...28
b- Coloration au bleu de Coomassie et quantification...28
c- Électrotransfert sur membrane de nitrocellulose...29
d- Immunobuvardage ...29
2.10 Transfection et interférence à ARN (siRNA) ...20
3. RÉSULTATS...32
3.1 Le stress induit la dissociation de dFMRP des polyribosomes et son accumulation dans les GS dans les cellules de drosophile...32
3.2 La réduction du niveau dFMRP n’affecte pas la formation des GS ...36
3.3 La surexpression de dFMRP induit la formation de granules dFMRP qui nécessite le domaine d'interaction protéine protéine de dFMRP...38
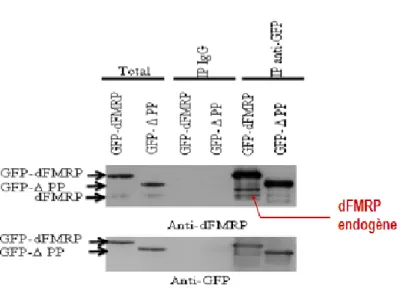
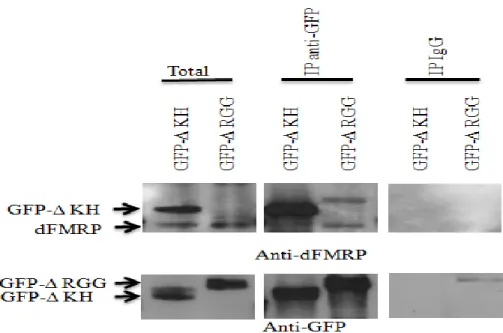
3.4 La formation des granules-dFMRP implique la dimérisation de dFMRP ...45
3.5 La formation des granules-dFMRP se produit indépendamment de la phosphorylation du facteur eIF2α...40
3.6 Caractérisation du dynamisme des granules-FMRP ...53
3.7 Caractérisation du recrutement de dFMRP dans les GS...56
3.8 Dynamisme de FMRP dans les GS...62
4. DISCUSSION... ...65
5. CONCLUSION...72
v
LISTE DES TABLEAUX
Tableau 1 : Principaux composants des granules de stress………..…15 Tableau 2.1 Anticorps utilisé en immunofluorescence………..….25 Tableau 2.2 : Caractéristiques des anticorps utilisés en immunobuvardage……….30
vi
LISTE DES FIGURES
Figure 1.1 : Présentation schématique du gène FMR1 humain………...3 Figure 1.2 : Les membres de la famille FXR sont conservés durant l’évolution (Figure tirée de Huot, 2005)……….4 Figure 1.3 : Présentation schématique des structures des membres de la famille FXRP…5 Figure 1.4 : Modèle de la répression des RiboNucléoParticules (mRNPs) par FMRP….10 Figure 3.1 : Le stress induit la dissociation de dFMRP des polyribosomes et l’inhibition de la traduction………...34 Figure 3.2 : Formation de granules de stress dans les cellules de drosophiles…………..35
Figure 3.3 : La formation de granules de stress ne semble pas affecter par la baisse du niveau de dFMRP………..37 Figure 3.4 : La surexpression de dFMRP induit la formation de granules cytoplasmiques où on retrouve des marqueurs de GS……….39 Figure 3.5 : Les granules dFMRP sont des granules à ARN……….40 Figure 3.6 : Identification des mutants de dFMR1………41 Figure 3.7 : Le mutant GFP-ΔPP n’induit pas la formation de granules dans les cellules de drosophile………..43 Figure 3.8 : Les mutants GFP-KH et GFP-RGG induisent la formation des granules à ARN………...44 Figure 3.9 : Le mutant GFP-PP ne s’associe pas efficacement avec dFMRP endogène………46 Figure 3.10 Confirmation du signal de dFMRP endogène………46 Figure 3.11 : GFP-ΔKH et GFP- RGG s’associent plus efficacement avec dFMRP endogène que GFP-PP……….47 Figure 3.12 : Le rôle du domaine de dimérisation de la protéine FMRP dans l'induction de la formation de granules d'ARN est conservé………....49
vii Figure 3.13 : La formation des granules dFMRP semble indépendante de la voie de phosphorylation de deIF2α chez les cellules de drosophiles……….51 Figure 3.14 : La formation des granules dFMRP semble indépendante de la voie de phosphorylation de deIF2α chez les mammifères………..52 Figure 3.15 L’analyse FRAP démontre que les granules-FMRP sont des complexes dynamiques………54 Figure 3.16 : Le dynamisme de FMRP dans ces granules est conservé chez les mammifères………55 Figure 3.17 : Le domaine PPID de la protéine dFMRP n’est pas important pour la localisation de la protéine dans les GS………...58 Figure 3.18 : Les granules formées après traitement à l’arsénite sont des granules à ARN………...59 Figure 3.19 : Figure 3.19, Suivie du recrutement de GFP-dFMRP dans les GS……..….61 Figure 3.20 : Le domaine d’interaction protéine-protéine est important pour le dynamisme de dFMRP dans les GS………...63 Figure 3.21 : Le dynamisme de FMRP dans les GS est conservé……….64
viii
LISTE DES ABRÉVIATIONS
ADNc : Acide désoxyribonucléique complémentaire ARNm : Acide ribonucléique messager
BSA : Albumine sérique de bovin (Bovine serum albumine) CKII : Caséine Kinase II
CYFIP1/2 : cytoplasmique FMRP interacting protein 1/2 Dapi : Dihydrochlorure de 4,6-diamidino-2-phénylindole dFMRP : Droso Fragile Mental Retardation Protein
EDTA : Acide ethylene diamine triacétique
FBS : Sérum de foetus bovin (Foetal Bovine serum) FMR1 : gène Fragile Mental Retardation 1
FMRP : Fragile Mental Retardation Protein FRAP : Fluorescence recovry after photobleaching FXS : Syndrome de l’X-fragile
FXTAS : Fragile X tremor ataxia syndrome FXR : Fragile X Related
FXR1P : Fragile X Related 1 Protein FXR2P : Fragile X Related 2 Protein FRAXA : Fragile chromosome X site A GS : Granules de stress
hFMRP : human Fragile Mental Retardation Protein HRI : heme regulated inhibitor
kDa : kilo Dalton
KH1, KH2, RGG : Motifs de reconnaissances à l’ARN M : molaire (mole/litre)
MEF : Fibroblastes embryonnaires de souris NLS : signal de localisation nucléaire NES : signal d’export nucléaire
NUFIPI : nuclear FMRP-interacting protein 1 mRNPs : RiboNucléoParticules
ix NaCl : Chlorure de sodium
PABP : protéine de liaison au poly A PBS : Phosphate Buffered Saline PhD : domaine phosphorylé PKR : protein kinase R
PPID : domaine d’interaction protéine-protéine RISC : RNA-Induced Silencing Complex RNPm : Ribonucléoparticules messager rpm : rotation par minute
a
Chapitre I :
Introduction
1
1- INTRODUCTION
1.1 Généralités
Le syndrome de l’X-fragile (FXS) représente la forme la plus fréquente de retard mental héréditaire. Son incidence est estimée à environ 1/4000 chez les hommes et 1/7000 chez les femmes (Crawford et al., 2001). Ce syndrome est dû à l’absence de la protéine Fragile X Mental Retardation (FMRP), une protéine de liaison aux ARNs impliquée dans plusieurs aspects du métabolisme de ces derniers. Il se manifeste par une altération des fonctions cognitives supérieures, allant de simples difficultés d’apprentissage à un retard mental sévère. Il est souvent associé à une dysmorphie faciale et/ou ligamentaire et à une macroorchidie chez les individus de sexe masculin (De Vries et al., 1998).
Le syndrome de l’X-fragile est causé par une expansion d'une répétition CGG dans la région 5' non codante du gène FMR1. Chez des sujets normaux, cette répétition peut aller de 5 à ~ 50 CGGs. Les patients atteints de l’X Fragile ont une répétition supérieure à 200 CGGs hyperméthylés. La méthylation s'étend jusqu’à la région promotrice adjacente, ce qui entraine une répression de la transcription du gène FMR1 (Coffee et al., 1999). Bien que les porteurs d’une prémutation ne sont pas atteints du syndrome de l’X fragile, ces allèles intermédiaires sont associés à d’autres phénotypes tels que la ménopause précoce ou une nouvelle forme de maladie neurodégénérative appelée : Fragile X Tremor Ataxia Syndrome (FXTAS) (Hagerman et Hagerman., 2004). Chez les patients atteints d’FXTAS, la quantité de la protéine FMRP est diminuée, tandis que le taux d’ARNm correspondant est plus élevé. FXTAS semble être liée à la surexpression des ARNm porteurs de la prémutation, leur conférant ainsi une fonction pathogénique. Une forme sévère de l’X fragile est associée à une mutation ponctuelle changeant une isoleucine très conservée en une asparagine (I304N) (De Boulle et al, 1993).
2
1.2 Le gène FMR1
Le gène FMR1, localisé au locus FRAXA (Fragile chromosome X site A) en position Xq27.3, est formé de plusieurs exons dont le premier contient le motif CGG(n) (Krawczun et al., 1985). Ce gène est précédé en 5’ par un « ilot CpG » normalement non méthylé sur le chromosome X de l’homme et méthylé uniquement sur le X inactivé de la femme. Le gène FMR1 comporte 17 exons et s’étend sur 38 kb au niveau de la région Xq27.3 (Eichler et al., 1993; Eichler et al., 1994) (Figure1).
3 Figure 1.1 : Présentation schématique du gène FMR1 humain. Les 17 exons du gène FMR1 sont représentés par les rectangles bleus. Les répétitions CGG sont contenues dans la région non traduite de l’exon 1. Les domaines fonctionnels sont indiqués en vert. NLS : Signal de Localisation Nucléaire; KH1/KH2 : K Homology 1/2; NES : Signal d’Export Nucléaire; RGG : boîte arginine-glycine-glycine. Figure adaptée de la Penagarikano et al., 2007.
4
1.3 La famille FXR
La protéine FMRP fait partie d’une famille de protéines liant l’ARN, appelée Fragile X Related (FXR). Cette famille comprend deux paralogues de FMRP : Fragile X Related 1 protein (FXR1P) et Fragile X Related 2 protein (FXR2P) (Khandjian., 1999). Tous deux sont des gènes autosomiques localisés, respectivement, sur le chromosome 3 en position 3q28 et sur le chromosome 17 en position 17p13.1 (Coy et al., 1995; Wilgenbus et al., 1996).
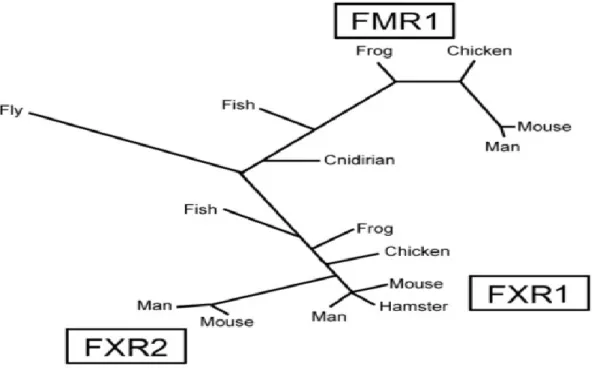
Les gènes FMR1, FXR1 et FXR2 sont bien conservés au cours de l’évolution (Figure 1.2). Chez la drosophile, il existe un seul gène, dFMR1 qui est considéré comme l’ancêtre commun des trois membres de cette famille FXR. Il existe aussi plusieurs orthologues de ces 3 gènes présents chez les mammifères et le poisson-zèbre (Ashley et
al., 1993a; Price et al., 1996; Wan et al., 2000; Van 't Padje et al., 2005). Xenopus laevis
contient, également, deux orthologues : xFmrp et xFrx1 (Siomi et al., 1995, Huot et al., 2005). Chez Hydractinia echinata, il y a un seul orthologue du gène FMR1, yFMR1 qui fait partie de l’embranchement des Cnidaires (Guduric-Fuchs et al., 2004).
Figure 1.2 Les membres de la famille FXR sont conservés durant l’évolution (Figure tirée de Huot, 2005).
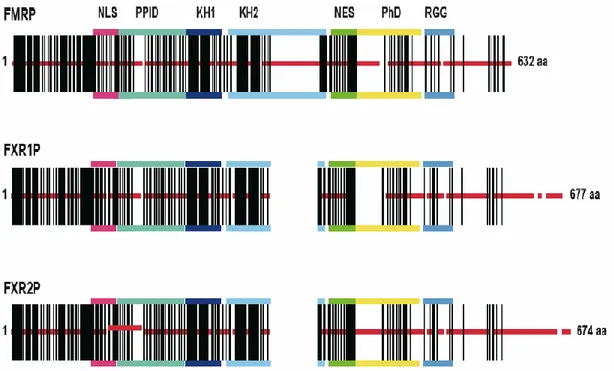
5 Les trois protéines se ressemblent structurellement (Bardoni et al., 2006) (Figure 1.3) et possèdent des domaines fonctionnels analogues ce qui suggère qu’elles sont susceptibles de se substituer et ainsi de compenser éventuellement un déficit fonctionnel. Les FXRP peuvent aussi former des homo- et des hétérodimères via leur domaine d’interaction protéine-protéine (PPID) (Mazroui et al., 2003).
Figure 1.3 : Présentation schématique des structures des membres de la famille FXRP. Les barres verticales (en noir) correspondent aux acides aminés identiques; les barres horizontales (en rouge) représentent les acides aminés divergents; les espaces blancs correspondent à des zones absentes dans la protéine. En haut les domaines fonctionnels correspondant aux signaux de localisation nucléaire (NLS) et d’export nucléaire (NES), aux motifs de reconnaissance de l’ARN (KH1, KH2 et RGG), au domaine d’interaction protéine-protéine (PPID) et enfin au domaine phosphorylé (PhD) sont indiqués. Les paralogues de FMRP sont : FXR1P = Fragile X related 1 protein; FXR2P = Fragile X related 2 protein (Figure adaptée de Bardoni et al., 2006).
6
1.4 Les domaines fonctionnels de la protéine FMRP
1.4.1 Les domaines de liaison à l’ARN
Les protéines FXR possèdent trois domaines distincts de liaison à l’ARN : KH1, KH2 et RGG. Les deux premiers possèdent une séquence consensus (K Homology) découverte pour la première fois chez la protéine hnRNP K (Siomi et al., 1993). Tous les membres de la famille de protéines FXR possèdent ces deux boîtes KH et 90 % des acides aminés composant ces domaines sont identiques chez les trois protéines. L’importance fonctionnelle des domaines KH a été confirmée par l’identification de la mutation I304N au niveau du domaine KH2 causant un phénotype X fragile très sévère (De Boulle et al, 1993).
Le domaine RGG, troisième domaine permettant à la protéine de lier l’ARN est riche en arginine et glycine (Matunis et al., 1992). Il a été initialement isolé dans la protéine hnRNP U par Kilidjian et Dreyfus (1992). La région RGG possède une forte charge électrique positive qui lui permet d’attirer le squelette négativement chargé des acides nucléiques (Kilidjian et al., 1992).
Il a été montré que le motif RGG de FMRP se lie à des séquences qui ont le potentiel pour former une structure intramoléculaire, le G-quartet, présente au niveau de l’ARNm FMR1 et dans plusieurs autres ARNms (Brown et al., 2001; Schaeffer et al., 2001), ce qui suggère que ce motif peut servir de médiateur spécifique de l’interaction FMRP-ARN.
1.4.2 Le domaine d’interaction protéine-protéine (PPID)
Le domaine PPID (Protein Protein Interaction Domain) est situé dans la région N-terminale de la protéine FMRP. II est très conservé au sein de la famille FXR et est impliqué dans l'interaction de FMRP avec ses partenaires protéiques et d'autres protéines spécifiques : FXR1P, FXR2P, NUFIP1 (nuclear FMRP-interacting protein 1), CYFIP1/2
7 (cytoplasmique FMRP interacting protein 1/2) (Bardoni et al., 2002; Bardoni et al., 2006). Des expériences montrent que la délétion de ce domaine abolit la fixation de FMRP aux polyribosomes (Mazroui et al., 2003). Ceci suggère que les interactions protéine-protéine sont aussi (en plus de l'interaction à l’ARN) importantes pour le rôle de FMRP. Cette caractéristique est propre aux protéines liant l’ARNm puisqu’elles forment des complexes nommés RiboNucléoParticules (mRNPs) composés de l’ARNm et des protéines régulant la traduction de l’ARNm. Les protéines FXR sont souvent présentes dans de tels complexes.
1.4.3 Le NLS et le NES
La protéine FMRP dans les cellules se localise dans la majorité des cas dans le cytoplasme, seulement 5 % se retrouve dans le noyau (Devys et al, 1993). Par contre, l’isoforme sans l’exon 14 se localise uniquement dans le noyau (Sittler et al, 1996). Cela explique la présence d’un signal d’export cytoplasmique ou NES (Nuclear Export Signal) dans l’exon 14 (Eberhart et al, 1996). La protéine FMRP possède également un signal de localisation nucléaire ou NLS (Nuclear Localisation Signal) (Eberhart et al, 1996). Ces deux domaines permettent le transit de la protéine dans le noyau et implique le transport des ARNm du noyau vers le cytoplasme (Eberhart et al., 1996; Tamanini et al., 1999).
1.4.4 Domaine de phosphorylation
Un nouveau domaine dans la protéine FMRP chez l’humain ainsi que chez la drosophile a été démontré pouvant être phosphorylé. Ce domaine se situe entre la boite RGG et le domaine NLS et il a été proposé que la phosphorylation de la protéine FMRP pourrait jouer un rôle dans la régulation de ses fonctions physiologiques (Siomi et al., 2002).
Le domaine de phosphorylation se trouve sur un acide aminé hautement conservé dans la famille FXRP chez différentes espèces (Ser406 dans dFMRP et Ser500 dans hFMRP) et la Caséine Kinase II (CKII) a été identifiée comme étant responsable de la phosphorylation de ce domaine de la protéine FMRP (chez l'humain et la drosophile). Par
8 ailleurs, FMRP possède d'autres sites probables de phosphorylation (Thr455, Thr518). La délétion de la région contenant ces trois résidus, n'abolit pas la capacité de liaison de la FMRP aux RNPm et aux polyribosomes selon l’étude faite par Mazroui et al., 2003.
1.4.5 Le mutant I304N
Un des cas les plus sévères du syndrome de retard mental de l’X fragile est le mutant I304N de la protéine FMRP. Cela a été identifié comme un cas unique de mutation ponctuelle créant la conversion d’une isoleucine en asparagine à la position 304 dans le domaine KH2 de FMRP (De Boulle et al., 1993; Siomi et al., 1994). Ceci suggère que ce domaine est important à la position 304 puisque le changement d’un seul acide aminé entraînait un phénotype aussi sévère qui est l’inactivation totale de FMR1. Cette mutation altère la capacité de FMRP de s’associer aux polyribosomes, même si elle est encore capable de lier l’ARNm (Feng et al., 1997a; Mazroui et al., 2003), ce qui pourrait expliquer le phénotype très sévère du porteur de cette mutation.
1.5 Fonction de FMRP
Par ses propriétés de liaison à l’ARN, la protéine FMRP pourrait être impliquée dans le métabolisme de l’ARN. De plus, la présence d’un signal d’export cytoplasmique et d’un signal de localisation nucléaire suggère qu’elle pourrait être impliquée dans le transport d’ARNm du noyau vers le cytoplasme. Enfin, sa présence dans les granules de transport des ARNm suggère un rôle possible dans la régulation de la traduction de certains ARNm (pour revues, Bagni & Greenough, 2005; Davidovic et al., 2006; Zalfa et al., 2006; Bardoni et al., 2006).
1.5.1 Rôle dans la régulation de la traduction
FMRP semble jouer un rôle dans la régulation de la traduction des ARNm, puisqu’elle se retrouve sur les polyribosomes en traduction active (Corbin et al., 1997; Dube et al., 2000; Khandjian et al., 1996). FMRP se retrouve cependant aussi dans des structures contenant des ARNm sous forme réprimée ce qui suggère que FMRP se comporte plutôt comme une protéine ayant un rôle de répresseur traductionnel (Laggerbauer et al., 2001;
9 Mazroui et al., 2002). Cette répression semble être fonction de la concentration de la protéine. En effet, à haute concentration, FMRP piège les ARNm qui quittent les polyribosomes et s’agglomèrent sous forme de granules contenant des ARNm réprimés (Mazroui et al., 2002). La figure 1.4 illustre cette activité répressive de la traduction.
Dans les neurones, des études montrent que la majorité des protéines FMRP cytoplasmiques sont incorporées dans les polyribosomes indépendamment des microtubules et qu’elle pourrait intervenir dans l’élongation de la traduction (Wang et al., 2008). Par contre, la fraction de protéines FMRP associées aux microtubules est transportée avec des mRNP dont la traduction est bloquée au niveau des granules à ARN (Wang et al., 2008). FMRP pourrait avoir un effet répresseur et participer à l’inhibition de l’initiation de la traduction au sein de ces granules à ARN.
Un des mécanismes moléculaires importants suggérés par rapport à la fonction de la protéine FMRP est le fait que celle-ci pourrait servir de chaperonne moléculaire (Gabus
et al., 2004; Ivanyi-Nagy et al., 2005). FMRP aurait un rôle dans la stabilisation de la
conformation de ses ARNm cibles. Par ailleurs, un plus grand nombre de protéines FMRP, en parallèle avec d’autres protéines, pourrait contribuer à l’empaquetage de l’ARNm, le rendant ainsi inaccessible à l’appareil de traduction (Ivanyi-Nagy et al., 2005).
Il a également été proposé que la protéine FMRP intervienne dans la voie de micro-ARN (Plante et Provost, 2006; Plante et al., 2006) en se liant au complexe RISC (RNA-Induced
10 Figure 1.4 : Modèle de la répression des RiboNucléoParticules (mRNPs) par FMRP A) Dans les cellules, il existe un équilibre entre les mRNPs réprimées et les mRNPs traduits. B) L’ajout de cycloheximide bascule l’équilibre vers les polyribosomes en bloquant les mRNPs sur ces mêmes polyribosomes. C) Lors de stress, il y a arrêt de la traduction et formation de granules de stress où les mRNPs se retrouvent réprimées. D) L’ajout de cycloheximide abolit la formation des granules en bloquant les mRNPs sur ces mêmes polyribosomes, ce qui réactive la traduction des mRNPs. E) L’augmentation du niveau de FMRP entraîne la formation de granules cytoplasmiques (ou de transport) contenant des mRNPs réprimées. Cet équilibre peut être renversé par l’action de la cycloheximide. Figure adaptée de Mazroui et al., 2002.
11
1.5.2 FMRP dans les neurones
Il a été démontré que les épines dendritiques des souris KO pour le gène FMR1 étaient anormalement longues, minces et tortueuses (Comery et al., 1997). Ces mêmes caractéristiques d’épines immatures ont été observées précédemment sur les cadavres de patients X-fragile (Rudelli et al., 1985; Hinton et al., 1991). Ces épines longues montrent une diminution de leurs mouvements, qui sont essentiels à l’établissement de connexions avec d'autres neurones d’où l’importance de FMRP dans la plasticité des ces dernières (Antar et al., 2006). Il a également été remarqué que dans le cerveau de souris dépourvu du gène Fmr1 (KO), plusieurs ARNm ainsi que les protéines correspondantes montrent des changements à la fois de localisation et d’abondance (Miyashiro et al., 2003).
Plusieurs études suggèrent une implication de la protéine FMRP dans la régulation de la traduction d’ARNm au niveau des dendrites. FMRP a été démontré s’associer avec des ARNm qui codent pour des protéines régulatrices du cytosquelette et des synapses. Une des cibles de FMRP est l’ARNm de la protéine MAP1B (Microtubule-Associated Protein
1B) associée aux microtubules. Chez la drosophile, des interactions ont été observées
entre dFMRP et la petite GTPase Rac1 qui intervient dans la régulation du cytosquelette d'actine (Schenck et al., 2003). D’autres ARNm tels que : l’ARNm de la protéine PSD-95 (Postsynaptic Density Protein of 95 kD), le facteur d’élongation EF-1α (Elongation
Factor 1 α), ou encore APP (Amyeloid Precursor Protein) se lient à FMRP et sont
essentiels à la plasticité synaptique. Cette régulation est mise en place en réponse à l’activation des récepteurs métabotropiques au glutamate du groupe I (mGluR1 et mGluR5) (Sung et al, 2003; Muddashetty et al., 2007; Zalfa et al., 2007; Westmark & Malter, 2007; Davidkova & Carroll, 2007).
Ainsi, chez les patients atteints de l’X fragile, l’absence de la protéine FMRP provoquerait la synthèse en continu des protéines normalement activées sous l’influence des récepteurs mGluR. Cette dérégulation dans la synthèse protéique serait à l’origine des changements synaptiques pouvant expliquer les désordres cognitifs observés dans cette pathologie.
12
1.6 Les granules à ARN
Les granules à ARN sont des RiboNucléoParticules (mRNPs) cytoplasmiques qui ont un rôle important dans la régulation postranscriptionnelle de l'expression des gènes en modulant la traduction et la dégradation des ARNm. Il en existe plusieurs types, parmi ces dernières : les granules de stress (GS), les granules neuronaux dans les neurones et les granules causées par la surexpression de FMRP nommées granules FMRP.
1.6.1 Granules neuronaux
Les granules neuronaux représentent des mRNPs spécifiques reliés au cytosquelette du neurone permettant le transport rapide des ARN, sous forme réprimée, du soma jusqu'aux synapses tout au long des axones et dendrites (pour revue Kiebler et Bassell, 2006). Arriver à destination, ces ARN seront libérés et leur traduction reprendra en réponse à des stimuli spécifiques (pour revue Kosik et Krichevesky, 2002). Les granules neuronaux contiennent les protéines des deux sous-unités ribosomales, grandes et petites, plusieurs protéines impliquées dans le transport de l'ARN, de sa stabilité et la régulation de sa traduction : FMRP en est parmi les plus connus (pour revue Khandjian et al., 2009). Les granules neuronales contenant FMRP se déplacent dans les dendrites suite à l'activation des récepteurs métabotropiques du glutamate (Antar et al., 2004),
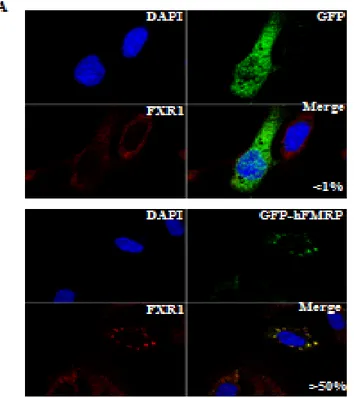
Des études suggèrent que FMRP sert de lien entre les granules à ARN et les molécules moteurs. En effet, la protéine KIF3C, une protéine adaptatrice couplant les granules à ARN aux molécules moteurs interagit avec la protéine FMRP et colocalisent au sein des mêmes granules de transport (Davidovic et al., 2007).
Plusieurs études démontrent que la protéine FMRP est relocalisée dans les granules neuronales de manière dépendante du réseau de microtubules (De Diego Otero et al., 2002; Antar et al., 2005). D'ailleurs, il existe une interaction directe entre FMRP et la protéine moteur neuronale, la kinésine KIF3C (Kinesin Family member 3C) (Davidovic
13 avec l'aide de la protéine FMRP via son interaction avec la kinésine KIF5 (Dictenberg et
al., 2008). Cela nous suggère que les microtubules auraient un rôle essentiel à jouer dans
l'assemblage de granules à ARN via la protéine FMRP, ainsi que dans la séquestration d'ARNm dans ces granules.
1.6.2 Les granules de stress :
Les granules de stress (GS) sont des complexes cytoplasmiques RiboNucléoProteiques qui se forment lorsque l'initiation à la traduction est altérée, soit lorsqu’il y a une diminution du taux de traduction suite à une réponse aux stress (Kedersha et al., 1999), ou l'ajout de drogues bloquant initiation de la traduction (Dang et al., 2006; Mazroui et
al., 2006; Mokas et al., 2009), la baisse d’expression de certains facteurs d'initiation à la
traduction (Mokas et al., 2009), ou la surexpression des protéines liant l'ARN pouvant réprimer la traduction (Mazroui et al., 2002; Gilks et al., 2004; Kedersha et al., 2005; Wilczynska et al., 2005; De Leeuw et al., 2007). Une fois le stress arrêté, les granules de stress commencent à se désagréger à une vitesse constante et disparaissent progressivement tant que les sentiers de mort cellulaire ne sont pas activés de façon irréversible (Kedersha et al. 1999, Kedersha et al. 2000).
Il est aussi possible d’observer des GS chez les levures Saccharomyces cerevisiae (Buchan et al., 2008; Grousl et al., 2009) et Saccharomyces pombe (Dunand-Sauthier I et
al., 2002), le protozoaire Trypanosoma brucei (Kramer et al., 2008), le métazoaire Caenorhabditis elegans (Jud MC et al., 2008) et Drosophila melanogaster (Farny et al.,
2009) ainsi que les chloroplastes de plante (Uniacke et Zerges, 2008). La présence de granules de stress chez tous ces types cellulaires, tant chez les animaux que chez les végétaux, indique que cette réponse au stress est très bien conservée et laisse sous-entendre son importance.
14
1.6.2.1 Composition des granules de stress
Les granules de stress sont des complexes cytoplasmiques qui, jusqu'à présent, n'ont pu être purifiés par les techniques d'analyse biochimique. Les granules de stress sont insolubles par des détergents non-ioniques (Mazroui et al., 2002) et ils sont résistants à différents traitements enzymatiques et biochimiques tel que des traitements à la RNAse, la DNAse, aux protéases, ainsi qu’à des lavages hypo et hypertoniques en sels (Lapointe 2004). La résistance des granules de stress à ces divers traitements chimiques et enzymatiques explique la difficulté de les manipuler. C'est la raison pour laquelle toutes les données concernant leur composition ont été obtenues par microscopie à fluorescence (pour revue Anderson et Kedersha, 2008; 2006).
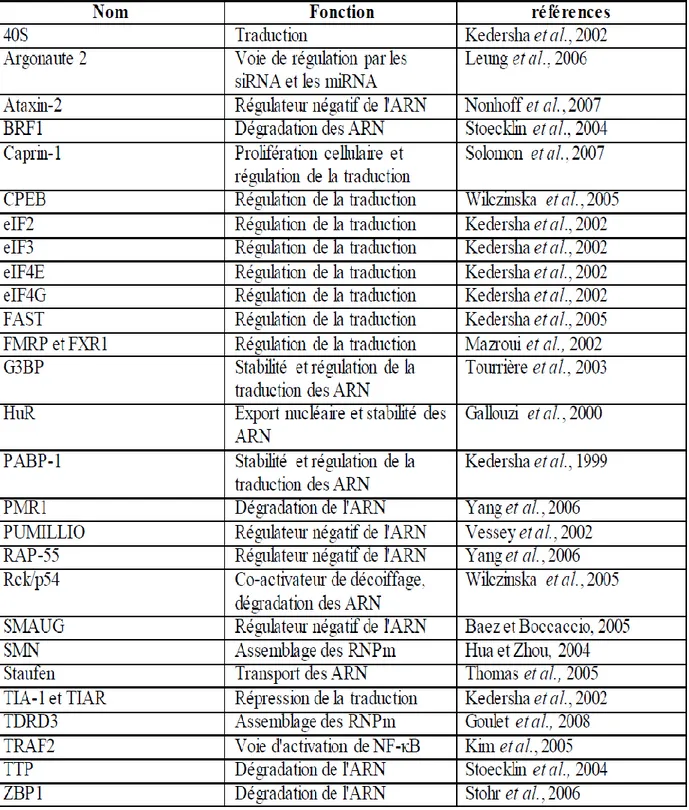
Les granules de stress contiennent généralement les ARNm poly (A) +, la sous-unité ribosomale 40S, les facteurs d’initiation à la traduction (eIF4E, eIF4G, eIF4A, eIF4B), la protéine de liaison poly (A) (PABP), eIF3, et eIF2 (Kedersha et al., 1999, 2002; Kimball
et al., 2003;. Mazroui et al., 2006; Anderson et Kedersha 2006), bien que la composition
15
Tableau 1 : Principaux composants des granules de stress
16
1.6.2.2 Mécanismes de formation des granules de stress
1.6.2.2.1 Dépendamment de la phosphorylation du facteur
eIF2α
Une étape importante et critique pour la formation des granules de stress est la phosphorylation de la sous-unité α du facteur d'initiation eIF2 au niveau du résidu Ser51 par la famille des kinases (PKR : protein kinase R, PKR-like ER kinase, GCN2, HRI : heme regulated inhibitor) (pour revue Kimball, 1999). Ces kinases sont activées par plusieurs stress tels que le choc thermique, le stress oxydatif et l’hyperosmolarité (Anderson et Kedersha, 2002), l’arsenite (Kedersha et al., 2000; Kedersha et al., 2002; Mazroui et al., 2002), les inhibiteurs de proteasome (Mazroui et al., 2007) et les infections virales (Mazroui et al., 2006; McInerney et al., 2005). Cette phosphorylation empêche l'échange du GDP en GTP durant le recyclage du complexe eIF2 par l'eIF2B, ce qui prévient la formation d'un complexe ternaire (eIF2-GTPtRNAiMe) fonctionnel. Le complexe ternaire fait partie du complexe 43S qui est recruté à l'ARNm par le complexe eIF4F (eIF4E, eIF4G, et eIF4A) au cours de l’initiation de la traduction. Ainsi, il y aura inhibition de l’initiation de la traduction (Gebauer et Hantze, 2004).
L’importance de la phosphorylation du facteur eIF2α dans la formation des granules de stress a été montrée dans plusieurs expériences telles que l'expression d'un mutant recombinant phosphomimétique du facteur eIF2α (S51D) qui est suffisante pour induire la formation des granules de stress (Kedersha et al., 2002); l'expression aussi d'un mutant recombinant non-phosphorylable de l'eIF2-a (S51A) bloque la formation des granules de stress (Kedersha et al., 2002); enfin, des fibroblastes de souris n'exprimant que la mutation de la forme non-phosphorylable de l'eIF2-a (S51A) sont incapables de former des granules de stress en réponse au choc thermique, au stress oxydatif (arsénite), et aux inhibiteurs du protéasome. Toutes ces études témoignent du rôle critique de la phosphorylation du facteur d’initiation eIF2α dans la formation des granules de stress.
17
1.6.2.2.2 Indépendamment de la phosphorylation du facteur
eIF2α
Il a été aussi montré aussi que la formation des granules de stress peut se faire dans des conditions des stress en l'absence de la phosphorylation du facteur eIF2α (Kedersha et al., 2002).
Des traitements avec des drogues inhibitrices de l'activité respiratoire des mitochondries telles que les inhibiteurs de la glycolyse (2-déoxyglucose), du potentiel membranaire des mitochondries (FCCP) et de l'ATPase mitochondriale (oligomycine), induisent l'assemblage des granules de stress sans la phosphorylation de ce facteur.
Il a été démontré aussi que deux petites molécules inhibitrices de l'initiation de la traduction, la patéamine A (extraite d'une éponge marine) et l’hippuristanol (extrait d'un corail) peuvent induire la formation des granules de stress à travers un autre mécanisme indépendamment de la phosphorylation de l'eIF2α (Dang et al., 2006; Mazroui et al., 2006). Ces deux molécules inhibent la traduction en ciblant l'hélicase d'ARN eIF4A impliquée dans le recrutement des ribosomes vers les ARNm (Rogers et al., 2002). L'eIF4A consomme de l'ATP pour former le complexe eIF4F avec l'eIF4G et l'eIF4E. Ce complexe est responsable du recrutement des ribosomes en permettant la liaison du complexe 43S à l'ARNm (Gingra et al., 1999). La patéamine A semble modifier l'activité ATPasique ARN-dépendante de l'eIF4A, sa liaison à l'ARNm ainsi que son activité hélicase, tandis que l'hippuristanol empêche la liaison de l'eIF4A à l'ARNm. Dans les deux cas, le recrutement des ribosomes n'a pas lieu (Bordeleau et al., 2006, Low et al., 2005). Des études indiquent que l'exposition des cellules à la patéamine et à l'hippuristanol conduit à l'inhibition de la traduction qui s'accompagne de la formation des granules de stress, qui a lieu en absence de la phosphorylation du facteur eIF2α (Dang et al., 2006; Mazroui et al., 2006). On peut noter aussi que les virus comme le poliovirus qui clive les sous-unités eIF4GI eIF4GII de l'eIF4F empêchant ainsi le recrutement du ribosome à l'ARNm, ce qui entraîne la formation des granules de stress indépendamment de la phosphorylation du facteur eIF2α (Mazroui et al., 2006).
18
1.6.2.3 Dynamique des granules de stress
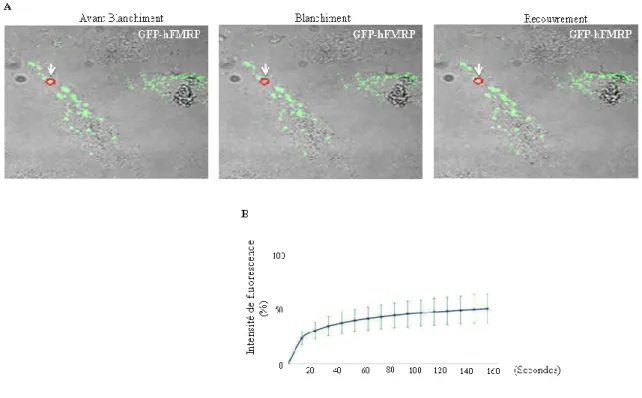
Des études in vivo de photodégradation, ou FRAP (Fluorescence recovery after
photobleaching), ont montré que certaines protéines liant l'ARN présente dans les GS
(par exemple, TIA-1, TIAR, TTP, G3BP et PABP) transitent rapidement dans et hors les GS malgré leur grande taille et la solidité apparente de ces structures, ce qui suggère un échange continuel des composants avec le cytoplasme d’où la difficulté de la purification des GS. En effet, les GS ne sont pas des dépôts stables d'ARNm non traduits; les inhibiteurs de l’initiation de la traduction tels que la pateamine et l’hupiristanol induisent la formation de granules de stress. Par contre, la cycloheximide ou l’émétine qui fixent les ribosomes sur l’ARNm en phase d’élongation de traduction inhibent l’induction des GS (Kedersha et al.. 2000, Mazroui et al., 2002).
1.6.2.4 Fonction des granules de stress
a. Stockage, triage et stabilisation des ARNm
Étant donné que de nombreux composants des granules de stress sont des répresseurs de traduction, et leur formation corrèle avec une diminution globale de la traduction, les granules de stress sont considérées comme des sites où la traduction des ARNms est réprimée (Anderson et Kedersha, 2009). Toutefois, leur formation n'engendre pas nécessairement la répression de la traduction globale (Buchan et al., 2008; Ohn et al., 2008; Mokas et al., 2009; Fujimura et al., 2009; Loschi et al., 2009). Certains ARNm spécifiques sont inefficacement réprimés lorsque les protéines liant l'ARN qui contribuent à la formation de granules de stress sont modifiées (Moeller et al., 2004; Kedersha et al., 2000; Gilks et al., 2004; Tsai et al., 2008; Mazroui et al., 2007), mais ces effets peuvent simplement refléter la perte d'un composant régulateur spécifique du mRNP plutôt que l'échec d'assembler un granule.
19 Les granules de stress sont des sites de stockage des ARNm, où la traduction y est réprimée. La présence dans les GS des protéines qui régulant positivement (HuR) ou négativement (G3BP, TTP) la stabilité de l'ARNm soulève la possibilité que les granules de stress n'aient pas seulement une fonction de stockage, mais aussi de sélection des ARNm destinés à être traduits ou dirigés vers les systèmes de dégradation après la récupération (Anderson et Kedersha, 2002; Stoeckline et al., 2004).
Certains travaux démontrent que les granules de stress ont également la fonction de stabilisation des ARNm. Pendant une grande variété de réponses au stress, la deadenylation des ARNm, qui est une condition préalable à la dégradation de la plupart des ARNm, est largement inhibée (Laroia et al., 1999; Hilgers et al., 2006; Gowrishankar
et al., 2006). Cependant, du moins chez la levure, des mutations qui empêchent la
formation de granules de stress, n'affecte pas la stabilisation des ARNms testés au cours du stress (Buchan et al., 2008). Par ailleurs, la deadenylation est inhibée au cours du stress, même lorsque l'ARNm est piégé dans les polysomes (Hilgers et al., 2006). Il est donc possible que la formation des GS induise la stabilisation spécifique d’ARNm.
b. Les granules de stress et la régulation physiologique
Plusieurs études montrent un rôle important des granules de stress dans plusieurs systèmes de régulation au sein de l'organisme. Par exemple, chez les poules traitées avec de la gentamycine, un antibiotique ototoxique, les GS apparaissent dans les cellules de la cochlée (organe dans l'oreille interne) plusieurs heures avant le déclenchement de l'apoptose (Mangiardi et al., 2004). Une autre étude montre que la radiothérapie induit l'assemblage des GS dans les cellules tumorales (Moeller et al., 2004), dans lesquelles l'ARNm codant pour le HIF-1 (hypoxia inducible factor-1), un activateur de transcription, se trouve piégé et son expression est inhibée, ce qui suggère que l'expression de ce transcrit est momentanément inhibée.
20
1.6.3 Similitudes entre les granules de stress et les granules
neuronaux
Les composants du cytosquelette sont largement impliqués dans le transport et la localisation intracellulaire de plusieurs ARNm. Au niveau des neurones, les ARNm codant pour des protéines synaptiques sont transportés dans des granules neuronaux le long des microtubules des axones (pour revue Khandjian et al, 2009; Davidovic et al, 2007; Bassell et Singer, 1997; Knowles et al, 1996). Les GS partagent quelques particularités avec les granules neuronaux notamment la présence des protéines de liaison à l'ARN telles que FMRP (Davidovic et al, 2007) et Staufen (Thomas et al, 2005). Comme les GS, les granules neuronales sont des sites de stockage des ARNm reprimés, indiquant des fonctions similaires. Les mécanismes de formation des granules neuronales sont cependant inconnus.
1.6.4 Similitudes entre les GS et les granules FMRP
L’importance des granules a augmenté à la suite de la découverte qu’elles peuvent être induites par une surexpression de certaines protéines impliquées dans le contrôle de la traduction. C’est le cas de FMRP, une protéine liant l’ARNm qui se retrouve dans les polyribosomes (Corbin et al., 1997, Mazroui et al., 2002). Bien que la fonction exacte de FMRP soit encore inconnue, il a été observé qu’il s’agit d’un régulateur négatif de la traduction très fortement exprimé dans les neurones et dont l’absence est impliquée dans le syndrome du X fragile (Khandjian et al., 1995 ; Laggerbauer et al., 2001 ; Mazroui et
al., 2002).
Les granules FMRP sont induites par une augmentation d’expression de FMRP. Ces granules contiennent les ARNm et certains marqueurs des GS. De ce faite, elles sont considérées comme étant des granules similaires aux GS. Les mécanismes de formation des granules FMRP ainsi que leur dynamique, restent inconnus.
21
1.7 Problématiques
L’ensemble des propriétés de la protéine FMRP décrites dans cette introduction illustre bien le large éventail de ses possibles fonctions. Comme je l’ai mentionné, FMRP est présente dans les granules à ARN et joue un rôle dans la régulation de la traduction (pour revue, Bardoni et al, 2006). Cependant le rôle exact de FMRP dans la formation de ces granules reste inconnu.
Il a déjà été montré que l'expression de la protéine FMRP chez les mammifères peut induire la formation de granules cytoplasmiques à ARN qui ressemblent aux granules neuronaux et aux granules de stress. Les mécanismes de formation de ces granules-FMRP et leur dynamisme sont cependant totalement inconnus. En utilisant cette propriété de la protéine FMRP de former des granules et en se servant d’un modèle génétiquement simple tel que les cellules de drosophile, cela nous a permis de mieux comprendre le rôle de la protéine FMRP sans l’interférence de ses homologues dans la formation et le dynamisme des granules à ARN.
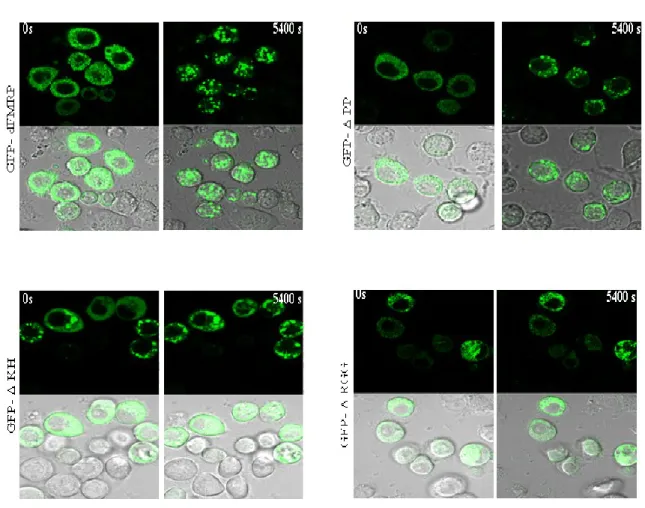
En débutant ce travail de thèse, peu d’information était disponible sur les domaines intervenant dans le recrutement de la protéine FMRP et son dynamisme dans les granules à ARN. Dans le but de mieux comprendre l’importance de ces domaines de FMRP, nous avons préparé plusieurs constructions dépourvues de domaines importants de la protéine, tels que le domaine d’interaction protéine-protéine (PP) qui s’est révélé important pour l’induction des granules-dFMRP et le dynamisme de dFMRP dans les granules de stress.
b
Chapitre II :
22
2- MATERIEL ET METHODES
2.1 Lignées cellulaires
Les cellules HeLa : lignée cellulaire cancéreuse provenant d'une patiente atteinte d'un cancer du col de l'utérus, a été obtenue de l'American Type Culture Collection (Manassas, VA, ATCC).
Les fibroblastes embryonnaires de souris (MEF) de type sauvage (WT) et les fibroblastes embryonnaires de souris dépourvus de FMRP : MEF FMR1-/- appelés STEK ont été décrits précédemment Mazroui et al, 2002.
Ces trois lignées cellulaires sont cultivées dans le milieu DMEM (Dulbecco’s Modified Eagle Medium) supplémenté avec 10 % de sérum bovin fœtal (FBS), ainsi que de pénicilline (100 Unités/ml), de streptomycine (50 ug/ml). Les cellules sont cultivées sous une atmosphère humide à 5 % de CO2.
Les cellules Schneider de drosophile S2 ont été obtenues du Dr Robert Tanguay (Université Laval) et ont été cultivées à 25 º C en milieu Schneider (Sigma-Aldrich) supplémenté avec 10 % de sérum bovin fœtal (FBS; Sigma) ainsi que la pénicilline (100 Unités/ml) et streptomycine (50 ug/ml).
2.2. Stress
a- Traitement à l’arsénite
Les cultures de cellules à une confluence de 60-70 %, sont incubées avec l’arsénite (agent de stress oxydatif) à une concentration de 0,5 mM pendant 60 min. Elles sont ensuite rapidement, soit observées pendant le traitement au microscope confocal “live”, soit lavées avec du PBS IX froid puis fixées pour des analyses telles que : l’immunofluorescences ou l’hybridation in situ.
23
b- Choc thermique
Les cellules de drosophile à une confluence de 60-70 %, sont incubées à 37 °C pendant 1 h 30 Elles sont ensuite rapidement soit directement observées pendant le traitement au microscope confocal, soit lavées avec du PBS IX froid puis fixées pour des analyses telles que : l’immunofluorescences ou l’hybridation in situ.
2.3 Manipulation de l'ADN
À mon arrivée dans le laboratoire du Dr Mazroui, les vecteurs que j’ai utilisés avaient été déjà établis. Le détail des clonages sont décrits çi bas :
Les vecteurs pAC-GFP-C2 codant pour GFP-hFMRP et GFP-I304N ont été produits comme suit: pET21a-FMRP et pET21a-I304N (Mazroui et al., 2003) ont d'abord été digérés avec EcoR1 et BamH1. Les fragments FMRP isolés ont été ensuite insérés dans pAC-GFP-C2 préalablement digéré par EcoR1 et BamH1. Pour générer le vecteur pAc5.1/V5-HisA (Invitrogen) codant pour GFP-dFMRP, l'ARN total a été extrait à partir de cellules de drosophile avec le kit de transcription inverse Omniscript (Qiagen) et utilisé pour produire l’ADNc dFMRP en utilisant oligo dT. Le produit de cette transcription est ensuite soumis à une réaction de PCR en utilisant dFMR1-Xho1-F (5'GGCCTCGAGCTATGGAAGATCTCCTCGTG 3') et dFMR1-EcoR1-Rend (5' GGCGAATTCTTAGGACGTGCCATTGAC 3') afin d'amplifier l'ADNc dFMRP. Cet ADN a été ensuite digéré, purifié et incorporé par ligation dans le vecteur Pac-GFP-C1 digéré par Xho1 et EcoR1 pour générer GFP-dFMRP. GFP-dFMRP a ensuite été amplifié
par PCR en utilisant GFP-F-EcoR1 oligo (5
'GGCGAATTCCGCCACCATGGTGAGCAA 3') et dFMR1-EcoR1-R (5
'GGCGAATTCTTAGGACGTGCCATTGAC 3'). Le produit de PCR GFP-dFMRP est ensuite digéré à ses deux extrémités avec EcoR1 et purifié pour être inséré dans le vecteur pAc5.1/V5-HisA de drosophile préalablement digéré avec EcoR1. Les vecteurs pAc5.1/V5-HisA codant pour GFP-dFMRP-RGG, KH et PP ont été générés par ligation des produits PCR pAc5.1/V5-HisA- GFP-dFMRP. Les produits de PCR ont d'abord été digérés par les enzymes de restriction correspondantes dont les sites sont
24 présents dans les amorces utilisées pour l'amplification par PCR avant la ligature. Pour le mutant GFP-dFMRP-ΔPP, les amorces GFP-F EcoR1 et BamH1 dFMRP-R342 ont été utilisés pour amplifier le premier fragment PCR. Ceux qui sont utilisés pour amplifier le deuxième fragment sont dFMRP-BamH1 F654 et dFMRP-Xba1 R. Les deux fragments ont été digérés et reliée à pAc5.1/V5-HisA préalablement digéré par EcoR1 et Xba1. Pour le mutant GFP-dFMRP-ΔKH, le premier fragment de PCR a été amplifié avec les amorces GFP-F EcoR1 et BamH1 dFMRP-R672, et le second fragment avec le F1012 dFMRP-BamH1 et Xba1-dFMRP. Les fragments amplifiés ont été digérés et ligaturés dans pAc5.1/V5-HisA préalablement digéré par EcoR1 et Xba1. Pour le mutant GFP-dFMRP-ΔRGG, nous avons utilisé les amorces GFP-EcoR1 F et dFMRP-BamH1 R1413 pour amplifier le premier fragment PCR et les amorces F1519 dFMRP-BamH1 avec dFMRP-Xba1 R pour amplifier le second fragment PCR. Les fragments de PCR ont été digérés et ligaturé dans pAc5.1/V5-HisA qui a été digéré avec EcoR1 et Xba1.
2.4 Immunofluorescence
Les cellules sont ensemencées sur des lamelles de verre dans des plaques de 6 puits. Après que ces dernières soient traitées et incubées comme indiqué dans chaque expérience, elles sont lavées deux fois avec le tampon PBS à 4 °C, puis sont fixées et perméabilisées pendant 15 à 20 minutes à -20 °C dans une solution de méthanol/acétone (3 : 7). Les lamelles sont ensuite séchées à l'air libre.
Après leur réhydratation dans du PBS, les cellules sont incubées à la température ambiante pendant 30 min avec du PBS contenant 1 % d'albumine bovine afin de bloquer les sites non spécifiques. Après cette fixation et perméabilisation, les cellules sont incubées avec des anticorps primaires dilués dans 0,1 % Tween-20/PBS (PBST) pour 1 h 30 à température ambiante. Après lavage trois fois pendant 30 min avec du PBST, les cellules sont incubées avec l’anticorps secondaire anti-souris ou anti-lapin (dépendamment de l’anticorps primaire) qui est conjuguée avec le colorant Alexa Fluor avec le maximum d'absorption appropriée (405/488/594) pendant 60 min dans l’obscurité. Les cellules sont ensuite, lavées trois fois pendant 30 min puis mises en contact avec le DAPI (Dihydrochlorure de 4',6-diamidino-2-phenylindole, 1 : 20 000,
25 dilué dans le tampon PBS) pendant quelques minutes, pour colorer l’ADN. Finalement les cellules sont lavées trois fois avec du PBS pour être montées sur les lames avec le milieu de montage puis scellées avec du vernis à ongles. Les photos sont prises en utilisant majoritairement l’objectif à immersion dans l'huile 63X d’un microscope confocal (Zeiss).
Tableau 2.1 Anticorps utilisé en immunofluorescence
Anticorpsprimaire
Provenance Dilution Anticorps
secondaire
Provenance Dilution
Anti-FMRP Laboratoire du Dr Khandjian
pure Alexa Fluor GAM 488 ou Alexa Fluor GAM 594 Invitrogen 1:500 Anti-FXR1 Laboratoire du Dr Khandjian 1:500 Alexa Fluor GAM 488 ou Alexa Fluor GAM 594 Invitrogen 1:500 Anti-deIF4E Laboratoire du Dr Sonenberg 1:250 Alexa Fluor GAM 488 ou Alexa Fluor GAM 594 Invitrogen 1:500 Anti-dPABP Laboratoire du Dr Sonenberg 1:500 Alexa Fluor GAM 488 ou Alexa Fluor GAM 594 Invitrogen 1:500
Anti-GFP Abcam 1:250 Alexa Fluor
GAM 488 ou Alexa Fluor GAM
594
26
2.5 L’hybridation in situ en fluorescence (FISH)
Dans cette analyse, les ARNm polyadénylés ont été détectés à l'aide d'une sonde oligo [dT] marquée Alexa Fluor 594 (Invitrogen, Burlington, ON, Canada). L'hybridation a été réalisée en modifiant la méthode présentée dans (Chakraborty et al., 2006). Les cellules ont été fixées en utilisant une solution de paraformaldéhyde 4 % (15 minutes à température ambiante), lavées trois fois avec du PBS (5 minutes à température ambiante) et perméabilisées à l'aide d'un triton X100 PBS/0.2% (15 minutes à température ambiante). Les lamelles ont été d’abord préhybridées pendant 15 min à 42 °C dans une solution d'hybridation (2X SSC, 1mg/ml t-ARN, 10 % de sulfate de dextrane (p/v), et 25 % de formamide) puis incubées pendant 16 heures à 37 °C dans la solution d'hybridation complétée par 2 ug/mL de la sonde oligo [dT]. Les cellules ont ensuite été lavées deux fois avec du SSC 2X (5 minutes à 42 °C), suivie par deux lavages avec 0,5 X SSC (15 minutes à 42 °C) pour finalement être fixée une seconde fois dans du paraformaldéhyde 4 % (15 minutes à température ambiante) pour subir immunofluorescence décrite ci-dessus. Les ARNs et des protéines ont été visualisés en utilisant le laser LSM 700 confocal à balayage Axio Observer. Z1 microscope (Zeiss), équipé d'un logiciel ZEN 2009 pour l'acquisition d'images et d'analyse.
2.6 Transfection et immunoprécipitation
Les cellules Schneider, MEF et HeLa ont été transfectées d’abord avec 0,5 ug d'ADN dans des plaques à 6 puits à l'aide du kit “ transfection Effectene reagent” (Qiagen) avant d’entamer l’expérience.
Les cellules ensuite étaient collectées et lysées à 4 °C avec un tampon de lyse (50 mM Tris-HCl, pH 7,4, 0,5 % de NP-40, 150 mM NaCl, 1 mM de MgCl2, 0,25 mM de PMSF : phenylmethanesulfonylfluoride et 0,5 mM de DTT) contenant un cocktail des inhibiteurs de la protéase (Roche, Laval, QC, Canada). L'extrait était ensuite incubé 2 h à température pièce avec des billes de sepharose (GE Healthcare Life Sciences, QC, Canada) conjugués avec l'anticorps approprié. Après trois lavages avec le tampon de lyse, les protéines sont éluées par remise en suspension des billes avec un volume égal de
27 tampon de charge. 5 % de la suspension est utilisé pour l'analyse par immunobuvardage des protéines immunoprécipitées.
2.7 L’analyse des polyribosomes
Les cellules Schneider sont collectées dans un tampon de lyse (20 mM Tris-HCl pH 7,4, 1,25 mM MgCl2, 150 mM NaCl, 1 mM DTT, 1 % NP-40), et 5 U/ml d'inhibiteur de RNase (Invitrogen) supplémenté avec des comprimés d’inhibiteur de protéase (Roche). L'homogénat cellulaire est ensuite clarifié par centrifugation à 12.000 tours par minute pendant 10 min à 4 °C. L'extrait cytoplasmique est ensuite chargé sur un gradient de sucrose de 15 % à 55 %, puis séparés en sédimentation par centrifugation pendant 2 h 30 à 37.000 tours par minute en utilisant un rotor Sorvall TH-641 (Du Pont, DE, USA) à 4 °C. Les fractions égales sont collectées à un contrôle continu de l'absorbance à 254 nm en utilisant un détecteur Isco UC-6 UV (Teledyne Isco). Les fractions sont précipitées, remises en suspension dans un volume égal de tampon d'échantillon SDS-PAGE et analysées par immunobuvardage.
2.8 Imagerie et FRAP
Les images sont acquises grâce à un système Zeiss LSM 700 confocal (Zeiss). Concernant le suivi de la formation des GS dans les cellules vivantes, des paramètres importants sont prélevés avant et après le traitement arsénite. En utilisant les mêmes paramètres, les vidéos sont acquises par la prise d'images toutes les 3 min pendant 90 min. Pour le FRAP, un seul granule marqué par GFP par cellule est photoblanchis en utilisant la fonction “Photo Bleach” du système d’imagerie Zeiss LSM 700 avec du laser diode 488-ligne à 100 %. Pour le temps de recouvrement, l'acquisition est faite en utilisant le laser 488-ligne à 2 %. Une première photo est prise avant le FRAP et ensuite, les photos sont prises successivement au cours d’une période de 30 cycles. Chaque photo est prise dans un laps de temps moyen de 5 secondes, en fonction de la taille de la région photoblanchis pour une durée totale d'environ 140 secondes. L'analyse de FRAP inclut la détermination de l'intensité moyenne de fluorescence d'une région d'intérêt contenant un
28 granule non blanchis ainsi que d'un espace de fluorescence de fond. Les mesures de fluorescence sont effectuées en utilisant le logiciel d'imagerie ZEN (Zeiss). En bref, le fond de fluorescence est soustrait des granules blanchis et non blanchis et les valeurs de fluorescence de récupération sont normalisées à un pourcentage de la fluorescence d'origine. Les granules blanchis sont ensuite corrigées à la fluorescence des granules non blanchies pour ajuster les légers changements de mise au point ou la légère dépendance du temps de blanchiment. La récupération peut alors être comparée dans les granules de tailles différentes et à partir de cellules différentes à travers de multiples sessions expérimentales. Les mesures de la fraction mobile (MF) (soit le pourcentage de protéines à fluorescence capables de diffuser dans une région blanchie d'intérêt au cours du temps de l'expérience) sont déterminées en utilisant le logiciel ZEN (Zeiss).
2.9 L’extraction des protéines et immunobuvardage
a- Extraction des protéines
Après les traitements spécifiques, les cellules sont lavées avec du PBS 1X froid ensuite les protéines sont extraites en utilisant un tampon d'extraction TEX-1X (67 mM Tris pH 8.7, 15 % Glycérol, 2 % SDS, 2 % β-mercaptoethanol, 0.01 % 33 Bromophenol). Le lysat cellulaire est ensuite chauffé à 100 °C pendant 5 min afin de dénaturer les protéines.
b- Coloration au bleu de Coomassie et quantification
Les protéines extraites sont déposées et séparées par électrophorèse sur gel de polyacrylamide en condition dénaturante (SDS-PAGE). La migration a lieu en utilisant le tampon d'électrophorèse (25 mM Tris-base, 190 mM glycine, 0,1 % SDS). Les gels sont incubés dans une solution de bleu de Coomassie (0,04 % Coomassie brillant blue R, 40 % méthanol, 10 % acide acétique) pendant 60 min à température ambiante sous agitation pour être ensuite décoloré dans une solution de décoloration (25 % méthanol, 10 % acide acétique) jusqu'à ce qu'il soit complètement transparent. Les bandes colorées sont ensuite quantifiés.
29
c- Électrotransfert sur membrane de nitrocellulose
Des quantités équivalentes de protéines sont séparées par SDS-PAGE contenant 11 % de polyacrylamide en condition dénaturante. Les protéines sont ensuite transférées sur une membrane de nitrocellulose 0,45 μm (BioRad) dans une cuve à transfert contenant du tampon de transfert (25 mM Tris-base, 190 mM glycine, 20 % méthanol).
d- Immunobuvardage :
Les protéines fixées sur les membranes ainsi que le marqueur de poids moléculaire sont révélés au rouge Ponceau (0,5 % Ponceau (Invitrogen), 1 % acide acétique). Les membranes sont ensuite bloquées avec du PBS-Tween 20 0,1 %, contenant 5 % de lait en poudre pendant 30 min à température ambiante, sous agitation. Après trois lavages au PBS-Tween, les membranes sont incubées à température pièce avec les anticorps primaires appropriés pendant un temps varié d’un anticorps à un autre. Après trois lavages au PBS-Tween d'une durée totale de 30 minutes, les membranes sont incubées 60 min avec les anticorps secondaires couplés au HRP. Un dernier triple lavage de 10 minutes avec du PBS-Tween est effectué avant de révéler le signal ChemiLuminescent par le réactif ECL (electrochemoluminescence) Plus Western Blotting Detection System
30
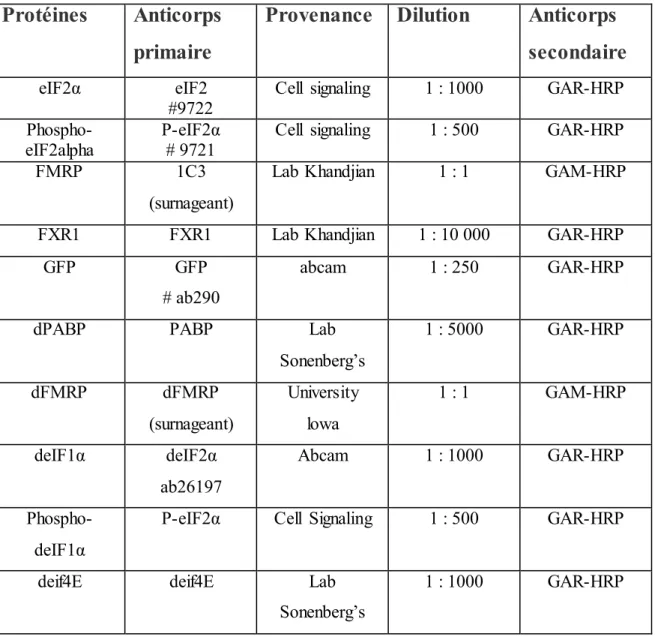
Tableau 2.2 : Caractéristiques des anticorps utilisés en
immunobuvardage
Protéines
Anticorps
primaire
Provenance Dilution
Anticorps
secondaire
eIF2α eIF2
#9722 Cell signaling 1 : 1000 GAR-HRP
Phospho-eIF2alpha
P-eIF2α # 9721
Cell signaling 1 : 500 GAR-HRP
FMRP 1C3
(surnageant)
Lab Khandjian 1 : 1 GAM-HRP
FXR1 FXR1 Lab Khandjian 1 : 10 000 GAR-HRP
GFP GFP
# ab290
abcam 1 : 250 GAR-HRP
dPABP PABP Lab
Sonenberg’s 1 : 5000 GAR-HRP dFMRP dFMRP (surnageant) University lowa 1 : 1 GAM-HRP deIF1α deIF2α ab26197 Abcam 1 : 1000 GAR-HRP Phospho-deIF1α
P-eIF2α Cell Signaling 1 : 500 GAR-HRP
deif4E deif4E Lab
Sonenberg’s
1 : 1000 GAR-HRP
2.10 Transfection et interférence à ARNm (siRNA)
siRNA-dFMRP ciblant FMRP et siRNA contrôle ont été achetés de Dharmacon (Lafayette, CO). Les transfections avec siRNA ont été réalisées essentiellement comme décrit (Gareau et al. 2011), en utilisant le réactif Hiperfect (Qiagen) en suivant le protocole du fabricant. Vingt-quatre heures avant la transfection, les cellules Schneider
31 ont été étalées sur des lamelles traitées avec la concanavaline A à une densité permettant la confluence de 60-80 % au moment de la transfections. Les cellules postransfées ont été traitées avec siRNA (50 nM) pendant 48 heures supplémentaires. Les cellules ont été ensuite soit fixées et traitées pour l'immunofluorescence, ou récoltées pour l'extraction des protéines. Les séquences de siRNAs utilisées sont les suivantes :
siRNA-dFMRP-1: 5’-GGACAAGAGTGGCGTGTTT-3’ siRNA-dFMRP-2: 5’-GCAGAAGGCAGAAGAACAA-3’
siRNA-3’UTR-dFMRP-1 : 5’-CAACACAACUCAACAACAA-3’ siRNA-3’UTR-dFMRP-2 : 5’-UUGUUGUUGAGUUGUGUUG-3’
c