Amendement en biochars : Effets sur l’activité et la
structure des microorganismes et sur les rendements
de la tomate et du poivron de serre
Thèse
Vicky Lévesque
Doctorat en microbiologie agroalimentaire
Philosophiae doctor (Ph.D.)
Québec, Canada
Amendement en biochars : Effets sur l’activité et la
structure des microorganismes et sur les rendements
de la tomate et du poivron de serre
Thèse
Vicky Lévesque
Sous la direction de :
Hani Antoun, directeur de recherche
Noura Ziadi, codirectrice de recherche
Martine Dorais, codirectrice de recherche
iii
Résumé
Le biochar, charbon produit par pyrolyse et utilisé comme amendement, présente plusieurs avantages et s’avère une avenue prometteuse pour une agriculture durable. Cependant, les méthodes de fabrication actuelles, les conditions de pyrolyse et les biomasses utilisées produisent des biochars de qualités très variables qui peuvent affecter différemment la productivité du sol et les rendements de la plante. Actuellement, aucune étude ne permet d’élucider l’influence des propriétés physicochimiques des biochars sur la structure et la diversité des communautés microbienne du sol. Le but de ce projet de doctorat visait à bien comprendre comment les propriétés physicochimiques d’un biochar affectent sa capacité à : (i) réduire les émissions des gaz à effet de serre; (ii) améliorer la croissance de la tomate et du poivron de serre; (iii) améliorer l’efficacité de l’utilisation des engrais et de l’eau; et (iv) modifier la structure et la diversité des communautés bactériennes dans un substrat horticole et dans un sol minéral. Cinq biochars ont été produits et évalués: écorces d’érable pyrolysés à 400°C, 550°C et 700°C, copeaux de pin pyrolysés à 700°C et copeaux de saule pyrolysés à 400°C. Les résultats obtenus ont permis d’identifier les propriétés physicochimiques du biochar responsables de la réduction des émissions en N2O et des apports d’engrais et celles permettant l’amélioration de l’efficacité d’utilisation de l’eau tout en favorisant la croissance de la plante. De plus, les résultats démontrent que l’ajout de biochar peut stimuler certains groupes de bactéries impliqués dans les cycles du carbone et de l’azote et possiblement ceux impliqués dans le développement de la plante. Ces travaux identifient les propriétés physicochimiques importantes des biochars qui pourront mieux guider le producteur agricole et les industries fabriquant des substrats à base de tourbe dans le choix d’un biochar favorable à la croissance de la tomate et du poivron et à une agriculture plus durable.
iv
Abstract
The biochar, charcoal produced by pyrolysis and used as an amendment, has several advantages and is a promising avenue for sustainable agriculture. However, the production methods, the pyrolysis conditions and the biomass types produce biochars with variable properties which have different effects on soil productivity and crop yields. Presently, there are no studies to elucidate the influence of the physicochemical properties of biochars on the structure and the diversity of soil microbial communities. The purpose of this PhD project was to understand how the physicochemical properties of biochar affect its ability to : (i) mitigate greenhouse gas emissions; (ii) improve growth of greenhouse tomato and pepper; (iii) improve fertilizer and water use efficiency; and (iv) modify the structure and the diversity of bacterial communities in a growing medium and a mineral soil. Five biochars were produced and evaluated: maple bark pyrolyzed at 400˚C, 550˚C and 700˚C, pine chips pyrolyzed at 700˚C, and willow chips pyrolyzed at 400˚C. The results demonstrated that some physicochemical properties are key drivers of the ability of biochars to efficiently mitigate N2O emissions, to reduce fertilizer inputs and to improve water use efficiency while promoting plant growth. Moreover, the results show that biochar amendment can stimulate specific bacterial groups involved in carbon and nitrogen cycles and possibly those involved in plant development. This work identifies key physicochemical properties of biochars that could better guide agricultural producers and industries producing peat-based growing media, in the choice of biochar promoting tomato and pepper growth and contributing to a sustainable agriculture.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... ix
Liste des figures ... xi
Liste des abréviations ... xiii
Remerciements ... xvii
Avant-propos ... xix
Chapitre 1 ... 1
1.0 Introduction Générale ... 1
1.1 Revue de littérature ... 2
1.1.1 Procédés de formation du biochar ... 2
1.1.1.1 Description ... 2
1.2 Les propriétés physicochimiques d’un biochar ... 3
1.2.1 Propriétés physiques ... 3
1.2.1.1 Porosité ... 3
1.2.1.2 Surface spécifique ... 3
1.2.1.3 Capacité de rétention en eau ... 4
1.2.2 Propriétés chimiques ... 5
1.2.2.1 Composition minérale... 5
1.2.2.2 Production de composés toxiques ... 5
1.2.2.3 Capacité d’échange cationique ... 6
1.2.2.4 Minéralisation et séquestration du carbone ... 6
1.2.2.5 pH et conductivité électrique ... 7
1.3 Effets du biochar sur les propriétés physicochimiques du sol ... 8
1.4 Effets du biochar sur les émissions des gaz à effet de serre ... 9
1.5 Effets du biochar sur la croissance de la plante ... 11
1.6 Effets du biochar sur la biologie du sol ... 12
1.7 Objectifs et hypothèses ... 14
1.8 Références... 16
Chapitre 2 ... 21
2.0 An incubation study on the mitigation of CO2 and N2O emissions from a nitrogen fertigated horticultural growing medium supplemented with biochars and compost ... 21
Sommaire ... 21
Abstract ... 22
2.1 Introduction ... 23
2.2 Material and methods ... 24
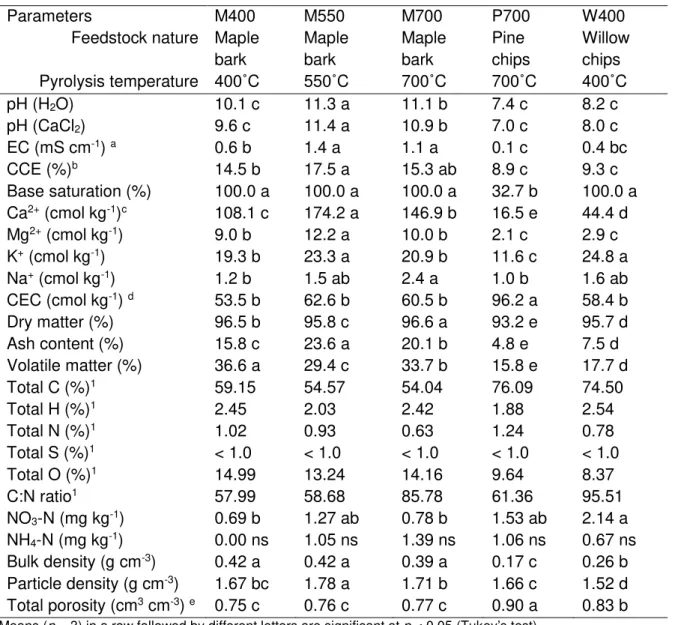
2.2.1 Biochar production and characterization ... 24
2.2.1.1 Chemical characteristics of biochars ... 25
2.2.1.2 Physical characteristics ... 28
vi 2.2.2.1 Peat-based GM properties ... 29 2.2.3 Incubation ... 29 2.2.3.1 Chemical analysis ... 30 2.2.3.2 Biological analysis ... 30 2.2.3.3 Gas sampling ... 31 2.2.4 Statistical analysis ... 31 2.3 Results ... 32 2.3.1 Biochar characterization ... 32
2.3.2 Effect of incubation time on the chemical properties of the saturated media extracts ... 33
2.3.3 Effect of incubation time on the biological properties of the peat-based GM .... 36
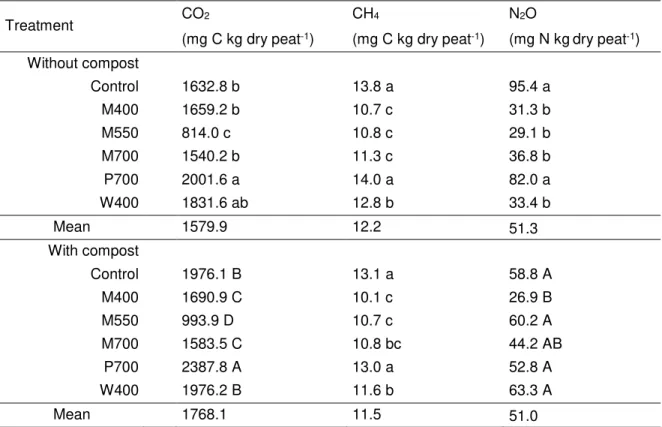
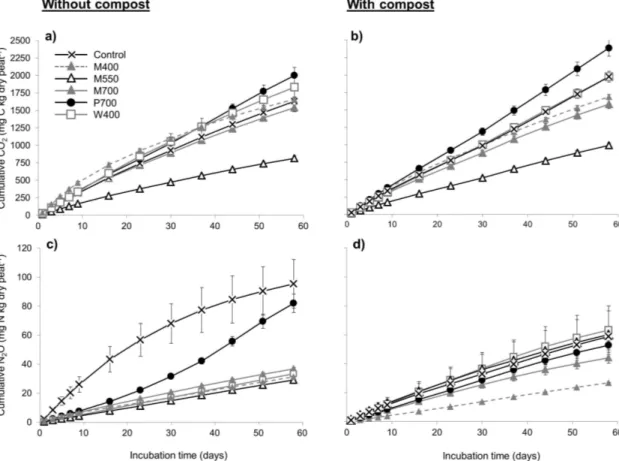
2.3.4 Effect of incubation time on greenhouse gas emissions from peat-based GM . 39 2.4 Discussion ... 43
2.4.1 GHG emissions from peat-based GM amended biochars ... 43
2.4.1.1 Carbon dioxide ... 43
2.4.1.2 Methane ... 44
2.4.1.3 Nitrous oxide ... 45
2.4.2 GHG emissions from peat-based GM amended biochar and enriched with compost ... 46
2.4.3 Time effect and successive applications of N fertilizer on GHG emissions from peat-based GM amended biochar ... 47
2.5 Conclusion ... 49
2.6 References... 50
Chapitre 3 ... 55
3.0 Effets de l’ajout de différents biochars à un substrat à base de tourbe sur les rendements d’une culture de la tomate et du poivron ... 55
Sommaire ... 55
3.1 Introduction ... 56
3.2 Matériel et méthodes ... 57
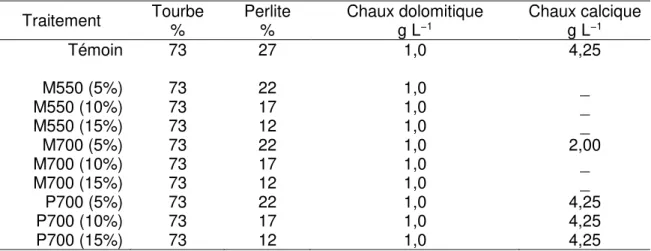
3.2.1 Biochar et les substrats de croissance ... 57
3.2.2 Propriétés chimiques des substrats de croissance ... 58
3.2.3 Propriétés physiques des formulations des substrats de croissance ... 59
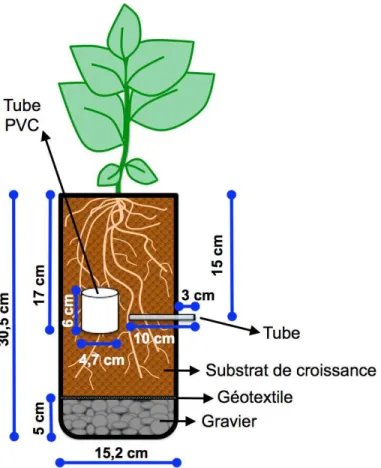
3.2.4 Préparation des pots ... 59
3.2.5 Conditions environnementales de la serre ... 60
3.2.6 Germination des semences ... 60
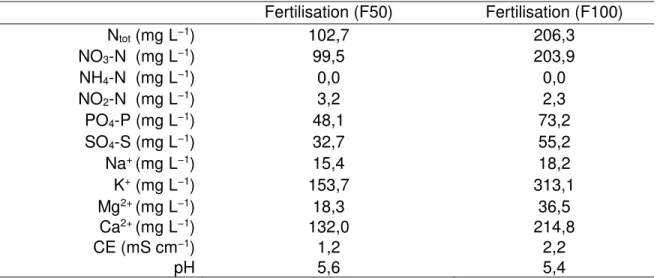
3.2.7 Fertilisation et irrigation ... 61
3.2.8 Dispositif expérimental ... 63
3.2.9 Mesures des paramètres physicochimiques des substrats de croissance ... 63
3.2.9.1 Analyse minérale des lixiviats et des substrats de croissance ... 63
3.2.9.2 Analyse de la masse volumique apparente dans la culture du poivron ... 64
3.2.10 Mesure des paramètres biologiques du substrat ... 64
3.2.10.1 Analyse de l’activité enzymatique et de la biomasse microbienne ... 64
3.2.10.2 Respiration du sol ... 64
3.2.11 Mesure des paramètres physiologiques ... 65
3.2.11.1 Rendement des fruits et biomasse totale ... 65
3.2.11.2 Surface foliaire ... 65
3.2.11.3 Analyses minérales de la biomasse ... 66
3.2.12 Analyses statistiques ... 66
3.3 Résultats ... 67
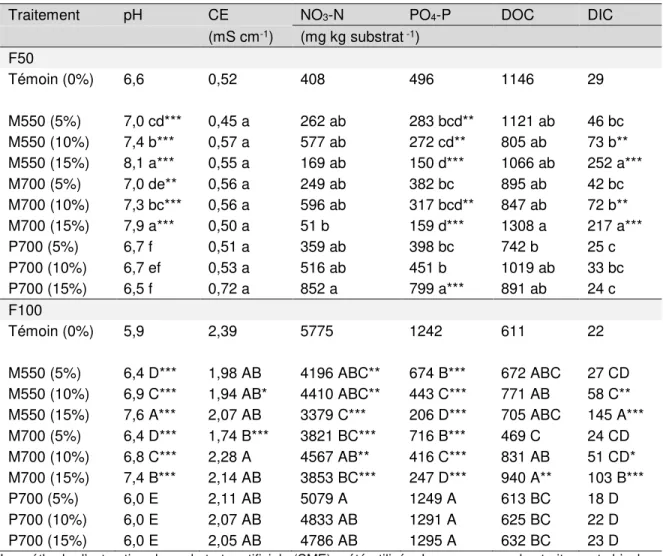
3.3.1 Propriétés chimiques des substrats ... 67
3.3.2 Activité microbienne dans les substrats ... 71
vii
3.3.4 Teneur en azote et en phosphore dans les tissus de la plante ... 80
3.3.5 Efficacité d’utilisation de l’eau d’irrigation ... 81
3.4 Discussion ... 82
3.4.1 Effets du biochar sur les rendements de la culture de la tomate et du poivron 82 3.4.2 Effets de la dose en biochar sur les rendements de la culture de la tomate et du poivron ... 86
3.4.3 Effet de la dose de fertilisation sur les rendements de la culture de la tomate et du poivron ... 86
3.4.4 Effet du biochar sur l’efficacité d’utilisation de l’eau d’irrigation ... 87
3.5 Conclusion ... 88
3.6 Références... 89
Chapitre 4 ... 92
4.0 Effets de l’ajout de différents biochars dans un substrat à base de tourbe sur la diversité et la structure des communautés bactériennes après une culture de la tomate ou du poivron ... 92 Sommaire ... 92 4.1 Introduction ... 93 4.2 Matériel et méthodes ... 95 4.2.1 Description de l’étude ... 95 4.2.2 Analyse métagénomique ... 96 4.2.2.1 Extraction de l’ADN ... 96
4.2.2.2 Quantification des bactéries totales ... 97
4.2.2.3 Construction des librairies Illumina ... 97
4.2.2.4 Analyse du séquençage ... 99
4.2.3 Analyses statistiques ... 100
4.3 Résultats ... 101
4.3.1 Diversité bactérienne ... 101
4.3.2 Structure des communautés bactériennes ... 102
4.3.3 Relation entre les communautés bactériennes et les variables environnementales mesurées ... 108
4.4 Discussion ... 110
4.4.1 Effets des biochars sur la diversité et la structure des communautés bactériennes ... 110
4.4.2 Effet du pH sur la composition des communautés bactériennes ... 111
4.4.3 Effet de la disponibilité en carbone sur la composition des communautés bactériennes ... 112
4.5 Conclusion ... 114
4.6 Références... 115
Chapitre 5 ... 119
5.0 Effets de différents biochars sur les communautés bactériennes et leur relation avec l’atténuation des émissions de gaz à effet de serre et les propriétés physicochimiques et biologiques du sol ... 119
Sommaire ... 119
5.1 Introduction ... 120
5.2 Matériel et méthodes ... 122
5.2.1 Biochars et sol ... 122
5.2.2 Préparation des mélanges de sol ... 122
5.2.3 Incubation – Expérience I ... 123
5.2.3.1 Analyses chimiques... 124
viii
5.2.3.3 Analyses des gaz (CO2, CH4 et N2O) ... 125
5.2.3.4 Analyses métagénomiques ... 126 5.2.4 Incubation – Expérience II ... 126 5.2.4.1 Analyses chimiques... 127 5.2.4.2 Technique de diffusion 15N ... 128 5.2.4.3 Abondance du 15N ... 129 5.2.5 Analyses statistiques ... 129 5.3 Résultats ... 130
5.3.1 Propriétés chimiques du sol ... 130
5.3.2 Propriétés biologiques du sol ... 131
5.3.3 Disponibilité de l’azote ... 133
5.3.4 Émissions de gaz à effet de serre ... 133
5.3.5 Diversité alpha des communautés bactériennes ... 136
5.3.6 Structure des communautés bactériennes et compositions taxonomiques .... 136
5.3.7 Relation entre les communautés bactériennes et les variables environnementales mesurées ... 141
5.4 Discussion ... 144
5.4.1 Effets des biochars sur les propriétés chimiques et biologiques ... 144
5.4.2 Effets des biochars sur l’atténuation des émissions des gaz à effet de serre . 146 5.4.2.1 Dioxyde de carbone ... 146
5.4.2.2 Méthane ... 147
5.4.2.3 Protoxyde d’azote ... 148
5.4.3 Effets des biochars sur la diversité et la structure des communautés bactériennes ... 150
5.4.4 Effets des biochars sur les communautés bactériennes impliquées dans le cycle du carbone et de l’azote ... 151 5.5 Conclusion ... 155 5.6 Références... 156 Chapitre 6 ... 161 6.0 Discussion générale ... 161 6.1 Références... 167 Chapitre 7 ... 169 7.0 Conclusion générale ... 169 7.1 Perspectives de recherche ... 171 Annexe ... 174
Chapitre 2: Matériel Supplémentaire ... 174
Chapitre 3: Matériel Supplémentaire ... 183
Chapitre 4: Matériel Supplémentaire ... 211
ix
Liste des tableaux
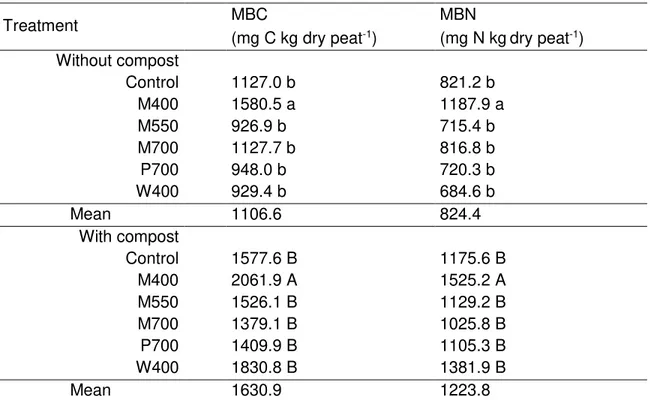
Table 2.1 Physicochemical characteristics of biochars. ... 27 Table 2.2 Effect of different biochars and a compost on microbial biomass carbon (MBC) and nitrogen (MBN) in a peat-based GM after 58 days of incubation. ... 39 Table 2.3 Effect of different biochars and a compost on the total cumulative CO2, CH4 and N2O emissions from a peat-based GM during 58-days incubation. ... 41 Tableau 3.1 Formulation des substrats de croissance ... 58 Tableau 3.2 Composition minérale des solutions fertilisantes pour les traitements ayant reçu 50% de la dose recommandée (F50) et la dose complète (F100) pour la culture de la tomate et du poivron. ... 62 Tableau 3.3 Potentiels matriciels utilisés pour enclencher les irrigations selon la dose de biochar dans le substrat. ... 62 Tableau 3.4 Analyses chimiques des substrats de la culture de la tomate (cv. Micro-Tom) à la fin de l’expérience en serre de 63 jours. ... 69 Tableau 3.5 Analyses chimiques des substrats de la culture du poivron (cv. Redskin) à la fin de l’expérience en serre de 63 jours... 70 Tableau 3.6 Taux d’hydrolyse de la FDA dans les substrats à base de tourbe amendé de biochars pour la culture de la tomate (cv. Micro-Tom) et du poivron (cv. Redskin). ... 72 Tableau 3.7 Comparaison de la biomasse aérienne, des fruits et des racines entre le substrat amendé de biochar fertilisé à F50 et le substrat non amendé (témoin) fertilisé à F100 pour la culture de la tomate (cv. Micro-Tom) et du poivron (cv. Redskin). ... 78 Tableau 3.8 Effet de la dose en fertilisation (F50 vs F100) de chaque traitement sur la biomasse aérienne, des fruits et des racines pour la culture de la tomate (cv. Micro-Tom) et du poivron (cv. Redskin). ... 79 Tableau 3.9 Efficacité d’utilisation de l’eau (EUE) d’irrigation entre le traitement biochar et le témoin pour la culture de la tomate (cv. Micro-Tom). ... 81 Tableau 4.1 Pourcentage des OTUs bactériennes au niveau de la classe dans les différents substrats à la fin de la culture de la tomate et du poivron fertilisée avec la dose recommandé en nutriments (F100). ... 106 Tableau 4.2 Pourcentage des OTUs bactériennes au niveau de la famille et du genre dans les différents substrats à la fin de la culture de la tomate et du poivron fertilisée avec la dose recommandé en nutriments (F100). ... 107 Tableau 4.3 Coefficients de corrélation SPEARMAN significatifs entre les espèces des familles bactériennes et les variables environnementales de la rhizosphère de la tomate et du poivron. ... 109
x
Tableau 5.1 Taux bruts de nitrification, minéralisation et d’immobilisation de l’azote dans les traitements de sol lors d’une étude d’incubation de 343 jours. ... 133 Tableau 5.2 Indices de diversité bactérienne dans les traitements de sol avec ou sans compost au jour 338 de l’incubation. ... 136 Tableau 5.3 Analyse statistique nonparamétrique ADONIS basée sur la matrice de comparaison des distances unweighted Unifrac dans les différents traitements sans compost au jour 338 de l’incubation. ... 138 Tableau 5.4 Pourcentage d’abondance relative des OTUs bactériennes au niveau de la classe dans les traitements de sol avec ou sans compost au jour 338 de l’incubation. .. 140 Tableau 5.5 Pourcentage d’abondance relative des OTUs bactériennes au niveau de la famille et du genre dans les traitements de sol sans compost au jour 338 de l’incubation. ... 141 Tableau 5.6 Nombre d’OTUs observé dans chaque traitement biochar sans compost significativement différent du témoin et coefficient de corrélation entre l’abondance relative des séquences des groupes bactériens et les variables environnementales mesurées au jour 338 de l’incubation. ... 143
xi
Liste des figures
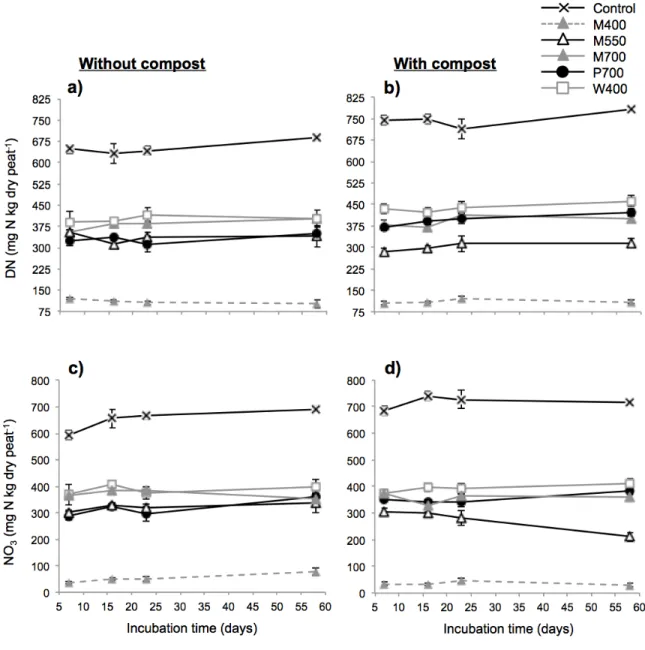
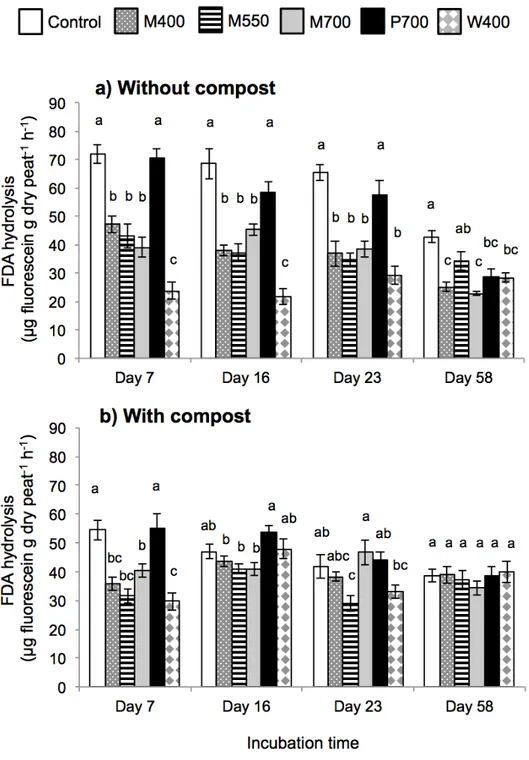
Fig. 2.1 Effect of different biochars and a compost on total dissolved nitrogen (DN) and nitrate (NO3-) in a peat-based GM measured by the saturated media extract method. ... 35 Fig. 2.2 Effect of different biochars and a compost on dissolved organic carbon (DOC) and inorganic carbon (DIC) in a peat-based GM measured by the saturated media extract method... 36 Fig. 2.3 Effect of biochars and a compost on microbial activity in a peat-based GM as reflected by fluorescein diacetate (FDA) hydrolysis. ... 38 Fig. 2.4 Effect of biochars and a compost on the cumulative CO2 and N2O emissions from a peat-based GM during 58 days of incubation. ... 42 Fig. 3.1 Schéma des pots utilisés pour la culture de la tomate et du poivron. ... 61 Fig. 3.2 Concentrations moyennes en CO2 dans l’air du substrat à base de tourbe amendé de biochars pour la culture de la tomate (cv. Micro-Tom) ou du poivron (cv. Redskin). .... 73 Fig. 3.3 Biomasses mesurées après 63 jours de culture des plants de tomate (cv. Micro-Tom). ... 76 Fig. 3.4 Biomasses mesurées après 63 jours de culture des plants de poivron (cv. Redskin). ... 77 Fig. 4.1 Sachet en Nitex utilisé pour l’étude des communautés bactériennes ... 96 Fig. 4.2 Effet des différents biochars sur les indices de la diversité bactérienne à la fin d’une culture de la tomate et du poivron de serre. ... 102 Fig. 4.3 L’analyse principale de coordination (PCoA) vue sur trois axes (PC1, PC2, PC3) des communautés bactériennes dans les différents substrats à la fin d’une culture de la tomate et du poivron de serre. ... 103 Fig. 4.4 Diagramme de Venn, où chaque ovale présente le nombre et la proportion d’unités taxonomiques opérationnelles (OTUs) détectés à la fin d’une culture de la tomate (a) et du poivron (b) de serre. ... 104 Fig. 5.1 Schéma et photo de la multiseringue à dix aiguilles construite pour l’application uniforme de la solution fertilisante. ... 124 Fig. 5.2 Effet de l’amendement avec du biochar et du compost sur les propriétés chimiques et l’activité enzymatique d’un sol minéral après 338 jours d’incubation. ... 132 Fig. 5.3 Effet de l’amendement avec du biochar et du compost sur les émissions cumulatives moyennes de CO2, CH4 et N2O dans un sol minéral durant 338 jours d’incubation. ... 135
xii
Fig. 5.4 Vue d’ensemble sur trois axes (PC1, PC2, PC3) de la structure des communautés bactériennes dans les traitements de sol avec ou sans compost aux jours 44 et 338 de l’incubation. ... 137 Fig. 5.5 Diagramme de Venn, où chaque rond présente le nombre et la proportion d’unités taxonomiques opérationnelles (OTUs) détectés au jour 338 dans les traitements sans compost. ... 138
xiii
Liste des abréviations
ADN Acide désoxyribonucléique
ANOVA Analyse de la variance
ARN Acide désoxyribonucléique
BD Bulk density
CE / EC Conductivité électrique / Electrical conductivity
CCE Calcium carbonate equivalence
CEC Capacité d’échange cationique / Cation exchange capacity
CMA Champignons mycorhiziens arbusculaires
DIC Carbone Inorganique dissous / Dissolved inorganic carbon
DMP Diamètre moyen pondéré
DN Azote total dissous / Total dissolved nitrogen
DOC Carbone organique dissous / Dissolved organic carbon
Ds/Do Diffusion des gaz
EUE Efficacité d’utilisation de l’eau
FDA Fluorescéine diacétate (activité enzymatique)
GE Gas emissions
Ksat Conductivité hydraulique saturée
m/m Masse / masse
MBC Biomasse microbienne du carbone
MBN Biomasse microbienne de l’azote
MVA Masse volumique apparente
OTU Unité taxonomique opérationnelle
PA Porosité de l’air
pb Paires de bases
PCR Réaction de polymérisation en chaîne
PD Particle density
PT / TP Porosité totale / Total porosity
PVC Polychlorure de vinyle
qPCR Réaction de polymérisation en chaîne quantitative
RFU Réserve en eau facilement utilisable
RU Réserve utile en eau
SME Extraction de milieu saturé en eau / Saturated Media Extract SPE / WFPS Saturation des pores en eau / Water-filled pore space
TC Carbone total / Total carbon
TOC Carbone organique totale
TN Azote total / Total nitrogen
Tort Tortuosité
TSA Tryptic Soy Agar
U.E. Unités expérimentales
UFC Unité formant colonie
v/v Volume / volume
xvi
The role of the infinitely small in nature is infinitely great − Louis Pasteur
xvii
Remerciements
Pour arriver au dépôt de cette thèse, j’ai relevé de nombreux défis, parfois stressants mais par contre, très stimulants et enrichissants. Ayant déjà franchi la ligne d’arrivée d’un marathon, je me permets de comparer cette thèse à un ultra-marathon. Il m’a fallu beaucoup de détermination, du temps et de la discipline pour y parvenir. C’est grâce au support moral de ma famille, de mes amis, de mes collaborateurs et de mes superviseurs de recherche que j’ai pu atteindre mes objectifs ambitieux.
Je tiens d’abord à remercier mon directeur, Hani Antoun, de m’avoir transmis ses connaissances en microbiologie des sols et sa passion de la recherche. Je tiens à vous remercier pour vos petites attentions, pour votre confiance et pour les opportunités offertes tout au long de mon cheminement de doctorat. Je tiens également à vous remercier pour votre rigueur scientifique et votre inspiration. Cela a été un réel plaisir de travailler avec vous et j’ai grandement apprécié nos nombreuses discussions. Dommage que vous soyez maintenant à la retraite et c’est un honneur pour moi d’être la dernière étudiante que vous avez dirigé dans le cadre de votre carrière de professeur à l’Université Laval!
Je remercie aussi ma codirectrice, Martine Dorais, qui m’a soutenue depuis le début de ma maîtrise et tout au long de mon doctorat. Merci beaucoup, Martine, pour tes commentaires pertinents et rigoureux, tes conseils, tes idées innovantes et ton dynamisme. Je tiens également à te remercier de ta confiance. Malgré ton horaire très chargé, tu as toujours réussi à trouver du temps pour moi. Ce fut grandement apprécié. Je remercie également ma codirectrice, Noura Ziadi, pour sa générosité, sa rigueur et ses nombreux conseils. À chaque fois que j’entrais dans ton bureau, il y avait toujours un vent de fraîcheur! Merci beaucoup pour ton écoute, ta confiance et ton support. Tes commentaires et ton aide m’ont été très utiles.
La réalisation de ce projet a été rendue possible grâce à la participation de nombreux collaborateurs. Je tiens d’abord à remercier les chercheurs Philippe Rochette et Martin Chantigny d’Agriculture et Agroalimentaire Canada (AAC), Richard Hogue de l’Institut de Recherche et de Développpement en Agroenvironnement (IRDA), ainsi que Martin Trépanier et Rémi Naaz de la compagnie Premier Tech. Merci beaucoup d’avoir accepté de collaborer avec moi dans ce projet et de votre confiance au succès de ce projet. De plus, un immense merci à l’entreprise Premier Tech pour m’avoir fourni gracieusement de la tourbe pour réaliser mes diverses expériences en serre et en laboratoire.
xviii
Le travail considérable en laboratoire et en serre n’aurait pu être réalisé sans l’aide et les conseils des nombreux professionnels de recherche et techniciens (Sylvie Côté, Johanne Tremblay, Claude Lévesque, Annie Robichaud, Josée Bourassa, Carole Boily, Mireille Thériault, Réjean Bacon, Claudine Ménard, Danielle Mongrain, Daniel Marcotte, Gabriel Lévesque et Sébastien Lange), de l’équipe des serres (Carole Martinez, Rachel Daigle, Nicolas Pelletier, Nicole Bolduc et Normand Massicotte) et des étudiants et des collègues de travail (Marc-Antoine Bisson, Jean-Michel Fortin, Laetitia Roy, Stéphanie Houde, Salma Taktek et Hélà Selmi). Merci énormément pour votre généreux temps et votre professionnalisme.
Plus particulièrement, un grand merci à Normand Bertrand, professionnel de recherche du Dr Philippe Rochette, pour son aide et sa patience pour les nombreuses heures passées devant le GC afin d’analyser mes échantillons de gaz! Un merci spécial à Thomas Jeanne, professionnel de recherche du Dr Richard Hogue, pour son expertise en bio-informatique. Thomas, tu m’as été d’une aide incroyable. Sans toi, je n’aurais pas encore terminé cette thèse. Un grand merci pour tes disponibilités afin de répondre à mes questions, autant la semaine que le weekend, et pour m’avoir transmis tes connaissances en bio-informatique. J’aimerais également remercier Martin Chantigny, Steeve Pépin et Joann K. Whalen, qui ont accepté, aux côtés de mon directeur et de mes deux codirectrices de recherches, d’évaluer cette thèse de doctorat et de faire partie du jury lors de ma soutenance.
Bien entendu, je tiens à remercier mes proches, soit ma famille, mes ami(e)s et ma belle-famille pour leur soutien et leurs encouragements. Je tiens particulièrement à remercier Nicole de m’avoir accueillie à bras ouverts chez elle au début et à la fin de mon doctorat. De plus, j’aimerais remercier profondément mes parents, Julien et Johanne, qui m’ont toujours encouragée dans mes études et qui m’ont appuyée dans mes choix de vie. Vous avez cru en moi et vous m’avez donnée la chance d’étudier dans un domaine qui me passionne. Je vous en suis très reconnaissante pour tout ce que vous avez fait pour moi. Mille fois merci!!
Finalement, je tiens à remercier mon amoureux, Clement, qui était là pour m’appuyer et me réconforter dans mes moments un peu plus difficiles. J’ai une chance unique de t’avoir à mes côtés. Ton calme, ta compréhension et ta joie de vivre m’ont permis d’aller jusqu’au bout de ce projet. Merci encore pour ton aide et ta participation au projet. Je te dois une fière chandelle!
xix
Avant-propos
Cette thèse a été réalisée dans le cadre d’un projet intitulé « Développement d’un biochar favorable à l’établissement d’une microflore bénéfique chez la tomate et le poivron cultivés en serres» financé par le Programme de Soutien à l’Innovation en Agroalimentaire (PSIA), un programme issu de l’accord du cadre Cultivons l’avenir conclu entre le Ministère de l'Agriculture, des Pêcheries et de l'Alimentation du Québec (MAPAQ) et Agriculture et Agroalimentaire Canada (AAC). Mes études doctorales ont aussi été réalisées grâce aux bourses du Fonds de Recherche sur la Nature et les Technologies (FRQNT), de l’Université Laval, du Centre Sève et de l’Association Québécoise de Spécialistes en Sciences du Sol (AQSSS).
Cette thèse est composée de sept chapitres. Le chapitre 1 comprend une introduction générale et une revue de la littérature. Ce premier chapitre permet d’atteindre des connaissances générales sur le sujet, de dégager les problématiques et d’énoncer les hypothèses et les objectifs de recherche. Les chapitres 2 à 5 sont le cœur de la thèse et sont écrits sous forme d’articles scientifiques. Le chapitre 2 est écrit en anglais. Les articles sont présentement en préparation et seront prochainement publiés dans des journaux scientifiques avec comité de lecture. Le chapitre 2 présente l’effet de cinq biochars sur les propriétés physicochimiques et biologiques d’un substrat à base de tourbe enrichie ou pas avec un compost sur les émissions des gaz à effet de serre, durant une courte étude d’incubation sans plante. Le titre de ce chapitre est «An incubation study on the mitigation of CO2 and N2O emissions from nitrogen fertigated horticultural growing medium supplemented with biochars and compost». Le chapitre 3 concerne l’effet d’un amendement de biochar sur les rendements d’une culture de la tomate ou du poivron, et son effet sur la réduction des apports en nutriments et l’amélioration de l’efficacité d’utilisation de l’eau. Le titre de ce chapitre est «Effets de l’ajout de différents biochars à un substrat à base de tourbe sur les rendements d’une culture de la tomate et du poivron». Le chapitre 4 est la continuité du chapitre 3, mais celui-ci s’attarde à la diversité et à la structure des communautés bactériennes de la rhizosphère. Le titre de ce chapitre est «Effets de l’ajout de différents biochars dans un substrat à base de tourbe sur la diversité et la structure des communautés bactériennes après une culture de la tomate ou du poivron». Le chapitre 5 aborde les effets d’un amendement de biochars sur les
xx
communautés bactériennes en relation avec l’atténuation des émissions de gaz à effet de serre et sur les propriétés physicochimiques et biologiques d’un sol agricole. Ce chapitre permet d’approfondir le sujet sur la capacité du biochar à améliorer la productivité du sol et à modifier les populations bactériennes. Ce chapitre s’intitule «Effets de différents biochars sur les communautés bactériennes et leur relation avec l’atténuation des émissions de gaz à effet de serre et les propriétés physicochimiques et biologiques du sol». Le chapitre 6 comprend une discussion générale qui permet de faire le lien entre les chapitres 2 à 5 et de répondre aux hypothèses proposées en introduction. Enfin, le chapitre 7 présente une conclusion générale permettant de faire le point sur les objectifs de ce projet de thèse et souligne l’originalité des travaux effectués. De plus, ce dernier chapitre propose des pistes de réflexion pour de futurs projets de recherche dans ce domaine. En annexe, on retrouve des résultats supplémentaires des chapitres 2 à 5 qui permettent de supporter les renseignements fournis dans cette thèse.
Mes résultats de recherche ont été présentés dans le cadre de plusieurs congrès internationaux et un colloque provincial. J’ai effectué une présentation lors du colloque les «Journées du Centre Sève», le 7 et 8 novembre 2013 à l’Hôtel Wendake (QC, Canada) et le titre de ma présentation orale était : « Développement d’un biochar de qualité
favorable à la croissance des plantes et des microorganismes». De plus, j’ai présenté mes
résultats de recherche lors de trois congrès internationaux : 1- le congrès conjoint Soil Interfaces for Sustainable Development organisé par la International Union of Soil
Science (IUSS), la Canadian Society of Soil Science (CSSS) et l’AQSSS du 5 au 10 juillet
2015 à l’Université McGill (QC, Canada) et le titre de ma présentation orale était : «Soil
CO2 and N2O emissions: «Is the mitigation efficiency of biochars impacted by periodic
applications of mineral nitrogen fertilizer?»; 2- The Rhizosphere 4 organisé par Wageningen University et Netherlands Institute of Ecology (NIOO) du 21 au 25 juin 2015
au Maastricht Exposition and Congress Centre (MECC) (Maastricht, Pays-Bas), et le titre de mon affiche était: «Effect of different biochars on the establishment of the symbiosis
between Rhizophagus irregularis and leek grown in peat-based substrate»; et 3- 16th
International Symposium on Microbial Ecology (ISME16) organisé par International
Society for Microbial Ecology du 21 au 26 août 2016 au Palais des Congrès de Montréal
(QC, Canada), et le titre de mon affiche était: «Soil bacterial community structure and
greenhouse gas emissions as affected by the addition of biochar»., J’ai également été
xxi
Développement de Québec − AAC (QC, Canada). Le titre du séminaire s’intitulait : «Amendement en biochar : Effet sur les rendements des cultures en serre et leur impact
environnemental». Cette présentation orale sera diffusée par le Centre de Référence en
Agriculture et Agroalimentaire du Québec (CRAAQ) dans les prochains mois et sera accessible sur le site Internet d’Agri-Réseau. Enfin, j’ai présenté mes résultats de recherche lors de la «Journée de la Recherche de la FSAA» organisée par la Faculté des Sciences de l’Agriculture et de l’alimentation (FSAA), le 18 mai 2017 à l’Université Laval (QC, Canada), et le titre de ma présentation orale était : «Amendement en biochars :
Effets sur les rendements de la tomate et du poivron de serre».
J’ai obtenu le 3e prix pour la meilleure présentation orale lors du congrès annuel de l’AQSSS tenu à l’Université McGill lors du congrès international conjoint IUSS−CSSS−AQSSS en juillet 2015. De plus, j’ai obtenu des bourses de mérite pour assister aux différents congrès internationaux, dont une bourse de 1000$ offert par le Centre Sève et une autre de 1000$ offert par le Centre de Recherche en Innovation sur les Végétaux (CRIV) pour participer au congrès The Rhizosphere 4, en juin 2015; et une bourse de mérite de 750$ offert par l’AQSSS pour participer au congrès international conjoint IUSS−CSSS−AQSSS, en juillet 2015.
1
Chapitre 1
1.0 Introduction Générale
Dans le centre de l’Amazonie où l’on retrouve des terres infertiles se trouvent des régions localisées où les sols ont une fertilité exceptionnelle et où l’activité microbiologique y est des plus développées. Ces terres noires nommées Terra Preta (do Indigo) sont particulièrement riches en composés carboniques et en minéraux. Elles possèdent trois fois plus de matière organique, d’azote, de phosphore et de calcium et 70 fois plus de carbone que les sols des régions avoisinantes (Barrow, 2012; Glaser, 2007). Ces sols se seraient formés il y a plusieurs milliers d’années à partir de résidus carbonisés (charbon), d’excréments, d’os et de résidus organiques provenant d’élevage semi-intensif (Barrow, 2012; Glaser, 2007). Après plusieurs décennies, ce type de sol à l’origine très pauvre a évolué et est devenu très intéressant pour l’agriculture d’aujourd’hui vu la stabilité du carbone présent (Barrow, 2012). Les groupements aromatiques polycondensés retrouvés dans la structure du charbon des sols de Terra Preta expliqueraient en grande partie sa stabilité biochimique et par conséquent le faible dégagement en CO2 (Liang et al., 2008). Des études récentes démontrent que des sols fortement fertiles, suite à l’application de charbon pyrolysé (biochar), étaient structurellement comparables à ceux des sols de Terra Preta (Mao et al., 2012).
La stabilité du carbone dans les sols amazoniens, les bilans négatifs des émissions en CO2 et l’effet positif du carbone sur la croissance de la plante ont beaucoup attiré l’intérêt des chercheurs. Plusieurs études démontrent que le biochar a des propriétés uniques qui permettent d’accroître la santé et la croissance des plantes, et la productivité du sol, mais aussi qu’il est un outil indispensable permettant la séquestration du carbone dans les sols durant de nombreuses années (Barrow, 2012; Chan et Xu, 2009; Glaser, 2007; Lehmann et al., 2009; Revell et al., 2012; Schimmelpfennig et Glaser, 2012; Schulz et Glaser, 2012). De plus, les nombreuses études effectuées au cours de la dernière décennie sur l’utilisation du biochar comme amendement démontrent qu’il possède plusieurs avantages biologiques et physicochimiques et qu’il s’avère une avenue prometteuse pour l’agriculture durable. Cependant, les méthodes de fabrication actuelles, les conditions de pyrolyse et les biomasses utilisées produisent des biochars de qualités très différentes qui, suite à
2
leur utilisation, affectent de façon variable la productivité du sol et les rendements de la plante (Anderson et al., 2011 ; Ding et al., 2016 ; Gul et al., 2015 ; Liu et a l., 2016). Ce projet de doctorat visait donc à bien comprendre comment les propriétés physicochimiques d’un biochar affectent la productivité du sol, l’activité et la composition des communautés microbiennes et la croissance de la plante. Finalement, cette étude va fournir des informations utiles pour le développement de recettes industrielles pour la production de biochars de bonne qualité, en faisant varier la température de la pyrolyse et en employant différentes biomasses.
Ce premier chapitre introduit les facteurs influençant les propriétés physicochimiques d’un biochar sur les propriétés physicochimiques et biologiques du sol, sur les émissions des gaz à effets de serre et sur la croissance de la plante. Ce chapitre permet d’atteindre des connaissances générales et d’énoncer les hypothèses et les objectifs visant à mettre en évidence certaines propriétés physicochimiques essentielles du biochar pour améliorer la productivité du sol, d’atténuer les émissions des gaz à effet de serre et de favoriser la croissance de la plante et la diversité microbienne.
1.1 Revue de littérature
1.1.1 Procédés de formation du biochar
1.1.1.1 Description
Le biochar est la partie solide produite par la pyrolyse, processus de dégradation d’une biomasse organique par la chaleur en absence d’oxygène. Il existe différents biochars, selon le matériel utilisé et la température de pyrolyse (Brewer et al., 2011). Les biomasses organiques utilisées pour former le biochar sont d’origines végétales ou animales et riches en carbone comme le bois, les résidus de récoltes, les excréments d’animaux et les déchets organiques. Lors de la dégradation de la biomasse, trois phases sont générées par la pyrolyse. Il y a une partie solide (biochar), une partie liquide organique (biohuile) et une partie gazeuse. La quantité de chaque composante (gaz, liquide et biochar) est différente selon la méthode de pyrolyse utilisée. Plusieurs systèmes de pyrolyse existent. Les systèmes les plus utilisés sont les pyrolyseurs rapides et lents (Brewer et al., 2012; Bruun et al., 2012). Un système de pyrolyse rapide va chauffer très rapidement
(au-3
dessus de 1000°C s-1) la biomasse sèche en absence d’oxygène et le temps de séjour dans le système est très court (environ 2 secondes). Le but d’une pyrolyse rapide est de maximiser la production de la biohuile. C’est pour cette raison que le chauffage est très rapide et de courte durée. Pour ce qui est du système traditionnel (la pyrolyse lente), la biomasse sèche est chauffée très lentement (1°C à 20°C min-1) en absence d’oxygène et avec un temps de séjour dans le système variant de quelques heures à quelques jours (Dutta et al., 2012).
1.2 Les propriétés physicochimiques d’un biochar
La matière première, la température, la vitesse d’élévation de la température, le temps de chauffage et la grosseur des particules peuvent affecter les propriétés physicochimiques et la qualité d’un biochar (Brewer et al., 2011; Lehmann et Joseph, 2009; Pituello et al., 2015). Parmi les propriétés physicochimiques qui distinguent un biochar, il y a la porosité, la surface spécifique, la capacité de rétention en eau, le contenu en éléments minéraux et organiques, la capacité d’échange cationique (CEC) et le pH.
1.2.1 Propriétés physiques
1.2.1.1 Porosité
Lors de la formation du biochar, la température de la pyrolyse choisie influence la porosité. Dutta et al. (2012) ont observé que les biochars produits entre 350°C et 400°C avaient une porosité totale plus élevée que ceux produits à 300°C. Aussi, Bagreev et al. (2001) ont démontré qu’une température de pyrolyse entre 400°C et 600°C a augmenté considérablement la porosité du biochar. L’augmentation des pores serait créée par un accroissement de molécules d’eau relâchées suite à l’action de l’hydroxylation à haute température (Bagreev et al., 2001). Aussi, le temps de séjour de la biomasse dans le pyrolyseur pourrait avoir un impact sur la porosité du biochar (Novak et al., 2009a).
1.2.1.2 Surface spécifique
La surface spécifique d’un adsorbant est par définition une surface par unité de masse (m2 g-1). Cette surface est créée essentiellement par les micro- et mésopores. Plus la surface spécifique est grande plus la surface de contact est élevée et plus la quantité de matières
4
adsorbées est importante. Ce paramètre est obtenu en appliquant la théorie de Brunauer, Emmet et Teller, d’où l’appellation surface BET (Schimmelpfennig et Glaser, 2012). D’après la littérature, la surface spécifique des biochars varie beaucoup selon la température et les conditions de la pyrolyse. Il a été démontré qu’un biochar de paille de blé produit à partir d’une pyrolyse lente (6°C min-1, température finale à 525°C et maintenue durant 2 heures) a eu une plus faible surface spécifique (0,6 m2 g-1) comparativement à la production de ce biochar à partir d’une pyrolyse rapide (250 à 1000°C s-1, température finale à 525°C et maintenue durant quelques secondes, 1,6 m2 g -1) (Bruun et al., 2012). Novak et al. (2009a) ont déterminé que plus la température augmente, plus la surface spécifique s’élève et plus il y a augmentation de la teneur en cendres.
Aussi, la surface spécifique est influencée par la nature de la biomasse utilisée. Pour une température donnée (entre 400°C et 450°C), des biochars fabriqués à partir de bois de pin, de litières de volaille et de tiges de maïs avaient une surface spécifique inférieure à 50 m2 g-1, tandis qu’un biochar de bois d’aulne avait une surface spécifique comprise entre 350 m2 g-1 et 400 m2 g-1 et celui d’écales de noisettes avait une surface spécifique supérieure à 500 m2 g-1. En général, les biochars provenant de produits de bois ont une surface spécifique supérieure à 400 m2 g-1 (Downie et al., 2009). Selon l’étude de Schimmelpfennig et Glaser (2012), un biochar ayant une surface spécifique supérieure à 100 m2 g-1 serait bénéfique dans l’amélioration de la fertilité des sols et permettrait la séquestration du carbone.
1.2.1.3 Capacité de rétention en eau
Le rapport O:C d’un biochar serait un indicateur potentiel pour déterminer son caractère hydrophile et sa polarité. Normalement, lorsque la température de la pyrolyse augmente, le biochar a une faible teneur en oxygène et donc un rapport O:C très faible. Selon une étude de Wang et al. (2006) l’augmentation de la température de la pyrolyse peut diminuer la polarité sur la surface du biochar résultant en une diminution de sa capacité de rétention en eau. Cependant, Kinney et al. (2012) ont observé une faible hydrophobicité de trois différents biochars pyrolysés entre 400°C à 600°C.
5 1.2.2 Propriétés chimiques
1.2.2.1 Composition minérale
Selon la littérature, la composition et la disponibilité des éléments minéraux des biochars varient beaucoup. La matière première et les conditions de la pyrolyse seraient la source de cette variation (Ding et al., 2016). Chan et Xu (2009) ont observé une grande variation du contenu en phosphore selon la biomasse et les conditions de la pyrolyse utilisées. Pour ce qui est du contenu en azote, celui-ci tend à être plus faible dans le biochar lorsque la température de pyrolyse augmente. De plus, il a été rapporté que lorsque la température de pyrolyse atteint 500˚C, plus de la moitié du contenu en azote et en soufre de la biomasse peut être perdu (Bagreev et al., 2001; Chan et Xu, 2009; Lang et al., 2005). La réduction de l’azote pourrait être causée par une perte de composés organiques volatils lors de la pyrolyse. L’augmentation de la température de pyrolyse peut favoriser la libération plus grande de matières volatiles piégées dans le biochar (Bagreev et al., 2001 ; Dutta et al., 2012).
La biomasse utilisée lors de la pyrolyse peut avoir un effet sur la concentration en éléments minéraux retrouvés dans le biochar (Unger et al., 2011). De façon générale, le contenu en éléments minéraux semble être plus élevé dans les biochars d’origine animale, de déchets alimentaires et de maïs, que dans les biochars de produits forestiers (pin, chêne et noix) (Rajkovich et al., 2012). D’ailleurs, Chan et Xu (2009) ont constaté que les concentrations en phosphore et en azote étaient plus élevées dans les biochars produits à partir de litières d’animaux que dans les biochars de biomasses végétales. Pour ce qui est du carbone, Antal et Grønli (2003) mentionnent que le contenu en carbone dans le biochar varie selon le type de biomasse. Un biochar dont la matière première provient de bois durs a un contenu plus élevé en carbone comparativement à des résidus de cultures ou de la litière de volaille.
1.2.2.2 Production de composés toxiques
Le type de biomasse et la température de la pyrolyse ont une influence sur la concentration des hydrocarbures aromatiques polycycliques (HAPs) et des dioxines dans le biochar (Schimmelpfennig et Glaser, 2012). De plus, les conditions de la pyrolyse peuvent aussi influencer la concentration des HAPs (Brown et al., 2006). Lors de la
6
pyrolyse, les composés organiques contenus dans la biomasse sont partiellement fragmentés en de plus petits composés instables. Ces fragments sont composés de radicaux libres hautement réactifs qui se combinent pour former un nouveau composé plus stable par des réactions de recombinaison et forment les HAPs (Hale et al., 2012). Selon Stanmore (2004), les dioxines seraient essentiellement formées lorsque la température de la pyrolyse est entre 200°C et 400°C. Dans le cas des HAPs, Manya (2012) rapporte qu’une biomasse pyrolysée à des températures plus élevées que 700°C génère une forte concentration d’HAP. Concernant l’étude de Hale et al. (2012), une faible concentration d’HAP a été observée dans les biochars produits à des températures de pyrolyse variant entre 500°C et 600°C. Étant donné la variabilité, Schimmelpfennig et Glaser (2012) recommandent une teneur en HAPs plus faible que celle retrouvée normalement dans le sol.
1.2.2.3 Capacité d’échange cationique
Il a été établi que plus la température de la pyrolyse est faible plus la CEC est faible et vice versa (Lehmann, 2007). De plus, l’amendement avec un biochar possédant une surface spécifique élevée peut favoriser davantage la CEC des sols (Liang et al., 2006). La CEC du biochar est attribuée en partie à une augmentation de l’oxygénation des groupements fonctionnels retrouvés sur la surface du biochar (Cheng et al., 2006). Ces différents groupes fonctionnels qui interagissent avec le milieu sont les groupements pyrannes, phénoliques, carboxyliques, lactones et les amines (Brennan et al., 2001). Ces groupes peuvent agir sur l’agrégation des particules du sol, sur la matière organique dissoute et sur le transport des gaz et de l’eau (Joseph et al., 2009). Selon certains chercheurs, l’oxydation de la surface du biochar mènerait à une plus grande CEC par unité de carbone dans le sol (Liang et al., 2006; Mao et al., 2012). Toutefois, l’ajout de biochar peut aussi avoir un effet nul sur la CEC du sol et cela pourrait dépendre du type de biomasse utilisée. Par exemple, Novak et al. (2009b) rapportent que l’amendement avec un biochar de coquilles de noix de pécan pyrolysé à 700°C n’a eu aucun effet sur la CEC d’un sol incubé pendant 67 jours.
1.2.2.4 Minéralisation et séquestration du carbone
À des températures élevées lors de la pyrolyse, le carbone aliphatique se convertit en carbone aromatique. Par exemple, lorsque la température de la pyrolyse augmente de
7
150°C à 550°C, les groupements OH et CH3 de la matière organique diminuent et les liaisons doubles C=C augmentent. De plus, les ratios H:C et O:C du biochar diminuent lorsque la température de la pyrolyse augmente. En général, des biochars produits à des températures élevées, entre 500°C à 700°C, sont bien carbonisés et stables. Ces biochars possèdent un faible ratio H:C (< 0,1) et une grande surface spécifique. À l’inverse, des biochars produits à de faibles températures (300 °C et 400°C) sont partiellement carbonisés et moins stables. Dans ce cas, le ratio H:C et la concentration en oxygène sont élevés et le biochar possède une faible surface spécifique. La présence de groupements aromatiques engendre une réduction du taux de minéralisation du carbone et par conséquent une réduction de la disponibilité des nutriments tels l’azote, le phosphore et le soufre (Ameloot et al., 2013; Chan et Xu, 2009; Xiao et Yang, 2013).
Certains biochars peuvent être très récalcitrants, dont ceux possédant une forte proportion de carbone avec des structures aromatiques condensées. La nature récalcitrante du biochar peut être intéressante si l’objectif principal est de séquestrer le carbone. Par contre, si l’objectif est d’améliorer la fertilité des sols et d’augmenter également la séquestration du carbone, les groupes structurels du biochar doivent être plus oxydables et avoir un faible ratio C:N (Novak et al., 2009b). Dans le cas où le biochar est utilisé comme amendement, Schimmelpfennig et Glaser (2012) recommandent d’avoir un biochar avec un ratio O:C < 0,4, un ratio H:C < 0,6 et un contenu en C total > 15%.
1.2.2.5 pH et conductivité électrique
La température de la pyrolyse peut influencer le pH du biochar. Par exemple, Novak et al. (2009a) ont observé qu’un biochar produit à une température élevée (700°C) avait un pH plus élevé comparativement à un biochar produit à faible température (250°C). Une autre étude rapporte une augmentation de 2 unités de pH entre les biochars produits à une température de 300°C et de 600°C (Rajkovich et al., 2012). L’augmentation de la température de pyrolyse peut favoriser la production de cendre et une augmentation du contenu en cations basiques (Na+, K+, Mg2+ et Ca2+) qui sont directement corrélés avec le pH du biochar (Singh et al., 2015). La matière première choisie peut également faire varier le pH du biochar, allant d’un pH = 4 à un pH = 12 (Cheng et al., 2006; Lehmann, 2007; Rogovska et al., 2012). Un biochar produit à partir de bois, un matériel très ligneux, possède en général un pH plus élevé qu’un biochar produit à partir de résidus de cultures car son contenu en Ca2+ est plus élevé (Singh et al., 2015). Toutefois, une récente revue
8
littérature rapport aucun effet du contenu en lignine sur le pH du biochar (Ding et al., 2016). Le pH du biochar est plutôt proportionnel avec la température de pyrolyse propre à chacune des biomasses végétales. D’autre part, la méthode de pyrolyse (rapide ou lente) peut influencer le pH du biochar. Bruun et al. (2012) ont observé qu’un biochar produit à partir de pailles de blé et pyrolysé lentement (vitesse de 6°C min-1 ; température maximale de 525°C maintenue durant 2 heures) avait un pH plus élevé (pH = 10,1) qu’un biochar pyrolysé rapidement (pH = 6,8 ; pyrolyse en continu avec un temps de résidence de quelques secondes ; vitesse de 250 à 1000°C s-1).
Par rapport à la conductivité électrique (CE), celle-ci semble varier plus en fonction du type de biomasse que de la température de la pyrolyse (Rajkovich et al., 2012). Par exemple, la CE dans des biochars d’origine animale (bovin et volaille) et de maïs présentées dans l’étude de Rajkovich et al. (2012) n’a pas été influencée avec l’augmentation de la température de la pyrolyse, allant de 300 à 600 °C. En excluant les résidus alimentaires et ceux des boues de papetières, la CE des biochars dans l’étude de Rajkovich et al. (2012) est généralement plus élevée dans les biochars d’origine animale (200 à 500 mS m-1) que ceux d’origine végétale (3,8 à 203 mS m-1). Sing et al. (2015) mentionnent que le contenu en sels du matériel original influence la CE du biochar.
1.3 Effets du biochar sur les propriétés physicochimiques du sol
Selon la littérature, l’amendement en biochar peut améliorer les propriétés physiques du sol, telles que la masse volumique apparente, la porosité, la capacité de rétention en eau, la stabilité et la formation d’agrégats (Ding et al., 2016). Toutefois, des effets divergents ont été rapportés. Par exemple, Watts et al. (2005) n’ont observé aucune amélioration de l’agrégation de leur sol argileux amendé en biochar, sans apport supplémentaire en matière organique. Selon Warnock et al. (2007), il est possible que l’agrégation soit seulement possible lorsqu’il y a interaction entre la matière organique et l’activité des microorganismes. D’autre part, Cheng et al. (2006) mentionnent que l’effet du biochar sur l’agrégation du sol serait plutôt lié à sa CEC et au pH du sol. Comme c’est le cas avec les argiles, une CEC élevée peut favoriser l’agrégation du sol.Pour ce qui est des propriétés chimiques, une méta-analyse de 371 études indépendantes rapporte que l’ajout de biochar dans le sol permet d’augmenter le contenu en azote, phosphore, potassium et celui du carbone total (Biederman et Harpole, 2013 ; Mukherjee
9
et al., 2014). De plus, l’apport en biochar dans un sol acide tend à augmenter le pH, la CE et la CEC (Chintala et al., 2014 ; Nemati et al., 2014). Le potentiel chaulant du biochar peut être attribué à son haut contenu en cations basiques qui peut améliorer la disponibilité des nutriments essentiels à la plante dans un sol acide. Toutefois, cela va dépendre de la dose appliquée et de la composition chimique du biochar (Chintala et al., 2014).
Le type de sol pourrait influencer l’effet bénéfique du biochar (Unger et Killorn, 2011). Les résultats obtenus après l’application de 10 t ha-1 d’un biochar fabriqué à partir des rebuts de pâtes et papiers sur un sol ferreux ont permis d’améliorer la qualité du sol et le rendement des cultures. Par contre, l’application de ce biochar sur un sol calcaire a présenté des effets négatifs, en particulier en présence d’engrais. Le pouvoir chaulant du biochar provenant des rebuts de pâtes et papiers serait très bénéfique dans les sols acides, où la concentration très élevée en aluminium limite la croissance de la plante. Par contre, le pouvoir chaulant du biochar serait moins bénéfique pour les sols calcaires (Van Zwieten et al., 2010). Certains biochars alcalins peuvent contenir une forte concentration en sels et influencer à la hausse de la salinité des sols calcaires pouvant nuire à la croissance de la plante et à l’activité microbienne (Van Zwieten et al., 2010; Hussain et al., 2016).
1.4 Effets du biochar sur les émissions des gaz à effet de serre
Les principales propriétés physicochimiques du biochar impliquées dans l’atténuation des émissions en CO2 du sol sont : sa capacité de rétention en eau et en carbone ; sa porosité ; la stabilité du carbone ; et son contenu en composés toxiques (Fornes et al., 2015; Jones et al., 2011; Laird et al., 2009; Liu et al., 2016; Maestrini et al., 2015). Par exemple, l’augmentation du contenu du sol en carbone facilement dégradable (carbone labile), suite à l’ajout de biochar, peut favoriser l’activité microbienne et contribuer aux émissions en CO2 (Ameloot et al., 2013).Il existe trois fractions de carbone labile : le carbone minéral (soluble à l’eau) ; le carbone organique (soluble à l’eau et rapidement minéralisé par les microorganismes) ; et le carbone difficilement oxydable provenant de la partie amorphe ou microcristalline de la structure du biochar. Le carbone labile du biochar est défini comme étant la fraction minéralisée en CO2 au cours d’une courte période. Cette minéralisation serait occasionnée
10
par des effets abiotiques ou biotiques. La minéralisation du biochar comporte généralement deux phases : la minéralisation rapide suivie d’une minéralisation lente. Selon un test d’incubation, la phase rapide de minéralisation se manifeste dans la première semaine ou les premiers mois, suite à l’application du biochar dans un sol (Joseph et al., 2009). L’épuisement du carbone labile engendre, par la suite, une diminution des émissions en CO2 dans le sol amendé en biochar (Case et al., 2012; Maestrini et al., 2015; Yoo et Kang, 2012).
Pour ce qui est des émissions en CH4, il a été observé dans la littérature que les sols amendés avec du biochar émettaient des concentrations très variées selon le type de biochar et le type de sol (Liu et al., 2016 ; Manya et al., 2012 ; Yoo et Kang, 2012). Les émissions en CH4 vont dépendre de la présence de matières organiques facilement décomposables, de la teneur en eau du sol et du potentiel redox. De plus, une concentration élevée en potassium dans le biochar peut favoriser l’activité des microorganismes méthanotrophes et inhiber ceux impliqués dans la méthanogenèse (Babu et al., 2006 ; Lehmann et Joseph, 2009 ; Le Mer et Roger, 2001).
Selon la littérature, les émissions en N2O semblent diminuées suite à l’amendement en biochar. Plusieurs mécanismes biotiques impliqués dans l’atténuation du N2O dans les sols amendés en biochar ont été proposés (Clough et al., 2013; Cayuela et al., 2014; Van Zwieten et al., 2014). Parmi ces mécanismes, il y a: (i) augmentation de l’aération du sol en inhibant le processus de dénitrification par la présence d’oxygène ; (ii) le contenu en carbone labile du biochar favorisant la dénitrification complète de l’azote (formation de N2) ; (iii) accroissement du pH par le biochar créant un environnement optimal pour l’activité de la N2O réductase où celle-ci contribue à la formation du N2; (iv) réduction de la disponibilité de l’azote inorganique aux microorganismes impliqués dans la nitrification et/ou la dénitrification qui produit le N2O; et (v) relâchement de composés toxiques inhibant l’activité biologique du sol.
Des mécanismes abiotiques ont aussi été proposés dans l’atténuation des émissions de N2O dans les sols amendés en biochar (Cayuela et al., 2014). Il y a la chimiodenitrification qui réfère à des réactions chimiques abiotiques qui mènent à la formation de monoxyde d’azote (NO), N2O et de N2. Parmi ces réactions, il y a la décomposition chimique de: (i) l’hydroxylamine (NH2OH) ; (ii) du NO2- ; et (iii) du nitrate d’ammonium (NH4NO3)) en présence de lumière, d’humidité et d’une surface réactive. Un autre mécanisme abiotique
11
plausible est l’adsorption du N2O sur la surface du biochar dû à la présence d’hydroquinone de fer, de cuivre et de manganèse. De plus, Cayuela et al. (2013) mentionnent que le biochar pourrait possiblement agir comme un transporteur «electron
shuttle» favorisant le transport d’électrons aux microorganismes compétitionnant avec les
microorganismes dénitrificateurs, réduisant ainsi les émissions en N2O.
1.5 Effets du biochar sur la croissance de la plante
L’amendement en biochar peut avoir un effet bénéfique sur la croissance des plantes (Biedermann et Harpole, 2013). Par exemple, Graber et al. (2010) ont étudié l’apport de biochar de citronnier (1, 3 et 5% m/m) sur la croissance de la tomate et du poivron dans de la fibre de coco. Selon leurs résultats, la croissance de la tomate et du poivron a été significativement plus élevée dans les substrats amendés en biochar que dans le témoin sans amendement. Une autre étude a démontré un effet bénéfique sur la croissance de la tomate et du poivron suite à un amendement en biochar dans un sol sableux (Harel et al., 2012). Par contre, aucun effet significatif sur la croissance de la plante entre les deux doses d’applications de biochar (1 et 3% m/m) n’a été observé. Pour ce qui est de l’étude de Vaughn et al. (2013), des effets divergents ont été observés sur la croissance des plants de tomate et de Marigold amendés avec une dose de 5, 10 ou 15% (v/v) de biochar de bois ou de paille.
Bien qu’un amendement de biochar peut avoir des effets positifs, ceci peut aussi occasionner des effets neutres et même nuisibles à la croissance de la plante. Ceci peut dépendre des propriétés physicochimiques du biochar (Manya et al., 2012). C’est le cas des biochars fabriqués à partir de litières de volaille. Ces biochars possèdent généralement une forte concentration en sodium. Selon une étude réalisée par Revell et al. (2012), l’application de 2,5% (m/m) de biochar, fabriqué à partir de litières de volaille, avait une concentration en sels solubles (1,2 dS m-1) très élevée. Ils constatent que la concentration en sels était beaucoup trop élevée pour la croissance du poivron. Rajkovich et al. (2012) ont également mesuré une concentration élevée en sodium dans les biochars de litières de volaille, mais aussi dans ceux de bovin et de rebuts de pâtes et papiers. Cette concentration élevée en sels expliquerait la réduction de la croissance du maïs dans leur étude. Enfin, Rajkovich et al. (2012) mentionnent qu’une application supérieure à 2% (m/m) (≈ 26 t ha-1) de biochar n’a pas amélioré la croissance du maïs. Ils mentionnent que
12
l’effet du biochar varie beaucoup avec le type de sol et le type de culture et qu’une interaction entre la plante, le sol et le type de biochar est possible.
D’autre part, une étude récente rapporte que l’ajout de 5% (m/m) de biochar (mélange d’écorces de riz et de coton) dans un loam sableux a permis de réduire les apports en eau sans affecter les rendements d’une culture de la tomate (Akhtar et al., 2014). Selon les auteurs de cette étude, l’augmentation du pouvoir de rétention dans le sol amendé en biochar pourrait avoir contribué à réduire le nombre d’irrigations. Toutefois, des effets divergents peuvent se manifester et cela va dépendre des exigences nutritionnelles, du type de cultivar et du stade de développement de la plante (Vaccari et al., 2015).
1.6 Effets du biochar sur la biologie du sol
Dans la plupart des études, il a été démontré que la biomasse microbienne avait augmenté suite à l’ajout de biochar dans les sols (Gul et al., 2015). De plus, l’apport en biochar aurait créé des changements importants dans la composition des communautés microbiennes incluant les mycorhizes et l’activité des enzymes (Anderson et al., 2011; Gul et al., 2015; Warnock et al., 2007). Selon Anderson et al. (2011), l’ajout de biochar pourrait potentiellement influencer la croissance de certains groupes de microorganismes impliqués dans le cycle de l’azote, du carbone et du phosphore dans le sol. De plus, le biochar pourrait avoir un impact positif sur la composition des communautés microbiennes du sol et favoriser certaines espèces impliquées dans la dénitrification complète de l’azote (Xu et al., 2014 ; Harter et al., 2014 ; 2016). Cependant, peu d’études existent à ce jour sur les relations entre le type de biochar et la diversité des populations microbiennes dans le sol (Ding et al., 2016 ; Gul et al., 2015 ; Harter et al., 2016).
Des études rapportent que l’amendement de biochar peut favoriser la croissance de certains groupes d’organismes bénéfiques à la croissance de la plante (Graber et al., 2010 ; Kolton et al., 2011 ; Harel et al., 2012). Par exemple, Graber et al. (2010) ont observé une augmentation de Pseudomonas spp., Trichoderma spp et de Bacillus spp dans la rhizosphère d’une culture du poivron amendé en biochar comparativement au témoin sans amendement. Pour ce qui est de l’étude de Kolton et al. (2011), ceux-ci ont observé des effets divergents sur les populations bactériennes. D’après leurs résultats, il y a eu une augmentation de 12 à 30% des bacteroidetes et une diminution de 71 à 47% des
13
constaté une augmentation de la population bactérienne totale et de Bacillus spp suite à un apport de 1 à 3% (m/m) de biochar. Par contre, aucun effet apparent sur le développement des bactéries du genre Pseudomonas spp., et des champignons du genre
Actinomycetes spp n’a été observé. Dans le cadre d’une autre étude, l’amendement de
biochar semble avoir eu un rôle important dans l’induction d’une réponse systémique chez la plante contre des microorganismes pathogènes. Elad et al. (2010) ont constaté que l’addition de biochar provenant de bois de citronnier (1, 3 et 5% m/m) dans un mélange de substrat horticole et dans un sol sableux a permis une meilleure résistance contre deux champignons pathogènes foliaires (Botrytis cinerea et Leveillula taurica) chez la tomate et le poivron. Toutefois, une récente étude rapporte que l’ajout de 50% (v/v) de biochar de pin pyrolysé à 475˚C dans un substrat organique a favorisé le développement du Pythium
ultimum, un agent pathogène, dans différentes cultures de serre (géranium, basilic, laitue
et poivron) (Gravel et al., 2013). Cependant, aucun effet négatif visible sur la plante n’a été observé dans leur étude. Selon une récente revue littérature, le biochar pourrait altérer les signaux entre la plante et les microorganismes du sol et modifier l’équilibre de la microchaîne trophique du sol (Soil Food Web) favorisant ainsi certaines espèces microbiennes au détriment d’autres organismes (Ding et al., 2016).
Selon Matsubara et al. (2002), le biochar peut augmenter l’efficacité des champignons mycorhiziens arbusculaires à protéger les racines de leur plante hôte contre les infections transmises par des organismes pathogènes. Dans certains cas, il a été démontré que les pores du biochar pouvaient servir de refuge pour les bactéries et les champignons dans le sol. Par la grosseur de ses pores, le biochar peut servir d’habitat aux microorganismes (0,3 à 3,0 μm pour les bactéries; 2 – 80 μm pour les champignons; et 7 – 30 μm pour les protozoaires) qui les protègent contre les microarthropodes, des prédateurs du sol (Warnock et al., 2007; Gul et al., 2015). Toutefois, la biodisponibilité des certains éléments minéraux tels que le carbone, l’azote, le phosphore, et le sodium dans le sol amendé en biochar peut influencer négativement les populations microbiennes. De plus, la libération de produits toxiques retrouvés dans le biochar pourrait aussi jouer un rôle important sur l’inhibition du développement des microorganismes du sol (Ding et al., 2016 ; Warnock et al., 2007). Récemment, l’International Biochar Initiative (IBI, 2015) a établi des normes pour qu’un biochar puisse être utilisé comme amendement. Le IBI (2015) propose des concentrations limites en hydrocarbure (HAPs, dioxine et éthylènes) et en métaux lourds pour ne pas nuire à la croissance de la plante et à la microflore du sol.