Impact d’une sensibilisation aux lipides oxydés sur
la réponse pulmonaire induite par la fumée de
cigarette de tabac
Mémoire
Maude Talbot
Maîtrise en médecine expérimentale
Maître ès sciences (M.Sc.)
Québec, Canada
Impact d’une sensibilisation aux lipides oxydés sur
la réponse pulmonaire induite par la fumée de
cigarette de tabac
Mémoire
Maude Talbot
Sous la direction de :
Mathieu Morissette, directeur de recherche
David Marsolais, codirecteur de recherche
iii
RÉSUMÉ
PROBLÉMATIQUE : Une exposition à la fumée de cigarette de tabac (FC), via un stress oxydatif accru, affecte l’homéostasie lipidique pulmonaire, induisant une réponse inflammatoire ainsi qu’une altération fonctionnelle et structurelle pulmonaire. L’arrêt tabagique demeure l’outil préventif le plus efficace pour pallier ces effets délétères et le développement de maladies telle la maladie pulmonaire obstructive chronique (MPOC). Récemment, une augmentation d’anticorps pulmonaires contre les lipoprotéines de faible densité oxydées (anti-OxLDL) a été démontrée chez un modèle murin d’exposition à la FC. Des anticorps semblables ont été observés dans l’athérosclérose, qui possèdent des similitudes avec la MPOC associée au tabagisme, et ont servi au développement de stratégies d’immunisation visant la réduction des plaques d’athérome. OBJECTIF : Déterminer l’impact d’un protocole de sensibilisation aux lipides oxydés sur la réponse pulmonaire induite par la FC. MÉTHODES : Un protocole d’immunisation composé d’OxLDL ou de PBS seul (véhicule/contrôle) a été développé puis administré en prophylaxie chez un modèle murin d’exposition à la FC. Les niveaux d’anticorps anti-OxLDL systémiques et pulmonaires, la réponse inflammatoire, les fonctions pulmonaires ainsi que les changements structuraux et transcriptionnels ont été comparés lors de l’administration de l’immunothérapie ou du véhicule. RÉSULTATS : Aucune différence significative au niveau inflammatoire, mais des niveaux d’anticorps anti-OxLDL plus élevés qu’en contexte tabagique seul ont été observé dans les poumons et le sérum des souris immunisées. L’immunothérapie seule affectait les fonctions pulmonaires similairement à la FC, sans induire de changements additifs. Aucun changement histologique ou transcriptionnel n’a été observé entre l’immunisation et le véhicule. CONCLUSION : Bien qu’aucun effet délétère additionnel à la FC n’ait été observé lors de l’administration prophylactique de cette immunothérapie à base d’OxLDL, ces résultats n’apparaissent pas prometteurs quant au développement d’une telle thérapie réduisant les conséquences pulmonaires du tabagisme. De plus amples analyses seront toutefois nécessaires.
iv
ABSTRACT
BACKGROUND: Cigarette smoke exposure, through increased oxidative stress, affects pulmonary lipid homeostasis, resulting in an inflammatory response as well as functional and structural alterations in the lungs. Smoking cessation remains the most effective prevention tool to counteract these deleterious effects and the development of chronic obstructive pulmonary disease (COPD). Recently, an increase in pulmonary antibodies against oxidized low-density lipoproteins (anti-OxLDL) has been demonstrated in a mouse model of cigarette smoke exposure. Similar antibodies have been observed in atherosclerosis, a condition similar to COPD associated with smoking, and have been used to develop immunization
strategies for atheroma plaque reduction. OBJECTIVE: To determine the impact
of an oxidized lipids’ sensitization protocol on the pulmonary response induce by
cigarette smoke exposure. METHODS: An immunization protocol composed of
OxLDL or PBS alone (vehicle/control) was developed and then administered prophylactically in a mouse model of acute or subchronic cigarette smoke exposure. Levels of systemic and pulmonary anti-OxLDL antibodies, inflammatory response, pulmonary functions as well as structural and transcriptional changes
were compared (immunotherapy vs vehicle). RESULTS: No significant difference
in inflammatory response but higher levels of anti-OxLDL antibodies than in smoking context were observed in the lungs and serum of the immunized mice. Immunotherapy with OxLDL alone affected pulmonary functions similarly to cigarette smoke exposure, but did not induce additive changes. No apparent histological changes or transcriptional changes were observed between
immunization and the vehicle. CONCLUSIONS: Although no additional deleterious
effects to cigarette smoke exposure have been observed during prophylactic administration of this OxLDL immunotherapy, these results do not seem promising for the development of such a therapy reducing the pulmonary consequences of smoking. However, further experimentations will be necessary.
v
TABLE DES MATIÈRES
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des figures ... vii
Listes des tableaux ... viii
Listes des abréviations ... ix
Remerciements ... xiv
Avant-propos ... xvi
Chapitre I : Mise en contexte générale ... 1
1.1. Le tabagisme ... 1
1.1.1. État actuel de la situation ... 1
1.1.2. Composition de la fumée de cigarette de tabac ... 1
1.1.3. Problèmes de santé associés ... 2
1.1.3.1. Les maladies pulmonaires associées : le cas de la MPOC ... 2
1.1.3.2. Les maladies cardiovasculaires associées : le cas de l’athérosclérose ... 7
1.2. Les systèmes pulmonaire et immunitaire et leur implication en contexte tabagique ... 10
1.2.1. Le système pulmonaire ... 10
1.2.1.1. Le surfactant pulmonaire ... 12
1.2.2. Le système immunitaire ... 14
1.2.2.1. Les réponses immunitaires innées et adaptatives pulmonaires ... 14
1.2.2.2. Les thérapies immunitaires et leur composition ... 20
1.2.3. Réponse pulmonaire à la fumée de cigarette de tabac ... 21
1.2.3.1. Stress oxydatif ... 21
1.2.3.1.1. Débalancement de l’homéostasie lipidique pulmonaire ... 24
1.2.3.2. Réponse inflammatoire ... 26
1.2.3.3. Génération d’épitopes oxydés et production d’anticorps subséquente ... 28
1.2.3.4. Changements tissulaires ... 30
1.2.3.5. Altération des fonctions pulmonaires ... 33
1.3. Les modèles animaux ... 35
1.4. Problématique, hypothèse et objectifs ... 38
1.4.1 Problématique ... 38
1.4.2 Hypothèse ... 39
1.4.3 Objectifs ... 39
Chapitre II : Impact de l’immunisation au OxLDL sur la réponse pulmonaire à la fumée de cigarette chez la souris ... 41
2.1. Résumé ... 41
2.2. Title page ... 43
2.3. Abstract ... 44
2.4. Introduction ... 45
vi
2.5.1. Mice ... 47
2.5.2. Immunization to OxLDL ... 47
2.5.3. Cigarette smoke exposure ... 47
2.5.4. Pulmonary function assessment ... 47
2.5.5. Sample collection and processing ... 48
2.5.6. Measurement of OxLDL-specific antibodies ... 48
2.5.7. ELISA ... 49
2.5.8. Quantitative PCR ... 49
2.5.9. Lung histology ... 50
2.5.10. Statistical analysis ... 50
2.6. Results ... 51
2.6.1. Impact of recall injection numbers and cigarette smoke exposure on circulating and pulmonary anti-OxLDL antibody levels ... 51
2.6.2. Impact of OxLDL immunization on the pulmonary inflammatory response to cigarette smoke exposure ... 51
2.6.3. Impact of OxLDL immunization on smoking-induced changes in lung functions ... 52
2.6.4. Impact of OxLDL immunization on pulmonary structure ... 52
2.7. Discussion ... 53
2.8. References ... 56
2.9. Figure legends ... 57
Chapitre III : Discussion générale ... 63
3.1. Impact d’une immunisation au OxLDL sur les altérations fonctionnelles et structurelles pulmonaires induites par la FC ... 65
3.2. Forces et limites de l’étude ... 71
3.3. Perspectives ... 76
3.4. Conclusion générale ... 78
Bibliographie ... 80
vii
LISTE DES FIGURES
Figure 1.1. : Caractéristiques pathophysiologiques de la MPOC/COPD. ... 3 Figure 1.2. : Réponse primaire et secondaire suite à une sensibilisation à un antigène. ... 18 Figure 2.1. : Impact of OxLDL immunization on circulating and pulmonary levels of anti-OxLDL antibodies and its interaction with cigarette smoke exposure. .. 59 Figure 2.2. : OxLDL immunization does not exacerbate the pulmonary inflammatory response to cigarette smoke exposure. ... 60 Figure 2.3. : Impact of OxLDL immunization on cigarette smoke-induced alterations in lung functions. ... 61 Figure 2.4. : OxLDL immunization does not impact cigarette smoke-induced histological changes. ... 62
viii
LISTES DES TABLEAUX
Tableau 1.1. : Comparatif entre l’athérosclérose et la MPOC. ... 7 Tableau 1.2. : Exemple de paramètres obtenus selon les différents modèles mathématiques utilisés par le FlexiVent®. ... 34
ix
LISTES DES ABRÉVIATIONS
ABCA1 ATP-Binding Cassette A-1 ABCG1 ATP-Binding Cassette G-1
acta2 Actine alpha 2 du muscle lisse (Alpha 2 smooth muscle actin) ADN Acide désoxyribonucléique
ANOVA Analyse de la variance
Anti-OxLDL Contre les lipoprotéines de faible densité Anti-OxPL Contre les phospholipides oxydés
Anti-OxPC Contre la phosphatidylcholine oxydée
Apo Apolipoprotéine
ApoE-/- Apolipoproteine E knock-out
BAL Bronchoalveolar lavage
BALF Bronchoalveolar lavage fluid
BSA Bovine serum albumin
CCAC Canadian Council for Animal Care CD Cluster de différenciation
cDNA Complementary deoxyribonucleic acid CmH2O Centimeter of water
CMH Complexe majeur d’histocompatibilité
col1a1 Chaine alpha 1 du collagène de type I (Collagen Type I Alpha 1 Chain)
col3a1 Chaine alpha 1 du collagène de type III (Collagen Type III Alpha 1 Chain)
CO2 Dioxyde de carbone
COPD Chronic obstructive pulmonary disease
CPA Cellule présentatrice d’antigène
Cq Quantification cycle
CS Cigarette smoke
ctgf Facteur de croissance du tissu conjonctif (Connective tissue growth factor)
x
CTL Lymphocytes T cytotoxiques (Cytotoxic T lymphocyte)
CuSO4-OxLDL Lipoprotéine à faible densité oxydée par du sulfate de cuivre CVF Capacité vitale forcée
CxCL5 (ou cxcl5) C-X-C motif chimiokine 5
DAMP Motifs moléculaires associés aux dommages cellulaires (damage-associated molecular patterns)
DC Cellule dendritique
DPPC Dipalmitoylphosphatidylcholine ELISA Enzyme-linked immunosorbent assay FC Fumée de cigarette de tabac
FLBA Fluide du lavage bronchoalvéolaire
G Amortissement tissulaire (tissue damping)
GM-CSF Granulocyte-macrophage colony-stimulating factor GOLD Global Initiative for Chronic Obstructive Lung Disease
h hour
H Élastance tissulaire (tissue elastance)
Hprt Hypoxanthine-guanine phosphoribosyltransférase (article) H&E Hématoxyline & éosine
iBALT inducible Bronchus-Associated Lymphoid Tissue
IFN Interféron
Ig Immunoglobuline
IL Interleukine
IL-1α Interleukine-1alpha
IU Unité internationale (international unit)
kg kilogram
LBA Lavage bronchoalvéolaire LDL Lipoprotéine de basse densité
LDLR-/- Récepteur de lipoprotéine de faible densité knock-out MARCO Macrophage receptor with collagenous structure MCP-1 Monocyte chemoattractant protein-1
xi
mg milligram
min minute
mL milliliter
MMP Matrix metalloproteinases
MPOC Maladie pulmonaire obstructive chronique MSR1 Macrophage scavenger receptor 1
N normale
nm nanometer
NS Not significant
OD Optic density
ODN CpG Oligodéoxynucléotides contenant des motifs Cytosine-phosphate guanine non méthylés
OxLDL Lipoprotéine de basse densité oxydée OxPL Phospholipides oxydés
OxPC Phosphatidylcholine oxydé
O2 Oxygène
PAMP Motifs moléculaires associés aux pathogènes (pathogen-associated molecular patterns)
PBS Phosphate Buffered Saline
PC Phosphatidylcholine
PCR Polymérisation en chaîne quantitative (polymerase chain reaction) PE Phosphatidyléthanolamine pg picogram PG Phosphatidylglycérol PL Phospholipide PI Phosphatidylinositol
PPARγ Peroxisome proliferator-activated receptor γ
PRR Récepteurs de reconnaissance de motifs moléculaires (pattern recognition receptors)
xii
P-V loop Courbe pression-volume (pression-volume loop)
qPCR Réaction de polymérisation en chaîne quantitative en temps réel (quantitative polymerase chain reaction)
RA Room air
Rn Résistance newtonienne (Newtonian resistance)
RNA Ribonucleic acid
ROS Espèce réactive de l’oxygène (Reactive oxygen species) Rplp0 Ribosomal protein large P0
R2 Coefficient of determination
s second
SM Sphingomyéline
Sn Stereospecific numbering SP-(A à D) Surfactant protein-(A à D) ssp1 Ostéopontine (osteopontin)
TBARS Thiobarbituric Acid Reactive Substances TCR Récepteur du lymphocyte T (T cell receptor) TGF Tumor growth factor
TH Lymphocytes T auxiliaires (T helper) TLTs Tissus lymphoïdes tertiaires
TMB 3,3',5,5'-tétraméthylbenzidine TNF Tumor necrosis factor
Treg Lymphocyte T régulateur
T° Temperature
VEMS Volume expiratoire maximal à une seconde
vs Versus α Alpha β Beta γ Gamma µl Microliter µm Micrometer
xiii
« La chance ne sourit qu’aux esprits bien préparés »
xiv
REMERCIEMENTS
Je tiens à remercier premièrement mon directeur de recherche, Mathieu Morissette, qui a cru en moi dès le début et qui m’a permis d’écourter mon séjour dans son laboratoire afin d’aller vers d’autres horizons, poursuivre ma formation académique. Un sincère merci à toi ! Tu es à mes yeux un jeune chercheur d’exception qui a très certainement une grande carrière devant lui. Ton sens de l’humour, ta disponibilité pour tes étudiants et tes connaissances sans fin me manquent déjà.
J’aimerais aussi remercier mes parents, France Parent et Normand Talbot, à qui je ne prends pas souvent le temps de dire merci. Je vous suis infiniment reconnaissante de m’avoir supporté depuis le début de mes études et de continuer à le faire jour après jour. En ce sens, je ne peux passer sous silence l’excellent travail de soutien, de motivation et de réconfort de mon amoureux et confident, Mathieu Cauchon. J’ai une chance inouïe de vous avoir à mes côtés.
Merci aux membres du comité évaluateur.Merci à mon codirecteur, David Marsolais, qui a toujours été de très bonne compagnie, surtout lorsqu’il était question de prendre une bière ! Merci aussi à tous les collaborateurs de l’Institut universitaire de cardiologie et de pneumologie de Québec.
J’aimerais aussi remercier deux personnes que j’apprécie énormément soit Marie-Josée Beaulieu et Sophie Aubin tant pour leurs réponses à mes innombrables questions qu’à leur enthousiasme de m’enseigner leur savoir et de m’aider. Marie-Jo, tu as été formidable de comprendre mon langage empressé, ponctué d’onomatopées et toi, Sophie, tu as été tellement dédiée dans tout ce que tu entreprenais pour moi. Les deux, vous avez été si généreuses de votre temps à mon égard. Un merci tout spécial à Marie-Eve Paré, avec qui je n’ai pas eu la chance de partager beaucoup de moments, mais qui m’a aidé énormément dans l’optimisation de certaines techniques et la génération de résultats.
xv
J’aimerais finalement remercier mes collègues et amis de tous les jours, Mélanie Hamel-Auger, Ariane Lechasseur, Joanie Routhier et Éric Jubinville ainsi que les stagiaires Marie Pineault, Mickael Maranda-Robitaille, Karine Duquette-Lozeau et Jennifer Lamothe. Oh combien de fous rires nous avons partagés tous ensemble ! On continu de s’organiser des soupers quand je descends à Québec.
Je tiens à remercier aussi les organismes subventionnaires, le Conseil de recherches en sciences naturelles et en génie du Canada et les Fonds de Recherche du Québec - santé pour leur bourse de maitrise.
Chacun, vous avez fait de mon parcours, une étape de ma vie dont je vais me souvenir à jamais. Merci sincèrement !
xvi
AVANT-PROPOS
Un article original, intitulé Impact of OxLDL immunization on the pulmonary response to cigarette smoke exposure in mice, dont je suis la première auteure, fait office de chapitre II du présent mémoire. Il regroupe les objectifs, la méthodologie et les principaux résultats pertinents à ce mémoire. Cet article, soumis une première fois dans la revue PLoS One, sera sous peu resoumis, suite à des correctifs, aujournal Physiological Reports.
En ce qui concerne la contribution de chacun des auteurs, je détiens la plus grande implication étant donné que j’ai été responsable de la planification et la réalisation de la majorité des expériences. En effet, j’étais en charge de mettre au point les protocoles d’immunisation, de préparer les solutions nécessaires et d’injecter les souris, et ce, à l’occasion en compagnie de Sophie Aubin. Cette dernière s’occupait également de l’exposition quotidienne des souris à la FC ou était remplacée par Marie-Josée Beaulieu lorsque nécessaire. De plus, j’ai procédé aux euthanasies des animaux, conjointement avec Mélanie Hamel-Auger et Marie-Josée Beaulieu. J’ai également généré la majorité des résultats présentés dans cet article scientifique. Certaines des analyses ont toutefois été générées par Ariane Lechasseur, Marie-Josée Beaulieu et Marie-Eve Paré. Morgan Gazzola et Ynuk Bossé ont contribué quant à eux à cet article en aidant à l’interprétation des résultats générés par le FlexiVent®. Marie-Eve Paré s’est également chargée de l’écriture initiale de l’article en se basant majoritairement sur mes figures et des sections (objectifs et hypothèses, méthodologie, résultats) que j’avais préalablement écrites en français. Mathieu C Morissette, le directeur de recherche qui a initialement imaginé ce projet, s’est occupé pour sa part d’éditer et de produire la version finale de ce manuscrit avec l’aide de David Marsolais qui a participé à la révision de ce dernier.
1
CHAPITRE I : MISE EN CONTEXTE GÉNÉRALE
1.1. Le tabagisme
1.1.1. État actuel de la situation
Le tabagisme est un problème de santé publique d’envergure mondiale ; malgré l’état actuel des connaissances sur le sujet, plus de 1,1 milliard de personnes fument [1]. Depuis les dernières décennies, suite à la sensibilisation et l’implantation de législations entourant le tabac, on fait face cependant à une diminution de leur nombre dans les pays occidentaux [2]. Il n’en demeure pas moins que, parmi ceux qui en consomment, au moins la moitié mourront d'une maladie liée au tabac. Cela représente plus de six millions de décès par année à travers le monde [3, 4], dont cinq directement attribuables à l’utilisation du tabac [3-5]. En 2014, au Canada, 18,1% de la population âgée de 12 ans et plus fumait chaque jour ou occasionnellement [6]. De plus, environ 80 000 à 100 000 enfants commencent à fumer chaque jour à travers le monde [4]. Cela dit, les complications liées au tabagisme telles les maladies pulmonaires vont persister pour des décennies [7]. D’un point de vue économique, les coûts associés au tabagisme (soins de santé, feux) sont astronomiques, estimés à 500 milliards de dollars/année mondialement [4]. Face à ces statistiques, il demeure d’actualité d’effectuer des recherches afin de développer des thérapies diminuant l’impact du tabagisme sur les sociétés actuelles.
1.1.2. Composition de la fumée de cigarette de tabac
La fumée de cigarette de tabac (FC) est un mélange dynamique et réactif composé de plus de 4 700 [8, 9] à 7 000 composés chimiques [10, 11], dont plusieurs sont documentés comme ayant des propriétés antigéniques [12], cytotoxiques, mutagènes, cancérigènes [7, 9, 10, 12, 13] ou pro-inflammatoires [7, 9]. Ce mélange d’aérosols constitué de gouttelettes liquides, de gaz et de composés semi-volatils [7] se divise en deux phases : une gazeuse et une particulaire [14]. Cette deuxième phase consiste en de fines particules atteignant les voies aériennes inférieures en
2
l’absence de filtre [7, 14]. Ces phases sont toutes deux riches en radicaux libres et autres oxydants [8, 14], mais les composés de ces deux fractions diffèrent. Les oxydants hautement réactifs de la phase gazeuse, au nombre de 1014 radicaux libres par bouffée, sont de courte durée de vie et incluent des espèces réactives de l’oxygène (ROS). Ceux de la phase particulaire, au nombre de 1017 oxydants à longue durée de vie par gramme, sont quant à eux des radicaux relativement stables tels des semiquinones pouvant être dommageables [8, 14]. Par conséquent, les oxydants dérivés de la combustion d’une cigarette sont majoritairement à l’origine des dommages [15] et réactions inflammatoires pulmonaires induits par la FC [16].
1.1.3. Problèmes de santé associés
Le tabagisme est un facteur de risque majeur associé au développement de maladies pulmonaires, cardiovasculaires et métaboliques [2]. En outre, il est connu pour son implication dans une panoplie d’affections, dont la maladie pulmonaire obstructive chronique (MPOC; COPD en anglais), différents cancers, l’asthme et des maladies cardiovasculaires telles l’athérosclérose [2, 17]. En effet, beaucoup de conditions chroniques systémiques résultent des conséquences indirectes (stress oxydatif, réactions inflammatoires) d’une exposition continue à la FC [12].
1.1.3.1. Les maladies pulmonaires associées : le cas de la MPOC
La MPOC est une cause majeure de morbidité/mortalité à travers le monde; elle est responsable d’un fardeau économique et sociétal substantiel [18]. Il s’agit de la 4e cause de décès au Canada [19], une personne y succombant toutes les heures, soit le tiers des gens mourant d'une maladie pulmonaire au pays [20]. En effet, plus de 750 000 personnes en souffrent et c'est au Québec que le taux de mortalité qui lui est attribuable est le plus élevé [20]. De plus, malgré le déclin du tabagisme, vu le vieillissement de la population, l’incidence de cette maladie a augmenté de 1976 à 2006 [16] et elle continue de le faire [18].
D’un point de vue pathophysiologique, la MPOC se caractérise par une obstruction, c’est-à-dire une limitation du passage de l’air non entièrement réversible
3
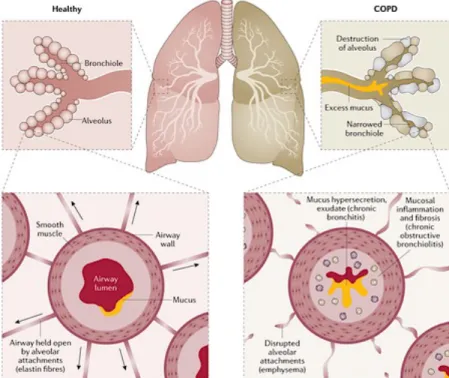
[2, 21-23] ainsi que par une inflammation chronique des voies respiratoires classiquement due à des particules délétères. Les deux sont habituellement progressives et peuvent évoluer vers une insuffisance respiratoire [18, 20, 21, 23, 24]. Cette maladie regroupe deux entités cliniques présentes de façon isolée ou non : l'emphysème et la bronchite chronique [2, 20, 22, 25]. Il s’agit de deux processus distincts touchant différentes régions du poumon et possédant des caractéristiques pathologiques et cliniques propres, mais la même étiologie [7]. L’emphysème se caractérise par une distension permanente des alvéoles associée à une détérioration de leurs parois [2, 20, 24], en l’absence de fibrose [23]. On observe également une perte d’élasticité du tissu pulmonaire [20] vu l’atteinte des fibres d’élastine maintenant normalement les voies aériennes ouvertes [26]. Pour sa part, la bronchite chronique entraine une inflammation permanente des bronches souvent accompagnée d’hypersécrétion de mucus [20, 24]. L’épaississement du muscle lisse, jumelé à l’accumulation excessive de mucus, entraine une réduction progressive de la lumière bronchique obstruant le passage de l’air [24]. Contrairement à l’emphysème, la bronchite chronique n'est pas associée à un processus destructif [27], mais elle inclut une fibrose tissulaire (voir Figure 1.1.)[24].
Tirée de [26]. Figure 1.1. : Caractéristiques pathophysiologiques de la MPOC/COPD.
4
La présentation clinique de la MPOC comprend divers symptômes tels que la dyspnée et la toux [23, 24] qui s’accompagnent souvent d’infections pulmonaires chez les patients [21, 24]. Chez les sujets emphysémateux, la sensation persistante d’essoufflement et de fatigue provient des expirations de plus en plus restreintes [20]. En effet, la perte de parenchyme pulmonaire et d’élasticité engendre la fermeture prématurée des bronches à l'expiration, causant un emprisonnement d'air [27]. Pour sa part, la bronchite chronique se caractérise par des expectorations abondantes durant plusieurs mois (≥ 3), et ce, généralement de durée de plus en plus longue chaque fois [2, 20, 27]. L’obstruction des bronches et les sécrétions causent encore une fois de l’essoufflement et une respiration sifflante [2, 20]. Ces symptômes se présentent de façon graduelle, après plusieurs années d'exposition à l'agent initiateur; la maladie apparaissant généralement entre 40-50 ans ou plus tôt si des facteurs génétiques sont impliqués [23].
Dans les pays industrialisés, la MPOC est causée principalement par le tabagisme qui est responsable de 80 [2] à 90% des cas [19, 20]. En effet, à long terme, entre 5 et 10% [2] ou de 15 à 25 % des fumeurs [20], selon les sources, vont développer cette maladie qui est largement sous-diagnostiquée et sous-traitée [23]. D’autres facteurs étiologiques incluent la pollution atmosphérique comme l’exposition aux gaz de combustion du charbon dans certaines régions du globe [2, 25] ou des prédispositions génétiques dont celle familiale associée à une anomalie de l’inhibiteur de protéases « alpha-1-antitrypsine », pour l’emphysème [7, 20].
La classification de la MPOC se base sur les valeurs obtenues par spirométrie, un test permettant la mesure des fonctions pulmonaires, dont le volume expiratoire maximal à une seconde (VEMS), la capacité vitale forcée (CVF) et le rapport VEMS/CVF, ainsi que sur d’autres critères comme les symptômes du patient [23]. Cinq stades de sévérité sont actuellement définis par la Global Initiative for Chronic Obstructive Lung Disease (GOLD), soit : à risque (GOLD 0, valeur de spirométrie normale, mais symptômes chroniques), léger (GOLD I), modéré (GOLD II), sévère (GOLD III) [2, 18, 28, 29] et très sévère (GOLD IV) [18, 28, 29].
5
Chez les personnes atteintes, on observe un déclin dans le VEMS [9] par rapport à la valeur prédite qui est d’autant plus marqué lorsque la maladie est sévère. De plus, elles possèdent un rapport VEMS/CVF plus petit que 0,7 confirmant la limitation du flot d’air. L’évaluation de la sévérité de cette limitation permet d’évaluer l’impact de la maladie sur la santé du patient, ses risques d’exacerber, d’être admis à l’hôpital ou de décéder et permet ainsi de guider les choix thérapeutiques [18, 28, 29].
Concernant les traitements actuels, ceux-ci sont de nature anti-inflammatoire. Ils visent principalement à réduire les symptômes [30], ralentir l’évolution de la maladie, prévenir les complications et améliorer la qualité de vie des malades [18, 20]; toutefois, aucun n’est curatif ni ne permet d’arrêter la progression de la MPOC [20]. D’ailleurs, malgré une connaissance grandissante des mécanismes cellulaires et moléculaires se déroulant dans les poumons de fumeurs, l’arrêt tabagique précoce demeure actuellement l’outil de prévention le plus efficace [23, 25], et ce, que ce soit pour pallier aux effets délétères de l’exposition à la FC en général ou pour prévenir le développement d’une maladie en particulier [1]. Cependant, lorsqu’une maladie telle la MPOC est établie, l’arrêt tabagique, en tant que traitement, n’a qu’un effet partiel sur l’inflammation pulmonaire et ne peut arrêter le déclin accéléré des fonctions respiratoires. En effet, à ce stade, la maladie est considérée comme « autonome » et n'a plus besoin de la FC pour progresser [29, 31, 32]. Malgré cela, l’arrêt tabagique demeure essentiel afin de ralentir l’aggravation de l’obstruction bronchique, la dégénérescence pulmonaire et la diminution des fonctions pulmonaires [18, 20, 22]; il s’agit de la stratégie thérapeutique la plus efficace vu l’absence d’autres thérapies ciblant les causes de la maladie [25]. Parmi les autres traitements disponibles, on retrouve les bronchodilatateurs (agonistes β-adrénergiques) qui aident à soulager l’essoufflement ou encore des anti-inflammatoires (corticostéroïdes inhalés ou en comprimé) qui peuvent réduire l’inflammation pulmonaire et limiter la gravité des exacerbations en combinaison avec la prise d’antibiotiques [18, 20, 22, 24]. De plus, il est fortement recommandé à ces personnes de recevoir les vaccins contre la grippe et la pneumonie. La rééducation respiratoire permet quant à elle de renforcer les muscles respiratoires
6
et d’améliorer la qualité de vie des patients grâce à des exercices adaptés [18, 20, 22]. L’oxygénothérapie peut s’avérer nécessaire dans les cas d’hypoxie grave. De plus, des traitements chirurgicaux telle la réduction du volume pulmonaire ou la transplantation sont envisagées dans certains cas particuliers sans toutefois prolonger la vie des patients [20, 22, 24]. Face à cela, à ce jour, aucune médication ne modifie réellement le déclin à long terme des fonctions respiratoires [18].
En ce qui a trait à la pathogenèse de la MPOC, plusieurs hypothèses ont été émises par la communauté scientifique au cours des dernières décennies ; certaines ont été confirmées, mais plusieurs éléments demeurent à être élucidés. Il est connu que le déséquilibre entre les oxydants et antioxydants générés par l’inhalation de la FC est impliqué dans un processus inflammatoire associé au déclin fonctionnel chez les patients MPOC [7, 16, 33]. Le stress oxydatif accru, l’augmentation des dommages et la sénescence cellulaire qui en résulte ainsi que le déséquilibre entre les protéases (élastases, métalloprotéinases (MMPs ; matrix metalloproteinases), etc.) et les antiprotéases sont tous des mécanismes impliqués dans l’inflammation pulmonaire chronique chez ces patients [7, 33].Comme revu plus loin, le tabagisme est également caractérisé par l’induction de différentes cascades de signalisation intracellulaires entrainant l’augmentation d’expression de gènes codant pour une multitude de protéines incluant des cytokines, des chimiokines, des facteurs de croissance et des molécules d’adhésions [16]. Ces dernières entrainent un afflux de cellules dans les poumons (voir Section 1.2.3.2.) qui à leur tour relarguent des cytokines ou autres médiateurs et créent des dommages et du remodelage au tissu pulmonaire (voir Section 1.2.3.4.) [16, 25]. En effet, malgré un recrutement marqué de cellules immunitaires (macrophages et neutrophiles) dans les poumons [16], la capacité de phagocytose de ces cellules est diminuée dû au stress oxydatif induit par la FC [12, 15], ce qui favorise entre autres l’inflammation chronique chez ces patients (voir Section 1.2.3.2.). Toute cette inflammation induite par la FC est considérée comme centrale au développement de la MPOC [16]. D’ailleurs, des preuves récentes dévoilent le rôle probable du système immunitaire adaptatif dans la progression de cette maladie (voir Section 1.2.3.3.) [12].
7
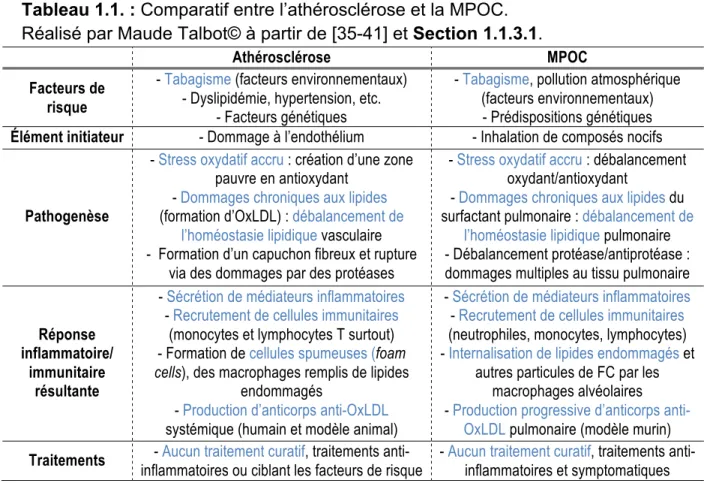
1.1.3.2. Les maladies cardiovasculaires associées : le cas de l’athérosclérose L’athérosclérose, la première cause de mortalité et d’invalidité précoce dans les sociétés développées [34], peut être considérée comme le pendant cardiovasculaire de la MPOC. D’ailleurs, le tabagisme est un des plus importants facteurs de risque modifiables impliqués dans son développement [35]. En effet, l’exposition à la FC entraine une inflammation chronique systémique qui peut expliquer le fait que les fumeurs puissent développer les deux maladies [36]. Cela dit, l’athérosclérose et la MPOC partagent plusieurs similitudes (voir Tableau 1.1).
Tableau 1.1. : Comparatif entre l’athérosclérose et la MPOC. Réalisé par Maude Talbot© à partir de [35-41] et Section 1.1.3.1.
Athérosclérose MPOC
Facteurs de risque
- Tabagisme (facteurs environnementaux) - Dyslipidémie, hypertension, etc.
- Facteurs génétiques
- Tabagisme, pollution atmosphérique (facteurs environnementaux) - Prédispositions génétiques
Élément initiateur - Dommage à l’endothélium - Inhalation de composés nocifs
Pathogenèse
- Stress oxydatif accru : création d’une zone pauvre en antioxydant
- Dommages chroniques aux lipides
(formation d’OxLDL) : débalancement de l’homéostasie lipidique vasculaire - Formation d’un capuchon fibreux et rupture
via des dommages par des protéases
- Stress oxydatif accru : débalancement oxydant/antioxydant
- Dommages chroniques aux lipides du surfactant pulmonaire : débalancement de
l’homéostasie lipidique pulmonaire - Débalancement protéase/antiprotéase : dommages multiples au tissu pulmonaire
Réponse inflammatoire/
immunitaire résultante
- Sécrétion de médiateurs inflammatoires
- Recrutement de cellules immunitaires
(monocytes et lymphocytes T surtout) - Formation de cellules spumeuses (foam cells), des macrophages remplis de lipides
endommagés
- Production d’anticorps anti-OxLDL
systémique(humain et modèle animal)
- Sécrétion de médiateurs inflammatoires
- Recrutement de cellules immunitaires
(neutrophiles, monocytes, lymphocytes) - Internalisation de lipides endommagés et
autres particules de FC par les macrophages alvéolaires - Production progressive d’anticorps
anti-OxLDL pulmonaire (modèle murin)
Traitements - Aucun traitement curatif, traitements
anti-inflammatoires ou ciblant les facteurs de risque
- Aucun traitement curatif, traitements anti-inflammatoires et symptomatiques Concernant la pathogenèse,l’athérosclérose est une maladie inflammatoire chronique, caractérisée par la formation de plaques dans la paroi des artères. L’hypercholestérolémie, un excès de cholestérol sérique, est un des facteurs de risque pouvant engendrer un site propice à l’initiation d’une lésion athéromateuse en endommageant l’endothélium vasculaire [34]. Ce cholestérol, insoluble, est transporté aux tissus et au foie par les LDLs [34, 42], un des 5 types de lipoprotéines
8
possédant un cœur hydrophobe contenant des triglycérides, des acides gras et des esters de cholestérol et une surface hydrophile composée de cholestérol, de phospholipides (PLs) et de protéines telles les apolipoprotéines (Apo) jouant un rôle crucial dans la liaison aux récepteurs et l’export lipidique [34, 36]. En excès, les LDLs s’accumulent dans l’intima des artères, où elles subissent des modifications oxydatives et induisent une inflammation locale et la libération de médiateurs chimiques (molécules d’adhésion, ROS, etc.). D’ailleurs, les OxLDLs résultants jouent un rôle crucial dans le développement de l’athérosclérose en favorisant le recrutement local de leucocytes tels des monocytes qui deviendront des macrophages pouvant phagocyter l’excès de cholestérol estérifié. Cela entraine la formation de cellules spumeuses, soit des macrophages chargés en lipides, tentant de restaurer l’homéostasie lipidique, caractéristiques de cette pathologie [34, 38, 43, 44]. Les épitopes spécifiques d'oxydation (OSEs ; oxydation-specific epitopes) nouvellement présents à la surface des OxLDLs facilitent leur capture par les macrophages médiée par des récepteurs éboueurs tels que MSR-1 (Macrophage Scavenger Receptor-1) et CD36 [38]. Éventuellement, ces OSEs sont reconnus par des cellules de l’immunité et induisent la production d’anticorps anti-OxLDL ayant une spécificité entre autres pour les PLs oxydés (OxPLs) de cette macromolécule [41]. En effet, de tels anticorps sont autant présents chez les humains que chez les animaux souffrant d’athérosclérose, et ce, en plus grand nombre qu’en temps normal [45, 46]. De plus, la présence soutenue de cellules inflammatoires active un processus de réparation impliquant la division et la migration de cellules musculaires lisses, ce qui forme un bouchon fibreux sur la région riche en lipides [34, 44, 47]. Dans certains cas, des macrophages activés par des lymphocytes T sécrèteront différents médiateurs, incluant des MMPs dégradant le collagène matriciel de la plaque [34], ce qui entrainera sa rupture et la formation d’un thrombus entrainant de graves complications cardiovasculaires [34, 36, 44].
Pour ce qui est des outils thérapeutiques, les principaux disponibles consistent en des changements dans les habitudes de vie [36], la prise de statines, d’antiplaquettaires ou d’antihypertenseurs, tous ayant pour but de réduire un facteur
9
de risque tel une dyslipidémie ou une hypertension connue [43, 46]. Par conséquent, il est difficile d’atteindre une réduction du risque relatif de plus de 40% avec les stratégies thérapeutiques actuelles et cela fait en sorte que près du deux tiers des complications cardiovasculaires ne sont pas prévenues. Le besoin de développer de nouvelles thérapies est donc pressant puisqu’actuellement aucune ne cible le processus pathologique même qui se déroule dans la paroi des artères [46].
Face à cela, plusieurs chercheurs se sont penchés dernièrement sur la mise au point de différentes stratégies d’immunisation pour l’athérosclérose, dont des immunisations ou l’induction d’une tolérance contre différents autoantigènes générés lors de cette maladie (protéines de choc thermique, Apo modifiée suite à l’oxydation, OxLDL). D’intérêt, l’immunisation à l’aide de lipides modifiés combinés à un adjuvant, dans le but d’augmenter les niveaux d’anticorps spécifiques contre ces lipides, a été testée [46-49]. En effet, des preuves croissantes démontrent que les niveaux sériques d’immunoglobuline (Ig)M ayant pour spécificité différents OSEs sur les OxLDLs sont inversement corrélés au risque de souffrir d’athérosclérose [50]. De ce fait, les souris ayant des niveaux moindres d’IgM soluble sont plus susceptibles à l’athérosclérose. Similairement, chez l’humain, ceux possédant des hauts niveaux d’IgM circulants anti-OxLDL présentent une maladie de plus faible sévérité que les autres avec des niveaux plus bas[51]. D’ailleurs, plusieurs équipes de recherche ont démontré un impact bénéfique de ce type d’approche pour limiter les lésions athérosclérotiques chez l’animal [52-54]. Par exemple, une immunisation avec un extrait de pneumocoque (Streptococcus pneumoniae), une bactérie dont l’un des lipides de la parois cellulaire s’apparente à la phosphatidylcholine (PC), a entrainé une production robuste d’anticorps naturels anti-OxLDL IgM, majoritairement de type E06/T15 [54] ayant une spécificité contre la PC oxydée (anti-OxPC) [55]. Les souris souffrant d’athérosclérose (modèle LDLR–/– nourri avec du cholestérol) immunisées avec ce protocole jouissaient d’une réduction significative de la formation des plaques d’athérome [54]. De plus, le transfert de cellules B-1 sécrétant des anticorps naturels d’isotype IgM chez un autre modèle murin de souris développant l’athérosclérose (ApoE–/– sans rate) conférait aussi une
10
athéroprotection [51]. L’hypothèse est que ces anticorps, ayant une haute spécificité pour les OSEs, médient une protection en partie en promouvant la clairance de cellules apoptotiques et des autoantigènes (OxLDL) par des mécanismes impliquant le complément. De plus, ces anticorps pourraient neutraliser l’action inflammatoire de OSEs en inhibant entre autres la capture lipidique médiée par les récepteurs éboueurs [38],des fonctions déjà décrites pour les anticorps naturels présents dans la circulation même en condition normale [55]. D’ailleurs, le rôle protecteur des anticorps naturels pour la santé et leur effet thérapeutique a été démontré dans plusieurs pathologies(voir Section 1.2.2.1.) [51].
Bien que différentes stratégies d’immunisation contre des espèces lipidiques oxydées ont démontré du succès, les lymphocytes B et les anticorps anti-OxLDL semblent avoir des effets pro- ou anti-athérosclérotiques selon l’approche ou le sous-groupe de lymphocytes B investigué [39, 41, 51, 56]. Beaucoup de résultats opposés ont effectivement été obtenus selon qu’une réponse pro-inflammatoire ou régulatrice ait été induite par la procédure vaccinale. Ces divergences pourraient provenir des différents adjuvants, routes et fréquences d’administration utilisés selon les études (voir Section 1.2.2.1.) [48, 49] Malgré ces résultats contradictoires, une telle immunisation contre des lipides oxydés représente une option thérapeutique à investiguer pour la MPOC, vu les multiples points communs qui existent entre ces deux maladies dont l’induction progressive d’anticorps anti-OxLDL mise en évidence chez un modèle murin d’exposition à la FC (voir Section 1.2.3.3.) [37].
1.2. Les systèmes pulmonaire et immunitaire et leur
implication en contexte tabagique
1.2.1. Le système pulmonaire
Le système pulmonaire correspond à l’ensemble des voies de conduction et respiratoires qui s’étendent de la cavité nasale jusqu’aux alvéoles [2, 21, 24, 57, 58]. Il s’agit d’un organe vital ; son rôle étant de fournir l’oxygène (O2) à l’organisme via le système sanguin et de le débarrasser du dioxyde de carbone (CO2) [24, 57, 59].
11
Concernant la structure macroscopique de l'arbre pulmonaire, celui-ci débute par la trachée qui relie les voies aériennes supérieures aux deux bronches souches du poumon, le gauche et le droit composés de deux et trois lobes respectivement. Chacune des bronches souches se ramifie en bronches lobaires puis segmentaires qui donnent naissance à des ramifications de plus en plus petites menant aux bronchioles puis aux bronchioles terminales [2, 21, 24, 57, 58, 60]. La zone respiratoire comprend quant à elle les bronchioles respiratoires, les conduits alvéolaires et les sacs alvéolaires, contenant l’unité fonctionnelle du poumon, les alvéoles, séparées par des septums [2, 21, 24, 57]. Ce sont ces dernières, au nombre de plusieurs millions, qui permettent les échanges gazeux [24, 57, 59].
Pour ce qui est de sa structure microscopique, toutes les voies de conduction, à quelques exceptions près, sont revêtues d’un épithélium de type cylindrique ou cubique cilié́, pseudostratifié soutenu par du tissu conjonctif, le chorion. Ensemble, ils forment la muqueuse respiratoire. Le chorion, contenant différentes glandes à mucus ainsi que des vaisseaux sanguins, est composé de différent type de collagène, de fibres élastiques et de muscle lisse [61]. La présence et la localisation de ce muscle lisse et du cartilage de soutien diffèrent selon les régions [2, 21, 24, 57, 58, 60]. On retrouve également plusieurs autres protéines et molécules diverses au niveau de la matrice extracellulaire de ce tissu conjonctif [61].
D’un point de vue cellulaire, plus de 40 phénotypes différents ont été décrits dans les tissus qui tapissent l'arbre bronchique et l’épithélium respiratoire chez les mammifères adultes [60, 62]. Entre autres, deux types de pneumocytes se trouvent au niveau de l'épithélium alvéolaire [21, 60]. Les pneumocytes de type I, la fraction majeure parmi les cellules épithéliales alvéolaires, sont impliqués dans la diffusion gazeuse avec les cellules endothéliales des capillaires sanguins tandis que ceux de type II sont responsables de la production de surfactant [21, 24, 57, 59].
Avant de discuter de l'interaction de la FC avec le surfactant, il est important d'avoir une connaissance conceptuelle de ce qui le compose et de ses fonctions.
12 1.2.1.1. Le surfactant pulmonaire
Le surfactant pulmonaire est une structure essentielle à la survie qui tapisse les alvéoles des poumons. Grâce à l’association de ses différentes composantes en une fine couche, celui-ci permet de diminuer la tension de surface, de maintenir l’intégrité structurale, de conserver l’élasticité du tissu pulmonaire et d’assurer la défense de l’hôte (immunité innée) en plus de réguler l’inflammation. Il s’agit effectivement de la première structure pulmonaire en contact avec l’air [62, 63].
Cette mince couche est composée à 90% de lipides, le 10 % restant étant constitué majoritairement de protéines, les surfactant proteins (SP)-A à -D. Parmi ces lipides, la majorité correspond à des PLs (80-85%) [62-65], une classe de lipides amphiphiles qui contiennent un groupement phosphate [42]. De ce 85%, un 70 à 80% est comblé par de la phosphatidylcholine (PC), dont une grosse proportion (environ 60%) est de type disaturated, sous forme de dipalmitoylphosphatidylcholine (DPPC ; 16:0/16:0-PC), qui représente la composante tensioactive majeure [62-65]. Outre ces espèces saturées, 30% des PLs du surfactant contiennent des chaines d’acide gras insaturées, souvent positionnées en sn-2 [64]. Pour sa part, le phosphatidylglycérol (PG) représente 7 à 15% du nombre total de PLs [62-64]. Les autres PLs [phosphatidyléthanolamine (PE), sphingomyéline (SM), phosphatidylinositol (PI) et phosphatidylsérine (PS)] comptent pour généralement moins que 5 % du total [63, 65]. Il est à noter que chaque PL, peu importe la nature de son groupement hydrophile (choline, sérine, etc.), possède des chaines d’acide gras de longueur et de saturation variables [42]. En plus de ces PLs, on retrouve 5% de cholestérol et minoritairement des mono- di- et triglycérides ainsi que des acides gras [62, 63, 65]. Ces lipides neutres, ainsi que la PG et la PI jouent un rôle dans l'adsorption, la diffusion et la fluidité de la fine couche de surfactant. Cela dit, le surfactant pulmonaire est un réservoir de lipides extracellulaires différent des autres fluides corporels [64], dont la composition unique en PL est hautement conservée chez les mammifères [63, 64].
13
Pour leur part, les protéines du surfactant interagissent avec les lipides de ce dernier afin de réguler sa structure et ses propriétés. SP-B et SP-C, deux protéines hydrophobes, jouent un rôle dans la régulation de sa formation et sa stabilité. SP-A et SP-D, plutôt hydrophiles, sont impliquées davantage au niveau de la réponse inflammatoire et de l’immunité innée [62-64], bien qu’elles soient aussi responsables de restaurer les propriétés du surfactant oxydé [62]. De plus, SP-D est impliquée dans le maintien du métabolisme du surfactant et l’homéostasie pulmonaire [63].
Concernant le métabolisme du surfactant pulmonaire, il s’agit d’un cycle incluant la biosynthèse ou le remodelage des PLs, leur trafic intracellulaire (enrichissement et emballage), suivi par leur sécrétion puis leur dégradation ou recyclage [63, 66]. Brièvement, les différentes espèces lipidiques qui le composent sont générées, soit de novo ou par remodelage via différentes voies métaboliques [63, 65]. Concernant la synthèse de novo, celle-ci a lieu dans le réticulum endoplasmique des pneumocytes de types II à partir de substrats cellulaires ou de la circulation [63, 66]. En effet, il est intéressant de noter que la composition du surfactant est sensible aux lipoprotéines circulantes [64]. Ces PL nouvellement synthétisés sont emballés dans des corps lamellaires [63, 66] suite à un enrichissement en espèces lipidiques saturées qui se produit durant le processus de synthèse et de transport jusqu’à ces structures d’entreposage intracellulaire [66]. Ils sont par la suite sécrétés par exocytose dans l’espace alvéolaire sous forme de gros agrégats actifs qui s’adsorbent rapidement à l’interface air-liquide des alvéoles pour former un film tensioactif. Durant la respiration, dû à la forte pression, des petits agrégats inactifs sont formés et retirés de l’espace alvéolaire par différents mécanismes. Une importante proportion des lipides qui s’y trouve (25 à 95%) est internalisée et recyclée par les pneumocytes de type II [63, 66]. De manière alternative, le surfactant est catabolisé [63] par l’action combinée de phospholipases et des macrophages responsables du transport lipidique (voir Section 1.2.3.1.1.). Une certaine proportion est aussi perdue dans l’arbre bronchique [63, 66].
14
1.2.2. Le système immunitaire
Le système immunitaire se divise en deux grands types : inné et adaptatif. Le premier mécanisme, non spécifique, se déploie rapidement alors que le deuxième, basé sur la reconnaissance d’un agent en particulier, met un certain temps à se développer. Le système immunitaire adaptatif se subdivise en une immunité humorale (extracellulaire) médiée par les lymphocytes B(-2) et leurs anticorps ainsi qu’en une immunité cellulaire médiée par les lymphocytes T [24, 34, 59, 67].
1.2.2.1. Les réponses immunitaires innées et adaptatives pulmonaires
Concernant la réponse immunitaire innée, son rôle est la reconnaissance et l’élimination de tout matériel étranger, et ce, sans égard à sa nature [24, 59, 67]. Au niveau pulmonaire, une fois les barrières physiques superficielles de l’épithélium respiratoire ayant été franchies (mucus, cellules ciliées, etc.), différentes cellules sont en charge de réagir rapidement contre tous agents biologiques ou chimiques s'étant frayés un chemin jusqu’à elles [59]. À cet effet, cette première ligne de défense dispose de phagocytes tels le macrophage et le neutrophile [24, 59, 67].
Le macrophage est une cellule immunitaire au cœur de plusieurs réponses inflammatoires, dont la défense de l’hôte contre les pathogènes extracellulaires et la réparation tissulaire suite à un dommage [26]. Dans le poumon, il tapisse en tout temps l’épithélium interne des voies respiratoires et des alvéoles. D’ailleurs, à l'état physiologique, il s’agit de la cellule retrouvée en plus grand nombre dans les alvéoles (90-95% des cellules) et donc dans le lavage broncho-alvéolaire (LBA).En tant que cellule résidente, sa fonction première est de veiller à l’innocuité des voies respiratoires en phagocytant toute particule extérieure se déposant dans le tractus respiratoire, en plus de détecter la présence d'agents microbiens [59, 68]. Avec les cellules dendritiques (DCs), une autre cellule présentatrice d’antigène (CPAs), les macrophages sont effectivement les premières cellules immunitaires entrant en contact avec les pathogènes [69]. Ceux-ci détectent aussi la présence de lipides
15
endommagés ou s’accumulant dans les tissus, ce qui les relient au métabolisme lipidique et à certaines pathologies (voir Sections 1.1.3.2. et 1.2.3.1.1.) [70].
Le neutrophile est, quant à lui, la première cellule recrutée au site d’infection ou d’inflammation (voir Section 1.2.3.2.). En effet, bien qu’en temps normal les voies respiratoires et les alvéoles en renferment très peu, étant donné que les neutrophiles sont présents en grande quantité dans la circulation sanguine (majorité des leucocytes), ils demeurent séquestrés temporairement dans les petits capillaires pulmonaires. En réponse à un gradient chimiotactique, ils s’extravasent rapidement dans le tissu pulmonaire afin de venir en aide aux macrophages résidents grâce à leur capacité de phagocytose. Tous deux ont recours à divers mécanismes, dontle relargage de ROS, de protéases et de peptides antimicrobiens, afin de tuer les microorganismes extracellulaires [59, 71, 72].
Pour sa part, la DC est responsable de faire le pont entre l'immunité innée et adaptative [59, 70]. En effet, malgré sa rapidité d'action, vu sa non-spécificité, l’immunité innée n’est souvent pas en mesure d'éradiquer à elle seule l'agent infectieux. Elle s’occupe donc de limiter sa prolifération, le temps que l’immunité adaptative se déploie [24, 59]. Au niveau de la muqueuse pulmonaire, les DCs sont nombreuses et agissent comme sentinelles afin de détecter la présence de motifs moléculaires associés aux dommages cellulaires ou aux pathogènes (DAMPs ; damage-associated molecular patterns ou PAMPs ; pathogen-associated molecular patterns) via leurs récepteurs de reconnaissance de motifs moléculaires (PRRs ; pattern recognition receptors) [59, 69, 71]. Une fois matures, avec un antigène apprêté prêt à être présenté à leur surface, elles migrent dans les organes lymphoïdes secondaires ou tertiaires, dont les tissus lymphoïdes associés aux bronches (BALT ; Bronchus-Associated Lymphoid Tissue), où elles activent des lymphocytes T naïfs [59, 69, 73]. À cet endroit, les DCs peuvent aussi activer directement les lymphocytes B en leur présentant l’antigène ce qui induit la production d’anticorps de façon T-indépendante, soit sans costimulation de la part d’un lymphocyte T auxiliaire (TH ; T helper ou CD4+). Les anticorps ainsi générés
16
demeurent toutefois de l’isotype IgM puisqu’il n’y a pas de maturation d’affinité ni de commutation isotypique (voir plus bas). Ce phénomène se produit généralement lors de la présentation d’un antigène polysaccharidique ou lipidique, les antigènes protéiques induisant plutôt la production d’anticorps de façon T-dépendante [34].
Afin d’activer les lymphocytes naïfs, différents signaux sont nécessaires. Tout d’abord, une interaction est requise entre le récepteur du lymphocyte T (TCR ; T cell receptor) et l’antigène présenté par la DC mature. Cette présentation se fait via le complexe majeur d’histocompatibilité (CMH) I pour les lymphocytes T cytotoxiques (CTLs ; Cytotoxic T lymphocyte ou CD8+) ou via le CMH II pour les lymphocytes TH. Ensuite, la DC doit fournir des signaux de costimulation dont l'expression a été stimulée par les DAMPs/PAMPs. Finalement, en réponse à cette dernière interaction, ainsi que selon l’antigène, sa dose et les autres signaux de l’environnement en présence, la DC relâchera différentes cytokines servant à polariser la réponse du lymphocyte TH vers le type 1 ou 2 [59, 74, 75].
Les lymphocytes TH1 font partie de l’immunité cellulaire adaptative puisqu’ils interagissent avec 1) les précurseurs des CTLs afin de favoriser leur développement en cellules effectrices CD8+ tuant les cellules infectées par des virus et 2) les macrophages infectés par des pathogènes intracellulaires pour les activer. Les lymphocytes TH2 interviennent plutôt dans l’immunité humorale adaptative en stimulant les lymphocytes B à proliférer, à se différencier et à produire des anticorps [59, 74, 75] de façon T-dépendante [67]. Il est à noter que la DC peut également induire un phénotype régulateur/suppresseur chez un lymphocyte ayant reconnu un antigène qu’elle présentait, et ce, en relâchant de façon concomitante certaines cytokines particulières. Ces lymphocytes T régulateurs (Tregs) aident à contrôler le développement de la réponse immunitaire en participant au maintien de la tolérance immunologique et au retour à l’homéostasie [59, 74, 75]. Les lymphocytes TH17, apparentés aux Tregs, sont quant à eux importants dans le maintien de l’intégrité des muqueuses en recrutant entre autres des neutrophiles au site d’inflammation. Grâce aux cytokines différentielles qu’ils produisent, ces différents sous-groupes ont
17
donc chacun un rôle particulier à jouer. De plus, selon leur importance relative lors d’une infection ou d’une pathologie, on parle d’une réponse de type 1, 2 ou 17 [75].
Concernant la tolérance immunologique, il s’agit d’une propriété essentielle du système immunitaire qui limite les réactions immunitaires face à un antigène dans certains contextes. En effet, celle dite centrale, soit la sélection thymique, permet l’élimination par apoptose des lymphocytes immatures n’ayant pas la capacité de reconnaître le soi du non-soi. La tolérance périphérique, relative aux lymphocytes matures présents dans les organes lymphoïdes, est responsable de l’absence d’activation (anergie) des lymphocytes en l'absence de tous les signaux nécessaires ou en présence de facteurs suppresseurs d’inflammation. Par exemple, les antigènes du soi sont habituellement apprêtés par les CPAs sans activation concomitante de leurs PRRs par un PAMP/DAMP. L’absence d’expression par la DC de signaux de costimulation entraine une réponse non inflammatoire, tolérogénique de la part du lymphocyte. Ce dernier est alors éliminé, inactivé ou inhibé par un Treg puisqu’il est autoréactif, ce qui peut être dangereux. Par exemple, au niveau pulmonaire, les réponses immunitaires sont souvent de type tolérogénique [59, 67, 75], vu que les DCs pulmonaires se doivent de maintenir l’équilibre précaire qui existe du point de vue immunitaire, et ce, en évitant de réagir face à chaque agression banale provenant de l’extérieur [74].
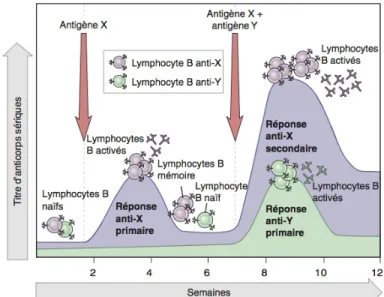
En ce qui a trait à la réponse immunitaire adaptative, en plus des généralités déjà mentionnées à son sujet, ce type d’immunité est à l’origine de la mémoire immunologique, une propriété du système immunitaire qui sous-tend le principe de vaccination (voir Section 1.2.2.2.). En effet, au cours d’une réponse immunitaire, l’antigène induit une expansion clonale des lymphocytes T et/ou B possédant un TCR ou un BCR (B cell receptor) reconnaissant spécifiquement l’antigène. De ces cellules effectrices résultent l’apparition d’une population de cellules mémoires propre à cet antigène, et ce, dans un délai de quelques semaines. Cela fait en sorte que lors d’une seconde rencontre avec le même antigène, ce dernier induira une réponse adaptative plus rapide et plus efficace que la première vu la persistance de
18
cellules mémoires dans les organes lymphoïdes et la moelle (voir Figure 1.2.) [59, 67, 75].
Tirée de [67].
Au niveau des organes lymphoïdes du tissu pulmonaire, l’interaction d’un lymphocyte B avec un antigène présenté par une DC et son activation par un lymphocyte TH entraine la formation de centres germinatifs [73]. À l’intérieur, des lymphocytes B activés prolifèrent en cellules effectrices, mémoires et plasmocytes dont le rôle principal est de produire des anticorps d’une grande spécificité. Ces anticorps, qui peuvent se disséminer via la circulation où ils sont la composante protéique la plus abondante, possèdent différents rôles. Ils peuvent entrainer l'opsonisation des pathogènes et la neutralisation des toxines et des virus via leur liaison, les empêchant ainsi de se lier eux-mêmes à leur récepteur sur les cellules cibles. L’opsonisation correspond au mécanisme par lequel une bactérie/cellule recouverte d’anticorps est reconnue puis phagocytée par les macrophages et neutrophiles. Ce processus est possible puisque les phagocytes expriment à leur surface des récepteurs Fc capables de lier la région Fc constante des anticorps. De plus, la formation de complexes anticorps: antigène à la surface de ces cellules initie l'activation classique du complément entrainant entre autres la formation de pores dans les membranes, la mort cellulaire et de l’inflammation [59, 67, 75].
19
La spécificité de l’immunité adaptative provient du fait que chaque BCR est composé de deux régions variables (sites de liaison à l’antigène) correspondant chacune au même motif moléculaire obtenu suite au réarrangement de séquences géniques des chaines lourdes et légères. Ces régions se lient spécifiquement à des épitopes, soit des séquences particulières présentes dans la structure des molécules agissant comme antigène [59]. Au cours de l’étape de prolifération dans les centres germinatifs, les gènes de ces chaines composant les BCRs des lymphocytes B activés subissent une maturation de l'affinité (hypermutation somatique) et seuls les BCRs les plus spécifiques sont sélectionnés. Lors d’une réponse monoclonale, un seul clone de lymphocyte B est activé, comparativement à une réponse polyclonale, plus fréquente en nature, où plusieurs clones sont activés suite à la reconnaissance de différents épitopes. Il en résulte la production d'une grande quantité de lymphocytes B matures sécrétant principalement des IgM (réponse primaire) puis, dans un deuxième temps (réponse secondaire), suite à la commutation des classes, des IgG ou autres, davantage spécifiques. Ces anticorps sont l’équivalent soluble des BCRs, qui sont initialement de type IgM et IgD, et leur temps de génération est d’environ 5-10 jours lors de la réponse primaire [59, 67, 75].
Cela dit, il existe des milliards d’anticorps différents séparés en cinq classes, soit IgA, IgD, IgE, IgG et IgM, nommées ainsi selon leurs chaines lourdes. Chacune de ces classes médie une réponse particulière suite à sa liaison avec un antigène. Par exemple, les IgAs sont les principaux anticorps retrouvés dans les sécrétions, dont celles respiratoires, alors que les IgGs activent le complément et facilitent la phagocytose [34, 59, 67, 75]. Ce sont les deux Igs retrouvées majoritairement dans le LBA [73]. Il existe aussi des anticorps naturels, provenant d'un sous-type de lymphocyte B appelé B-1, une lignée germinale innée [45, 75]. Cette classe d’anticorps habituellement d’isotype IgM [51, 75] représente donc la majorité des anticorps à la naissance. En effet, ces anticorps, retrouvés chez les humains et les souris, sont produits en absence de néoantigène très tôt après la naissance par la rate et leur relargage ne dépend pas de l’activation classique d’un lymphocyte B [45, 55, 75]. Par contre, les clones de lymphocyte B-1 sélectionnés initialement peuvent
20
proliférer suite à une exposition à un antigène plus tard au courant de la vie [76]. D’ailleurs, ils possèdent une haute spécificité pour les épitopes oxydés, lipidiques ou protéiques [45, 51, 75]. Par conséquent, ils sont en charge de fonctions housekeeping importantes dans l’homéostasie contre les autoantigènes [76].
1.2.2.2. Les thérapies immunitaires et leur composition
Comme déjà mentionné, le principe derrière la vaccination repose sur une propriété de l’immunité adaptative, soit l’habileté des lymphocytes à développer une mémoire immunologique face à un antigène, pour procurer une protection de longue durée contre une maladie infectieuse. Toutefois, de plus en plus d’immunothérapies contre des conditions non infectieuses sont sous investigation. Contrairement à la vaccination préventive, celle thérapeutique (deux types d’immunisation active), consiste à stimuler le système immunitaire pour favoriser la production d'anticorps contre un antigène en présence. Il ne s'agit donc plus de prévenir l'apparition d'une infection ou d’une maladie, mais d'aider l'organisme déjà atteint à lutter en stimulant ses défenses immunes. L’immunisation passive consiste quant à elle en l’injection directe d’anticorps [59, 67, 75, 77]. Une immunisation, aussi nommée sensibilisation, qu’elle soit passive ou active, est donc un procédé ou une circonstance déclenchant, chez un individu, une réaction immune défensive contre un élément étranger, désigné antigène. Ce genre de procédure nécessite bien souvent des doses de rappel (recall injections) destinées à renforcer l’immunité spécifique acquise lors de la première dose (voir Figure 1.2.) [77].
Concernant la composition d’un vaccin, les constituants classiques sont l’antigène, qui peut être entier, fragmenté ou encore dénaturé ainsi qu’un adjuvant et/ou un véhicule [34, 67, 75]. Un adjuvant est une substance qui, lorsque combinée avec un antigène, améliore la réponse immunitaire globale induite par celui-ci en accélérant, prolongeant ou augmentant cette dernière [78]. Les adjuvants sont utilisés puisque, bien souvent, les antigènes ne sont pas suffisamment immunogènes, c’est-à-dire aptes à provoquer une réponse immunitaire à eux seuls [75, 78]. En effet, les nouveaux antigènes biosynthétiques ou ceux non protéiques
21
ont besoin d'être couplés à un tel composé immunogène [78]. Les adjuvants peuvent être une multitude de molécules (protéines de choc thermique, cytokines, etc.) et sont conventionnellement classifiés en composés minéraux, produits bactériens, émulsions, complexes immunostimulatoires et liposomes [78]. Beaucoup sont au stade expérimental ou trop toxique pour être utilisés [75, 78]. Les adjuvants provoquent leurs effets (ex. : augmenter la production d’anticorps) en stimulant une réponse inflammatoire. D’ailleurs, cette dernière est souvent responsable des effets secondaires (douleur, enflure, fièvre) ressentis suite à une immunisation. L’effet des adjuvants est majoritairement attribuable à deux modes d’action, soit la concentration de l’antigène au site des lymphocytes ou l’induction de la production de cytokines régulant la fonction des lymphocytes [75]. Certains adjuvants permettent la formation d’un dépôt d’antigène au site d’injection et un relargage sur une longue période de temps pouvant être prolongée grâce à des doses de rappel. De ce fait, l’adjuvant permet de réduire le nombre d'immunisations nécessaires. D’autres adjuvants servent de véhicule ou activent les cellules immunitaires. Il est à noter qu’il existe des différences dans l’efficacité des adjuvants selon la route d’administration [78]. De plus, les vaccins induisent des types de réponses immunitaires différentes selon leur composition [75]; les adjuvants pouvant faire basculer le type de réponse de TH1 à TH2 ou l’inverse par exemple [78].
1.2.3. Réponse pulmonaire à la fumée de cigarette de tabac
La FC est connue pour induire une réponse pulmonaire rapide, attribuable à un stress oxydatif accru [14, 15] entrainant un débalancement de l’homéostasie lipidique [40] et de l’inflammation [16] observable par une sécrétion de médiateurs [12, 79] un recrutement cellulaire [16, 80], la production d’anticorps [37] ainsi que par des changements tissulaires [15] et dans les fonctions pulmonaires [81, 82].
1.2.3.1. Stress oxydatif
Il a été démontré dans la plupart des études effectuées chez l’humain et l’animal qu’une exposition aiguë à la FC entraine une augmentation du stress