UFR des sciences fondamentales et appliquées
Institut de chimie des milieux et matériaux de Poitiers - IC2MP (Diplôme National - Arrêté du 25 mai 2016)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Chimie organique, minérale, industrielle
Présentée par : Khaled Younes
Application et développement de techniques d'analyse de biogéomarqueurs moléculaires : mesure de l impact
d'une perturbation argileuse sur le développement d'une tourbière du Limousin
Directeur(s) de Thèse : Laurent Grasset, Joëlle Laduranty Soutenue le 20 octobre 2016 devant le jury
Jury :
Président Daniel Beaufort Professeur des Universités, Université de Poitiers Rapporteur Armelle Riboulleau Maître de conférences, Université de Lille 1
Rapporteur Arnaud Huguet Chargé de recherche CNRS, Université Pierre et Marie Curie Membre Laurent Grasset Maître de conférences, Université de Poitiers
Membre Hervé Gallard Professeur des Universités, Université de Poitiers Membre Claude Le Milbeau Ingénieur de recherche, Université d'Orléans Membre Philippe Martinez Professeur des Universités, Université de Bordeaux Membre Gérard Gruau Directeur de recherche CNRS, Université de Rennes
Pour citer cette thèse :
Khaled Younes. Application et développement de techniques d'analyse de biogéomarqueurs moléculaires : mesure
de l impact d'une perturbation argileuse sur le développement d'une tourbière du Limousin [En ligne]. Thèse
Chimie organique, minérale, industrielle. Poitiers : Université de Poitiers, 2016. Disponible sur Internet <http://theses.univ-poitiers.fr>
1
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS (Faculté des Sciences Fondamentales et Appliquées)
(Diplôme National – Arrêté du 7 août 2006)
Ecole Doctorale : Sciences pour l’Environnement Gay Lussac No523
Secteur de Recherche : Chimie Organique, minérale, industrielle Présentée par :
Khaled YOUNES
*************************Application et développement de
techniques d’analyse de
biogéomarqueurs moléculaires :
mesure de l’impact d’une perturbation argileuse sur le développement d’une tourbière du Limousin
*************************
Directeurs de Thèse : Laurent GRASSET, Maître de Conférences (HDR), Université de Poitiers
Et
Joëlle LADURANTY, Ingénieur Recherche et Formation - Docteur d'Etat, Université de Poitiers
*************************
Soutenue le 20 octobre 2016 devant la Commission d’Examen *************************
JURY
Daniel BEAUFORT, Professeur, Université de Poitiers Président
Armelle RIBOULLEAU, Maître de Conférences (HDR), Université de Lille Rapporteur
Arnaud HUGUET, Chargé de Recherche CNRS (HDR), Université de Pierre et
Marie Curie, Paris Rapporteur Gérard GRUAU, Directeur de Recherche CNRS, Université de Rennes Examinateur
Hervé GALLARD, Professeur, Université de Poitiers Examinateur
Philippe MARTINEZ, Professeur, Université de Bordeaux Examinateur
Claude LE MILBEAU, Ingénieur de Recherche, Université d’Orléans Examinateur
3
Ce travail de thèse a été réalisé au sein de l’équipe Eau, Géochimie et Santé (EGS) à l’Institut de Chimie des Milieux et des Matériaux de Poitiers (IC2MP) de l’Université de Poitiers. Cette thèse, dirigée par le Docteur Laurent Grasset et le Docteur Joëlle Laduranty, a bénéficié du soutien financier du Ministère francais de l’Education Nationale, de l’Enseignement Supérieure et de la Recherche.
En préambule de ce mémoire de thèse, je tiens à remercier tous ceux qui ont participé, de près ou de loin, à ce travail.
Monsieur Laurent Lemee, Ingénieur de Recherche (HDR) à l’Université de Poitiers, pour son acceuil dans son laboratoire et pour les conseils techniques.
Monsieur Daniel Beaufort, Professeur à l’Université de Poitiers, pour avoir accepté de présider le jury de cette thèse.
Madame Armelle Riboulleau, Maître de Conférences (HDR) à l’Université
de Lille et Monsieur Arnaud Huguet, Chargé de Recherche CNRS (HDR) à l’Université Pierre et Marie Curie de Paris, pour avoir accepté de juger ce travail. Madame, Monsieur, vos commentaires ont sûrement aidé à affiner le travail et la qualité du manuscrit.
Monsieur Gérard Gruau, Directeur de Recherche CNRS à l’Université de Rennes, Monsieur Hervé Gallard, Professeur à l’Univeristé de Poitiers, Monsieur Philippe Martinez, Professeur à l’Université de Bordeaux et Monsieur Claude Le Milbeau, Ingénieur de Recherche à l’Université d’Orléans, pour avoir accepté de participer à ce jury de thèse.
Monsieur Michael Descostes, Ingénieur de Recherche à la société AREVA, pour avoir assuré avec sécurité les prélèvements sur site et avoir suivi l’avancement des travaux. Monsieur Michel Chauveau et Monsieur Bertrand Leroux pour avoir aidé dans les prélèvements des échantillons. Monsieur Claude Fontaine pour les analyses par perte au feu.
4
Madame Joëlle Laduranty, Ingénieur Recherche et Formation - Docteur d'Etat à l’Université de Poitiers, pour ses aides à la fois techniques et administratives.
Monsieur Laurent Grasset, Maître de Conférences (HDR) à l’Université de Poitiers, pour son aide, sa disponibilité et ses conseils avisés. J’ai ainsi pu mener ce travail dans le meilleur environnement possible.
Il m’est impossible d’oublier Madame Claude Geffroy et Madame Pauline Poinot, Maîtres de Conférences à l’Université de Poitiers, pour leurs aides surtout dans les dernières semaines, avant la soutenance. Claude, Pauline, si les mots sont capables de vous exprimer ma reconnaissance, une dizaine de page ça ne suffirait pas !!!
Je tiens également à remercier chaleureusement l’ensemble des permanents et non-permanents du laboratoire pour leurs conseils et les bons moments passés ensemble et tous ceux qui ont contribué par leur bonne humeur et leur amitié : les doctorants du laboratoire (Balkis, Abdel Rahman, Abdel Kerim, Hanxiang, Alice, Pamela, les 2 Zeinab, Joseph et Marie) et les doctorants et ingénieurs des autres équipes (Amine, Zaki, Pierre, Adrien, les 3 Hussein, Mira, Amir, Carlos, Nahla, Ibrahim, Tarek, Ahmad, Christiano, Fabien, Mehrad et Jean-Dominique) ; les postdocs (Sophie, Pascaline, Ghizlaine et Amelène) ; les stagiaires (les 2 Guillaume). Merci à tous pour ces bons moments passés ensemble autour d’un Pizza (Amir), un Kebbab (Ziad, Zaki et Ahmad), un café, une cigarette (Olivier) ou
une Madeleine…
Je terminerai en remerciant ma famille en France et au Liban, mes parents,
mes frères, ma sœur et tous mes proches, pour leurs soutiens au quotidien et tout
5
SOMMAIRE
INTRODUCTION GENERALE ... 21
CHAPITRE I : GENERALITES SUR LA MATIERE ORGANIQUE DES SOLS ET DES SEDIMENTS. TECHNIQUES D’ANALYSES EMPLOYEES ET NOTIONS SUR LES BIOGEOMARQUEURS MOLECULAIRES ... 27
I. Biomolécules ... 29
I.1. Protéines ... 29
I. 2. Polysaccharides ... 31
I.2.1. Polysaccharides de structure ... 31
I.2.1.1. Cellulose ... 31
I.2.1.2. Hémicellulose ... 32
I.2.1.3. Polysaccharides présents dans les sphaignes ... 33
I.2.2. Polysaccharides en tant que réserve d’énergie ... 34
I. 3. Lipides ... 35
I.3. 1. Lipides simples ... 35
I.3. 2. Triglycérides ... 36
I.3. 3. Phospholipides ... 38
I.3. 4. Glycolipides... 39
I.4. Lignine ... 41
I.5. Tannins ... 44
I.6. Cutine et subérine ... 44
II. Techniques d’analyse de la MO ... 46
II. 1. Analyses globales ... 46
II.1. 1. Perte au feu ... 46
II.1. 2. Analyse élémentaire ... 47
II.1. 3. Spectroscopie infrarouge ... 48
II.1. 4. Résonance magnétique nucléaire ... 51
II.1. 5. Résonance de spin électronique... 53
II.1.6. Chromatographie d’exclusion stérique ... 53
II.1.7. Spectroscopie UV-Visible ... 54
II.1.8. Fluorescence ... 55
II.2. Dégradations chimiques ... 56
II.2.1. Hydrolyse alcaline ... 56
6
II.2.3. Oxydation alcaline en présence de CuO (II) ... 59
II.3. Dégradations thermiques ... 61
II.3.1. Pyrolyse ... 61
II.3.2. Thermochimiolyse ... 63
II.3.2.1. Mécanisme de la thermochimiolyse ... 63
II.3.2.2. Agents pour la thermochimiolyse ... 66
II.3.2.3. Thermochimiolyse séquentielle ... 70
II.4. La méthode DFRC ... 72
III. L’approche moléculaire ... 73
III. 1. Notion de biomarqueurs moléculaires ... 73
III. 2. Approche historique... 74
III. 3. Informations portées par les biomarqueurs moléculaires ... 76
III. 4. Les biomarqueurs concernants l’étude ... 77
III.4. 1. Sucres ... 77
III.4. 2. n-alcanes ... 79
III.4. 4. n-alcanols ... 81
III.4. 5. Acides gras ... 81
III.4. 6. Composés phénoliques ... 84
IV. CONCLUSION ... 86
Références ... 88
CHAPITRE II : PRESENTATION DE L‘ETUDE ... 119
I. LES TOURBIERES ... 121
I.1. Répartition géographique ... 121
I.2. Formation d’une tourbière ... 123
I.3. Dynamique de la MO dans les tourbières ... 129
I.3.1. Cycle de carbone dans les tourbières ... 129
I.3.2. Processus de dégradation et préservation de la MO dans la tourbe ... 130
I.3.2.1. Processus de dégradation de la MO dans l’acrotelme ... 130
I.3.2.2. Processus de dégradation de la MO dans le mésotelme ... 131
I.3.2.3. Processus de dégradation de la MO dans le catotelme ... 131
I.4. Perturbation des tourbières ... 132
I.4.1. Causes naturelles de perturbation des milieux tourbeux ... 134
I.4.2. Causes anthropiques provoquant une dégradation souvent réversible . 134 I.4.3. Causes anthropiques brutales et irréversibles ... 135
7
II. CONTEXTE GEO-INDUSTRIEL ... 136
Références ... 141
CHAPITRE III : L’étude des biomarqueurs moléculaires pour la mesure de l’impact d’une perturbation argileuse sur une tourbière ombrotrophe147 ABSTRACT ... 151
I. Introduction ... 152
II. Material and methods... 153
II.1. Setting ... 153
II.2. Sampling ... 156
II.3. LOI ... 156
II.4. Elemental analysis ... 156
II.5. Lignin monomers from CuO-NaOH oxidation ... 157
II.6. Sugar analysis ... 157
II.7. Lipid extraction ... 157
II.8. GC-mass spectrometry analysis ... 158
II.9. GC analysis ... 158
II.10. Statistical analyses ... 159
III. Results and discussion ... 160
III.1. Bulk and elemental analysis ... 160
III.2. Lignin phenol monomers ... 162
III.3. Non-cellulose carbohydrates ... 165
III.4. Lipids... 168
III.4.1. n-Alkanes ... 169
III.4.2. n-alkanols ... 170
III.4.3. n-Alkanoic acids ... 171
III.4.4. ω-Hydroxyalkanoic acids ... 172
III.5. Phospholipids ... 173
III.6. Statistical analysis ... 177
IV. Conclusion ... 178
Acknowledgments ... 179
References ... 179
CHAPITRE IV : APPLICATION DE LA THERMOCHIMIOLYSE PREPARATIVE POUR L’ANALYSE DE LA MO AU SEIN D’UNE TOURBIERE DU LIMOUSIN ... 191
8
I. ANALYSE EN COMPOSANTE PRINCIPALE DES
BIOGEOMARQUEURS D’UNE TOURBIERE DU LIMOUSIN OBTENUS
PAR THERMOCHIMIOLYSE... 193
ABSTRACT ... 195
I.1. Introduction ... 196
I.2. Materials and methods ... 198
I.2.1. Setting and sampling ... 198
I.2.2. Elemental analysis ... 199
I.2.3. THM ... 199
I.2.4. GC-MS ... 200
I.2.5. Statistical analysis ... 200
I.3. Results and discussion ... 201
I.3.1. Vegetation and microbial markers ... 201
I.3.2. Principal Component analysis ... 204
I.3.3. Proxies and Factors Comparisons ... 207
I.3. 4. Factors vs. depth ... 208
I.4. Conclusion ... 209
Acknowledgments ... 210
References ... 210
II. COMPARAISON ENTRE LA THERMOCHIMIOLYSE ET LES TECHNIQUES CLASSIQUES D’EXTRACTION ET/OU DEGRADATION DE LA MATIERE ORGANIQUE DANS LES SOLS ET LES SEDIMENTS ... 217
ABSTRACT ... 219
II.1. Introduction ... 220
II.2. Materials and methods ... 222
II.2.1. Setting and sampling ... 222
II.2.2. TMAH thermochemolysis ... 223
II.2.3. Sugar analysis ... 223
II.2.4. Lignin monomers by CuO oxidation ... 224
II.2.5. Lipid extraction ... 224
II.2.6. GC-MS analysis ... 224
II.2.7. GC analysis ... 225
II.3. Results and discussion ... 225
II.3.1. Carbohydrates ... 225
II.3.2. Lignin subunits ... 227
II.3.3. Lipids ... 229
9
Acknowledgments ... 233
References ... 233
CHAPITRE V : NOUVELLE METHODE D’ANALYSE DE SUCRE AU SEIN D’UNE TOURBIERE DU LIMOUSIN ... 239
ABSTRACT ... 242
I. Introduction ... 242
II. Materials and methods ... 244
II.1. Sampling ... 244
II.2. Derivatization with acetyl bromide ... 244
II.3. Hydrolysis with hydrochloric acid ... 245
II.4. GC analysis ... 246
III. Results and discussion ... 246
V. Conclusion ... 249 Acknowledgments ... 249 References ... 250 CONCLUSION GENERALE ... 253 PARTIE EXPERIMENTALE ... 259 I. Précautions ... 261 II. Extraction de la MO ... 261 II.1. n-alcanes ... 264
II.2. n-alcanols, n-acides gras et FAMEs ... 265
II.3. ω-hydroxy FAMEs et ω-hydroxy acides gras ... 268
III. Méthode au bromure d’acyle ... 269
IV. Hydrolyse acide ... 271
IV.1. Protocole ... 271
IV.2. Dérivation des monosaccharides ... 271
V. Oxydation alcaline par l’oxyde de cuivre ... 273
VI. Hydrolyse alcaline ... 274
VII. Thermochimiolyse préparative ... 275
VIII. Caractérisations globales ... 275
VIII.1. LOI ... 275
VIII. 2. Analyse élémentaire ... 276
VIII. 3. Spectroscopie IR ... 276
10 IX. 1. Acétylation ... 276 IX. 2. Silylation ... 277 IX. 3. GC ... 277 IX. 4. GC-MS ... 278 Références ... 278
11
LISTE DES FIGURES
Figure 1 : Structure des L- -acides aminés les plus abondants ... 30
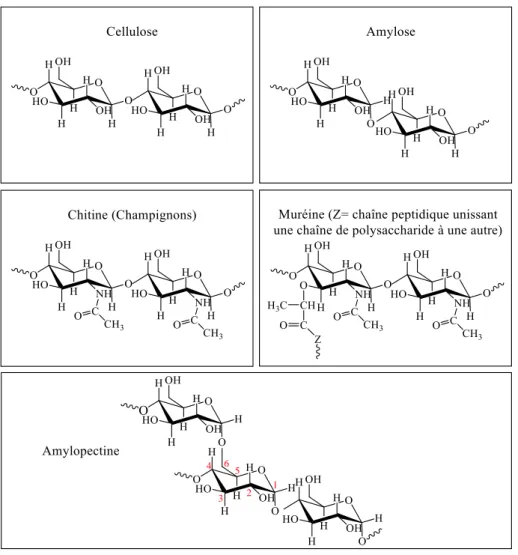
Figure 2 : Structures de quelques polysaccharides ... 33
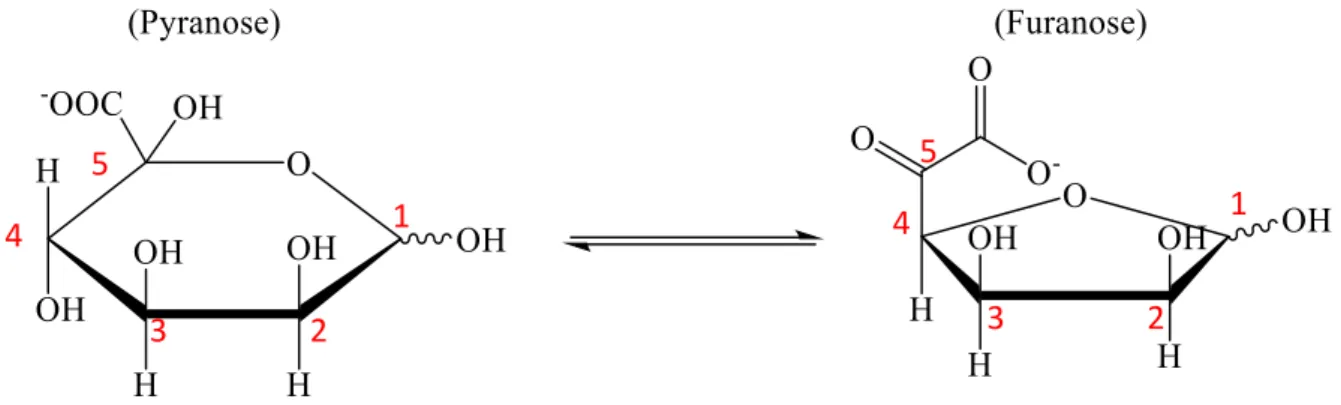
Figure 3 : Acide céto-D-mannuronique dans ces deux formes pyranose et furanose ... 34
Figure 4 : Réaction de synthèse du triglycéride ... 37
Figure 5 : Structure générale d’un phospholipide dans une membrane cellulaire [21]. ... 38
Figure 6 : Hydrolyse des phospholipides en diglycérides suite à l’apoptose (d’après Virtue et al [23]). ... 39
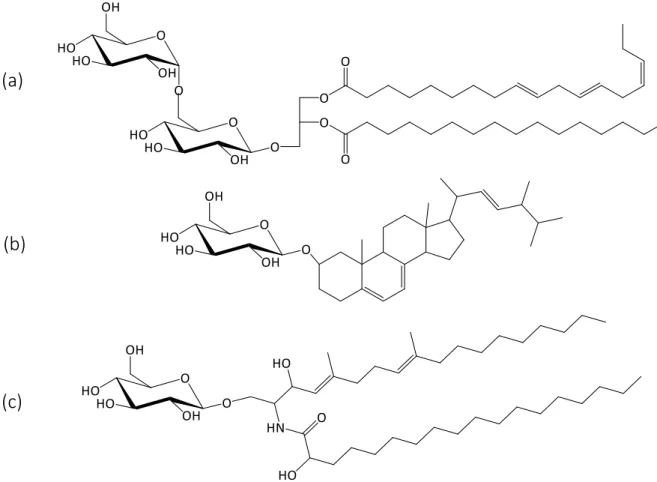
Figure 7 : Glycolipides avec des motifs diacylglycérol, stérol et céramide comme partie hydrophobe. (a) digalactosyldiacylglycérol (1,3-di-O-acyl-3-O-[ -D-galactopyranosyl-(1-6)- -D-galacto-pyranosyl]-sn-glycerol) contenant un résidu linolenoyl et palmitoyl ; (b) Steryl- -glucoside (ergosteryl -D-glucopyranoside) ; (c) glucosylcéramide [N-(S)-2’-hydroxyoctadecanoyl-1-O- -D-glucopyranosyl-(4E, 8E)-9-methyl-sphingadienine] [25]. ... 40
Figure 8 : Unités phénylpropane à la base des lignines et alcools cinnamiques correspondants ; R1=R2= H : H-p ; R1= OCH3, R2= H : G-p ; R1= R2= OCH3 : S-p. 41 Figure 9 : Structure supposée d’une lignine de hêtre (d’après Killops et Killops [9]). ... 43
Figure 10 : Acide sphagnique [33]. ... 44
Figure 11 : Structure des monomères des tannins ... 44
Figure 12 : Modèle de subérine et de cutine (d’après Kolattukudy [37]). ... 45
Figure 13 : Structure des monomères aliphatiques de la subérine et la cutine [37]. ... 46
Figure 14 : Spectre IR d’une tourbière minérotrophe d’après Krumins et al. [65]. ... 50
Figure 15 : Spectre IR d’une tourbière ombrotrophe d’après Krumins et al. [65]. ... 51
12
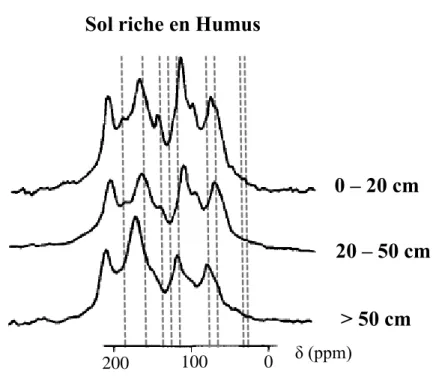
Figure 16 : Spectres RMN 13C du solide de différents horizons de sols de la
région de Halle, Allemagne (d’après Schmidt et al. [74]). ... 53 Figure 17 : Réaction d’hydrolyse alcaline en présence d’éther couronne 18-C-6 57 Figure 18 : Monomères ligneux libérés par oxydation alcaline en présence du CuO (II). ... 60 Figure 19 : Dispositif expérimental utilisé pour la pyrolyse/thermochimiolyse préparative ... 62 Figure 20 : Mécanisme d’obtention des esters par thermochimiolyse en présence de TMAH. ... 63 Figure 21 : Mécanisme d’obtention des ethers méthylés par thermochimiolyse en présence de TMAH d’après Kossa et al. [141]. ... 64 Figure 22 : Mécanisme de l’étape d’hydrolyse proposé par Challinor et al. [142], intervenant lors de la thermochimiolyse en présence de TMAH à l’origine de la rupture des liaisons éthers et esters. ... 64 Figure 23 : Mécanisme de la formation d’acides sacchariniques perméthylés lors de la thermochimiolyse du D-glucose en présence de TMAH d’après Fabbri et Helleur [143]. ... 65 Figure 24 : Structures des dérivés de la lignine identifiées par Clifford et al. [149]. ... 67 Figure 25 : Chromatogrammes obtenus par Fabbri et al. [163], suite à une pyrolyse/silylation off-line en présence du (a) HMDS et (b) TMSDEA. (1) 2-triméthylsilyloxyméthyl-5-triméthylsilyloxy-2,3-dihydro-(4H)-pyran-4-one ; (2) 1,6-anhydro-2,4-bis-O-(triméthylsilyl)--D-glucopyranose ; (3) 1,6-anhydro-2,3,4-tris-O-(triméthylsilyl)—D-glucopyranose ; (4) 1,4-anhydro-2,3,6-tris-O-(triméthylsilyl)-glucopyranose ; (5) 1,6-anhydro-2,3,5-tris-O-(triméthylsilyl)-glucofuranose... 69 Figure 26 : Chromatogrammes des produits de thermochimiolyse d’un échantillon de tourbes délipidifée par double-shot (d’après Estournel-Pelardy et al. [129]) : (a) HMDS 300 °C et (b) TMAH 400 °C, et par thermochimiolyse « simple » (TMAH 400°C) (c). Ax : composés aromatiques (les différents composés de cette famille sont présents dans le Tableau 5), S : sucres. ... 71 Figure 27 : Coupure de la liaison -éther par la méthode DFRC proposée par Lu et Ralph [168]. ... 73
13
Figure 28 : Structures chimiques de la chlorophylle (a) et ses dérivés dans les sédiments : la chlorophylle (1) est trouvée dans les plantes et le vanadyl (VO2
)-deoxophylloerythroetioporphyrins (DPEP) (2) se retrouve dans le pétrole et possède un noyau tetrapyrolique (1). Ces observations ont conduit Treibs [169] à suggérer l’origine biologique du pétrole. L’altération de la chlorophylle dans les sédiments par la rupture de la chaîne périphérique (phytyl) et l’hydrogénation des doubles liaisons ont aussi conduit à la formation des hydrocarbures isoprénoïque : Phytane et Pristane [174]. ... 75 Figure 29 : Monosaccharides à intérêt géochimique (d’après Killops et Killops [9]). ... 79 Figure 30 : Chromatogramme de la fraction apolaire de deux espèces de Sphaignes ; le C23 est dominant chez le S. balticum et le C25 est dominant chez le
S. fuscum. Numéro sur les pics = nombre de carbone des n-alcanes présentés ; (●)
homologues paires d’alcanes ; (■) étalons internes (10nonadecanone et 5 -cholestane respectivement) [189]. ... 80 Figure 31 : Relation entre changement du climat, végétations et motifs ligneux [236]. ... 85 Figure 32 : Carte mondiale de la proportion des surfaces continentales couvertes par les tourbières (d’après Joosten et Clarke [3]). ... 122 Figure 33 : Principaux paramètres déterminant le développement d’une tourbière [4,5]. ... 124 Figure 34 : Typologie des tourbières en fonction de leur apport en eau et de leur morphologie (d’après Baudin et al, [4]) ... 125 Figure 35 : Principaux stades d’évolution d’une tourbière (d’après Campy et Macaire [5]) ... 127 Figure 36 : Cycle de carbone dans les tourbières (d’après Francez [1]). ... 129 Figure 37 : Site de l’étude (cercle vert : tourbière des Sagnes). ... 137 Figure 38 : Site de l’étude de Wang et al. [27], les prélèvements effectués pour cette étude l’ont été dans la zone B. ... 137 Figure 39 : Composition des eaux interstitielles dans les zones A et B (Figure 38) en novembre 2011 et juillet 2012. Cercle bleu : zone A novembre 2011 ; cercle rouge : zone A juillet 2012 ; carré bleu : zone B novembre 2011 ; carré rouge : zone B juillet 2012 (d’après Wang et al. [27]). ... 138
14
Figure 40 : Techniques de prélèvement des échantillons. ... 140 Figure 41 : Spectre IRTF de la tourbe lyophilisée à 3 profondeurs. ... 140 Fig. 42. Map of study site in Limousin; the peatland sampling zone is marked with a red spot ... 153 Fig. 43. Peat core and depths of the three ecological layers. ... 154 Fig. 44. Methoxy phenols derived from CuO oxidation (Hedges and Ertel, 1982). H, p-hydroxyphenols (R2 = R3 = H); V, vanillyl compounds (R2 = H and R3 = OCH3)
and S, syringyl compounds (R2 = R3= OCH3) with their three forms: aldehyde (R1=
H), ketone (R1= CH3) and acid (R1 = COOH); C, cinnamyl compounds: p-coumaric
acid (R4 = H) and ferulic acid (R4 = OCH3). ... 155
Fig. 45. Geochemical and bulk analysis (after Bordelet (2014)) with depth (red dots: depth of the clay deposit). ... 160 Fig. 46. Elemental ratios of the Sagnes peatbog (red dots: depth of the clay deposit). ... 161 Fig. 47. VSC (mg/g OM) and different ratios of lignin phenols (red dots: depth of the clay deposit). ... 163 Fig. 48. Monsaccharides depth profile (red dots: depth of the clay deposit). ... 166 Fig. 49. Non-cellulose carbohydrate ratios with depth (red dots: depth of the clay deposit). ... 168 Fig. 50. Depth profiles of lipid biomarkers families (red dots: depth of the clay deposit). ... 169 Fig. 51. Molar contribution from lipid compounds in the three layers of the peat (red dots: depth of the clay deposit). ... 171 Fig. 52. PCA of all quantified PLFAs (mol%). The different groups of FAs shown are monounsaturated (▲), terminally branched (+), mid-chain branched 10Me (♦), straight chain ≥ C20 (●), 18ω2,6 (■), cyclopropyl (-). Capital letters (A to G)
designate major clusters. ... 173 Fig. 53. Depth profiles of total PLFAs and PLFAs representing different clusters from Fig. 52 (red dots: depth of the clay deposit). ... 175 Fig. 54. First two dimensions of the PCA performed on the data of 72 (= 24 x 3) depth samples. The PCA in (a) expresses the relationship between mol% of lignin
15
monomers (Fig. 44) and hemicellulose monosaccharides. The PCA in (b) expresses the relationship between different lignin ratios: S/V, H/V, C/V, Fer/Coum and Ac/Ad)V,S and carbohydrates: C6/C5 and Deoxy/C5 used in previous studies for soil
and sediment samples. ... 178 Fig. 55. Map of study site in Limousin; the peatland sampling zone is marked with a red spot (left). Peat core and depths of the three ecological layers (right). ... 197 Fig. 56. Depth records of different THM compounds and molecular families. Aliphatics represent the sum of ω-methoxy FAMEs and n-FAMEs; Branched FAMEs= i15+a15+i17+a17. ... 202 Fig. 57. PCA for the RMA of the dataset: factor scores of the samples (left); factor loadings of THM compounds (right) on the first two ordination axes (F1+F2=54.6%). Number for FAMEs and ω-methoxy FAMEs represent carbon
chain length of different compounds. Carbohydrate and S, G and A annotations are similar to those in Table 12. ... 204 Fig. 58. Selected correlation between elemental decomposition proxies and the first factors (F1) obtained by PCA of THM-GC-MS data. C/N, H/C, O/C and
molecular components determined by THM-GC-MS. Aliphatics represent the sum of ω-methoxy FAMEs and n-FAMEs. ... 206 Fig. 59. Depth records of factor scores F1 and F2. ... 208
Fig. 60. Depth record for carbohydrates obtained by TMAH thermochemolysis (●) and acid hydrolysis with HCl (●); the Mesotelm (from -25 to -50 cm) is marked in grey. ... 225 Fig. 61. Relationship between the sum of lignin subunits lambda ʌ, acid/aldehyde (Ac/ad) and Syringyl/Guaciayl (S/G) ratios among peat core samples by the TMAH and CuO methods. ... 227 Fig. 62. Molar contributions (%) of fatty acid methyl esters (FAMEs) and ɷ-hydroxy fatty acid methyl esters (ɷ-FAMEs) produced by TMAH and lipid extraction for the three ecological layer composing the peat core. ... 231 Fig. 63. The mechanism of AcBr with free carbohydrates (a) and carbohydrates bound to lignin (b). ... 243 Fig. 64. Depth (cm) distributions of carbohydrate concentrations (mg/g OM) within the peat core released after AcBr procedure (black bullets) and acid hydrolysis (grey bullets). ... 248
16
Figure 65 : Fractionnement des TLEs. ... 263 Figure 66 : Chromatogramme des n-alcanes (●). ... 264 Figure 67 : Courbes d’étalonnage de différentes n-alcanes analysés par rapport à IS. ... 265 Figure 68 : Chromatogramme n-acide gras (▲),n-alcanols (○) et FAMEs (●). . 266 Figure 69 : Courbes d’étalonnage du n-nonadécanoate ester méthylique analysé par rapport à l’éthylvaniline. ... 266 Figure 70 : Courbes d’étalonnage des n-alcanols analysés par rapport à l’éthylvaniline. ... 267 Figure 71 : Courbes d’étalonnage des n-acides gras analysés par rapport à l’éthylvaniline. ... 267 Figure 72 : Chromatogramme des ω-hydroxy FAMEs (●) et ω-hydroxy acides (○). ... 268 Figure 73 : Courbes d’étalonnage d’un ω-hydroxy FAME et d’un ω-hydroxy acides gras analysés par rapport à l’éthylvaniline. ... 268 Figure 74 : Chromatogramme des monosaccharides acétylés obtenu par la méthode du bromure d’acyle ... 269 Figure 75 : Courbes d’étalonnage de différents monosaccharides analysé par rapport au C19. ... 270
Figure 76 : Chromatogramme des monosaccharides sous forme d’alditols acétylés. ... 272 Figure 77 : Courbes d’étalonnage de différents monosaccharides (sous forme d’alditol acétylés) analysés par rapport au D-déoxy-2-glucose. ... 273 Figure 78 : Les sous-produits phénoliques de la lignine obtenus suite à une oxydation alcaline en présence du CuO (avec P : p-hydroxyphénol, G : composés guaïacyliques et S : composés syringililiques). ... 274 Figure 79 : Chromatogramme des FAMEs dérivés des acides gras des phospholipides. ... 275
17
LISTE DES TABLEAUX
Tableau 1 : Symbole, formule, nom usuel et systématique de quelques acides n-alcanoïques entrant dans la composition des cires cuticulaires. ... 36 Tableau 2 : Attribution des bandes infrarouge [65,66]. ... 49 Tableau 3 : Attribution des déplacements chimiques en RMN 1H [70] et 13C du
solide [71,72]. ... 51 Tableau 4 : Effet de la concentration en HCl sur les quantités des monosaccharides extraits à 100oC pour 3 heures [107]. ... 59
Tableau 5 : Composés identifiés après les différentes thermochimiolyses (Figure 26). ... 71 Tableau 6 : Quantité des principales familles de composés libérés après thermochimiolyses « simple » et « double » d’après Estournel-Pelardy et al. [129]. ... 72 Tableau 7 : Origines admises des acides gras de phospholipides... 83 Tableau 8 : Répartition des tourbières par les pays avec leurs plus grandes superficies (d’après Joosten et Clarke [3]). ... 122 Tableau 9 : Régression des tourbières européennes au cours du XXe siècle
(d’après R. Goodwillie [26]) ... 133 Tableau 10 : Pourcentages exprimés par rapport au poids sec de tourbe pour les teneurs en SiO2, Al2O3, Fe2O3total, MnO, CaO, Na2O, K2O et TiO2 ainsi que la
somme de ces éléments inorganiques. ... 139 Table 11. Median relative amounts of PLFAs classes in the peat core ... 174 Table 12. Peak identification and mean value (μmol g-1 of dry peat) of THM products .. 202
Table. 13. RT, Rf and linear regression (r2) of eight acetylated neutral sugars
18
LISTE DES ABREVIATIONS
5-KMA: Acide 5-céto- -mannuronique Ac2O: Anhydride acétique
AcBr: Bromure d’acyle AcOH: Acide acétique ACP: Acyl Carrier Protein ATP: Adénosine triphosphate
BSTFA: N,O-Bis(triméthylsilyl)trifluoroacétamide C: Cinnamyle
CE: Condensation Enzyme
CEC: Capacité d’Echange Cationique CHCl3: Trichlorométhane
CoA: Coenzyme A Cu: Cuivre
CuO: Oxyde de Cuivre
DFRC: Derivatization Followed by Reductive Cleavage FA: Fatty Acid
FAME: Fatty Acid Methyl Ester FID: Flame Ionization Detector FTIR: Fourrier Transform InfraRed G: Guaïacyle
G-p: Gaïacylpropane GC: Gaz Chromatography
19 GC-MS: Gaz Chromatography-Mass Spectrometry H2SO4: Acide sulfurique
H-p: p-hydroxyphénylpropane HCl: Acide chlorhydrique HMDS: Hexaméthyldisilazane IR: Infrarouge
IS: Internal Standard
KOH: Hydroxyde de Potassium LOI: Loss on ignition
MAS: Magic-Angle Spinning MMO: Methane MonoOxygénase MOS: Matière Organique des Sols MO: Matière Organique
OM: Organic Matter PC: Principal Component
PCA : Principal Components Analysis PLFA: Phospholipid Fatty Acid
PTC: Phase Transfer Catalyst
Py-GC/MS: Pyrolysis coupled with Gaz Chromatography-Mass Spectrometry RMA: Relative Molar Abundance
RMN: Résonnance Magnétique Nucléaire RSE: Résonnance de Spin Electronique RT: Retention Time
20 S: Syringyle
S-p: Syringylpropane SOM: Soil Organic Matter TAG: Triacylglycérol
TBAH: Hydroxyde de tétrabutylammonium TCD: Total Conductivity Detector
TEAAc: Acétate de tétraéthylammonium TFA: Acide trifluoroacétique
THM: Thermally assisted Hydrolysis and Methylation TIC: Total Ion Chromatogram
TMAAc: Acétate de tétraméthylammonium TMAH: Hydroxyde de tétraméthylammonium TMCS: triméthylchlorosilane
TMSDEA: triméthylsilyldiéthylamine
TMSH: Hydroxyde de tétraméthylsulfonium TMSI: triméthylsilylimidazole
TPAH: Hydroxyde de tétrapropylammonium XRD: X-Ray Diffraction
Zn: Zinc
21
22
23
Les sociétés industrialisées sont confrontées à des problèmes environnementaux majeurs, notamment en ce qui concerne les sols et les sédiments. Qu’il s’agisse en effet de la rétention ou du transport de polluants métalliques ou organiques, de la qualité de l’eau ou du maintien de la fertilité des sols, la matière organique des sols (MOS), au sens général joue un rôle important dans ces processus mis en jeu. Ces processus, et plus spécialement ceux qui affectent la matière organique (MO), nous intéressent au plus haut point, d’autant que la nature et les mécanismes d’évolution du compartiment organique des sols et des sédiments apparaissent encore mal compris.
Parmi les sédiments récents, les tourbières sont des espaces de transition entre la terre et l’eau où la MO a une tendance à s’accumuler. Ce sont des écosystèmes particuliers à la faune et à la flore spécifiques et rares. Elles jouent souvent un rôle de filtre naturel où MO et minéraux s’accumulent. Sur une échelle de temps longue, c’est aussi un énorme stock de MO qui est soustrait au cycle du carbone et qui est susceptible d’évoluer vers la formation de charbons.
Dans le cadre d’un partenariat scientifique entre AREVA et l’Université de Poitiers, il m’a été proposé d’étudier l’impact d’une perturbation argileuse contemporaine sur le développement d’une tourbière du Limousin en aval d’un ancien site minier uranifère. En effet, certains impacts anthropiques forts et récents ont pu mettre à l’épreuve l’évolution de certaines tourbières. Ici, l’appréciation de cet impact s’effectuera par l’analyse de biogéomarqueurs moléculaires (lipides, motifs ligneux, polyphénols et sucres spécifiques des différents couverts végétaux successifs) renseignant sur l’état de la MO (origines et processus d’accumulation). Cette étude est aussi l’occasion de développer de nouvelles techniques chimiques pour l’analyse de certains biogéomarqueurs.
En effet, la qualité et les quantités (absolues et relatives) de structures moléculaires bio(géo)chimiques rencontrées dans un sédiment renseignent sur l’origine biologique et l’état de transformation de ce dernier. Elles renseignent
24
directement sur la nature des événements successifs qui ont conduit à la formation de ce sédiment. Ces analyses moléculaires (Chapitre III) ont été effectuées sur trois colonnes de tourbe impactée (tourbières des Sagnes). De la surface au substrat minéral, ces colonnes ont une profondeur de 1 m. Chaque colonne a été divisée en pas de 4 cm d’épaisseur.
Après cette étude de cas, le deuxième objectif de cette thèse est une comparaison entre ces méthodes chimiques et des méthodes thermochimiques.
La thermochimiolyse (pyrolyse assistée chimiquement) permet à la fois une attaque chimique et thermique des macromolécules et présente comme intérêt de minimiser les réactions secondaires telles que les décarboxylations d’acides aromatiques. Un autre intérêt est sa sensibilité à une large gamme de molécules provenant de différentes origines (lignine et autres polyphénols, sucres et lipides) alors que les méthodes chimiques courantes sont très souvent spécifiques à une famille de molécules. Le quatrième chapitre regroupe deux études portant sur l’application de la thermochimiolyse et son potentiel.
La première étude a pour but de montrer, avec l’aide d’une analyse des composantes principales (PCA) appliquée aux composés obtenus par thermochimiolyse, que cette méthode permet de reconstituer les différents événements historiques de la formation de la tourbière étudiée ainsi que d’y reconnaître les différentes couches écologiques la constituant.
La deuxième étude est une comparaison des composés obtenus par thermochimiolyse avec ceux des méthodes spécifiques d’extraction et/ou de la dégradation de la MO (oxydation alcaline en présence d’oxyde de cuivre CuO pour la lignine, hydrolyse acide pour les polysaccharides et extraction lipidique).
Enfin, le cinquième chapitre présente les résultats obtenus pour l’analyse
des sucres par le bromure d’acyle. Cette méthode est utilisée dans la chimie du bois pour la solubilisation de la lignine. Sa spécificité pour la rupture sélective
25
des liaisons -aryl éthers peut en faire une méthode de choix pour l’analyse spécifique de certains sucres ligno-cellulosiques.
27
CHAPITRE I : GENERALITES SUR LA MATIERE
ORGANIQUE DES SOLS ET DES SEDIMENTS.
TECHNIQUES D’ANALYSES EMPLOYEES ET
NOTIONS SUR LES BIOGEOMARQUEURS
29
La matière organique des sols (MOS) est constituée par l’ensemble des composés organiques provenants de résidus d’organismes vivants à plusieurs stades de décomposition.
Constituant ubiquiste des sols, des eaux, des sédiments récents ou anciens, la matière organique (MO) est, par sa nature et sa réactivité, un composant tout à fait singulier. Elle participe au recyclage géochimique de nombreux élements (C, N, O, S, P et cations). Elle est à l’origine de la formation des combustibles fossiles. Elle contient de précieuses informations sur les environnements passés de la Terre [1]. Elle est aussi le substrat indispensable au développement de la vie biologique et joue un rôle clé dans la fertilité des sols [2] en conditionnant leurs propriétés chimiques (stocks de carbone, d’azote et de phosphore) et physiques (perméabilité, stabilité structurale, capacité de rétention et de circulation de l’eau). Elle intervient dans la composition atmosphérique par le biais de la minéralisation (CO2 pour la respiration aérobie et CH4 pour la
respiration anaérobie).
Elle est constituée de différents composés organiques de hauts poids moléculaires (polysaccharides, protéines, lipides complexes…) et de substances plus simples (monosaccharides, acides aminés, lipides simples…). Ces molécules proviennent de différentes structures composant les organismes vivants. Donc, une connaissance de ces structures permet de mieux comprendre le devenir de la matière organique (MO) dans les sols et les sédiments.
I. Biomolécules
I. 1. Protéines
Les protéines et leurs produits de dégradation (peptides et acides aminés) sont une composante importante de la MO et jouent un rôle important dans le cycle de l’azote [3]. Elles représentent 40-60 % des composés organiques azotés dans les sols [4], la structure non protéique des composés azotés dans les sols et
30
les sédiments restant encore sujette à discussion. Les protéines sont constituées de l’enchaînement d’acides aminés.
Figure 1 : Structure des L- -acides aminés les plus abondants
Le trait commun à tous les acides aminés est un atome de carbone central (C ), autour duquel s’articulent quatre substituants : un atome d’hydrogène (-H), un groupement carboxyle, un groupement amine (-NH2) et une chaîne variable
dont la nature est caractéristique de chaque acide aminé (Figure 1). La fonction acide carboxylique se condense sur le groupement amine d’un autre acide aminé afin de donner un dipeptide dont la cohésion est assurée par une liaison peptidique (liaison amide). Cette liaison est à la base de la formation des protéines dans le monde vivant. Que ce soit sur des échantillons solides ou aqueux, les acides aminés sont généralement libérés par hydrolyse acide avec de l’acide chlorhydrique (HCl ; 6M) [5]. D’autres études ont toutefois utilisé
31
l’hydrolyse alcaline (NaOH ; 0.5 et 0.1 M) ou une simple macération dans l’eau chaude [6].
I. 2. Polysaccharides
Les hydrates de carbone, sous la forme de sucres simples et de polyoses, représentent entre 5 et 25 % de la MOS [7]. Ces molécules, avec la cellulose, sont des composantes essentielles de la membrane cellulaire et permettent de rigidifier la structure des membranes chez les bactéries, les champignons et les plantes [8,9]. Les polysaccharides servent aussi en tant que réserve d’énergie en
stockant les monosaccharides qui se libèrent par le cycle de Krebs en fonction des besoins de l’organisme [10]. Etant donnée la différence des monosaccharides constituants ces molécules, d’une espèce à une autre, elles peuvent être des indicateurs de l’origine et de la dynamique des MOS.
Les polysaccharides sont formés par la condensation des monosaccharides par la liaison glycosidique. La condensation du même type de monosaccharides conduit à la formation des homopolysaccharides tels que la cellulose et l’amylose (Figure 2). Les polysaccharides formés par la condensation de différents monosaccharides sont des hétéropolysaccharides ou polyoses tels que les hémicelluloses.
I.2 1. Polysaccharides de structure I.2.1. 1. Cellulose
La cellulose est le constituant majeur des parois de la cellule végétale. C’est le plus important constituant chimique du bois et le biopolymère le plus abondant du monde végétal. On trouve aussi de la cellulose dans des organismes non photosynthétiques comme certaines bactéries, par exemple l’Acetobacter
32
invertébrés tels les Tunicates qui présentent une coquille cellulosique flexible
[12].
I.2.1. 2. Hémicellulose
Les hémicelluloses constituent, après la cellulose, la source de polysaccharides la plus abondante sur la Terre. Elles sont de plus faibles masses moléculaires que la cellulose. Contrairement à cette dernière, les hémicelluloses sont composées de sucres différents. Cela donne à ces polymères une grande diversité selon les types de végétaux, d’une part, et une grande variété dans une même plante, d’autre part [12]. Elles sont, entre autres, des constituants des parois cellulaires du bois, en association étroite avec la cellulose et la lignine, rentrant ainsi dans la constitution des matériaux lignocellulosiques. Les glucides constituants les hémicelluloses sont le plus souvent le glucose, le galactose, l’acide glucuronique, l’acide galacturonique, l’arabinose et le xylose. Les quatres types d’hémicelluloses les plus importants dans les parois des cellules végétales sont :
-Les glucanes constitués exclusivement de glucose lié entre eux par des liaisons -1,3 et -1,4,
-Les xylanes constitués majoritairement de xylose lié entre eux par une liaison -1,4,
-Les mannanes constitués majoritairement de mannose lié entre eux par une liaison -1,4,
-Les galactanes constitués majoritairement de galactose lié entre eux par une liaison -1,4 [13].
33
1 2 3
4 6 5
Figure 2 : Structures de quelques polysaccharides I.2.1. 3. Polysaccharides présents dans les sphaignes
La paroi cellulaire des sphaignes contient des polysaccharides similaires aux pectines : rhamnogalacturonane I [14], xyloglucomannane et cellulose [15]. Les fragments des polysaccharides similaires aux pectines, une fois relargués dans l’environnement, prennent le nom de sphagnane [16,17]. De plus, Painter
[18] a montré que les polysaccharides de Sphagnum quinquefarium contenaient un acide céto-uronique original (acide 5-céto-D-mannuronique (5-KMA)). Ce polysaccharide est présent au niveau des parois cellulaires des hyalocystes (cellules mortes dépourvues de chloroplastes et ne contiennent que de l’eau) des sphaignes [17].
34 1 2 3 4 5 1 2 3 4 5
Figure 3 : Acide céto-D-mannuronique dans ces deux formes pyranose et furanose Le 5-KMA est présent dans les sphagnanes sous deux formes isomériques (pyranose et furanose ; Figure 3). La forme furanose contient un groupement carbonyle réactif sur l’atome C-5 sous la forme de l’acide -cétocarboxylique qui a donné au sphagnane des propriétés uniques par rapport aux autres polysaccharides. Ces propriétés sont la grande capacité d’échange cationique (CEC) de ce polymère. L’échange d’ions conduit à la libération de H+, renforçant
ainsi l’acidification du milieu, la raréfaction d’oligo-éléments (Zinc Zn ou Cuivre Cu) et l’inactivation des exo-enzymes. En milieu acide, le groupement carbonyle de ce sucre est capable de réagir avec le groupement amine des acides aminés ou avec l’ammoniaque (réaction de Maillard) [19]. Les divers produits de cette réaction se polymérisent ensuite pour produire des substances humiques difficilement dégradables [14,19]. L’azote, indispensable pour les plantes et les micro-organismes se trouve ainsi séquestré d’une manière pérenne.
I.2 2. Polysaccharides en tant que réserve d’énergie
Le D-glucose peut aussi être stocké sous forme de polysaccharides en tant que réserve d’énergie. Chez les plantes, ce biopolymère est l’amidon contenant approximativement 80 % d’amylopectine et 20 % d’amylose (Figure 2). Des différences existent au niveau de la composition de ces deux polymères du fait que l’amylopectine présente des ramifications sur le carbone C-6 tous les 20 à 25 monomères de glucose composant la chaîne linéaire principale (Figure 2). La structure de ces deux polymères diffère de celle de la cellulose au niveau de la
35
configuration du C-1. Le glycogène, polysaccharide de réserve d’énergie chez les animaux, est aussi un polymère -D-glucopyranose avec un degré de réticulation plus important que l’amylopectine.
I. 3. Lipides
Les lipides sont définis comme des substances insolubles dans l’eau mais solubles dans les solvants organiques (chloroforme, hexane, toluène et acétone). Cette définition vaste regroupe une très large gamme de molécules et macromolécules. Les molécules organiques telles que les acides carboxyliques (acides gras), les alcools gras (alcanol) et les alcanes sont considérées comme les lipides les plus simples. Les lipides existent aussi chez les organismes sous forme de combinaisons de ces molécules simples (esters à longues chaînes, triglycérides, esters de stérols et phospholipides) ou bien avec d’autres types de molécules telles que les monosaccharides (glycolipides) ou les protéines (lipoprotéines) [9]. Nous présenterons ici les classes de lipides les plus abondants et ayant aujourd’ hui un intérêt géochimique.
I.3. 1. Lipides simples
Les n-alcanes sont les hydrocarbures linéaires saturés. Ils peuvent soit provenir des cires cuticulaires des végétaux [20], soit de la diagenèse de composés fonctionnalisés linéaires tels que les n-acides gras et les n-alcanols.
Les n-alcanols (alcan-1-ols) sont des composés amphiphiles, la tête hydrophile étant constituée d’un groupement hydroxyle, la chaîne hydrocarbonée (hydrophobe) pouvant contenir de 12 à 32 atomes de carbone. Les alcanols sont biosynthétisés par réduction enzymatique d’acides gras. Cela conduit à une prédominance des composés pairs sur les composés impairs [9].
Les acides gras sont aussi des molécules amphiphiles possédant une tête hydrophile, un groupement carboxylique, et un corps hydrophobe composé d’une
36
chaîne d’hydrocarbure. Les principaux acides linéaires entrant dans la composition des cires cuticulaires sont, à titre d’exemple, présentés dans le Tableau 1.
Tableau 1 : Symbole, formule, nom usuel et systématique de quelques acides n-alcanoïques entrant dans la composition des cires cuticulaires.
Symbole Formule Nom usuel Nom UICPA
C12:0 H3C-(CH2)10-COOH acide laurique acide dodécanoïque
C13:0 H3C-(CH2)11-COOH acide tridécylique acide tridécanoïque
C14:0 H3C-(CH2)12-COOH acide myristique acide tétradécanoïque
C15:0 H3C-(CH2)13-COOH acide pentadécylique acide pentadécanoïque
C16:0 H3C-(CH2)14-COOH acide palmitique acide hexadécanoïque
C17:0 H3C-(CH2)15-COOH acide margarique acide heptadécanoïque
C18:0 H3C-(CH2)16-COOH acide stéarique acide octodécanoïque
C19:0 H3C-(CH2)17-COOH acide nonadécylique acide nonadécanoïque
C20:0 H3C-(CH2)18-COOH acide arachidique acide eicosanoïque
C21:0 H3C-(CH2)19-COOH - acide hénéicosanoïque
C22:0 H3C-(CH2)20-COOH acide béhénique acide docosanoïque
C23:0 H3C-(CH2)21-COOH - acide tricosanoïque
C24:0 H3C-(CH2)22-COOH acide lignocérique acide tétracosanoïque
C25:0 H3C-(CH2)23-COOH - acide pentacosanoïque
C26:0 H3C-(CH2)24-COOH acide cérotique acide hexacosanoïque
C27:0 H3C-(CH2)25-COOH - acide heptacosanoïque
C28:0 H3C-(CH2)26-COOH acide montanique acide octacosanoïque
C29:0 H3C-(CH2)27-COOH - acide nonacosanoïque
C30:0 H3C-(CH2)28-COOH acide mélissique acide triacontanoïque
C31:0 H3C-(CH2)29-COOH - acide
hentriacontanoïque C32:0 H3C-(CH2)30-COOH acide lacéroïque acide
dotriacontanoïque
I.3. 2.Triglycérides
Les triglycérides (aussi appelés triacylglycérides, triacylglycérol ou TAG) sont des glycérides formés par l’estérification des trois groupements hydroxyles
37
du glycérol par des acides gras (Figure 4). Ils sont les constituants principaux des huiles végétales et des graisses animales et servent de réserve d’énergie.
Figure 4 : Réaction de synthèse du triglycéride
Les acides gras vont ici du C12 au C36 sous des formes plutôt saturées chez
les animaux et insaturées chez les plantes. Chez les animaux, les acides gras C16
et C18 prédominent, alors que les acides gras majeurs des plantes sont les C18
mono-, di- et tri-insaturés. Les acides gras polyinsaturés sont plus abondants chez les algues que chez les végétaux supérieurs [9].
Les TAGs sont utilisés par les animaux et les plantes en tant que réserve d’énergie. La respiration aérobie des TAGs est précédée par leur hydrolyse en acides gras qui, ensuite, se transforment en acyl-CoA et perdent successivement des unités acétyles pour arriver à la fin à l’acétyl-CoA. Cette dernière forme est oxydée en CO2 dans le cycle de Krebs avec la libération d’énergie sous forme
d’adénosine triphosphate (ATP). La partie glycérol des TAGs contribue aussi à la génération d’énergie en se transformant en acide pyruvique dans le cycle de Krebs. Ce mécanisme d’oxydation des acides gras prend le nom de la -oxydation et se produit chez tous les organismes aérobies. D’autre part, l’oxydation aérobie peut aussi se produire par raccourcissement de la chaîne carbonée d’un atome de carbone par dégradation enzymatique, c’est la -oxydation [9].
38 I.3. 3. Phospholipides
Les membranes biologiques sont des bicouches lipidiques faites de molécules amphiphiles réparties en trois grandes catégories : les phospholipides, les glycolipides et le cholestérol [10].
Les phospholipides sont des diglycérides contenant un acide phosphorique et deux unités d’acides gras. Le groupement phosphate est souvent lié à un groupement amine tel que la choline (Figure 5).
Figure 5 : Structure générale d’un phospholipide dans une membrane cellulaire
[21].
Chez les microbes, les acides gras des phospholipides présentent une chaîne de carbone comportant de 12 à 24 unités (le plus souvent entre 14 et 20). Suite à l’apoptose (mort cellulaire), les groupements phosphate s’hydrolysent rapidement et les phospholipides libérant des diglycérides (Figure 6). Un grand intérêt a été porté à ces molécules pour l’analyse des communautés microbiennes des sols et des sédiments. En effet, elles sont le reflet de l’état de la biomasse microbienne vivante [22].
39
Figure 6 : Hydrolyse des phospholipides en diglycérides suite à l’apoptose (d’après Virtue et al [23]).
I.3. 4. Glycolipides
Les glycolipides sont formés d’un ou deux monosaccharides, principalement le glucose et le galactose, avec une configuration - (Figure 7a) ou - (Figure 7b et c). Ils sont liés à des composés lipidiques. On les trouve dans les membranes cellulaires des bactéries, des champignons, des végétaux et des animaux sous la forme de glycosyldiacylglycérol, glycosylstérides et glycosylcéramides (Figure 7) [24].
40
(a)
(b)
(c)
Figure 7 : Glycolipides avec des motifs diacylglycérol, stérol et céramide comme partie hydrophobe. (a) digalactosyldiacylglycérol (1,3-di-O-acyl-3-O-[ -D-galactopyranosyl-(1-6)- -D-galacto-pyranosyl]-sn-glycerol) contenant un résidu linolenoyl et palmitoyl ; (b) Steryl- -glucoside (ergosteryl -D-glucopyranoside) ; (c) glucosylcéramide [N-(S)-2’-hydroxyoctadecanoyl-1-O- -D-glucopyranosyl-(4E,
8E)-9-methyl-sphingadienine] [25].
Diacylglycérols, stérols et céramides (Figure 7) sont présents dans la partie hydrophobe de la membrane cellulaire et fonctionnent comme des intermédiaires métaboliques [24]. Ils servent aussi comme accepteurs pour les glycosyltransférases pour être converti en glycolipides correspondants avec des têtes hydrophiles spécifiques pour les différents organismes procaryotes et eucaryotes [25].
41
I. 4. Lignine
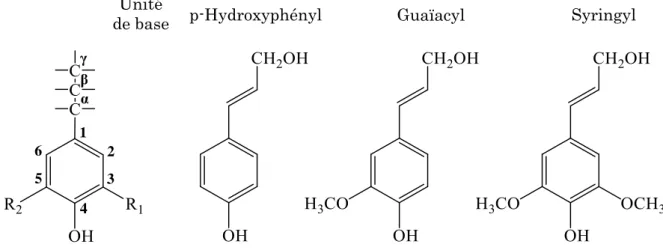
Après la cellulose, la lignine est, du point de vue quantitatif, la deuxième biomacromolécule par ordre d’importance dans la biosphère [12]. Elle est une macromolécule amorphe et complexe, constituée d’un système aromatique et phénolique [12]. Sa structure polyphénolique est formée par la condensation de trois unités que l’on distingue comme suit : p-hydroxyphénylpropane (H-p), syringylpropane (S-p) et guaïacylpropane (G-p) (Figure 8).
La position 3 dans les noyaux aromatiques de S-p et G-p est occupée par un groupement méthoxyle (-OCH3). Des liaisons C-O-C (diaryléther) ou C-C
(unités condensées) sont possibles sur la position 5 pour G-p et à la fois sur les positions 3 et 5 pour H-p. Les substitutions sur d’autres positions sur les unités phénylpropane sont rares [12]. La liaison éther -O-4 (entre l’oxygène phénolique
en C4 et un carbone en ; Figure 8) est celle la plus rencontrée entre les unités de
base des lignines. La deuxième liaison, c’est la -O-4 benzyléther, qui se présente à la fois sous forme cyclique (phénylcoumarane) et non cyclique. Parmi les liaisons C-C, les plus importantes sont les liaisons - et les liaisons 5-5 (Figure 8). 1 2 3 4 5 6 α Unité
de base p-Hydroxyphényl Guaïacyl Syringyl
Figure 8 : Unités phénylpropane à la base des lignines et alcools cinnamiques correspondants ; R1=R2= H : H-p ; R1= OCH3, R2= H : G-p ; R1= R2= OCH3 : S-p.
42
Les trois monomères précurseurs de la lignine (les monolignols selon la nomenclature proposée par Freudenberg [26], en référence à la lignine qui serait un polylignol) sont les dérivés de l’alcool cinnamique (3-phénylprop-2-ène-1-ol) : les alcools coumarique, coniférylique et sinapique.
Une définition unique et précise de la lignine, du fait de sa grande variabilité, n’est jamais possible et cela au sein même d'une espèce donnée, car sa formation dépend de l'environnement physico-chimique dans lequel le végétal croît. La Figure 9 représente une structure supposée d’une lignine. Il serait donc préférable de parler des lignines. En effet, la proportion des monomères et la nature des liaisons intermoléculaires sont très variables (avec la liaison -O-4 dominante) et dépendent de l’origine botanique, du tissu et de sa localisation dans la paroi. Les lignines sont très résistantes à de nombreux agents chimiques et biochimiques et sont donc difficilement dégradées ce qui leur confère une grande stabilité. Analysée à l’echelle moléculaire dans les sols et les sédiments, cette biomolécule nous donnes des indications sur la qualité et la quantité des MO d’origine végétale potentiellement présentes [27,28].
Au contraire de la cellulose et de l’amidon qui sont présents chez toutes les plantes, même les moins évoluées, les lignines sont des constituants caractéristiques des plantes vasculaires [12]. La lignification des parois cellulaires a permis une transition importante dans l’évolution des plantes. Cette transition est présentée par le passage du comportement rampant des plantes du milieu aquatique à un port dressé des plantes du milieu terrestre [12]. La question de la présence ou non de la lignine dans les cellules des mousses reste, à ce jour, sans réponse décisive. Néanmoins, en règle générale, l’allure rampante des mousses est en accord avec l’absence de lignification [12,18,29].
43
Figure 9 : Structure supposée d’une lignine de hêtre (d’après Killops et Killops
[9]).
Par contre, la paroi cellulaire des mousses de type sphaignes est recouverte de polymères phénoliques amorphes, structurellement et fonctionnellement similaires à la lignine (à base de phénylpropanes) [16]. Ces polyphénols constituent une barrière physique contre les agressions extérieures
[30]. De plus, quand ils se décomposent, ces composés donnent des monomères tels que l’acide sphagnique (Figure 10) [31,32]. L’acide sphagnique est considéré
comme un inhibiteur de l’activité enzymatique extracellulaire, particulièrement en conditions anaérobies [29].
44
Figure 10 : Acide sphagnique [33].
I. 5. Tannins
Les tannins sont des polyphénols présents dans de nombreux végétaux. Ils sont quantitativement moins importants que la lignine [9], mais jouent un rôle important de défense contre les organismes phytophages [34]. Les unités structurales des tannins sont les acides polyhydroxyaromatiques tels que l’acide gallique et l’acide ellagique (Figure 11). Comme la lignine, la structure des tannins est liée à des sources botaniques spécifiques, ce qui permet d’avoir des indices sur l’origine de la végétation d’un sol et sur son fonctionnement [35,36].
Acide gallique Acide ellagique
Figure 11 : Structure des monomères des tannins
I. 6. Cutine et subérine
La cutine et la subérine sont des polyesters qui, en association avec les cires, composent l’enveloppe protectrice des plantes. Ces macromolécules sont constituées, en majorité, par des acides et des hydroxyacides liés par des liaisons
45
esters, et des modèles pour ces polymères ont déjà été proposés (Figure 12). Ses motifs sont analysés dans les sols et les sédiments après dégradation chimique ou thermique [37–40].
Les cutines sont composées d’acides carboxyliques, d’hydroxy- et d’époxy-acides, en C16 et C18 (Figure 13). Elles constituent, associées aux cires et aux
graisses, la cuticule qui est la couche externe protectrice des organes aériens des végétaux et de certains animaux.
La subérine est un constituant des parois cellulaires du bois et le composé principal du liège et est aussi présente dans les parties souterraines des plantes. Contrairement à la cutine, les principaux monomères de la subérine sont à longue chaîne carbonée (C20-C30) et en particulier des alcan-1-ols, des acides gras,
des ɷ-hydroxyacides gras et des ,ɷ-diacides gras de longueur de chaîne C16 ou
C18. Elle contient également des composés phénoliques et notamment des acides
hydroxycinnamiques [37,41].
46
Principaux monomères aliphatiques de la cutine
Famille C16 Famille C18 Principaux monomères aliphatiques
de la subérine
m= 18-30 n= 14-20
y= 3, 4, 5 ou2 x+y= 10
Figure 13 : Structure des monomères aliphatiques de la subérine et la cutine [37].
II
. Techniques d’analyse de la matière organique
De nombreuses approches analytiques sont utilisées pour l’analyse qualitative et quantitative de la structure et de la nature moléculaire de la MO dans les sols et les sédiments.
Cette partie présente les méthodes d’analyses les plus fréquemment utilisées pour la MO des sols et des sédiments et/ou pour des fractions qui la compose. La première partie (partie II.1) s’attache à décrire les principales techniques qui permettent une caractérisation globale (quantité totale, élémentaire, groupements fonctionnels). La seconde partie présente les méthodologies de dégradations chimiques (partie II.2) et thermiques (partie II.3) de la MO utilisées dans le cadre d’une approche moléculaire.
II. 1. Analyses globales
II.1. 1. Perte au feu
La perte au feu (Loss on ignition, LOI) est une méthode utilisée pour déterminer la quantité totale de la MO dans les sols et les sédiments. Elle permet
47
de mesurer directement la quantité de la MO dans un échantillon solide par différence de masse avant et après calcination à une température dépendante de la nature de l’échantillon (sol agricole, sédiment …). Une étape de séchage préalable est normalement effectuée à 105 oC pendant 12 à 24 heures [42]. Pour
les sols, la température de calcination est de 375 oC à 450 oC [43].
Pour les sédiments, le LOI a été largement utilisée pour estimer la quantité de la MO et des carbonates [42,44,45]. Dans une première réaction, la MO est oxydée à 500-550 oC pour donner du CO2 et des cendres [46,47]. Dans la
deuxième réaction, le CO2 provient des carbonates à 900-1000 oC [42]. Le temps
de calcination peut varier d’une à quatre heures [42,48,49]. La perte de masse durant ces réactions est facilement mesurée par pesage de l’échantillon avant et après le chauffage [44,45]. Dean [45], montre que le LOI possède une précision comparable à des méthodes plus sophistiquées.
II.1. 2. Analyse élémentaire
L’analyse élémentaire, couramment utilisée pour les MOS [50,51] et les kérogènes [52], permet l’obtention des rapports C/N, C/H et O/C.
Le rapport C/N a pu être utilisé comme indicateur de l’activité microbienne dans les sols [53,54]. Kuhry et Vitt [55] ont montré que la diminution de C/N indique une augmentation de la décomposition. D’autres études ont utilisées ce rapport comme indicateur de source. La MO des tissus des plantes supérieures est riche en lignine, tannins, hémicellulose, cellulose et cutine ayant pour conséquence de forts rapports C/N, de l’ordre de 20-500 [56]. Des valeurs entre 4 et 10 ont aussi été rapportées pour le phytoplancton [57]. Les valeurs les plus basses (<5) sont rencontrées dans des sédiments pauvres en carbone organique (<0,3%) où la majorité de l’azote est sous forme inorganique. De faibles valeurs peuvent aussi indiquer une contribution du phytoplancton d’eau douce dans les sédiments marins [58]. Lors de la diagenèse précoce, la plus forte labilité des composés azotés, comme les protéines, conduit généralement à une augmentation
48
du rapport C/N [59]. Le C/H est un indicateur de l’importance relative de la part
de composés aromatiques. Le O/C est considéré comme indicateur des acides carboxyliques et des sucres [60].
Zaccone et al. [60] ont utilisé ces rapports dans une tourbière afin de délimiter les trois couches écologiques qui la composent : (a) une zone supérieure aérée dans laquelle les molécules sont moins complexes (faible C/H) et lentement dégradables (fort C/N), (b) une zone profonde anoxique ou faiblement oxygénée du fait que c’est une zone immergée dans l’eau. Cette partie montre un faible C/N et un fort C/H, le dernier, indiquant une augmentation possible de l’aromaticité (durant le processus d’humification par exemple) ; (c) une zone intermédiaire de transition dans laquelle les rapports C/N et C/H diminuent par rapport à la zone supérieure et inférieure.
Ces différents rapports ont aussi été utilisés au sein de tourbières comme indicateurs de changement de végétations et/ou décomposition aérobique suivant la variation du niveau de l’eau [61]. Le C/N diminue avec la décomposition, mais varie aussi d’une végétation à une autre (sphaignes ou plantes vasculaires) [62]. Biester et al. [61] ont montré une variation du C/N entre une végétation en sphaignes (≈ 41) et des plantes vasculaires (de 28 à 37). Schmidt et al. [63] ont montré une variation de C/N d’un site de tourbière à un autre, ce qui est dûe à une variation du taux d’azote atmosphérique et la capacité des sphaignes à le fixer [64]. D’autre part, le ratio O/C est élevé dans les sections où la décomposition est faible et où sont présentes des molécules telles que les polysaccharides [61]. D’autre part, ce ratio est plus élevé dans les niveaux où des débris de sphaignes se sont accumulés [61].
II.1. 3. Spectroscopie infrarouge
La spectroscopie infrarouge par transformée de Fourrier (FTIR ; nombre d’onde de 400 à 4000 cm-1) permet l’analyse qualitative des groupements
49
fonctionnels (Tableau 2). La spectroscopie FTIR reste d’une utilisation simple et rapide [65].
Tableau 2 : Attribution des bandes infrarouge [65,66].
Nombre d’onde Vibration Groupement fonctionnel
3670-3300 O-H Groupement hydroxyl
3450-3300 -OH -NH (mineur) - 3077-3030 -CH Aromatiques 2950-2850 -CH -CH, CH2, CH3 aliphatique
2500-1850 COO- Ions carboxyles
1725-1710 C=O Acides carboxyliques, aldéhydes et
cétone
1725-1640 C=O Acides carboxyliques
1640-1585 C=O Composés cycliques et acycliques
1620-1600 C=C Produits aromatiques 1540-1510 N-H C=N Amide II C=C Produits aromatiques 1470-1420 C-H Composés aliphatiques 1400-1390 -OH C-O Composés phénoliques C-H Composés aliphatiques 1260-1200 C-O -OH Acide carboxylique
C-O Esters aromatiques et phénols
1170-1120 C-OH Alcool aliphatique
1090-1040 C-O Alcool, polysaccharides
975-775 C-H Composés aromatiques
880-750 -OH Composés carboxyliques
Cette technique a été couramment utilisée pour l’analyse des fractions solubles (fractions humiques) des MOS [67,68]. Appliquée à des échantillons d’une tourbière minérotrophe, l’analyse par spectroscopie FTIR a permis de mettre en évidence des pics d’absorbance caractéristiques des alcools, hydrocarbures aliphatiques, acides carboxyliques et des polysaccharides (Figure
50
14). Dans le cas d’une tourbière ombrotrophe les bandes supplémentaires, correspondantes à des structures aromatiques et à des alcènes, ont été identifiées (Figure 15) [67]. Ces résultats montrent que le degré de décomposition élevé d’une tourbière minérotrophe simplifie le spectre infrarouge (IR) montrant simplement les structures moléculaires ayant résistées à la dégradation lors de la décomposition de la MO. O-H Alcools C-H Hydrocarbures aliphatiques C=O Acides carboyxliques C-O Polysaccharides 4000 3500 3000 2500 2000 1500 1000 500 0,05-0,10 0,35-0,40 0,40-0,45 0,70-0,75 2,35-2,40 Longueur d’onde, cm-1
51 O-H Alcools C-H Hydrocarbures aliphatiques C=O Acides carboyxliques C-O Polysaccharides 4000 3500 3000 2500 2000 1500 1000 500 0,05-0,10 1,00-1,05 2,00-2,05 3,00-3,05 3,45-3,5 Longueur d’onde, cm-1 C=C Benzène C-O Carboxyl C=C Alcènes
Figure 15 : Spectre IR d’une tourbière ombrotrophe d’après Krumins et al. [65]. II.1. 4. Résonance magnétique nucléaire
La spectroscopie de résonance magnétique nucléaire (RMN) du carbone 13C
en phase solide permettent d’identifier les fonctions carbonées présentes dans la MO et sont couramment utilisées (Tableau 3). Pour une analyse en RMN d’un échantillon solide, il est essentiel d’effectuer un couplage à la technique de l’angle magique de spin (MAS), afin de compenser l’anisotropie des échantillons solides.
Avec ce couplage, la rotation d'un échantillon s’effectue autour d'un axe particulier, l'angle magique, et permet l'obtention de spectres résolus [69].
Tableau 3 : Attribution des déplacements chimiques en RMN 1H [70] et 13C du
solide [71,72]. Type de proton Déplacements chimiques (ppm) Attribution 1H 0 - 2,5 H aliphatiques
2,6 – 4,5 hydrate de carbone, alcools, esters, amines
5,8 – 9,5 H aromatiques
13C 0 – 25 Groupement methyle terminal

![Figure 9 : Structure supposée d’une lignine de hêtre (d’après Killops et Killops [9])](https://thumb-eu.123doks.com/thumbv2/123doknet/7894252.264345/44.892.239.687.103.698/figure-structure-supposée-lignine-hêtre-killops-killops.webp)
![Figure 13 : Structure des monomères aliphatiques de la subérine et la cutine [37].](https://thumb-eu.123doks.com/thumbv2/123doknet/7894252.264345/47.892.106.791.110.409/figure-structure-monomères-aliphatiques-subérine-cutine.webp)
![Figure 14 : Spectre IR d’une tourbière minérotrophe d’après Krumins et al. [65].](https://thumb-eu.123doks.com/thumbv2/123doknet/7894252.264345/51.892.137.758.318.663/figure-spectre-ir-tourbière-minérotrophe-krumins-al.webp)
![Figure 15 : Spectre IR d’une tourbière ombrotrophe d’après Krumins et al. [65].](https://thumb-eu.123doks.com/thumbv2/123doknet/7894252.264345/52.892.141.758.103.440/figure-spectre-ir-tourbière-ombrotrophe-krumins-al.webp)