UNIVERSITE DE PICARDIE JULES VERNE UFR de Médecine d’Amiens
Année 2020 N°2020-68
EVALUATION DES PERFORMANCES DE LA TEP-18FDG AVEC
DETECTEURS AU SILICIUM POUR LE DIAGNOSTIC
D’ENDOCARDITE INFECTIEUSE : EXPERIENCE AMIENOISE
THESEPrésentée et soutenue publiquement le 3 Juillet 2020 Pour obtenir le diplôme d’Etat de
DOCTEUR EN MEDECINE DES Médecine Nucléaire
Par
Romain GALAN
Président du jury :
Monsieur le Professeur Marc-Etienne MEYER
Membres du jury :
Monsieur le Professeur Christophe TRIBOUILLOY Monsieur le Docteur Jean-Philippe LANOIX
Monsieur le Docteur Cédric RENARD
Directrice de thèse :
2
DEDICACES ET REMERCIEMENTS
Monsieur le Professeur Marc-Etienne MEYER
Professeur des Universités – Praticien Hospitalier (Médecine nucléaire et traitement d’image)
Chef du service de médecine nucléaire et traitement de l’image Pôle Imagerie
Vous me faites l’honneur de juger ce travail et de présider ce jury. Soyez assuré de mon profond respect pour votre travail au sein du service de Médecine Nucléaire. Je tiens à vous remercier pour votre gentillesse et vos grandes qualités humaines.
Monsieur le Professeur Christophe TRIBOUILLOY
Professeur des Universités – Praticien Hospitalier (Cardiologie)
Chef du Pôle « Cœur – Thorax – Vaisseaux »
Vous me faites l’honneur de juger ce travail et de participer à ce jury de thèse.
Je vous prie d’accepter mes plus sincères remerciements et l’expression de ma grande admiration pour vos accomplissements dans le domaine de la Cardiologie.
Madame le Docteur Isabelle EL ESPER
Maître de Conférences des Universités – Praticien Hospitalier (Médecine nucléaire)
Vous m’avez fait l’honneur de diriger ce travail. Je vous remercie pour votre aide incommensurable et vos remarques d’une justesse à toute épreuve. Merci pour votre gentillesse, votre rigueur et votre bienveillance au cours de ces quatre dernières années.
Monsieur le Docteur Jean-Philippe LANOIX
Maître de Conférences des Universités – Praticien Hospitalier (Maladies infectieuses et tropicales)
Vous me faites l’honneur de juger ce travail et de participer à ce jury de thèse.
Soyez assuré de ma grande considération pour l’ensemble de vos travaux relatifs à l’Infectiologie.
Monsieur le Docteur Cédric RENARD
Praticien Hospitalier
(Imagerie et Radiologie Médicale)
Vous me faites l’honneur de juger ce travail et de participer à ce jury de thèse.
Veuillez trouver ici l’expression de ma reconnaissance pour votre accessibilité et les connaissances en imagerie que j’ai acquises à vos côtés.
3 A ma famille
Merci à ma mère, qui a toujours été là pour moi, à nous tirer vers le haut avec ma sœur et mon frère, à stimuler notre curiosité, et à nous soutenir tout ce que nous avons entrepris depuis tout petit.
Merci à mon père, force tranquille de la famille, bourreau de travail, modèle de sérénité et qui nous montre à tous chaque jour qu’il faut avant tout être heureux dans la vie.
Merci à Agathe, amour de ma vie, je suis tellement fier toi ; nous allons enfin pouvoir laisser derrière nous ces longues années d’études, résolument tournés vers un avenir serein et radieux.
Merci à ma sœur et mon frère, avec qui je n’ai pas toujours rendu la vie facile à nos parents étants enfants ; je suis extrêmement fier en repensant à tout le chemin que nous avons parcouru : toi Corentin, l’ainé, qui a eu la lourde tâche d’être le modèle à suivre, maintenant père accompli, et toi Emilie, la touche-à-tout passionnée par tant de choses et pleine d’audace.
Merci à Marie, tu es ma belle-sœur préférée, maman investie à plein temps pour élever ses deux jeunes pousses ; Robin et Garance, tonton est fier de ce que vous devenez, j’attends de pied ferme vos propres thèses dans 30 ans !
Merci à Papi Paul et Mamie Lydie, soutiens indéfectibles et ravitailleurs hors pair.
Merci à Mamie Line, soutien indéfectible, infatigable, qui plie souvent, mais ne rompt pas ! Merci à Papi Emile, je pense fort à toi là où tu es.
Merci à mes oncles, tantes, cousins et cousines, à qui je pense fort.
Merci à Michèle, pour tous ces week-ends compiégnois agrémentés de bons repas revigorants nous ayant permis de recharger les batteries ces quatre dernières années.
4 A mes amis
Merci à Adrian et Sébastien, mes sincères amis, compagnons d’aventure, de Seignosse à la Patagonie.
Merci à Pierre, mon « frère », compagnon d’externat, de tennis et de guitare, quoi doit être si bien à l’ombre des pins attendant que l’heureuse nouvelle arrive.
Merci également à Charles et Clémence, pour cet externat de folie passé auprès de vous. Merci à Florent, compagnon de fraternité de médecine, une force tranquille bourrée de gentillesse et d’intelligence.
Merci à Pierrick, sans qui je n’aurais pas appris l’anatomie dès le lycée.
Merci à Madame Michelli, qui a su m’intéresser aux sciences de la vie et qui a pu motiver des générations d’agenais vers la voie médicale.
Merci à Adrien, pour nos intenses parties de tennis et nos (trop ?) nombreux restaurants américains.
Merci à mes co-internes Trevor, Etienne, Pauline et Inès, une équipe de choc, je ne vous oublierai jamais.
Merci à Bastien, Ozaire et Simon, en mémoire de nos journées TEP mélodieuses. Une pensée également pour mes nouveaux co-internes rouennais très sympathiques.
Merci à Julie et Albane pour votre bienveillance et votre confiance, j’ai tant appris auprès de vous.
Merci à Chalabia, joie de vivre incarnée, tu es arrivée avec ta volonté et ta bonne humeur au moment où le service en avais le plus besoin.
Merci à Florian pour toutes les connaissances que tu m’as transmises.
Merci à Véronique, pour votre gentillesse et vos connaissances transmises durant le début de mon internat.
Merci à Lazhar pour tout ce que vous m’avez transmis, tout le monde vous regrette.
Merci à Pascal et Roger, pour toute l’aide que vous m’avez apportée durant cette fin d’internat.
Merci à Nicolas notre radiopharmacien pour ta bienveillance, pour toutes les fois où tu as accepté mes prescriptions en urgence.
Merci à toute l’équipe du service de médecine nucléaire du CHU d’Amiens : Sophie, Fanny, Pascale, Marie-Christine, Florence, Anita, Elsa, Corinne, Sophie, Robin, Mathilde, Mimi, Claudette, Benoît, Xavier, Carole, Brenda, Marie-Paule, Zaza, Mathieu, Simon, Eric, Caroline, Laurens, Bruno et bien sûr Nono.
5
Liste des abréviations :
Par ordre alphabétique,
ACC : American College of Cardiology, ou Collège Américain de Cardiologie AHA : American Heart Association, ou Association Américaine du Cœur
ASNC : American Society of Nuclear Cardiology, ou Société Américaine de Cardiologie Nucléaire CHU : Centre Hospitalo-Universitaire
DAI : défibrillateur automatique implantable DES : dispositif d’électrostimulation
EI : endocardite infectieuse
ESC : European Society of Cardiology, ou Société Européenne de Cardiologie ETO : échographie trans-œsophagienne
ETT : échographie trans-thoracique
18F : fluor 18
FDG : fluorodésoxyglucose
HMPAO : hexa-méthyl-propyl-amineoxime IC : intervalle de confiance
IgG : immunoglobuline de type G IMC : indice de masse corporelle
IRM : imagerie par résonnance magnétique
OSEM : ordered subset expectation maximization, ou maximisation des attentes de sous-ensemble ordonné
PDL : produit dose longueur PCR : polymerase chain reaction
PET : positron emission tomography, ou tomographie par émission de positon (TEP) PM : pacemaker, ou stimulateur cardiaque
PMT : tube photomultiplicateur
SiPM : silicon photomultiplier, ou photodiode à base de silicium
SNMMI : Society of Nuclear Medicine and Molecular Imaging, ou Société de Médecine Nucléaire et d’Imagerie moléculaire
SCCT : Society of Cardiovascular CT, ou Societé du Scanner cardiovasculaire
TAVI : transcatheter aortic valve implantation, ou implantation d’une valve aortique par voie percutanée
TDM : tomodensitométrie
TEMP : tomoscintigraphie par émission monophotonique
TEMP-TDM : tomoscintigraphie par émission monophotonique – tomodensitométrie TEP : tomographie par émission de positons
TEP-FDG : tomographie par émission de positons au fluorodésoxyglucose TEP-TDM : tomographie par émission de positons - tomodensitométrie TOF : time of flight, ou temps de vol
6
SOMMAIRE
1 INTRODUCTION ... 8
1.1 Contexte ... 9
1.2 L’appareil valvulaire cardiaque ... 9
1.3 Le matériel intra-cardiaque ... 10
1.3.1 Les dispositifs d’électrostimulation ... 10
1.3.1.1 Les stimulateurs cardiaques ... 11
1.3.1.2 Les défibrillateurs automatiques implantables ... 11
1.3.2 Les prothèses valvulaires... 11
1.3.2.1 Les prothèses valvulaires mécaniques ... 11
1.3.2.2 Les prothèses valvulaires biologiques... 12
1.3.2.3 Les TAVI ... 12
1.3.3 L’intervention chirurgicale de Bentall ... 12
1.4 L’endocardite infectieuse... 13 1.4.1 Epidémiologie ... 13 1.4.2 Physiopathologie ... 14 1.4.3 Présentation clinique ... 14 1.4.4 Biologie ... 15 1.4.5 Imagerie ... 15 1.4.5.1 Echocardiographie ... 15 1.4.5.2 Scanner cardiaque ... 16
1.4.5.3 Scintigraphie aux leucocytes marqués : ... 17
1.4.6 Traitement ... 17
1.4.7 Critères diagnostiques ... 17
1.4.7.1 Critères de Duke modifiés... 17
1.4.7.2 Critères révisés de l’ESC 2015 ... 18
1.5 La TEP au 18F-fluorodésoxyglucose couplée à la TDM ... 20
1.5.1 Principe général de la TEP ... 20
1.5.2 Rayonnement β+ ... 20 1.5.3 Les détecteurs ... 21 1.5.4 Reconstruction ... 21 1.5.5 Quantification ... 22 1.5.6 Tomodensitométrie ... 23 1.5.7 Irradiation ... 23 1.5.8 Le fluorodésoxyglucose ... 23
7
1.5.8.1 Métabolisme, répartition et élimination physiologique ... 24
1.5.8.2 En cas d’infection bactérienne ... 24
2 MATERIEL ET METHODES ... 25
2.1 Population ... 25
2.2 Protocole de réalisation de l’examen ... 26
2.3 Caractéristiques de la TEP-TDM... 26
2.4 Interprétation des images ... 27
2.5 Evaluation des performances et de l’impact thérapeutique de la TEP-FDG ... 28
3 RESULTATS ... 29
3.1 Population ... 29
3.2 Résultats de la TEP-FDG ... 32
3.3 Classification selon les critères de Duke modifiés ... 32
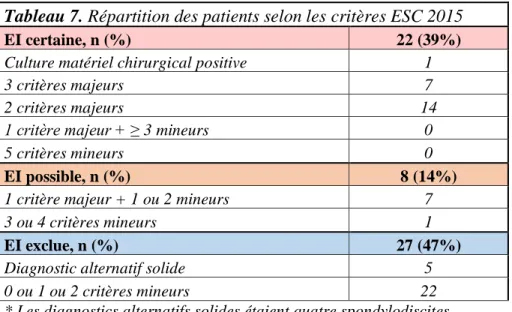
3.4 Classification selon les critères révisés de l’ESC 2015 ... 33
3.5 Diagnostic retenu par le médecin clinicien spécialiste ... 33
3.6 Performances de la TEP-FDG ... 34
3.6.1 Performances diagnostiques globales ... 34
3.6.2 Performances diagnostiques en fonction du matériel ... 36
3.7 Suppression de la fixation myocardique physiologique : ... 39
4 DISCUSSION ... 41
4.1 Revue de la littérature ... 41
4.2 Intérêt de l’ajout de la TEP-FDG aux critères de Duke modifiés ... 42
4.3 Analyse des TEP-FDG discordantes par rapport au diagnostic final ... 42
4.3.1 Faux négatifs : ... 42
4.3.1.1 Petite taille des lésions ... 42
4.3.1.2 La fixation myocardique résiduelle gênant l’interprétation ... 43
4.3.1.3 La stérilisation par l’antibiothérapie ... 43
4.3.2 Faux positifs : ... 43
4.4 Analyse critique des méthodes employées ... 44
5 CONCLUSION – PERSPECTIVES ... 47
6 Annexes ... 48
7 Résumé ... 49
8
LISTE DES DOCUMENTS
Figure 1. (Annexe). Algorithme diagnostique d’une suspicion d’EI valvulaire.
Figure 2. (Annexe). Algorithme diagnostique d’une suspicion d’infection sur dispositif d’électrostimulation.
Figure 3. Coupe du cœur passant par les quatre orifices.
Figure 4. Photographies d’un modèle de stimulateur cardiaque et d’un modèle de DAI. Figure 5. Photographies d’un modèle de prothèse mécanique à double ailettes et d’un modèle de bioprothèse.
Figure 6. Photographie de deux modèles de bioprothèse TAVI.
Figure 7. Schéma d’une intervention de Bentall et photographie du matériel.
Figure 8. Principe de l’émission d’un positon et de la détection des deux photons gamma générés au cours du processus d’annihilation. Les détecteurs sont placés en couronne autour de la source.
Figure 9 : Schéma représentant le principe de la TEP. Figure 10. Diagramme de flux.
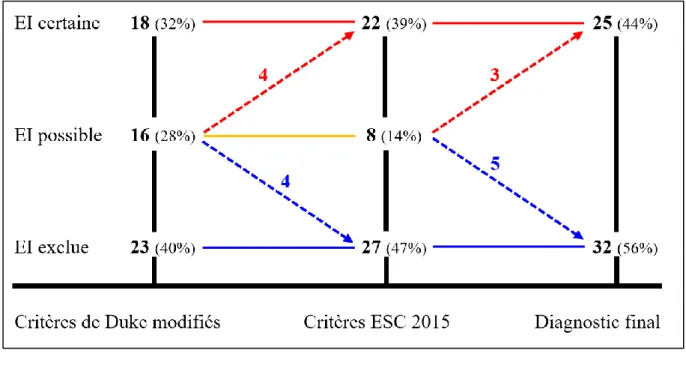
Figure 11. Diagramme de flux du classement des TEP-FDG selon les critères de Duke modifiés, les critères ESC 2015 et le diagnostic final.
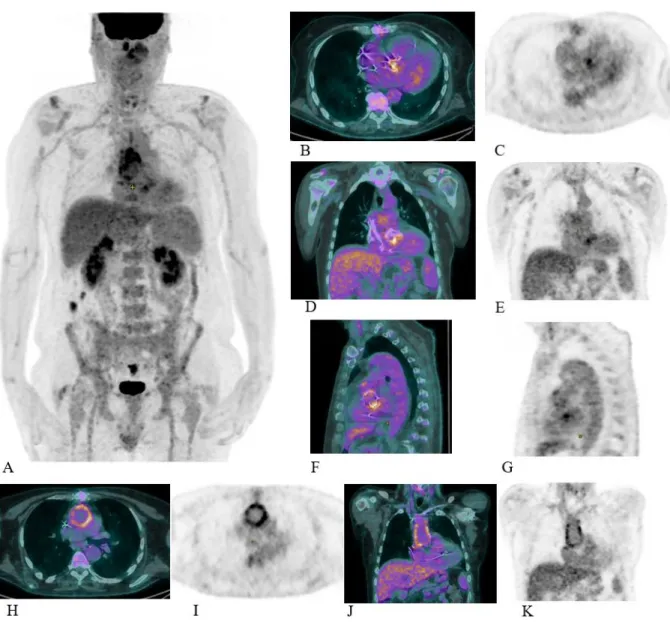
Figure 12. TEP-FDG d’un patient avec EI mitrale native.
Figure 13. TEP-FDG d’un patient avec EI sur bioprothèse aortique. Figure 14. TEP-FDG d’un patient avec EI sur sonde de DAI.
Figure 15. Images multiplanaires TEP-TDM de trois patients avec différentes intensités de fixation myocardique résiduelle.
Tableau 1. Cardiopathies à risque d’endocardite infectieuse.
Tableau 2. Critères de Duke proposés par Durack et al. en 1994 et modifiés par Li et al. en 1999 pour le diagnostic d'endocardite infectieuse (EI).
Tableau 3. Critères modifiés de la Société Européenne de Cardiologie (ESC) 2015 pour le diagnostic d'endocardite infectieuse.
Tableau 4. Définition de l’EI selon les critères de Duke modifiés par Li et al. Tableau 5. Caractéristiques des patients.
Tableau 6. Répartitions des patients selon les critères de Duke modifiés. Tableau 7. Répartition des patients selon les critères ESC 2015.
Tableau 8. Décision du médecin clinicien en charge du dossier.
Tableau 9. Performances diagnostiques de la TEP-FDG pour le diagnostic d’EI. Tableau 10. Performances diagnostiques de la TEP-FDG pour l’EI prothétique. Tableau 11. Performances diagnostiques de la TEP-FDG pour l’EI sur sonde d’électrostimulation.
9
1 INTRODUCTION
1.1 Contexte
L’endocardite infectieuse (EI) est un challenge diagnostique car c’est une pathologie se présentant sous de multiples facettes ; la faible spécificité de la symptomatologie peut amener à un retard au diagnostic et au traitement approprié [1]. Un sur-diagnostic d’EI entraînerait la réalisation d’actes invasifs, potentiellement iatrogènes, tandis qu’un sous-diagnostic serait souvent fatal [2].
La tomographie par émission de positons (TEP) au [18F]-fluorodésoxyglucose (FDG) couplée
à la tomodensitométrie (TDM) est une modalité d’imagerie officiellement intégrée au bilan diagnostique de l’endocardite infectieuse depuis les recommandations de 2015 de la société européenne de cardiologie (ESC 2015) (figure 1 dans la rubrique Annexe) [3]. Jusqu’il y a très peu de temps, elle n’était indiquée que dans le cadre d’une EI valvulaire « possible ou exclue » selon les critères de l’ESC 2015, avec forte suspicion clinique. Un consensus international a récemment proposé en avril 2020 de réaliser une TEP-FDG devant une suspicion d’EI sur sonde de dispositif d’électrostimulation [4] (figure 2 dans la rubrique Annexe) en cas d’hémocultures positives et échocardiographie négative, pour rechercher des localisations infectieuses emboliques extra-cardiaques et pour rechercher une porte d’entrée de l’infection. Cependant la sensibilité de cet examen, en particulier pour le diagnostic d’EI sur sonde d’électrostimulation, n’est pas totalement satisfaisante [4].
Une innovation technologique récente dont est équipé notre système TEP, les photodiodes à base de silicium (SiPM), a nettement accru la sensibilité de détection de la TEP, et semble donc prometteuse quant à l’amélioration des performances de cet examen dans le cadre de la recherche de foyers d’endocardite infectieuse, souvent de très petite taille.
Le but de ce travail était donc d’évaluer les performances du TEP-FDG équipé de photodiodes à base de silicium, dans le diagnostic de l’endocardite infectieuse, et d’évaluer les pratiques du service de médecine nucléaire du CHU Amiens-Picardie dans cette indication.
1.2 L’appareil valvulaire cardiaque
La pompe cardiaque est organisée selon un flux sanguin unidirectionnel à l’aide d’un système valvulaire adapté en valves atrio-ventriculaires (mitrale et tricuspide) et valves artérielles (aortique et pulmonaire) [5].
10
Figure 3. Coupe du cœur passant par les quatre orifices [5].
Les valves atrio-ventriculaires sont constituées d’un anneau, d’un voile et d’un appareil sous-valvulaire, lui-même composé de cordages tendineux et de muscles papillaires (ou piliers). De forme elliptique, le voile de la valve mitrale se divise en valve antérieure (ou grande valve) et valve postérieure (ou petite valve). L’orifice atrio-ventriculaire droit est occupé par l’appareil valvulaire tricuspide, dont le voile est, comme son nom l’indique, divisé en trois feuillets valvulaires.
A l’inverse des valves atrio-ventriculaires, les valves artérielles (aortique et pulmonaire) ne possèdent pas d’appareil sous-valvulaire ; elles possèdent trois valves sigmoïdes s’effaçant au passage du flux systolique ventriculaire, et résistantes aux basses pressions diastoliques. La valve aortique est donc composée de trois valvules dites sigmoïdes, formées par des replis membraneux de forme semi-lunaire insérés sur l’anneau fibreux aortique. La valve pulmonaire, située en avant de la valve aortique, est également composée de trois valvules sigmoïdes semi-lunaires.
1.3 Le matériel intra-cardiaque
Les EI peuvent survenir sur différents types de matériel implantable, tels que les dispositifs d’électrostimulation (stimulateur cardiaque, défibrillateur automatique implantable (DAI)) et les prothèses valvulaires.
1.3.1 Les dispositifs d’électrostimulation
Une infection de dispositif d’électrostimulation (DES) est considérée comme une EI lorsque les portions intravasculaires des sondes sont infectées ; si le boitier ou la portion extravasculaire des sondes est infecté, on parle d’infection de la loge du boitier (profonde ou superficielle).
11 1.3.1.1 Les stimulateurs cardiaques
Ils sont constitués d’un boitier implanté sous la peau du patient au niveau pectoral et de une à trois sondes posées par voie endocavitaire. Il permet de stimuler les contractions myocardiques en imposant un rythme au moyen d’impulsions électriques. La sonde ventriculaire est implantée historiquement à l’apex du ventricule droit ou actuellement au niveau du septum haut de ce ventricule à l’aide d’une vis à son extrémité. L’implantation de la sonde de l’oreillette droite est réalisée dans l’auricule homolatérale et la sonde ventriculaire gauche dans le sinus coronaire [6].
1.3.1.2 Les défibrillateurs automatiques implantables
Ils permettent de détecter la survenue de troubles du rythme ventriculaire graves et de les traiter automatiquement sans intervention extérieure. Ils sont composés d’un boîtier qui enregistre et traite toutes les informations provenant du cœur, et d’une ou plusieurs sondes qui apportent ces informations au boîtier et permettent de délivrer un choc électrique interne si nécessaire.
Figure 4. Photographies d’un modèle de stimulateur cardiaque Medtronic® [7] à gauche et d’un
modèle de DAI Medtronic® [8] à droite.
1.3.2 Les prothèses valvulaires
1.3.2.1 Les prothèses valvulaires mécaniques
Les prothèses valvulaires mécaniques actuelles, à double ailette, autorisent une hémodynamique performante, une faible thrombogénicité et une excellente durabilité [5]. Leur inconvénient majeur reste cependant leur thrombogénicité et la nécessité d’un traitement anticoagulant à vie. Les recommandations européennes suggèrent l’utilisation d’une valve mécanique chez les patients âgés de moins de 60 ans [5].
12 1.3.2.2 Les prothèses valvulaires biologiques
Les bioprothèses ne justifient pas un traitement anticoagulant mais un traitement antiagrégant plaquettaire est indiqué en prévention des évènements thromboemboliques. La détérioration structurelle représente le problème majeur des bioprothèses. Les recommandations européennes suggèrent l’utilisation d’une bioprothèse chez les patients âgés de plus de 65 ans [5].
Figure 5. Photographies d’un modèle de prothèse mécanique à double ailettes SJM® [5] à gauche et
d’un modèle de bioprothèse Carpentier-Edwards Perimount® [5] à droite.
1.3.2.3 Les TAVI
Le remplacement valvulaire aortique par méthode de cathétérisme (TAVI pour Transcatheter Aortic Valve Implantation) a été développé au début des années 2000. Il est indiqué chez les patients pour qui la chirurgie conventionnelle est contre-indiquée ou jugés à haut risque [5].
Figure 6. Photographie de deux modèles de bioprothèse TAVI [5].
1.3.3 L’intervention chirurgicale de Bentall
Elle consiste en un remplacement complet de la racine aortique par un tube monté sur une valve mécanique ou biologique, avec réimplantation des artères coronaires selon la technique décrite par De Bono et Bentall en 1968 [9]. Cette intervention est indiquée pour des anévrysmes de l’aorte ascendante (retrouvés notamment dans le syndrome de Marfan) [5].
13
Figure 7. Schéma d’une intervention de Bentall et photographie du matériel [5].
1.4 L’endocardite infectieuse
L’endocardite infectieuse (EI) se définit par la colonisation de l’endocarde par un micro-organisme pathogène (souvent bactérien). L’EI n’est pas une maladie unique mais plutôt un ensemble de maladies aux présentations cliniques variées, dépendant du germe responsable, de la localisation de l’atteinte infectieuse et de la cardiopathie sous-jacente ; c’est une pathologie multidisciplinaire faisant intervenir cardiologues, infectiologues, chirurgiens cardiaques, radiologues, médecins nucléaires mais aussi d’autres spécialistes en fonction de la localisation d’éventuels emboles.
1.4.1 Epidémiologie
Ni l’incidence (autour de 30 cas par million d’habitants et par an dans les études en population générale conduites dans les pays occidentaux [10]) ni la mortalité (mortalité intra-hospitalière globale de 22,7% en France en 2008 [11]) de l’EI n’ont diminué ces dernières années ; il existe une prédominance masculine nette (incidence annuelle en France en 2008 de 51 cas par million chez les hommes, contre 16 chez les femmes [11]), cependant les femmes atteintes semblent présenter un plus mauvais pronostic. Le pic d’incidence annuelle monte à environ 200 cas par million d’habitants en France chez les hommes entre 75 et 79 ans [11]. Le profil épidémiologique de l’EI s’est considérablement modifié ces dernières années [12] avec notamment l’augmentation du nombre de matériels intracardiaques implantés et surtout l’importante augmentation de la fréquence des endocardites nosocomiales en rapport avec la multiplication des gestes invasifs à risque de bactériémie (les EI nosocomiales représentent ainsi 26,7 % des cas d’EI en France en 2008 [11]). En France, le Staphylococcus aureus est devenu le germe le plus fréquent (26,6% des cas d’EI en 2008), associé à un pronostic péjoratif [11].
14
1.4.2 Physiopathologie
Deux principaux facteurs sont nécessaires pour l’installation et la pérennisation d’une endocardite :
- une bactériémie
- une valvulopathie ou une cardiopathie à risque entraînant des lésions de jet sur l’endocarde (tableau 1).
Tableau 1. Cardiopathies à risque d’endocardite infectieuse [13]
Cardiopathies à haut risque Cardiopathies à risque moins élevé - Prothèse valvulaire (mécanique,
homogreffe ou bioprothèse)
- Cardiopathie congénitale cyanogène non opérée ou avec shunts résiduels, dérivation chirurgicale ou conduit prothétique, matériel prothétique implanté chirurgicalement ou par voie percutanée (pendant les 6 mois qui suivent si correction complète)
- Antécédent d’endocardite infectieuse
- Valvulopathies : insuffisance aortique, insuffisance mitrale, rétrécissement aortique, prolapsus de la valve mitrale avec
insuffisance mitrale et/ou épaississement valvulaire
- Bicuspidie aortique
- Cardiopathie congénitale non cyanogène sauf communication interauriculaire - Cardiomyopathie hypertrophique obstructive (avec souffle à l’auscultation)
La colonisation de l’endocarde aboutit :
- aux végétations : ce sont les lésions les plus caractéristiques de l’endocardite, appendues aux feuillets valvulaires, aux cordages ou sur la berge d’une communication interventriculaire ; elles sont composées de germes, de fibrine et de leucocytes.
- à des mutilations valvulaires (perforations) ou à des ruptures de cordages Dans la majorité des cas, la résultante des lésions est une fuite valvulaire.
1.4.3 Présentation clinique
L’EI peut être suspectée devant un grand nombre de situations cliniques différentes : insuffisance cardiaque, accident vasculaire cérébral, fièvre isolée ou infection de loge de pacemaker par exemple. La présentation clinique peut être très brutale (choc cardiogénique, choc septique) ou plus insidieuse (fièvre intermittente, spondylodiscite).
15 Les signes extra-cardiaques de l’EI sont très fréquents et traduisent à la fois son caractère systémique et la fréquence de ses complications emboliques. Les manifestations cutanées sont fréquentes, et les plus spécifiques sont les « faux panaris d’Osler », nodosités rougeâtres siégeant au niveau de la pulpe des doigts ou des orteils ; l’hippocratisme digital est relativement fréquent ; le purpura pétéchial est fréquent mais peu spécifique. En outre, on peut observer au fond d’œil des hémorragies et des exsudats (taches de Roth). Enfin, les manifestations articulaires sont fréquentes et le diagnostic d’EI doit particulièrement être évoqué devant la présente d’une spondylodiscite [14].
1.4.4 Biologie
Une hyperleucocytose et/ou l’élévation de la protéine C-réactive (CRP) sont fréquemment observées au cours de l’EI et sont utiles au suivi sous traitement antibiotique.
Les hémocultures sont un des éléments diagnostiques décisifs ; elles doivent être pratiquées par prélèvement veineux direct, en évitant la contamination par un cathéter de perfusion, de préférence avant toute antibiothérapie, ou bien après une fenêtre thérapeutique de quelques heures à quelques jours, répétées en cas de frissons ou de pics fébriles, cultivées en milieu aérobie et anaérobie de façon suffisamment prolongée pour permettre l’identification de germes à croissante lente ou difficile. Lorsqu’elles sont négatives, elles doivent être complétées par des sérologies voire des PCR.
1.4.5 Imagerie
Le diagnostic d’EI peut faire appel à des imageries morphologiques (échocardiographies transthoracique (ETT) et trans-œsophagienne (ETO), scanner cardiaque) et à des imageries fonctionnelles (scintigraphie aux leucocytes marqués et TEP-FDG) ; nous développerons la TEP-FDG dans le chapitre 1.5).
1.4.5.1 Echocardiographie
A côté des hémocultures, l’échocardiographie occupe une place centrale dans l’EI pour le diagnostic, l’évaluation pronostique et le suivi sous traitement adapté. Trois signes échocardiographiques sont évocateurs d’EI : végétation, abcès péri-valvulaire et apparition d’une régurgitation péri-prothétique [15].
Une végétation est une masse dense, généralement appendue à une structure valvulaire, dont la cinétique est indépendante de la structure à laquelle elle est accrochée. Les végétations
16 valvulaires sont observées à l’échocardiographie dans 50 à 80% des endocardites ; leur apparition peut être retardée par rapport au tableau clinique [16]. Le diagnostic de végétation est évoqué en échocardiographie sur la présence d’échos anormaux denses, vibratiles « chevelus », surajoutés sur la valve, mais ne limitant pas sa cinétique. Les végétations qui ont le plus haut risque emboligène sont celles dont la taille dépasse 10 mm, pédiculées, très mobiles, à localisation mitrale. L’évolution des végétations (diminution de volume sous traitement, disparition en cas de migration, calcification secondaire) peut être suivie en répétant périodiquement l’examen échographique. Le dépistage des petites végétations, inférieures à 3 mm de diamètre, est souvent impossible en échographie trans-thoracique. De même, il est impossible de distinguer une végétation active bactériologiquement d’une végétation stérile [16]. Les végétations anciennes cicatrisées peuvent être difficiles à interpréter dans le contexte d’un nouvel épisode fébrile. Les rares causes de faux positifs sont notamment les remaniements « nodulaires » de la valve (épaississement rhumatismal ou myxoïde, calcifications), les déchirures valvulaires, les végétations non infectieuses (endocardite de Libman-Sacks, endocardite marastique), les tumeurs valvulaires (myxome, papillome, fibrolipome), les strands (petits filaments fins mobiles linéaires appendus aux prothèses mitrales et aortiques, et dans une moindre mesure sur les valves natives), des thrombi, des dépôts fibrineux, des fils de suture prothétique.
L’échocardiographie présente cependant des limitations :
- les résultats douteux ne sont pas rares, en particulier au stade initial de la maladie - en présence de matériels tels qu’une sonde de dispositif d’électrostimulation ou une
prothèse valvulaire, l’échocardiographie a une sensibilité et une spécificité qui sont diminuées [17].
- un examen échocardiographique négatif n’élimine pas une EI et il peut être nécessaire de le répéter.
1.4.5.2 Scanner cardiaque
Au cours des dernières années, les performances du scanner injecté avec synchronisation cardiaque se sont considérablement améliorées, notamment en termes de résolution spatiale et surtout de résolution temporelle, permettant l’acquisition d’images d’excellente qualité, particulièrement utiles pour l’évaluation des complications péri-valvulaires : abcès et pseudo-anévrysmes. Le scanner permet en outre la mise en évidence de lésions emboliques éventuelles et une évaluation coronarienne préopératoire.
Sa principale limitation est la néphrotoxicité des produits de contraste iodés, chez des patients souvent insuffisants rénaux dans ce contexte de suspicion d’EI.
17 1.4.5.3 Scintigraphie aux leucocytes marqués :
La scintigraphie aux leucocytes marqués est comme la TEP-FDG un examen d’imagerie fonctionnelle. Les leucocytes d’un prélèvement sanguin du patient sont isolés des autres lignées sanguines, radiomarqués par de l’111In-oxinate ou du 99mTc-HMPAO, puis réinjectés
au patient. Vingt-quatre heures plus tard, temps nécessaire pour que les leucocytes marqués se localisent sur les éventuels sites infectieux cardiaques et extra-cardiaques, on réalise des images tomoscintigraphiques couplées à la TDM.
La positivité de cet examen est très spécifique d’une infection. Cependant, outre la complexité technique du radiomarquage des leucocytes, sa principale limite est sa résolution spatiale, plus faible que celle de la TEP, entrainant donc une plus faible sensibilité vis-à-vis des petites lésions.
1.4.6 Traitement
Le traitement médical de l’endocardite infectieuse repose sur une antibiothérapie adaptée prolongée. Le recours à la chirurgie est nécessaire dans plus d’un tiers des cas [16]. Les indications chirurgicales sont d’ordre hémodynamique (fuite valvulaire massive entraînant une insuffisance cardiaque sévère ou un choc cardiogénique, végétation valvulaire obstructive cliniquement mal tolérée), infectieux (lésions péri-valvulaires sévères telles qu’un abcès, une fistule ou un faux anévrysme) ou embolique.
1.4.7 Critères diagnostiques
1.4.7.1 Critères de Duke modifiés
En 1994, Durack et al. [18] ont proposé un ensemble de critères diagnostiques, certains « majeurs », d’autres « mineurs » connus sous le nom de critères de Duke, permettant de classer les patients en trois catégories : « EI certaine », « EI possible » et « EI exclue ». Cependant, ces critères initiaux présentaient quelques limites, notamment le fait que le groupe « EI possible » était trop large, et ils ont été modifiés par Li et al. (tableau 2) [19].
Mais même ces critères de Duke modifiés sont imparfaits : un travail portant sur 93 cas d’EI confirmées anatomiquement a montré qu’ils ne classaient pas comme « certaine » 24% des patients [20]. L’échocardiographie et l’hémoculture sont la pierre angulaire du diagnostic de l’EI ; cependant, toutes deux peuvent être faussement négatives à un stade précoce de la maladie et de surcroît ont une sensibilité diminuée en présence de prothèse valvulaire ou de matériel d’électrostimulation [3].
18 1.4.7.2 Critères révisés de l’ESC 2015
A la différence de l’American Heart Association (AHA), la Société Européenne de Cardiologie (ESC) a en 2015 considéré qu’il y avait suffisamment de publications solides concernant l’utilité de la TEP-FDG, de la scintigraphie aux leucocytes marqués et du scanner cardiaque dans le diagnostic d’EI [3] pour les intégrer comme critères « majeurs » aux critères de Duke modifiés.
Selon ces recommandations, la TEP-FDG ou la scintigraphie aux leucocytes marqués ne devraient toutefois être réalisées qu’en cas de suspicion d’EI sur prothèse valvulaire et non en présence d’autre matériel ni en cas d’image douteuse à l’échocardiographie sur une valve native ou ayant bénéficié d’une plastie.
Tableau 2. Critères de Duke proposés par Durack et al. en 1994 [18] et modifiés par Li et al. en 1999 [19] pour le diagnostic d'endocardite infectieuse (EI).
Critères majeurs
1. Hémoculture positive pour une EI
a. Microorganismes typiques cohérents avec une EI dans deux hémocultures séparées : - Streptococci viridans, Streptococcus bovis, groupe HACEK*, Staphylococcus aureus
- Enterococci en l'absence d'un foyer primitif
b. Microorganismes cohérents avec une EI persistant dans des hémocultures répétées de cette manière : - Au moins 2 hémocultures prélevées à plus de 12 heures d'intervalle
- 3 sur 3, ou une majorité sur 4 ou plus hémocultures séparées (avec la première et la dernière hémoculture séparées d'au moins une heure)
c. Une unique hémoculture positive pour Coxiella burnetii ou un titre d'anticorps IgG antiphase I > 1:800
2. Echocardiographie positive pour une EI (ETO recommandée chez les patients porteurs de prothèse valvulaire, classés au moins comme "EI possible" par les critères cliniques, ou une EI compliquée (abcès para-valvulaire) ; ETT en premier lieu chez les autres patients), définie comme suit :
- Masse oscillante intracardiaque sur une valve, un pilier, un cordage, dans la direction d'un jet de régurgitation, ou sur du matériel implanté en l'absence d'explication anatomique alternative
- Abcès
- Apparition d'une déhiscence partielle sur une prothèse valvulaire
3. Mise en évidence anatomopathologique d'une endocardite
4. Apparition d'une régurgitation valvulaire (aggravation ou modification d'un souffle préexistant).
Critères mineurs
1. Prédisposition (cardiopathie à risque préexistante) ; utilisateur de drogues à injection intraveineuse 2. Fièvre (température > 38°C)
3. Manifestations vasculaires : embolie artérielle, infarctus pulmonaire septique, anévrysme mycotique, hémorragie intracrânienne, hémorragie conjonctivale, placard érythémateux palmoplantaire de Janeway
4. Manifestations immunologiques : glomérulonéphrite, faux-panaris d'Osler, taches de Roth, facteur rhumatoïde
5. Hémocultures d'une bactérie cohérente avec une EI mais n'entrant pas dans le cadre du critère majeur ; sérologie positive pour une infection active d'un micro-organisme cohérent avec une EI
*HACEK = Haemophili parainfluenzae/aphrophilus/paraphrophilus/influenzae, Actinobacillus
19 Tableau 4. Définition de l’EI selon les critères de Duke modifiés par Li et al. [3,18,19]
EI certaine
Pathological criteria:
a. Microorganisms demonstrated by culture or histological examination of a vegetation, a vegetation that has embolized, or an intracardiac abscess specimen or
b. Pathological lesions; vegetation or intracardiac abscess confirmed by histological examination showing active endocarditis
Clinical criteria:
a. 2 major criteria or
b. 1 major criterion and 3 minor criteria or c. 5 minor criteria
EI possible
a. 1 major criterion and 1 minor criterion or b. 3 minor criteria
EI rejetée
a. Firm alternate diagnosis explaining evidence of infective endocarditis or
b. Resolution of infective endocarditis syndrome with antibiotic therapy for ≤ 4 days or c. No pathological evidence of IE at surgery or autopsy, with antibiotic therapy for ≤ 4 days or d. Does not meet criteria for possible infective endocarditis, as above
Tableau 3. Critères modifiés de la Société Européenne de Cardiologie (ESC) 2015 pour le diagnostic d'endocardite infectieuse [3]
Critères majeurs
1. Hémoculture positive pour une EI
d. Microorganismes typiques cohérents avec une EI dans deux hémocultures séparées : - Streptococci viridans, Streptococcus bovis, groupe HACEK*, Staphylococcus aureus
- Enterococci en l'absence d'un foyer primitif
e. Microorganismes cohérents avec une EI persistant dans des hémocultures répétées de cette manière : - Au moins 2 hémocultures prélevées à plus de 12 heures d'intervalle
- 3 sur 3, ou une majorité sur 4 ou plus hémocultures séparées (avec la première et la dernière hémoculture séparées d'au moins une heure)
f. Une unique hémoculture positive pour Coxiella burnetii ou un titre d'anticorps IgG antiphase I > 1:800
2. Imagerie positive pour une EI
a. Echocardiographie positive pour une EI : végétation, abcès, pseudo-anévrysme, fistule intra-cardiaque,
perforation valvulaire, anévrysme, nouvelle déhiscence de la prothèse valvulaire
b. Activité anormale péri-prothétique détectée par TEP-TDM au [18F]-FDG (seulement si la
prothèse a été implantée il y a plus de 3 mois) ou par TEMP-TDM aux leucocytes marqués.
c. Mise en évidence par TDM cardiaque de lésions para-valvulaires.
Critères mineurs
6. Prédisposition (cardiopathie à risque préexistante) ; utilisateur de drogues à injection intraveineuse 7. Fièvre (température > 38°C)
8. Manifestations vasculaires : embolie artérielle, infarctus pulmonaire septique, anévrysme mycotique, hémorragie intracrânienne, hémorragie conjonctivale, placard érythémateux palmoplantaire de Janeway
9. Manifestations immunologiques : glomérulonéphrite, faux-panaris d'Osler, taches de Roth, facteur rhumatoïde
10. Hémocultures d'une bactérie cohérente avec une EI mais n'entrant pas dans le cadre du critère majeur ; sérologie positive pour une infection active d'un micro-organisme cohérent avec une EI
*HACEK = Haemophili parainfluenzae/aphrophilus/paraphrophilus/influenzae, Actinobacillus
20
1.5 La TEP au
18F-fluorodésoxyglucose couplée à la TDM
1.5.1 Principe général de la TEP
La TEP est une modalité d’imagerie fonctionnelle permettant d’étudier la répartition d’une molécule dans l’organisme. Afin que la molécule soit détectable, il faut lui adjoindre un atome radioactif, tel le fluor 18, qui émet un rayonnement β+ indirectement détectable par le
tomographe TEP. Différentes molécules sont utilisées selon la pathologie ou l’organe étudié. La molécule vectrice et son atome radioactif forment un couple appelé « radiopharmaceutique » qui est injecté en très faible quantité au patient par voie intraveineuse dans un délai variable avant l’acquisition des images.
1.5.2 Rayonnement β
+Il est constitué d’électrons de charge positive, les positons. Une fois que le positon émis a perdu toute son énergie cinétique, il rencontre un électron et le couple électron-positon disparaît (« s’annihile ») en émettant deux photons qui s’éloignent l’un de l’autre dans deux sens opposés avec une énergie de 511 keV. En plaçant des cristaux détecteurs de part et d’autre du site de l’annihilation, il est possible de le localiser. Selon l’énergie du positon lors de son émission, il parcourt une distance plus ou moins longue, de l’ordre de quelques millimètres, avant de rencontrer un électron. L’image finale représentera donc la distribution des sites d’annihilation, qui n’est pas rigoureusement identique à celle des sites d’émission des positons. Ces quelques millimètres de différence avec l’origine réelle du signal β+
constituent une limite incontournable de la résolution de la technique.
Figure 8. Principe de l’émission d’un positon et de la détection des deux photons gamma générés au
21
1.5.3 Les détecteurs
Le système de détection de la TEP est constitué de blocs de détecteurs arrangés en anneaux. Chaque bloc-détecteur est constitué de cristaux scintillants couplés à un photodétecteur. Les cristaux scintillants sont des milieux denses et transparents, absorbant les photons de haute énergie issus du rayonnement β+ pour les convertir en photons lumineux de basse énergie. Chaque constructeur développe son propre cristal scintillant à base notamment de silicium, d’oxygène, de lutétium, d’yttrium et de cérium.
Les photodétecteurs correspondaient historiquement à un tube photomultiplicateur (PMT) couplé à un étage électronique. Le PMT était composé :
- d’une photocathode convertissant les photons lumineux en électrons - de dynodes multipliant les électrons ainsi créés
- d’une anode transmettant l’impulsion électrique analysable à l’étage électronique. Cependant, les deux handicaps des PMT sont leur encombrement et leur grande sensibilité aux champs magnétiques [22]. Pour les besoins du développement de la TEP couplée à l’IRM, il a fallu utiliser un photodétecteur insensible au champ magnétique : c’est alors qu’ont été créées les photodiodes à avalanche. Cependant, ces photodiodes à avalanche en mode linéaire présentaient des performances inférieures aux PMT (gain modéré, temps de réponse lent). Il a fallu les améliorer : elles désormais utilisées en mode Geiger : ce mode permet d’obtenir un gain élevé, un temps de réponse rapide et également de la technologie du temps de vol dont nous parlerons dans le paragraphe suivant [23]. Le mode Geiger permet qu’une photodiode fonctionne de manière binaire : soit une elle est au repos, soit elle capte un photon et émet une quantité fixe d’électricité. Ce dispositif composé de centaines de cellules photodétectrices est de dimensions très réduites (quelques dizaines de microns de côté). Les photodiodes à avalanche en mode Geiger à base de silicium (SiPM) sont plus sensibles que les photomultiplicateurs : leur sensibilité de détection est accrue [24], le temps mort entre deux détections de photons est grandement réduit [23] et il n’est plus nécessaire d’avoir d’étage électronique associé comme c’est le cas avec un photomultiplicateur [25]. La limite de détection des TEP-TDM équipés de SiPM est légèrement inférieure à 5 mm [26], ce qui pourrait avoir un intérêt dans la détection de foyers infectieux infracentimétriques.
1.5.4 Reconstruction
L’objectif de la reconstruction des images est de retrouver la localisation la plus probable du site de chaque annihilation positon-électron. Les méthodes de reconstructions itératives de type OSEM permettent, après différentes étapes de traitement du signal (corrections d’atténuation, de photons diffusés, de coïncidences fortuites) et en intégrant les informations
22 du temps de vol (TOF ou Time Of Flight) basées sur le décalage temporel de l’arrivée des deux photons d’annihilation sur les détecteurs, d’obtenir rapidement des images de très bonne qualité.
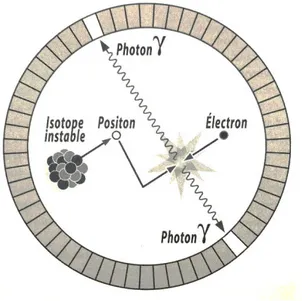
Figure 9 : Schéma représentant le principe de la TEP [27]
A : Désintégration du radio-isotope dans l’organisme du patient avec émission d’un positon qui s’annihile avec un électron en émettant 2 photons gamma à un angle de 180° l’un de l’autre dont l’axe de propagation définit la ligne de réponse des détecteurs.
B : Les photons gamma sont détectés par deux cristaux opposés de l’anneau de détecteurs TEP. C : Reconstruction des images en replaçant dans une matrice l’origine supposée de chaque paire de photons.
D : Transfert et affichage des images sur une console d’interprétation.
1.5.5 Quantification
Les images de TEP représentent une cartographie tridimensionnelle de la concentration du radiopharmaceutique dans l’organisme, s’exprimant en activité volumique tissulaire (becquerel par millilitre). Cette grandeur est dépendante notamment de la dose injectée, c’est pourquoi on lui préfère la « valeur de fixation normalisée » ou standardized uptake value (SUV) qui est calculée de la manière suivante :
SUV = nombre de désintégrations par unité de volume de tissu (Bq/mL) dose injectée (Bq)
poids du patient (g)
En pratique quotidienne, nous utilisons un paramètre quantitatif dérivé de la SUV, la SUVmax, qui correspond à la SUV du voxel le plus intense dans une région définie ; il est le plus utilisé car sa définition et sa mesure sont simples. Cependant, ne se basant que sur un
23 voxel, il est très dépendant des paramètres d’acquisition et de reconstruction et donc peu reproductible entre deux machines différentes.
1.5.6 Tomodensitométrie
De nos jours, l’acquisition des images TEP est systématiquement associée à l’acquisition « simultanée » d’images TDM dans le but d’une part, obtenir des informations morphologiques et une localisation anatomique des foyers hypermétaboliques, d’autre part de faire la correction de l’atténuation des photons gamma en fonction du type de tissu traversé. Sauf exception, les acquisitions TDM sont réalisées sans injection de produit de contraste.
1.5.7 Irradiation
L’irradiation du patient lors d’un examen TEP-TDM correspond à l’énergie déposée dans les tissus biologiques :
- par les positons avant leur annihilation puis par les photons d’annihilation. - par les photons X émis par le tube du scanner.
La dose efficace (au corps entier) résultant de l’administration d’une activité de 3 MBq/kg de FDG chez un patient de 70 kg est d’approximativement 3 mSv.
La dose d’irradiation liée au scanner dépend de la morphologie du patient, des paramètres d’acquisition et du champ exploré ; elle est exprimée par le produit dose absorbée x longueur du champ exploré (PDL). En tenant compte de la radiosensibilité des organes situés dans le champ exploré, on peut, à partir du PDL, estimer la dose efficace. Pour un champ exploré donné, les acquisitions TDM couplées à la TEP sont moins irradiantes que les acquisitions TDM à visée diagnostique, car on ne cherche pas à optimiser la qualité des images. Pour une acquisition base du crâne – racine des cuisses lors d’une acquisition TEP-TDM chez un patient de corpulence moyenne, la dose efficace liée à la TDM est de l’ordre de 7 mSv.
La dose reçue par l’entourage du patient après l’examen est infime, notamment en raison de l’élimination urinaire rapide du FDG et de la décroissance physique du fluor18 ; elle ne justifie aucune précaution particulière.
1.5.8 Le fluorodésoxyglucose
Le fluor 18 est le radionucléide émetteur β+ le plus utilisé, principalement parce que sa demi-vie (110 minutes) est compatible avec un transport du radiopharmaceutique de son site de
24 production jusqu’au service de médecine nucléaire utilisateur, tandis que la plupart des autres radionucléides émetteurs β+ ont une demi-vie de quelques minutes.
Le [18F]-fluoro-2-désoxy-D-glucose (FDG) est obtenu par substitution d’un groupement hydroxyle du désoxyglucose par un atome de fluor 18.
1.5.8.1 Métabolisme, répartition et élimination physiologique
Analogue du glucose, le FDG s’accumule dans les cellules qui utilisent le glucose comme source d’énergie principale. Il traverse la membrane cellulaire de la même façon que le glucose grâce à des transporteurs spécifiques (GLUT), mais ne subit que la première étape de la glycolyse pour donner du fluorodésoxyglucose-6-phosphate qui reste piégé à l’intérieur de la cellule. Comme la déphosphorylation par les phosphatases intracellulaires est un mécanisme lent, le FDG est retenu dans le tissu pendant quelques heures.
La captation du FDG par les tissus périphériques peut résulter :
- d’une part d’un mécanisme non insulino-dépendant, particulièrement au niveau du cerveau et dans les organes riches en macrophages tels que le foie et la rate
- d’autre part d’un mécanisme insulino-dépendant, particulièrement au niveau des muscles (dont le cœur) et du tissu adipeux. Pour cette raison, le patient doit être à jeun au moins six heures avant l’examen afin d’éviter un pic insulinémique et empêcher la captation du FDG par ces tissus ; il est également laissé au repos, sans parler, durant une heure après l’injection du FDG, afin de réduire sa captation par les muscles (dont ceux de la phonation).
L’élimination du FDG est principalement rénale, 20% de l’activité étant excrétée dans les urines dans les 2 heures qui suivent l’injection.
1.5.8.2 En cas d’infection bactérienne
Lors d’une infection, les bactéries sont généralement avides de glucose nécessaire à leur métabolisme : elles ont recours à la fermentation des glucides. Le FDG franchit la membrane bactérienne au moyen de systèmes de transport actif, puis est phosphorylé et reste piégé à l’intérieur de la bactérie. Par ailleurs, grâce à la stimulation des cytokines, les cellules inflammatoires activées au niveau des sites infectieux (macrophages, polynucléaires neutrophiles et lymphocytes) surexpriment le transporteur membranaire du glucose GLUT1 et le FDG s’y accumule [28].
25
2 MATERIEL ET METHODES
Nous avons mené une étude diagnostique rétrospective monocentrique dans le service de médecine nucléaire du CHU d’Amiens portant sur des examens réalisés entre janvier 2018, date du début d’utilisation de la TEP avec détecteurs SiPM dans sa nouvelle version, et février 2020.
2.1 Population
Nous avons analysé le dossier de tous les patients adressés au service de médecine nucléaire du CHU Amiens-Picardie par un spécialiste cardiologue ou infectiologue pour la réalisation d’une TEP-TDM au 18F-FDG dans le bilan de suspicion d’endocardite infectieuse.
Cette suspicion était basée sur :
- une ou plusieurs hémocultures positives chez un patient avec une cardiopathie à risque d’endocardite infectieuse (tableau 1).
- une ou plusieurs hémocultures positives chez un patient porteur de matériel d’électrostimulation (stimulateur cardiaque, défibrillateur automatique implantable) - une échocardiographie révélant une image suspecte ou douteuse.
Nous avons exclu les patients :
- présentant une hyperglycémie strictement supérieure à 11 mmol/L le jour de l’examen (correspond au seuil indiqué dans les guidelines de l’EANM 2015 [29], au-delà duquel les performances de l’examen peuvent être diminuées)
- présentant des images de TEP-FDG inutilisables (protocole non respecté, problème d’injection du radiopharmaceutique)
- pour lesquels le diagnostic final établi par le clinicien n’était pas disponible (patients suivis dans un hôpital périphérique).
- dont la TEP-FDG a été réalisée plus de trois mois avant le reste du bilan diagnostique. Le recueil des données a été réalisé à partir des dossiers médicaux informatisés des patients du CHU Amiens-Picardie ; il comprend les informations suivantes :
- âge - sexe - IMC
26 - antécédents médicaux et chirurgicaux notamment cardiaques, et la présence ou non de
matériel intra-cardiaque (et si oui le type de matériel implanté)
- CRP et numération leucocytaire dosées à moins de cinq jours de la TEP-TDM - hémocultures réalisées au cours de l’hospitalisation
- résultats des échocardiographies trans-thoraciques et trans-œsophagiennes
- résultats des autres imageries, notamment les tomodensitométries cérébrales, thoraco-abdomino-pelviennes et cardiaques.
- nombre de jours consécutifs d’antibiothérapie directement avant la TEP-TDM.
2.2 Protocole de réalisation de l’examen
Les patients devaient se présenter le jour de l’examen après avoir scrupuleusement respecté un régime précis destiné à supprimer l’hypermétabolisme glucidique physiologique du myocarde :
- prise la veille au soir d’un repas riche en graisses (hyperlipidique) avec apport de protéines toléré ; interdiction de tout apport glucidique (exemples : friandises, fruits, pain, sodas, mais aussi soluté glucosé intraveineux ou alimentation parentérale à composante glucidique).
- jeûne alimentaire strict jusqu’à l’heure de l’injection du FDG.
Le 18F-Fluorodésoxyglucose était synthétisé et majoritairement distribué par Curium Glisy (Somme). Les doses individuelles étaient délivrées au moyen d’un injecteur automatique Intego (Medrad® PET Infusion System, Etats-Unis d’Amérique), à la posologie de 3 MBq/kg par voie intraveineuse positionnée par un manipulateur en électro-radiologie du service. Après l’injection, le patient devait rester allongé ou semi-assis, au repos strict pour éviter toute fixation musculaire, pendant 60 minutes, temps nécessaire à l’accumulation du 18F-FDG dans les tissus cibles [30].
2.3 Caractéristiques de la TEP-TDM
Les examens ont été réalisés sur un système Discovery™ MI 4-anneaux couplé à un tomodensitomètre 64 coupes Revolution™ EVO CT (GE Healthcare, Waukesha, WI, Etats-Unis d’Amérique).
Ce tomographe par émission de positons est équipé de cristaux de lutétium-yttrium-orthosilicate (LYSO) mesurant chacun 3,95 mm x 5,3 mm x 25 mm, regroupés en 9 x 4 et
27 couplés avec des photodiodes à base de silicium (SiPM) pour former les blocs détecteurs agencés en quatre anneaux accolés formant un cylindre de 700 mm de diamètre et 198 mm de longueur [31]. Selon les mesures NEMA, la sensibilité du dispositif est de 14 kcps/kBq et la résolution spatiale de 3,8 mm [32].
Le tomodensitomètre générait des épaisseurs de coupe de 1,25 mm avec un temps de rotation de 0,5 secondes [33].
Toutes les images TDM ont été reconstruites avec un algorithme de reconstruction itérative statistique adaptatif ASIR-V™ [34].
Les images TEP ont été reconstruites avec un algorithme itératif OSEM incluant une correction d’atténuation basée sur le scanner, une correction des photons diffusés, une correction des coïncidences fortuites et la technologie du temps de vol [35,36]. GE Healthcare propose également un algorithme ajouté à la reconstruction (Q.Clear®) qui agit comme un opérateur régularisant pour améliorer encore le rapport signal sur bruit.
L’acquisition se faisait en moyenne en 8 pas de 2,5 minutes, soit un total de 20 minutes.
2.4 Interprétation des images
Les TEP-FDG ont été interprétées par un médecin nucléaire senior sur la station Advantage Workstation version 4.7 (GE Healthcare, Waukesha, WI, Etats-Unis d’Amérique) avec accès au dossier médical du patient et notamment aux résultats des imageries échocardiographiques et de TDM cardiaque réalisées avant notre examen, s’ils étaient disponibles.
L’interprétation était purement visuelle (sans quantification) et pouvait se faire librement avec le choix de l’échelle de couleur, de l’orientation des coupes, de la sommation des coupes et de tout autre paramètre réglable sur la console d’interprétation. Le compte-rendu de l’examen concluait sur le caractère positif, négatif, douteux ou ininterprétable de l’examen et sur la localisation précise des anomalies suspectes d’être de caractère infectieux.
Une TEP-FDG était « positive » s’il était mis en évidence un ou plusieurs foyers hypermétaboliques dont l’intensité, l’aspect et la localisation étaient compatibles avec un foyer infectieux d’endocardite valvulaire native, prothétique valvulaire, prothétique vasculaire (chirurgie de Bentall et chirurgies complexes de cardiopathie congénitale) ou d’infection des portions intravasculaires des sondes de matériel d’électrostimulation. Concernant les foyers hypermétaboliques prothétiques valvulaires ou vasculaires, ils étaient considérés comme positifs si l’hypermétabolisme était focal ou hétérogène et supérieur au bruit de fond
28 vasculaire de la crosse aortique [37,38]. Quant aux foyers hypermétaboliques sur les portions endovasculaires des sondes de matériel d’électrostimulation ou sur valve native (les valves natives ayant bénéficié de chirurgie de décalcification ou de plastie sont incluses), ils étaient considérés comme positifs quel que soit leur pattern morpho-métabolique.
Une TEP-FDG était « négative » s’il n’était mis en évidence aucun foyer hypermétabolique sur les valves natives, les prothèses valvulaires ou vasculaire ou sur les portions intravasculaires des sondes d’un éventuel dispositif d’électrostimulation. Elle était également considérée comme négative lorsqu’il y avait un hypermétabolisme péri-prothétique homogène correspondant à de probables remaniements inflammatoires post-chirurgicaux non spécifiques, et ce d’autant plus si la pose du matériel datait de quelques semaines seulement. Une TEP-FDG était « douteuse » s’il était mis en évidence un ou plusieurs foyers hypermétaboliques dont l’intensité, l’aspect ou la localisation n’étaient typiques ni de foyers infectieux ni de remaniements inflammatoires non spécifiques post-chirurgicaux.
Pour les besoins de la thèse, toutes les TEP-FDG ont été relues par un deuxième médecin nucléaire senior dans des conditions d’analyse similaires, puis éventuellement par un troisième médecin senior pour les cas litigieux ; le but final était d’aboutir à un consensus afin de classer l’examen comme positif ou négatif.
Nous n’avons pas pris en compte les foyers hypermétaboliques au contact des parties profondes ou superficielles d’un éventuel boitier d’électrostimulation car elles n’entrent pas dans le diagnostic d’endocardite infectieuse à proprement parler.
2.5 Evaluation des performances et de l’impact
thérapeutique de la TEP-FDG
Nous avons tout d’abord classé les patients inclus selon les critères de Duke modifiés par Li et al. [19] en trois groupes : « EI certaine », « EI possible », « EI exclue ». Ensuite nous les avons reclassés selon les critères de l’ESC 2015 [3], donc prenant en compte le résultat de la TEP, de façon à pouvoir apprécier l’impact de la TEP.
Nous avons mesuré les performances de la TEP-FDG avec comme gold standard le diagnostic final établi par le clinicien en charge du dossier, précisant la localisation de l’infection (valve native, valve prothétique, prothèse vasculaire, sondes de PM ou de DAI, ou autre).
29
3 RESULTATS
3.1 Population
Au total, 91 patients ont réalisé une TEP-FDG au CHU Amiens-Picardie dans le cadre d’un bilan de suspicion d’endocardite infectieuse entre janvier 2018 et février 2020. Parmi ceux-ci 34 patients n’ont pas été retenus car ils répondaient aux critères d’exclusion :
- deux patients présentaient une glycémie strictement supérieure à 11 mmol/L le jour de l’examen,
- seize patients présentaient des images de TEP-FDG ininterprétables :
o quatorze patients présentaient sur les images un hypermétabolisme myocardique physiologique résiduel trop gênant pour réaliser une analyse convenable (témoignant du non-respect ou de l’inefficacité du régime alimentaire préconisé, ou d’une injection de soluté glucosé intraveineux quelques heures avant la réalisation de l’examen)
o un patient présentait des images caractéristiques d’une hyperinsulinémie (hypométabolisme diffus des organes nobles et hypermétabolisme modéré musculaire diffus, l’insuline séquestrant le 18F-FDG dans ce tissu)
o une patiente a eu un problème d’injection avec une extravasation massive du radiopharmaceutique dans les tissus sous-cutanés de la jambe droite de sorte qu’une quantité trop faible de FDG est passée dans la circulation.
- quinze patients pour lesquels nous ne disposions pas du diagnostic final (patients suivis dans des hôpitaux périphériques)
- un patient présentait une TEP-TDM réalisée plus de trois mois avant le reste du bilan diagnostique.
Ainsi ce sont 57 patients qui ont été inclus dans l’étude (figure 10). Les caractéristiques générales de la population incluse, les résultats des bilans biologiques et d’imagerie conventionnelle sont détaillés dans le tableau 5.
30
Figure 10. Diagramme de flux.
Patients avec suspicion d'EI (n = 91)
TEP-TDM (n = 57)
Patients exclus (n = 34)
- TEP-TDM réalisée trois mois avant ETT, ETO et hémocultures (n = 1)
- Pas d'information de suivi durant les trois mois qui suivent la TEP-TDM (patient suivi dans un autre hôpital) (n = 15)
- Hyperglycémie strictement supérieure à 11.0 mmol/L le jour de l'examen (n = 2)
- Régime non respecté avec fixation myocardique physiologique très gênante (n = 14)
- Aspect TEP d'hyperinsulinémie (n = 1) - Extravasation massive (n = 1)
31 Tableau 5. Caractéristiques des patients (n = 57)
Caractéristiques cliniques
Âge en années : moyenne (écart-type) 62 (20)
Sexe Féminin : nombre (%) 14 (25%)
Sexe Masculin : nombre (%) 43 (75%)
Diabète : nombre (%) 16 (28%)
Biologie
CRP la plus proche de la TEP-TDM en mg/L : moyenne (écart-type) * 56,7 (57,0) Numération leucocytaire en x10E9/L : moyenne (écart-type) * 8,4 (2,9) Hémocultures au cours de l'hospitalisation : nombre de patients (%)
° Positives en critère majeur de Duke 23 (40%)
° Positives en critère mineur de Duke 7 (12%)
° Négatives 27 (47%)
Traitement
Prise d’une antibiothérapie dans le mois précédent la TEP-FDG :
nombre de patients (%) 49 (86%)
Délai entre le début de la prise d'une antibiothérapie et la date de la
TEP-TDM en jour : médiane (écart-type) ** 9 (6,8)
Type de matériel implanté chez les patients : nombres de patients (%)
Dispositif d'électrostimulation seul 20 (35%)
Prothèse valvulaire seule 8 (14%)
Prothèse valvulaire + dispositif d'électrostimulation 12 (21%) Prothèse valvulaire + dispositif d'électrostimulation + plastie valvulaire 2 (3,5%)
Prothèse valvulaire + plastie valvulaire 4 (7%)
Plastie valvulaire seule 1 (2%)
Bentall mécanique seul (= prothèse mécanique aortique + prothèse
tubulaire de la racine aortique) 2 (3,5%)
Bentall mécanique + dispositif d'électrostimulation 1 (2%) Chirurgie cardiaque complexe
- 1 tube VD/AP - 2 patchs sur CIV
3 (5%)
CIV non opérée 1 (2%)
Pas de matériel implanté, ni de chirurgie cardiaque, ni de cardiopathie
congénitale 3 (5%)
Délai entre la TEP-TDM et la chirurgie en mois : moyenne (écart-type) 46 (61)
° ≤ 1 mois, n (%) 6 (9%)
° entre 1 mois et 1 an, n (%) 16 (24%)
° > 1 an, n (%) 44 (67%)
Type de prothèse valvulaire
Bioprothèse aortique "classique" 13
TAVI 7
Bioprothèse mitrale 1
Bioprothèse tricuspide 1
Prothèse mécanique aortique 6
Prothèse mécanique mitrale 1
* Limite maximale de 5 jours
32
3.2 Résultats de la TEP-FDG
Les 91 injections de 18F-FDG se sont déroulées sans incident, à l’exception d’une extravasation massive du radiopharmaceutique dans les tissus sous-cutanés de la jambe droite d’une patiente (le point d’injection était sur le dos du pied homolatéral). Aucun effet indésirable imputable au radiopharmaceutique n’a été rapporté pendant ou au décours de l’examen.
Pour les patients inclus, la dose injectée de FDG était en moyenne de 236 ± 63 MBq. La dose efficace liée au fluor 18 était en moyenne de 4,6 ± 1,0 mSv pour les 54 adultes inclus, 4,3 mSv pour une fille de 11 ans, 2,6 mSv pour une fille de 8 ans et 3,2 mSv pour une fille de 6 ans, valeurs calculées en utilisant les facteurs de conversion du Résumé des Caractéristiques du Glucotep® [39]. Les acquisitions étaient réalisées à 63 ± 7 minutes de l’injection du radiopharmaceutique. Le produit dose longueur délivré par le TDM couplé au TEP était de 699 ± 335 mGy.cm.
Dix-sept TEP-FDG ont été interprétées « positives » et quarante TEP-FDG « négatives ». Onze TEP-FDG qui avaient été interprétées comme « douteuses » ont nécessité une relecture par le troisième médecin senior, avant interprétation finale « positive » ou « négative ».
3.3 Classification selon les critères de Duke modifiés
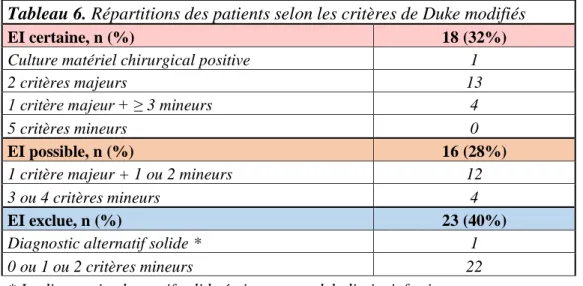
Les résultats de la classification des patients selon les critères de Duke modifiés sont regroupés dans le tableau 6 ci-dessous.
Tableau 6. Répartitions des patients selon les critères de Duke modifiés
EI certaine, n (%) 18 (32%)
Culture matériel chirurgical positive 1
2 critères majeurs 13
1 critère majeur + ≥3 mineurs 4
5 critères mineurs 0
EI possible, n (%) 16 (28%)
1 critère majeur + 1 ou 2 mineurs 12
3 ou 4 critères mineurs 4
EI exclue, n (%) 23 (40%)
Diagnostic alternatif solide * 1
0 ou 1 ou 2 critères mineurs 22
![Figure 4. Photographies d’un modèle de stimulateur cardiaque Medtronic® [7] à gauche et d’un modèle de DAI Medtronic® [8] à droite](https://thumb-eu.123doks.com/thumbv2/123doknet/7318193.210553/11.893.272.617.624.810/figure-photographies-modèle-stimulateur-cardiaque-medtronic-modèle-medtronic.webp)
![Figure 5. Photographies d’un modèle de prothèse mécanique à double ailettes SJM® [5] à gauche et d’un modèle de bioprothèse Carpentier-Edwards Perimount® [5] à droite](https://thumb-eu.123doks.com/thumbv2/123doknet/7318193.210553/12.893.269.622.308.476/photographies-prothèse-mécanique-ailettes-bioprothèse-carpentier-edwards-perimount.webp)
![Tableau 3. Critères modifiés de la Société Européenne de Cardiologie (ESC) 2015 pour le diagnostic d'endocardite infectieuse [3]](https://thumb-eu.123doks.com/thumbv2/123doknet/7318193.210553/19.893.103.789.807.1111/critères-modifiés-société-européenne-cardiologie-diagnostic-endocardite-infectieuse.webp)
![Figure 9 : Schéma représentant le principe de la TEP [27]](https://thumb-eu.123doks.com/thumbv2/123doknet/7318193.210553/22.893.173.699.158.542/figure-schéma-représentant-le-principe-la-tep.webp)