Identification de gènes impliqués dans la synthèse des
apocaroténoïdes chez la tomate et la violette odorante
Mémoire
Blandine Bulot
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
Identification de gènes impliqués dans la synthèse des
apocaroténoïdes chez la tomate et la violette odorante
Mémoire
Blandine Bulot
Sous la direction de :
Résumé
Les apocaroténoïdes volatils sont des composés à l’arôme fruité qui contribuent de façon positive à la flaveur des fruits et à la fragrance des fleurs. La régulation de la production de ces composés dans les plantes est encore peu comprise. Ce projet visait à identifier des gènes clés impliqués dans le sentier de production des apocaroténoïdes, dans le but ultime d’améliorer l’arôme des fruits. Chez les tomates, SlCCD1 (Carotenoid Cleavage Dioxygenase 1), malgré sa localisation cytosolique, était considérée comme l’enzyme responsable d’effectuer le clivage oxydatif des caroténoïdes situés dans les plastes afin de libérer des apocaroténoïdes. Cependant, l’étude de lignées de tomates transgéniques et de fleurs de Viola odorata démontre que CCD1 n’est pas une enzyme clé dans la synthèse des apocaroténoïdes chez les fleurs et les fruits et que la présence d’enzymes capables d’accéder aux caroténoïdes est nécessaire. Ces enzymes peuvent être des CCDs localisées dans les plastes, comme VoCCD4 et VoCCD1-like chez V.
odorata, ou des lipoxygénases comme TomloxC chez la tomate, capables de co-oxyder
les caroténoïdes lors de l’oxydation des acides gras. L’accumulation des caroténoïdes dans les plastes ayant un impact important sur la nature des apocaroténoïdes produits, la synthèse de ces précurseurs a également été étudiée. L’analyse génétique de tomates qui présentent une accumulation anormale du lycopène a mis en évidence l’importance du gène de la phytoène synthase 1 (PSY1) dans le sentier et la façon dont différentes variations structurelles dans ses séquences promotrices et codantes peuvent affecter la couleur des fruits. Le phénotype des cultivars bicolores est notamment causé par une baisse vraisemblable de l’efficacité de la traduction de PSY1 due à une délétion dans sa région 5’UTR, tandis que les cultivars jaunes ry sont le résultat d’une perte de fonction de
PSY1 suite à réarrangement complexe en aval du gène. Ces connaissances sur la synthèse des caroténoïdes et des apocaroténoïdes seront utiles afin d’améliorer l’arôme des tomates et de nombreuses autres espèces cultivées.
Abstract
Volatile apocarotenoids are molecules with a fruity aroma that have a significant impact on the flavor of fruits and the fragrance of flowers. Despite their importance, the regulation of their synthesis in plants in still not fully understood. The main objective of this thesis was to identify key genes involved in the apocarotenoid pathway in order to ultimately improve the aroma of fruits. In tomatoes, SlCCD1 (Carotenoid Cleavage Dioxygenase 1), even if localized in cytosol, was considered the enzyme responsible for the oxidative cleavage of plastid-localized carotenoids. Analyses of transgenic tomato lines and Viola odorata flowers demonstrate that CCD1 is not a key enzyme in apocarotenoid synthesis in flowers and fruits, and that plastidial enzymes are associated with the production of apocarotenoid volatiles. In tomato, the lipoxygenase C co-oxidizes carotenoids while performing fatty acid oxidation. In V. odorata flowers, the considerable production of ionones correlates with the high expression of plastid-localized CCDs such as VoCCD4 and VoCCD1-like. Since carotenoid accumulation in plastid has an important impact on the nature of the apocarotenoids produced, our attention was also drawn to their synthesis. Genetic analysis of tomatoes that show unusual lycopene accumulation demonstrated the importance of the phytoene synthase 1 (PSY1) gene in the pathway, and the way different structural variation in its promoter or coding sequences can affect fruits color. Bicolor cultivars phenotype is notably due to a likely decrease of PSY1 translation efficiency caused by a deletion in the PSY1 5’UTR region. Similarly, yellow cultivars are the result of structural variations in the first or last exon of PSY1. This knowledge on carotenoid and apocarotenoid synthesis will be useful in order to improve the flavor of tomatoes and many other cultivated species.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières... v
Liste des tableaux ... vii
Liste des figures ... viii
Remerciements ... ix
Avant-propos ... x
Introduction générale ... 1
Chapitre 1 : Revue de littérature ... 3
1.1 Les caroténoïdes ... 3
1.1.1 Synthèse des caroténoïdes ... 3
Sentier du MEP ... 3
Synthèse des carotènes ... 3
Synthèse des xanthophylles ... 4
1.1.2 Rôle des caroténoïdes ... 5
Dans les tissus photosynthétiques ... 5
Dans les tissus non-photosynthétiques ... 6
1.1.3. Régulation de la synthèse des caroténoïdes ... 7
Régulation au début du sentier du MEP ... 7
Régulation au niveau de PSY1 ... 8
Facteurs de transcriptions impliqués dans le mûrissement et éthylène... 9
Formation des chromoplastes ... 10
Dégradation ... 10
1.2. Les composés volatils ... 11
1.2.1 Description générale ... 11
1.2.2 Les apocaroténoïdes ... 12
Origine et odeur des apocaroténoïdes... 12
Synthèse des apocaroténoïdes ... 13
1.2.3 Les composés volatils dérivés des acides gras ... 17
Origine et odeur ... 17
Synthèse des composés volatils dérivés des acides gras... 18
1.3. Objectifs et hypothèses ... 19
Chapitre 2 : Synthesis of apocarotenoid volatiles in flower and fruits, reassessing the importance of cytosolic Carotenoid Cleavage Dioxygenases ... 22
2.1 Résumé ... 22
2.2 Abstract ... 23
2.3 Introduction ... 24
2.4 Materials and Methods ... 27
Growth of transgenic tomatoes ... 27
Flowers harvesting ... 28
Volatile compounds analysis ... 28
Transcriptome sequencing and analysis ... 29
2.5 Results ... 30
Silencing of SlCCD1 and TomloxC in Tomato ... 30
Apocarotenoid volatiles emission in Viola flowers ... 34
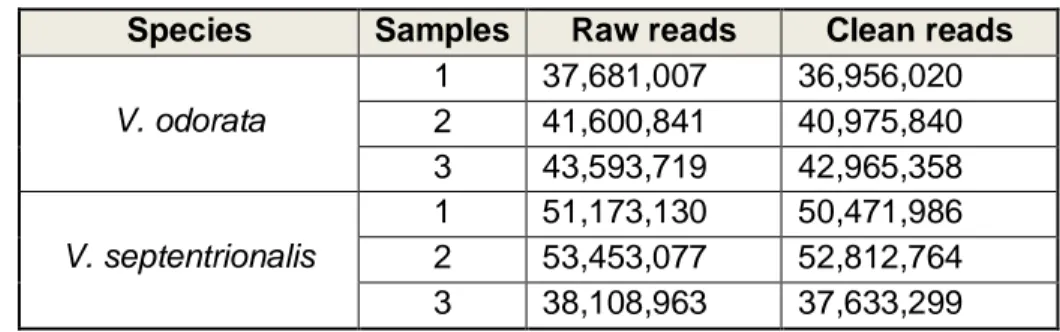
Sequencing and transcriptome assembly of V. odorata and V. septentrionalis ... 35
Differential gene expression analysis between V. odorata and V. septentrionalis ... 36
2.6 Discussion and Conclusion ... 41
2.7 References ... 45
Chapitre 3 : Structural variations in the phytoene synthase 1 gene affect carotenoid accumulation in tomato fruits and result in bicolor and yellow phenotypes... 50
3. 1. Résumé ... 50
3.2 Abstract ... 51
3.3 Introduction ... 51
3.4 Materials and Methods ... 54
Growth of plant materials ... 54
Volatile compounds analysis ... 54
Genetic markers design ... 55
Quantitative PCR ... 55
Transcriptome sequencing and analysis ... 56
3.5 Results ... 57
Mapping of a QTL for bicolored fruits ... 57
Apocarotenoid volatiles emission in bicolor fruits ... 58
Phytoene synthase expression in the bicolor introgression line ... 60
Structural variation in bicolor cultivars ... 61
Genomic rearrangement in yellow tomato cultivars ... 63
3.6 Discussion and Conclusion ... 68
3.7 References ... 73
Discussion et conclusion ... 77
Bibliographie ... 87
Annexe 1 : Figures supplémentaires (Chapitre 2) ... 93
Annexe 2 : Tableaux supplémentaires (Chapitre 2) ... 97
Annexe 3 : Figures supplémentaires (Chapitre 3) ... 115
Liste des tableaux
Table 2.1. Apocarotenoid volatiles emission of V. odorata and V. septentrionalis flowers.34 Table 2.2. Statistics of V. odorata and V. septentrionalis sequencing data. ... 36 Table 2.3. Statistics of de novo transcriptome assembly quality for V. odorata and V.
septentrionalis. ... 36 Table 2.4. Differential analysis expression of genes of the MEP pathway between V.
odorata and V. septentrionalis. ... 38 Table 2.5. Differential analysis expression of genes of the carotenoid pathway between V. odorata and V. septentrionalis. ... 38 Table 2.6. Differential analysis expression of genes suspected to be involved in
Liste des figures
Figure 1.1. Sentier de synthèse des caroténoïdes... 5 Figure 1.2. Synthèse des apocaroténoïdes volatils chez les plantes à partir du clivage
oxydatif des caroténoïdes ... 15
Figure 1.3. Fleurs des violettes Viola odorata et Viola septentrionalis ... 21 Figure 2.1. Expression of SlCCD1 and TomloxC in the transgenic lines. SlCCD1a (A),
SlCCD1b (B) and TomloxC (C) transcript levels in ripe fruits of the control line M82
and the transgenic lines for SlCCD1 (9528_CCD1, 9530_CCD1) and TomloxC
(0966_LoxC) ... 32
Figure 2.2. Apocarotenoid volatiles emission from the fruit of the transgenic lines.
Emission of the apocarotenoid volatiles 6-methyl-5-hepten-2-one (A) and
geranylacetone (B) in the ripe fruits of the control line M82, the transgenic lines for
SlCCD1 (9528_CCD1, 9530_CCD1), TomloxC (0966_LoxC), and the crosses
CCD1+LoxC 1 (9528_CCD1 x 0966_LoxC, n=6) and CCD1+LoxC 2 (9530_CCD1 x 0966_LoxC) ... 33
Figure 2.3. Phylogenetic analysis of the viola Carotenoid Cleavage Dioxygenases... 40 Figure 3.1. Apocarotenoid volatiles emission from fruits of bicolor introgression line.
Emission of the apocarotenoids geranylacetone (A) and 6-methyl-5-hepten-2-one (B) ... 59
Figure 3.2. PSY1 gene expression is reduced in the bicolor introgression line. (A)
Representative fruits of the red introgression line 3923-locus 2 and the bicolor
introgression line 3923-locus 3. (B) Transcript levels of PSY1 in the parental line 4024 and the introgressed lines 3923-locus 2 and 3923-locus 3a ... 60
Figure 3.3. Top, bottom and cross section of the bicolor cultivars Striped German (A),
Mortage Lifter bicolor (B) and Grapefruit (C) at ripe stage... 62
Figure 3.4. Transcripts level of PSY1 in ripe fruits of red, yellow and bicolor tomato
cultivars. ... 63
Figure 3.5. A structural variation in the bicolor cultivars changes the 5’UTR transcripts
profile of PSY1 ... 64
Figure 3.6. Yellow r and ry cultivars PSY1 transcripts alignment on S. lycopersicum
reference genome ... 67
Figure 3.7 Influence of the bicolor and ry allele of PSY1 on the fruit phenotype ... 68
Remerciements
Je tiens tout d’abord à remercier mon directeur de recherche, Charles Goulet, pour sa confiance, et la chance qu’il m’a donné de réaliser cette maîtrise. Son dévouement, ses conseils, et sa passion pour la science ont été d’une aide précieuse durant ces deux années.
Un grand merci également à Roberto Montoya, Sébastien Isabelle, Jérémie Ghironzi, Louis-Félix Nadeau, Maxime Bastien et Isabelle Clermont, qui n’ont jamais hésité à m’apporter leur aide, que ce soit au champ ou au laboratoire. Leur présence a été très motivante, et je n’aurais pas pu avoir mieux comme équipe de travail !
Merci aussi à mes amies, mes biologistes préférées, qui m’ont accueillie à mon arrivée au Québec, et m’ont depuis accompagnée dans toutes les étapes de mes études, et de ma vie.
Finalement, merci à mon amoureux Jonathan, ainsi qu’à ma sœur Diane et mes parents. Leur soutien et leurs encouragements ont été tellement importants. C’est grâce à eux que j’en suis là aujourd’hui.
Avant-propos
Ce mémoire est constitué d’une introduction générale, suivie de trois chapitres. Le premier chapitre intègre une revue de littérature portant d’abord sur la synthèse et l’accumulation des caroténoïdes dans les fleurs et les fruits, et plus particulièrement les tomates, puis sur les composés volatils, molécules ayant un impact significatif sur leur arôme. Dans le cadre de ce projet, nous nous sommes davantage concentrés sur les apocaroténoïdes, composés volatils dérivés des caroténoïdes.
Le deuxième chapitre est un article scientifique, rédigé en anglais, qui s’intitule « Synthesis of apocarotenoid volatiles in flower and fruits, reassessing the importance of cytosolic Carotenoid Cleavage Dioxygenases ».
Le troisième chapitre est également présenté sous la forme d’un article scientifique, rédigé en anglais, dont le titre est « Structural variations in the phytoene synthase 1 gene affect carotenoid accumulation in tomato fruits and result in bicolor and yellow phenotypes ».
En tant qu’auteure principale de ces deux articles, j’ai contribué à la majorité des expériences décrites, à l’analyse des résultats, ainsi qu’à la rédaction des manuscrits. Louis-Félix Nadeau est co-auteur du premier article pour sa participation aux croisements des lignées de tomates transgéniques. Sébastien Isabelle a participé à la préparation de librairies d’ARN et est co-auteur du deuxième article. Mon directeur de recherche Charles Goulet a dirigé l’ensemble des travaux de recherche, de l’élaboration des dispositifs expérimentaux à la rédaction des articles et est donc également un co-auteur des deux articles. Ces deux articles seront soumis à un journal scientifique au cours de l’année 2019.
Ce mémoire s’achève sur une discussion générale et une conclusion qui résument les chapitres 2 et 3, et ouvrent la porte à de prochaines recherches. Afin d’alléger le mémoire et d’en faciliter la consultation, les références bibliographiques citées dans l’Introduction générale, le premier Chapitre ainsi que la partie Discussion générale et Conclusion ont été regroupées dans la section Bibliographie, située à la fin du mémoire.
Introduction générale
La tomate (Solanum lycopersicum), originaire d’Amérique du Sud et importée en Europe au 16ème siècle, fait partie de la famille des Solanacées qui regroupe plus de 3000 espèces, dont certaines sont très importantes du point de vue économique, telles que la pomme de terre, le tabac et l’aubergine. La production mondiale de tomate a considérablement augmenté au cours des 50 dernières années. C’est aujourd’hui la deuxième culture maraîchère la plus consommée, derrière la pomme de terre. Sa production est passée de 31 millions de tonnes en 1966 à plus de 177 millions de tonnes en 2016. En 2017 seulement, le Canada a cultivé et récolté plus de 277000 tonnes de tomates en serre pour une valeur à la ferme de 556 millions de dollars (CA$) (FAO 2016, Statistique Canada 2018).
L’intensification de la production depuis une cinquantaine d’années, liée à la forte demande, a nécessité une sélection de cultivars possédant des caractéristiques bien précises, telles que la rapidité de croissance, la résistance aux maladies, le rendement, ainsi que la taille des fruits. Cependant, la sélection génétique pour certains de ces traits a eu des effets inattendus sur la flaveur des tomates. Cette caractéristique, considérée comme accessoire, n’a ainsi pas été prise en compte dans les plans d’amélioration génétique, et de plus en plus, les consommateurs se plaignent de l’arôme des tomates dans leur assiette (Klee et Tieman 2013). Un exemple bien connu de cette perte de saveur au profit l’apparence des fruits est le phénotype uniforme (u). La majorité des cultivars modernes ont été sélectionnés pour leur faculté à produire des fruits qui murissent de façon uniforme, sans « épaules vertes » persistantes à maturité au niveau du pédicelle. Cette caractéristique, qui plaît davantage visuellement aux consommateurs, provient d’une mutation inactivant le facteur de transcription GLK2 qui se traduit par un moins bon développement des chloroplastes dans les fruits, qui accumulent peu de thylakoïdes et de chlorophylle, d’où l’absence des « épaules vertes » (Waters et al. 2009). Cette sélection pour un caractère intéressant au niveau de l’apparence a cependant eu des conséquences insoupçonnées sur le goût des fruits. Il a été observé dans certains cas que les tomates possédant moins de chloroplastes réalisent la photosynthèse de façon moins efficace. Cela résulte en une accumulation moins importante de sucre dans les tissus, et donc une saveur moins appréciée (Powell et al. 2012).
Sur les 400 composés volatils synthétisés par la tomate, une trentaine ont été identifiés pour leur rôle dans son arôme (Baldwin et al. 2000). Cependant, une partie des gènes et des enzymes impliqués dans leur synthèse reste inconnue. De plus, les mécanismes de régulation dirigeant la production de ces composés volatils, ainsi que des caroténoïdes, des pigments importants pour la couleur des fruits, sont nombreux, complexes et souvent encore incompris. Malgré cette complexité, la tomate constitue néanmoins un excellent modèle pour la recherche appliquée sur les fruits climactériques. Son génome diploïde relativement petit (950Mb), séquencé en 2012, est disponible sur des bases de données en ligne (Klee et Giovannoni 2011, Fernandez-Pozo et al. 2015). De plus, les grandes collections de cultivars phénotypiquement variés, de lignées d’introgression, de mutants, ainsi que de plants transgéniques, associées à de nouvelles technologies comme le séquençage d’ARN à haut débit, rendent possible l’étude des mécanismes génétiques et moléculaires régulant le métabolisme secondaire des tomates, et du même fait la synthèse de leurs composés volatils (Monforte et Tanksley2000).
Une meilleure compréhension des sentiers métaboliques de production des caroténoïdes et des apocaroténoïdes volatils, molécules aromatiques dérivées du clivage oxydatif des caroténoïdes, permettra à terme de créer des marqueurs génétiques spécifiques. Ceux-ci pourront alors être utilisés par les hybrideurs afin de les aider à sélectionner des cultivars produisant des arômes qui donneront à nouveau un meilleur goût aux tomates. De plus, les connaissances acquises sur la tomate pourront être utiles pour d’autres cultures maraîchères et fruitières. Ainsi, les producteurs pourront davantage répondre aux exigences gustatives des consommateurs qui demandent de plus en plus des produits de qualité.
Chapitre 1 : Revue de littérature
1.1 Les caroténoïdes
Les caroténoïdes constituent un groupe de pigments très diversifié et répandu dans la nature qui peuvent être synthétisés par les plantes, les algues, les champignons et les bactéries
(Bartley et al. 1994). Les caroténoïdes sont des molécules de la famille des terpènes. Ce sont plus précisément des isoprénoïdes à 40 carbones, possédant des doubles liaisons dans leur chaine hydrocarbonée. Ils peuvent également être munis d’un ou plusieurs anneaux à leurs extrémités (Hirschberg 2001).
1.1.1 Synthèse des caroténoïdes
Sentier du MEPDans les plantes, la majorité des isoprénoïdes, dont les caroténoïdes, sont synthétisés dans les chloroplastes et les chromoplastes par des enzymes codées par des gènes nucléaires
(Hirschberg 2001). Ces isoprénoïdes dérivent de la condensation de trois molécules d’isopentenyl diphosphate (IPP) avec une molécule de dimethylallyl diphosphate (DMAPP), tous deux issus du sentier du 2-C-méthyl-D-érythritol-4-phosphate, aussi appelé sentier non-mévalonique, ou MEP. La condensation de l’IPP et du DMAPP est catalysée par l’enzyme géranyl géranyl pyrophosphate synthase (GGPS) et résulte en une molécule de diphosphate de géranyl géranyl (GGPP) (Hunter 2007, Phillips et al. 2008). Il existe deux isoformes de l’enzyme
GGPPS chez la tomate. GGPS1 s’exprime dans les feuilles, tandis que GGPS2 agit dans les plastes des fleurs et des fruits (Ament et al. 2006). Le GGPP est une molécule très importante, qui peut servir de précurseur pour la synthèse de molécules essentielles pour la plante, telles que les chlorophylles, les gibbérellines, les tocophérols, les plastoquinones ainsi que les caroténoïdes (Bouvier et al. 2005).
Synthèse des carotènes
Le sentier de production des caroténoïdes débute par la condensation de deux molécules de GGPP, sous l’action de l’enzyme phytoène synthase (PSY). Cela génère le premier caroténoïde, le 15-cis-phytoène, qui est incolore (Bartley et al. 1992). Le 15-cis-phytoène est par la suite transformé en 15-9’-di-cis-phytofluène, puis en
9,15,9’-tri-cis-ζ-carotène par deux réactions de désaturation successives catalysées par l’enzyme phytoène désaturase (PDS) (Pecker et al. 1992). L’enzyme ζ-carotène isomérase (Z-ISO) convertit alors
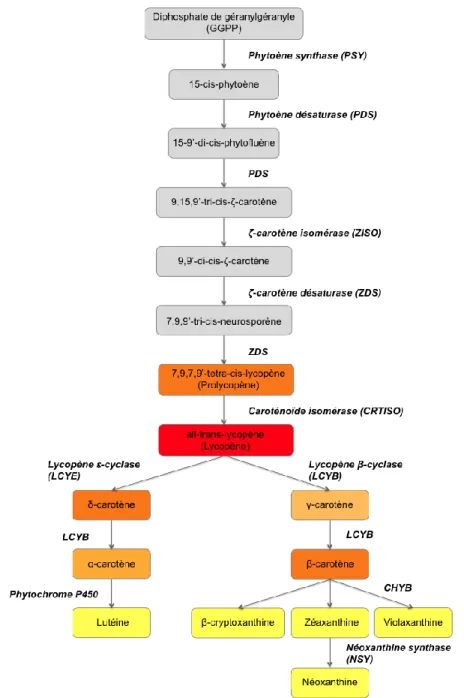
la 9,15,9’-tri-cis-ζ-carotène en 9,9’-di-cis-ζ-carotène, qui subit une nouvelle réaction de désaturation, catalysée cette fois par l’enzyme ζ-carotène désaturase (ZDS). La molécule de 7,9,9’-tri-cis-neurosporène qui en résulte est également désaturée par ZDS pour donner du 7,9,7,9’-tetra-cis-lycopène, aussi appelé prolycopène (Hirschberg 2001, Bouvier et al. 2005). L’enzyme caroténoïde isomérase (CRTISO) convertit alors la configuration cis du prolycopène, en configuration trans, afin de générer le fameux caroténoïde all-trans-lycopène, ou lycopène, connu pour être à l’origine la couleur rouge caractéristique des tomates (Isaacson et al. 2002). La cyclisation du lycopène marque un embranchement du sentier. Une branche, via la lycopène β-cyclase (LCYB), ajoute un ou deux anneaux β (présence d’un double lien entre les carbones 5 et 6 de l’anneau) au lycopène ce qui donne respectivement le γ-carotène et le β-carotène. Dans l’autre branche, la lycopène ε-cyclase (LCYE) ajoute un anneau ε (présence d’un double lien entre les carbones 4 et 5 de l’anneau) au lycopène afin de générer le δ-carotène. Par la suite, la LCYB peut ajouter un anneau β au δ-carotène, ce qui résulte en la synthèse d’α-carotène. Tous ces caroténoïdes hydrocarbonés, synthétisés depuis le 15-cis-phytoène, appartiennent à la sous-famille des carotènes (Fantini et al. 2013, Pecker et al. 1996).
Synthèse des xanthophylles
Un groupement fonctionnel oxygéné peut être ajouté aux anneaux de l’α-carotène et du β-carotène par des réactions d’hydroxylation catalysées par des hydroxylases et le cytochrome P450. L’enzyme caroténoïde β-hydroxylase non-hème-di-iron mono-oxygénase (CHYB) transforme la β-carotène pour générer entre autres les xanthophylles β-cryptoxanthine, zéaxanthine et violaxanthine. La violaxanthine est ensuite modifiée par l’enzyme néoxanthine synthase (NSY), ce qui donne la néoxanthine. Le phytochrome P450, quant à lui, modifie l’α-carotène qui devient la lutéine. Ces caroténoïdes oxygénés appartiennent à la sous-famille des xanthophylles (Hirschberg 2001, Bouvier et al. 2005). Le sentier de production des caroténoïdes est résumé à la Figure 1.1.
Figure 1.1 Sentier de synthèse des caroténoïdes. La couleur de chaque caroténoïde est représentée
par la couleur de l’encadré dans lequel son nom est écrit. Les caroténoïdes présents dans les encadrés gris sont incolores. CHYB : caroténoïde β-hydroxylase non-hème-di-iron mono-oxygénase.
1.1.2 Rôle des caroténoïdes
Dans les tissus photosynthétiquesLes propriétés chimiques des caroténoïdes font de ceux-ci des composés essentiels chez tous les organismes photosynthétiques. Dans les photosystèmes I et II des chloroplastes, ils augmentent l’efficacité de la photosynthèse en assurant le transfert à la chlorophylle de
l’énergie lumineuse qu’ils absorbent entre 400 et 600 nm. Les caroténoïdes, et plus particulièrement les xanthophylles, protègent également les cellules des formes réactives dangereuses de l’oxygène qui peuvent être générées lors de la photosynthèse. Les caroténoïdes jouent, enfin, un rôle important dans la régulation de la fluidité des membranes cellulaires (Young 1991, Horton et Ruban 2004).
Dans les tissus non-photosynthétiques
Dans les tissus non-photosynthétiques, les caroténoïdes s’accumulent dans les chromoplastes, organites dont la formation dérive des chloroplastes. Ils peuvent être contenus dans différentes structures telles que les plastoglobules, les membranes internes des chromoplastes, les cristaux et les tubules (Ljubesić et al. 1991). Les caroténoïdes sont des pigments, c’est-à-dire des molécules qui confèrent une couleur particulière aux tissus dans lesquels ils se trouvent. La couleur attrayante des fleurs et des fruits, allant du jaune au rouge en passant par le orange, provient en effet majoritairement des caroténoïdes (Klee et Giovannoni 2011). Ainsi, les insectes et les animaux sont attirés par ces couleurs et participent à la pollinisation ou à la dissémination des graines, ce qui est très important pour la propagation des plantes (Dicke et Baldwin 2010). Les tomates dont les chloroplastes n’effectuent pas une transition normale vers les chromoplastes, en raison des mutations « green-flesh » ou « never
ripe » par exemple, ne peuvent donc pas accumuler de caroténoïdes et restent de couleur verte,
même à maturité (Lanahan et al. 1994, Powell et al. 2012). La fine régulation de la transcription des gènes codant pour des enzymes essentielles à la biosynthèse des caroténoïdes est extrêmement importante pour que survienne l’accumulation des caroténoïdes souhaités (Klee et Giovannoni 2011). Par exemple, la fleur des tomates arbore une couleur jaune-orange éclatant, à cause de l’accumulation des caroténoïdes néoxanthine, violaxanthine et lutéine dans ses chromoplastes (Galpaz et al. 2006). Les fruits, quant à eux, deviennent rouges au cours de leur maturation car ils accumulent dans leurs chromoplastes d’importantes quantités du caroténoïde lycopène, qui est un pigment rosé. Au cours de ce processus, il est également nécessaire que la chlorophylle, responsable de la couleur verte aux premiers stades de maturité, soit dégradée (Li et Yuan 2013). C’est l’addition du pigment flavonoïde jaune naringenine chalcone au lycopène qui confère aux tomates leur couleur rouge caractéristique (Gady et al. 2012). Afin de parvenir à une telle accumulation de lycopène, il y a augmentation de la transcription des gènes PSY1, PDS, CRTISO et DXS, dont l’action est située en amont de la synthèse du lycopène. Au contraire, les gènes qui participent à la transformation du lycopène, tels que LCYB, LCYE et CHYB, montrent une transcription régulée à la baisse (Giuliano et al. 1993). Ainsi, des lignées
de tomates possédant des mutations au niveau des gènes régulant la biosynthèse des caroténoïdes n’accumulent pas de lycopène de façon normale et produisent alors des fruits de couleurs variées. Par exemple, l’hypothèse de la mutation récessive yellow-flesh (r) a été émise afin d’expliquer pourquoi certains cultivars de tomates produisent des fruits de couleur jaune. Dans ce cas, il a été proposé que la mutation rend la protéine PSY1 non-fonctionnelle, ce qui bloque le sentier de biosynthèse du lycopène dès sa première étape et empêche donc l’accumulation de lycopène (Fray et Grierson 1993). Les fruits ne synthétisent alors que le flavonoïde naringenine chalcone et arborent une couleur jaune (Gady et al. 2012). Par ailleurs, dans les lignées de tomates mutantes Delta et Bêta, la transcription des gènes LCYE et LCYB est respectivement augmentée par rapport à des tomates non mutées. Cela résulte en la transformation rapide du lycopène qui ne peut plus s’accumuler dans les chromoplastes, en δ-carotène ou en β-δ-carotène selon la lignée mutante. Les tomates produites, en accumulant peu de lycopène mais d’importantes quantités de δ- et β-carotène, présentent alors une couleur orange, caractéristique de ces formes de carotène (Pecker et al. 1996, Ronen et al. 1999). Les lignées de tomates possédant la mutation tangerine produisent aussi des fruits de couleur orange. Dans ce cas, la mutation inhibe l’expression du gène CRTISO, le prolycopène de couleur orange n’est alors jamais isomérisé en lycopène et la tomate accumule donc d’importantes quantités de prolycopène lui conférant sa couleur orange (Isaacson et al. 2002). Ainsi, la régulation différentielle des gènes impliqués dans la synthèse des caroténoïdes est à l’origine d’une impressionnante collection de tomates de couleurs variées. En plus plus des multiples teintes de vert, de rouge, de jaune, d’orange, de roses ou de brun, les tomates peuvent porter des rayures ou même exhiber un phénotype bicolore. Une meilleure compréhension de ces mécanismes de régulation permettra de contrôler davantage l’accumulation des caroténoïdes dans les fruits.
1.1.3. Régulation de la synthèse des caroténoïdes
Même si le sentier de production des caroténoïdes paraît simple, les mécanismes de régulation sont nombreux et complexes.
Régulation au début du sentier du MEP
L’étape initiale du sentier du MEP, qui consiste en la transformation du pyruvate et du glycéraldéhyde-3-phosphate (G3P) par l’enzyme 1-deoxy-d-xylulose 5-phosphate synthase 2 (DXS2) pour donner les précurseurs des caroténoïdes, est considérée comme la première étape
déterminante de régulation du sentier des caroténoïdes. L’expression du gène DXS2 est directement corrélée avec l’augmentation de la production de caroténoïdes dans les fruits (Lois
et al. 2000, Walter et al. 2002).
Régulation au niveau de l’enzyme PSY1
La synthèse de phytoène, catalysée par l’enzyme PSY1, est également considérée comme une étape clé dans la production des caroténoïdes. Trois isoformes du gène de la phytoène synthase, ayant chacun des rôles bien définis, ont été identifiés chez la tomate. Le gène PSY3 s’exprime essentiellement dans les racines, et joue un rôle essentiel de réponse aux stress abiotiques, tels que la sécheresse (Li et al. 2008, Welsch et al. 2008). PSY1 est un gène paralogue de PSY2 qui serait apparu suite à un évènement de duplication. Les deux isoformes auraient par la suite persisté dans le génome par fonctionnalisation (Zhang 2003). Les séquences protéiques des deux isoformes montrent 78% d’homologie et contiennent toutes deux un peptide de transit (Giorio et al. 2008). Solanum lycopersicum produit des fleurs jaunes et des fruits de couleur rouge. Sur les douze espèces sauvages fortement apparentées à
Solanum lycopersicum, toutes produisent des fleurs jaunes, mais seulement trois produisent des
fruits colorés. Par exemple, S. pimpinefollium produit des fruits rouges, S. cheesmaniae des fruits de couleur jaune-orangé et S. galapagense des fruits orange, tandis que les autres espèces telles que S. habrochaites et S. pennellii produisent des fruits verts. (Peralta et Spooner 2007). Cela laisse supposer que des évènements de spécialisation des isoformes de PSY dans différents tissus, et particulièrement de PSY1 dans les fruits, auraient permis la production de tomates colorées (Zhang 2003). Tandis que PSY2 s’exprime dans les feuilles et les fleurs, PSY1
s’exprime principalement dans les fruits en cours de mûrissement. Son expression commence au stade « mature green », lorsque les graines sont arrivées à maturité, puis augmente de façon très importante jusqu’au stade « pink », avant de diminuer progressivement jusqu’au stade « red
ripe ». L’expression de PSY1 dans les fruits au cours de la maturation est donc essentielle à la
synthèse de phytoène, et par conséquent de tous les autres caroténoïdes. Il n’y a pas de moyen alternatif pour le fruit d’accumuler des caroténoïdes, plusieurs lignées différentes de tomates possédant une mutation au niveau du gène PSY1 ayant permis de démontrer comment l’activité de l’enzyme influençait l’accumulation des caroténoïdes dans le fruit. Par exemple, le mutant W180* possède un codon stop prématuré qui cause une perte de fonction de l’enzyme PSY1 qui ne peut alors pas convertir le diphosphate de géranyl géranyl en phytoène; les fruits, par conséquent restent jaunes, même à maturité, comme chez le mutant yellow flesh (Fray et Grierson 1993, Gady et al. 2012). En revanche, le mutant P192L possède seulement une
mutation de substitution au sein de la séquence de PSY1. La protéine reste en partie fonctionnelle malgré cette mutation et les tomates accumulent quand même du lycopène, mais de façon ralentie et en concentration deux fois moins abondante par rapport aux fruits témoins. Le mutant P192L produit donc des fruits qui restent jaunes jusqu’à trois jours après le stade
post-breaker, alors qu’à ce stade les tomates non mutantes sont déjà oranges, en raison de
l’accumulation de lycopène. Il faut attendre sept jours après le stade post-breaker pour que les fruits mutants P192L aient accumulé assez de lycopène pour arborer une couleur rouge (Gady et al. 2012). Au contraire, lorsque PSY1 est surexprimée, les caroténoïdes s’accumulent dans
les fruits de façon beaucoup plus importante (Fraser et al. 2007).
Facteurs de transcriptions impliqués dans le mûrissement et la synthèse de l’éthylène
De nombreux facteurs de transcription sont également impliqués dans la synthèse des caroténoïdes. Les facteurs de transcription les plus connus chez la tomate en mûrissement sont RIN (Ripening Inhibitor), SGC (Stay-Green), NOR (Non-Ripening), CNR (Colorless Non Ripening), TAGL1 (Agamous-Like 1), HB-1 (HD-ZIP Homeobox protein 1), Apetala2a (AP2a), ERF6 (Ethylene Response Factor), ainsi que TDR4 et MBP7 (Fruitfull) (Fujisawa et al. 2013). Le facteur de transcription RIN appartient à la famille des facteurs de transcription Mad-Box. De par sa capacité à interagir avec les promoteurs de nombreux gènes impliqués dans le mûrissement des tomates, il est considéré comme décisif pour le bon fonctionnement de ce processus, et donc pour la synthèse des caroténoïdes. Le facteur RIN interagit directement avec le promoteur du gène PSY1, pour activer sa transcription (Martel et al. 2011). Il peut aussi, conjointement avec les facteurs de transcription TDR4 et MBP7 intervenir sur l’expression de gènes impliqués dans la synthèse de l’éthylène, une phytohormone essentielle dans le mûrissement des fruits climactériques comme la tomate (Li et al. 2011). L’augmentation du niveau d’éthylène dans les
fruits régule en effet à la hausse l’expression de PSY1 et PDS et donc la production des caroténoïdes (Fujisawa et al. 2013). Les plants portant la mutation « never ripe » (Nr) abordée précédemment produisent des fruits qui restent verts car présentant justement une insensibilité à l’éthylène (Lanahan et al. 1994). Le facteur RIN joue également un rôle dans la régulation du métabolisme des parois cellulaires, très important lors de la maturation des fruits (Martel et al. 2011). Enfin, il peut également agir sur d’autres facteurs de transcriptions impliqués dans la
maturation des fruits. Par exemple, le facteur de transcription SGR (stay-green) inhibe l’expression de PSY1, donc la synthèse des caroténoïdes. Cependant, lorsque le facteur RIN réprime le facteur SGR, la synthèse de phytoène, et par conséquent l’accumulation de caroténoïdes devient possible. Les plants mutants pour le gène RIN (rin) présentent
évidemment de sérieux retards de maturation, ainsi qu’une baisse significative d’accumulation de caroténoïdes dans leurs fruits, par rapport à des plants témoins (Fujisawa et al. 2013, Luo et
al. 2013, Ito et al. 2017).
Formation des chromoplastes
La formation des chromoplastes à partir des chloroplastes au cours de la maturation des fruits joue également un rôle important dans la synthèse et l’accumulation des caroténoïdes. Par exemple, des tomates avec des chloroplastes plus efficaces à réaliser la photosynthèse au stade « mature green » seront à l’origine de chromoplastes qui accumuleront davantage de caroténoïdes au stade mature (Nashilevitz et al. 2010). De plus, la quantité et la taille des chromoplastes dans les fruits à maturité influencent grandement la synthèse des caroténoïdes. Les mutants hp-1 et hp-2 (high pigment) produisent respectivement des chromoplastes en plus grande quantité, et plus volumineux. Ces changements favorisent à maturité une accumulation plus importante de caroténoïdes dans le fruit (Liu et al. 2004, Kolotilin et al. 2007).
Dégradation
Les enzymes CCDs (Carotenoid Cleavage Dioxygenase) et NCEDs (9-Cis Epoxycarotenoid Dioxygenase) catalysent le clivage oxydatif des caroténoïdes à des positions précises dans leur chaine hydrocarbonée, pour générer des molécules appelées apocaroténoïdes. L’accumulation des caroténoïdes dans les fruits est donc également régulée par leur dégradation via ces enzymes (Auldridge et al. 2006).
Une bonne compréhension des mécanismes de régulation de synthèse des caroténoïdes est essentielle afin de comprendre les patrons de coloration variés pouvant survenir dans les fruits. Les caroténoïdes étant également à l’origine de composés volatils essentiels à l’arôme des tomates, les connaissances acquises sur le sujet sont d’une grande utilité pour l’étude de leur flaveur.
1.2. Les composés volatils
1.2.1 Description générale
Les caroténoïdes, une fois synthétisés dans les fleurs et les fruits, peuvent servir de précurseurs à la production de molécules volatiles appelées apocaroténoïdes qui ont impact significatif sur la flaveur des fleurs et des fruits.
Toutes les plantes sont capables, grâce à leur métabolisme secondaire, de synthétiser, stocker, et émettre dans l’air une importante quantité de composés volatils. Un cinquième du CO2 atmosphérique fixé chaque jour par les plantes terrestres est relâché dans l’air sous forme de composés volatils. La majorité de ces composés sont dérivés de quatre grandes classes biosynthétiques dérivées du métabolisme secondaire : les terpènes, les acides gras, les composés aromatiques et les produits dérivés des acides aminés (Baldwin 2010). Ils constituent un groupe hétérogène de molécules variées : saturées ou insaturées, à chaînes branchées ou non, qui peuvent porter des structures cycliques possédant des groupements fonctionnels tels que des alcools, des aldéhydes, des cétones, des esters et des éthers, remplissant diverses fonctions (Schwab et al. 2008). Les composés volatils peuvent être synthétisés dans les cellules de l’épiderme. Les
résidus hydrophiles de ces composés volatils doivent être enlevés ou modifiés par des réactions de réduction, de méthylation ou d’acylation afin qu’ils puissent traverser les membranes plasmiques de ces cellules et diffuser dans l’air. Ils peuvent également être synthétisés dans d’autres structures, comme les trichomes (des structures dérivées des cellules épidermiques), les osmophores, ou les cellules épidermiques crénelées spécialisées dans la production et le relâchement de composés volatils dans les fleurs. Ils peuvent finalement sortir des tiges et des feuilles par les stomates. Certains volatils sont même stockés sous certaines formes dans des vacuoles à l’intérieur des cellules (Baldwin
et al. 2010).
Les composés volatils peuvent être synthétisés par les plantes dans le but de se protéger contre différents stress biotiques et abiotiques, leur procurant ainsi des solutions face au défi de devoir vivre immobiles (Pare et Tumlinson 1999). Les feuilles relâchent en temps normal peu de composés volatils mais des hormones de stress comme l’acide jasmonique, l’acide salicylique et l’éthylène stimulent la production de ces composés
lorsque la plante est considérée en danger (Scala et al. 2013). Par exemple, des terpènes à cinq carbones produits en réponse à l’action de ces hormones protègent la plante contre la chaleur, en stabilisant les interactions hydrophobes au sein des membranes. De plus, les terpènes peuvent réagir avec les formes réactives de l’oxygène et ainsi les empêcher d’endommager les cellules (Vickers et al. 2009). Par ailleurs, un mélange complexe de composés volatils dérivés des acides gras émis par les feuilles permet aux plantes de se défendre contre les herbivores, les insectes et les microorganismes pathogènes. La nature des composés émis varie avec l’espèce de la plante, mais aussi avec le type d’herbivore. Les volatils produits confèrent à la plante un goût repoussant l’herbivore, attirant aussi ses prédateurs naturels et lui permettant de prévenir les plantes des dangers qui les entourent afin qu’elles induisent une réaction de défense (Pare et Tumlinson 1999). Les composés volatils émis par les fruits servent pour leur part à signaler aux animaux et insectes disséminateurs de graines que le fruit est de bonne qualité. Ceux-ci vont donc le manger et ainsi disséminer efficacement les graines (Baldwin et al. 2010).
Chez les humains, les composés volatils sont détectés par deux mécanismes complémentaires de la perception olfactive : la rétro-olfaction et l’ortho-olfaction. L’ortho-olfaction consiste à détecter les composés en humant directement l’aliment ou la plante, sans l’ingérer : c’est la notion d’odeur. La rétro-olfaction, en revanche, est le mécanisme physiologique permettant de percevoir à partir du système olfactif les caractéristiques aromatiques, aussi appelées flaveurs, des aliments une fois retrouvés dans la bouche. Les molécules ingérées passent alors à l’arrière du palais pour atteindre l’épithélium olfactif derrière les fosses nasales : c’est la notion d’arôme (Tieman et al. 2012). Certains volatils très abondants dans les fruits ne contribuent pas à former une saveur appréciée par le consommateur, alors que d’autres, beaucoup moins abondants, y contribuent. Sur les 400 composés volatils synthétisés par la tomate, une trentaine ont été identifiés pour leur rôle déterminant dans son arôme (Baldwin et al. 2000). Dans le cadre de ce projet, seuls les composés volatils dérivés des terpènes et des acides gras seront abordés plus en détail.
1.2.2 Les apocaroténoïdes
Origine et odeur des apocaroténoïdes
Certains apocaroténoïdes volatils, synthétisés à partir du clivage oxydatif des caroténoïdes, dégagent des arômes particuliers et agréables afin d’attirer les insectes pollinisateurs et les animaux disséminateurs de graines. Ils sont également d’une grande
importance pour la qualité gustative des fruits et des légumes que nous consommons
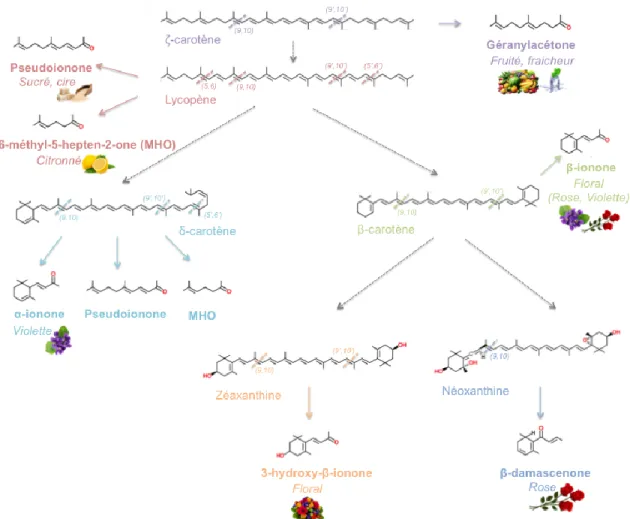
(Baldwin et al. 2010). Les principaux apocaroténoïdes qui participent à la flaveur des tomates sont la β-ionone, le 6-méthyl-5-hepten-2-one, le géranylacétone, l’α-ionone et la pseudoionone. La β-ionone (C13) est issue du clivage de la β-carotène aux liens 9,10 (9’,10’). Ce composé volatil possède une odeur de type floral, plus particulièrement une odeur de rose. Il dégage également des touches de boisé, de fruité, de sucré et de baies. Le clivage de la delta-carotène aux liaisons 9,10 (9’,10’) entraine la formation de l’α-ionone (C13), qui a une odeur caractéristique de violette (Viola odorata), et joue également un rôle très important dans l’arôme de la framboise. Le 6-méthyl-5-hepten-2-one (C8) est un apocaroténoïde possédant un arôme citronné. Il peut être synthétisé par le clivage du lycopène au niveau des doubles liaisons 5,6 (5’,6’), ou bien au niveau de la double liaison 5’,6’ de la δ-carotène. L’apocaroténoïde pseudoionone (C13) résulte du clivage du lycopène aux liaisons doubles 9,10 (9’,10’), ou du clivage de la δ-carotène au niveau de la double liaison 9’,10’ émettant alors un arôme sucré. Le géranylacétone (C13), qui dégage un arôme fruité et frais, est synthétisé lors du clivage de la ζ-carotène aux doubles liaisons 9,10 (9’,10’). (Simkin et al. 2004, Ohmiya 2009). D’autres composés volatils, moins
importants pour l’arôme de la tomate peuvent être synthétisés à partir du clivage oxydatif des caroténoïdes. Par exemple, la β-damascenone (C13) dérive du clivage de la néoxanthine à la liaison 9,10. Dégageant un arôme floral, elle est un des principaux composés volatils responsables de l’odeur des roses. Le composé volatil 3-hydroxy-β-ionone (C13) résulte du clivage de la zéaxanthine aux doubles liens 9,10 (9’,10’). Cet apocaroténoïde possède un arôme floral mais ne semble pas très impliqué dans la flaveur de la tomate (Auldridge et al. 2006). Dans les racines mycorhizées, la β-carotène peut également subir un clivage oxydatif au niveau des liens 9,10 (9’,10’). Cela relâche les apocaroténoïdes mycorradicine (C14) et cyclohexenone (C13), essentiels pour assurer une bonne communication entre les racines et les microorganismes du sol (Floss et al. 2008). La Figure 1.2 résume les différents composés volatils générés à partir des caroténoïdes, ainsi que les caractéristiques olfactives de chaque molécule produite.
Synthèse des apocaroténoïdes
Ce sont des enzymes de type CCD (Carotenoid Cleavage Dioxygenase) qui catalysent le clivage oxydatif des caroténoïdes pour générer les apocaroténoïdes, dont une grande partie sont des composés volatils. Les enzymes de la famille des CCDs partagent plusieurs propriétés. Elles requièrent toutes un ion Fe2+, nécessaire à leur
activité catalytique et contiennent 8 histidines afin de coordonner la fixation de cet ion ferreux. Elles possèdent en outre une séquence peptidique particulière et spécifique à leur extrémité carboxy-terminale. Il existe neuf classes de dioxygénases, recensées d’abord chez l’espèce Arabidopsis thaliana puis identifiées chez d’autres plantes, dont la tomate. Cinq de ces enzymes sont des 9-cis epoxycaroténoïdes dioxygénases (NCED2, NCED3, NCED5, NCED6 et NCED9), qui acceptent seulement comme substrat, des caroténoïdes à 40 carbones en configuration cis (Ohmiya 2009). Ces enzymes sont impliquées dans la biosynthèse de l’hormone acide abscissique, à partir de néoxanthine et de violaxanthine. Cette hormone est très importante chez les plantes, puisqu’elle joue des rôles primordiaux dans la régulation de la tolérance au stress hydrique et le développement de la graine. Les quatre autres classes de CCD, CCD1, CCD4, CCD7 et CCD8, dont les séquences nucléotidiques sont éloignées de celles des 9-cis epoxycaroténoïdes dioxygénases, jouent pour leur part des rôles différents dans la plante
(Tan et al. 2003, Kloer et Schulz 2006).
Les gènes CCD7 et CCD8 s’expriment principalement dans les racines. L’enzyme CCD7 clive la 9-cis-β-carotène de façon asymétrique, au niveau du double lien entre les carbones 9 et 10, afin de produire un composé à 13 carbones, la β-ionone, ainsi qu’un aldéhyde à 27 carbones, le carotenal. L’enzyme CCD8 coupe alors le 10’-apo-β-carotenal par deux réactions de clivage oxydatif consécutives, pour générer l’apocaroténoïde carlactone (C18) (McQuinn et al. 2015). Ce dernier composé est ensuite converti en 5-deoxystrigol, une molécule de type strigolactone, précurseure d’autres strigolactones. Les strigolactones sont des phytohormones très importantes pour le développement de la plante. En plus d’être responsables d’inhiber le bourgeonnement des tiges latérales, elles sont impliquées dans la formation des racines latérales et adventives, le développement des poils racinaires, la germination des graines, la photomorphogenèse et la réponse à différents stress (Goulet et Klee 2010). Les enzymes CCD7 et CCD8 ne sont pas impliquées dans la formation d’arômes (Auldridge et al. 2006). Chez la tomate, les gènes codant pour ces deux enzymes sont respectivement appelés SlCCD7 (Solyc01g090660) et SlCCD8 (Solyc08g066650) (Wei et al. 2016).
Figure 1.2. Synthèse des apocaroténoïdes volatils chez les plantes à partir du clivage
oxydatif des caroténoïdes. La figure illustre les principaux apocaroténoïdes volatils (en gras) émis
par les plantes, les sites de clivage des CCDs au niveau de leurs précurseurs (lignes pointillées) ainsi que leurs arômes respectifs (en italique).
L’enzyme CCD4 est connue pour jouer un rôle dans le clivage oxydatif des caroténoïdes dans les fleurs. De par son action oxydative sur les caroténoïdes, cette enzyme est à l’origine de leur dégradation, et donc de la couleur blanche des pétales de certaines fleurs comme par exemple celles du chrysanthème (Chrysanthemum
morifolium). Au contraire, lorsque l’expression de CCD4 est inhibée, les fleurs de
chrysanthèmes arborent une couleur jaune due aux caroténoïdes qui s’y accumulent
(Kishimoto et Ohmiya 2006). La même observation a été faite sur les graines d’Arabidopsis thaliana, et sur les tubercules de pomme de terre (Solanum tuberosum)
(Campbell et al. 2010, Gonzalez-Jorge et al. 2013). Dans les stigmates du safran (Crocus
sativus), CCD4 est impliquée dans la production d’apocaroténoïdes jaunes, tels que la
bixine, la crocetine et le safranal à partir du clivage de la zéaxanthine. Ce sont ces pigments qui donnent à l’épice sa couleur et son arôme si caractéristiques. Chez certaines
plantes comme le chrysanthème et le pommier, l’enzyme CCD4 semble impliquée dans la synthèse de composés volatils dérivés des caroténoïdes, notamment de β-ionone (Huang
et al. 2009). Dépendamment des espèces, CCD4 peut effectuer le clivage oxydatif des caroténoïdes au niveau des doubles liens 9,10 (9’,10’) et 7,8 (7’,8’) (Huang et al. 2009, Ma et al. 2013). Cependant, comme CCD4 ne s’exprime presque pas dans les fruits de Solanum lycopersicum, elle n’y est pas impliquée dans la synthèse de composés volatils.
Deux isoformes de CCD4, appelés SlCCD4a (Solyc08g075480) et SlCCD4b (Solyc08g075490) existent chez la tomate. SlCCD4a s’exprime surtout dans les fleurs, tandis que SlCCD4b est principalement actif dans les feuilles, et plus modérément dans les fleurs (Fernandez-Pozo et al. 2015, Wei et al. 2016).
En théorie, l’enzyme capable de cliver les doubles liens 9,10 (9’,10’), 5,6 (5’,6’) et 7,8 (7’,8’) des caroténoïdes linéaires et cycliques pour générer dans les fruits la variété d’apocaroténoïdes mentionnés plus haut est CCD1. Il existe deux isoformes de l’enzyme CCD1 chez la tomate, SlCCD1a (Solyc01g087250) et SlCCD1b (Solyc01g087260). Les gènes codant pour ces deux enzymes sont situés sur le chromosome 1 et possèdent 83% d’homologie. Bien que les deux isoformes soient capables de cliver les mêmes substrats, ils présentent in vitro des affinités distinctes pour certains liens et certains caroténoïdes.
SlCCD1a s’exprime surtout dans les racines, tandis que SlCCD1b s’exprime fortement
dans les fruits, des stades « mature green » à « red ripe » (Ilg et al. 2014, Wei et al. 2016). Lorsque l’expression des gènes SlCCD1a et SlCCD1b est inhibée, la quantité d’apocaroténoïdes émise par les tomates est réduite par rapport à des tomates témoins
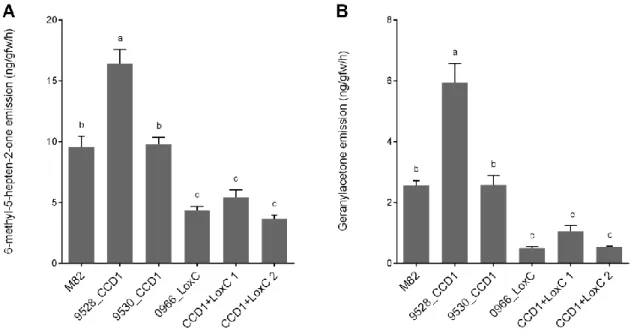
(Simkin et al. 2004). Une baisse de 37 à 45% de la β-ionone et de 56 à 61% du géranylacétone ont en l’occurrence été observés dans les fruits où l’expression des
SlCCD1 avait été supprimée. Cette réduction, bien que significative, n’était cependant pas
totale et les tomates continuaient d’émettre des quantités non négligeables d’apocaroténoïdes. SlCCD1a et SlCCD1b étant les seules enzymes de la famille des CCDs ne possédant pas de peptide de signalisation spécifique aux plastes, elles sont donc situées dans le cytosol alors que les caroténoïdes s’accumulent dans des structures situées à l’intérieur des chromoplastes. SlCCD1a et SlCCD1b ne peuvent donc, en théorie, n’accéder qu’aux caroténoïdes à 40 carbones qui se seraient « échappés » de chromoplastes dont la membrane externe aurait subi des dommages ou bien à ceux qui se retrouvent sur les membranes externes (Walter et al. 2010, Wei et al. 2016). Ces observations laissent supposer que, même si SlCCD1 semble essentielle dans la
synthèse d’apocaroténoïdes chez la tomate, elle doit nécessiter l’assistance d’une autre enzyme ou d’un autre intermédiaire afin de remplir ses fonctions. Cette idée est appuyée par le fait que dans les racines de Medicago truncatula, lorsque l’expression de MtCCD1 est inhibée, en plus d’une baisse importante de mycorradicine et de cyclohexone, des apocaroténoïdes à 14 et 13 carbones, une accumulation de composés non pas à 40 carbones, mais à 27 carbones est observée. Cela suggère que, dans les racines, une première enzyme assurerait le clivage oxydatif des caroténoïdes à 40 carbones en apocaroténoïdes à 27 carbones, qui seraient ensuite pris en charge par CCD1. De plus, des études ont démontré in vitro et chez A. thaliana que l’enzyme CCD1 semble avoir 12 à 16 fois plus d’affinité pour les apocaroténoïdes à 27 carbones tels que le β-apo-10’-carotenal, un dérivé de la β-carotène, plutôt que pour les caroténoïdes à 40 carbones plus courants(Schmidt et al. 2006). L’enzyme CCD7 est de plus en plus considérée comme la
candidate capable de fournir des substrats à 27 carbones à l’enzyme CCD1 dans les racines. Dans les fleurs, c’est l’enzyme CCD4 qui pourrait jouer ce rôle. Cependant,
SlCCD7, SlCCD4a et SlCCD4b ne s’exprimant pas dans les fruits, elles ne peuvent
qu’expliquer la synthèse des apocaroténoïdes dans les racines et les fleurs, mais pas dans les tomates (Floss et al. 2008).
1.2.3 Les composés volatils dérivés d’acides gras
Origine et odeurLes composés volatils retrouvés dans les plantes proviennent en majorité de la dégradation des acides gras saturés et insaturés (Klee et Tieman 2013), qui constituent la deuxième classe de composés volatils pertinente à étudier pour ce projet, en plus des apocaroténoïdes. Ces composés dérivés des acides gras peuvent être des alcools, des aldéhydes, des cétones, des acides ou des esters. Ils sont retrouvés dans toutes les plantes, et à de grandes concentrations. Ils sont produits dans les tissus végétatifs de la plante en réponse à des blessures physiques, ainsi que pour se défendre contre l’attaque d’insectes et de microorganismes pathogènes (Scala et al. 2013). De plus, l’arôme de
verdure et d’herbe fraichement coupée qu’ils dégagent est très importante pour la flaveur des fruits (Schwab et al. 2008). Parmi les composés dérivés d’acides gras, ce sont ceux à
6 carbones (hexanal, cis-3-hexenal, l’hexanol, et cis-3-hexenol) et ceux à 5 carbones (1-penten-3-one, cis-2-pentenal, 3-pentanone, 1-pentanol, 1-penten-3-ol, éthylvinylcétone)
qui sont considérés comme les plus importants pour l’arôme de la tomate (Tieman et al. 2012).
Synthèse des composés volatils dérivés d’acides gras
Au cours de la maturation des fruits, la transformation des chloroplastes en chromoplastes implique la dégradation des membranes des thylakoïdes par des lipases, ce qui relâche alors des acides gras polyinsaturés à 18 carbones tels que l’acide linolénique et l’acide linoléique (Chen et al. 2004). L’enzyme 13-lipoxygénase (13-LOX)
est une dioxygénase catalysant l’incorporation d’un atome d’oxygène au niveau du carbone en position 13 des acides gras linoléiques et linoléniques afin de les convertir en acides gras hydroperoxydés en position C13 (13-HPOs) (Schwab et al. 2008). Afin de générer des composés volatils à 6 carbones, l’enzyme hydroperoxyde lyase (HPL) transforme ensuite ces acides gras hydroperoxydés en aldéhydes volatils, comme l’hexanal et le cis-3-hexenal (Shen et al. 2014). L’enzyme alcool déshydrogénase 2
(ADH2) peut alors convertir l’hexanal et le cis-3-hexenal en alcool pour créer, respectivement, les composés volatils hexanol et cis-3-hexenol (Speirs et al. 1998). Les 13-HPOs peuvent également être modifiés une deuxième fois par la 13-LOX avant d’être pris en charge par d’autres enzymes pour générer les différents composés volatils dérivés des acides gras à 5 carbones énumérés précédemment (Shen et al. 2014). Chez S.
lycopersicum, la 13-LOX responsable de la synthèse des composés volatils dérivés des
acides gras dans les fruits est connue sous le nom de TomloxC (Solyc01g006540). TomloxC se situe dans les chloroplastes, et son niveau d’expression augmente considérablement au cours de la maturation des fruits. Il existe deux autres 13-LOX chloroplastiques chez la tomate (Chen et al. 2004). TomloxD, dont l’expression est
distribuée dans les racines, les fleurs, les feuilles et les fruits, est impliquée dans la synthèse de la phytohormone acide jasmonique (Hu et al. 2011, 2013). TomloxF s’exprime
très peu en temps normal dans les fruits en comparaison avec TomloxC et TomloxD, son expression étant stimulée lors d’une infection par des agents pathogènes (Shen et al. 2014). Cet isoforme de la 13-LOX est impliqué dans la synthèse d’acide 13-hydroxy-octadécatrienoïque, qui a des propriétés antifongiques. Son rôle dans la synthèse des composés volatils C6 n’a pas été caractérisé (Mariutto et al. 2011).
Trois 9-lipoxygénases, TomloxA, TomloxB et TomloxE, ont également été identifiées chez S. lycopersicum. Ces trois isoformes utilisent les mêmes substrats que les 13-LOX afin de générer des acides gras hydroperoxydés en position C9, les 9-HPOs (Hu
et al. 2014). Ces composés peuvent ensuite être transformés en diverses molécules impliquées dans la défense des plantes, telles que l’acide colnelénique et l’acide 9-oxo-nonanoique (Fammartino et al. 2007, Mita et al. 2005). Bien que très exprimées dans les fruits en maturation, ces trois 9-LOX ne sont pas impliqués dans la synthèse de composés volatils des acides gras (Griffiths et al. 1999). Si la 13-LOX est particulièrement importante pour ce projet, c’est parce qu’en catalysant l’oxydation des acides gras, elle pourrait également entrainer l’oxydation des caroténoïdes présents dans les plastes. En effet, les radicaux peroxyl provisoirement générés lors de l’hydroperoxydation des acides gras peuvent, de par leur caractère très réactif, provoquer l’oxydation aléatoire des caroténoïdes (Wu and Robinson, 1999). Ce processus de co-oxydation est connu in vitro et dans la farine depuis plusieurs années (Leenhardt et al. 2006).
1.3. Objectifs et hypothèses
En résumé, l’accumulation des caroténoïdes dans les tomates au cours de leur maturation est essentielle afin de leur donner aussi bien leur couleur caractéristique que leur flaveur. La synthèse des apocaroténoïdes, des composés volatils réputés pour avoir un impact significatif sur l’arôme des fruits, dérive directement du clivage oxydatif des caroténoïdes. La nature et la concentration respective des différents caroténoïdes qui sont à l’origine des multiples patrons de coloration des tomates à maturité, apparaît par conséquent déterminant sur le mélange d’apocaroténoïdes produits, et donc sur la flaveur du fruit. Les processus d’accumulation et de clivage des caroténoïdes doivent donc être compris afin de pouvoir contrôler et améliorer l’arôme des fruits. Dans cet optique, l’objectif principal de ce projet de maîtrise était d’étudier les processus génétiques et moléculaires impliqués dans l’arôme de la tomate, et plus particulièrement le sentier de synthèse des apocaroténoïdes. Afin d’identifier de nouveaux gènes impliqués dans ce sentier et ainsi mieux en comprendre certaines étapes clés, trois axes de recherche ont été définis.
Axe 1. Le premier axe de recherche s’est concentré sur l’étape de clivage des
caroténoïdes associés à la libération des apocaroténoïdes volatils. La manière dont l’enzyme CCD1, située dans le cytosol, accède à ses substrats, les caroténoïdes,
enfermés dans les chromoplastes demeurait inconnue. Une première hypothèse pour le projet était donc qu’une ou plusieurs autres enzymes accompagnent CCD1 dans son rôle de clivage, en lui permettant au préalable de se retrouver en contact avec ses substrats. Plus précisément, l’enzyme Lipoxygénase C (TomloxC), en assurant sa fonction originelle d’oxydation des acides gras dans les plastes des tomates, pourrait entrainer la co-oxydation aléatoire des caroténoïdes, par l’entremise de radicaux peroxyles très réactifs. Ainsi, la co-oxydation des caroténoïdes dans les plastes par TomloxC constituerait une étape préalable à leur clivage oxydatif par CCD1 dans le cytosol.
Axe 2. Comme la tomate est un modèle d’étude complexe qui émet de multiples
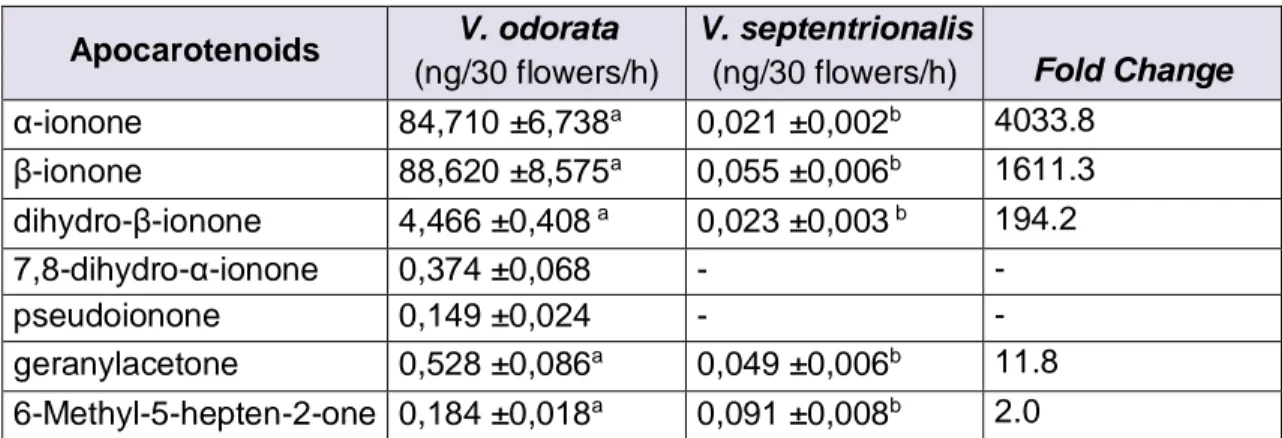
composés volatils, la deuxième partie du projet s’est basée sur l’espèce Viola odorata, ou violette odorante, une petite fleur printanière de couleur violette. Même si les pétales de ses fleurs ne semblent pas accumuler de caroténoïdes, Viola odorata émet de grandes quantités d’apocaroténoïdes, et plus particulièrement d’α-ionone, de β-ionone et de dihydro-β-ionone (Gautschi et al. 2001). L’objectif ici était de comparer les données
transcriptomiques des pétales de V. odorata, avec celles de V. septentrionalis, une espèce apparentée peu odorante (Figure 1.3), afin d’identifier les gènes impliqués dans la synthèse des apocaroténoïdes. Cette expérience a été réalisée dans le but de pouvoir transposer les connaissances acquises sur les violettes, à la tomate. La deuxième hypothèse ayant été posée était donc que des gènes fortement exprimés chez V. odorata par rapport à V. septentrionalis sont impliqués dans la synthèse des apocaroténoïdes. Selon notre hypothèse, les gènes du sentier de production des apocaroténoïdes devraient être très exprimés chez V. odorata afin d’expliquer les importantes quantités d’apocaroténoïdes émises par ses pétales. Au contraire, ces mêmes gènes devraient être peu exprimés chez V. septentrionalis, qui n’émet pas l’odeur caractéristique des apocaroténoïdes.
Axe 3. En complément aux deux premiers axes, nous nous sommes davantage intéressés à comprendre, dans le troisième axe, l’importance des réactions qui se déroulent en amont du clivage présumé des caroténoïdes par l’enzyme CCD1, soit l’accumulation des caroténoïdes dans les tomates en maturation. Il avait été observé au préalable que des tomates appelées « bicolores » à cause de leur coloration particulière comportant un mélange de jaune et de rouge présentaient une baisse d’émission d’apocaroténoïdes par rapport à des tomates rouges standard (Mathieu et al. 2009). Ces
observations suggéraient que les caroténoïdes accumulés dans les fruits ont un impact direct sur le profil d’émission des apocaroténoïdes. Sur cette base, la troisième hypothèse de ce projet était que l’identification d’un gène impliqué dans la synthèse du lycopène permettrait d’expliquer le phénotype particulier de ces tomates « bicolores » qui ne rougissent pas uniformément. De manière plus spécifique, le profil particulier d’apocaroténoïdes émis par les tomates bicolores pourrait être causé par un défaut dans la structure ou l’expression d’un gène régulant la synthèse du lycopène, un caroténoïde responsable de la couleur rouge des fruits chez la tomate.
Chapitre 2 : Synthesis of apocarotenoid volatiles in
flower and fruits: Reassessing the importance of
cytosolic carotenoid cleavage dioxygenases
Bulot, B., Nadeau, L-F., and Goulet, C.
Département de Phytologie, Faculté des Sciences de l’Agriculture et de l’Alimentation, Université Laval. Pavillon Envirotron, 2480 boulevard Hochelaga, Québec QC, G1V0A6, Canada
2.1 Résumé
Chez les tomates, SlCCD1 (Carotenoid Cleavage Dioxygenase 1) est considérée comme l’enzyme responsable du clivage oxydatif des caroténoïdes pour la libération des apocaroténoïdes volatils responsables des arômes fruités et sucrés. Les tomates accumulent de grandes quantités de caroténoïdes dans leurs tissus mais seulement une petite fraction est convertie en apocaroténoïdes, qui contribuent néanmoins de façon significative à leur flaveur. SlCCD1 étant située dans le cytosol, la manière dont elle accède à ses substrats localisés dans les plastes demeure inconnue. L’objectif de cette étude était d’identifier d’autres enzymes qui pourraient, conjointement à CCD1, être impliquées dans le sentier de production des apocaroténoïdes. Les lipoxygénases, qui catalysent la co-oxydation aléatoire des caroténoïdes par l’oxydation des acides gras in
vitro, constituaient à cet égard des candidates intéressantes. Des lignées de tomates
transgéniques dont l’expression de SlCCD1 et de la lipoxygénase C (TomloxC) sont inhibées, ont permis de démontrer que l’absence de SlCCD1 ne cause aucun changement dans l’émission de composés volatils tandis que l’absence de TomloxC entraine une diminution d’apocaroténoïdes. Ces observations suggéraient que SlCCD1 n’est pas une enzyme clé dans la synthèse des apocaroténoïdes alors que TomloxC y jouerait un rôle déterminant. Les fleurs de la violette odorante (Viola odorata), au contraire des tomates, accumulent peu de précurseurs, mais produisent beaucoup d’ionones. Afin d’évaluer le rôle des lipoxygénases et des CCDs chez V. odorata, une analyse transcriptomique a été réalisée pour comparer ses fleurs et celles d’une espèce inodore apparentée, V.