Évaluation du potentiel antimicrobien de composés
inspirés de peptides
Mémoire
Gaëlle Simon
Maîtrise en chimie - avec mémoire
Maître ès sciences (M. Sc.)
Évaluation du potentiel antimicrobien de composés
inspirés de peptides
Mémoire
Gaëlle Simon
Sous la direction de :
Résumé
Alors que les options de traitement s’épuisent devant la problématique pandémique de résistance microbienne, il est d’une pertinence tout à fait actuelle de multiplier les stratégies pour traiter les maladies infectieuses. Ces travaux portent sur l’investigation du potentiel antimicrobien de peptides et de dérivés peptidiques inspirés par des métabolites bioactifs. Les effets de trois familles de molécules synthétiques comportant des groupements non-naturels ont été étudiés dans un contexte de microbiologie buccale. Le biofilm dentaire, dense et polymicrobien, est un excellent modèle pour le développement de nouveaux antimicrobiens. À la recherche de composés pouvant inhiber la formation du biofilm bactérien, interrompre les processus infectieux ou désorganiser les membranes bactériennes, l’évaluation de l’activité de dipeptides cycliques, de pipérazines et de courts peptides cationiques a été effectuée. L’investigation a été conduite pour chaque famille de molécules de façon à définir le spectre d’action, en révéler le mécanisme et établir une relation entre la structure et l’activité qui prenne en considération les contraintes structurelles et la stéréochimie.
Table des matières
Résumé ... ii
Table des matières ... iii
Liste des figures ... vi
Liste des tableaux ... vii
Liste des abréviations, sigles, acronymes ... viii
Remerciements ... x
Avant-propos ... xi
Introduction ... 1
1. Le biofilm microbien ... 4
1.1 Le biofilm est un colonisateur universel ... 5
1.2 Le biofilm est meneur de la résistance ... 7
1.2.1 Le biofilm en tant que forteresse ... 7
1.2.2 Le biofilm en tant que société inclusive forte de sa diversité ... 8
2. Le biofilm oral ... 10
2.1 Les microorganismes pathogènes buccaux ... 10
2.1.1 Bactéries parodontopathogènes: Porphyromonas gingivalis et Fusobacterium nucleatum ... 11
2.1.2 Streptococcus mutans ... 12
2.1.3 Candida albicans ... 13
3. La communication chez les microorganismes ... 16
3.1 La détection du quorum chez la bactérie ... 17
3.2 La détection du quorum chez Candida albicans ... 19
3.3 Les communications inter-espèces et inter-domaines ... 21
4. Stratégies pour combattre le biofilm ... 23
4.1 « Quorum quenching » et inhibiteurs de virulence ... 24
4.1.1 Dicétopipérazines ... 25
4.1.2. Pipérazines ... 26
4.1.3 Peptides antimicrobiens ... 27
Chapitre 1. Anti-biofilm and anti-adherence properties of novel cyclic dipeptides against oral pathogens ... 29
1.1 Résumé ... 29
1.2 Abstract ... 29
1. Introduction ... 30
2. Results and discussion ... 32
2.1 Synthesis of cyclic dipeptide library ... 32
2.2 Determination of anti-biofilm activity ... 34
2.2.2 Candida albicans biofilm ... 37
2.3 Biofilm disruption ... 39
2.4 Antimicrobial susceptibility assay ... 39
2.5 Effects of CDPs on adherence of S. mutans and C. albicans to an hydroxylapatite surface ... 40
3. Conclusion ... 41 4. Experimental ... 42 4.1 General information ... 42 4.2 Preparation of CDPs (1-75) ... 42 4.3 Characterization of CDPs (1-46) ... 43 4.4 Anti-biofilm activity ... 44
4.5 Determination of minimal inhibitory concentration ... 45
4.6 Adherence to a hydroxylapatite surface ... 45
5. Acknowledgments ... 46
6. Declaration of interest ... 46
7. References ... 46
Chapitre 2. Preventing Candida albicans biofilm formation using aromatic-rich piperazines. ... 49
2.1 Résumé ... 49
2.2 Abstract ... 49
Preventing Candida albicans biofilm formation using aromatic-rich piperazines ... 50
1. Introduction ... 50
2. Results ... 51
2.1 Synthesis of piperazine analogs... 51
2.2 Identification of anti-biofilm compounds ... 53
2.3 Anti-biofilm mechanisms of action of piperazines ... 56
3. Discussion ... 61
4. Experimental... 62
4.1 Synthesis ... 62
4.2 Characterization of piperazines and N,N’-dimethylpiperazines ... 63
4.4 Inhibition of morphogenesis ... 67
4.5 Reduction of adherence ... 68
5. Author contributions ... 69
6. Acknowledgements ... 69
7. References ... 69
Chapitre 3. 2,5-dicétopipérazines et pipérazines : comparaison et résultats supplémentaires ... 75
3.1 Activité anti-biofilm ... 76
3.2 Activité antimicrobienne ... 76
3.3 Inhibition de l’adhérence microbienne ... 77
3.4 Inhibition de la morphogénèse ... 77
Chapitre 4. Peptides 14-mères cationiques ... 78
4.1 Peptides à l’étude ... 78
4.2 Travaux antérieurs ... 79
4.3 Objectifs ... 80
4.4 Méthodes expérimentales ... 80
4.4.1 Test standardisé d’activité antimicrobienne ... 80
4.4.2 Test de perméabilité membranaire ... 81
4.4.3 Test de viabilité cellulaire BacTiter-Glo™ ... 81
4.4.4 Activité anti-biofilm ... 82
4.5 Résultats ... 82
4.5.1 Activité antimicrobienne ... 82
4.5.2 Perméabilisation de la membrane bactérienne ... 84
4.5.3 Diminution de la viabilité de E. coli ... 87
4.5.4 Inhibition de la formation de biofilm ... 88
4.6 Discussion ... 89
Conclusion ... 92
Liste des figures
Figure 1. Antibiotiques commerciaux récents de la classe des lipopeptides cycliques et des oxazolidones ... 1
Figure 2. Cycle général de développement du biofilm microbien. Figure tirée de Lebeaux et al. (2012) 41 ... 4
Figure 3. Infections causées et entretenues par des biofilms. Figure tirée de Lebeaux et al. (2012) 41 ... 7
Figure 4. Évolution des maladies parodontales liées au tartre. ... 11
Figure 5. Évolution de la carie dentaire. ... 12
Figure 6. Principales morphologies de Candida albicans et traits de virulence associés. ... 13
Figure 7. Morphologies et principaux facteurs de résistances associés au développement du biofilm de Candida albicans. Image adaptée depuis la publication de Lohse et al. (2018).110 ... 14
Figure 8. Représentation schématique de la détection du quorum chez les bactéries Gram négatives (A) et Gram positives (B). ... 17
Figure 9. Molécules de signalisation régulant la détection du quorum chez les bactéries. ... 18
Figure 10. Molécules de signalisation régulant la détection du quorum chez Candida albicans ... 20
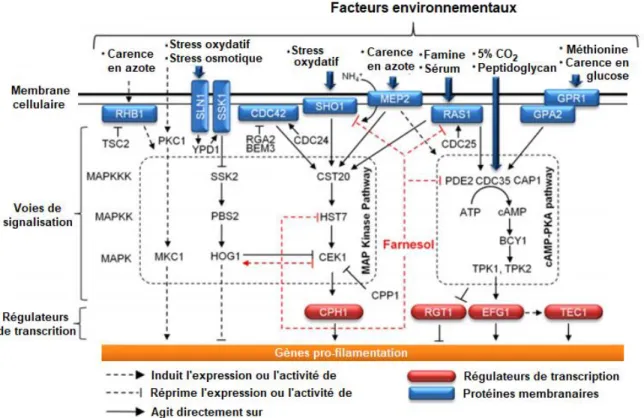
Figure 11. Voies métaboliques induisant la morphogénèse de Candida albicans en réponse à différents facteurs environnementaux et régulation par le farnesol (rouge). Figure adaptée de Han et al. (2011)178 ... 21
Figure 12. 2,5-piperazinedione ... 25
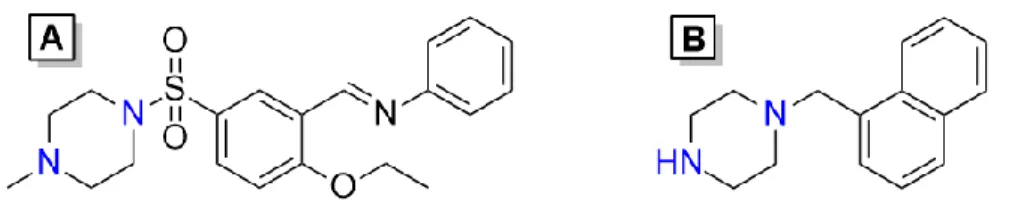
Figure 13. Pipérazines inhibant la formation du biofilm fongique (A)204 et l'expression de facteurs de virulence des entérobactéries (B)205 via la modulation de mécanismes de la détection du quorum. ... 26
Figure 14. Dicétopipérazines (gauche, présentées au Chapitre 1) et leurs dérivés pipérazine (droite, présentées au Chapitre 2) partageant un motif bioactif commun. ... 75
Figure 15. Peptide 14-mère dont une série d'analogues a été synthétisée par substitution de leucines pour des résidus basiques. ... 78
Figure 16. Cinétique de fluorescence du SYTOX® Green induite par la désorganisation membranaire d'E. coli ATCC 15939 en présence de peptides 14-mères. ... 86
Figure 17. Réaction luminescente du réactif test de viabilité BacTiter Glo catalysée par la luciférase en présence d'ATP. ... 87
Figure 18. Luminescence relative mesurée par réaction du BacTiter Glo avec des cellules d'E. coli ATCC 15939 après plusieurs temps d'incubation en présence des peptides Rac27-A1 et NPO 159D. ... 87
Liste des tableaux
Tableau 1. Courts peptides cationiques antimicrobiens connus ... 28
Tableau 2. Activité antimicrobienne des pipérazines dans les conditions expérimentales de la formation du biofilm ... 76
Tableau 3. Activité antimicrobienne de la pipérazine 1a contre des bactéries pathogènes communes. ... 77
Tableau 4. Dénomination des principaux peptides 14-mères antimicrobiens ... 79
Tableau 5. Compilation des valeurs d’activité antimicrobienne des 14-mères à l’étude. ... 83
Tableau 6. Variation de la concentration minimale inhibitrice en fonction de la densité optique de l'inoculum bactérien ... 84
Tableau 7. Fluorescence relative obtenue par réaction avec le SYTOX® Green lors de l’incubation d’E.coli ATCC 15939 en présence des peptides 14-mères (duplicata) à 37 °C pendant une heure. ... 85
Tableau 8. Luminescence relative mesurée par réaction du BacTiter GloTM avec E. coli ATCC 15939 en présence de peptides 14-mères ... 88
Tableau 9. Comparaison des ratios de 14-mères et de bactéries dans les différentes méthodes expérimentales ... 90
Liste des abréviations, sigles, acronymes
6-Cl-HOBt: 6-Chloro-1-hydroxybenzotriazole dihydrateAcOH: Acide acétique AI: Auto-inducteur AI-2: Auto-inducteur-2 Boc: tert-Butoxycarbonyle Bn: Benzyl
CDP: Cyclic dipeptide (dipeptide cyclique) CMI: Concentration minimale inhibitrice CMB: Concentration minimale bactéricide CMF: Concentration minimale fongicide DIC: N,N'-Diisopropylcarbodiimide DIEA: N,N-diisopropyléthylamine DMAP: 4-diméthylaminopyridine
DMEM: Dubelcco’s Modified Eagle’s Medium DMF: N,N-Diméthylformamide
DO660: Densité optique à 660nm
FITC: Isothiocyanate de fluorescéine Fmoc: 9-fluorénylméthyloxycarbonyle
HBTU : O-(Benzotriazol-1-yl)-N,N,N′,N′-tetramethyluronium hexafluorophosphate HEPES: Acide 4-(2-hydroxyéthyl)-1-pipérazineéthanesulfonique
IC50: Concentration inhibitrice médiane
MHB: « Mueller Hinton Broth » MOI: Multiplicity of infection OD660: Densité optique à 660 nm
PAC: Peptide antimicrobien cationique PBS: Tampon phosphate salin
QS: Quorum sensing (détection du quorum)
RFU: Relative fluorescence unit (Unité relative de fluorescence) R.T.: Room Temperature (Température ambiante)
THB: « Todd Hewitt Broth » TFA: Acide trifluoroacétique THF: Tétrahydrofurane
« La résistance aux antimicrobiens pourrait réduire à néant de nombreuses découvertes médicales du siècle dernier. Des maladies infectieuses qui jusqu’ici pouvaient être guéries pourraient devenir impossibles à traiter et se propager de par le monde. De fait, cela a déjà commencé à se produire. » 1
Remerciements
Une maîtrise multidisciplinaire se réalise en collaboration avec beaucoup de personnes et implique de longs remerciements.
J’aimerais d’abord témoigner ma gratitude à mon directeur de recherche. Merci à Normand Voyer pour son enthousiasme, sa latitude, sa confiance, son humour et pour la place qu’il sait faire à la créativité et à l’émerveillement. Je tiens aussi à remercier sincèrement le Professeur Daniel Grenier, qui m’a accueillie dans son laboratoire et s’est montré d’une générosité, d’une constance, d’une patience et d’une implication exceptionnelles à mon endroit. Merci de m’avoir gentiment prêté tes professionnels de recherche pour me former en microbiologie. Tandis que je les mentionne, merci à Jabrane, Katy et Geneviève pour tout ce qu’ils ont fait pour et avec moi dans les deux dernières années (incluant le Zumba et autres types de pauses santé). Je me dois aussi de remercier tous les membres de ces deux laboratoires. En particulier, j’aimerais remercier chaleureusement Christopher Bérubé, qui a été mon principal collaborateur dans ces travaux. Faire équipe avec des gens aussi positifs, proactifs et inspirés que mon co-auteur est une bénédiction motivante qui allège et enjolive les études graduées. J'aimerais exprimer une tendre reconnaissance à Amel Ben Lagha et Marie-Pier Veilleux pour leur sourire, leur aide avec la culture cellulaire et leur ouverture à partager avec moi leurs précieuses connaissances sur la microbiologie, Candida albicans, les démarches administratives qui m’échappent ou l’endroit où s’est caché un produit. Au laboratoire Voyer, merci à Pierre-Alexandre Paquet-Côté et Nicolas Poulin qui ont fait naître, vivre et survivre le projet des 14-mères. Un merci spécial à Pierre-Alexandre qui déniche toujours la bonne information au bon moment: merci de prendre le temps de faire ça. J’en profite aussi pour remercier Claudia Carpentier et Meggan Beaudoin, avec qui j’ai travaillé sur un projet qui ne fait malheureusement pas partie de ce mémoire.
Merci finalement à tous ceux qui m’ont offert du support motivationnel quelque part à travers mon parcours académique et nomade, qui m’ont parfois alimentée ou hébergée et qui m’ont souvent fait rire. Un premier remerciement dans cette catégorie va à toutes mes figures parentales, Nadine, Pascal, Philippe et Brigitte. J'aimerais aussi faire un clin d’œil au professeur John Kingma, à mon oncle Guillaume et à Anne Letarte pour leur exprimer ma gratitude avant de changer de paragraphe.
Les dernières et non les moindres, pour toutes les raisons précédentes et encore davantage : merci à mes acolytes inconditionnelles, Anne-Sophie Lavoie et Audrey Gilbert, ainsi qu’à leur famille.
Avant-propos
Ce mémoire décrit en trois parties des travaux de maîtrise portant sur l’évaluation de l’activité antimicrobienne de peptides et de composés d’inspiration peptidique issus de la synthèse sur support solide. Le premier chapitre traite de résultats publiés dans Bioorganic and Medicinal Chemistry sur l’activité anti-biofilm de 2,5- dicétopipérazines. Le deuxième chapitre est un article en préparation qui recense les résultats obtenus quant à l’activité anti-biofilm de pipérazines spécifique à Candida albicans. Le court chapitre 3 compare les résultats obtenus entre ces deux groupes de molécules et recense quelques résultats supplémentaires. Le quatrième et dernier chapitre dresse le bilan des résultats obtenus avec une série de peptides 14-mères cationiques qui agissent comme perturbateurs de la membrane bactérienne.
Introduction
La résistance microbienne est un problème d’envergure mondiale consistant en la capacité des microorganismes à contrecarrer l’action des traitements antimicrobiens et se rencontre sans discrimination dans les infections d’origine bactérienne, virale, fongique et parasitaire. Constituant la réponse évolutive adaptative des agents pathogènes à l’invention humaine, le phénomène de résistance est apparu dès la découverte des antibiotiques.2 En effet, les premières souches d’Escherichia coli produisant des pénicillases ont été rapportées3
et la propagation de ce gène de résistance a été documentée4 avant même que la pénicilline ne soit produite
industriellement. Cette découverte n’en demeure pas moins une révolution médicale ayant changé la face du monde et ouvert le bal au développement fulgurant d’une vingtaine de classes d’antibiotiques entre 1940 et 1962. Depuis lors, tandis que la résistance microbienne n’a cessé de se répandre progressivement,5 seulement
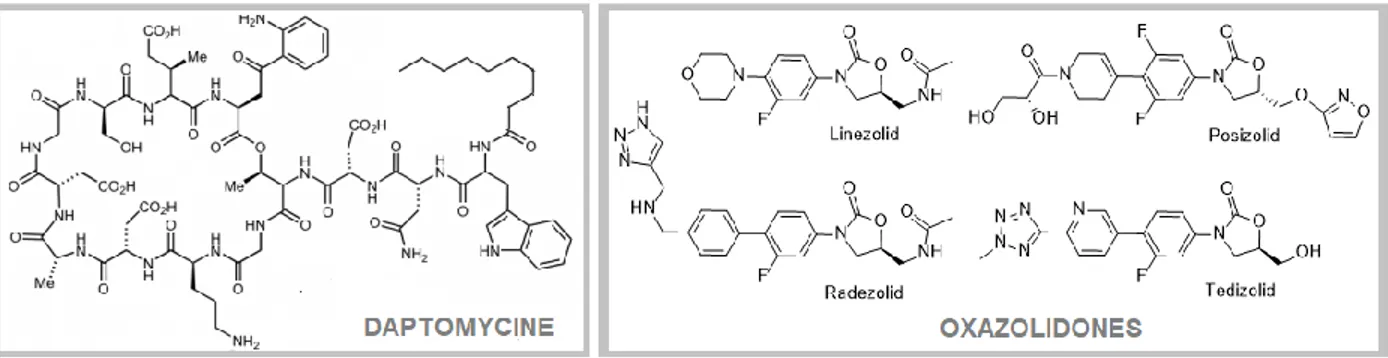
deux nouvelles classes d’antibiotiques ont été commercialisées: les lipopeptides cycliques comme la daptomycine6 et les inhibiteurs de la synthèse protéique de la famille des oxazolidones7 (Figure 1).
Figure 1. Antibiotiques commerciaux récents de la classe des lipopeptides cycliques (gauche) et des oxazolidones (droite).
La rareté des nouveaux antimicrobiens est d’autant plus problématique dans le cas des infections fongiques, contre lesquelles les agents thérapeutiques disponibles sont encore plus limités.8 En effet, les antifongiques
commerciaux ciblent soit la synthèse de l’ergostérol ou des 1,3-β-glucanases. Pour traiter ces infections de plus en plus inquiétantes, il s’agit d’un éventail de stratégies bien maigre, voir déjà insuffisant face à certaines espèces de Candida.9-11
Le ralentissement de la recherche, le désintérêt de l’industrie pharmaceutique,12 la surutilisation d’antibiotiques
et l’augmentation des déplacements humains internationaux ont contribué à l’épuisement des ressources thérapeutiques qui se manifeste par l’apparition d’agents pathogènes pan-résistants à travers la planète.13-15
L’Organisation mondiale de la Santé considère que la situation actuelle représente un enjeu majeur de santé publique alors que se multiplient les cas de résistances aux traitements de dernier recours. L’échec de traitement
est d’une gravité particulière dans le cas des bactéries à Gram négatif, la résistance de Klebsiella pneumoniae aux carbapénèmes16 et d’E. coli aux fluoroquinones17,18 se présentant dans plus de 50% de ces infections dans
certains pays. Le taux de mortalité élevé lié aux infections par les entérobactéries résistantes aux carbapénèmes est aujourd’hui renforcé par l’apparition de gènes de résistance au dernier traitement alternatif, la colistine.19,20,21
Le plasmide porteur de cette résistance s’est répandu mondialement et n’est plus exclusif aux entérobactéries,22
si bien qu’on le retrouve dans le microbiote de patients n’ayant jamais été exposés à l’antibiotique.23 S’ajoutant
à la liste des infections désormais incurables, l’émergence de gonorrhées résistantes aux céphalosporines de 3e génération a été confirmée dans plus d’une dizaine de pays industrialisés incluant le Canada.24
La situation de crise s’étend donc bien au-delà de la problématique de Staphylococcus aureus multi-résistants qui hante les hôpitaux depuis déjà plus de trente ans.25 Comme dans tous les cas de résistance, l’incidence de
S. aureus multi-résistant entraîne une augmentation de la complexité et des coûts de traitement, du temps d’hospitalisation des patients et des risques de transmission et de morbidité des infections.26 En plus du fardeau
socio-économique qu’elle impose, la résistance microbienne menace par son ampleur croissante de faire régresser la médecine à l’ère préantibiotique et de rendre la population mondiale vulnérable à des épidémies intraitables dans un futur rapproché.
La résistance ne fait pas d’exception et compromet le traitement de maladies aux impacts majeurs comme la tuberculose, la malaria, le VIH et l’influenza. Les gènes de résistance sont déjà présents dans l’environnement incluant l’eau potable27 et se propageront inévitablement à l’échelle globale,28 malgré des mesures de santé
publique, de prévention et de surveillance qui puissent tenter de ralentir le processus.29,30 Il a été démontré que
les amateurs de sports nautiques sur les côtes du Royaume-Uni sont plus à risque d’être colonisés par des souches cliniquement résistantes d’E. coli auxquels ils sont exposés dans l’eau,31 ce qui illustre l’ampleur de la
présence de la résistance dans l’environnement.
Pour complexifier cet enjeu, les changements climatiques entraîneront éventuellement des migrations humaines et fauniques massives, une incidence accrue de phénomènes météorologiques extrêmes et une foulée de facteurs qui favoriseront la répartition de la résistance comme l’émergence de nouvelles maladies.32 Le
réchauffement global laisse envisager l’éclosion dans un territoire de plus en plus étendu d’infections parasitaires ou transmises par des vecteurs qu’on retrouve traditionnellement en zones tropicales, comme la malaria et le paludisme.33 Un exemple flagrant touchant le Canada est l’incidence croissante de la maladie de
Lyme, causée par un microorganisme infectant une tique qu’on ne trouvait pas à cette latitude jusqu’à ce que les températures plus élevées induisent la migration d’animaux porteurs de la tique, comme la souris à patte blanche, vers le nord.34
Selon la même logique, on peut s’attendre à voir s’élargir les zones géographiques dans lesquelles s’établissent les espèces fongiques. On anticipe que l’augmentation de la fréquence et l’apparition d’infections fongiques35
seront amplifiées par la vulnérabilité grandissante de l’hôte humain lorsque ces espèces s’adapteront à des températures élevées s’approchant de plus en plus de la température du corps.36,37 Considérant le peu de
traitements antifongiques commerciaux mentionné plus tôt, il serait convenable de développer de nouveaux agents ou vaccins antifongiques pour se préparer à l’émergence et la résistance de ces espèces.38,39
En somme, il est essentiel de développer de nouvelles approches thérapeutiques en réponse à la situation d’urgence que constitue la résistance microbienne. De nouvelles stratégies thérapeutiques sont nécessaires pour permettre de contrôler les infections en utilisant des mécanismes innovateurs qui ne favoriseraient pas l’acquisition de résistance. En ciblant des facteurs de virulence et des voies métaboliques essentielles à la pathogenèse, mais non microbicides, on peut envisager d’interrompre le processus infectieux (et la maladie) en minimisant la pression adaptative exercée sur le pathogène. En effet, il est proposé dans la littérature que la réponse évolutive serait amoindrie si l’agent antimicrobien ne menace pas la survie des microorganismes pathogènes, éliminant le facteur de sélection naturelle qui résulte d’un traitement microbicide ne permettant que la survie des agents infectieux résistants.40 De tels traitements présenteraient aussi l’avantage collatéral de
diminuer les effets secondaires liés à la perturbation du microbiote.
Les microorganismes évoluent in vivo dans un milieu compétitif et multifactoriel où ils interagissent avec les autres microbes et leur environnement. La plupart d’entre eux, pathogènes ou non, vivent dans des communautés organisées et structurées appelées biofilms. Dans le cadre de ces travaux de maîtrise, le potentiel antimicrobien de peptides et dérivés peptidiques a été évalué visant à développer de nouveaux agents perturbant le cycle d’établissement du biofilm, la communication intercellulaire et d’autres facteurs de virulence de microorganismes pathogènes buccaux. Les concepts clés de la problématique et les cibles envisagées seront décrits pour justifier la pertinence des mécanismes pathogènes visés dans cette étude. La structure et le développement du biofilm ainsi que son importance dans les domaines médicaux et industriels seront décrits. Une attention particulière sera portée aux voies de signalisation qui permettent la communication et la coordination des microorganismes entre eux, ainsi qu’à l’intérêt d’interférer dans ces communications.
1. Le biofilm microbien
Le terme « biofilm » réfère à une communauté multicellulaire de microorganismes qui adhèrent entre eux et à une surface grâce à la sécrétion d’une matrice extracellulaire adhésive et protectrice. Celle-ci contribue à la structure tridimensionnelle dense et complexe du biofilm et est principalement composée d’exopolymères, notamment de polysaccharides, de protéines et d’ADN extracellulaire, et d’autres excrétats cellulaires selon les espèces microbiennes. Les bactéries et les mycètes intégrés au sein d’un biofilm adoptent un comportement coopératif et différencié qui les distinguent des individus de la même espèce sous leur forme planctonique. Le biofilm est donc associé à l’émergence de propriétés distinctes qu’on ne peut observer chez les microorganismes en suspension.41
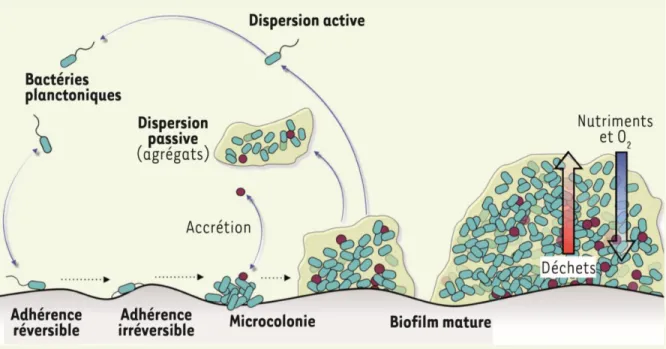
Figure 2. Cycle général de développement du biofilm microbien. Figure tirée de Lebeaux et al. (2012) 41
Le cycle de vie général d’un biofilm (Figure 2) est initié par l’adhérence des premiers microorganismes à une surface, cette première étape dépendant des propriétés physicochimiques de la surface (charges électrostatiques, hydrophobicité), des composantes membranaires et des protéines de surfaces des microorganismes. L’adhérence est d’abord permise par des interactions non-spécifiques favorables et réversibles, puis l’attachement irréversible est assuré par des adhésines et autres protéines de liaison.
La phase suivante est marquée par l’adhésion des microorganismes entre eux pour former une micro-colonie. La croissance microbienne et la sécrétion concomitante des composantes de la matrice se poursuivent pendant la maturation du biofilm, durant laquelle l’expression génique des microorganismes est synchronisée par des mécanismes régulateurs et des signaux moléculaires en réponse aux stimuli environnementaux et à la densité de la population microbienne. Le biofilm consomme des nutriments en s’épaississant ce qui crée des gradients de concentration en oxygène, en nutriments et en déchets cellulaires, de façon à former des microenvironnements distincts à travers la structure tridimensionnelle dense du biofilm. La dispersion du biofilm mature permet ensuite de relarguer dans l’environnement des microorganismes planctoniques et des agrégats qui seront disséminés pour permettre la colonisation de nouvelles surfaces.42
1.1 Le biofilm est un colonisateur universel
Aucune espèce microbienne ne vit strictement sous forme planctonique dans la nature, ce qui témoigne de l’universalité des biofilms. Il s’agit du mode de vie le plus répandu sur la planète, d’un élément d’adaptation évolutive des microorganismes omniprésent et essentiel à l’équilibre écologique participant activement aux cycles biogéochimiques des nutriments.
Le biofilm peut s’établir sur tous les types de surfaces, qu’elles soient de nature biologique comme la peau, les muqueuses, l’émail dentaire, les ongles, la viande et les végétaux, ou abiotique. Les microorganismes peuvent ainsi coloniser sans exception les surfaces industrielles, polymères, minérales ou synthétiques, incluant des matériaux antiadhérents comme le téflon. Cette capacité d’adaptation des microorganismes en fait même des colonisateurs de l’espace : la découverte de biofilms dans 4 stations spatiales a fait naître un projet de recherche à la Station Spatiale Internationale pour mieux comprendre et prévoir les risques encourus pour la santé et l’équipement dans le cadre de mission de longue durée.43
Cette répartition ubiquitaire fait du biofilm un enjeu présent dans tous les secteurs d’activité humaine. Le biofilm établi dans les canalisations (tuyauterie, aqueducs, réservoirs, etc.) influe sur la concentration des microbes mais aussi de l’oxygène dissous, de métaux et de matières organiques dans l’eau. Le biofilm influence aussi d’autres facteurs pouvant avoir un impact sur les procédés industriels comme la dureté de l’eau, l’efficacité des désinfectants et la corrosion.44-46 La contamination de la tuyauterie par les biofilms en fait d’abord une menace
à la qualité des eaux potables et à la salubrité alimentaire, comme en témoignent les éclosions de listériose d’origine alimentaire47-49 et de légionellose,50 dont une épidémie causée par des biofilms dans les tours de
Les biofilms établis sur les murs, les planchers et autres surfaces industrielles, les systèmes de nettoyage et d’aération et chez les êtres vivants constituent d’autant plus de réservoirs pathogènes à partir desquels les microorganismes peuvent se disséminer pour contaminer les aliments.48,52 Cela pose également un problème
majeur en milieu hospitalier, où ces biofilms hébergent les agents pathogènes qui contribuent aux infections nosocomiales. Des procédures préventives rigoureuses de nettoyage et de désinfection sont nécessaires pour limiter les risques de transmission de maladie.
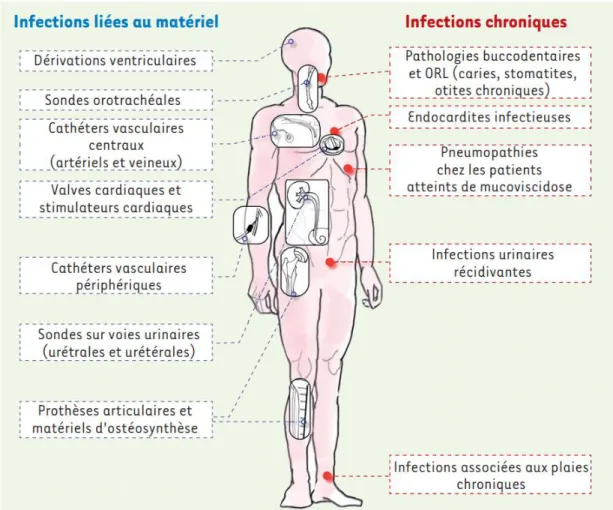
En plus des surfaces et vecteurs de transmission mentionnés précédemment, le biofilm microbien peut s’établir sur du matériel médical directement en contact avec le patient, incluant les sondes et les cathéters, les prothèses, les valves cardiaques et les appareils dentaires.41,53,54 On estime que la moitié des cathéters veineux
aux États-Unis sont colonisés par des biofilms, une contamination responsable à elle seule de plus de 100 000 décès et 6,5 milliards de dollars de frais supplémentaires par année.54,55
Les infections liées au matériel médical représentent une sérieuse proportion des infections nosocomiales et un enjeu socioéconomique majeur. Elles impliquent des risques accrus de complications et de morbidité pour les patients, une menace particulièrement mortelle dans les pays en voie de développement.56,57 Des systèmes de
surveillance ont été établis progressivement à travers le monde pour mieux contrôler et prévenir ces infections. 58-60 Selon un rapport de surveillance américain de 2008, les microorganismes les plus souvent impliqués dans les
infections liées au matériel et aux procédures médicales (incluant les septicémies et infections urinaires liées aux cathéters, les pneumonies liées aux appareils ventilatoires et les infections localisées au site d’intervention chirurgicale) sont Staphylococcus sp. (30%, dont S. aureus représente la moitié), Enterococcus sp. (12%), Candida sp. (11%), E. coli (10%), P. aeruginosa (8%) et K. pneumoniae (6%). Jusqu’à 16% de ces infections étaient causées par des microorganismes antibiorésistants.61
Le biofilm ne se contente pas d’assurer un réservoir infectieux sur les surfaces abiotiques mais contribue également à la pathogenèse de nombreuses infections en leur permettant de coloniser les tissus humains (Figure 2). Davantage d’exemples de la place du biofilm dans les maladies seront discutés dans les sections correspondant aux microorganismes à l’étude. Le biofilm est associé au caractère chronique des infections qu’il cause ou entretient lui-même, et ce, en raison de la résistance et de la tolérance dont profitent les agents pathogènes qui en font partie.
Figure 3. Infections causées et entretenues par des biofilms. Figure tirée de Lebeaux et al. (2012) 41
1.2 Le biofilm est meneur de la résistance
La principale menace que constitue le biofilm réside en la tolérance qu’il confère aux microorganismes grâce à sa structure et à la production d’un micro-environnement hétérogène et communicatif favorisant l’apparition de résistance. En effet, des doses jusqu’à 1000 fois plus élevées d’antimicrobien sont nécessaires pour éliminer les microorganismes dans un biofilm qu’il n’en faut pour éradiquer la même population dans une suspension planctonique.62 Les caractéristiques à la source d’une telle résistance relèvent de mécanismes de protection
physique et métabolique.63
1.2.1 Le biofilm en tant que forteresse
Dans un premier temps, la structure polymérique de la matrice extracellulaire du biofilm assure la fonction de barrière physique et confère une résistance mécanique au biofilm. L’architecture stable du biofilm lui offre une meilleure tolérance aux changements d’hydratation et de salinité, aux acides et aux ultraviolets, lui permettant
de s’accrocher aux surfaces malgré l’usage de détergents et de désinfectants.64 Le réseau polymère
tridimensionnel fait obstacle à la pénétration de certains antibiotiques et désinfectants en limitant leur diffusion, ou en les inactivant par adsorption ou réaction avec les composantes de la matrice. Par exemple, il a été montré que la concentration de chlore ayant pénétré l’intérieur d’un biofilm mixte (P. aeruginosa et K. pneumoniae) à la suite d’une désinfection est inférieure à 20% de la concentration originale du désinfectant chloré.65 Le
ralentissement de la diffusion d’antibiotiques à travers le biofilm a aussi été démontré à maintes reprises,66-69
offrant aux microorganismes un délai d’adaptation progressif au stress antibiotique.
Il existe également certains mécanismes par lesquels la structure du biofilm lui permet de résister aux défenses immunitaires de l’hôte. Par exemple, la sécrétion prolongée de cytokines inflammatoires et d’espèces réactives d’oxygène par des macrophages ayant de la difficulté à percer la barrière physique du biofilm peut endommager les tissus environnants ou causer une inflammation excessive.53 Même si les cellules immunitaires arrivent dans
certaines conditions à pénétrer la structure du biofilm, d’autres mécanismes et interactions avec les composantes de la matrice peuvent altérer l’efficacité de la réponse immunitaire, notamment en empêchant la phagocytose par les leucocytes.70
1.2.2 Le biofilm en tant que société inclusive forte de sa diversité
L’épaississement du biofilm dans la phase de maturation génère une structure hétérogène et mène à l’établissement de micro-environnements. Les populations vivant dans ces niches aux propriétés distinctes adoptent un phénotype adapté à leur environnement physico-chimique. La communauté résultante est composée de sous-populations physiologiquement distinctes à différentes profondeurs du biofilm, caractérisées par une activité métabolique propre et pouvant exprimer différents facteurs de résistance.63 Cette diversité
multiplie les chances de survie du groupe lorsque le biofilm est soumis à un stress, par exemple à un traitement antibiotique.71,72
L’activité métabolique est globalement réduite au sein du biofilm, ce qui diminue la vulnérabilité aux antimicrobiens. Le ralentissement de la croissance et particulièrement important à la base du biofilm, où l’apport en oxygène et en nutriments diminue, le pH augmente et les débris cellulaires s’accumulent.63 Certaines
sous-populations appelées « cellules persistantes » ont une activité métabolique presque dormante qui les rend insensibles aux antibiotiques, particulièrement aux inhibiteurs de la synthèse du peptidoglycane, comme les pénicillines et les céphalosporines, et aux autres antimicrobiens qui agissent efficacement en phase de croissance.73
Le ralentissement métabolique peut aussi être induit en réponse à une menace issue de l’environnement. L’induction de la phase stationnaire en réponse au stress n’est qu’un exemple de comportement de groupe parmi les adaptations physiologiques et phénotypiques qui permettent au biofilm d’augmenter la résistance et la virulence des agents pathogènes.71
De plus, les biofilms naturels sont généralement polymicrobiens. La présence de plusieurs espèces dans un environnement restreint fait naître des phénomènes de compétition, mais aussi de collaboration. Des espèces qui cohabitent peuvent développer des relations symbiotiques ou antagonistes. Un exemple de cohabitation favorable est l’abaissement de la pression oxydative dans le biofilm causée par la respiration des levures tel que Candida albicans. Il en résulte un environnement hypoxique qui stimule la croissance des anaérobes, comme les streptocoques oraux. En retour, ceux-ci produisent des lactates qui servent de nutriments à Candida. Cette complémentarité métabolique entre des bactéries et des mycètes promeut la virulence des microorganismes pathogènes et leur procure un microenvironnement acide et protecteur qui accélère le développement de caries dentaires.74-75
Le traitement d’infections polymicrobiennes est d’autant plus complexe si les agents infectieux impliqués présentent des susceptibilités différentes aux antibiotiques. Le biofilm est un environnement favorisant la proximité et la communication entre les espèces microbiennes qui l’habitent. Ce confinement favorise le partage génétique et l’acquisition de résistance par transfert horizontal.76 La prise orale d’antibiotiques expose la flore
saine des biofilms buccaux et intestinaux aux antimicrobiens. Ceci favorise l’acquisition de gènes de résistance qui demeureront dans l’organisme et pourront être transmis à de futurs agents pathogènes, diminuant l’efficacité d’un traitement ultérieur. Ce phénomène a notamment été contributoire à l’ascension fulgurante d’antibiorésistance de Neisseria gonorrhoeae, dont les infections oropharyngées sont difficilement détectables et souvent asymptomatiques.77
En somme, la diversité des espèces, l’hétérogénéité physiologique et la structure protectrice de la matrice contribuent à la tolérance et la résistance accrues des biofilms. De nombreux facteurs et mécanismes régulatoires sont impliqués à différentes étapes de la formation du biofilm, à commencer par les propriétés de la surface, l’identité et la densité de la population microbienne, ainsi que les interactions entre ses membres. Les biofilms microbiens constituent un réservoir pathogène tenace qui contribue autant à la virulence qu’à la chronicité des infections, entraînant une prévalence, des coûts et une complexité de traitement supplémentaires.78 Au final, on estime que 80% des infections bactériennes affligeant l’être humain sont
attribuables au biofilm.79 L’enjeu de santé publique qu’incarne le biofilm continue de justifier l’engouement de la
2. Le biofilm oral
La plaque dentaire est un des biofilms polymicrobiens les plus complexes et un exemple riche de coopération entre les espèces. Comptant plus de 700 espèces microbiennes, ce biofilm d’une hétérogénéité et d’une densité (1011 cellules/g humide) est un modèle idéal pour l’étude des biofilms et des interactions entre les
microorganismes et avec leur environnement.80 L’étude des maladies buccales est guidée par la dynamique
interactive entre les agents infectieux et les autres microbes, mais aussi avec l’hôte, ses défenses immunitaires et son alimentation. La flore buccale fait face à des fluctuations environnementales importantes qui en font un haut lieu de compétition et de coopération où les interactions contribuent au développement, à l’équilibre et à la survie du microbiote.
Par ces interactions, certaines espèces favorisent l’adhésion d’autres espèces ou se co-agrègent pour mieux s’établir sur les différentes surfaces de la cavité orale (muqueuses, émail dentaire, implants, appareils prosthétiques, etc.) malgré le flux salivaire, le brossage, la déglutition et d’autant plus de processus chimiques et mécaniques qui tentent de les déloger. Ainsi, l’identité des premiers microorganismes établis détermine le recrutement successif d’espèces commensales et/ou pathogènes, ce qui représente bien la complexité du cycle de vie du biofilm oral et le délicat équilibre entre le maintien d’une flore saine et le développement de pathologies.81 La difficulté à délivrer efficacement les médicaments dans le biofilm oral en fait un défi de taille
pour les professionnels de la santé, mais aussi un modèle de choix pour le développement de molécules anti-biofilm et de nouvelles stratégies thérapeutiques.82,83
D’autre part, le biofilm oral entretient une relation symbiotique avec son hôte et lui procure une protection naturelle contre les agents pathogènes étrangers, ainsi que des bénéfices certains sur le plan immunologique, la régulation de la réponse inflammatoire et l’écologie des systèmes digestifs et cardiovasculaires. Le développement de stratégies thérapeutiques non microbicides est donc d’autant plus pertinent dans le contrôle des infections oropharyngées. Des médicaments permettant de contrôler finement le développement du biofilm oral permettraient de protéger la flore saine tout en évitant de la transformer en porteur latent de résistance.84
2.1 Les microorganismes pathogènes buccaux
Les infections oropharyngées sont des infections à biofilm. Certains agents pathogènes buccaux sont des microorganismes commensaux qui occasionnent des maladies de façon opportuniste. Étant donné les multiples interactions et la nature polymicrobienne du biofilm oral, un antimicrobien actif contre un microorganisme
pathogène buccal donné est susceptible d’affecter d’autres microbes partageant le même habitat. Au-delà des maladies buccales, les infections causées par la dissémination des microorganismes oraux hors de leur niche principale suscitent de plus en plus d’attention et rehaussent la pertinence du biofilm oral comme modèle pour le développement d’agents anti-biofilm.85 Les principaux agents pathogènes buccaux seront décrits dans la
prochaine section.
2.1.1 Bactéries parodontopathogènes: Porphyromonas gingivalis et Fusobacterium
nucleatum
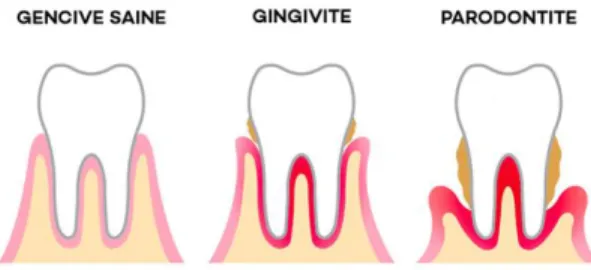
Certaines bactéries anaérobiques à Gram négatif de la plaque dentaire peuvent causer des maladies parodontales, qui regroupent les conditions d’inflammation des tissus et structures qui supportent la dent.86 La gingivite peut évoluer
en parodontite et l’infection peut se détériorer jusqu’à la destruction chronique des gencives, du ligament parodontal et de l’os alvéolaire, puis provoquer la perte des dents.
Entre le tiers et la moitié de la population globale sera touchée par l’inflammation des gencives alors que les infections plus sévères affectent jusqu’à 15% des adultes. Les maladies parodontales sont un facteur de risque important pour de nombreuses conditions systémiques aussi diverses que le diabète, les maladies cardiovasculaires et les complications de grossesses.87 L’infection parodontale peut constituer une porte
d’entrée par laquelle les bactéries accèdent à l’endothélium et au système circulatoire, ce qui implique un risque accru de septicémie bactérienne. Ceci pourrait expliquer la corrélation positive entre l’incidence de parodontites et de maladies vasculaires artérioscléreuses.88 L’agent étiologique principal de la parodontite est
Porphyromonas gingivalis.89 Cette bactérie parodontopathogène semble aussi impliquée dans le
développement d’anévrismes aortiques, possiblement en activant les plaquettes sanguines et favorisant la coagulation.90,91
La bactérie pathogène opportuniste Fusobacterium nucleatum est aussi pointée du doigt en raison de son rôle clé dans la formation du biofilm oral : cette bactérie favorise la co-agrégation d’autres microorganismes et promeut le développement de la plaque dentaire en faisant le pont entre les différents colonisateurs.92 La
co-infection par F. nucleatum est associée à la chronicité et à la virulence des maladies par le biais d’interactions synergiques démontrées avec les autres bactéries pathogènes parodontales.93 Par exemple, la co-infection
avec F. nucleatum augmente d’un facteur 2 à 20 la capacité de P. gingivalis à pénétrer les cellules épithéliales
Figure 4. Évolution des maladies parodontales liées au tartre. Source: Dentego (2017)
des gencives et les cellules endothéliales aortiques humaines in vitro.94 Bien qu’ubiquitaire à l’environnement
oropharyngé chez le patient en santé, F. nucleatum figure parmi les pathogènes les plus fréquemment retrouvé hors de la bouche chez le malade. Ceci laisse encore une fois supposer son implication dans une multitude de désordres systémiques et inflammatoires auxquels s’ajoutent des cancers et inflammations du côlon, l’arthrite rhumatoïde, ou la maladie d’Alzheimer.95
2.1.2 Streptococcus mutans
Les caries dentaires représentent la maladie chronique la plus courante dans le monde et la plus fréquente chez les enfants en Amérique du Nord.96,97 Bien que la carie soit
souvent bénigne dans les pays développés, dans certains cas des caries agressives apparaissent tôt dans l’enfance et peuvent avoir des conséquences graves et irréversibles sur le développement de l’enfant.98
L’alimentation, plus particulièrement l’apport en glucides, est le principal facteur d’incidence de la carie. L’étude de la flore buccale de patients sujets ou non aux caries a permis d’identifier certaines espèces qui prédisposent à la condition. Bien que les agents étiologiques soient variables, les principaux accusés sont des streptocoques acido-tolérants comme S. mutans.99 Cette bactérie Gram-positive peut fermenter le sucre alimentaire ou l’utiliser
pour synthétiser les glucans et les fructans qui composent sa matrice extracellulaire. Le cariogène produit aussi des protéines d’adhésion qui se lient aux glucans. Une alimentation riche en sucrose favorise donc le développement du biofilm en accélérant la production de la matrice, qui non seulement protège S.mutans, mais sert aussi de port d’ancrage pour que davantage de bactéries puissent adhérer et coloniser la surface dentaire.100 De plus, les produits de la fermentation contribuent à une acidification du milieu environnant et
subséquemment à la déminéralisation de l’émail dentaire. Dans les niches acides ainsi formées, la sélection naturelle contribue à la prévalence et la survie des bactéries acido-tolérantes, dont S. mutans.101
Cet agent pathogène buccal semble aussi impliqué dans le développement de maladies à distance. Certaines souches sont associées à une aggravation de la colite ulcéreuse, une maladie inflammatoire chronique de l’intestin.102 Un certain sérotype exprime une protéine d’adhésion qui lui permet d’adhérer aux tissus et
vaisseaux sanguins endommagés : S. mutans peut infecter la muqueuse endothéliale du cœur et contribuer au développement d’endocardites infectieuses103 et d’accidents vasculaires cérébraux hémorragiques.104
Figure 5. Évolution de la carie dentaire. Source: Dentego (2017) https://dentego.fr
2.1.3 Candida albicans
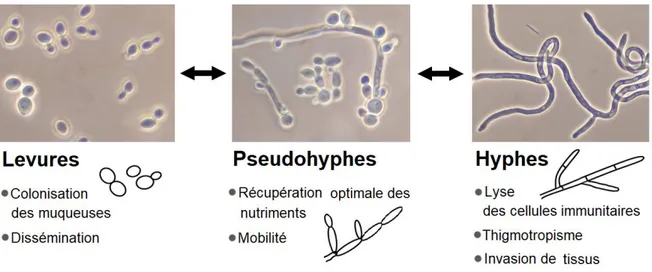
Candida albicans colonise la peau et les muqueuses de l’être humain en tant que membre de sa flore commensale. Ce mycète parvient à coloniser différents milieux en s’adaptant à son hôte et à son environnement et peut adopter jusqu’à 9 morphologies différentes, aux phénotypes et aux métabolismes distincts. Cette espèce polymorphique est aussi un agent pathogène opportuniste dont la virulence est intimement liée à sa morphogénèse (Figure 6).105,106 Les morphologies principales sont la forme levure, qui se reproduit par
bourgeonnement, et la forme filamenteuse associée à une virulence accrue, où l’élongation des hyphes maintient les cellules connectées les unes aux autres.
Figure 6. Principales morphologies de Candida albicans et traits de virulence associés.
Chaque morphologie joue des rôles spécifiques à différentes étapes de la pathogenèse (Figure 6) et du développement du biofilm (Figure 7) de C. albicans. Au moment de l’adhésion initiale de levures à une surface, 250 gènes sont régulés à la baisse et 150 à la hausse en comparaison avec les levures planctoniques. La régulation phénotypique qui a lieu tout au long du cycle de vie du biofilm est assurée par un mécanisme central de neuf régulateurs. Les nombreuses voies métaboliques interdépendantes modulées par ces régulateurs sont souvent associées à la plasticité morphologique et à l’expression de facteurs de virulence. Le rôle des morphologies et des mécanismes régulatoires à différentes étapes de formation du biofilm de C. albicans ont été exhaustivement revus dans la littérature, ainsi que les impacts pour la santé humaine.105-110
Figure 7. Morphologies et principaux facteurs de résistances associés au développement du biofilm de Candida albicans. Image adaptée depuis la publication de Lohse et al. (2018).110
Des changements environnementaux affectant le pH et la disponibilité des nutriments ainsi que la perturbation de la flore générale suivant la prise d’antibiotiques peuvent favoriser la croissance anormale de C. albicans. Cette prolifération peut causer des infections superficielles de la peau et des muqueuses orales, gastrointestinales et génitales. L’affaiblissement du système immunitaire causé par le stress ou la présence d’une autre infection peut aussi contribuer au développement d’infections à Candida. Si l’érythème fessier, la candidose orale et la vaginite à levure sont des infections incommodantes chez les patients en santé, les infections superficielles à Candida représentent un risque particulier pour les patients immunosupprimés, chez qui la condition peut évoluer en infections invasives beaucoup plus graves.
Le biofilm fongique est hautement résistant aux défenses immunitaires innées et souvent aux agents antifongiques.111 De multiples stratégies d’évasion rendent le biofilm 2 à 3 fois plus résistant aux attaques des
monocytes et 2 à 5 fois plus résistant à celles des neutrophiles, comparativement à C. albicans sous sa forme planctonique. D’autres phénomènes contribuent à la résistance du biofilm fongique aux médicaments. Par exemple, l’expression de pompes à efflux dans le biofilm de Candida est accrue dès les premières étapes de la formation du biofilm et est maintenue ainsi tout au long de son développement, tandis que les cellules planctoniques n’expriment ces protéines qu’en présence d’un antifongique. En conséquence, le traitement des infections liées au matériel médical requiert généralement des doses élevées de médicaments en plus du retrait de l’appareil contaminé. Ces traitements s’avèrent coûteux et risqués puisque l’administration souvent intraveineuse d’antifongiques peut occasionner des dommages au foie et aux reins. La rémission est parfois impossible, particulièrement s’il faut remplacer l’appareil cardiaque d’un patient déjà affaibli par une chirurgie. 112-114 Non traité, le biofilm établi par le mycète sur le matériel médical peut engendrer des infections invasives des
organes ou se disséminer jusqu’au système sanguin. Ces infections du sang couramment acquises en milieu hospitalier atteignent des taux de mortalité de près de 40%.110,115
Les infections polymicrobiennes impliquant C. albicans sont d’autant plus problématiques étant donné la combinaison d’antimicrobiens nécessaires pour traiter simultanément une infection fongique et bactérienne. On estime que 27 à 56% des septicémies à Candida sont polymicrobiennes. Hormis les infections qu’il cause, le mycète peut jouer un rôle dans le développement de pathologies par d’autres microorganismes avec lesquels il interagit partout dans le corps de manière parfois synergique, parfois antagoniste.116 Le biofilm de C. albicans
peut en effet agir comme une structure protectrice abritant d’autres pathogènes. Le biofilm fongique procure un micro-environnement hypoxique qui promeut la co-agrégation de bactéries anaérobiques et assure leur survie dans un milieu autrement hostile à leur égard, un phénomène qui facilite la prolifération des bactéries pathogènes Clostridium perfringens et Bacteroides fragilis dans l’intestin.117
Candida entretient aussi des relations synergiques avec les staphylocoques. La bactérie multi-résistante S. aureus, qui forme difficilement des biofilms par elle-même sur les surfaces abiotiques, peut aisément établir des colonies au sein du biofilm de Candida en adhérant préférentiellement sur ses hyphes.118,119 Cette intégration
au biofilm fongique confère à S. aureus une résistance accrue à la vancomycine.120 Le biofilm mixte de C.
albicans et S. epidermidis montre un effet protecteur pour les deux microorganismes en comparaison à leurs biofilms individuels, augmentant la résistance du staphylocoque à la vancomycine et celle du fungus à l’amphotéricine B et au fluconazole.121
D’autre part, la colonisation des poumons par C. albicans augmente les risques d’incidence de pneumonies bactériennes à P. aeruginosa. La présence conjointe des deux microorganismes est particulièrement fréquente chez les patients atteints de fibrose kystique.122 L’interaction entre ces pathogènes est antagoniste : la bactérie
sécrète des phénazines qui endommagent la membrane cellulaire de C. albicans, pour mieux adhérer ensuite au réseau d’hyphes morts.123-125
Le biofilm oral regorge aussi d’exemples d’interactions où C. albicans favorise la co-agrégation de bactéries et contribue aux infections bactériennes. Les relations symbiotiques entre C. albicans et les bactéries Gram-positives des genres Streptococcus et Actinomyces mènent dans plusieurs cas à un rehaussement de la virulence, de l’invasion des tissus et de la formation de biofilm.126-128 Le biofilm mixte de C. albicans et S. mutans
est un exemple très étudié où la collaboration augmente la virulence des deux espèces.74 Il est démontré que
la co-infection par le fungus est contributoire dans le développement, la récurrence et la sévérité de la carie dentaire ainsi que des maladies parodontales.74,129Somme toute, le biofilm de C. albicans pose un défi
thérapeutique de taille dont la portée s’étend à toutes les muqueuses et au-delà des infections fongiques.130
3. La communication chez les microorganismes
Tel que mentionné plus tôt, la proximité et le confinement que procurent le biofilm favorisent les interactions entre les microorganismes. Le biofilm peut être considéré comme une société organisée où la compétition, la symbiose, l’antagonisme, la communication et les interactions entre les membres a donné naissance au concept de « sociomicrobiologie ».131 Ce sont des molécules de signalisation qui constituent le langage desmicroorganismes, que les cellules envoient et détectent comme du courrier pour transmettre un message. Les systèmes de communication des microorganismes sont essentiels au développement, à l’adaptation et à la survie des biofilms. Les voies métaboliques qu’ils empruntent sont conséquemment d’un grand intérêt dans l’étude de la résistance microbienne.
Les microorganismes s’expriment en sécrétant de petites molécules de signalisation dans le milieu extracellulaire. Dans l’environnement du biofilm, où le milieu extracellulaire est dense et où les microorganismes sont sédentaires, la concentration locale de ces molécules augmente plus rapidement que ce ne serait le cas dans une suspension planctonique. Les microorganismes possèdent également des récepteurs qui reconnaissent spécifiquement ces molécules. La concentration de ces signaux chimiques augmente proportionnellement à la quantité d’individus, de pair avec la fréquence à laquelle elles se fixent aux récepteurs membranaires. Les microorganismes sont donc renseignés en temps réel sur la densité de population microbienne en détectant des signaux qu’ils ont eux-mêmes produits, ce qui a valu à ces molécules de signalisation la dénomination d’auto-inducteurs (AI).
La fixation d’un AI à un récepteur déclenche une cascade de signalisation qui peut mener à l’activation ou la répression de régulateurs de l’expression génique. Ainsi, lorsqu’une certaine densité de population est atteinte et que la concentration d’AIs atteint un certain seuil (le quorum), cela induit une modification collective de l’expression génique. Il en résulte une réponse phénotypique concertée, ou l’adoption d’un comportement de groupe, à des moments précis du développement démographique de la communauté. Le terme quorum sensing (QS) désigne l’ensemble des mécanismes impliqués dans la synchronisation de l’expression génique en fonction de la densité de population.
La détection du quorum permet d’orchestrer le développement du biofilm. D’autre part, ce mode de communication régule une multitude de traits et de phénomènes collectifs, incluant la migration cellulaire, la sporulation, l’adoption de phénotypes résistants, l’expression de bioluminescence, de toxines et d’autres facteurs de virulence et comportements essentiels à la pathogenèse. Des efforts importants ont été mis pour décrire et comprendre les mécanismes impliqués dans la détection du quorum et pour développer des inhibiteurs.132-134 La perturbation du QS est proposée dans la littérature comme une stratégie prometteuse pour
contrôler les infections à biofilm sans promouvoir l’apparition de résistance comme les antibiotiques traditionnels.135 La capacité de telles molécules à augmenter la vulnérabilité et la susceptibilité des biofilms
bactériens aux antibiotiques a été démontrée in vitro et in vivo.136 Toutefois, le spectre d’action des inhibiteurs
du QS dépend des systèmes de signalisation utilisés par les pathogènes.
3.1 La détection du quorum chez la bactérie
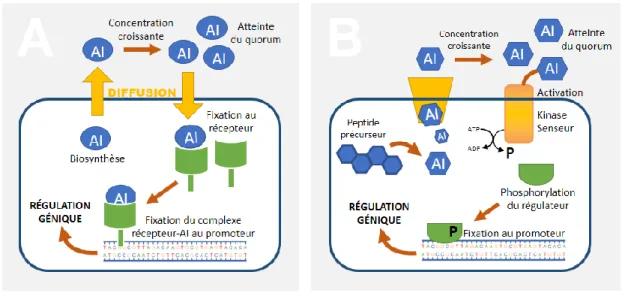
Chez les bactéries, le QS est généralement assuré selon deux de mécanismes principaux (Figure 8).
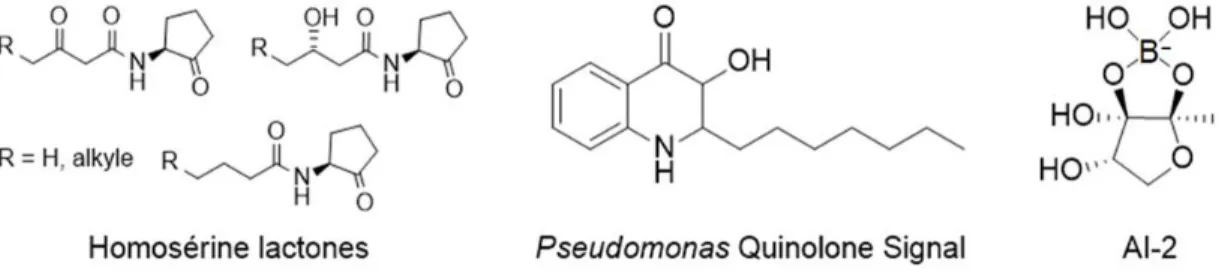
Les bactéries à Gram négatif utilisent principalement un système basé sur de petites molécules qui traversent la membrane par transport diffusion. Les AIs les plus étudiés sont les homosérine lactones (HSLs), qui ont d’abord été identifiées chez l’espèce biofluorescente Vibrio fischeri (Figure 9). Ces HSLs et des analogues ont par la suite été rapportés chez davantage de bactéries Gram négatives incluant P. aeruginosa, un bacille qui utilise plusieurs systèmes de QS, dont l’un est assuré par une quinolone unique et spécifique à son espèce. Des analogues synthétiques de HSLs peuvent agir comme inhibiteurs du QS et inhiber la formation de biofilm. Bien que la production d’HSLs n’ait pas été démontrée chez les bactéries pathogènes parodontales,137,138 des
analogues synthétiques ont montré un effet inhibiteur sur la formation et la structure du biofilm de P. gingivalis.139
Figure 9. Molécules de signalisation régulant la détection du quorum chez les bactéries.
Il est toutefois connu que P. gingivalis et F. nucleatum produisent une autre molécule de signalisation, l’AI-2.140
Cet auto-inducteur est hautement conservé entre les espèces, faisant partie du QS de plus d’une centaine d’espèces bactériennes à Gram négatif et positif. Ce système de communication coopératif inter-espèces encodé par le gène luxS est impliqué dans bon nombre d’interactions synergiques augmentant la virulence des microorganismes dans un environnement polymicrobien. Dans la cavité buccale, les bactéries pathogènes parodontales répondent à des concentrations d’AI-2 plus élevées que les bactéries commensales. Ainsi, plus la plaque dentaire se développe, la concentration d’AI-2 au sein du biofilm oral augmente et favorise ultimement la croissance des bactéries parodontopathogènes au détriment de la flore commensale saine.141,142 L’AI-2 régule
aussi l’acidorésistance et la virulence de S. mutans, assurant sa survie dans le compétitif biofilm buccal.143 La
délétion du gène luxS chez ce streptocoque cariogène altère la structure de son biofilm et la production de bactériocines.144,145
On retrouve habituellement un système légèrement plus complexe chez les bactéries à Gram positif, où les AIs sont de nature peptidique.146 Plutôt que d’utiliser de petits AIs diffusibles, le système de signalisation fait
intervenir le transport actif d’oligopeptides. Des peptides précurseurs sont clivés dans le cytosol et subissent des modifications post-transcriptionnelles avant d’être transportés à l’extérieur de la cellule. La fixation des oligopeptides active leur récepteur cognat, souvent des kinases « senseurs », ce qui consomme de l’ATP pour
permettre la phosphorylation subséquente d’un facteur de transcription. Le régulateur phosphorylé module l’expression génique en conséquence. Il s’agit toutefois d’une représentation simplifiée et non-exhaustive. D’autres mécanismes et intermédiaires peuvent être impliqués et il arrive couramment que des bactéries utilisent ou répondent à des éléments d’un système traditionnellement associé au Gram opposé.147,148
Une combinaison de plusieurs voies de signalisation est nécessaire pour contrôler différents processus chez une même bactérie. Chez les bactéries Gram positives, ces voies métaboliques sont catégorisées selon la structure du peptide et du récepteur. Les peptides cycliques de type Arg (qui ultimement régulent un des gènes de la famille Arg) et les peptides au motif Gly-Gly (dont la séquence peptidique qui se lie au récepteur suit deux résidus glycine) activent des kinases senseurs tel que schématisé (Figure 8B). D’autres oligopeptides sont plutôt internalisés et, une fois dans le cytoplasme, se lient directement à des régulateurs pour former un complexe actif qui régule l’expression génique selon un chemin métabolique dont la finale ressemble à celle des bactéries Gram négatives.149
Chez S. mutans, deux circuits du QS utilisant des oligopeptides ont été étudiés en détail.150 Le système modulé
par des peptides de type Gly-Gly est impliqué dans la production de facteurs d’adhérence, de toxines et de peptides antimicrobiens. Une autre voie métabolique, que S. mutans partage avec ses congénères S. pyogenes, S. bovis et S. salivarius, implique le peptide XIP. Celui-ci est transporté dans la cellule où il active le régulateur transcriptionnel ComR pour réguler l’expression génique par reconnaissance du motif SigX.151,152 Le facteur
sigma alternatif SigX est une séquence d’ADN hautement conservée parmi le genre Streptococcus. Il est même présent chez des espèces qui ne produisent pas les peptides qui le régulent; dans de tels cas, ceci en fait un mécanisme régulatoire purement inter-espèce.153
3.2 La détection du quorum chez Candida albicans
Bien que le QS des eucaryotes ait été caractérisé de façon beaucoup moins exhaustive que celui des bactéries, les régulateurs transcriptionnels qu’ils activent chez Candida spp dans les différentes étapes de la formation du biofilm ont fait l’objet de revues de littérature.109 Les premières études ayant reporté des molécules de
signalisation chez les mycètes y sont parvenues en étudiant les facteurs influençant la morphogénèse plutôt que le développement du biofilm. Chez les espèces polymorphiques, la formation du biofilm est marquée à chaque étape non seulement par l’adoption de phénotypes nouveaux, mais aussi de morphologies distinctes. Pour cette raison, la régulation de la formation du biofilm fongique et de la morphogénèse emprunte souvent des mécanismes régulatoires qui se chevauchent et utilisent des molécules de signalisation communes. Le QS fongique le mieux caractérisé est définitivement celui de C. albicans (Figure 10).154
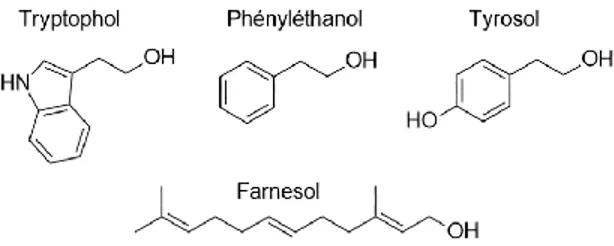
Les premières molécules de signalisation à avoir été identifiées chez C. albicans sont le tryptophol et l’alcool phényléthylique,155 qui répriment à la fois la
croissance cellulaire et la formation d’hyphes. C’est toutefois le QS régulé par un sesquiterpène, le farnesol, qui a été le plus étudié.
Le farnesol module chez C. albicans l’expression de gènes impliqués dans l’intégrité et l’hydrophobicité membranaire, le métabolisme du fer, la réponse phagocytique, la résistance aux antifongiques et la tolérance aux stress thermiques et oxydatifs. Le farnesol inhibe la filamentation des levures dans plusieurs conditions pro-hyphes (apport en sérum, proline, N-acétylglucosamine) sans affecter la vitesse de croissance. Par ces différents mécanismes, le farnesol inhibe la formation du biofilm chez plusieurs espèces de Candida. En revanche, il ne peut interrompre l’élongation d’hyphes préexistants.156 Certaines souches de C. albicans
produisent aussi un analogue moins actif, l’acide farnesoïque.157
Alors que les molécules précédentes inhibent la formation d’hyphes à des densités de population élevées, le tyrosol, quant à lui, accélère le processus de morphogénèse dans des conditions environnementales pro-hyphes. Lors de la dilution d’une culture mature, le tyrosol accélère l’induction de la phase de croissance exponentielle et l’élongation des hyphes. Son effet favorable sur la morphogénèse est donc observé dans les premières phases de formation du biofilm, avant que la croissance ne ralentisse, et pourrait être dû à l’activation de gènes de croissance et de réplication. D’autre part, le tyrosol possède une activité antioxydante qui protège Candida de la phagocytose par les neutrophiles.
Chacun de ces auto-inducteurs agit à plusieurs sites et via plusieurs voies métaboliques chez C. albicans. Ils modulent différemment l’expression génique selon la densité de population en réponse aux conditions environnementales. La figure 11 résume les principaux éléments déclencheurs et chemins métaboliques conduisant à la filamentation des hyphes de C. albicans, ainsi que les sites où le farnesol peut intervenir. Ceci illustre bien la complexité et la multi-factorialité des phénomènes régulatoires du QS tout comme leur interdépendance avec l’environnement.
Figure 10. Molécules de signalisation régulant la détection du quorum chez Candida albicans
Figure 11. Voies métaboliques induisant la morphogénèse de Candida albicans en réponse à différents facteurs environnementaux et régulation par le farnesol (rouge). Figure adaptée de Han et al. (2011)178
3.3 Les communications inter-espèces et inter-domaines
Les voies métaboliques et les signaux utilisés pour la communication sont plus ou moins conservés entre les espèces, ce qui peut occasionner des interférences entre les signaux et permettre une multitude d’interactions entre les microorganismes. Ces interactions sont à la fois la cause et le résultat des biofilms polymicrobiens. Les mécanismes du QS et la régulation des gènes au cours de la formation de biofilms sont essentiels à l’établissement et au maintien de l’homéostasie dans une population microbienne hétérogène, ainsi qu’à son adaptation à son environnement. La communication entre les espèces donne lieu à des phénomènes de coopération et de compétition dont plusieurs ont été rapportés parmi la flore buccale.138,158
Plusieurs streptocoques oraux dont S. mutans, S. gordonii et S. sanguinis, produisent des bactériocines dont l’expression est régulée par des mécanismes du QS qui empruntent des voies métaboliques se chevauchant avec celles qui régulent la formation de biofilms. Ces espèces font partie des premiers microorganismes à adhérer à la surface dentaire, au tout début de la formation de la plaque. Pourtant, les bactériocines produites par ces espèces qui s’établissent ensemble s’attaquent aux autres streptocoques parmi eux.159-161 Les