HAL Id: dumas-01699517
https://dumas.ccsd.cnrs.fr/dumas-01699517
Submitted on 5 Feb 2018
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Lymphomes malins non hodgkiniens : approche
pluridisciplinaire des lymphomes de la zone marginale
Géraldine Schuch
To cite this version:
Géraldine Schuch. Lymphomes malins non hodgkiniens : approche pluridisciplinaire des lymphomes de la zone marginale. Sciences pharmaceutiques. 2009. �dumas-01699517�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
---
...
--~--- --- · - - ----D 1111111
f
l~i~
lUŒU
1111- - - -- -
UNIVERSITE JOSEPH FOURIER
FACULTE DE PHARMACIE DE GRENOBLE
Année 2009LYMPHOMES MALINS NON HODGKINIENS :
APPROCHE PLURIDISCIPLINAIRE DES LYMPHOMES DE LA ZONE MARGINALE
MEMOIRE
DU DIPLOME D'ETUDES SPECIALISEES DE BIOLOGIE MEDICALE
Conformément aux dispositions réglementaires du décret N'90-810 du 10 septembre 1990, tient lieu de thèseTHESE PRESENTEE POUR L'OBTENTION DU DIPLOME D'ETAT
DE DOCTEUR EN PHARMACIE
Géraldine SCHLICH
Thèse soutenue publiquement à la faculté de Pharmacie de Grenoble
Le 25 septembre 2009 Devant le jury composé de :
Président du jury: Mr le Professeur Patrice FAURE
Membres: Mme le Professeur Dominique LEROUX
Mme le Docteur Christine LEFEBVRE Mme le Docteur Claire VETTIER
Mme le Docteur Chantal DUMESTRE-PERARD
La faculté de Pharmacie de Grenoble n'entend donner aucune approbation ni improbation aux opinions émises dans les thèses ; ces opinions sont considérées comme propres à leurs auteurs.
Année 2009
UNIVERSITE JOSEPH FOURIER
FACULTE DE PHARMACIE DE GRENOBLE
LYMPHOMES MALINS NON HODGKINIENS :
No
APPROCHE PLURIDISCIPLINAIRE DES LYMPHOMES DE LA ZONE MARGINALE
MEMOIRE
DU DIPLOME D'ETUDES SPECIALISEES DE BIOLOGIE MEDICALE
Conformément aux dispositions réglementaires du décret N°90-810 du 10 septembre 1990, tient lieu de thèse
THESE PRESENTEE POUR L'OBTENTION DU DIPLOME D'ETAT
DE DOCTEUR EN PHARMACIE
Géraldine SCHLICH
Thèse soutenue publiquement à la faculté de Pharmacie de Grenoble
Le 25 septembre 2009 Devant le jury composé de :
Président du jury: Mr le Professeur Patrice FAURE
Membres: Mme le Professeur Dominique LEROUX
Mme le Docteur Christine LEFEBVRE Mme le Docteur Claire VETTIER
Mme le Docteur Chantal DUMESTRE-PERARD
La faculté de Pharmacie de Grenoble n'entend donner aucune approbation ni improbation aux opinions émises dans les thèses ; ces opinions sont considérées comme propres à leurs auteurs.
UFR
y Tl\Ul'll L iJ11 L'
nvr.Rc
TTr.DE PHARMACIE
JOSEPH FOURIER
DE GRENOBLE
SCIENCES.TECHNOLOGIE.SANTÉ. BAKRI BOUMENDJEL BURMEISTER CALOP DANEL DECO UT DROUET FAURE FA VIER GODIN-RIBUOT GRILLOT MARIOTTE PEYRIN SEVE RIBUOT ROUSSEL WOUESSIDJEWEUNIVERSITE JOSEPH FOURIER
FACULTE DE PHARMACIE DE GRENOBLE
Domaine de la Merci 38700 LA TRONCHE Doyen de la Faculté : Mme le Professeur Renée GRILLOT
Vice -Doyen : Mmè Edwige NICOLLE
Année 2008-2009
Mise à jour : le 6 octobre 2008
PROFESSEURS A L'UFR DE PHARMACIE
Aziz Pharmacie Galénique et Industrielle, Formulation et Procédés Pharmaceutiques (LR)
Ah cène Chimie Organique (D.P.M.) Wilhelm Physique (U.V.H.C.1) Jean Pharmacie Clinique (CHU) Vincent Toxicologie (CHU SAMU-SMUR) Jean-Luc Chimie Inorganique (D.P.M.)
Emmanuel Immunologie/ Microbiologie (U.V.H.C.1) Patrice Biochimie (DBI I CHU)
Alain Professeur Emérite
Diane Physiologie - Pharmacologie (HP2)
Renée Parasitologie - Mycologie Médicale (Directeur UFR et CHU) Anne-Marie Pharmacognosie (D.P.M.)
Eric Chimie Analytique (D.P.M.) Michel Biotechnologie (CHU/ CRI IAB) Christophe Physiologie - Pharmacologie (HP2) Anne-Marie Biochimie Nutrition (L.B.F.A) Denis Pharmac9technie (D.P.M.)
UFR
DE
PHARMAC
IE
DE
GRENOBLE
~ ASSOCIES (PAST)~
ITE
JOSEPH
~
SCIENCES.TECHNOLOGIE.SANTE.
CRAMPON RIEU TROUILLER Bernard Isabelle Patrice
Pharmacie officine Qualitologie (CHU)
SantéPublique (CHU)
~ (PRAG) GAUCHARD
CHU :Centre Hospitalier Universitaire
DPM :Département de Pharrnacochimie Moléculaire
Pierre Alexis
HP2 :Hypoxie Physiopathologie Respiratoire et Cardiovasculaire
LBFA :Laboratoire de Bioénergétique Fondamentale et Appliquée
LCIB :Laboratoire de Chimie Inorganique et Biologie
LR :Laboratoire des Radio pharmaceutiques
PAST :Professeur Associéà Temps Partiel PRAG: Professeur Agrégé
UVHCI:Unit of Virus Host Cell Interactions
UFR
Y
U
l
rNn
1
V
r
L
r
r
.nc1T
\011
L
r
DE
PHARMAC
IE
JOSEPH FOURIER
DE
GRENOBLE
SCIENCES.TECHNOLOGIE.SANTÉ.UNIVERSITE JOSEPHFOURIER FACULTE DE PHARMACIE DE GRENOBLE
Domaine de laMerci 38700 LA TRONCHE Doyen de laFaculté :Mme leProfesseur Renée GRILLOT
Vice -Doyen :Mme Edwige NICOLLE
Année 2008-2009
· ·
l i
-~i ~~~ ~ilii ~~·
.. ···
.· ',t·'~· - •. >: '·:.::·.· <··;:i: '... ·· ~-~- ~ · · - ~ - ~ ALDEBERT ALLENET BATANDIER BRETON BRIANCON-MARJOLLET BUDAYOVA SPANO CAVAILLES CHOISNARD DELETRAZ-DELPORTE DEMEILLIERS DURMORT-MEUNIER ESNAULT GEZE GERMI GILLY GROSSET HININGER-FAVIER JOYEUX-FAURE KRIVOBOK MOUHAMADOU MORAND MELO DE LIMA NICOLLE PINEL RACHID! RAVEL RA VELET RICHARD SOUARD TARBOURIECH VANHAVERBEKE Delphine Benoît Cécile Jean Anne Monika Pierre Luc Martine Christine Claire Danielle Annabelle Raphaële Catherine Catherine Isabelle Marie Serge Bello Jean-Marc Christelle Edwige Claudine Walid Anne Corinne Jean Michel Florence Nicolas CécileParasitologie -Mycologie (L.A.P.M)
Pharmacie Clinique (ThEMAS TIMC-IMAG /CHU) Nutrition et Physiologie (L.B.F.A/CHU)
Biologie Moléculaire/ Biochimie (L.C.I.B) Physiologie Pharmacologie (HP2)
Biophysique (U.V.H.C.I)
Biologie Cellulaire et génétique (L.A.P.M) Pharmacotechnie (D.P.M)
Droit Pharmaceutique Economie Santé Biochimie (N.V.M.C)
Biotechnologies (I.B.S.) Chimie Analytique (D.P.M.) Pharmacotechnie (D.P.M.) Microbiologie (I.V.H.C.I. /CHU) Chimie Thérapeutique (D.P.M.) Chimie Analytique (D.P.M.) Biochimie (L.B.F.A)
Physiologie -Pharmacologie (HP2) Biologie Végétale et Botanique (L.C.B.M) Cryptogamie, Mycologie Générale (L.E.C.A) Chimie Thérapeutique (D.P.M.)
Probabilités Biostatistiques (LE.C.A) Chimie Organique (D.P.M.)
Parasitologie -Mycologie Médicale (CIB /CHU) Biochimie (L.C.l.B)
Chimie Analytique (D.P.M.) Chimie Analytique (D.P.M.)
Service Accueil Handicap (Direction) Pharmacognosie (D.P.M)
Biophysique (U.V.H.C.I.) Chimie organique (D.P.M.)
UFR
DE
PHARMAC
IE
JOSEPH
UNIVERSITE
~
DE
GRENOBLE
SCIENCES.TECHNOLOGIE.SANTE.ENSEIGNANTS ANGLAIS
COLLEPierre Emmanuel Maître de Conférence
FITEAndrée Professeur Certifié
GOUBIERLaurence Professeur Certifié
ATER
1 ATER RECHOUMYassine IATER GLADENicolas YzATER RUT AJoséphine IATER NZENGUEYves 1 ATER ELAZZOUZISamira 1 ATER VERONJean Baptiste 1 ATER HADJ SALEMJamila
Yz ATER REINICKEAnne Teresa
1 ATER CHENAUJérôme IATER NASER EDDINEAbeer
ATER:Attachés Temporaires d'Enseignement et de Recherches
CHU :Centre Hospitalier Universitaire CIB :Centre d'Innovation en Biologie
DPM :Département de Pharrnacochimie Moléculaire
DMBMT :Département Mécanismes Biologiques des Maladies et des Traitements HP2 :Hypoxie Physiopathologie Respiratoire et Cardiovasculaire
IAB :InstitutAlbert Bonniot, Centre de Recherche«Oncogenèse et Ontogenèse» IBS :Institutde Biologie Structurale
LAPM :Laboratoire Adaptation et Pathogenèse des Microorganismes
LBFA:Laboratoire de Bioénergétique Fondamentale et Appliquée LCBM :Laboratoire Chimie et Biologie des Métaux
LCIB :Laboratoire de Chimie Inorganique et Biologie LECA :Laboratoire d'Ecologie Alpine
Immunologie/DMBMT Biophysique Chimie Analytique Biologie cellulaire/ DMBMT Pharmacie Galénique Chimie Organique Pharmacognosie Pharmacologie DMBMT Anglais
TIMC-IMAG: Laboratoire Technique de !'Imagerie, de laModélisation et de Cognition UVHCI: Unit ofVirus Host Cel! Interactions
Remerciements
Je tiens à exprimer tout d'abord mes remerciements aux membres du jury, qui ont
accepté d'évaluer mon travail.
A Monsieur le Professeur Patrice Faure
Je vous remercie d'avoir bien voulu juger ce travail et en présider le jury. C'est un honneur que vous me faite.
A Madame le Professeur Dominique Leroux
Merci de m'avoir accueillie au sein de votre laboratoire et de m'avoir confié ce travail. Soyez assurée de toute mon estime et de mon profond respect.
A Madame le Docteur Christine Lefebvre
Merci pour ta disponibilité, ton écoute, tes conseils et ton dynamisme communicatif.
Je tiens particulièrement à te remercier pour la confiance accordée et la sympathie
témoignée au cours de ce travail.
A Madame le Docteur Claire Vettier
Je te remercie pour ta disponibilité et pour la transmission de tes connaissances si précieuses en hématologie. C'est un honneur de t'avoir dans mon jury.
A Madame le Docteur Chantal Dumestre-Perard
Merci d'avoir accepté d'évaluer mon mémoire et de participer à ce jury. Ce fut un
grand plaisir de travailler à tes côtés durant mon internat. Merci pour tes
compétences, ta disponibilité et ton dynamisme.
Je tiens à remercier également les différentes équipes du laboratoire d'hématologie,
notamment celles de cytogénétique oncohématologique et d'hématologie cellulaire. Merci pour votre aide sur le plan technique qui m'a permis d'avancer dans ce travail.
Enfin, un grand merci à l'ensemble des différentes personnes rencontrées
(biologistes, techniciens, aides de laboratoire, et autres personnes) au cours des stages successifs de mon internat. J'en garderai un souvenir chaleureux.
A mes parents,
Je vous dédie ce travail. Merci pour votre confiance et votre soutien qui m'ont permis d'avancer durant ces longues années d'étude.
A Cyril,
Un grand merci pour ta présence, ton écoute, et ton aide. Avec tout mon amour.
A ma sœur Mélanie, et Frédéric,
Pour tous les moments partagés.
A Danièle et Damien, Florence et Julien, Laure et Laurent,
Merci pour les nombreux bons moments partagés depuis de si longues années. Merci pour votre amitié qui m'est si chère. Puisse-t-elle se poursuivre le plus longtemps possible.
A Sophie et Aurélie,
Merci pour votre soutien et votre joie en toutes circonstances. Avec toute mon amitié. Que le trio perdure.
A mes amis et co-internes Yolande, Marion, Stéphanie, Lauren, Marie, Charles,
Lydvine, Jérémie, Antoine et les plus jeunes Elodie, Noémie, Nicolas et Jérôme. Merci pour votre bonne humeur durant ces 4 années d'internat.
A toute ma famille et tous mes amis. A ma Mémé et ma Tata,
Ce mémoire vous aurait rendues fières. Les valeurs humaines transmises durant
SOMMAIRE
LISTE DES ABREVIATIONS ... 4
TABLE DES FIGURES ... 6
INTRODUCTION GENERALE ... 8
PARTIE 1: PHYSIOLOGIE DE LA MATURATION DES LYMPHOCYTES B 9 1. Description générale de la maturation des lymphocytes B ... 10
2. L'immunoglobuline de surface (slg) ou B Cell Receptor (BCR) ... 12
3. Production de lymphocytes B naïfs dans la moelle osseuse ... 14
3.1. Les étapes successives de maturation cellulaire ... 14
3.2. La recombinaison VDJ ... 15
3.3. Régulation des différentes étapes de la lymphopoïèse B précoce ... 18
3.4. Caractéristiques phénotypiques et morphologiques des précurseurs identifiés ... 19
4. La circulation lymphocytaire, phase transitionnelle des lymphocytes B ... 21
5. Maturation dans les organes lymphoïdes secondaires ... 22
5.1. Structure des organes lymphoïdes secondaires ... 23
5.1.1. Les ganglions lymphatiques ... 23
5.1.2. La rate ... 25
5.1.3. Le tissu lymphoïde associé aux muqueuses (MALT) ... 27
5.2. Le centre germinatif (CG), plaque tournante de la maturation des LB dans les organes lymphoïdes secondaires ... 28
5.2.1. Généralités ... 28
5.2.2. Evènements génétiques: les hypermutations somatiques et la commutation isotypique ... 29
5.2.2.1 Rôle de l'enzyme AID (Activation-lnduced Cytidine Deaminase) 31 5.2.2.2 Les hypermutations somatiques ... 31
5.2.2.3 La commutation isotypique ou« switch » ... 32
5.2.3. Caractéristiques morphologiques des cellules lymphoïdes du centre germinatif ... 34
PARTIE Il : LES LYMPHOMES MALINS DE LA ZONE MARGINALE ... 37
1. Particularités anatomiques et fonctionnelles de la zone marginale ... 38
1.1. Structure histologique ... 38
1.2. Fonctions ... 38
1.3. Cellules constituant la zone marginale ... .40
1.4. Particularité des lymphocytes B de la zone marginale ... .41
2.1. Les anciennes classifications ... .43
2.2. La classification REAL ... .43
2.3. La classification de l'OMS ... .45
3. Les lymphomes de la zone marginale ... .46
3.1. Epidémiologie des lymphomes de la zone marginale ... .46
3.2. Facteurs de risque ... .47
3.2.1. Facteurs de risque communs aux LMNH ... .47
3.2.1.1 Facteurs environnementaux ... .47
3.2.1.2 lmmunosuppression ... 47
3.2.2. Facteurs de risque identifiés dans les LZM ... .48
3.2.2.1 Maladies auto-immunes ... .48
3.2.2.2 Stimulation antigénique chronique par des agents pathogènes .48 3.3. Caractéristiques cliniques ... 50
3.3.1. Les lymphomes du MALT ... 50
3.3.2. Les lymphomes de la zone marginale splénique (SMZL) ... 51
3.3.3. Les lymphomes de la zone marginale ganglionnaire (NMZL) ... 52
3.4. Aspects cytologiques ... 52
3.5. Caractéristiques immunologiques ... 55
3.5.1. Généralités ... 55
3.5.2. Caractéristiques immunophénotypiques des cellules du LMNH de la zone marginale ... 56
3.6. Aspects génétiques ... 57
3.6.1. Généralités ... 57
3.6.2. Le caryotype ... 58
3.6.3. L'hybridation fluorescente in situ (FISH) ... 60
3.6.4. Anomalies cytogénétiques décrites dans les lymphomes de la zone marginale ... 61
3.6.4.1 Anomalies cytogénétiques et LMNH ... 61
3.6.4.2 Anomalies cytogénétiques dans les LZM ... 61
3.6.5. Anomalies de structure dans les LZM du MALT et conséquences moléculaires: activation de la voie NF-KB ... 62
3.6.5.1 La voie NF-KB ... 63
3.6.5.2 Anomalies génétiques et conséquences moléculaires sur la voie NF-KB 64 3.7. Evolution et pronostic ... 65
3.8. Traitement ... 66
3.8.1. Particularité du traitement des MZL du MALT ... 66
3.8.1.1 LZM du MALT: exemple du MALT gastrique ... 66
3.8.1.2 LZM du MALT non associés à une inflammation chronique ou en échec d'un traitement éradicateur ... 67
3.8.2. Traitement des SMZL ... 68
3.8.3. Traitement des NMZL ... 69
PARTIE Ill : ETUDE RETROSPECTIVE DE 51 CAS DE LYMPHOMES DE LA ZONE MARGINALE DIAGNOSTIQUES AU CHU DE GRENOBLE ENTRE 2004 ET 2007 ... 70
1. Objectifs ... 71
2.1. Patients et échantillons sélectionnés ... 71 2.1.1. Matériel ... 71 2.1.2. Méthodes ... 73 2.2. Données cliniques ... 73 2.3. Etude histologique ... 74 2.4. Etude cytologique ... 74 2.5. Etude cytogénétique ... 75 2.5.1. Etude caryotypique ... 75 2.5.1.1 Mode opératoire ... 75
2.5.1.2 Relecture des caryotypes ... 76
2.5.2. Etude par FISH ... 77
2.5.2.1 Matériel utilisé ... 77 2.5.2.2 Mode opératoire ... 80 3. Résultats ... 82 3.1. Résultats immunologiques ... 82 3.2. Etude cytologique ... 83 3.3. Résultats cytogénétiques ... 85
3.3.1. Pour l'ensemble des 51 patients ... 85
3.3.2. Anomalies cytogénétiques observées dans les MALT ... 86
3.3.3. Anomalies cytogénétiques identifiées dans les SMZL ... 87
3.3.4. Anomalies cytogénétiques identifiées dans les NMZL ... 88
3.3.5. Anomalies cytogénétiques des formes frontières ... 89
4. Confrontation des résultats cytologiques et cytogénétiques ... 90
5. Discussion ... 91
CONCLUSION ... 104
BIBLIOGRAPHIE ... 107
ADN: AID: Ag: BAFF: BCP: BCR: CD: COR: CG: CGH: CLP: CSH: Dapi: EBV:
LISTE DES ABREVIATIONS
Acide désoxyribonucléique
Activation-lnduced Cytidine Deaminase Antigène
B-Cell Activating Factor B-Cell Precursor
B Cell Receptor Cluster Differenciation
Zones hypervariables de l'lg (Complementaries Determining Regions) Centre Germinatif
Hybridation Génomique Comparative Progéniteur Lymphoïde Commun Cellule souche totipotente
4',6-diamino-2-phénylindole Epstein-Barr Virus
FISH : Hybridation Fluorescente ln Situ
HHV-8 : Herpès virus humain de type 8
HTLV-1 : Human T-Leukemia/Lymphoma de type 1
lg : Immunoglobuline slg : Immunoglobuline de surface IL : Interleukine INF : Interféron LB : Lymphocyte B LDH : Lacticodéshydrogénase
LMNH : Lymphome Malin Non Hodgkinien
L T : Lymphocyte T
LPS : Lipopolysaccharide
LZM : Lymphome de la zone marginale
MALT : Tissu Lymphoïde associé aux muqueuses (Mucosa Associated Lymphoid Tissue)
N/C : Noyau/Cytoplasme
OLllR: Organe lymphoïde secondaire
OMS : Organisation Mondiale de la Santé
Pb : Paire de base
PLP : Progéniteur Lymphoïde Précoce
RAG : Recombination Activation Gene
RSS : Séquence Signal de Recombinaison
SCF: Stem Cell Factor
SLVL: Lymphome de la zone marginale splénique à lymphocytes villeux
SMZL : Lymphome de la zone marginale splénique
SSC : Solution de Sodium Citraté
TGF : Tumor Growth Factor
TNF: Tumor Necrosis Factor
VIH : Virus de l'lmmunodéficience Humaine
TABLE DES FIGURES
Figure 1 : Les différentes étapes de maturation du lymphocyte B dans le centre
germinatif, après stimulation antigénique ... 11
Figure 2 : Structure d'une lg et digestion enzymatique ... 12
Figure 3 : Représentation structurelle de l'immunoglobuline de surface, associée aux molécules de transduction du signal, CD79a et CD79b ... 13
Figure 4 : Les différentes étapes de la lymphopoïèse B ... 14
Figure 5 : Structure des séquences signal de recombinaison ... 16
Figure 6 : Mécanisme de recombinaison VDJ ... 16
Figure 7: Mécanisme d'action des différents enzymes intervenant dans la recombinaison VDJ ... 17
Figure 8 : Processus moléculaire de la recombinaison VDJ ... 17
Figure 9 : Contrôle transcriptionnel de la lymphopoïèse précoce ... 19
Figure 10 : Principales modifications phénotypiques au cours de la lymphopoièse B ... 20
Figure 11 : Structure d'un ganglion lymphatique ... 24
Figure 12 : Follicules lymphoïdes visualisés grâce à l'immunohistochimie ... 24
Figure 13 : Zone paracorticale visualisée grâce à l'immunohistochimie ... 25
Figure 14 : Structure de la rate ... 26
Figure 15 : Structure d'un follicule B activé dans la rate ... 28
Figure 16 : Modifications moléculaires des gènes des lg dans les centres germinatifs ... 30
Figure 17 : Modèle de switch isotypique chez la souris (formation d'lgA) ... 33
Figure 18 : Mécanisme de formation des cassures doubles brins et devenirs de l'ADN ... 33
Figure 19 : Rôle des cytokines dans le contrôle de l'expression des isotypes d'lg . 34 Figure 20 : Aspect cytologique de centroblastes ... 34
Figure 21 : Aspect cytologique d'un centrocyte ... 35
Figure 22 : Aspect cytologique d'un immunoblaste ... 35
Figure 23 : Aspect cytologique de plasmocytes ... 36
Figure 24 : Structure de la zone marginale ... 39
Figure 25 : Localisation anatomique des différents types cellulaires composant la zone marginale ... 40
Figure 26 : La classification REAL proposée en 1993 ... 44
Figure 28 : Lymphocytes d'aspect monocytoïde ... 53
Figure 29 : Plasmocytes et lymphocytes à des stades divers de différenciation plasmocytaire ... 53
Figure 30 : Lymphocyte villeux ... 54
Figure 31 : Informations« morphologiques »apportées par la cytométrie de flux .. 55
Figure 32 : Principe de la cytométrie de flux ... 56
Figure 33 : Caryotype masculin normal - bandes R ... 58
Figure 34 : Représentation d'un caryotype - bandes G ... 59
Figure 35 : Principe de !'Hybridation Fluorescente in Situ ... 60
Figure 36 : Mécanisme d'activation de la voie classique et alterne ... 63
Figure 37: Anomalies génétiques et conséquences moléculaires hypothétiques observées dans les lymphomes de la zone marginale du MALT. ... 65
Figure 38 : MALT gastrique et translocation APl2/MAL T1 : présence d'Helicobacter pylori, réponse au traitement antibiotique et évolution ... 67
Figure 39 : Algorithme thérapeutique face à un diagnostic de SMZL ... 69
Figure 40 : Devenir du prélèvement à l'arrivée au« laboratoire des lymphomes», situé en anatomopathologie ... 73
Figure 41 : Age des patients de notre étude ... 73
Figure 42 : Représentation schématique de la sonde LSI APl2/MAL T1 ... 78
Figure 43 : Images de FISH sur mitoses avec la sonde LSI APl2/MAL T1 ... 78
Figure 44 : Représentation schématique de la sonde IGH de ... 79
Figure 45 : Représentation des résultats immunologiques concernant les marqueurs CD5, CD10 et CD23 ... 83
Figure 46 : Représentation des anomalies cytogénétiques identifiées dans notre cohorte ... 85
Figure 47: Trisomie 3: région potentiellement impliquée dans la lymphomagénèse des LZM ... 94
Figure 48 : Technique de mBAND : mise en évidence d'une délétion 7q ... 95
Figure 49 : Délétion 7q dans les SMZL : région 7q32, zone minimale délétée (24 patients sur 26 dans cette étude) ... 95
Figure 50 : Translocations réciproques observées dans les MALT ... 96
Figure 51 : Représentation de la sonde BCL 10 split signal (Dako) accompagnée de 2 photos de FISH interphasique utilisant cette sonde ... 97
INTRODUCTION GENERALE
La physiologie de la maturation du lymphocyte B (LB) est marquée par 2 grandes étapes : la lymphopoïèse B dans la moelle osseuse puis la maturation dans les organes lymphoïdes secondaires. Ces phases sont marquées par des évènements génétiques importants accompagnés de modifications phénotypiques. Chacun des cancers des cellules lymphoïdes résulte de l'échappement d'une
cellule normale bloquée à un stade donné de maturation, puis de son expansion
clonale. Selon le niveau de blocage de maturation, on parle de leucémie (arrêt de maturation de la lymphopoïèse B dans la moelle osseuse) ou de lymphome (arrêt de maturation des lymphocytes B dans les organes lymphoïdes secondaires).
Les lymphomes de la zone marginale (LZM) se développent à partir d'une
expansion clonale de lymphocytes B de la zone marginale. Cette zone est présente
dans les ganglions à l'extérieur des centres germinatifs et de la couronne du
manteau, dans les tissus lymphoïdes associés aux muqueuses (MALT) et dans la rate où elle y est particulièrement développée. Ainsi 3 entités sont distinguées : les LZM de la zone marginale splénique (SMZL), les LZM du MALT et les LZM ganglionnaires (NMZL). Les LZM font partie d'un groupe de maladies hétérogènes,
regroupées sous le terme de lymphomes malins non-hodgkiniens (LMNH) à
cellules B matures. Ces pathologies sont souvent complexes du point de vue biologique, clinique et pronostique. Un diagnostic multidisciplinaire (clinique, anatomopathologique, cytologique, génétique et immunophénotypique) est nécessaire.
Dans ce travail il nous a paru intéressant de faire le point sur les connaissances concernant la maturation des lymphocytes B afin de pointer les étapes clés en cause dans la lymphomagénèse. La seconde partie expose l'ensemble des caractéristiques cliniques, génétiques et phénotypiques permettant de définir les lymphomes de la zone marginale.
Enfin nous présenterons les résultats de l'étude pluridisciplinaire effectuée sur une série de patients atteints de cette maladie et diagnostiqués entre 2004 et 2007 au CHU de Grenoble.
PARTIE 1 :
PHYSIOLOGIE DE LA MATURATION DES
LYMPHOCYTES B
1. Description générale de la maturation des lymphocytes B
La maturation des lymphocytes 8 débute par la lymphopoïèse 8, phase de différenciation exclusivement médullaire après la naissance [1]. Cette étape indépendante de la présence d'antigène (Ag) permet la production de lymphocytes 8 matures, c'est-à-dire exprimant des immunoglobulines de surface (slg) communément désignées sous le terme « B Cell Receptor » (BCR). Ces LB sont cependant naïfs car ils n'ont pas encore été au contact d'Ag du non-soi.
La lymphopoïèse B est orchestrée par un évènement génétique majeur : la recombinaison VDJ. Elle contribue à la synthèse et la diversité du répertoire des slg.
A la sortie de la moelle osseuse, les LB naïfs entament une phase transitionnelle
permettant une « colonisation » des organes lymphoïdes secondaires (rate,
ganglions lymphatiques, foie, ... ). A ce niveau, lors d'une stimulation antigénique, une nouvelle phase de maturation, aboutit à la production de LB porteurs d'un récepteur spécifique à un Ag donné et à l'amplification de la réponse immune. Cette maturation se déroule précisément dans le centre germinatif (CG) des follicules secondaires.
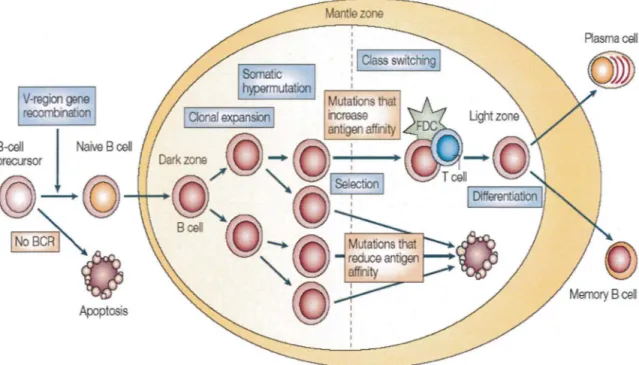
La figure ci-dessous, qui suit un modèle classique basé sur l'hypothèse d'une sectorisation anatomique et fonctionnelle du processus de maturation B, représente les différentes étapes de cette maturation dans le CG. Ce processus reste cependant dynamique et le modèle sectorisé a été récemment remis en question [2].
Mantlezone
Plasma cell
Apoptosis
Figure 1 : Les différentes étapes de maturation du lymphocyte B dans le centre germinatif, après stimulation antigénique.
Le lymphocyte B mature naïf recevant un signal de maturation est conduit au sein des organes lymphoïdes secondaires, dans un follicule primaire. Celui-ci se transforme en follicule secondaire avec un centre germinatif lors de la poursuite de la stimulation. Le centre germinatif est le siège d'importantes modifications de la structure génique des lg : les hypermutations somatiques et la commutation de classe.
(d'après Küppers R. , [3])
Deux évènements génétiques importants se succèdent lors de ces étapes : les hypermutations somatiques, qui sont des modifications de la séquence des bases d'ADN codant pour les régions variables des slg et la commutation de classe des lg
ou « switch » permettant de modifier la fonction effectrice de l'lg.
Ces différentes phases de maturation des LB dans la moelle, puis dans les organes
lymphoïdes secondaires s'accompagnent de changements de leur aspect phénotypique. Un blocage de maturation au niveau des organes lymphoïdes secondaires suivi d'une expansion clonale révèlent le lymphome. Nous comprenons donc pourquoi une approche pluridisciplinaire est importante dans le diagnostic du lymphome.
De manière paradoxale, si la place des lymphocytes T est majeure dans la réponse
européens. Ainsi, dans ce travail, nous développerons exclusivement les
évènements aboutissantàune réponse immuneB.
2
.
L
'
immunog
lobu
l
ine
de
surface
(s
lg)
ou
B
Ce
l
l
Receptor
(BCR
)
Il s'agit du récepteur de l'Ag des LB, présentàleur surface et acquis au
cours de la maturation des LB dans la moelle osseuse. Le BCR, élément
fonctionnel majeur, va permettre la réponse immuneB.
Sa structure a été déterminée grâce aux rayons X, puis par les travaux de
G.Edelmann et R.Porter basés sur la digestion enzymatique par la pepsine et la
papaïne. Le Prix Nobel de Physiologie ou Médecine leura été attribué en 1972 [4].
La slg est composée de deux chaînes lourdes H identiques et de deux chaînes
légères L identiques. Elles sont liées par des ponts disulfures. Leur structure est
représentée dans lafigure ci-dessous.
Régions N-terminales
...-H chaut
Régions C-terminales
1
Papa in
Pcpsin digestion
digestion .\lcrcaptm:thanol
~
l ~
~~
HS Fe Hchain +n
LchainUsH
SH SHFigure 2: Structure d'une lg et digestion enzymatique
Travaux ayant contribuéàla connaissance de la structure d'une lg.
Les parties N-terminales de la chaîne lourde H et de la chaîne légère L comportent
des séquences hypervariables impliquées directement dans la liaisonàl'Ag : les
séquence variable et unique pour un LB donné, destinéeàrépondreàun Ag
précis.
En opposition, les parties C-terminales de ces mêmes chaînes constituent la partie
constante de l'lg. Les parties constantes se définissent que sous les formes
suivantes : M,D, G, A etE.Elles déterminent la fonction et la classe de l'lg [5].
La molécule d'lg de surface (slg) est associéeàdes molécules intracellulaires
permettant la transduction du signal reçu par la cellule. Parmi ces molécules, les
marqueurs CD19, CD22, CD79a et CD79b jouentun rôle prépondérant [6].
Lorsque la molécule d'lg reconnaît un épitope antigénique, un signal d'activation
intracellulaireest transmis par l'intermédiairenotamment du CD79a et CD79b.
CD79b CD79a
ou
~
Cytoplasmic tails
Figure 3 : Représentation structurelle de l'immunoglobulinede surface, associée aux molécules de transduction du signal, CD79a et CD79b.
3
.
Produc
t
ion
de
lymphocy
tes
B
na
ï
fs
dans la
moe
l
le osseuse
Il s'agit de la lymphopoïèse B. Elle se déroule en différentes étapes
successives aboutissantàla production de lymphocytes B naïfs, indépendamment
de la présence d'un Ag.
3
.1
.
Les
é
tapes
success
ives
de
ma
tura
t
ion
ce
l
lu
la
ire
Dans la moelle osseuse, la cellule souche totipotente CSH possèdant la
capacité d'autorenouvellement donne naissanceàun progéniteur multipotent par
l'expression du récepteur Flt3. Le progéniteur multipotent progresse dans la voie
lymphoïdeen se différenciant en progéniteur lymphoïdeprécoce (PLP) ou«earliest
lymphocyteprogenitor». Cette cellule peut alors générer:
soit un progéniteur T précoce (qui migrera vers le thymus pour se
différencier en lymphocyteT),
soit un progéniteur lymphoïde commun (CLP) restant capable de se
différencier en lymphocyteB, NK ou en cellule dendritique.
L'acquisition de la spécificité de lignage B s'effectue par le biais de précurseurs
lymphocytaires (BCP), ou«B cell precursors». Ces précurseurs sont hautement
prolifératifs. Les étapes successives les mettant en jeu sont représentées dans la
figure ci-dessous.
CSH
ProgéniteurTprécoce
~ ~~~~~~~
~~
CLP ëârly B prô-B prë·BI large &ri'lâll immatl.lfë ri'lâturë prë•Bll pr&Bll B B
Figure 4 : Les différentes étapes de la lymphopoïèse B
(CSH : cellule souche totipotente, PLP : progéniteur lymphoïde précoce, CLP : progéniteur lymphoïdecommun)
(d'après Blom and Spits,[7])
Lors de ces différentes étapes de maturation dans la moelle osseuse, les
précurseurs des LB subissent des réarrangements génétiques. La recombinaison
3.2. La recombinaison
VDJElle permet la diversité des répertoires de BCR exprimés par les LB matures mais constitue également la première grande source d'erreur via des mécanismes de recombinaison aberrante [8].
Le processus de recombinaison VDJ permet la genèse d'une seule et unique
région variable à partir de segments géniques distincts codés par les loci des gènes
IGH, IGK et /GL.
La recombinaison VDJ concerne les parties variables des chaînes lourdes H ( « Heavy » ), et des chaînes légères L ( « Light » ). Les parties variables des chaînes lourdes H sont constituées de segments codés par un assemblage somatique de 3 séquences géniques (Variable VH, Diversity DH et Joining JH) et celles des chaînes légères L par 2 séquences géniques (Variable VL et Joining JL) [9].
Le locus /GH, situé sur le chromosome 14, en 14q32, regroupe 123 à 129
segments variables VH dont 51 fonctionnels, 27 segments de diversité DH, 7 segments de jonction JH et 11 segments constants CH. Chaque segment CH code
pour une région constanteµ, ô, y (1 à 4), E et a (1 et 2).
Les gènes codant pour la chaîne légère K se localisent sur le chromosome 2, en
2p11 et ceux codant pour la chaîne légère
A
sur le chromosome 22, en 22q11. Lesloci /GK et /GL ne possèdent pas de segment D.
La recombinaison VDJ est un processus combinatoire ordonné : les chaînes lourdes sont réarrangées avant les chaînes légères (K avant A).
Ce mécanisme de recombinaison site-spécifique, indépendant de l'antigène, est initié par des enzymes : les recombinases RAG-1 (Recombination Activating Gene-1) et RAG-2 (Recombination Activating Gene-2). Il est complété par des complexes protéiques du système NHEJ (Non-Homologous End-Joining) impliqués dans la réparation de l'ADN [1 O].
RAG-1 et RAG-2 sont impliqués dans l'activation de ce processus de
recombinaison. Leur expression est restreinte aux cellules lymphoïdes (B et T), à
certains stades de maturation. Un déficit de l'une de ces enzymes entraîne un blocage complet de la maturation des précurseurs lymphoïdes.
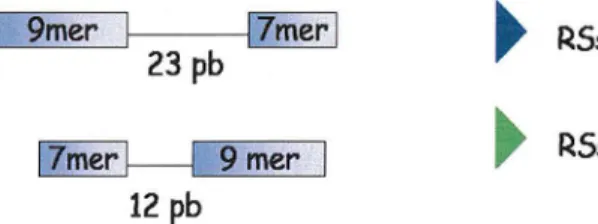
Ces enzymes RAGs se fixent sur le gène en configuration germinale, c'est-à-dire non réarrangé, au niveau de séquences spécifiques adjacentes aux gènes V, D et J, définies comme des séquences signal de recombinaison (RSS). Elles sont situées en 3' des gènes V, 5' des gènes J et de part et d'autre des gènes D. Chaque RSS est constituée d'un heptamère palindromique conservé et d'une séquence nonamérique riche en A-T, séparés par un segment espaceur de 12 paires de bases (pbs) ou 23 pbs. Lors de la recombinaison, il y a appariement d'une RSS de type 12 et d'une de type 23.
~ 23 pb ~ 12 pb
~
RSs 23~
RSs 12Figure 5 : Structure des séquences signal de recombinaison
L'héptamère palindromique et la séquence nonamérique sont séparés par 12 ou 23 pbs.
Figure 6 : Mécanisme de recombinaison VDJ. Elle n'est possible qu'entre des RSS de type 12 et 23.
La fixation des enzymes RAG sur !'ADN entraîne des cassures de l'ADN double brin, précisément entre la séquence RSS et le locus d'un gène variable V, D ou J. La boucle générée entre les 2 séquences RSS est éliminée [5, 11, 12].
La cassure double brin induite par cette recombinaison est réparée par les enzymes de réparation de l'ADN (complexe NHEJ) puis la TdT (Terminal desoxynucleotide Transferase) grâce à une insertion de 1 à 9 nucléotides appelée région N.
a
b
RAG1&RAG2
-w
!
+
Ouverture desstructuresen tète d'épingleG
g
Structure en tète d'épingle\
l
~ (bout roddnt) 5'---~ ---
~
."-.,/'• -bout signalDNA·PKcs,Artemis/,AG1&
~
1
~~ i
du NEH!;"' \Ku,XRCC4,Ligase IV,
+
+
TdT:ajouldenurléotidesNAutresfacteurs·1
---
~~~---Joint codant:
Imprécis,aver ajout de nucléotides N bouts irancs,Joint slig,\lionignal:précise avernombre variable djolnl codantemtrléotidesN
Figure 7: Mécanisme d'action des différents enzymes intervenant dans la recombinaison VDJ
a. Initiation de la cassure double brin par lesenzymes RAGs b. Réparation par lesenzymes de réparation de l'ADN et laTdT (d'après Brant V, J. Clin. lnvest.,2003, 111 :315)
Lors du premier réarrangement dans la cellule pro-B précoce, un gène DH se
recombine avec un gène JH. Puis, dans la cellule pro-B, la séquence DHJH
réarrangée se recombine avec un gèneVH.Les combinaisons sont différentes pour
chaque LB. Il s'agit de ladiversité combinatoire.
Ce réarrangement séquentiel aboutit au stade pré-Bàune recombinaison complète
VDJ sur la partie variable de la chaîne lourdeH.
Le réarrangement des chaînes légères débute alors selon le même mécanisme :
juxtapositiond'un gèneVL (pris au hasard) avec l'un des gènesJL.
aVDJ recombination
Figure 8 : Processus moléculaire de la recombinaison VDJ
Rapprochement des segments OH etJH puis du segment VH.La région variable des gènes des lg est ultérieurement connectéeàla région constante (ici au segment Cµ).
La dernière étape de ce processus combinatoire est le rapprochement de la région variable VHDHJH, tout juste créée, avec un segment constant CH. Un épissage
alternatif du segment VDJC (soit sur le gène µ, soit sur le gène o) aboutit à une
coexpression en surface du LB naïf d'une slgMD possédant cependant le même domaine variable, donc la même spécificité antigénique [13].
Les lymphocytes B porteurs de récepteurs non fonctionnels ou autoréactifs (dirigés contre des Ag du soi) seront éliminés avant la sortie de la moelle. Seuls 10% des
lymphocytes B échappent à ce stade à l'apoptose.
Les LB non autoréactifs et avec un BCR fonctionnel vont quitter la moelle vers la circulation sanguine puis lymphatique.
A la sortie de la moelle osseuse, on estime que le répertoire immun est composé
de 1011 BCR différents [9].
3.3. Régulation des différentes étapes de la lymphopoiëse B précoce
Toutes ces étapes ne se font pas au hasard ; le microenvironnement joue un
rôle essentiel, à la fois par le biais de contacts cellulaires, le stroma médullaire, et
par la production de médiateurs solubles (les cytokines et les interleukines). Certains facteurs de croissance sont actuellement connus pour jouer un rôle dans la lymphopoïèse B.
Le C-kit, récepteur à tyrosine kinase qui se trouve sur la cellule pro-B, interagit avec
une cytokine fixée sur les cellules du stroma : le SCF (Stem Cell Factor).
Cette interaction génère un signal de prolifération et de maturation dans les phases précoces de la lymphopoïèse, tout comme le ligand de Flt3, Flk2.
D'autres molécules d'adhésion et facteurs solubles, tels que des cytokines interviennent :
l'IL-3 joue un rôle important dans cette différenciation,
l'IL-7 est souvent mentionnée; son action est bien décrite chez la souris,
cependant, à l'heure actuelle, rien ne permet d'affirmer son intervention dans
Le développement lymphoïde B précoce est également orchestré par un réseau
élaboré de facteurs de transcription ubiquitaires ou lymphocyte-spécifiques (PU.1,
lkaros, BCL 11A,E2A, EBF (early B-cell factor), FOXP1 et PAX5).
PU.1 et lkaros agissent en parallèle dans le contrôle de la transition des cellules
souches en précurseurs de la lignéelymphoïde.
E2A, EBF et Pax-5 régulent la différenciation des progéniteurs lymphoïdes B en
lymphocytes pro-B précoces. E2A assume le contrôle d'EBF qui régule Pax-5 [7,
15,16].
CSH : cellulesot!cfu::. hÉmatopoïstique
PL.1.1 CS L: cell11le souche lymphoïde
l
CDL:csl[uleds-ndri'tique d'origif1e lymphciide--~ l i positive:.
Figure 9: Contrôle transcriptionnelde lalymphopoïèse précoce (d'après Blom and Spits,[7])
Ces facteurs transcriptionnels peuvent être la cible d'altérations moléculaires
(mutations, translocations chromosomiques) à l'origine de transformations
tumorales.
3.4. Caractéristiques phénotypiques et morphologiques des précurseurs identifiés
Lors de ces différentes étapes de maturation dans la moelle osseuse,
l'expression des Ag de surface évolue. Ainsi, les précurseurs sont identifiablesà
chaque stade.
Les principales modifications phénotypiques observées au cours des différentes
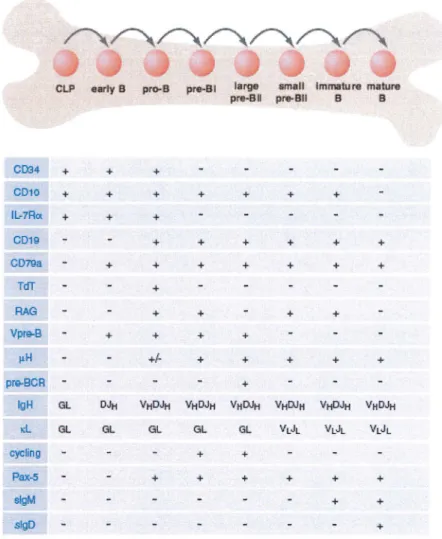
CLP early B pro-B pre•BI large small Immature mature pre•Bll pré-Bll B B CD34 + + + CD10 + + + + + + + ll.,.7ROI + + + CD19 + + + + + + CD7lla + + + + + + + TdT + RAG + + + + Vpr3-B + + + + µH +l- + + + + + pr3-BCR
-
+ lgH GL DJH VHDJH YHDJH YttDJH VHDJH VHDJH VttDJH i.:L GL GL GL GL GL YtJL Vt JL Vt JL cycling + + Pax..s + + + + + + slgM + + slgD +Figure 10 : Principales modifications phénotypiques au cours de la lymphopôièse B
CLP : progéniteur lymphoïde commun GL : configuration germinale
(d'après Blom and Spits, [7))
CD34, marqueur d'immaturité cellulaire, disparaît lors du passage du stade
précurseur pro-8 à pré-8.
Ces précurseurs acquièrent progressivement l'expression de marqueurs
pan-8 comme CD19, CD79 et CD22.
Dans la moelle, les précurseurs ont une expression transitoire du CD10 [9].
A partir du stade pro-8, les gènes des chaînes lourdes VHDHJH sont réarrangés. Ces cellules expriment transitoirement la chaîne lourdeµ.
Les cellules pré-8 de petite taille commencent à réarranger les chaînes légères.
Les précuseurs pré-8 vont, dans le stade suivant, générer des LB immatures, au sein desquels les gènes des chaînes lourdes et légères sont réarrangés. Ils expriment une lgM de surface, notéé slgM.
Il se produit alors une sélection négative permettant d'éliminer les LB autoréactifs, dont le BCR est dirigé contre les Ag du soi.
Seuls les LB matures survivent à ce stade. Le LB mature est défini par l'expression
en surface de deux isotypes : slgMD. Il est cependant naïf; il n'a en effet pas
encore rencontré l'Ag [14]. Outre CD10, les mêmes molécules seront exprimées à
leur surface.
En ce qui concerne les caractères cytologiques, les cellules des différents stades de maturation dans la moelle osseuse ont la morphologie de lymphoblastes et ne sont pas distinguables les unes des autres.
A la sortie de la moelle, le LB mature et naïf présente les caractères cytologiques d'un petit lymphocyte circulant.
4. La circulation lymphocytaire, phase transitionnelle des
lymphocytes B
La phase transitionnelle permet aux LB sortant de la moelle osseuse de
« coloniser » les organes lymphoïdes secondaires. Cependant, seules 10% des
cellules B transitionnelles échappent à l'apoptose.
Cette phase met en jeu deux voies de signalisation fondamentales pour la survie et la différenciation de ces LB : la signalisation via le BCR et la signalisation via le BAFF-R (B-cell Activating Factor - Receptor).
Signalisation via le BCR :
Au niveau du BCR, un signal d'activation est transmis jusqu'au noyau par l'intermédiaire notamment du CD79a et CD79b. Il va permettre d'activer les voies
de signalisation Pl3K, RAS-RAF-ERK et NF-kB, nécessaires à la survie et à la
prolifération des LB. L'importance fonctionnelle du BCR a été établie par les études de nombreux modèles de souris transgéniques, confirmant qu'une altération de BCR ou de sa voie de signalisation induit un blocage des cellules B au stade transitionnel [17].
Signalisation via BAFF-R :
BAFF, membre de la famille des TNF (Tumor Necrosis Factor) est indispensable à
la progression des cellules B transitionnelles. BAFF induit l'engagement du récepteur BAFF-R (BAFF-Receptor), présent sur les cellules B, et maintient leur survie et leur maturation par induction de facteurs anti-apoptotiques (Bcl2, Bel-XL, MCL 1 ... ) [18-20]. L'équipe de Mackay évoque la disparition des cellules B de la zone marginale en l'absence de BAFF. Les auteurs suggèrent que cette absence perturberait l'ensemble du microenvironnement de la zone marginale et conduirait,
par conséquent, à une perte de la population de cellules B de cette zone.
Chez la souris, après activation de ces voies, 2 types de lymphocytes B sont individualisés [21] :
les lymphocytes B1 dont la correspondance avec les cellules B CD5+ humaines n'est pas encore établie avec certitude [22, 23].
Leur origine reste controversée [18].
- les lymphocytes B2 eux-mêmes subdivisés en 2 types :
• les cellules B folliculaires (FO) qui vont poursuivre leur maturation par le CG et enclencher la réponse T-dépendante.
• les cellules B de la zone marginale (ZM) qui vont se différencier en plasmocytes mémoires circulants, sécréteur d'lgM de faible affinité et de courte durée de vie.
La différenciation en cellules ZM ou FO dépendrait d'un réseau transcriptionnel complexe, encore imparfaitement identifié, et de la force de signalisation du BCR [24].
5. Maturation dans les organes lymphoïdes secondaires
Après la phase transitionnelle, la maturation des LB se poursuit dans les organes lymphoïdes secondaires.
Parmi les organes lymphoïdes secondaires, on distingue: les ganglions lymphatiques,
la rate,
Ces organes permettent le contact entre l'Ag, apporté par les cellules présentatrices de l'Ag ou directement par le flux sanguin, et les rares cellules T ou B qui lui sont spécifiques. Cette interaction va permettre la différenciation des LB naïfs en LB immunocompétants.
La maturation des lymphocytes B se produit au niveau des CG qui se développent au sein des follicules secondaires, au dépend des follicules primaires. Les CG constituent de véritables plaques tournantes dans l'élaboration de LB immunocompétents : les LB mémoires et les plasmocytes. Cette différenciation va s'accompagner d'une modification de la structure génique de l'lg par le biais des hypermutations somatiques et de la commutation de classe, deux événements génétiques incontournables.
5.1. Structure des organes lymphoïdes secondaires
5. 1. 1. Les ganglions lymphatiques
Ils sont disposés sur le trajet des voies lymphatiques. Environ 1000
ganglions, de 1 à 15 mm de diamètre, sont répartis dans tout l'organisme
permettant ainsi la surveillance de nombreux territoires.
Le tissu lymphoïde est y présent dès le 5ème mois de la vie fœtale.
Les ganglions sont munis d'une double circulation, lymphatique et sanguine. La circulation lymphoïde s'effectue dans un seul sens : du tissu au sang via les ganglions.
Une capsule entoure le ganglion. Elle est séparée du parenchyme ganglionnaire par un sinus.
Le ganglion lui-même est composé:
d'une zone corticale externe, siège des follicules lymphoïdes constitués en majorité de LB,
d'une zone paracorticale, lieu de transit des lymphocytes venant de quitter la circulation lymphatique. On y trouve surtout des L T et des cellules dendritiques, mais aussi des LB en cours de migration vers les follicules, d'une zone médullaire riche en petits sinus, où aboutit l'artériole ganglionnaire et d'où partent la veinule splénique et la circulation
lymphatique efférente. Elle est particulièrement riche en macrophages et en plasmocytes. veine artère
si'l us rnaro.mat.
sous.capSUlaireFigure 11 :Structure d'un ganglion lymphatique
cap1lta.1re
Iohëul11 p i ~
- Zone corticale - Zone paracorticale c::=:::J Zone médullaire
Trois zones sont distinguables :lazone corticale externe comportant des follicules lymphoïdes, la zone paracorticale riche en L T et la zone médullaire.
L'anatomopathologie permet de préciser cette architecture ganglionnaire sur des
coupes, notamment grâceàdes techniques immunohistochimiques (cf photos ci
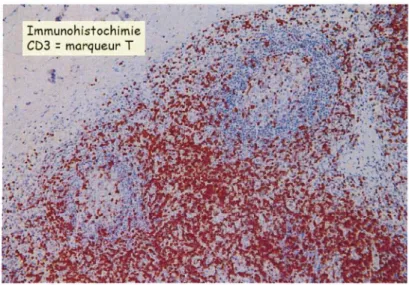
Figure 13: Zone paracorticale visualisée grâce à l'immunohistochimie.
Marquage par un Ac dirigé contre le CD3, marqueur pan-T, révélant les lymphocytes T présent dans la zone paracorticale. ·
L'examen cytologique va, quant à lui, permettre une étude plus fine à l'échelle cellulaire grâce à des appositions ganglionnaires.
5.1 .2. La rate
Avec 200g et 12 cm de long en moyenne, la rate est le plus volumineux des organes lymphoïdes secondaires. Elle est située du côté gauche de la cavité abdominale et s'incurve autour de la partie antérieure de l'estomac.
La rate est entourée d'une capsule fibreuse qui se prolonge vers le centre par les trabécules de la rate.
Elle contient deux zones distinctes séparées par la zone marginale [25]:
la pulpe blanche (1 % du volume de la rate), organisée en régions riches en lymphocytes T et en follicules riches en LB. Elle forme des manchons autour des artérioles centrales ramifiées de l'artère splénique, et dessine des îlots dans la pulpe rouge. Elle constitue le tissu lymphoïde de la rate.
la pulpe rouge est composée du tissu splénique restant, c'est-à-dire des sinus veineux et des cordons spléniques, ainsi que des régions de tissu conjonctif réticulaire contenant des érythrocytes et un très grand nombre de macrophages et plasmocytes.
La zone marginale occupe une place fondamentale au sein du tissu splénique. Elle y est particulièrement développée et se trouve à l'interface entre la pulpe blanche et
la pulpe rouge. Ainsi le flux sanguin comportant les Ag traverse la pulpe blanche,
atteint les sinus marginaux et filtre la zone marginale avant de retourner dans la
circulation via les sinus veineux de la pulpe rouge. Les cellules de la zone
marginale sont ainsi constamment exposées au flux sanguin et donc aux Ag
circulants [24]. Ceci permet aux LB de la zone marginale de répondre très
rapidementàun Ag par une production d'lgM, de façon peu dépendante des
lymphocytesT.
La rate ne possède pas de circulation lymphatique afférente ; les Ag ne sont ainsi
apportés que par la circulation sanguine. De par sa disposition stratégique, la rate
constitue un filtre très efficace permettant l'élimination des globules rouges
sénescents et des Ag du non-soi.
Les artères centrales apportent une partie du sang dans des capillaires qui
s'ouvrent dans les cordons spléniques, ce qui permet aux macrophagocytes de la
pulpe rouge d'intervenir dans la destruction des érythrocytes et des plaquettes en
fin de vie ainsi que celle des agents pathogènes présents dans lesang.Le reste du
sang est acheminé dans la pulpe blanche.
Collecting vein
Venous si us
"-1---1---Cords
Outer c.apsule
withtrabeculae
--~~ -- --- Centralarte ·oie
Follicle
-i~i ~~ ~ - --- ~--- T-cellzone
---~---Figure 14: Structure de la rate.
La pulpe blanche, composée de zones riches en lymphocytesTet de follicules riches en lymphocytes B, forme des véritables manchons autour de l'artériole centrale. La zone marginale constitue une véritable interfaceentre pulpe blanche et pulpe rouge.
5.
1. 3. Le tissu lymphoïde associé aux muqueuses (MALT)Le MALT constitue la masse de tissu lymphoïde la plus importante de l'organisme (80%) et joue un rôle fonctionnel fondamental puisqu'il est impliqué dans la prévention de la pénétration des pathogènes aux principales portes
d'entrée de notre organisme, à savoir les muqueuses. Il est également impliqué
dans le traitement des innombrables antigènes de l'environnement (aliments,
matériaux inhalés ... ) afin d'induire un état de tolérance à leur égard.
Selon les tissus concernés, on parlera de GALT (Gut Associated Lymphoid Tissue) pour le tractus digestif ou de BAL T (Branchus Associated Lymphoid Tissue) pour les bronches.
Fonctionnellement le MALT est organisé en 2 types de structures :
les sites effecteurs qui sont des infiltrats plus ou moins denses composés de L T, de plasmocytes sécrétant principalement des lgA, et de lymphocytes intra-épithéliaux de phénotype Tet NK,
les sites inducteurs organisés en follicules lymphoïdes isolés (bronches, côlon) ou en agrégats de follicules (amygdales et végétations adénoïdes pour le carrefour aéra-digestif, appendice iléo-coecal et plaques de Peyer pour le tube digestif). A leur niveau, des cellules de type bordure en brosse et des cellules spécialisées se chargent de capturer l'Ag et de le transporter vers les follicules.
Contrairement aux ganglions lymphatiques et à la rate qui « surveillent » des
territoires stériles et qui répondent vigoureusement à l'entrée d'un microorganisme
dans leurs territoires, le MALT doit moduler ses réponses immunes et discriminer
les agresseurs potentiels des antigènes inoffensifs ou à respecter. Cela permet
d'éviter les réactions inflammatoires délétères pour les échanges gazeux ou digestifs.
5.2. Le centre germinatif (CG), plaque tournante de la maturation
des LB dans les organes lymphoïdes secondaires
Le centre germinatif (CG) est une véritable microstructure anatomique spécialisée ayant un rôle fondamental dans la maturation des LB.
Suite à une stimulation antigénique, le follicule primaire évolue en follicule
secondaire avec un centre germinatif. Le CG constitue une véritable plaque tournante dans l'élaboration de LB immunocompétents.
5. 2. 1. Généralités
La structure microanatomique du follicule secondaire est visualisée grâce à
la Figure 15 ci-dessous.
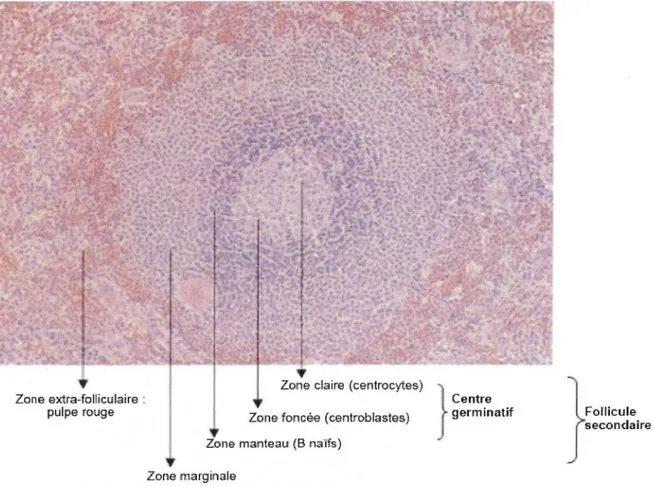
Zone claire (centrocytes) Zone foncée (centroblastes) Zone manteau (B naîfs)
Zone marginale
Figure 15: Structure d'un follicule B activé dans la rate
} Centre germinatif } Follicule secondaire
Le centre germinatif est composé de la zone foncée, lieu de prolifération intense des centroblastes, et de la zone claire. La zone du manteau forme une couronne externe. La zone marginale recouvre le follicule secondaire.
Dans le centre germinatif, on distingue :
la zone sombre (ou foncée) du centre germinatif, siège d'une prolifération avec expansion oligoclonale des centroblastes. Cette zone est également le lieu des mutations somatiques,
la zone claire où s'effectue la différenciation en centrocytes et l'arrêt du cycle cellulaire. Une sélection clonale s'y opère.
5.2.2. Evènements génétiques: les hypermutations somatiques
et la commutation isotypique
Les cellules B « activées » par l'Ag se localisent en premier lieu au sein d'une région du ganglion lymphoïde riche en cellules T, la zone paracorticale. Il y aura production de lymphocytes sécrétant une lgM (=réponse immune primaire). Si la réaction se poursuit, quelques une de ces cellules migrent vers un autre territoire de l'organe lymphoïde où ils se regroupent pour former un follicule primaire.
Si la stimulation se perpétue, le follicule primaire se transforme en follicule secondaire avec un CG.
Deux modifications successives des gènes d'lg surviennent dans les cellules centrofolliculaires au niveau du centre germinatif :
- des hypermutations somatiques sur les chaînes lourdes et légères d'lg, au niveau de leurs parties variables,
une commutation isotypique ou « switch » : les séquences codant pour la région constante M de la chaîne lourde sont remplacées par celles codant pour les chaînes G, A ou moins fréquemment, E.
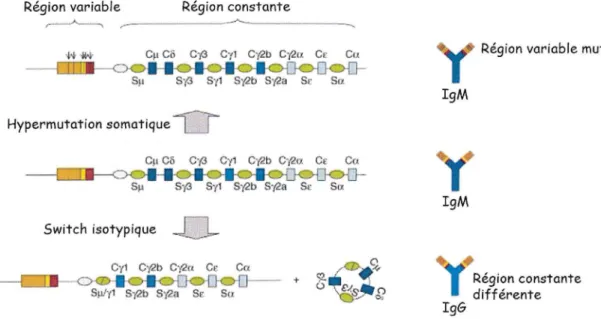
Ces 2 évènements génétiques sont représentés dans la Figure 16 ci-dessous.
Région variable Région constante
,...---"---
---Région variable mutée S11 Sy.l Sy1 Sy.?b Sy.?a Si: Set
Hypermutation somatique
LJ
Cµ Cô C'(J Cy1 C.,Zb Cy.!et Ct: Cet
$µ S·/3 Sy1 Sr2b S·f.2a S.: Su
Switch isotypique
-D-Sµ/y1 S(2b Sy.!a S& Sa
Cy1 Cy2b C·/2a C& Cet
- - + u <;2.
De Yebenes, VG. et al. 2006. Trends Mal. Med. 12(9): 432.
IgM
IgM
Y
Région constante différenteIgG
Figure 16 : Modifications moléculaires des gènes des lg dans les centres germinatifs L'hypermutation somatique change l'affinité de l'lg pour l'Ag.
Le switch permet d'obtenir une région constante différente, modifiant les propriétés de l'Ac. (d'après De Yebenes, VG. and al, [27])
Ensuite les cellules subissent une sélection d'affinité : les lymphocytes B qui portent en surface l'lg ayant la plus forte affinité pour l'Ag, c'est-à-dire les LB qui ont subi les mutations somatiques conférant la plus forte spécificité, seront sélectionnés. Les LB ne répondant pas à ces critères meurent par apoptose.
Les cellules à forte affinité vont à nouveau proliférer. Elles vont alors se différencier en lymphocytes mémoires à longue vie et en précurseurs plasmocytaires.
Les lymphocytes mémoires recirculent indéfiniment dans l'organisme à la recherche de leur Ag complémentaire. Un nouveau contact induit un nouveau cycle qui produira de nouvelles cellules B spécifiques de l'Ag plus rapidement.
Par rapport aux lymphocytes naïfs, les lymphocytes mémoires ont un BCR à plus forte affinité pour l'Ag, de nature lgG, A ou E.
Les précurseurs plasmocytaires, quant à eux, migreront vers la pulpe rouge de la rate, la médullaire du ganglion ou la moelle osseuse et se transformeront en plasmocytes qui vont produire des lg à haute affinité pour l'Ag.
5.2.2.1 Rôle de l'enzyme AID (Activation-lnduced Cytidine Deaminase)
Cette enzyme est essentielle aux mutations somatiques et aux commutations isotypiques.
Découverte en 1999, son expression est limitée au CG.
Cependant, son mécanisme d'action, encore mal défini, pourrait avoir un lien avec certains mécanismes de lymphomagénèse.
Deux modèles de mécanisme d'action, sujet à de nombreux débats, ont été proposés:
l'AID serait une ARNm déaminase responsable de la synthèse d'un ARNm codant pour une protéine, possiblement une endonucléase, directement ou indirectement impliquée dans les hypermutations somatiques et le switch isotypique. Néanmoins l'ARNm en question n'a pas été identifié.
l'AID agirait en déaminant directement les cytosines entraînant le mismatch G-U et en conséquence des cassures simple brin puis double brin [27]. La deuxième alternative est la plus soutenue actuellement ; elle a déjà été mise en
évidence « in vitro» par plusieurs équipes (Muramatsu et al., Poltoratsky et al. et
plus récemment Petersen-Mahrt et al) [28].
En effet, in vitro, l'AID est capable de transformer les dC en dU sur l'ADN [28, 29]. Le mismatch G-U qui en résulte est le signal nécessaire au processus d'hypermutation mais aussi de switch [30].
5.2.2.2 Les hypermutations somatiques
Il s'agit de mutations ponctuelles sur les gènes réarrangés codant pour les séquences variables des chaînes lourdes et légères. Ces mutations somatiques vont augmenter ou diminuer l'affinité du BCR pour l'antigène.
Elles ont lieu dans la zone sombre du CG et se produisent au hasard.
Certains auteurs avancent que les hypermutations somatiques n'ont pas uniquement lieu dans le CG mais également dans la zone marginale splénique. Des travaux de différentes équipes (Willenbrock et al, Jungnickel et al, Küppers et
al) ont montré que ces hypermutations somatiques dans la zone marginale sont
significativement moindre en nombre de bases mutées par rapport
à
celles dans leCG [31 ].
Le LB continue à maturer et induit la formation de la zone basale claire du CG.
C'est une zone de sélection clonale. Les clones ayant une forte affinité pour l'Ag
sont « sauvés » de l'apoptose. Il y aura expansion de ces clones-là. Ainsi on peut
parler de pression de sélection exercée par l'Ag positivement et négativement. 5.2.2.3 La commutation isotypique ou « switch »
La commutation isotypique a lieu dans la zone claire du centre germinatif. Elle permet aux LB activés, exprimant des lgM eVou des lgD, de modifier la structure de leur chaîne lourde. Différents isotypes sont possibles : lgG, lgA et lgE. Cette commutation n'affecte pas la spécificité antigénique ni l'affinité de l'lg pour l'Ag mais change les fonctions effectrices de l'Ac.
Elle se produit par recombinaison génétique, impliquant l'excision d'ADN entre les régions V réarrangées et l'exon sélectionné de la région C. Les gènes des régions constantes des chaînes lourdes sont localisés en 3' du gène VDJ recombiné. Chaque gène est en fait une série d'exons codant pour les différents domaines C complétés par les exons spécifiques de la région charnière (sauf l'lgA) et des régions cytoplasmiques et transmembranaires.
Entre chacun de ces gènes, des séquences d'ADN spécifiques (les régions S), riche en G, sont la cible de l'AID. L'enzyme déamine les résidus cytosines dans les régions S de part et d'autre de la région à éliminer [28].
La Figure 17 ci-dessous représente le mécanisme de la commutation isotypique (exemple de la formation d'lgA).
aHeavy chain genes in lgM-expressing cells VDJ~ Cµ Cô C')'3
~· ··
~
.
S.
---
ômRNA b Switch recombination (requires DSBs) V DJ•
s•
C')'2 b Cy2a~
CaC Heavy chain genes
inlgA-expressingcell ---VDJ[]J----eCa---
---
" mRNA c,~.
S @.
"S,.......-___ -~ Germline IranscriptFigure 17: Modèle de switch isotypiquechez la souris (formation d'lgA) a. L'AID initiele switch en déaminant les résidus cytosines au niveau des régions S
b. Formation de cassures double brin au niveau de 2 régions S, délétion de la partie entre les 2 régions S
c. Formation d'un gène codant pour la partie constante de la chaîne lourdede l'lgA. (d'aprèsJ.Stavnezer,[28])
Ce mécanisme entraîne des cassures doubles brins de l'ADN qui constituent des
points sensibles supplémentaires. Outre la commutation isotypique, des
réparations,des mutations, des translocations peuvent se produire.
G 1 1 1 , Ç1 1 1 AID ~ 1111&• 1 1 u ~ ~- ~ G À
I
DNA+
Pol
l 11 DSB ~ Pol 0 """""""'"l"'l"l""I G G .i.i..a.w.w.~ Sg Sy3 c NC-Jass switching Repair Mutation
1
"l""!"!"I'"l"l"'l""I
i i i ~
~ c-myc
Tran'Slocations
Figure 18: Mécanisme de formation des cassures doubles brins et devenirs de l'ADN
L'AID déamine dC en dU quiest excisé par l'une des uracil-DNA-glycosylases,l'UNG.Les sites sans base sont coupés par des endonucléases (APE1 et APE2) créant des simples brins d'ADN.Différents devenirs sont alors possibles (réparation,mutation,translocation,commutation isotypique).
La commutation isotypique est sous le contrôle de différentes cytokines. Comme
indiqué dans le tableau ci-dessous, l'IL-4, l'IFN-y et le -~ jouent un rôle
importantdans lecontrôle de l'expressiondes différents isotypesd'lg.
Cylok nes 19A
IL
IL-5 IFN,
Figure 19 :Rôle des cytokines dans le contrôle de l'expression des isotypesd'lg
(d'après lmmunobiologie:le système immunitairefondamental et pathologique,CA Janeway et al.)
5.2.3. Caractéristiques morphologiques des cellules lymphoïdesdu centre germinatif
Dans la zone sombre du centre germinatif, la cellule B « activée»se
transforme en celluleàfort index mitotique morphologiquement proche d'un
lymphoblaste plurinucléolé : le centroblaste. Il s'agit d'une cellule de grande taille
(en moyenne 15à25 µm de diamètre) ayant un rapport nucléocytoplasmique
élevée (N/C>0,8). Sa chromatine est fine avec 2à5 nucléoles souvent marginés.
Le cytoplasme est basophile.
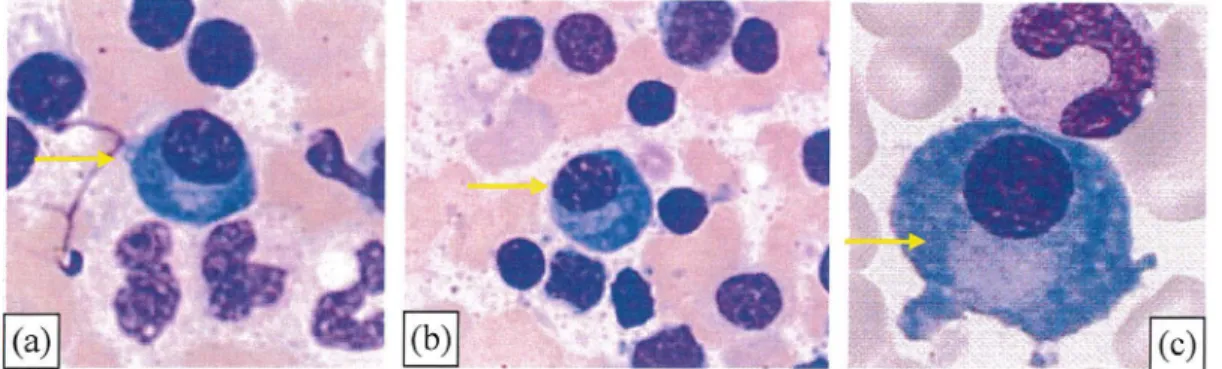
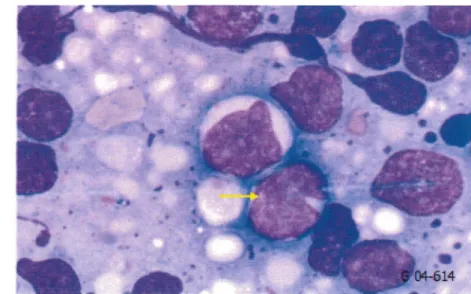
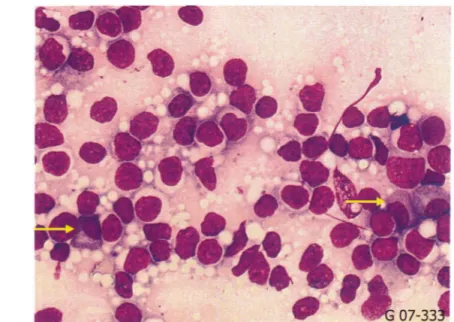
Figure 20 :Aspect cytologique de centroblastes
(a) et (b) :photos prises sur des lamesd'appositions ganglionnaires, secteur cytologie,laboratoire d'hématologie cellulaire et moléculaire,CHU de Grenoble (obj X1 OO)
(c): photo du site de la faculté d'Angers (cours cellules lymphoïdes)
L'accumulation de centroblastes au cytoplasme basophile permet de distinguer la