Devant le jury :
Président : M. DERBAL. F. Mc U. ANNABA
Examinateur : M. FREHI H. Mc U. ANNABA
Examinateur : M. DRARDJA B. Mc U. ANNABA
MINISTAIRE DE L’ENSEIGNEMENT SUPERIEUR
UNIVERSITE BADJI MOKHTAR –ANNABA
Faculté des Sciences
Département des Sciences de la Mer
MEMOIRE
Présenté en vue de l’obtention du diplôme de Magister
Option : Environnement littoral
THEME
Distribution du zooplancton du Bas estuaire du Mafrag
(Bras d’El-kébir) en 2007
Présenté par : Melle. DIAF Assia
Directeur de Mémoire : M. OUNISSI Makhlouf
Pr. U. ANNABA
Dédicace
Grâce à Dieu, le tout puissant, j’ai accompli ce travail dans
l’effort et l’abnégation : je dédie cette modeste contribution
scientifique :
Aux deux êtres les plus chères au monde, mon père mon idole
dans la vis, et ma mère la fontaine de l’amour et soleil de mes
jours.
Sans oublier, bien sûr, mes frères : Hichem et Fouad. Et mes
sœurs : Wafa et Khadîdja.
A toute ma grande famille.
A la mémoire de tous ceux qui nous sont chers et qui ne sont plus
de ce monde.
A toutes mes amies les plus intimes : Saida, Lamia, Radia,
Karima, Hala pour son aide, son assistance et son soutient
moral.
A tous mes camarades du laboratoire Environnement littoral.
Diaf Assia
Ce projet d’étude a été réalisé au Département des Sciences de la Mer, dans le contexte
de 2 projets nationaux (ONEDD/05/04-CREAD/123/Ministère de l’Aménagement du
Territoire et de l’Environnement), visant la compréhension du devenir et des incidences
des flux de matières continentales enrichissantes et polluantes dans le littoral d’Annaba.
Ce mémoire n’aurait jamais vu le jour sans la précieuse collaboration d’un grand
nombre de personnes que je tiens à remercier.
Je voudrais d’abord remercier vivement Monsieur Ounissi Makhlouf, Professeur, au
département des sciences de la mer et directeur de laboratoire d'Environnement littoral à
l'université d'Annaba pour avoir accepté de m’encadrer et de me diriger dans mon travail
et pour m’avoir aidé dans l’analyse de laboratoire et m’avoir orienté la présentation et la
mise en forme du mémoire ainsi que pour m’avoir fait profiter de son expérience dans le
domaine de l’environnement littoral et pour son soutien infaillible. Je lui exprime ma
profonde gratitude.
Je remercie Monsieur Haridi Ahcène,
Maître Assistant pour m’avoir aidé dans les
relevés de terrain et dans l’analyse de laboratoire. Il m’a encouragé pendant toute la
période du stage pour achever notre recherche dans les meilleures conditions. Je lui
exprime mes profondes gratitudes.
Madame Belbacha-Khélifi-Touhami Meriem m’a aidé de façon incontestable dans les
analyses des récoltes et m’a encouragé pour assurer un travail de qualité. Elle a mis à
ma disposition de nombreux articles récents le zooplancton littoral et estuarien.
Monsieur Derbal Farid, Maître de conférences au Département de science de la mer à
l’Université d’Annaba, qui m’a fait l’honneur d’accepter de juger ce travail et de présider
ce jury, qu’il trouve ici l’expression de ma profonde reconnaissance.
Monsieur Frihi Hocine, Maître de conférences au Département de science de la mer à
l’Université d’Annaba, qui m’a fait l’honneur d’examiner et de juger ce travail, qu’elle
trouve ici l’expression de ma profonde gratitude.
Je suis très heureuse que ce travail soit jugé par Draredja Brahim, Maître de
conférences au Département de science de la mer, m’a dispensé des enseignements de
qualité d’écologie marine, j’espère ne pas le décevoir si ‘son benthos’ n’ont pas été
considéré à tord dans ce travail, Ses remarques me seront de grandes utilités.
Certains parmi les étudiants doctorants et magistérants ainsi que les étudiants du
master ІІ, inféodés au laboratoire, qui mon aider et encouragé à plusieurs titres, je les
remerciais et leur souhaitais tout le succès dans leurs études actuelles et futures sur
l’estuaire.
Résumé
Résumé
L’estuaire du Mafrag est un écosystème littoral très particulier en Méditerranée à la fois par son régime hydrologique et par la diversité de composants hydrographiques. La structure, l’abondance et la biomasse du zooplancton du système estuarien du Mafrag ont été étudiées à partir de prélèvements mensuels en 2007 dans 9 stations par un tri horizontal des eaux de surface. L’hydro-système étudié est soumis au rythme d’une marée biquotidienne. Ces influences provoquent une grande variabilité de la salinité (0–35 psu) dans l’espace et dans la profondeur, qui permettent de constater que l’estuaire a connu trois phases très distinctes : phase rivière, phase estuaire a coin salé et phase lagune fermée. Le chimisme et la dynamique saisonnière des nutriments minéraux et organique sont suffisamment ordonnés par le cycle hydrologique ouverture-fermeture de l’estuaire. Dont les aspects minérales de l’azote et du phosphore riches en période d’ouverture surtout en surface, et que les aspects organiques NOD et POD qui semblent s’accumuler aussitôt de la période de fermeture, et qui représentent le double en stock de la forme minérale, et joue donc un rôle vitale dans l’édification et le cycle biogéochimique du système estuarien. Sur le plan spatial, la branche d’El-kébir est plus fertile chimiquement ou biologiquement que Bounamoussa. Dans ces conditions changeantes, l’analyse des récoltes a permis d’identifier 44 espèces de zooplancton, dont quelque unes provient de la mer surtout pendant la période d’ouverture à la mer. Les copépodes dominent à travers les espèces autochtones : Acantocyclopss americanus, Calanipeda aquae-dulcis, Hemidiaptomus amblyodon, Eudiaptomus coreulus. Le zooplancton montre une distribution saisonnière différentielle en relation avec les conditions hydrologiques et chimiques des aires prospectées. Le zooplancton total est composé principalement de 2 groupes : les Copépodes 50%, les Cladocères 23%. Les faibles valeurs de densité totale s’observent en période de fermeture de l’embouchure, surtout en été. Mais pendant la période d’ouverture, des exportations zooplanctoniques massives se poursuivent en début d’hiver et au printemps. La biomasse en poids sec et en Carbone, la production secondaire et le taux de rotation (productivité, P/B) ont été calculés à partir des échantillons de zooplancton de l’estuaire du Mafrag qui permis d'estimer la capacité de charge de poisson. Selon les estimations, la biomasse a été de 5 mg C m-3 suivie par la plus haute
production de Copépodes au cours de cette période, qui créé l'un des principales voie de flux d'énergie dans l’écosystème. La moyenne de production secondaire dans l’estuaire a été 170 mg C m-3 j-1. Cette production
peut augmenter le rendement en poisson de l’écosystème par 612 kg de l'effectif total des captures des poissons par jour. Cette zone forme une aire de concentration de plancton.
Abstract
The Mafrag estuary is an ecosystem very special coastline in the Mediterranean in both its hydrological regime and the diversity of components basins. The structure, abundance and biomass of zooplankton in the estuarine system Mafrag were studied from monthly fishing samples of the surface in 2007 in 9 stations. The hydro-system studied is subject to the rhythm of a twice daily tide. These influences cause a wide range of salinity (0-35 psu) in space and depth, which indicates that the estuary has experienced three distinct phases: phase river estuary phase a coin and salty lagoon phase closed. The chemises and seasonal dynamics of mineral and organic nutrients are sufficiently ordered by the hydrological cycle opening-closure of the estuary. Which aspects of mineral nitrogen and phosphorus-rich opening period mainly on the surface, and the organic aspects NOD and POD that seem to accumulate as the closure period, and who represent the double of the stock mineral form, and therefore plays a vital role in building and biogeochemical cycle of estuarine system. On the space, the branch of El-Kebir is more fertile chemically or biologically than Bounamoussa.
In these changing conditions, analysis of crops identified 44 species of zooplankton, some of which comes from the sea especially during the period of opening to the sea copepods dominate across species: Acantocyclopss americanus, Calanipeda aquae-dulcis, Hemidiaptomus amblyodon, and Eudiaptomus coreulus. Zooplankton showed a seasonal distribution differential in relation to hydrological and chemical conditions of the prospecting areas. The total zooplankton is mainly composed of 2 groups: 50% Copepods, the Cladocères 23%. The low values of total density observed during closure of the mouth, especially in summer. But during the opening period, exports continue zooplankton mass in early winter and spring. Biomass dry weight and carbon, secondary production and turnover (productivity, P/B) were calculated from samples of zooplankton in the estuary of the Mafrag which helped to estimate the carrying capacity of fish. The estimated biomass was 5 mg m-3 carbon followed by the highest production of Copepods during this
period, which created one of the main paths of energy flow in the ecosystem. The average secondary production in the estuary was 170 mg C m-3 day-1. This production may increase the fish yield of the
ecosystem by 612 kg of the total catch of fish per day. This area is an area of concentration of plankton.
Résumé
ﺺﺨﻠﻤﻟﺍ
ﺕﺎﺒﺼﻣ ﻉﻮﻨﺗ ﺚﻴﺣ ﻦﻣ ﻢﻬﻣﻭ ﺍﺪﺟ ﺹﺎﺧ ﻡﺎﻈﻧ ﻮﻫ ﻭ ،ﻂﺳﻮﺘﻤﻟﺍ ﺾﻴﺑﻷﺍ ﺮﺤﺒﻟﺍ ﻰﻠﻋ ﻞﻄﻤﻟﺍ ﺪﻴﺣﻮﻟﺍ ﻲﺌﻴﺑ ﻡﺎﻈﻧ ﻮﻫ ﻕﺮﻔﻣ ﺐﺼﻣ ﻡﺎﻋ ﻲﻓ ﺎﻳﺮﻬﺷ ﺔﻴﺋﺎﻤﻟﺍ ﺔﻴﻧﺍﻮﻴﺤﻟﺍ ﻖﻟﺍﻮﻌﻟﺍ ﻦﻣ ﺕﺎﻨﻴﻋ ﺔﺳﺍﺭﺩ ﺖﻤﺗ ﺪﻗﻭ ، ﺽﺍﻮﺣﻷﺍ ﺕﺎﻧﻮﻜﻣ ﻭ ﺭﺎﻬﻧﻷﺍ 2007 ﻲﻘﻓﻷﺍ ﺪﻴﺼﻟﺎﺑ ﻙﺎﻨﻫ ﺖﻧﺎﻛﻭ ، ﺐﺼﻤﻟﺍ ﺍﺬﻫ ﻲﻓ ﺔﻴﻧﺍﻮﻴﺤﻟﺍ ﻖﻟﺍﻮﻌﻟﺍ ﻩﺬﻬﻟ ﺔﻳﻮﻴﺤﻟﺍ ﺔﻠﺘﻜﻟﺍ ﺓﺮﻓﻭﻭ ﺔﺒﻴﻛﺮﺗ ﻭ ﺮﺻﺎﻨﻋ ﺺﺨﻳ ﺎﻤﻴﻓ ﺕﺎﻄﺤﻣ ﻲﻓﻭ ﺔﺣﻮﻠﻤﻟﺍ ﻰﻠﻋ ﻊﺳﺍﻭ ﻞﻜﺸﺑ ﺮﺛﺆﻳ ﺍﺬﻫﻭ ،ﺭﺰﺠﻟﺍ ﻭ ﺪﻤﻠﻟ ﺎﻴﻣﻮﻳ ﻦﻴﺗﺮﻣ ﻝﺪﻌﻤﺑ ﺽﺮﻌﺘﻳ ﺐﺼﻤﻟﺍ ﻥﺃ ﺖﺒﺜﺗ ﺔﻴﻨﻴﺟﻭﺭﺪﻴﻫ ﺔﺳﺍﺭﺩ ﻝﺪﻌﻤﺑ 0 ﻰﻟﺇ 35 psu ﺔﻠﺣﺮﻣ، ﺮﻬﻧ ﺔﻠﺣﺮﻣ :ﺔﻔﻠﺘﺨﻣ ﻞﺣﺍﺮﻣ ﺙﻼﺜﺑ ﺮﻣ ﺐﺼﻤﻟﺍ ﻥﺃ ﻪﻨﻣ ﺞﺘﻨﺘﺴﻳ ﺎﻤﻣ ﻖﻤﻌﻟﺍ ﻭ ءﺎﻀﻔﻟﺍ ﻲﻓ ، ﻭ ﺔﻴﻧﺪﻌﻤﻟﺍ ﺩﺍﻮﻤﻠﻟ ﻲﻤﺳﻮﻤﻟﺍ ﻭ ﻲﻠﺼﻔﻟﺍ ﻲﺋﺎﻴﻤﻴﻜﻟﺍ ﻊﻳﺯﻮﺘﻟﺍ ﺔﻴﻜﻴﻣﺎﻨﻳﺩ ﻥﺇ ،ﺔﻘﻠﻐﻣ ﺓﺮﻴﺤﺑ ﺔﻠﺣﺮﻣ ﺍﺮﻴﺧﺃ ﻭ ﺔﺤﻟﺎﻣ ﺔﻳﻭﺍﺯ ﻪﻟ ﺐﺼﻣ ﻭ ﺕﻭﺯﻵﺍ ﻦﻣ ﺔﻴﻧﺪﻌﻤﻟﺍ ﺩﺍﻮﻤﻟﺍ ﻥﺃ ﺖﺒﺛ ﺚﻴﺣ ﻕﻼﻏﺇ– ﺢﺘﻓ ﻦﻣ ﺐﺼﻤﻟﺍ ﺔﻴﻨﻴﺟﻭﺭﺪﻴﻫ ﺐﺴﺣ ﺎﻴﻓﺎﻛ ﻝﺍﺰﻳ ﻻ ﻭ ﻥﺎﻛ ﺔﻴﺋﺍﺬﻐﻟﺍ ﺔﻳﻮﻀﻌﻟﺍ ﺔﻳﻮﻀﻌﻟﺍ ﺩﺍﻮﻤﻠﻟ ﺔﺒﺴﻨﻟﺎﺑ ﻚﻟﺬﻛ،ﺔﻴﺋﺎﻤﻟﺍ ﺔﻴﺤﻄﺴﻟﺍ ﺔﻘﺒﻄﻟﺍ ﻰﻠﻋ ﺔﺻﺎﺧ ﺐﺼﻤﻟﺍ ﺢﺘﻓ ﺓﺮﺘﻓ ﻲﻓ ﺔﻴﻨﻏ ﺭﻮﻔﺴﻔﻟﺍ NOD ,POD ﻭ ﻱﻮﻴﺣ ﺭﻭﺪﺑ ﻡﻮﻘﺗ ﻲﻟﺎﺘﻟﺎﺑ ﻭ ﻥﺩﺎﻌﻤﻟﺍ ﻥﻭﺰﺨﻣ ﻒﻌﺿ ﻞﺜﻤﺗ ﻲﺘﻟﺍ ﺓﺮﻴﺧﻷﺍ ﻩﺬﻫ ﺐﺼﻤﻟﺍ ﻕﻼﻏﺇ ﺓﺮﺘﻓ ﻲﻓ ﻢﻛﺍﺮﺘﺗ ﺎﻬﻧﺃ ﺍﻭﺪﺒﻳ ﻲﺘﻟﺍ ﻭ ﻲﺋﺎﻴﻤﻴﻜﻟﺍ ﺐﻧﺎﺠﻟﺍ ﺚﻴﺣ ﻦﻣ ﺔﺑﻮﺼﺧ ﺮﺜﻛﺃ ﺮﻴﺒﻜﻟﺍ ﺩﺍﻭ ﺮﺒﺘﻌﻳ ﻲﻧﺎﻜﻤﻟﺍ ﻊﻳﺯﻮﺘﻟﺍ ﺐﺴﺣ ﺐﺼﻤﻠﻟ ﺔﻴﺋﺎﻴﻤﻴﻛ ﻮﻴﺟﻮﻴﺒﻟﺍ ﺓﺭﻭﺪﻟﺍ ءﺎﻨﺑ ﻲﻓ ﺪﻳﺪﺤﺗ ﺖﻤﺗ ،ﺓﺮﻴﻐﺘﻤﻟﺍ ﻑﻭﺮﻈﻟﺍ ﻩﺬﻫ ﻲﻓ ﻭ ،ﺔﺳﻮﻣﺎﻧﻮﺑ ﺮﻬﻧ ﻊﻣ ﺔﻧﺭﺎﻘﻣ ﻲﺟﻮﻟﻮﻴﺒﻟﺍ 44 ﺎﻬﻨﻣ ﺾﻌﺒﻟﺍ ، ﺔﻴﻧﺍﻮﻴﺤﻟﺍ ﻖﻟﺍﻮﻌﻟﺍ ﻦﻣ ﻉﻮﻧ ﻥﺃ ﺎﻤﻛ ،ﺮﺤﺒﻟﺍ ﻰﻠﻋ ﺡﺎﺘﻔﻧﻻﺍ ﺓﺮﺘﻓ ﻝﻼﺧ ﺔﺻﺎﺧ ﺮﺤﺒﻟﺍ ﻦﻣ ﻲﺗﺄﻳ ﻞﺟﺭﻷﺍ ﺕﺎﻴﻓﺍﺬﺠﻣ ﺕﺎﻳﺮﺸﻗ ﺎﻫﺪﺟﺍﻮﺗ ﺔﺒﺴﻧ ﺚﻴﺣ ﻦﻣ ﻦﻤﻴﻬﺗ : ﺔﻴﻠﺻﻷﺍ ﺕﺎﻨﺋﺎﻜﻟﺍ ﺮﺒﻋ ﺐﺼﻤﻟﺍ ﻲﻓ Acantocyclopss americanus,Calanipeda aquae-dulcis, Hemidiaptomus
amblyodon, Eudiaptomus coreulus, ﺔﺒﺴﻨﻟﺎﺑ ﺎﻴﻠﺿﺎﻔﺗ ﺎﻴﻤﺳﻮﻣ ﺎﻌﻳﺯﻮﺗ ﻊﺳﻮﺘﺗ ﺎﻬﻧﺄﺑ ﺔﻴﻧﺍﻮﻴﺤﻟﺍ ﻖﻟﺍﻮﻌﻟﺍ ﺕﺮﻬﻅﺃ ﺪﻗﻭ. : ﻦﻴﺘﻋﻮﻤﺠﻣ ﻦﻣ ﺎﺳﺎﺳﺃ ﻒﻟﺄﺘﺗ ﺔﻴﻧﺍﻮﻴﺤﻟﺍ ﻖﻟﺍﻮﻌﻟﺍ ﻉﻮﻤﺠﻣ، ﺔﺳﻭﺭﺪﻤﻟﺍ ﻖﻁﺎﻨﻤﻠﻟ ﺔﻴﺋﺎﻤﻴﻜﻟﺍ ﻭ ﺔﻴﺟﻮﻟﻭﺭﺪﻴﻬﻟﺍ ﻑﻭﺮﻈﻠﻟ 50 % ﻞﺟﺭﻷﺍ ﺕﺎﻴﻓﺍﺬﺠﻣ ﺕﺎﻳﺮﺸﻗ ﻭ 23 % Cladocéres ﻕﻼﻐﻧﺍ ﺓﺮﺘﻓ ﻝﻼﺧ ﺔﻳﺮﺤﺒﻟﺍ ﻖﻟﺍﻮﻌﻟﺍ ﺔﻓﺎﺜﻛ ﺔﻤﻴﻗ ﻲﻓ ﺮﻴﺒﻛ ﺽﺎﻔﺨﻧﺍ ﻙﺎﻨﻫ، ﻞﺋﺍﻭﺃ ﻲﻓ ﺔﻴﻧﺍﻮﻴﺤﻟﺍ ﻖﻟﺍﻮﻌﻟﺍ ﻦﻣ ﺔﻠﺋﺎﻫ ﺕﺍﺭﺩﺎﺻ ﻙﺎﻨﻫ ﻆﺣﻼﻧ ﻪﺣﺎﺘﻔﻧﺍ ﺓﺮﺘﻓ ﻝﻼﺧ ﻦﻜﻟﻭ ،ﻒﻴﺼﻟﺍ ﻞﺼﻓ ﻲﻓ ﺎﺻﻮﺼﺧ ﺐﺼﻤﻟﺍ ﺔﻴﺟﺎﺘﻧﻹﺍ ﻭ ﺝﺎﺘﻧﻹﺍ ﻢﺠﺣ ﻭ ﻱﻮﻧﺎﺜﻟﺍ ﻥﻮﺑﺮﻜﻠﻟ ﺔﻳﻮﻴﺤﻟﺍ ﺔﻠﺘﻜﻟﺍ ﻭ ﻑﺎﺠﻟﺍ ﻥﺯﻮﻟﺍ ﺏﺎﺴﺣ ﺖﻤﺗ ،ﻊﻴﺑﺮﻟﺍ ﻭ ءﺎﺘﺸﻟﺍ P/B ﺕﺎﻨﻴﻌﻠﻟ ﺔﻳﻮﻴﺤﻟﺍ ﺔﻠﺘﻜﻟﺍ ﺖﻧﺎﻛﻭ ، ﻙﺎﻤﺳﻷﺍ ﻦﻣ ﺔﻴﺑﺎﻌﻴﺘﺳﻻﺍ ﺔﻗﺎﻄﻟﺍ ﺮﻳﺪﻘﺗ ﻲﻓ ﺕﺪﻋﺎﺳ ﻲﺘﻟﺍ ﺐﺼﻤﻠﻟ ﺔﻴﻧﺍﻮﻴﺤﻟﺍ ﻖﻟﺍﻮﻌﻟﺍ ﻦﻣ ﺔﺳﻭﺭﺪﻤﻟﺍ ﺏ ﺓﺭﺪﻘﻣ 5
ﻡ
ﻝ ﺝﺎﺘﻧﺇ ﻰﻠﻋﺃ ﻦﻣ ﺖﺠﺘﻨﺘﺳﺍ ﻲﺘﻟﺍ ﻭ ﺐﻌﻜﻣ ﺮﺘﻤﻟﺍ ﻲﻓ ﻥﻮﺑﺮﻛ ﻎﻟ : ﻞﺟﺭﻷﺍ ﺕﺎﻴﻓﺍﺬﺠﻣ ﺕﺎﻳﺮﺸﻗ ﺓﺪﺣﺍﻭ ﺮﺒﺘﻌﺗ ﻲﺘﻟﺍ ﻮﻫ ﺐﺼﻤﻠﻟ ﻱﻮﻧﺎﺜﻟﺍ ﺝﺎﺘﻧﻹﺍ ﻂﺳﻮﺘﻣ ، ﻲﺌﻴﺒﻟﺍ ﻡﺎﻈﻨﻟﺍ ﻲﻓ ﺔﻗﺎﻄﻟﺍ ﻖﻓﺪﺗ ﺭﺎﺴﻣ ﻢﻫﺃ ﻦﻣ 170ﻡ
ﻲﻓ ﺐﻌﻜﻤﻟﺍ ﺮﺘﻤﻟﺍ ﻲﻓ ﻥﻮﺑﺮﻛ ﻎﻟ :ـﺑ ﺐﺼﻤﻠﻟ ﻙﺎﻤﺳﻷﺍ ﺝﺎﺘﻧﺇ ﻦﻣ ﺪﻳﺰﻳ ﺪﻗ ﻡﻮﻴﻟﺍ 612 ﺎﻴﻣﻮﻳ ﻙﺎﻤﺳﻷﺍ ﻦﻣ ﺪﻴﺼﻟﺍ ﻉﻮﻤﺠﻣ ﻦﻣ ﻎﻠﻛ . ﺰﻴﻛﺮﺗ ﻝﺎﺠﻣ ﺮﺒﺘﻌﻳ ﺐﺼﻤﻟﺍ ﺍﺬﻫ .ﻖﻟﺍﻮﻌﻠﻟ ، ﺔﻴﻧﺍﻮﻴﺤﻟﺍ ﻖﻟﺍﻮﻌﻟﺍ ، ﺔﺣﻮﻠﻤﻟﺍ : ﺔﻴﺴﻴﺋﺮﻟﺍ ﺕﺎﻤﻠﻜﻟﺍ ﻞﺟﺭﻷﺍ ﺕﺎﻴﻓﺍﺬﺠﻣ ﺕﺎﻳﺮﺸﻗ ﺐﺼﻣ ، ﺔﻳﻮﻴﺤﻟﺍ ﺔﻠﺘﻜﻟﺍ ، .ﻕﺮﻔﻣTableau 1. Caractéristiques des stations étudiées. Les stations d’El-Kébir sont dénommées de K1 à K5 et les
stations de Bounamoussa sont dénommées de B1 à B3 (en 2007)………06
Tableau 2. Résumé des méthodes utilisées dans l’analyse des éléments chimiques………..07 Tableau 3. Taxons zooplanctoniques ayant fait l’objet d’estimation de biomasse exprimée en poids sec. On
note que 7182 individus ont été isolés et traités pour les pesées………09
Tableau 4. Variations annuelles de la température (°C) des eaux superficielles et des eaux du fond
enregistrées en 2007 dans l’estuaire du Mafrag (d’après Kebabsa, 2009)……….…10
Tableau 5. Variations annuelles de la salinité (psu) des eaux superficielles et des eaux du fond enregistrées
en 2007 dans l’estuaire du Mafrag (d’après Kebabsa, 2009)……….…11
Tableau 6. Valeurs moyennes annuels, intervalle de variation des différentes formes de l’azote inorganique
dissous (µM), les teneurs en phosphates (µM) et matières organiques (azote organique dissous : NOD, Carbone Organique Particulaire : COP, exprimées en mg. l-1, Chlorophylle a phytoplanctonique: mg. m-3)
dans l’estuaire du Mafrag en enregistrées en 2007 (d’après Kebabsa, 2009)………12
Tableau 7. Liste systématique des taxons récoltés au cours de la période (29 janvier et 27 décembre 2007)
dans le système estuarien du Mafrag. ………..16
Tableau 8. Pourcentage moyen (%) et densité moyenne des principaux taxons zooplanctoniques rencontrés
dans l’estuaire du Mafrag entre 29 janvier- 27 décembre 2007………17
Tableau 9. Densités moyenne (ind .m-3) calculées entre 29 janvier et 27 décembre 2007 dans deux
situations : en période d’échange avec les eaux marines (janvier à juin et décembre) et pendant la période de la fermeture (juillet à novembre). ……….18
Tableau 10. Abondance et fréquence relative (%) annuelles des taxons zooplanctoniques récoltés en 2007
dans la station embouchure et les stations de K1 à B3 du système estuarien du Mafrag………..……….…..19
Tableau 11. Abondance et fréquence relative (%) annuelles des Copépodes récoltés en 2007 dans la
station Embouchure et les stations de K1 à B3 du système estuarien du Mafrag………..24
Tableau 12.Abondance et fréquence relative (%) des espèces du Cladocère récolté en 2007 dans la station embouchure et les stations de K1 à B3 de l’estuaire du Mafrag. Les mois et les espèces dont les résultats d’analyses sont négligeables, ne sont pas représentés sur les tableaux………..27
Tableau 13. Abondance et fréquence relative (%) des espèces du Rotifères récoltés en 2007 dans la station
embouchure et les stations de K1 à B3 de l’estuaire du Mafrag. Les mois dont les résultats d’analyses sont négligeables, ne sont pas représentés sur le tableau……….29
Tableau 14. Pourcentage moyen (%) et densité moyenne des principaux taxons zooplantoniques
rencontrés dans l’estuaire du Mafrag entre 15 janvier- 24 décembre 2006 (Tazir K, 2009)……….32
Tableau 15. Poids secs moyens individuels (µg) des taxons et des espèces, d’après les données de la
littérature………34
Tableau 16. Estimation de la biomasse individuel en poids sec (µg) et en poids sec en Carbone (µg) et le
rapport en Carbone sur le poids sec des différents groupes zooplanctoniques et espèces de Copépodes récoltés dans le system estuarien du Mafrag en 2007………35
Tableau 17. Densités moyenne (ind .m-3), Biomasse moyenne en poids sec (mg PS m-3) et Biomasse
Tableau 18. Evaluation de la Respiration zooplanctonique exprimée en mg C/m3/j dans les stations du
système estuarien du Mafrag étudié en 2007……….39
Tableau 19. Evaluation de la production zooplanctonique exprimée en mg C/m3/j dans les stations du
système estuarien du Mafrag étudié en 2007……….40
Tableau 20. Production (mg C/ m3/j), Biomasse (mg C/ m3) et la productivité (P/B) dans les stations du
système estuarien du Mafrag étudié en 2007……….40
Tableau 21. Production (mg C/m3/j), Respiration (mg C/m3/j), Assimilation (mg C/m3/j), Consommation
(mg C/m3/j), et la partie non assimilée (U=excrétion et F= fécès) (mg C/m3/j), de zooplancton dans les
stations du système estuarien du Mafrag étudié en 2007………41
Tableau 22. Production (mg C/m3/j), Respiration (mg C/m3/j), Assimilation (mg C/m3/j), Consommation
(mg C/m3/j), et la partie non assimilée (U=excrétion et F= fécès) (mg C/ m3/j), de zooplancton pendant la
Figure 1. Contexte géographique de l’estuaire du Mafrag et de son bassin versant. : limite du coin salé,
: barrage………..….04
Figure 2. A gauche vue de l’embouchure de l’estuaire du Mafrag ouverte en période humide, à droite vue
de l’embouchure en saison de crue………..05
Figure 3. A gauche et droite vue du colmatage de l’embouchure de la Mafrag (période de sécheresse) en
2007, et la formation de bancs de sable………05
Figure 4. Positionnement des stations étudiées de l’estuaire du Mafrag en 2007. E : station embouchure
(mouth), K1-K5 : stations 1 à 5 de la branche El-Kébir, B1-B3 : stations 1-3 de la branche Bounamoussa (en 2007)……….………06
Figure 5. Filet WP2. : Filet cylindro-conique de 30cm de diamètre, une ouverture de 0,15m² et 170µm de
vide de maille………..……….08
Figure 6. Variations de l’abondance de zooplancton total (ind m-3, échelle logarithmique) récolté en 2007
dans l’Embouchure et les stations du système estuarien du Mafrag……….………18
Figure 7. Variations de la biomasse du zooplancton total exprimée en µg Ps m-3 et µg C m-3 récolté en
Sommaire
Introduction
………...……...………...………...
Chapitre
I
. Matériel et méthodes
Caractères géographiques et écologiques de l’estuaire du Mafrag
1. Présentation du milieu ………..……..……..……….………...
2. Prélèvements et méthodes d’analyses chimiques …...………....….
3. Echantillonnage du zooplancton ………..……….………...….
Chapitre
II
. Hydrobiologie
1. Température………...………
2. Salinité………...………...….
3. Les sels nutritifs.………..………..
4. Les matières organiques………...…..…….………
Chapitre
III
. Composition et abondance du zooplancton de surface
Introduction………..………..………..
1. Composition globale du zooplancton.………..……….……
2.
Le zooplancton total…………..……….………
3.
Composition.………..………...……….………...………
4.
Principaux groupes zooplanctoniques …...……..…………...…....……….
4.1. Les Copépodes
………..……….……….…
4.2. Les Cladocères
………..………....….
4.3. Les larves de cirripèdes
………..………….………....…
4.4. Les Rotifères
……….……….….…
4.5. Les groupes divers
………...………..….
3. Discussion.……….……….……….
Chapitre
IV
. Biomasse
Introduction………...………...…...…
1. Variation de la biomasse en poids sec et en Carbone du zooplancton.………...…….……
2. Estimation des variations énergique de l’écosystème………..………….………….…...
2.1. Variables énergétiques.
……….………...…………..……...
2.2. La respiration.…...……….……….…………..…....…...
2.3. La production secondaire ………………….…………..…...…...
2.4. Flux d’énergie……….…3. Discussion……….………...………...………..…
Conclusion générale………..………..……...
Références bibliographiques……….………...……...………...…
Résumé en français……….………...………
Résumé en anglais.……….….……….…...………..…....…
Résumé en arabe……….………..……...……….……
01
01
04
06
07
10
10
11
14
15
15
16
19
21
21
26
28
29
31
32
34
34
38
38
39
39
40
41
43
47
53
54
55
Introduction
L’anthropisation des zones humides n’a cessé de croître depuis que l’homme a su domestiquer l’élément liquide. Ceci est d’autant plus vrai dans le cas des estuaires et des zones côtières qui subissent directement les pressions anthropiques liées à leur exploitation. Les estuaires sont des étendues d’eaux côtières semi-fermées, qui ont une connexion libre avec l’océan et dans lesquelles l’eau de mer est progressivement diluée par de l’eau douce provenant du drainage continental (Pritchard 1967). Cette définition, qui est la plus utilisée pour définir le milieu estuarien, fait apparaître le concept de gradients environnementaux caractéristiques essentiels de l’écosystème estuarien. En effet, ces écosystèmes sont de fascinants milieux permettant aux biologistes d’étudier les adaptations physiologiques de la faune et de la flore face à des gradients environnementaux tels que la salinité. La plupart des modifications environnementales et biologiques qui se produisent dans ces milieux sont liées dans une large mesure à l’importance et la variabilité des échanges hydrologiques et biologiques avec la mer (Castel et Courties, 1979). Peu d’espèces sont capables d’adapter leur physiologie à de tels gradients environnementaux, ce qui entraîne au niveau des estuaires une réduction de la biodiversité par rapport aux écosystèmes marins et dulçaquicoles voisins (McLusky 1989).
Les estuaires sont également considérés en tant que nurseries pour les poissons juvéniles issus de pontes marines. De plus, les productions autochtones de ces milieux peuvent contribuer aux apports trophiques et même au recrutement vis-à-vis du littoral marin. Elles reçoivent, le seston marin transporté passivement par les courants et les poissons immigrants qui y pénètrent attirés par la nourriture abondante dans ces milieux. Ainsi Amanieu et Lasserre (1981) en étudiant 35 sites littoraux méditerranéens, ont montré que l’importance des captures des poissons démersaux est liée directement à la proximité de ces sites lagunaires et même estuariens productives.
Les estuaires maintiennent d’importantes activités économiques : irrigation, pêche, aquaculture, extraction de sédiments, navigation, transport, tourisme et sont ainsi soumis aux modifications environnementales défavorables comme les activités anthropiques et des agressions terrestres (Elliot and McLusky, 2002). Ces écosystèmes offrent des potentialités unique au profit de l’homme : ils entretiennent la santé des écosystèmes par le piégeage des contaminants dans leurs sédiments alors qu’ils accueillent les poissons marins et les oiseaux migrateurs et leurs offrent les meilleurs conditions de fraye et de nourriture et diversité d’habitats. Les estuaires du fait de leur position géographique à l’interface mer-continent, forment des écosystèmes aquatiques particuliers, caractérisés par d’intenses processus d’échanges et de transformations chimiques, physiques et biologiques et constituent ainsi de véritables zones filtres (Lisitzin, 1999; Conley et al., 2000).Ces zones agissent comme filtres en piégeant les nutriments et les contaminants et par les transformations biologiques de la matière introduite à la côte. Dans cet ordre d’idée, Lisitzin (1999) suggère que les estuaires fonctionnent comme de véritables zones tampon entre la rivière et la mer.
Les estuaires sont directement soumis aux influences de l’activité humaine. Dans les pays tempérés industrialisés, les estuaires et les eaux de surface plus généralement connaissent de véritables problèmes de pollutions chimiques issues d’activités agricoles et industrielles (Seirra et al., 2002; Conley et al., 2000). Dans la région méditerranéenne en particulier pour les pays du Sud (Afrique du Nord, Afrique du Sud,
Introduction
graves perturbations de leurs cycles hydrologiques, à la suite de rétention des eaux en amont dans les barrages (AEE, 1999 ; Harris, 2001 ; Benblidia et al., 1997 ; Milliman, 1997).
Un estuaire est la partie d’une rivière affectée et contrôlée par la marée où l’eau continentale rencontre l’eau marine (Pritchard, 1967; fairbridge, 1980; Romao, 1996; Ibáňez et al, 2000; Elliot et McLusky, 2002). Si dans les estuaires macrotidaux l’eau marine pénètre jusqu’à plusieurs dizaines de kilomètres dans le continent (Dyer, 1997; Uncles, 2002), en régime microtidal comme en Méditerranée, l’intrusion marine y est très limitée (plusieurs centaines de mètres à 2-3 dizaines de kilomètres), en raison de la faiblesse des apports d’eaux douce et de la marée (Pauc, 2003 ; McLusky et McIntyre, 1995). Cette limite d’intrusion marine appelée aussi coin salé, avance ou recule dans l’estuaire selon l’importance des apports en eau douce fluviale. Lors des crues d’hiver et de printemps, le coin salé est reculé jusqu’à la mer. En période d’étiage le coin salé avance dans le continent et gagne une bonne partie de la rivière. Il s’agit en Méditerranée d’estuaires atypiques à coin salé très stratifiés (Ibanez & Prat, 2003) avec l’eau douce en surface et l’eau marine au fond.
Les estuaires d’Algérie sont très peu connus, seulement deux ont été très récemment explorés : Pauc (1989; 2003) pour l’estuaire du Mazafran et Khélifi-Touhami et al., (2006) pour l’estuaire du Mafrag.
Le système estuarien du Mafrag du nord-est de l’Algérie est formé par les oueds Bounamoussa et El-Kébir et par les marécages des pleines littoraux. Il s’agit d’un système de zones humides singulier en Méditerranée (Khélifi-Touhami et al., 2006) par son régime hydrologique et par la diversité de ses composants hydrographiques (oueds, marécage, marais, plaine inondable, dunes littorales).
A partir d’une station embouchure, l’étude du Mafrag s’est focalisée sur les échanges en sels nutritifs entre l’estuaire et le littoral contigu.
En pratique, le colmatage de l’embouchure, l’intrusion de l’eau marine dans les rivières, l’usage non coodonné des eaux dans l’irrigation, la rétension par les barrages, l’inondation des plaines littorales, la pêche opportuniste, la silinisation des sols et des eaux souterraines, constituent de problèmes aigus pour l’environnement se répercutant gravement sur la socio-économie de la région, pourtant la plus riche en eau d’Algérie.
D’autre part, les récentes études du plancton des estuaires, lagunes et milieux cotiers ouverts à l’océan, sont intéressées aux transports, dispersions, échanges et aux aires de concentrations des larves méroplanctoniques selon l’advertion tidale et la circulation des masses d’eaux ( Lagadeuc et Brylinski, 1987 ; Mathiavat-Lllier et Cazaux, 1990 ; Lagadeuc, 1992 ; Dewarumez et al., 1993 ; Maracano et Cazaux, 1993 ; Maracano et Cazaux, 1994 ; Thiebut et al., 1994). Le plancton constitue un indicateur direct intégrateur des perturbations aux paramétres hydrologiques, peut refléter l’état global du milieu.
Le zooplancton comme maillon essentiel de la chaine trophique attire beaucoup de alevins marins (Boutiére, 1979-1980) en milieu éstuairien. En hivers le milieu deviennent défvorables, et les poissons regagnent la mer et contribuent à l’enrichissement des pécheries démersales littorales (Amanieu et Lasserre, 1981). Dans l’éstuaire de la Mafrag, il est extrémement important de connaitre la composition, les variations et la taille des organismes zooplanctoniques,considérés comme proies essentielles pour les jeunes poissons exploités. De plus, la connaissance des modalités de succession des défférents taxons zooplanctoniques peut étre utilisée pour synchroniser, par exemple, la période d’abondance d’une proie considérée à la date d’empoissonnement ou d’alevinage, compte tenu des conditions thermiques.
La présente étude sur la gestion intégré des zones continentales suppose d’abord une meilleure connaissance des composants du systéme éstuairien en particulier la structuration du réseau trophique de part la qualité chimique des eaux. Le zooplancton devrait constituer un élément crucial dans l’aide à la décision pour une gestion intégrée des zones cotiéres. Ces interventions supposent aussi que l’on devra raisonner dans une perspective de gestion durable des ressources renouvelables.
Cette étude s’inscrit dans une problématique visant l’évaluation écologique du l’estuaire de la Mafrag a travers plusieurs descripteurs, l’objectif biologique est de préciser les caractéristiques hydrologiques et ses incidences sur le suivi des échanges zooplanctoniques entre l’estuaire et le littoral voisin sur un cycle annuel. Du bassin versant au littoral peut être transposées à d'autres bassins versants comparables en Algérie et en Méditerranée sud-occidentale. L'évaluation de la qualité des environnements littoraux (estuaire et littoral adjacent) est également un objectif scientifique majeur.
L’autre but fondamental se rapporte à la description des peuplements zooplanctoniques encore mal connus. De l'autre côté, en plus d’essayer de calculer la production secondaire, Ainsi, l'objectif de cette étude est une tentative d'estimer la production de zooplancton et d'évaluation de la capacité de charge des poissons. Il aidera dans le calcul de la pouvoir d’estuaire et de son efficacité pour la pêche.
Ce travail est consigné dans quatre chapitres, le premier chapitre présente brièvement le milieu étudié et la méthodologie utilisée (stratégie de prélèvement, traitement et analyse des échantillons). Le deuxième chapitre s’attache à l’étude de la caractéristique hydrologiques et physico-chimiques de la Mafrag, le troisième chapitre présente la composition, structure et abondance des peuplements zooplanctoniques, enfin la biomasse et la production secondaire est traité dans le dernier chapitre.
Le manuscrit s’achève par une discussion et une conclusion reprenant les points fondamentaux essentiels.
Chapitre I 0 10 20 N Tunisie Annaba Méditerranée Basin versant du Estuaire Mafrag El-kébir Bounamoussa
Golfe d’Annaba Bar. Cheffia Bar. Mexa Algéri e Mediterranée Kilomètres 36°30 8°30 8° 36°45
Chapitre I. Matériel et méthodes
Caractères géographiques et écologiques de l’estuaire du Mafrag
1. Présentation du milieu
Le complexe estuarien du Mafrag est un écosystème micro tidal semi-diurne, est alimenté par Oued El Kébir, Oued Bounamoussa et par Leurs marécages. Le bassin versant avec 3 200 Km2 s’étend jusqu’au frontières
Tunisiennes, incluant deux barrages (Cheffia et Mexa) construits respectivement sur Bounamoussa et El-Kébir (Figure 1). Un autre barrage est actuellement en construction dans le sous-bassin d’El-El-Kébir. Cet ensemble de systèmes de régulation devrait aboutir à de graves perturbations du cycle hydrologique de l’estuaire.
L’estuaire se déverse sur une rive littorale très exposée aux vents du Nord et du Nord-ouest. Son parcours traverse, à l’approche du littoral, une masse de dune littorale très mouvante sur sa rive Est. Il s’ensuit un colmatage accentué lors des périodes d’étiages (3-4mois).
Figure 1. Contexte géographique de l’estuaire du Mafrag et de son bassin versant. : limite du coin salé, : barrage.
La profondeur moyenne dans la branche d’El-Kébir est de 3m et atteint 2,3m dans la branche de Bounamoussa, les 2 branches ont des surfaces et des volumes comparables formant ensemble environ 4 Millions m3 et 120 ha de surface en eau. La précipitation moyenne annuelle est de l’ordre de 800 mm et l’évaporation atteint 1250 mm. Le débit à l’embouchure du Mafrag est fortement variable avec des valeurs extrêmes de 0 m3 s-1 en période sèche jusqu’à 500 m3 s-1 lors des périodes de crues (Khélifi-Touhami et al.
2006). En saison sèche, le coin salé, atteint 25 km dans la branche El-Kébir et environ 15 km dans Bounamoussa (Khélifi-Touhami et al. 2006 ; Ziouch, 2007 ; Haridi, 2008, Fig. 1). Suivant la période pluvieuse, et le fort écoulement, le volume de l’estuaire peut être entièrement déchargé à la mer en quelques jours seulement. Le temps de résidence peut varier ainsi entre quelques jours et quelques mois.
La zone environnante est occupée par d’importants marécages (600 km² environ) inadéquats pour l’agriculture en raison de la salinisation des terres. Le bassin peu peuplé (100 000 habitants) est exploité pour l’agriculture et l’irrigation, est assurée en grande partie par les rivières tributaires de l’estuaire. L’agriculture y est essentiellement intensive et l’industrie se limite à de petites usines agro-alimentaires. En période de crue, l’eau excédentaire envahit complètement la pleine littorale et occasionne, de sérieuses atteintes des infrastructures et de l’environnement (figure 2). En l’absence de décharge d’eau fluviale en été, l’embouchure se colmate par la formation de bancs de sable, la fermeture de l’embouchure peu durer entre quelques jours à plusieurs mois selon la pluviométrie. En 2002 par exemple, l’estuaire est resté colmaté toute l’année et n’a pas aboutit a la mer par suite de son faible débit et de l’ensablement rapide entretenu par la pro gradation. En 2007, l’embouchure s’est fermé plusieurs mois en conditions de période de sécheresse prolongée (juillet-novembre) et lorsque le niveau d’eau de l’estuaire diminue par suite d’absence d’apports continentaux. A cela s’ajoute le transport et l’accumulation de sable sur la côte, due à l’action des vents, importants par ailleurs en cette époque de l’année (figure 3).
Figure 2. A gauche vue de l’embouchure de l’estuaire du Mafrag ouverte en période humide, à droite vue de l’embouchure en saison de crue.
Figure 3. A gauche et droite vue du colmatage de l’embouchure de la Mafrag (période de sécheresse) en 2007, et la formation de bancs de sable.
Chapitre I
2. Prélèvements et méthodes d’analyses chimiques
Afin de déterminer la variabilité spatiale des conditions hydrologiques et biologiques, les stations équidistantes de 2 kilomètre ont été situées tout au long de l’estuaire, depuis l’embouchure jusqu’à 10,5 km dans la branche El-Kébir et 6,4 km dans la branche Bounamoussa (Tableau 1 et Fig. 3). Au total de neufs stations ont été retenues dont cinq stations dans le bras d’El-Kébir (dénommées K1, K2, K3, K4 et K5), trois stations dans le bras de Bounamoussa (dénommées B1, B2, B3) et une station dans la partie exutoire (station dite embouchure) où se rencontrent les deux rivières.
Les caractéristiques des stations choisies sont résumées dans le tableau 1.
Ces 9 stations ont été suivies mensuellement lors de 12 sorties au cours de l’année 2007.
Figure 4. Positionnement des stations étudiées de l’estuaire du Mafrag en 2007. E : station embouchure (mouth), K1-K5 : stations 1 à 5 de la branche El-Kébir, B1-B3 : stations 1-3 de la branche Bounamoussa (en 2007).
Tableau 1. Caractéristiques des stations étudiées. Les stations d’El-Kébir sont dénommées de K1 à K5 et les stations de Bounamoussa sont dénommées de B1 à B3 (en 2007).
Stations Positionnement (latitude,
longitude) Profondeur (m) Distance à l’embouchure (km)
Embouchure (E) N 36°50.739' E 07°56.913' 3 0,2 Confluence (C) N 36°50.308' E 07°57.428' 5,2 1,1 K1 N 36°49.931' E 07°58.001' 4,1 2,3 K2 N 36°49.551' E 07°59.027' 3,6 4,2 K3 N 36°49.476' E 08°00.024' 2,8 6 K4 N 36°49.463' E 08°01.249' 2,1 8 k5 N 36°48.696' E 08°01.988' 2,3 10,5 B1 N 36°49.561' E 07°57.639' 2 2,6 B2 N 36°48.640' E 07°58.244' 2,1 4,6 B3 N 36°47.778' E 07°58.073' 2,9 6,4
Les paramètres de qualité générale des eaux ont été étudiés au cours des 12 sorties mensuels dans les 9 stations estuariennes, une station Embouchure et 5 stations du bras El-kébir, et 3 stations du bras Bounamoussa du Mafrag. Il s’agit de la salinité, la température, les sels nutritifs (nitrate NO3-, nitrite NO2-,
ammonium NH4+, orthophosphate PO43-), l’azote organique dissous (NOD), le carbone organique particulaire
E K2 B1 B2 B3 K1 K3 K4 K5
2 Km 10 Km N El-Kébir Bounamoussa
(COP) et la biomasse chlorophyllienne phytoplanctonique Chla. Ces paramètres sont dosés sur des échantillons d’eaux de surface et de fond conformément aux protocoles d’analyses (Parsons et al., 1989 ; Aminot et Chaussepied, 1983 ; Rodier, 1984 ; Lorenzen, 1967). Les eaux de font sont prélevées à l’aide d’une bouteille à renversement type Niskin. Les méthodes d’analyse de ces éléments chimiques et biochimiques sont succinctement résumées dans le tableau 2.
Sur le plan pratique, ces paramètres océanographiques constituent des éléments clés dans la gestion intégrée du littoral et dans la compréhension des relations d’échange entre le continent et la mer.
Tableau 2. Résumé des méthodes utilisées dans l’analyse des éléments chimiques.
En outre, il faut noter que l’estuaire a connu deux phases très contrastées durant l’année 2007. Lors les premières sorties d’hiver et du printemps, l’estuaire est bien ouvert à la mer mais s’est fermé en juillet jusqu’en novembre. Les sorties d’été et d’automne se sont donc déroulées en période de fermeture de l’estuaire.
La salinité est exprimée en practical salinity unit (psu) sans dimension.
Les teneurs en sels nutritifs sont exprimées en micromole par litre, symbolisé par µM et ceux des matières en suspension et des matières organiques sont exprimés en milligramme par litre (mg. l-1) ou mg/l.
3. Echantillonnage du zooplancton
3 .1 Prélèvements et traitement des échantillons
Les prélèvements du zooplancton conjointement aux relevés de température et salinité, ont été effectués mensuellement dans les 9 stations entre 29 janvier et 27 décembre 2007 (figure 4). Les pêches de plancton sont effectuées horizontalement en surface une station à l’autre (total de 108 prélèvements) à l’aide d’un filet à plancton WP2 de 170 µm de vide de maille (figure 5).
Eléments Méthodes Références
Azote ammoniacal (NH3 + NH4+) Dosage spectophotométrique
(λ = 630 nm) Parsons et al. (1989) Nitrates (NO3 -) Réduction des nitrates en nitrites et dosage
spectrophotométrique des nitrites (λ = 543 nm)
Parsons et al. (1989) Nitrites (NO2-) Dosage spectophotométrique
(λ = 543 nm) Parsons et al. (1989) Phosphate (PO43-) Dosage spectrophotométrique :
(λ = 885 nm) Aminot et Chaussepied (1983) Azote Organique Dissous (NOD) Minéralisation en milieu basique et dosage
indirecte de l’équivalent en nitrates Dosage spectrophotométrique : (λ = 885 nm)
Parsons et al. (1989)
Carbone Organique Particulaire
(COP) Méthode titrimétrique : oxydation et dosage du carbone en équivalent glucose
Parsons et al. (1989) Chlorophylle a (Chla) Méthode spectrophotométrique de Lorenzen Lorenzen (1967)
Chapitre I
Figure 5. Filet WP2. : Filet cylindro-conique de 30cm de diamètre, une ouverture de 0,15m² et 170µm de vide de maille.
Chaque échantillon du zooplancton correspond à un prélèvement de 12 à 19 m3 d’eau. Le temps de pêche
toujours égale à 3 mn, la vitesse de traînée est plus ou moins rapide et constante, ce qui augmente la vulnérabilité des organismes et permet d’éviter les fuites et les échappements à l’approche de l’échantillonneur, conformément aux suggestions de Bougis (1974).
L’échantillon est ensuite filtré sur un tissu de filet à plancton de maille 170µm et le contenu de la filtration est conservé dans une solution de formol à 5%, coloré au rose de Bengale afin de faciliter l’observation microscopique des organismes qui les composent. Les échantillons de zooplancton ont été fractionnés en sous-échantillons représentant statistiquement la totalité des récoltes (3 fractions par récoltes), dont le volume de chaque fraction est varié entre 5 et 20 ml et parfois 30 ml et même 50 ml.
Le comptage de zooplancton est effectué sous microscope binoculaire Gx3.20 à Gx10, dans une cuve de dolffus, le passage au GX40 était nécessaire pour identifier jusqu’à l’espèce. Les ouvrages utilisés pour cette identification sont : Tregouboff et Rose. (1978), Bernard dussart (1967, 1969,1989), Wilhelm Lilljeborg (1900), Rotifera edmondson W.T (1959).
Il est intéressant de rappeler que les résultats portent sur l’observation de trois sous-échantillons représentant statistiquement le contenu des pêches planctoniques et le nombre moyen a été pris. Lorsque l’échantillon est peu dense, il sera analysé entièrement.
Les résultats de dénombrement sont exprimés en densité absolue ou abondance (individus par mètre cube ou ind. m-3) et en pourcentage de d’abondance ou fréquence relative (%).
3 .2 Estimation de la biomasse
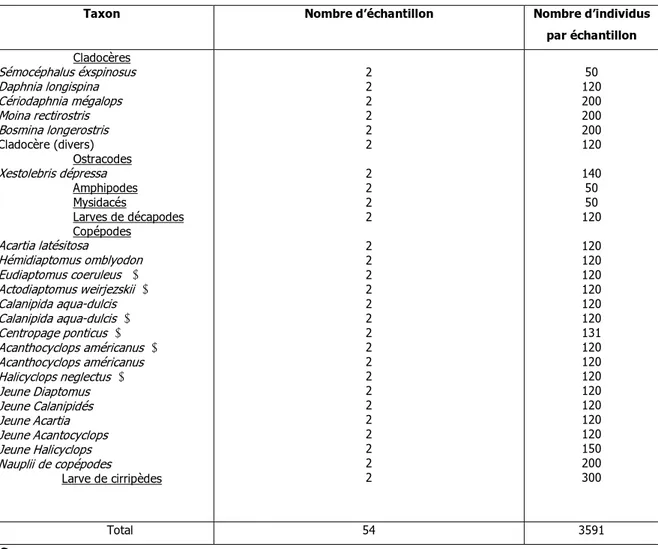
Les cladocères, les ostracodes, les amphipodes, les larves de décapodes, les Nauplii, Copépodites et adultes de copépodes et les larves de Cirripèdes ont été préalablement séchés à l’étuve pendant 72 heures à 60˚C (tableau 3). Après le séchage, les individus sont pesés à l’aide d’une balance Mettler AR0640 de précision 10 µg et de capacité max 65 g, pour obtenir finalement leurs poids secs individuels.
La biomasse individuelle en carbone de ces espèces est évaluée selon la méthode décrite dans le manuel de Aminot et Chaussepied, 1983.
Le poids sec moyen individuel est exprimé en µg PS et en µg C pour la biomasse moyenne individuelle carbonée.
Le poids sec moyen de Larves d’Annélides, les Rotifères, et quelques formes de copépodes (Oithona nana, Euterpina acutifrons, Halicyclops neglectus) pour lesquels on a pas de mesures, ont été tirés de la littérature en admettant un rapport C/PS = 50% (Parsons et al., 1984 ; Mullin , 1969).
Tableau 3. Taxons zooplanctoniques ayant fait l’objet d’estimation de biomasse exprimée en poids sec. On note que 7182 individus ont été isolés et traités pour les pesées.
Taxon Nombre d’échantillon Nombre d’individus par échantillon Cladocères Sémocéphalus éxspinosus Daphnia longispina Cériodaphnia mégalops Moina rectirostris Bosmina longerostris Cladocère (divers) Ostracodes Xestolebris dépressa Amphipodes Mysidacés Larves de décapodes Copépodes Acartia latésitosa ♀ Hémidiaptomus omblyodon ♀ Eudiaptomus coeruleus ♂ Actodiaptomus weirjezskii ♂ Calanipida aqua-dulcis ♀ Calanipida aqua-dulcis ♂ Centropage ponticus ♂ Acanthocyclops américanus ♂ Acanthocyclops américanus ♀ Halicyclops neglectus ♂ Jeune Diaptomus Jeune Calanipidés Jeune Acartia Jeune Acantocyclops Jeune Halicyclops Nauplii de copépodes Larve de cirripèdes 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 50 120 200 200 200 120 140 50 50 120 120 120 120 120 120 120 131 120 120 120 120 120 120 120 150 200 300 Total 54 3591
Chapitre II
Chapitre II. Hydrologie
1. Température
La faible profondeur fait que la température de l’eau suit sensiblement celle de l’air (Tableau 4). Les valeurs des températures montrent le même accident en hiver et en automne où les eaux profondes restent plus chaudes et témoignant non seulement de la faible influence des températures atmosphériques mai aussi de l’individualité de la masse d’eau profonde et de sa forte inertie. Ce gradient s’inverse au printemps et en été, le réchauffement printanier débute au mois de mars (13°C), les eaux de surface sont plus chaudes mai le
réchauffement est généralisé à l’ensemble de la colonne d’eau durant la saison estivale. Les températures maximales sont notées en saison estivale au mois de juin. La plus forte température (31°C) a été relevée le
moi de juin à la station MK3. Le refroidissement automnal des eaux de surface commence à la fin de l’automne. La température des eaux de l’estuaire a varié entre (11-31°C) avec une forte saisonnalité. La
distribution de la température dans la colonne d’eau montre clairement l’isolement de la tranche d’eau 0,7-2,6 m par rapport à la lame d’eau sous-jacente particulièrement en hiver et au printemps. On peut remarquer l’existence d’une thermocline à 0,7- 2,6 m selon la station et son épaisseur varie de 0,1-0,7m. Il s’agit d’une forte stratification thermique s’établissant en cette époque de l’année.
Tableau 4. Variations annuelles de la température (°C) des eaux superficielles et des eaux du fond enregistrées en 2007 dans l’estuaire du Mafrag (d’après Kebabsa, 2009).
Mois Température (°C) Embouchure K1 K2 K3 K4 K5 B1 B2 B3 S F S F S F S F S F S F S F S F S F 29.01.07 18.02.07 13.03.07 15.04.07 14.05.07 17.06.07 12.07.07 12.08.07 26.09.07 24.10.07 22.11.07 27.12.07 12,2 15,1 13,0 17,7 23,8 27,1 25,9 25,9 23,2 16,9 14,2 11,7 15,5 15,8 12,8 17,4 19,8 22,2 24,0 25,6 23,9 16,4 13,0 14,7 12,3 15,0 13,5 17,8 24,5 29,9 27,3 24,1 24,0 17,4 14,5 11,4 16,6 15,6 13,3 17,7 19,3 21,3 22,2 24,3 24,0 16.8 13,2 14,7 12,7 15,4 13,4 17,8 23,2 30,2 27,6 27,1 24,4 17,2 14,3 11,6 16,5 15,6 13,2 17,7 18,9 21,3 22,7 26,9 24,8 17,9 13,0 13,0 12,6 14,7 13,5 17,4 22,5 30,8 27,4 27,4 24,7 17,6 13,0 11,1 16,6 14,4 13,4 17,4 19,2 22,4 25,0 27,1 24,0 16,7 12,0 11,1 12,9 14,9 13,9 17,4 23,3 28,8 26,8 26,9 24,2 17,6 13,4 11,1 15,1 14,5 13,6 17,4 22,0 26,0 26,0 26,1 23,6 16,2 11,8 11,0 12,4 15,5 14,2 17,8 23,6 30,0 27,6 27,4 24,4 16,4 12,9 11,3 14,6 14,7 13,6 17,8 22,5 22,0 24,2 26,5 24,8 15,3 12,0 11,0 14,4 16,4 12,8 19,9 25,1 29,2 27,6 27,2 25,0 18,0 14,5 12,3 16,8 16,5 12,7 19,8 20,7 25,8 26,8 26,8 24,5 17,1 13,9 11,8 13,6 16,5 12,7 21,0 24,3 28,7 27,3 27,7 25,6 18,7 14,9 12,3 15,0 16,0 12,6 19,3 23,9 27,7 26,6 26,6 24,3 17,4 13,7 12,0 13,8 16,5 12,2 20,2 25,3 29,1 28,4 28,8 25,4 18,5 14,8 12,5 14,8 15,8 12,2 18,6 21,9 24,7 26,4 27,4 24,6 18,0 13,7 11,9 2. Salinité
La salinité a été représentée d’une représentation de l’évolution spatio-temporelle des salinités de surface et de fond (tableau 5). La salinité dans un estuaire temporaire comme Mafrag est conditionnée par les événements hydrauliques d’ouverture et de fermeture. La salinité moyenne au niveau de l’embouchure est de l’ordre de 10,5. En période d’ouverture la salinité atteint 13 alors qu’en période de fermeture elle n’est que de l’ordre de 7,2. La salinité moyenne en surface est moins importante (2,9) à celle du fond (18) en raison de la forte stratification des eaux en phase d’ouverture en particulier au printemps (tableau 5). En Eté
la salinité en surface n’est que de l’ordre de 7,8 tandis qu’en profondeur les eaux sont beaucoup plus salées avec une valeur moyenne de 23,7.
Dans la branche d’El-Kébir la salinité a une moyenne annuelle de 7,2. La salinité en période d’ouverture est de l’ordre de 7,8 alors en période de fermeture la salinité est de 6,4. En surface la salinité moyenne est de 1,8 comparée à celle de la profondeur qui s’élève jusqu’à 12,7 (tableau 5).
La salinité moyenne au niveau de Bounamoussa atteint la valeur de 3,8. En période d’ouverture la salinité atteint 4,5 alors qu’en période de fermeture elle n’est que de l’ordre de 2,8. D’un autre coté on peut dire que la salinité moyenne de surface est de la même (1,9) dans la branche de Bounamoussa et El- Kébir ainsi avec une valeur en profondeur à El- Kébir (12,7) qui est supérieure à celle de Bounamoussa (5,8).
Tableau 5. Variations annuelles de la salinité (psu) des eaux superficielles et des eaux du fond enregistrées en 2007 dans l’estuaire du Mafrag (d’après Kebabsa, 2009).
Mois Salinité (psu) Embouchure K1 K2 K3 K4 K5 B1 B2 B3 S F S F S F S F S F S F S F S F S F 29.01.07 18.02.07 13.03.07 15.04.07 14.05.07 17.06.07 12.07.07 12.08.07 26.09.07 24.10.07 22.11.07 27.12.07 1,7 1,5 0 0,2 1,1 6,5 8,9 8 3,1 2 0,4 1,1 32 31 0 7,8 33,3 33 28,6 9,6 6,5 3 1,4 30,6 0,6 0,3 0 0 0,5 2,8 7,8 8,1 3 0,8 0,4 1,3 34,8 32,3 0,2 0 30,3 34 32,4 26,6 6,5 3,3 2 30,3 0,3 0,1 0 0 0,3 1,8 7,2 8,5 5,5 0,2 0 0,2 32,5 31,1 0 0 28,6 33,4 30,4 12,9 7,8 3,2 2 22 0,2 0,1 0 0 0,1 1,6 6,7 8,7 5,1 0,1 0 0,1 31,3 29,8 0 0 26,2 26,4 26,6 11,1 5,5 0,1 0,8 0,1 0,2 0 0 0 0 1,5 5,8 8,4 4,2 0 0 0,1 28,2 0,4 0 0 0 28,7 8 8,7 4,6 0 0 0,1 0,1 0 0 0 0 0,5 4,1 7,4 2,9 0 0 0 26,5 0,2 0 0 0 28 20,8 8,4 4,9 0 0 0 2 2,3 0 0,4 1,8 5,1 6,7 5,7 2 1 0,3 1,7 30 26,9 0 0,4 23,6 18,2 9,9 9,1 6,3 2,8 0,6 2,6 3,6 3,8 0 0,1 0,4 3,6 4 3,7 1,3 0,5 0,2 0,5 13,7 3,8 0 0,2 0,4 4,8 4,1 6,9 1,5 0,9 0,5 0,5 3,2 3,2 0 0,1 0,3 2,6 3 2,8 0,8 0,3 0,2 0,4 15,8 4 0 0,2 0,5 9 3,3 4,7 1 0,6 0,7 0,5
3. Les sels nutritifs
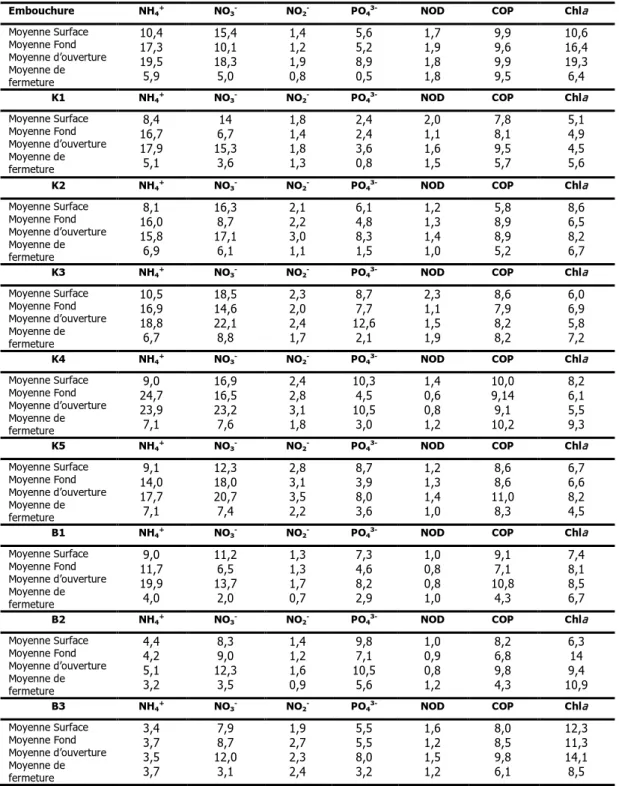
En milieu estuarien peu profond, le volume d’eau par rapport à la surface du fond est très faible, l’influence des processus benthiques sur la chimie de l’eau est importante. De plus, la lumière atteinte souvent le fond et permet une production accrue de matière organique végétale. Après son accumulation dans le sédiment, la matière organique métabolisable est décomposée par les bactéries. Les produits de telles réaction oxydantes diffusent vert l’eau sus-jacente et seront oxydés (ou restent en l’état selon l’oxygénation de l’eau) puis utilisés par les producteurs primaires. La principale forme de l’azote inorganique libérée par les sédiments est l’ammonium (Raine et Patching, 1980). Davies (1975) en étudiant la chimie des sédiments vaseux des Fjords écossais a estimé que l’ammonium libérée par le sédiment représente plus de 50% de l’azote utilise par le phytoplancton tandis 25% de cette forme réduite d’azote est consommée immédiatement par le microphytobenthos (Nowicki et Nixon, 1985). Dans les eaux bien oxygénées l’azote ammoniacal se trouve alors sous l’action des bactéries nitrifiantes. La majeure partie de l’azote minéral se trouve alors sous forme de nitrates. Le tableau 6 peut renseigner sur la dynamique, l’origine et le
Chapitre II
Tableau 6. Valeurs moyennes annuels, intervalle de variation des différentes formes de l’azote inorganique dissous (µM), les teneurs en phosphates (µM) et matières organiques (azote organique dissous : NOD, Carbone Organique Particulaire : COP, exprimées en mg. l-1, Chlorophylle a phytoplanctonique: mg. m-3) dans l’estuaire du Mafrag en
enregistrées en 2007 (d’après Kebabsa, 2009).
Embouchure NH4+ NO3- NO2- PO43- NOD COP Chla Moyenne Surface Moyenne Fond Moyenne d’ouverture Moyenne de fermeture 10,4 17,3 19,5 5,9 15,4 10,1 18,3 5,0 1,4 1,2 1,9 0,8 5,6 5,2 8,9 0,5 1,7 1,9 1,8 1,8 9,9 9,6 9,9 9,5 10,6 16,4 19,3 6,4 K1 NH4+ NO3- NO2- PO43- NOD COP Chla Moyenne Surface Moyenne Fond Moyenne d’ouverture Moyenne de fermeture 8,4 16,7 17,9 5,1 14 6,7 15,3 3,6 1,8 1,4 1,8 1,3 2,4 2,4 3,6 0,8 2,0 1,1 1,6 1,5 7,8 8,1 9,5 5,7 5,1 4,9 4,5 5,6 K2 NH4+ NO3- NO2- PO43- NOD COP Chla Moyenne Surface Moyenne Fond Moyenne d’ouverture Moyenne de fermeture 8,1 16,0 15,8 6,9 16,3 8,7 17,1 6,1 2,1 2,2 3,0 1,1 6,1 4,8 8,3 1,5 1,2 1,3 1,4 1,0 5,8 8,9 8,9 5,2 8,6 6,5 8,2 6,7 K3 NH4+ NO3- NO2- PO43- NOD COP Chla Moyenne Surface Moyenne Fond Moyenne d’ouverture Moyenne de fermeture 10,5 16,9 18,8 6,7 18,5 14,6 22,1 8,8 2,3 2,0 2,4 1,7 8,7 7,7 12,6 2,1 2,3 1,1 1,5 1,9 8,6 7,9 8,2 8,2 6,0 6,9 5,8 7,2 K4 NH4+ NO3- NO2- PO43- NOD COP Chla Moyenne Surface Moyenne Fond Moyenne d’ouverture Moyenne de fermeture 9,0 24,7 23,9 7,1 16,9 16,5 23,2 7,6 2,4 2,8 3,1 1,8 10,3 4,5 10,5 3,0 1,4 0,6 0,8 1,2 10,0 9,14 9,1 10,2 8,2 6,1 5,5 9,3 K5 NH4+ NO3- NO2- PO43- NOD COP Chla Moyenne Surface Moyenne Fond Moyenne d’ouverture Moyenne de fermeture 9,1 14,0 17,7 7,1 12,3 18,0 20,7 7,4 2,8 3,1 3,5 2,2 8,7 3,9 8,0 3,6 1,2 1,3 1,4 1,0 8,6 8,6 11,0 8,3 6,7 6,6 8,2 4,5 B1 NH4+ NO3- NO2- PO43- NOD COP Chla Moyenne Surface Moyenne Fond Moyenne d’ouverture Moyenne de fermeture 9,0 11,7 19,9 4,0 11,2 6,5 13,7 2,0 1,3 1,3 1,7 0,7 7,3 4,6 8,2 2,9 1,0 0,8 0,8 1,0 9,1 7,1 10,8 4,3 7,4 8,1 8,5 6,7 B2 NH4+ NO3- NO2- PO43- NOD COP Chla Moyenne Surface Moyenne Fond Moyenne d’ouverture Moyenne de fermeture 4,4 4,2 5,1 3,2 8,3 9,0 12,3 3,5 1,4 1,2 1,6 0,9 9,8 7,1 10,5 5,6 1,0 0,9 0,8 1,2 8,2 6,8 9,8 4,3 6,3 14 9,4 10,9 B3 NH4+ NO3- NO2- PO43- NOD COP Chla Moyenne Surface Moyenne Fond Moyenne d’ouverture Moyenne de fermeture 3,4 3,7 3,5 3,7 7,9 8,7 12,0 3,1 1,9 2,7 2,3 2,4 5,5 5,5 8,0 3,2 1,6 1,2 1,5 1,2 8,0 8,5 9,8 6,1 12,3 11,3 14,1 8,5
Les teneurs de l’azote inorganique dissous (NID) sont élevées variant en moyenne entre 27,5 µM à l’exutoire et 30 µM dans le bras d’El-Kébir (tableau 6). A l’estuaire aval (embouchure), les teneurs diminuent de 20% en raison des apports de Bounamoussa (22,5 µM) moins fertiles.
Les teneurs en ammonium des eaux du fond sont cependant supérieures à celles de surface. Les ions NH4+
constituent la forme réduite des composés minéraux azotés. Les résultats de nos analyses montrent que l’ion ammonium est la forme prépondérante de l’azote minéral dissous, il représente entre 40-80% du stock de
l’azote inorganique total. Peu représentés dans les milieux ouverts (Océan et bassins), ils deviennent la forme azotée prédominante dans les lagunes semi-fermées (Robert, 1984). Ces ions NH4+,
préférentiellement consommés par les microphytes, constituent le lien privilégié entre la matière organique en voie de décomposition et les producteurs primaires. Particulièrement en milieu eutrophie, le sédiment, centre de minéralisation de la matière organique, se comporte comme un réservoir en azote qui est libéré sous forme de NH4+ (Blackburn, 1986), dons selon nos analyses les teneurs moyennes de l’azote
ammoniacal des eaux de fond sont de l’ordre de 17,3 µM pour l’embouchure et 18 µM dans le bras El-kébir et 7 µM pour Bounamoussa. Cette forme réduite subissant une oxydation chimique, était convertie en partie en azote oxydé par l’oxygène. Ainsi, des concentrations très élevées en nitrites 2 µM et en nitrates 11 µM ont été enregistrées suite à cette oxydation pour les eaux de fond. Les valeurs des Nitrate traduisent une chute de 1/2 au 4/5 du stock qui s’est convertit en forme réduite à la suite d’une dénitrification en l’absence d’oxygène. On constate d’autre part que les teneurs suivent une distribution spatiale comparable à celle de l’ammonium avec un maximum dans le bouchon vaseux (K3 et B2).
Les nitrates ont tendance à s’accumuler dans les eaux de surface où les teneurs sont toujours importantes (14 µmoles. l-1 en moyenne), contrairement aux eaux du fond très pauvre en azote oxydé en raison des
conditions réductrices de sédiments et de la mauvaise oxygénation du comportement benthique. Ces différences s’accentuent lors de la période de fermeture par suite de la stagnation des eaux en particulier (tableau 6).
Les ions nitrites semblent avoir une tendance à l’augmentation d’amont en aval. Lorsque l’on passe à la période de fermeture de l’estuaire en été, l’environnement physico-chimique change profondément et l’on assiste à une diminution générale de l’azote minéral. N’étant pas entretenu par les apports continentaux, devenus pratiquement nuls, la cinétique du stock en sels azotés ne dépend donc que de la consommation et de régénération biologiques. Il semble que la régénération l’emporte sur la consommation puisque les teneurs restent assez élevées. L’azote minéral dépend donc de l’activité biologique et suit ainsi un comportement strictement non conservatif.
Le cycle saisonnier de l’azote minéral est très marqué avec de fortes teneurs à la fin de l’automne et en hiver (période d’ouverture a la mer) qui coïncide avec la période d’accumulation de la matière organique conjuguée à la faible demande végétale hivernale. A la fin du printemps et en été (période de fermeture de l’embouchure), les concentrations diminuent suite au développement du phytoplancton et des algues benthiques. D’où en note que le stock du NID construit en hiver, à partir d’apports continentaux se trouve diminué de moitié dans l’exutoire et El-Kébir et se réduit au 1/3 dans Bounamoussa.
Les conditions chimiques de l’estuaire du Mafrag indiquent un fort enrichissement au cours des saisons aussi bien par les phosphates que par l’azote minéral. On retient que les teneurs moyennes du NID sont de l’ordre de 24 µmoles. l-1 et celles des phosphates de 5 µmoles. l-1.
Sur le plan spatial, la branche d’El-kébir est plus fertile en sels nutritifs que Bounamoussa au printemps et en automne en raison d’apports agricoles, comme le confirme les valeurs rapportées par Ziouch (2007). C’est en automne que l’apport en phosphate est plus important consécutivement aux amendements de terrains par les engrais phosphatés et azotés. Le rapport N/P ne dépassant pas en moyenne 3,5, traduit l’influence
Chapitre II
4. Les matières organiques
Le domaine estuarien possède une faible inertie qui peut retentir sur toutes ses caractéristiques (Boutière, 1979-1980). Sa faible profondeur permet à la lumière d’atteindre souvent le fond qui supporte ainsi une production végétale accrue tant benthique que planctonique (Nowicki et Nixon, 1985). Ainsi, Martens (1982) a qualifié ces milieux comme de véritables pièges naturels de matière organique produite dans leurs eaux souvent très fertiles. De même ; Montgomery et al. (1979) rapportent que les sédiments dissoutes en particulier les sels nutritifs. Dans bien des écosystèmes côtiers, l’azote ammoniacal est souvent réputé comme un paramètre conservatif notamment en milieu lagunaire (Perthuisot, comm. Orale) et en milieu côtier à fort apport continental (Tréguer et al., 1985 ; Mc Lachlan et al., 1981). En revanche, la distribution des éléments nutritifs dissous dépend largement des propriétés chimiques sédimentaires en particulier les processus d’oxydoréduction (Wollast, 1982) qui dépendent à leur tour de l’importance de l’accumulation de la matière organique métabolisable. Ainsi, l’augmentation de celle-ci peut amener le système benthique à libérer des produits réduits toxique qui sont déterminants dans la distribution des populations benthiques (De Jonge, 1980).
Les fractions organiques azotées (NOD), Dans la colonne d’eau, les teneurs de la période d’ouverture est moins fertile celle de la période de fermeture (tableau 6) donne un argument sur l’origine de la l’azote organique dissous dans l’estuaire du Mafrag qui est endogène (70-120 µmoles. l-1).
L’estuaire est fortement chargé en matière organique particulaire sous forme de carbone dont les teneurs moyennes varient entre (660 µmoles. l-1 ou 8 mg. l-1), L’augmentation en période d’ouverture est due aux
échanges continentaux et marins (tableau 6).
Les variations saisonnières des biomasses chlorophylliennes planctoniques sont caractérisées par de fortes concentrations en été et un minimum hivernal. Les microalgues benthiques apparaissent actives même en hiver.
Si on observe la distribution de l’ensemble des éléments chimiques étudiés, on s’apercevra qu’ils s’organisent selon une tendance à l’augmentation générale à environ 7 km de l’embouchure pour l’estuaire d’El-Kébir. Il s’agit de zone à bouchon vaseux construit lors des étales de courant de marée qui semblent avoir pour effet la décantation de matières minérales et organiques. Cette zone peut constituer une source potentielle d’accumulation et de largage de polluants selon les conditions hydrologiques. En effet on rencontre de très fortes proportions d’ammonium dans les eaux du fond de cette zone, témoignant d’un relargage à partir de ce bouchon vaseux.
CHAPITRE III. Composition et abondance du zooplancton de surface
Introduction
Le milieu marin se comporte parfois comme exportateur vis-à-vis du domineestuarien. En plus des poissons attirés par la nourriture très abondante en milieu estuarien, le zooplancton transporté passivement par les courants d’alimentation peut constituer une part importante de ces exportations marines, selon la sison. Lors de leur séjour dans les estuaires, ces éléments sont confrontés notamment aux variations des facteurs physico-chimiques qui peuvent être fortes dans ces types d’environnements confinés. Leur persistance dans un milieu d’accueil instable, par principe, dépend de leurs capacités de tolérances vis-à-vis des fluctuations des paramètres abiotiques de celui-ci. Le zooplancton constitue la nourriture principale pour la plupart des stades juvéniles de poissons; la quasi-totalité de cette macrofaune passe par une phase planctonophage (Legendre et al., 1987 ; Castel, 1985). Ce maillon occupe ainsi une position clé dans la chaîne trophique et les processus de transferts d’énergie. L’étude de la faune planctonique peut contribuer à la compréhension des aspects fondamentaux du fonctionnement de l’écosystème tels que la productivité, l’état trophique et la circulation de la matière organique dans le réseau trophique.
Dans ce troisième chapitre, nous présenterons les variations spatio-temporelles du zooplancton en général et de ses différents éléments, il s’agira de décrire tout d’abord la composition et l’abondance des différents éléments planctoniques sous un concept dynamique. Puis une discussion cohérente intégrant les paramètres du milieu et les catégories planctoniques sont proposés. L’ensemble de ces données sont comparées et pondérées par rapports à celle de la littérature concernant surtout les localités méditerranéennes.
IL est important de souligner au préalable que l’étude qui se rapporte au zooplancton de l’estuaire du Mafrag est peu réalisée. Etant donnée son importance du point de vue trophique par rapport aux échelons trophiques supérieurs, il est intéressant de connaître la composition zooplanctonique de la région, nécessaire à toute investigation ultérieure se rattachant à la biologie et à l’écologie de ce type d’environnement eutrophie.
1. Composition globale du zooplancton
L’étude systématique du zooplancton du system estuarien du Mafrag, nous a permis d’identifier 44 espèces appartenant à 4 embranchements. Quantitativement, et en terme de richesse spécifique, la majorité des espèces sont rencontrées à la station embouchure et les premières stations d’oued El-kébir et Bounamoussa. Ceci explique que l’intrusion marine (situation flot) est un facteur d’importation d’espèces d’affinités néritiques et même parfois océaniques. Parmi les 44 espèces inventoriées (tableau 7), quelques unes n’ont été relevées qu’une ou deux fois au cours de toute la période d’étude, il s’agit de: 2 espèces de Cladocères d’eau de mer: Podon polyphémoides, Evadne spinifera, et une espèce d’eau douce: Ceriodaphnia pulcheca typica, les Copépodes: Acartia latisetosa, le mysidacé indéterminée, les rotifères: Brachionus bidentata. Il faut signaler que les 3 espèces de Rotifères Brachionus angularis, Keratella sp, Keratella canadensis n’ont été trouvés que au bras de Bounamoussa.