Mise au point d’un compteur sanguin pour l’imagerie
moléculaire quantitative
Thèse Romain Espagnet Doctorat en physique Philosophiæ doctor (Ph.D.) Québec, CanadaMise au point d’un compteur sanguin pour l’imagerie
moléculaire quantitative
Thèse
Romain Espagnet
Sous la direction de:
Philippe Després, directeur de recherche Louis-André Hamel, codirecteur de recherche
Résumé
Cette thèse a pour sujet le développement d’un compteur gamma pour l’imagerie moléculaire. L’objectif principal du projet est de développer, à faible coût, un appareil compact comme outil pour l’obtention d’une quantification robuste de l’image. Celui-ci a été conçu pour caractériser la courbe temps-activité des patients, à savoir la concentration d’un radio-marqueur dans le sang en temps réel. Le prototype construit comporte donc un détecteur de gammas, une pompe péristaltique et un système d’acquisition. Le compteur gamma a été conçu à partir d’un
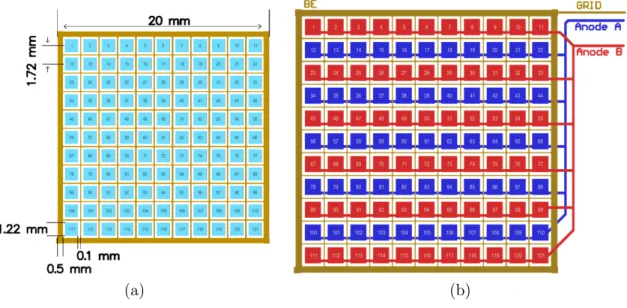
détecteur à semi-conducteur CdZnTe commercial de 6 cm3, 20 × 20 × 15 mm3, comportant une
anode segmentée en 121 pixels. Cette anode demande un grand nombre de voies d’électroniques ; aussi son instrumentation ne s’inscrit pas facilement dans un design compact et peu coûteux. Une technique innovante d’instrumentation a été développée pour remplir ces objectifs en se basant sur la technique de grille coplanaire. L’anode étant segmentée en 11 x 11 pixels, les pixels des colonnes paires ont été reliés ensemble ainsi que ceux des colonnes impaires afin de former deux peignes imbriqués. Ce nouveau design d’anode virtuelle, nommé grille virtuelle coplanaire, est instrumenté avec une électronique maison. Pour piloter ce détecteur et faire le traitement du signal, la technologie des circuits logiques programmables, FPGA, a été choisie. Elle offre une grande latitude de développement et est aussi utilisée pour contrôler les autres éléments du prototype. Ce détecteur CdZnTe, dans sa nouvelle configuration d’anode virtuelle, affiche une efficacité intrinsèque de 34% à 662 keV avec une grande stabilité d’efficacité de détection (déviation, non significative, inférieure à 0,05%) et une résolution en énergie de 8%. Le prototype construit sur cette base a permis de mesurer la courbe temps-activité d’un patient lors d’un examen TEP avec succès. La sensibilité du prototype a été évaluée à 7,1 cps/(kBq/ml) avec
une activité minimum détectable de 2,5 kBq/ml pour le18F. Les performances spectroscopiques
du prototype et la grande plage d’énergie couverte ouvrent des perspectives d’utilisation en tomographie d’émission monophotonique. Celui-ci peut aussi être adapté pour des études pré-cliniques chez le petit animal en modifiant le système de prélèvement.
Abstract
The subject of this thesis is the development of a gamma counter for molecular imaging. The main objective of the project is to develop a low cost device with a compact design with the purpose of producing a robust quantification of a SPECT/PET image. The tool is designed to characterize the time-activity curve of patients, specifically the concentration of a radio marker in the blood in real time. The prototype consists of a gamma detector, a peristaltic pump and an acquisition system. The gamma counter is designed from a commercial
CdZnTe semiconductor detector. It is a cubic crystal of size 20 × 20 × 15 mm3, containing an
anode segmented in 121 pixels. This anode requires a large number of electronic readouts, thus its instrumentation does not easily fit in a compact and low cost design. An innovative technique of instrumentation has been developed to solve this problem based on the coplanar grid technique. The anode being segmented into 11 x 11 pixels, the pixels of the even-numbered columns were connected together, as well as the pixels of the odd columns, to form intercalated bands. This new virtual anode design, named virtual Coplanar Grid, is instrumented with an custom-made electronics. To drive this detector and to process its signal, an FPGA technology was used. It offers wide flexibility for development and is also used to control the other elements of the prototype. The CdZnTe detector, in its new configuration of virtual anode, displays an intrinsic detection efficiency of 34% at 662 keV with a low standard deviation, a non-significant signal drift (<0.05%) and a 8% energy resolution. The prototype built allowed to successfully measure the time-activity curve of a patient during a PET scan. The device achieves a sensitivity of 7.1 cps/(kBq/mL) with a minimum detectable activity of 2.5 kBq/mL
for 18F. The spectroscopic performance of the prototype and the energy detection range open
perspectives to be used in single photon emission computed tomography. It can also be adapted for preclinical studies in small animal by changing the sampling system.
Table des matières
Résumé iii
Abstract iv
Table des matières v
Liste des tableaux viii
Liste des figures ix
Liste des symboles xii
Remerciements xv
Avant-propos xvi
Introduction 1
1 Imagerie moléculaire et analyse quantitative 5
1.1 La tomographie d’émission par positons . . . 6
1.2 L’évolution du radio-marqueur dans le patient au cours du temps . . . 9
1.3 L’analyse quantitative . . . 10
1.3.1 Modèle compartimental . . . 11
Exemple d’un modèle à trois compartiments . . . 11
La valeur de fixation normalisée (SUV pour Standard Uptake Value) 13 Image dynamique et solution hors équilibre . . . 14
1.3.2 Détermination de la courbe temps-activité (CTA). . . 14
Mesure dérivée de l’image . . . 15
Mesure par extraction de sang . . . 16
1.3.3 Compteur sanguin automatisé. . . 16
Compteurs basés sur la détection des gammas . . . 17
Compteurs basés sur la détection des positons . . . 22
2 Système de détection 26 2.1 Propriété du CdZnTe. . . 27
2.2 Théorème de Ramo . . . 27
2.3 Techniques de collection de charges unipolaires . . . 29
Technique de correction en profondeur d’interaction . . . 31
Technique de correction radiale de la collection de charge proche de l’anode . . . 32
Technique de correction par pondération . . . 33
2.3.3 Impact du design de l’anode. . . 34
2.3.4 Cas particulier des détecteurs à large volume avec anode coplanaire. 35 2.4 Grille virtuelle coplanaire . . . 36
2.5 Fonctionnement d’un FPGA . . . 37
2.5.1 Changement d’état . . . 38
2.5.2 Méthode de programmation . . . 38
2.5.3 Utilisation. . . 38
2.6 De la charge au spectre : les étapes du traitement du signal . . . 39
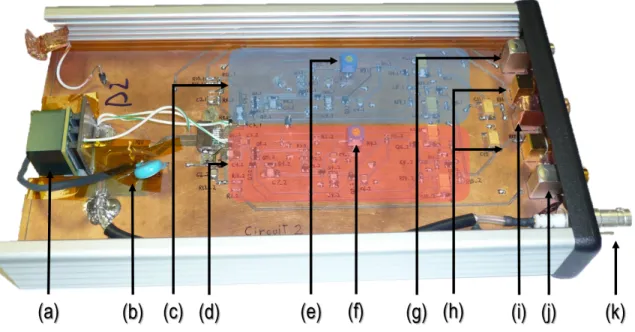
Collection de charge . . . 42 Traitement du signal . . . 43 2.7 Conclusion . . . 46 3 Évolution du prototype 49 3.1 Électronique du prototype . . . 49 3.1.1 Circuit pré-amplificateur . . . 49 Version 1 . . . 50 Version 2 . . . 52 Version 3.1 . . . 53 3.1.2 Circuit acquisition . . . 54 Version 0 : Tig10 . . . 55 Version 1 . . . 57 Version 2 . . . 59 3.1.3 Résumé . . . 60 3.2 Prototype . . . 61 3.2.1 Boîtier du détecteur . . . 62 3.2.2 Support du détecteur . . . 64 3.2.3 Pompe péristaltique . . . 65 3.2.4 Autres éléments. . . 66 3.3 Conclusion . . . 67
4 Conception and characterization of a virtual coplanar grid for a 11x11 pixelated CZT detector 68 4.1 Résumé . . . 68
4.2 Abstract . . . 69
4.3 Introduction. . . 69
4.4 Detector configuration and readout electronics. . . 71
4.5 vCPG exploration . . . 74
Intrinsic efficiency . . . 81
4.6 Discussion and conclusion . . . 82
5 A CZT-based Blood Counter for Quantitative Molecular Imaging 85 5.1 Résumé . . . 85
5.2 Abstract . . . 86
5.3 Introduction. . . 86
5.4 Materials and Methods. . . 88
5.4.1 General device features . . . 88
5.4.2 Gamma detector . . . 89
5.4.3 Data acquisition . . . 91
5.4.4 Graphical User Interface . . . 92
5.4.5 Device characterisation . . . 93
Stability over time and catheter positioning reproducibility . . . 93
Minimum Detectable Activity . . . 94
Dispersion. . . 95
5.4.6 PET studies. . . 96
5.5 Results. . . 97
5.5.1 Stability over time and catheter positioning reproducibility . . . 97
5.5.2 Minimum Detectable Activity and energy resolution . . . 98
5.5.3 Dispersion. . . 98
5.5.4 PET study . . . 101
5.6 Discussion . . . 101
5.7 Conclusion . . . 102
Conclusion 105 A A CdZnTe-based automated Blood Counter for Quantitative Molecular Imaging 109 A.1 Résumé . . . 109
A.2 Abstract . . . 110
A.3 Introduction. . . 110
A.4 Materials and methods . . . 111
A.4.1 General features . . . 111
A.4.2 Gamma Counter . . . 112
A.4.3 Data acquisition . . . 114
A.4.4 Graphical User Interface . . . 114
A.4.5 Device testing. . . 115
A.5 Results. . . 116
A.5.1 Experiment I – Stability and linearity . . . 116
A.5.2 Sensibility . . . 118
A.6 Conclusions . . . 118
B Commande super utilisateurs du GUI 120
Liste des tableaux
1.1 Comparaison des compteurs sanguins [1]. . . 24
2.1 Propriétés de cristaux courants . . . 27
4.1 Gamma counter specifications and operating parameters . . . 74
5.1 Comparison of real-time blood counters. . . 104
A.1 Parameters . . . 118
Liste des figures
0.1 Vue 3D de l’appareil en utilisation . . . 3
1.1 Ligne de réponse en TEP : classique versus temps de vol . . . 7
1.2 Résumé des types d’événements qui peuvent se produire sur un anneau TEP. . 8
1.3 TEP statique versus TEP dynamique . . . 10
1.4 Exemple de modèles à trois compartiments . . . 12
1.5 Schéma du compteur sanguin développé par Eriksson et al. . . 17
1.6 Dessin technique du compteur sanguin développé par Votaw et Shulman et al. . 18
1.7 Photo du compteur sanguin développé par Boellaard et al. . . 19
1.8 Photo du compteur sanguin développé par Laymon et al.. . . 20
1.9 Photo du compteur sanguin développé par Breuer et al. . . 21
1.10 Compteur sanguin développé par Roehrbacher et al. . . 21
1.11 Photo du compteur sanguin développé par la compagnie Swisstrace et al. . . . 22
1.12 Photos du compteur sanguin développé par Yamamoto et al. . . 23
1.13 Photos du compteur sanguin développé par Convert et al. . . 23
1.14 Aperçu du système développé . . . 25
2.1 Potentiel de pondération dans le cas d’un détecteur planaire . . . 29
2.2 Description du détecteur à 121 pixels de la compagnie Redlen . . . 30
2.3 Potentiel de pondération pour un détecteur coplanaire . . . 31
2.4 Description de l’effet de la position d’interaction sur le potentiel de pondération 32 2.5 Exemple de la compensation de la recombinaison des électrons . . . 33
2.6 Exemple d’anode coplanaire développée par He et al. . . 34
2.7 Effet de la correction de la position d’interaction sur la résolution en énergie . . 35
2.8 Description d’une vCPG . . . 36
2.9 Description d’une horloge . . . 38
2.10 Schématisation de la formation du signal . . . 40
2.11 Schématisation du traitement numérique du signal . . . 41
2.12 Signaux différentiels pour un photon de 662 keV dans le MiniDP et dans le FPGA 43 2.13 Exemple de filtre trapézoïdal sur un signal reconstruit . . . 44
2.14 Descriptif global de la fenêtre principale de l’interface utilisateur . . . 47
2.15 Descriptif de la fenêtre de définition de la séquence temporelle de l’acquisition . 47 2.16 Descriptif de la fenêtre de développement de l’interface utilisateur. . . 48
3.1 Version 1 du circuit pré-amplificateur . . . 50
3.2 Détecteur de 10 × 10 × 2 mm3 avec son connecteur. . . . . 51
3.3 Vue en perspective éclatée du compteur gamma dans la version 2. . . 52
3.5 Vue explosée du circuit pré-amplificateur avec le détecteur. . . 54
3.6 Carte TIG10 développée pour TRIUMF. . . 55
3.7 Adaptateur VME/USB . . . 56
3.8 Spectre de 137Cs . . . . 57
3.9 Photographie de la version 1 du circuit acquisition . . . 57
3.10 Version 2 de la carte acquisition-signal. . . 59
3.11 Comparaison des principales versions des cartes développées à l’échelle 11/50. . 61
3.12 Photographie du prototype. . . 62
3.13 Dessin 3D du détecteur et de la tubulure . . . 63
3.14 Description du boîtier du détecteur . . . 64
3.15 Description du support de tungstène . . . 65
3.16 Pompe péristaltique disponible pour le prototype . . . 66
3.17 Montage du système pour échantillonner le sang . . . 67
4.1 Example of CPG and qCPG layout . . . 70
4.2 View of the CdZnTe detector and layout representation of the readout grid . . 71
4.3 Three types of anode geometry with associated signal and energy spectra . . . 72
4.4 The 11x11 pixelated anode connection configuration for the vCPG mode . . . . 72
4.5 Schematic of electronics used to implement the vCPG . . . 73
4.6 Effect of the weighting factor ω on the energy resolution for different biases . . 76
4.7 Full energy peak position for ω values determined, for SAB and SBA . . . 77
4.8 Measured counting rates for ω values determined . . . 77
4.9 Energy resolution obtained with a 137Cs source for ω values determined . . . . 78
4.10 Energy spectrum of different sources measured . . . 80
4.11 Energy resolution for different sources measured. . . 81
4.12 Energy calibration along with linear fits . . . 82
4.13 Measured (blue) vs expected (dash red) activity with 18F-FDG . . . . 83
5.1 3D rendering of the device . . . 89
5.2 An exploded view of the detector and preamplifier assembly . . . 90
5.3 The shielding container . . . 91
5.4 Signal workflow and connection diagram . . . 92
5.5 Screenshot of the GUI . . . 93
5.6 Positioning template for the 137Cs source . . . . 94
5.7 Setup used for calibration with circulating FDG . . . 95
5.8 Setup used to extract time-activity curves during clinical PET studies . . . 96
5.9 Acquisition with a 137Cs source over 6 hours . . . . 97
5.10 Box-and-whisker plot of nineteen 3 min measurements . . . 98
5.11 Box-and-whisker plot of twenty successive repositioning of the catheter . . . 99
5.12 Step functions for different flow rates and tubing lengths . . . 100
A.7 Setup for the stability/linearity experiment I . . . 116
A.8 Setup for the sensitivity experiment II . . . 116
A.9 Acquisition of 1800 s with mean and standard deviation values . . . 117
Liste des symboles
18F-FDG ou FDG Fluorodéoxyglucose
AMD - MDA Activité Minimum Détectable - Minimum Detectable Activity
CAN - DAC Convertisseur Analogique-Numérique - Analog-to-Digital Converter
CdZnTe ou CZT Tellure de cadmium et zinc
CSA Amplificateur de charge - Charge Sensitive Amplifier
CTA - TAC Courbe Temps-Activité - Time-Activity Curve
DSP Traitement de signal numérique - Digital Signal Processing
FPGA Matrice de portes programmables - Field-Programmable Gate Array
IDIF Courbe temps-activité extraite de l’image - Image Derived Input Function
MiniDP ou mDP Mini DisplayPort
SUV Valeur de fixation normalisée - Standardized Uptake Value
TEMP - SPECT Tomographie d’émission monophotonique - Single Photon Emission
Computed Tomography
TEP - PET Tomographie d’émission par positons - Positron Emission Tomography
TPM - PMT Photomultiplicateur - Photo Multiplier Tube
A mes parents sans qui rien n’aurait été possible, A ma femme qui a traversé un
océan pour me suivre Et à mes enfants qui illuminent ma vie.
Il faut toujours se réserver le droit de rire le lendemain de ses idées de la veille.
Remerciements
Cette thèse représente une aventure humaine et scientifique riche ; prendre son envol pour un nouveau continent n’est pas une chose facile, laisser sa famille, ses amis, son tissu social et ses habitudes de vie pour l’inconnu. Mais au cours de ces six dernières années, j’ai pu grandir, mûrir et m’épanouir de nouveau à travers des rencontres passionnantes et des défis scientifiques stimulants tout en conservant les liens importants de ma vie pré-doctoral.
En premier lieu, je tiens à remercier mon directeur de thèse, Philippe Després, d’avoir mis fin à ma longue recherche de sujet de doctorat en m’acceptant comme étudiant. Philippe m’a permis d’être très autonome au cours du doctorat en me laissant une totale liberté d’orientation pour le projet. J’ai ainsi pu suivre mes propres choix et approfondir ce qui me semblait le plus opportun pour mener le projet à son terme. Cela m’a conduit à me rendre à plusieurs congrès internationaux et cela même sans présentation à effectuer, ce qui m’a donné l’occasion de mieux comprendre les enjeux du projet, et de tisser des liens scientifiques avec plusieurs groupes de recherche. Son intransigeance lors de la rédaction scientifique a contribué à l’amélioration de mes aptitudes d’écritures. Je tiens aussi à remercier mon codirecteur, Louis-André Hamel, pour m’avoir expliqué le projet avant mon départ lors de notre rencontre à Paris et pour les discussions au cours du doctorat sur le coplanaire et la collecte de charge. Je profite de l’occasion pour remercier chaleureusement l’équipe du groupe technologique de l’université de Montréal, Jean-Pierre Martin, Yanik Landry-Ducharme et Nick Starinsky. Je peux dire sans m’avancer que le prototype développé n’existerait pas sous cette forme sans la supervision de Jean-Pierre pour l’instrumentation du détecteur et pour la conception de l’électronique. Les discussions avec Jean-Pierre ont été très enrichissante et j’ai beaucoup appris grâce à lui. Je remercie aussi Yanik pour sa gentillesse, son temps pour me montrer le fonctionnement d’Altium, ses soudures magiques et bien sûr les vidéos et les pizzas sur l’heure du lunch. J’ai une pensée pour tous les étudiants du groupe de recherche qui à différents degrés ont mis de la vie au labo et égayé les longues soirées d’hivers. Au cours du temps, j’ai eu la chance de créer au sein et en dehors du labo, un cercle d’amis formidable qui j’espère perdura longtemps. Un merci particulier à ma femme pour m’avoir supporté dans mon choix de venir au Québec, pour les enfants qu’elle m’a donné. Je termine en remerciant mes amis et ma famille pour venir
Avant-propos
Ce manuscrit de thèse comporte deux articles et un compte rendu de conférence. Ce qui suit fournit des informations sur les coauteurs et leurs contributions aux documents ainsi que sur le statut de ces publications.
Chapitre 4 : Conception and characterization of a virtual coplanar grid for a 11 x 11
pixelated CZT detector
Romain Espagnet1, Andrea Frezza1, Jean-Pierre Martin2, Louis-André Hamel2, Philippe
Després1,3
1Département de physique, de génie physique et d’optique et Centre de recherche sur le cancer
de l’université Laval, Québec, QC, G1R 0A6 Canada
2Département de physique, Université de Montréal, C.P. 6128 Montréal QC, H3C 3J7 Canada
3Département de radiooncologie et Centre de recherche du CHU de Québec, CHU de Québec
-Université Laval, 11 Côte du Palais, Québec, Canada, G1R 2J6
État : Cet article est accepté pour publication dans le journal Nuclear Instrumentation
and Method Part A en date du 12 mars 2017. Il est publié en ligne avec le DOI suivant 10.1016/j.nima.2017.03.025.
Contributions : Pour cet article, j’ai développé l’électronique, les méthodes et les
pro-tocoles de mesures. J’ai également effectué les mesures, analysé les résultats et accompli la rédaction de l’article. Jean-Pierre Martin a également participé à l’élaboration de l’instrumen-tation et à l’analyse des résultats. Tous les coauteurs ont participé à l’élaboration du plan de recherche, à l’analyse des résultats et ont pris part à la révision du manuscrit.
2Department of Physics, Université de Montréal, C.P. 6128 Montréal QC, H3C 3J7 Canada
3Department of Medical Imaging and Research Center of CHU de Québec - Université Laval,
Quebec City, QC, G1R 2J6 Canada
4Department of Radiology and Nuclear medicine and Cancer Research Center, Université Laval,
Quebec City, QC, G1V 0A6 Canada
5Department of Radiation Oncology and Research Center of CHU de Québec - Université Laval,
Quebec City, QC, G1R 2J6 Canada
État : Cet article est accepté pour publication dans le journal European Journal of
Nuclear Medicine and Molecular Imaging (EJNMMI Physics) en date du 2 mai 2017. Il est
publié en ligne en date du 2 juin 2017 avec le DOI suivant 10.1186/s40658-017-0184-5.
Contributions : Pour cet article, j’ai développé les méthodes et les protocoles de mesures.
J’ai également effectué les mesures, analysé les résultats et accompli la rédaction de l’article. Tous les coauteurs ont participé à l’élaboration du plan de recherche, à l’analyse des résultats et ont pris part à la révision du manuscrit.
Approbation d’éthique et consentement pour participer Toutes les procédures
effectuées dans les études avec des participants humains étaient conformes aux normes éthiques du comité d’éthique de CHU de Québec – Université Laval. Le consentement a été obtenu de tous les participants inclus dans l’étude.
Consentement pour publication Le consentement a été obtenu de tous les participants
inclus dans l’étude d’utiliser et de publier leurs données.
Annexe A: A CdZnTe-based automated Blood Counter for Quantitative Molecular Imaging
Romain Espagnet1, Andrea Frezza1, Jean-Pierre Martin2, Louis-André Hamel2, Philippe
Després1,3
1Département de physique, de génie physique et d’optique et Centre de recherche sur le cancer
de l’université Laval, Québec, QC, G1R 0A6 Canada
2Département de physique, Université de Montréal, C.P. 6128 Montréal QC, H3C 3J7 Canada
3Département de radiooncologie et Centre de recherche du CHU de Québec, CHU de Québec
-Université Laval, 11 Côte du Palais, Québec, Canada, G1R 2J6
Etat : Cet article a été publié dans la série IFMBE Proceedings du World Congress on
Medical Physics and Biomedical Engineering, Vol. 51 : 1338-1342, Juin 2015.
pro-rédaction de l’article. Jean-Pierre Martin a également participé à l’élaboration de l’instrumen-tation et à l’analyse des résultats. Tous les coauteurs ont participé à l’élaboration du plan de recherche, à l’analyse des résultats et ont pris part à la révision du manuscrit.
Introduction
Contexte
La tomographie d’émission monophotonique (TEMP) et la tomographie d’émission par positons (TEP) sont des modalités bien établies en imagerie moléculaire. Elles offrent une étude des processus biologiques aux niveaux moléculaires et fournissent des informations sur l’apparition
et la progression des maladies avant même les apparitions structurelles ou anatomiques [2,3].
Elles consistent à injecter un radio-marqueur ayant une affinité avec un processus biologique particulier qui s’accumulera sur ces sites actifs. Actuellement, le protocole le plus souvent utilisé est une acquisition statique qui consiste à acquérir les images après l’injection lorsque le taux de fixation est considéré comme maximal, et à les interpréter de manière semi-quantitative
avec la valeur de fixation normalisée (SUV pour Standardized Uptake Value) [4–9]. Le SUV
se base sur la quantité de radio-isotope fixée dans la région d’intérêt divisée par l’activité injectée, normalisée par le poids du patient en considérant celui-ci avec une masse volumique
de 1 g ml−1 [10]. Cette construction simple en fait un outil facile à mettre en œuvre en clinique
mais limite aussi son champ d’utilisation. Il a été rapporté que les valeurs de SUV étaient dépendantes de nombreux paramètres d’acquisitions, ce qui se traduit par une grande variabilité
allant de -11% à 59% [11]. Une autre cause de variabilité du SUV est d’ordre biologique, car la
vitesse d’accumulation ainsi que la quantité accumulée dépendent du patient. Par exemple,
avec le fluorodéoxyglucose (18F-FDG), Shankar et al. ont montré que la quantité de FDG sur
les sites actifs variait toujours au bout de 45 min et que la valeur dépend du patient [12]. Ainsi,
cette approche ne permet pas la comparaison précise d’images inter/intra patients [11–17].
Une quantification plus robuste passe par l’utilisation des modèles pharmacocinétiques qui cherchent à décrire la façon dont l’organisme réagit au radio-marqueur en termes d’absorption,
de distribution, de métabolisme et d’excrétion dans le corps [18]. Ces modèles requièrent la
connaissance de la courbe temps-activité (CTA) en plus d’une acquisition TEP dite dynamique, soit des séries d’images successives le plus souvent prises immédiatement suite à l’injection. La CTA est la concentration en radio-marqueurs dans le sang en fonction du temps. Les méthodes de détermination d’une CTA sont soit une mesure indirecte basée sur des estimations dans l’image, soit une mesure directe de la concentration dans le sang. L’estimation par l’image,
méthode demande d’avoir une artère visible à l’image et les modèles associés ont souvent besoin d’une mesure directe ponctuelle de la concentration dans le sang pour obtenir une marge
d’erreur acceptable [19]. La mesure directe est le standard pour les études quantitatives [19, 21]
et s’effectue par mesure manuelle ou automatisée. La mesure directe manuelle ou ponctuelle consiste à effectuer des prélèvements sanguins à différents temps. Elle est difficile à mettre en place pour les radio-isotopes ayant une captation rapide par l’organisme et est sujette à l’erreur humaine (inversion d’échantillons, erreur de notation, temps de prélèvement approximatif). Elle pose aussi problème car elle expose inutilement le personnel hospitalier à la radiation. Des compteurs sanguins automatisés ont été développés pour simplifier, automatiser et limiter les erreurs expérimentales de mesure. Ces systèmes reposent sur le branchement du patient à l’appareil pour prendre des échantillons à des intervalles réguliers, pour prélever du sang en continu et pour mesurer l’activité en radio-marqueur dans le sang. La majorité de ces appareils
utilise un tube photomultiplicateur (TPM ) couplé à un cristal scintillant comme le BGO [22–26]
ou le GSO [27,28]. D’autres sont basés sur des photodiodes couplées à un cristal scintillant [29–
31]. Parmi ceux-ci, plusieurs sont développés pour le petit animal et se concentrent sur de
petits volumes de sang à prélever. Ils n’offrent que rarement une solution à la fois compacte et sensible et leur utilisation n’est pas toujours transposable chez l’humain pour des raisons de sensibilité, le volume de sang analysé étant trop petit. Le prototype présenté ici est basé sur un système de détection à semi-conducteur CdZnTe couplé à une pompe péristaltique pour
le prélèvement de sang en continu (figure 0.1). Le CdZnTe présente l’avantage de convertir
directement l’énergie du gamma interagissant en charge électrique mesurable tout en ayant une haute efficacité aux énergies cliniques. La gamme d’énergie détectable de 60 à 2000 keV couvre tous les radio-isotopes cliniques. Le CdZnTe est utilisable à température ambiante de façon fiable et stable dans le temps.
Objectifs
Les travaux effectués ont pour but de montrer la faisabilité d’obtenir une CTA chez l’humain à partir d’un compteur sanguin compact prélevant du sang en continu basé sur un détecteur à semi-conducteur CdZnTe.
Le premier objectif a été d’instrumenter le détecteur monolithique de CdZnTe de 6 cm3 de chez
Redlen (Redlen Technologies, Saanichton BC, Canada). Ce détecteur à anode segmentée de 121 pixels étant livré avec trois connecteurs de 46 broches, la première étape a été de réduire au maximum la quantité d’électronique et le coût d’instrumentation tout en conservant de
Figure 0.1 – Représentation avec un dessin en trois dimensions du prototype en situation typique d’utilisation.
Le second objectif a été de rassembler les éléments pour effectuer une mesure de CTA et de construire un prototype fonctionnel. Ainsi, en se basant sur le détecteur à anode virtuelle, un prototype capable de mesurer une CTA en imagerie TEP chez l’humain a été développé. Un sous-objectif était de caractériser ce prototype tant au niveau de la robustesse dans le temps que de la répétabilité des mesures. Puis un second sous-objectif était de l’éprouver en situation
clinique. Dans le chapitre 5sont présentés les divers éléments du prototype, sa caractérisation
et la mesure d’une CTA en condition clinique.
Les éléments théoriques liés au développement de ce prototype seront présentés dans un chapitre introductif à l’imagerie moléculaire et à la quantification en tomographie d’émission par positons. Puis dans un deuxième chapitre, après avoir exposé des notions théoriques relatives au détecteur, le compte rendu des étapes du traitement de signal tout au long de la chaîne d’acquisition sera fait en prenant l’exemple concret d’un photon interagissant dans le prototype développé. Ensuite, un chapitre présentera les principales évolutions du prototype
pendant le projet. Les deux derniers chapitres (4 et5) caractérisent la version finale tant du
détecteur que du prototype et présentent son utilisation dans des cas cliniques. Le chapitre 4
décrira l’exploration du fonctionnement de la grille virtuelle coplanaire (vCPG) en abordant la compensation de la recombinaison des électrons dans le cristal et en déterminant les tensions optimales de cathode et de polarisation des anodes ainsi que les coefficients de pondérations
énergie, efficacité intrinsèque, activité minimum détectable (AMD), linéarité, stabilité et plage
d’activité du détecteur). Le chapitre 5 se concentrera sur le design général du prototype
et la description des composants ainsi que leur utilisation. Il présentera la robustesse d’une acquisition (mesure répétée) et la détermination en condition clinique d’une CTA. La conclusion sera une synthèse des réussites liées au projet, notamment sur la mise en place de la grille virtuelle coplanaire et la mesure concluante d’une courbe temps-activité avec le prototype construit. En prenant cette première mesure comme référence, des pistes seront proposées pour ajuster/améliorer les performances du système. Les perspectives d’avenir du prototype en tomographie monophotonique ou chez le petit animal seront évoquées.
Chapitre 1
Imagerie moléculaire et analyse
quantitative
Ce chapitre est une brève introduction à l’imagerie moléculaire quantitative. Le but est de montrer la nécessité du développement d’outils déterminant la courbe temps-activité afin d’obtenir une quantification absolue permettant de faire des études intra/inter patients. Deux sources majeures distinctes viennent fausser cette quantification, l’une, d’ordre technologique, concerne la difficulté d’obtenir un rendu précis de la distribution du radio-marqueur à l’image et la seconde est d’ordre biologique, c’est la réponse unique de chaque organisme à l’injection du radio-marqueur. En prenant l’exemple de la TEP, les étapes assurant une proportionnalité entre l’activité dans le patient et l’image seront présentées. Puis dans une seconde section les biais d’ordre biologique intra/inter patients seront introduits. Ces biais biologiques conduisent au développement de techniques d’analyses quantitatives basées sur des modèles pharmaco-cinétiques. Ces techniques seront présentées dans la troisième section qui abordera aussi les outils mis en place pour la caractérisation de la courbe temps-activité essentielle à l’utilisation de ces modèles.
Introduction
L’imagerie moderne se définit comme un ensemble de techniques utilisant divers processus physiques comme l’absorption des rayons X, la résonance magnétique nucléaire, la réflexion d’ondes ou la radioactivité afin d’acquérir un rendu anatomique, physiologique ou métabolique du corps humain en deux ou trois dimensions via un jeu d’images. L’imagerie nucléaire, une modalité dite d’émission, se différencie des autres du fait qu’elle n’est pas externe, dans le sens où les particules ne sont pas récoltées après avoir subi un passage au travers du patient mais elles sont émises depuis le patient lui-même. Aussi appelée imagerie fonctionnelle ou moléculaire du fait qu’elle cible un mécanisme métabolique particulier, cette modalité occupe une place de
L’imagerie moléculaire consiste à administrer un radio-isotope dénommé radio-marqueur via une molécule de support qui aura des affinités avec un processus biologique particulier. En d’autres termes, la molécule porteuse du radio-isotope se fixe dans des régions du corps où des réactions chimiques nécessitent la présence de cette molécule. Plus la métabolisation est active, donc plus le nombre de réactions chimiques est important, plus le nombre de radio-isotopes dans cette région sera important. Le radio-isotope est choisi en imagerie moléculaire pour émettre une particule (gamma ou positon) qui, détectée, donne ainsi une localisation de la molécule de support. Le dénombrement de ces emplacements donne une bio-distribution du radio-marqueur dans le corps et fournit ainsi des indices sur l’activité du processus biologique observé.
La TEMP et la TEP sont utilisées pour dénombrer ces particules et construire une image. En combinant par reconstruction tomographique plusieurs projections prises sous différents angles autour du patient, une distribution volumique du radio-marqueur est obtenue. Cette image représente alors l’activité métabolique du processus biologique observé.
1.1
La tomographie d’émission par positons
La caméra TEP se compose de plusieurs anneaux de détecteurs coaxiaux au centre desquels le
patient est placé [37]. Dans ce cas-ci, le marqueur injecté émet un positon qui s’annihile avec
un électron en deux gammas de 511 keV émis à environ 180° l’un de l’autre. Les détecteurs
de l’anneau enregistrent ces événements et donnent une ligne de réponse (figure 1.1).
L’ac-cumulation de ces lignes de réponse fourni l’information à un algorithme de reconstruction pour obtenir une image en trois dimensions du radio-marqueur dans le patient. La dernière génération de TEP dite temps de vol est capable de donner une probabilité à la position de
l’événement sur la ligne de réponse [38, 39]. Ceci améliore le ratio contraste à bruit de l’image,
Figure 1.1 – Probabilité du lieu de création de l’annihilation du positon en fonction de la prise en compte ou non de l’information temporelle. La ligne orange schématise une ligne de réponse, r représente le rayon de l’anneau du TEP, x la distance entre l’événement et le croisement de la ligne de réponse avec son axe perpendiculaire passant par le centre des anneaux.
Néanmoins, des phénomènes physiques perturbent la détection de ces lignes de réponses et biaisent la quantification de l’image. Ainsi, il est nécessaire de prendre en compte le temps mort des détecteurs et de procéder à des corrections pour les coïncidences fortuites, l’atténuation et la diffusion des gammas, les effets de volume partiel et les mouvements du patient pour obtenir
un meilleur rendu de la réalité de détection [18,20].
— Coïncidences fortuites : Il arrive que le circuit de coïncidence détecte deux gammas ne provenant pas du même β+. Le taux de déclenchement fortuit varie avec le carré
de l’activité en radio-marqueur et il est relativement uniforme [18]. Une des méthodes
utilisées pour corriger ces détections consiste à faire l’estimé du nombre de coïncidences fortuites à partir du nombre de photons détectés hors coïncidence sur les deux détecteurs
dans un laps de temps donné [18].
— Atténuation : Les photons subissent une atténuation en traversant la matière. La
probabilité de détection est donnée par p = e−Rd
0 µ(x)dx où d est l’épaisseur du milieu
traversé, µ(x) le coefficient d’atténuation au point x dans le milieu. Cette atténuation est corrigée par l’utilisation de la cartographie des atténuations dans le patient créée avec les données tomodensitométriques qui relient le µ(x) et l’échelle de Hounsfield à
l’énergie utilisée pour la tomodensitométrie [18,20,40–42].
Figure 1.2 – Résumé des types d’événements qui peuvent se produire sur un anneau TEP. En (a) une vraie coïncidence, en (b) une coïncidence fortuite, en (c) une coïncidence avec un photon diffusé et en (d) il n’y a pas de coïncidence.
quantité de diffusés peut atteindre 50% des événements comptés. Plusieurs méthodes sont disponibles pour compenser la diffusion et devraient être systématiquement mises en
œuvre [10]. Une des compensations est la mise en place de plusieurs fenêtres en énergie
qui permet d’estimer la distribution des diffusés. Une autre méthode est l’estimation
du diffusé par des modèles basés sur des simulations Monte-Carlo [43–46] ou sur les
données tomodensitométriques [18,20,40,41].
— Effets de volume partiel : C’est la conséquence d’une limitation de la résolution spatiale vis-à-vis des petites structures (de taille deux à trois fois inférieure à la résolution spatiale). L’effet induit une sous-estimation de la concentration en marqueur au niveau des petites structures et une surestimation dans leur région périphérique. Une méthode simple de correction consiste à utiliser un facteur correctif dépendant de la taille de la zone à observer. Ce facteur est déterminé à partir d’un fantôme rempli de sphères de
mouvement sont corrigés via des systèmes de suivis externes [48,49].
Une image en trois dimensions de la bio-distribution du traceur dans la région d’intérêt est
alors obtenue en comptes s−1cm−3. En considérant comme parfaitement exécutées toutes
les corrections citées précédemment et illustrées à la figure 1.2, l’intensité de chaque voxel
de l’image reconstruite est proportionnelle à la quantité de radio-marqueur dans le volume correspondant. Pour obtenir ce facteur de proportionnalité, un étalonnage du TEP avec une source à activité volumique connue est effectué. Ainsi, en divisant la valeur de l’image par ce
facteur, les images calibrées donnent une activité par voxel en kBq cm−3 [18].
1.2
L’évolution du radio-marqueur dans le patient au cours du
temps
Le protocole classique en TEP est un protocole d’acquisition statique, c’est-à-dire que l’ac-quisition se fait après un certain temps pour attendre que l’accumulation du radio-marqueur dans les régions d’intérêt soit maximale et la plus stable possible. Il s’oppose au protocole d’acquisition dynamique qui consiste à effectuer des séries d’images consécutives et le plus
souvent simultanément à l’injection comme illustré à la figure 1.3. Néanmoins, en plus des
biais associés à l’acquisition de l’image, il y a aussi des différences biologiques notables entre les patients vis-à-vis de l’accumulation du radio-marqueur.
L’étude du sort d’un produit dans le corps se fait en trois phases. La première est l’administration du produit et sa libération dans le corps, c’est la phase dite galénique. La seconde est dite
pharmacocinétique, c’est-à-dire qu’elle étudie l’absorption, la distribution, la métabolisation et
l’élimination du produit, soit tout ce qui se rapporte au déplacement et aux mécanismes du produit dans le corps. La troisième est la phase dite pharmacodynamique, c’est-à-dire celle qui étudie l’activité du produit sur le corps. Chacune de ces phases comporte des éléments pouvant amener à une variabilité inter individu de l’accumulation. Lors de l’injection du radio-marqueur, il est possible de noter des différences notables dans le temps de mise à disposition du produit pour le système cardio-vasculaire. Il n’est pas rare de voir le radio-marqueur s’attacher à la veine d’injection et ainsi retarder l’entrée de celui-ci. Ensuite vient la deuxième phase. Dans ce cas, avec une administration par injection, il n’y a pas d’absorption puisque le produit est déjà présent dans le système cardio-vasculaire. Les temps de distribution du produit dans le corps varient d’un patient à l’autre. La métabolisation, qui est l’élément à quantifier au cours de l’acquisition TEP, peut aussi être biaisée par des fixations dans d’autres sites non-désirés ou encore être en concurrence avec la molécule normalement présente dans le corps. Par exemple pour le FDG, du glucose est déjà présent dans le corps et il a autant de chance d’être capté que l’analogue injecté. Le dernier élément est l’élimination du produit du corps. Il est souhaitable à des fins d’imagerie qu’elle se produise le plus tard possible pour conserver l’accumulation
Figure 1.3 – La TEP statique est la plus utilisée en clinique, l’acquisition se fait une fois que la fixation du radio-marqueur est supposée à son maximum. La TEP dynamique commence avec l’injection du radio-marqueur sur la table et comporte une séquence de plusieurs acquisitions d’images suite à l’injection.
l’image et le couple molécule vectrice/radio-traceur doit avoir le moins d’effet possible sur le patient, l’injection n’ayant pas un but thérapeutique.
Ainsi, l’appareil de mesure n’est pas la seule source d’erreur en TEP. Le parcours biologique de la molécule injectée contribue aussi à ajouter des incertitudes sur la quantification de l’image. En d’autres termes, les corrections physiques faites lors de la reconstruction d’image corrigent l’image en elle-même en permettant de la quantifier pour un usage qualitatif et quantitatif tandis que la prise en compte des éléments biologiques permet d’obtenir la quantification de l’image pour un usage ultérieur entre images provenant d’injections différentes.
1.3
L’analyse quantitative
comparaison de l’accumulation dans le temps au sein de différents volumes de l’image. Cette utilisation concerne principalement les caméras gamma comme par exemple pour le diagnostic de l’algodystrophie où la vascularisation des deux pieds est comparée ou encore pour étudier la fonction rénale, un déséquilibre dans l’image indiquant un dysfonctionnement de l’un des deux. Néanmoins la non-prise en compte des biais biologiques limite les possibilités d’utilisation de cette image. Des méthodes de quantification intégrant l’évolution biologique du radio-marqueur sont mises en place pour obtenir une référence quantitative commune aux examens TEP. Ces méthodes de quantification sont dites absolues. Le but est d’avoir une quantification assez fiable pour effectuer des études intra et inter patients, voire même sur différents modèles d’appareil ou encore entre plusieurs centres hospitaliers. Pour cela, la cinétique du radio-marqueur est étudiée afin de pouvoir la modéliser. La répartition spatiale d’un radio-marqueur dans le corps varie dans le temps. Elle dépend d’un certain nombre de paramètres tel que son site d’injection et son extraction du système vasculaire, des liaisons à des récepteurs à la surface cellulaire, de la diffusion ou du transport dans les cellules, du métabolisme, de l’épuration des tissus et de l’élimination par l’organisme. Ainsi, l’intervalle de temps entre l’injection et l’imagerie doit être soigneusement choisi de sorte que les images reflètent le processus biologique d’intérêt, la composante temporelle étant très importante dans les études quantitatives en médecine nucléaire.
1.3.1 Modèle compartimental
Les modèles dits compartimentaux ont été développés pour disposer d’un outil donnant une échelle quantitative commune à toutes les images de patients, à tous les examens et à tous les modèles de TEMP ou TEP. Il s’agit d’établir un modèle régissant les échanges dans le corps en le considérant comme un nombre fini de blocs successifs homogènes. Les blocs, appelés des compartiments, ont une cinétique uniforme et discernable de transport
et/ou de transformation [50]. Les échanges inter-compartiments sont décrits par des équations
différentielles [51]. L’établissement de ces équations différentielles se fait en prenant en compte
les conditions initiales, des variables telles que la taille des structures compartimentées, les taux de transfert et/ou les taux de métabolisation et d’élimination. Le modèle compartimental doit permettre de simuler et de prédire les taux circulants pour une dose initiale donnée. Exemple d’un modèle à trois compartiments
En médecine nucléaire, le nombre de compartiments modélisé n’excède que rarement trois ou
quatre [18]. L’augmentation du nombre de compartiments demande de caractériser trop de
paramètres expérimentaux et complexifie d’autant l’acquisition.
La figure1.4 montre la mise en place d’un modèle à trois compartiments avec les blocs et les
Figure 1.4 – Exemple à trois compartiments, la courbe temps-activité (CTA) en rouge correspond à la concentration dans le compartiment A et la courbe de réponse des tissus en
bleu pointillé est donnée par l’image TEP. La constante k4 est le plus souvent négligée [18].
(Adapté de Simon R Cherry, James A. Sorenson, and Michael Phelps. Physics in Nuclear Medicine. Elsevier, fourth edition, 2012.)
C, la concentration en radio-marqueur dans A est donnée par CA(t). Ainsi la variation de la
concentration en B se définit comme ce qui entre dans le compartiment moins ce qui en sort. Dans ce cas-ci, la concentration est décrite par l’équation suivante :
dCB(t)
dt = Φentrant− Φsortant. (1.1) En médecine nucléaire, la plupart des modèles ne considèrent que le premier ordre des constantes d’échange décrivant les transferts entre les compartiments. Ce transfert est donc modélisé
comme kjCi(t) où j exprime l’entrée ou la sortie et i est le compartiment d’origine. Ainsi pour
ce modèle à trois compartiments, le système d’équations est donné par : CA(t) dCB(t) dt = k1CA(t) − k2CB(t) − k3CB(t) + k4CC(t) dCC(t) dt = k3CB(t) − k4CC(t) (1.2)
où k1, k2, k3, k4 sont les constantes de transfert entre les compartiments et CA, CB, CC sont
les concentrations dans les compartiments A, B et C. Il en ressort que pour résoudre ce système, il est nécessaire de connaître la réponse des tissus, la concentration en radio-marqueurs dans le
La valeur de fixation normalisée (SUV pour Standard Uptake Value)
Actuellement, en clinique, la solution la plus répandue est une solution à l’équilibre, c’est-à-dire sur une acquisition statique faisant un cliché instantané du système à un temps δt.
Pour simplifier le système d’équations les hypothèses suivantes sont posées :
— les échanges entre les compartiments sont à l’équilibre : les concentrations des comparti-ments ne changent plus,
— la fixation du marqueur est irréversible,
— la fixation ne se produit que sur les cibles spécifiques.
Le SUV se définit donc comme la normalisation de la quantité de radio-marqueur fixée dans la
région d’intérêt par l’activité injectée sur la masse du patient [10], ce qui donne :
SUV = AROI
D/M (1.3)
où AROI est l’activité mesurée dans le tissu d’intérêt en kBq ml−1 provenant de l’image TEP,
D est l’activité injectée en kBq et M est la masse du patient en gramme. La masse volumique
du patient est approximée à 1 g ml−1 ce qui fait que le SUV n’a pas d’unités. Ensuite la lecture
de l’image se fait par une comparaison à une région de référence Aref, ce qui amène à obtenir
un SUV donné par :
SUV = AROI/Aref
D/M . (1.4)
Ainsi une distribution du radio-marqueur parfaite dans tout le volume du patient donnera un SUV de un en tout voxel et une sur-fixation de celui-ci dans une zone particulière augmentera significativement le SUV.
De nombreuses tentatives ont été effectuées pour standardiser le SUV afin qu’il remplisse les objectifs de la quantification absolue, à savoir pour rappel, de permettre des études comparatives
au cours du temps intra et inter patients [4–9,12].
Or le SUV est tributaire des approximations qui en font un outil simple :
— l’équilibre d’échange inter-compartiment n’est pas toujours atteint au moment de
l’image [12],
— le corps débute une élimination du marqueur, induisant une perte de signal [18,20],
— la dose injectée n’est connue qu’à 5 ou 10% près [6],
— la masse du patient comporte aussi une incertitude, son poids n’est pas toujours repris juste avant l’examen TEP,
— la valeur normalisée dépend du volume de fixation [6].
Globalement, le SUV reste la photographie d’une situation à un temps t et il échoue dans de nombreux cas dans la recherche de son objectif, qui est de quantifier pour permettre des études
intra/inter patients [11,14–17]. Doot et al. en comparant plusieurs scanners TEP entre eux
et ces mêmes scanners sur six mois ont obtenu des différences significatives [11]. En effet, des
différences de SUV de l’ordre de -11 à 59% ont été mesurées dans le temps pour un même appareil. Néanmoins la facilité de mise en place et son contrôle à petite échelle font qu’il reste la norme de la quantification en TEP.
Pour rendre plus fiable la quantification, il faut donc se tourner vers d’autres types de solutions
du système d’équations 1.2et notamment celles hors équilibre.
Image dynamique et solution hors équilibre
Le SUV ne prend pas assez en compte les biais biologiques. Pour aller plus loin et prendre en compte les différences inter-compartiments, il faut effectuer une acquisition TEP dynamique
simultanée à l’injection. Le système d’équations 1.2 peut alors être résolu soit par solution
exacte qui demande l’identification de tous les paramètres ou par des solutions approchées qui requièrent seulement quelques paramètres principaux. La solution exacte est rarement exécutée dans un contexte clinique en raison de son haut niveau d’exigences (des protocoles d’imagerie dynamique longs, une évaluation de la courbe temps-activité artérielle et un logiciel pour utiliser
les données mesurées avec un modèle cinétique) [10,18]. Plusieurs solutions approchées ont été
développées et requièrent un protocole d’acquisition TEP plus simple [52–54]. Dans tous les
cas, il est nécessaire d’obtenir la courbe temps-activité dans le sang ou le plasma pendant que l’imagerie TEP donne la cinétique associée à la région d’intérêt. Suivant la molécule injectée, le modèle est alors adapté en fonction des connaissances biochimiques associées à celle-ci. La forme standard de la solution analytique du système d’équation est une somme d’exponen-tielles. Ainsi la concentration s’exprime comme suit :
CB(t) = C1exp (−αt) + C2exp (−βt) + ... (1.5)
où C1, C2, α et β sont des constantes à déterminer.
Cette différenciation est par exemple modélisée dans le cas du modèle à trois compartiments
de la figure 1.4par la constante k4. Deux approches différentes sont utilisées pour déterminer
la CTA. La première consiste à l’extraire de l’image par analyse numérique et la seconde, qui est le standard actuel, consiste à faire une mesure de l’activité en radio-marqueur présente
dans un volume de sang extrait [19,54].
Mesure dérivée de l’image
Les méthodes numériques d’extraction de la courbe temps-activité à partir des images TEP (IDIF pour Image Derived Input Function) sont de plus en plus développées afin d’améliorer la quantification sans augmenter la complexité de l’acquisition TEP. Ces méthodes recherchent et isolent dans l’image des pixels correspondant à un volume de sang dans le patient. À partir de ce volume segmenté, les valeurs de ces pixels sont utilisées pour obtenir une mesure de la concentration de l’activité dans le sang et donc une estimation de la courbe temps-activité en assumant que la différence de concentration entre le sang et le plasma est petite. Cette approximation et l’incapacité à différencier les métabolites du traceur disponible à la captation font que ces méthodes fonctionnent seulement pour quelques traceurs ne générant pas de
métabolites comme le 18F-FDG [19, 54]. Mais dans les faits, même pour ces traceurs, il est
nécessaire d’avoir un gros volume de sang visible à l’image comme le coeur [55], des segments
d’aorte [56], ou l’artère fémorale [57] ou encore la carotide dans le cas de cerveaux [58]. Mais
là encore, cette technique est limitée par les effets de volume partiel et par le rapport signal sur bruit du volume de sang choisi dans l’image. En effet, pour certains marqueurs comme
le [18F]-FMPEP-d2, le [11C]-MePPEP, le [11C]-DASB ou le [18F]-SP203, les tissus entourant
ce volume ont une absorption précoce importante qui affecte la visibilité de l’artère dans
l’image [19]. De plus, ces techniques sont d’autant plus sensibles aux corrections effectuées
pour obtenir l’image TEP comme les effets de volumes partiels et les artefacts de mouvement
qu’elles utilisent la segmentation de petits volumes [54].
Ces méthodes ne permettent pas d’obtenir la forme complète de la fonction d’entrée, ce qui limite l’utilisation des approches graphiques comme la méthode de Patlack ou de Logan qui ont
besoin de la forme exacte la courbe [52–54]. Pour une description plus poussée des méthodes
numériques mises en œuvre, une revue des diverses méthodes a été effectuée par Zanotti et
al. [19]. La simplicité de mise en place d’une CTA dérivée de l’image laissait présager un
déploiement rapide des méthodes indirectes et pourtant, malgré un grand nombre de modèles développés, seuls de rares centres les utilisent cliniquement pour la quantification et surtout pour les TEP de cerveaux. Ceci s’explique par le fait qu’un prélèvement reste nécessaire pour
Mesure par extraction de sang
La prise de mesure directe de la concentration du radio-marqueur dans le sang par extraction est
considérée comme le standard pour obtenir la fonction d’entrée [19, 21]. Elle permet d’obtenir
de manière fiable la valeur de la concentration dans le sang et offre la possibilité de réaliser d’autres analyses une fois le sang prélevé au patient. Pour effectuer cette mesure directe, trois méthodes peuvent être employées : l’échantillonnage manuel, l’échantillonnage automatique à l’aide d’une tubulure et la mesure automatique en continu du sang circulant dans une tubulure. La principale difficulté de ces techniques est d’obtenir une résolution temporelle n’influençant pas la quantification.
Dans le cas des échantillonnages manuels, la résolution est limitée par le nombre d’échantillons réalisables par minute. Le personnel clinique devant intervenir sur le patient, placer un tube de prélèvement, prélever, étiqueter, ranger, noter le temps de prélèvement, changer de tube et recommencer la manipulation, de nombreuses sources d’erreur peuvent survenir dans ces étapes. C’est sans compter le temps nécessaire et l’inutile exposition du personnel hospitalier à la radiation pour n’obtenir au final que quelques tubes à analyser. La procédure d’acquisition s’alourdissant, des systèmes d’échantillonnages automatiques ont été développés pour limiter
les risques d’erreurs et alléger les protocoles [59–63]. Ils consistent à poser une tubulure sur
une artère ou une veine et, à l’aide d’une pompe, à extraire le sang. Bien que plus avantageux que la prise de mesure manuelle, ils sont encore limités par le nombre d’échantillons effectués par minute et un nouveau biais est ajouté avec l’acheminement du sang jusqu’au système d’échantillonnage, le radio-marqueur se dispersant dans la tubulure. L’aire sous la CTA se trouve alors sous-évaluée par l’espacement entre les points de mesures et par la dispersion dans la tubulure acheminant le sang. Pour diminuer le biais introduit par le sous-échantillonnage, des détecteurs ont été ajoutés sur la tubulure pour faire des compteurs sanguins automatisés mesurant en continu la concentration en radio-marqueur dans le sang. Ils sont principalement
limités par la difficulté de mesurer l’activité dans le sang sans dispersion temporelle [64–66].
Votaw et al. ont reporté que des dispersions temporelles de 1,3 s et 10 s contribuaient pour 0.3% et 33% dans l’erreur sur la mesure de l’activité en radio-marqueur ce qui est conforme
à ce que Iida et al. avaient montré [24,64]. La dispersion peut être réduite en minimisant la
distance entre le patient et le détecteur, en réduisant le diamètre interne et en choisissant adéquatement la composition de la tubulure, et en augmentant la vitesse de prélèvement. Une fois ces paramètres optimisés, la dispersion se corrige selon deux méthodes différentes, soit par
Ils permettent d’avoir de plus gros volumes de sang pour augmenter la sensibilité du système. Néanmoins ils sont plus susceptibles d’être affectés par le bruit de fond provenant de la salle et du patient et ils requièrent donc un blindage en plomb ou tungstène. Les compteurs basés sur la détection des positons ont comme avantage de n’être qu’assez peu sensibles aux gammas ambiants et offrent une grande sensibilité et la possibilité d’utiliser de très petits volumes de sang, ce qui est essentiel pour les études chez la souris ou le rat.
Compteurs basés sur la détection des gammas
Tous les compteurs développés jusqu’ici utilisent des cristaux scintillants (BGO [23–26],
LYSO [31, 67, 68] ou GSO [27, 28] et leurs dérivés). Le tableau 2.1 montre les propriétés
pour plusieurs cristaux scintillants et semi-conducteurs.
Eriksson et al. ont opté pour un cristal de BGO de 45 × 45 × 45 mm3 couplé à un tube
photomultiplicateur Hamamatsu R1534 [23]. Schématisé à la figure 1.5, le compteur a un
blindage d’environ 6 cm autour du cristal. Ils obtiennent une résolution en énergie de l’ordre
de 20% à 511 keV, une limite de détection de 370 Bq ml−1 et un temps mort de 3,4 µs avec un
seuil à 350 keV.
Figure 1.5 – Schéma du compteur sanguin développé par Eriksson et al. [23].
Votaw et Shulman proposent un compteur contenant deux cristaux de 25 × 25 × 50 mm3 de
BGO utilisés en coïncidence avec un blindage de plomb de 1,6 cm [24]. Ils obtiennent une
sensibilité de 7,3 cps/(kBq ml−1) avec un seuil à 350 keV. Représenté par un dessin technique
à la figure1.6, le compteur assemblé, cristaux, TPM et amplificateur, occupe un volume de
12 × 12 × 22 mm3. Le volume détectable est de 110 µl mais ce compteur n’est pas automatisé,
Figure 1.6 – Dessin technique du compteur sanguin développé par Votaw et Shulman et
al. [24].
Boellaard et al. ont mis au point un échantillonneur de sang automatique (Fig.1.7) comportant
une unité de détection, une pompe avec un dispositif de détection d’écoulement et une unité
de récupération de déchets [25]. Ils utilisent comme système de détection un cristal de BGO
avec un diamètre de 6 cm par 6 cm d’épaisseur couplé à un tube photomultiplicateur et il est
blindé avec 6 cm de plomb. La sensibilité de leur appareil est de 23 cps/(kBq ml−1) avec une
Figure 1.7 – Photo du compteur sanguin développé par Boellaard et al. [25].
Laymon et al. ont développé un système radio-chromatographique appelé Posi-RAM constitué
d’un module de commande et d’un module de détection (Fig. 1.8) [26]. Celui-ci comprend deux
cylindres de 2,5 cm de diamètre par 2,5 cm de longueur de BGO utilisés en coïncidence et un
blindage. La sensibilité est de 11 cps/(kBq ml−1) pour une fenêtre de 400 à 1360 keV [26]. Le
Figure 1.8 – Photo du compteur sanguin développé par Laymon et al. [26].
Breuer et al. ont mis au point une unité de détection avec deux blocs de LSO faisant
50 × 40 × 30 mm3 chacun couplés à deux photodiodes à avalanche (APD) Hamamatsu
S8664-1010LC [31]. Montrés à la figure1.9, ces détecteurs sont blindés avec 40 mm de polymère de
tungstène sur les parties face au patient et par 20 mm sur les côtés. Le volume du système de
détection fait 16,9 × 14,3 × 12,2 cm3 pour un poids total de 12,8 kg. La résolution en énergie est
de 22% à 511 keV avec une efficacité de 18,5%. Les auteurs rapportent une grande dépendance à la température et ils maintiennent le système à 18 degrés Celsius.
Figure 1.9 – Photo du compteur sanguin développé par Breuer et al. [31].
Roehrbacher et al. ont développé un compteur automatisé effectuant des échantillonnages
discrets pour le petit animal représenté à la figure 1.10 [67]. Il comporte deux cristaux
cylindriques de LYSO d’un diamètre de 25,4 mm pour une épaisseur de 25,4 mm utilisés en coïncidence et deux TPM. Un anneau de blindage de 17 mm en plomb entoure les cristaux. Les auteurs rapportent une résolution en énergie à 662 keV de 23% et une efficacité absolue de 6.5 % en utilisant une fenêtre allant de 415 à 680 keV. Le débit de la pompe péristaltique est
ajustable entre 10 à 5400 µl min−1 pour un volume détectable de 33,4 µl.
Figure 1.10 – Compteur sanguin développé par Roehrbacher et al. [67].
La compagnie Swisstrace (Swisstrace GmbH, Menzingen, Suisse) a développé l’appareil twilite
II [69]. Illustré dans la figure1.11, il comporte un système de détection de 80 × 62 × 56 mm3
avec un poids d’approximativement 6 kg. Il est basé sur deux cristaux de LYSO encapsulés dans
Figure 1.11 – Photo du compteur sanguin développé par la compagnie Swisstrace et al. [69].
Compteurs basés sur la détection des positons
Yamamoto et al. utilisent un système de détection mixte en utilisant à la fois les gammas
et les positons [28]. Le système de détection fait 40 × 40 × 80 mm3 comprenant 4 cristaux de
GSO avec deux dopages différents. Les deux plus proches de la tubulure, épais de 0,5 mm, sont utilisés pour la détection des positons et les deux autres sont utilisés pour rejeter la détection
de gamma grâce à la différence de temps de montée des signaux. La sensibilité pour du 18F
est de 8,6% et de 24% pour 11C. Le seuil d’utilisation est placé à 80 keV. Le système complet,
Figure 1.12 – Photos du compteur sanguin développé par Yamamoto et al. [28].
Convert et al. proposent un compteur de positons, exposé dans la figure 1.13, avec un système
micro-fluidique de type lab-on-chip [30]. Une photodiode de 16 × 2 mm2 fait office de détecteur.
Un blindage d’environ 13 mm de tungstène est mis en place. L’efficacité absolue obtenue est de
39% pour du18F.
Figure 1.13 – Photos du compteur sanguin développé par Convert et al. [30].
Un tableau récapitulatif se situe au chapitre 5et est reproduit ici dans la table 1.1 [70], il met
Table 1.1 – Comparaison des compteurs sanguins [1].
Detector Technical characteristics
Type Size1 Number Shielding β+/γ Sensitivity (18F) MDA (18F) Absolute Efficiency Energy Time Energy
(mm) (mm), material (cps/(kBq/mL) (kBq/mL) (%) window drift resolution This work CZT 20x20x15 1 30, W γ 7.1 2.5 10,5 %at 511 keV 110-1050 keV <0.05% /h 8 %at 662 keV Eriksson et al. [23] BGO/PMT 45x45x45 1 60, Pb γ 25.5 0.37 - 350-650 keV <1% 20 % Votaw and Shulman[24] BGO/PMT 50x25x25 2 16, Pb γ 7.3 - 6,9 %at 511 keV >350 keV - -Boellaard et al. [25] BGO/PMT D=60 L=60 1 60, Pb γ 23 - - 30 %of 511 keV <3% /h -Kudomi et al. [27] GSO/PMT 20x20x12.9 4 20, Pb γ >2.6 - 6,2 %at 511 keV >450 keV - 11 %at 511 keV Twilite II (swisstrace)[69] LYSO - 2 - γ 2.4 - - - - -Laymon et al. [26] BGO/PMT D=25 L=25 2 - γ 11 (15O) - 19% at 511 keV 400-1360 keV <0.6%
-Breuer et al. [31] LSO/APD 50x40x30 2 40, W γ - - 18,5 %at 511 keV 350-1000 keV <1% 22 %at 511 keV Yamamoto et al. [28] GSO/PMT 10x20x0.5 4 4, W β+/γ - - 8.6% (18F) >80 keV - 18,5 %at 511 keV
Convert et al. [29] Si photodiode 30x3 1 <13, W β+ - 23 7.1% (18F) - -
-Convert et al. [30] Si photodiode 16x2 1 - β+ - 23-51 39% (18F) - -
-Roehrbacher et al. [67] LYSO/PMT D=25 L=25 2 17, Pb γ - 3.7 6.5% (18F) 415-680 keV - 23%
1for cylindrincal detector, D=diameter, L=length
Conclusion
Le SUV est utilisé quotidiennement en clinique en raison de sa mise en œuvre simple et malgré la prise en compte limitée des spécificités liées au patient. Des protocoles d’acquisition dynamique, plus complexes, peuvent réduire les erreurs et augmenter la qualité de la quantification. Ils requièrent, dans la plupart des situations, la détermination de la concentration du radio-marqueur dans le sang, la CTA, afin de résoudre le système d’équation. L’aspect invasif ne semble pas pouvoir être évité dans la majorité des cas pour obtenir une quantification fiable,
même pour les modèles basés sur l’image [19, 54]. Néanmoins, Everett et al. ont montré qu’un
prélèvement de 117 à 137 ml avec une canule artérielle radiale pendant un examen TEP n’avait
pas d’effet néfaste sur le patient [71]. Seules deux complications mineures ont été recensées sur
plus de 3000 patients [19].
Le projet de doctorat s’inscrit dans la recherche de l’amélioration de la quantification en imagerie moléculaire en développant un compteur automatisé basé sur la détection de gammas.
Montré dans la figure 1.14avec un aperçu de l’interface graphique, le compteur est décrit
en détail dans le chapitre5 et résumé ici. Le système développé se démarque des précédents
compteurs par l’utilisation d’un semi-conducteur pour la détection des gammas. Le système
de détection est basé sur un cristal de CdZnTe de 20 × 20 × 15 mm3 placé dans un boîtier en
aluminium de 27 × 67 × 37 mm3 entouré d’un blindage de 10 à 35 mm de tungstène suivant
l’orientation. Le prototype construit occupe un volume total d’environ 36 × 29 × 15 cm3 pour
un poids de près de 10 kg. Le seuil d’utilisation est placé à 70 keV donnant une efficacité intrinsèque de 34% et une résolution en énergie de 8% à 511 keV. La sensibilité du prototype a été évaluée à 7,1 cps/(kBq/ml) avec une activité minimum détectable de 2,5 kBq/ml pour le
18F. Le débit de la pompe péristaltique est ajustable de 17 à 7300 µl min−1 suivant la taille de
(a) compteur gamma (b) Interface Utilisateur Figure 1.14 – Système développé avec son interface utilisateur.
Chapitre 2
Système de détection
Introduction
La construction d’un prototype fonctionnel pour la caractérisation de la courbe temps-activité passe par le développement d’un système de détection. Dans le cadre de ces travaux de doctorat, il a été choisi d’élaborer le système de détection en partant d’un cristal semi-conducteur de la famille des II-VI disponible dans le commerce et de concevoir l’électronique pour le traitement du signal. Le détecteur commercial choisi est un cristal de tellurure de cadmium de zinc
monolithique avec des électrodes pixelisées en 121 pixels et d’un volume de 20 × 20 × 15 mm3
vendu par la compagnie Redlen [72]. Le choix d’un semiconducteur pour cette application
est inédit comme le montrent les exemples et le tableau comparatif 1.1de la section1.3.3du
chapitre 1. Le CdZnTe présente l’avantage de pouvoir être utilisé à température ambiante par
rapport au germanium ou au silicium et d’être indépendant de la température contrairement aux cristaux scintillants ou aux photodiodes à avalanche utilisées dans les systèmes existants. De plus, les semi-conducteurs convertissent directement en signaux électriques l’énergie déposée lors d’une interaction. Ce dépôt d’énergie crée un grand nombre de paires électrons-trous, qui, mesuré, donne l’énergie déposée lors de l’interaction avec une grande résolution. Ce détecteur est donc surtout destiné à des études de spectrométrie et comporte un grand nombre de pixels qu’il faut instrumenter. Dans cette application de comptage, la résolution en énergie est secondaire et des techniques d’instrumentation permettant de diminuer la quantité d’électronique frontale pour diminuer le volume et le coût de l’instrumentation ont été recherchées. L’aspect théorique de ces techniques est présenté dans ce chapitre tandis que la mise en œuvre, l’évaluation et la caractérisation d’une nouvelle technique, basée sur la grille coplanaire, est présentée dans le

![Figure 1.5 – Schéma du compteur sanguin développé par Eriksson et al. [23].](https://thumb-eu.123doks.com/thumbv2/123doknet/6256018.162974/35.918.137.781.546.819/figure-schéma-compteur-sanguin-développé-eriksson-al.webp)
![Figure 1.7 – Photo du compteur sanguin développé par Boellaard et al. [25].](https://thumb-eu.123doks.com/thumbv2/123doknet/6256018.162974/37.918.141.771.107.554/figure-photo-compteur-sanguin-développé-boellaard-al.webp)
![Figure 1.8 – Photo du compteur sanguin développé par Laymon et al. [26].](https://thumb-eu.123doks.com/thumbv2/123doknet/6256018.162974/38.918.126.789.104.607/figure-photo-compteur-sanguin-développé-laymon-al.webp)
![Figure 1.9 – Photo du compteur sanguin développé par Breuer et al. [31].](https://thumb-eu.123doks.com/thumbv2/123doknet/6256018.162974/39.918.132.794.106.312/figure-photo-compteur-sanguin-développé-breuer-al.webp)
![Figure 1.11 – Photo du compteur sanguin développé par la compagnie Swisstrace et al. [69].](https://thumb-eu.123doks.com/thumbv2/123doknet/6256018.162974/40.918.162.758.105.482/figure-photo-compteur-sanguin-développé-compagnie-swisstrace-al.webp)
![Figure 1.12 – Photos du compteur sanguin développé par Yamamoto et al. [28].](https://thumb-eu.123doks.com/thumbv2/123doknet/6256018.162974/41.918.129.791.106.354/figure-photos-compteur-sanguin-développé-yamamoto-al.webp)