HAL Id: hal-02731792
https://hal.inrae.fr/hal-02731792
Submitted on 2 Jun 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Données nouvelles sur le spectre d’hôtes et le
parasitisme du nématode entomophage Neoaplectana
carposapsae
C. Laumond, Hervé Mauléon, Alain Kermarrec
To cite this version:
C. Laumond, Hervé Mauléon, Alain Kermarrec. Données nouvelles sur le spectre d’hôtes et le para-sitisme du nématode entomophage Neoaplectana carposapsae. Entomophaga, Springer-Verlag, 1979, 24 (1), pp.13-27. �hal-02731792�
ENTOMOPHAGA, 24 (l), 1979, 13-27
Données nouvelles sur le spectre d'hôtes et le parasitisme
du nématode entomophage Neoaplectana carpocapsae
C Laumond (1), H. Mauléon (2) & A. Kermarrec (2)
(1) Station de Recherches sur les Nématodes, I.N.R.A., Antibes, France (2) Station de Zoologie et de Lutte Biologique, I.N.R.A., Petit-Bourg (Guadeloupe)
Des essais réalisés au laboratoire en conditions standards et destinés à compléter la connaissance du spectre d'hôtes de Neoaplectana carpocapsae carpocapsae WEISER ont été effectués à Antibes, en Guadeloupe et à Madagascar. 128 espèces d'insectes appartenant aux ordres des Odonates, Dictyoptères, Isoptères, Phasmoptères, Orthoptères, Planipennes, Lépidoptères, Diptères, Coléoptères, Hyménoptères, Homoptères, Hétéroptères, ont été étudiées ainsi que quelques autres arthropodes (diplopodes et acariens). Les résultats ont confirmé le fait que la gamme d'hôtes potentiels de N. carpocapsae est très large malgré quelques cas de résistance chez les Diptères essentiellement. La rapidité d'action de N. carpocapsae, sa capacité à se multiplier dans l'hôte, ainsi que certaines de ses exigences écologiques en vue de son utilisation pratique, ont été examinées.
De nombreux exemples de parasitisme d'insectes par nématodes sont actuellement connus. Si l'on excepte les cas où les insectes sont utilisés en tant qu'hôtes intermédiaires, les nématodes impliqués appartiennent généralement à l'un des 4 ordres suivants: Tylenchida (Allantonematidae et Aphelenchoididae), Dorylaimida (Mermithidae), Ascaridida (Oxyuridae et Thelastomatidae), Rhabditida (Rhabditidae, Panagrolaimidae, Steinernematidae, Diplogasteridae, etc.).
L'ordre des Rhabditida ne possède en fait que très peu de parasites vrais d'insectes. Dans la grande majorité des cas, il s'agit plutôt de phorétiques externes ou internes, sans effet réel sur 1 'hôte. Toutefois, des cas de parasitisme facultatif peuvent se rencontrer avec des nématodes capables d'infester les insectes, de les tuer et de s'y multiplier, tout en gardant la faculté de se reproduire et de se développer dans des conditions de vie libre (POINAR, 1972). Le genre Neoaplectana, qui appartient à la famille des Steinernematidae (syn. Neoaplectanidae), se rattache à cette dernière catégorie.
Le premier représentant du genre, Neoaplectana glaseri (STEINER, 1929), a été isolé de larves du hanneton japonais: Popillia japonica NEWM. aux États-Unis. II a suscité immédiatement un intérêt certain en tant qu'agent éventuel de lutte biologique, grâce à des résultats prometteurs obtenus lors d'essais préliminaires dans les conditions naturelles (GLASER, 1932) et à sa faculté de pouvoir être cultivé sur milieux artificiels (GLASER, 1940). Depuis, d'autres Neoaplectana carpocapsae ont été trouvés, également chez des Coléoptères, mais aussi chez des Lépidoptères, des Diptères et des Hyménoptères.
Ce n'est cependant qu'avec la découverte de N. carpocapsae sur Carpocapsa pornonella L., simultanément en Tchécoslovaquie (WEISER, 1955) et aux États-Unis (DUTKY & HOUGH, 1955), que les potentialités de ce groupe de nématodes se sont réellement affirmées. Les recherches fondamentales portant sur la connaissance de N. carpocapsae (position systématique, morphologie, bio-écologie, bactéries associées) ont été effectuéef\ essentiellement aux États-Unis à partir de 1966 par POINAR qui, après avoir publié de nombreux travaux, a réalisé ensuite une série de mises au point du problème (POINAR, 1971, 1972, 1975). Le sujet a également été abordé en U.R.S.S. (VEREMCHUK, 1969) et en Pologne (SANDNER & STANUSZEK, 1974; STANUSZEK, 1974). D'autres recherches ont porté plus particulièrement sur les bactéries associées et leur rôle (LYSENKO & WEISER, 1974; SHELYASTINA & ZHILYAEVA, 1974; LAUMOND & BOEMARE, 1976). L'élevage de masse de N. carpocapsae sur insecte hôte (DUTKY et al., 1964) est techniquement assez facilement réalisable. La multiplication de type industriel sur milieux artificiels reste encore expérimentale (HOUSE et al., 1965; HANSEN et al., 1968; BUECHER et al., 1970; BUECHER & HANSEN, 1971; TARAKANOV, 1976; KAYA, 1977; BEDDING, comm. pers.). Les tests d'efficacité, tant au laboratoire que dans les conditions naturelles, ont été nombreux et des revues de synthèse ont déjà été publiées (NIKLAS, 1967, 1969; POINAR, 1971, 1972; BENHAM & POINAR, 1973; DUTKY, 1974). Durant ces dernières années, un certain nombre de travaux ont encore contribué à enrichir la gamme d'hôtes de N. carpocapsae (JOURDHEUIL et al., 1970; CHENG & BUECHER, 1972; POINAR & ENNIK, 1972; RAO et al., 1972; HACKETT & POINAR, 1973; LANDAZABAL et al., 1973; LAUMOND, 1973; MOORE, 1973; WEBSTER, 1973; JOURDHEUIL et al., 1974; KERMARREC & MAULEON, 1974a et 1974b; SINGH & BARDHAN, 1974; BLINOVA, 1976; FINNEY & MORDUE, 1976; DE LUCAs, 1976; SKIERSKA & SZADZIEWSKA, 1976; TRIGGIANI & POINAR, 1976; VEREMCHUCK, 1976; FINNEY & W ALKER, 1977). Quelques tests d'action combinée Neoaplectana champignons entomopathogènes ont également été effectués (HEINRICHS, 1973; KAMIONEK et al., 1974a et 1974b). Certaines exigences écologiques ont été étudiées, en particulier le rôle de l'humidité (SIMMONS & POINAR, 1973; WEBSTER, 1973; KAMIONEK & SANDNER, 1974). Enfin, une méthode de détection des Neoaplectana carpocapsae dans le sol a été expérimentée (BEDDING & AKHURST, 1975) et pourrait rendre de grands services pour apprécier le devenir de ces nématodes dans le sol au cours des traitements, ainsi que pour la recherche de souches ou d'espèces nouvelles.
Le laboratoire des nématodes d'insectes d'Antibes dispose depuis 1968 de la souche DD136 et depuis 1970 de la souche agriotos de N. carpocapsae. Après la mise au point d'une multiplication de masse sur insecte hôte et parallèlement à des expérimentations effectuées en plein champ, il apparaissait primordial d'améliorer la connaissance du spectre d'activité de ces 2 souches. Une série d'essais au laboratoire ont été conduits conjointement en Fr:ance métropolitaine et en Guadeloupe, portant essentiellement sur des insectes appartenant à des ordres très variés, mais également sur d'autres arthropodes. Pour les essais effectués à Antibes, la plupart des espèces retenues ont été sélectionnées en fonction de leur importance en tant que ravageurs. En ce qui concerne la Guadeloupe, la gamme a été très élargie afin de mieux apprécier l'impact des Neoaplectana carpocapsae dans 1 'hypothèse d'une utilisation en milieu insulaire et tropical. Dans la même optique, une série plus limitée de tests a été réalisée à Madagascar (1). La virulence et la rapidité d'action de N. carpocapsae ont été également étudiées de même que le processus d'infestation et la qualité d'hôte marquée par la plus ou moins bonne multiplication du parasite. Quelques-unes des bases écologiques de l'utilisation des Neoaplectana carpocapsae dans la pratique agricole ont pu par ailleurs être précisées.
MATÉRIEL ET MÉTHODES
TECHNIQUE DE PRODUCTION DES LARVES INFESTANTES DE N. carpocapsae Le nématode utilisé est N. carpocapsae, souche DD136 (provenance Dr POINAR, Université de Californie, Berkeley) et souche agriotos (provenance Dr VEREMCHUK, Institut de Protection des Plantes, Léningrad).
L'élevage de masse a été réalisé à Antibes, tandis qu'une production annexe a été mise en place aux Antilles. La multiplication de N. carpocapsae a été effectuée selon la technique désormais classique sur insecte-hôte (DUTKY et al., 1964). G. mellonella est un lépidoptère dont l'élevage au laboratoire ne pose normalement aucun problème. Les papillons sont élevés à 22°C dans des éclosoirs en plexiglas. Les pontes sont recueillies entre des bandes superposées de carton et placées dans des boîtes en plastique avec des plaques de cire et du pollen. Les premières chenilles apparaissent au bout de 30 jours et se nourrissent de la cire et du pollen. Au bout de 15 jours, elles atteignent le stade prénymphal et commencent à tisser leur cocon. C'est à ce moment précis que l'infestation est la plus favorable (DUTKY et al., 1964). Le dispositif d'infestation est constitué par des boîtes de Petri dont le fond est couvert par un rond de tissu de coton. Après stérilisation au four électrique à 120°C de ce dispositif, le coton est imbibé avec 1 ml d'une suspension de nématodes (environ 50000 larves infestantes) et on ajoute 2 ml d'eau pour obtenir une humidité satisfaisante. Les Galleria sont débarrassées manuellement de leur cocon et sont placées dans les boîtes de Petri (environ 50 individus par boîte) qui sont ensuite fermées. L'ensemble est alors mis à l'obscurité pour limiter l'activité des chenilles et favoriser ainsi la pénétration des nématodes. Au bout de 24 à 48 h, les chenilles sont mortes et sont alors placées par lots de 50 dans de grands bacs de récolte en plastique. Ces bacs sont dotés de clayettes amovibles recouvertes par des bandes de tissu également en coton, imbibées par capillarité par l'eau dont une mince couche couvre le fond du bac. Les larves infestantes, qui sont les stades actifs, s'échappent des dépouilles des chenilles, rampent sur le tissu humide et tombent dans l'eau où elles sont ensuite récupérées. L'eau des bacs est additionnée d'aldéhyde formique à 1 pour 1000 pour éviter le développement des microorganismes. La première récolte a lieu au bout de 8 jours; les autres récoltes se succèdent tous les 3 jours et ce, pendant 3 ou 4 semaines. Après filtration et décantation, les larves infestantes sont comptées et concentrées à raison de 50000 nématodes/ml. La conservation s'effectue en chambre froide à 5-6°C, dans des boîtes en plastique, dans de l'eau également additionnée d'aldéhyde formique à 1 0/°°. Les nématodes sont oxygénés par agitation tous les mois environ.
SPECTRE D 'HOTES
Pour les insectes terrestres et aériens, les infestations ont été réalisées:
- en boîtes de Petri (selon la méthode utilisée pour la multiplication de masse), - - en boîtes plastique remplies de terre. En fonction des insectes testés, les
nématodes ont été déposés par pulvérisation en solution aqueuse, soit directement sur la terre, soit sur des feuilles de végétaux destinées à être ingérées. Pour les insectes aquatiques, les infestations ont été conduites en bacs de 2 litres remplis d'eau additionnée de larves infestantes.
Les souches DDl36 et agriotos ont été utilisées indifféremment à Antibes, tandis qu'en Guadeloupe et à Madagascar, seule la souche DD136 a été employée.
Dans la mesure du possible les quantités de nématodes utilisées ont été calculées d'après la dose de 1 000000 nématodes/m2, considérée comme optimale par de nombreux auteurs, soit environ 10 000 larves infestantes par boîte de Petri et 30 000 à 50 000 en terre ou sur feuilles.
Après un nombre de jours variable selon les espèces et les conditions matérielles de l'essai (en général 7 jours), les insectes étaient disséqués et la qualité de l'infestation évaluée. A Antibes et à Madagascar, la notation du degré d'infestation a été réalisée selon NIKLAS (1967), c'est-à-dire en évaluant globalement le nombre de nématodes présents, tous stades confondus. Les tests réalisés en Guadeloupe ont été contrôlés avec une optique légèrement différente, par une notation prenant en compte le degré d'évolution des nématodes selon la séquence suivante:
pas d'infestation :
-- présence de larves infestantes : + - présence d'adultes : ++
- présence d'adultes + larves 1re
génération: + + + +
A l'usage, ces 2 types de notation se sont, en fait, avérés très proches et tout à fait comparables.
VIRULENCE ET RAPIDITÉ D'ACTION
Les infestations ont été réalisées de la même façon que pour le spectre d'activité. Les pourcentages de mortalité, corrigés selon ABBOTT (1925), ont été établis en général 3, 5 et 7 jours après l'infestation. Cependant, dans certains cas (tests réalisés à Antibes), l'espacement des contrôles a été modifié en fonction des caractéristiques bio-écologiques de l'hôte et des impératifs techniques inhérents aux essais. Les insectes morts ont été disséqués et le stade d'évolution des nématodes noté.
RESULTATS
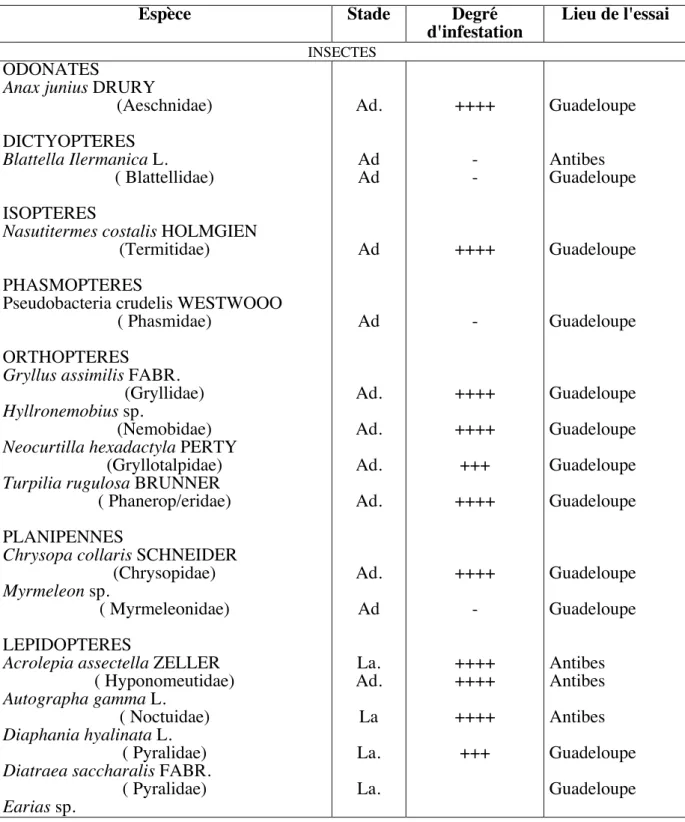
SPECTRE D'HOTES (tableau 1)
Aucune différence notable d'activité n'a été enregistrée entre les 2 souches utilisées: DDl36 et agriotos.
Les quelques odonates, isoptères et orthoptères testés ont montré une bonne sensibilité aux Neoaplectana. En ce qui concerne les dictyoptères, aucune action n'a été constatée sur Blattella germanica L., alors que des résultats positifs, avec cependant des réponses variables selon le stade de 1 'hôte, ont été enregistrés par ailleurs (NIKLAS, 1967). Nasutitermes costalis HOLMGIEN s'est révélé réceptif au laboratoire alors que, dans les conditions naturelles, l'injection d'une dose très élevée de larves infestantes de Neoaplectana carpocapsae ne paraît pas provoquer de déséquilibre marquant au sein d'une termitière.
Sur 35 lépidoptères étudiés à Antibes, en Guadeloupe et à Madagascar, seul le stade larvaire d'un Hesperiidae et d'un Sphingidae, ainsi que le stade adulte d'un Noctuidae, ont donné un résultat négatif. NIKLAS (1967, 1969) ne note également qu'un cas de résistance sur 60 espèces testées par divers auteurs. Il apparaît donc que les lépidoptères sont, dans la très grande majorité des cas, d'excellents hôtes pour N. carpocapsae. La résistance révélée chez la chenille du Sphingidae, Xylophanes tersa L., doit cependant être notée et est à rapprocher des échecs enregistrés en Guadeloupe avec des injections de Neoaplectana carpocapsae à des sphinx adultes.
Tableau l Spectre d'hôtes de Neoaplectana carpocapsae
Espèce Stade Degré
d'infestation Lieu de l'essai
INSECTES
ODONATES
Anax junius DRURY
(Aeschnidae) DICTYOPTÈRES
Blattella Ilermanica L. ( Blattellidae) ISOPTERES
Nasutitermes costalis HOLMGIEN (Termitidae) PHASMOPTERES
Pseudobacteria crudelis WESTWOOO ( Phasmidae)
ORTHOPTERES
Gryllus assimilis FABR. (Gryllidae) Hyllronemobius sp.
(Nemobidae) Neocurtilla hexadactyla PERTY
(Gryllotalpidae) Turpilia rugulosa BRUNNER ( Phanerop/eridae) PLANIPENNES
Chrysopa collaris SCHNEIDER (Chrysopidae) Myrmeleon sp.
( Myrmeleonidae) LEPIDOPTERES
Acrolepia assectella ZELLER ( Hyponomeutidae) Autographa gamma L.
( Noctuidae) Diaphania hyalinata L.
( Pyralidae) Diatraea saccharalis FABR.
( Pyralidae) Earias sp. Ad. Ad Ad Ad Ad Ad. Ad. Ad. Ad. Ad. Ad La. Ad. La La. La. ++++ -++++ -++++ ++++ +++ ++++ ++++ -++++ ++++ ++++ +++ Guadeloupe Antibes Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Antibes Antibes Antibes Guadeloupe Guadeloupe
( Noc/uidae) Elasmopalpus lignosellus ZELLER
( Pyralidae) Ephestia kuehniella ZELLER
( Pyralidae) Galleria mellonella L. ( Pyralidae) Gonodonta sp ( Noctuidae) Heliothis armigera HB. ( Noctuidae) Herse convolvuli L. (Sphinllidae) Hieroxestis subcervinella MEYR.
(Lyonetiidae) Hydraecia xanthenes GERM.
(Noctuidae) Hypsipyla grandella (ZELLER)
( Pyralidae) Mamestra oleracea L.
(Noctuidae) Mesocondyla concordalis HB.
( Pyraustidae) Mocis punctularis FABR.
(Noctuidae) Papilio demodocus ESPER.
( Papi/ionidae) Papilio epiphorbas BOISD.
( Papi/ionidae) Papilio machaon L
( Papilionidae) Parasa variabilis BUTLR.
( Limacodidae) Peridroma saucia HB.
(Noctuidae) Pieris brassicae L.
( Pieridae) Plutella maculipennis CURT.
(Hyponomeutidae) Prodenia eridania (CRAMER)
(Noctuidae) Pseudosphinx tetrio (L.)
( Sphingidae) Scotia segetum SCHIFF.
(Noctuidae) Scotia subterranea FABR.
(Noctuidae) Scotia ypsilon HUFN.
(Noctuidae) Spodoptera frugiperda (A. & S.)
(Noctuidae) Spodoptera littoralis BOISD.
(Noctuidae) Urbanus proteus (L.)
( Hesperiidae) Xanthopastis timais (CRAMER)
La. La. La La. La. La. Ad. La. Ny. La. La. La. La. Ad. La. La. La. La. La. La. La. La. La. La. La. La. La. La. La. La. La. ++ ++ ++++ +++ ++++ ++++ -++ +++ +++ +++ ++++ +++ ++++ ++++ ++ ++ +++ + ++++ ++++ +++ ++++ ++++ ++++ ++++ ++++ ++++ ++++ +++ -Madagascar Guadeloupe Guadeloupe Antibes Antibes Guadeloupe Guadeloupe Madagascar Antibes Madagascar Antibes Guadeloupe Antibes Guadeloupe Guadeloupe Madagascar Madagascar Antibes Madagascar Antibes Antibes Guadeloupe Guadeloupe Guadeloupe Antibes Guadeloupe Antibes Guadeloupe Antibes Guadeloupe Guadeloupe
( Hesperidae) Xylophanes tersa (L.)
(Sphingidae) Zinkenia fascialis (CRAMER)
( Pyralididae) DIPTERES
Aedes aegypti L.
( Culicidae) Aedes detritus HALLIDAY
(Culicidae) Culex sp.
( Culicidae) Dasyneura brassicae WINN.
(Cecidomyiidae) Drosophila repleta WOLLASTON
( Drosophilidae) Drosophila sp.
( Drosophilidae)
Metagonistylum minense TOWNSEND (Tachinidae)
Musca domestica L.
(Muscidae) Ornidia obesa (FABR.)
( Calliphoridae) COLEOPTERES
Acanthoscelides obtectus SAY (Bruchidae) Agriotes lineatus L.
(Elateridae) Anomala insularis CAST
(Scarabaeidae) Baris coerulescens SCOP
(Curculionidae) Brachycerus undatus FABR
(Curculionidae) Carpophilus hemipterus L.
(Nitidulidae) Cetonia sp.
(Scarabaeidae) Ceutorrhynchus assimilis PAYK.
(Curculionidae) Ceutorrhynchus napi GYLL.
(Curculionidae) Ceutorrhynchus picitarsis GYLL.
(Curculionidae)
Ceutorrhynchus pleurostigma MARSH. (Elaleridae)
Chalcolepidius obscurus LAP. (Elaleridae) Chlorida festiva L.
(Cerambycidae) Coleomegylla sp.
(Coccinellidae) Cosmopolites sordidus GERM.
La. La. La. La. La. Ny. La. La. La. Ad. œ La. Ad. Ad. Ad. La. Ad. Ad. La. La. La. La. La .Ny. La Ny. La Ny. La Ny. Ad. Ad. Ad. Ad. -+++ + + + + +++ -++++ -+++ -+++ -+++ +++ -++++ ++++ ++++ ++++ ++++ ++++ ++++ ++++ +++ ++++ ++++ ++++ Guadeloupe Guadeloupe Guadeloupe Antibes Antibes Antibes Antibes Guadeloupe Antibes Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe s Antibes Antibes Antibes Guadeloupe Antibes Antibes Madagascar Antibes Antibes Antibes Antibes Antibes Antibes Antibes Antibes Antibes Guadeloupe Guadeloupe Guadeloupe Guadeloupe
(Curculionidae) Cybister sp.
(Dysticidae) Cyclocephala insulicola AR. (Scarabaeidae) Cycloneda sanguinea L.
(Coccinellidae) Diabrotica balteata LEC.
(Chrysomelidae) Diaprepes abbreviatus L.
(Curculionidae) Diaprepes famelicus OLIVIER
(Curculionidae) Diaprepes marginatus OLIVIER
(Curculionidae) Dinoderus minutus FARBR.
(Bostrychidae) Dynastes hercules L.
(Scarabaeidae) Eburia octomaculala CHEVROLAT
(Cerambycidae) Gastrophysa viridula DEGEER
(Chrysomelidae) Heilipus latro GYLL..
(Curculionidae) Heteronychus plebejus KLUG.
(Srarabaeidae) Hexacolus guyanensis SCHEDL.
(Scolytidae) Hydrophilus sp.
(Hydrophilidoe) Lasiodactylus sp.
(Nitidulidae) Leptinotarsa decemlineata SAY
(Chrysomelidae) Ligyrus cuniculus FABR.
(Scarabaeidae) Macraspis tristis CAST
( Scarabaeidae) Madoniella pici LEP.
(Cleridae) Mastodotera nodicollis KLUG.
( Ceramb ycidae) Meligethes sp (Nitidulidae) Melolontha melolontha L. (Scarabaeidae) Metamasius hemipterus L. (Curculionidae) Otiorrhynchus sulcatus FABR.
(Curculionidae) Passalus unicornis St FAR. & SER.
( Passalidae)
Paxillus puncticollis ST FAR. & SER.
Ad. La. Ad. Ad. Ad. Ad. Ad. Ad. Ad. Ad. La. Ny. Ad. La. La. La. Ny. Ad. Ad. La. La. Ad. Ad. Ad. Ad. La. La. Ny. La. Ad. La. Ad. Ad. -+ +++ ++++ +++ ++++ ++++ ++++ -++++ ++++ ++++ ++++ ++++ + ++++ ++++ ++++ ++++ + + + -++++ ++++ + ++++ ++++ -++++ ++++ ++++ +++ Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Antibes Antibes Antibes Guadeloupe Madagascar Guadeloupe Guadeloupe Guadeloupe Guadeloupe Madagascar Antibes Antibes Guadeloupe Guadeloupe Guadeloupe Madagascar Antibes Antibes Antibes Guadeloupe Antibes Guadeloupe Guadeloupe
(Passalidae)
Phyllophaga patrueloides PAULIAN (Scarabaeidae)
Phyllophaga pleei BLANCHARD (Scarabaeidae) Phyllotreta sp
(Chrysomelidae) Pissodes notatus FABR.
(Curculionidae) Propilia 14 punctata L.
(Coccinellidae) Psylliodes chrysocephala L.
(Chrysomelidae) Pyrophorus phosphorescens COST.
(Elateridae) Zophobas atratus FABR.
(Tenebrionidae) HYMENOPTERES
Acromyrmex octospinosus REICH. (Formicidae) Athalia rosae L. (Tenthredinidae) Camponotus sp. (Formicidae) Camponotus sp. (Formicidae) Campsomeris dorsata F ABR.
(Scoliidae) Iridomyrmex humilis MAYR
(Formicidae) Polystes sp.
(Vespidae) Solenopsis geminata (FABR.)
( Formicidae) Sphex caliginosus ERICKSON
(Sphegidae) Xylocopa mordax L. ( Xylocopidae) HOMOPTERES Brevicoryne brassicae L. ( Aphididae) Cicadidae (indéterm.) Ferrisia sp. (Pseudococcidae) Phthia picta DRURY
(Coreidae) Pseudococcus sp.
(Pseudococcidae) HETEROPTERES
Belostoma boscii LEP. & SER. ( Belostomidae) Bueona antigone KIRK.
(Notonectidae) Corythaica cyathicollis (COSTA)
Ad. La. La .Ny. La. Ny. La. La. Ny. Ad. Ad. La. Ny. Ad. La. Ad. La. Ad. Ad. Ad. La. Ad. Ad. Ad. Ad. Ad. Ad. Ad. La. Ad. Ad. Ad. Ad. + -++++ ++++ ++++ ++++ ++++ ++++ ++++ -++++ ++++ + -+++ ++++ +++ +++ +++ -++++ ++++ ++++ ++++ +++ + -+ ++++ -++++ Guadeloupe Guadeloupe Antibes Antibes Antibes Antibes Antibes Antibes Antibes Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Antibes Guadeloupe Guadeloupe Guadeloupe Guadeloupe Antibes Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe
(Tingidae) Corixiidae (indéterm.)
Dysdercus cingulatus F ABR. ( Pyrrhocoridae) Dysdercus sp. ( Pyrrhocoridae) Nezara viridula (L.) ( Pentatomidae) Notonectidae (indéterm.) Pyrrhocorus sp. (Pyrrhocoridae) Ad. Ad. Ad. Ad. Ad. Ad. -+ ++ ++++ -++++ Guadeloupe Guadeloupe Guadeloupe Guadeloupe Guadeloupe MYRIAPODES CHILOPODES Scolopendra viridis
(Scolopendridae) Ad. - Guadeloupe
ARACHNIDES
ACARIENS
Lasioseus thermophilus WILMANN
( Aceosejidae) Ad. - Antibes
Œ : oeuf; La. : larve; Ny. : nymphe; Ad. : adulte. Degré d'infestation:
Antibes- Madagascar : pas d'infestation : infestation légère : + infestation moyenne : + + infestation forte : + + + infestation très forte : + + + + Guadeloupe : voir texte
Chez les diptères, les résultats ont été dans l'ensemble peu favorables, mais surtout très variables selon les espèces. Cette diversité de réponse est également très nette, au sein d'une même espèce, en fonction des différents stades; ainsi, chez Musca domestica L., l'adulte est réceptif mais non les reufs et les larves. Les moustiques sont relativement contaminables mais présentent très souvent une réaction de défense (mélanisation) déjà signalée (WELCH & BRONSKILL, 1962; ANDREADIS & HALL, 1976; BERESKY & HALL, 1977). Les cécidomyies ont une réponse négative en boîtes de Petri ou en terre, sauf si l'infestation est réalisée à température élevée (30'C). Les drosophiles sont particulièrement résistantes avec des stades larvaires se développant sans aucun dommage dans les bacs de multiplication des Neoaplectana, à la suite de contaminations accidentelles.
De nombreuses espèces de coléoptères, larves, adultes, mais également nymphes, ont pu être parasitées. En raison de leur importance, 12 espèces appartenant à la famille des Curculionidae ont été testées. Elles se sont toutes avérées particulièrement sensibles et ont permis une multiplication importante des nématodes. Cependant, en particulier chez les Scarabaeidae et les Elateridae (hanneton, cétoine, taupin), des phénomènes de résistance inexpliqués mais ayant peut-être un rapport avec le développement déjà très avancé des larves soumises à l'essai, ont été constatés. En ce qui concerne Agriotes lineatus L., la résistance, qui s'est également manifestée chez l'adulte, paraît d'autant plus étonnante que l'une des 2 souches de N. carpocapsae utilisées a été découverte chez des représentants de cette espèce en U.R.S.S. Des phénomènes de ce type, aussi caractérisés, ne semblent pas avoir été signalés précédemment (NIKLAS, 1967, 1969).
L'ordre des hyménoptères revêt une grande importance en agriculture car il renferme la plupart des pollinisateurs. Les essais réalisés en Guadeloupe ont montré que les guêpes, les abeilles et les bourdons sont très réceptifs dans les conditions du laboratoire. Il reste à déterminer quels seraient les risques réels engendrés par une utilisation massive des
Neoaplectana dans les conditions de la pratique agricole. Les résultats obtenus sur fourmis sont variables d'un genre à l'autre et, là encore, le stade offert à l'infestation apparaît important. Les larves de la fourmi manioc, Acromyrmex octospinosus REICH., sont de bons hôtes tandis que les nymphes sont moins parasitables et que les adultes ne sont pas pénétrés par les nématodes. Dans ce cas précis, il semble que, chez les: adultes, les larves infestantes de Neoaplectana soient stockées dans la cavité sub-linguale et régurgitées périodiquement. Les expériences d'inoculation de nids expérimentaux et naturels (KERMARREC, 1975) n'ont jamais provoqué l'extinction des colonies.
Les homoptères ont une réceptivité moyenne. En ce qui concerne les hétéroptères de Guadeloupe testés, alors que les espèces terrestres ont été normalement contaminées, toutes les espèces aquatiques se sont curieusement avérées résistantes.
Les essais limités effectués sur des arthropodes autres que les insectes (chilopode et acarien) ont donné dés résultats négatifs qui s'accordent avec les données déjà publiées (NIKLAS, 1967).
VIRULENCE ET RAPIDITÉ DE DÉVELOPPEMENT (tableau 2)
Les mortalités corrigées mettent particulièrement en évidence l'impact des Neoaplectana. Des mortalités de 100 % en 3 jours sont relativement fréquentes chez des insectes appartenant à des ordres très divers. Les meilleurs résultats (100 % de mortalité en 24 h) ont été enregistrés avec les altises du colza (Psylliodes chrysocephala L.) en boîtes de Petri ou en terre. Il est à noter que des mortalités encore très satisfaisantes (égales ou supérieures à 70",,%) ont été obtenues au bout d'un laps de temps relativement long: 12 jours dans le cas de Pissodes notatus FABR., 27 jours chez Spodoptera littoralis BOISD. par exemple. La rapidité d'action apparaît, en fait, relativement variable en fonction de la qualité de l'hôte, de la dose employée et de la méthode d'infestation utilisée.
En ce qui concerne le développement des nématodes dans l'hôte, des adultes ont été retrouvés dans tous les cas, sauf chez Aedes aegypti L. et le Chironomidae. Chez ces derniers hôtes, on constate une réaction de défense rapide (qui n'empêche pas une issue généralement fatale) qui se manifeste par une agglutination d'hémocytes autour des larves infestantes (mélanisation).
DISCUSSION ET CONCLUSION
Les résultats obtenus montrent que, au laboratoire, la gamme d'hôtes de N. carpocapsae est très large. Ces données doivent cependant être exploitées avec prudence si l'on veut se placer dans une optique d'utilisation pratique en lutte biologique, les conditions de laboratoire étant en effet des conditions optimales particulièrement favorables au nématode.
Le fait que N. carpocapsae ait une gamme d'hôtes très large, alors qu'on le rencontre très rarement dans les prospections, pose un problème. Il semble que l'on ait affaire à une spécificité de type essentiellement écologique. Dans la nature, le parasite a une capacité d'infestation qui dépend de son mode de transmission et de sa circulation dans les différentes biocénoses considérées. Il est capable d'infester des hôtes très variés, mais est limité par des barrières écologiques plus ou moins strictes. Au laboratoire, la coïncidence spatio-temporelle est réalisée artificiellement. Les barrières écologiques sont donc levées et le spectre d'hôtes tend à devenir illimité si d'autres blocages propres à l'hôte, de nature mécanique, physiologique ou phylogénique, ne se manifestent pas.
La température ambiante et l'état d'hygrométrie du milieu dans lequel évoluent les larves infestantes de Neoaplectana carpocapsae influent grandement sur leur activité, donc sur leur capacité de recherche et de pénétration dans l'hôte (JOURDHEUIL et al., 1970). Il n'est donc pas du tout certain que des insectes réceptifs à la température du laboratoire puissent être atteints dans les conditions naturelles.
Les observations réalisées ont confirmé que la pénétration des larves infestantes dans l'hôte s'effectue généralement par voie buccale, lors de l'ingestion alimentaire. Bien que plus exceptionnelle, la pénétration par les stigmates ou à travers la cuticule au niveau des articulations semble possible puisque des nymphes d'A. octospinosus et de G. viridula ont pu être parasitées.
Des différences sensibles ont été constatées dans les possibilités de multiplication des Neoaplectana carpocapsaechez les différents hôtes testés. Les lépidoptères en général peuvent être qualifiés de bons hôtes. Cependant, les essais réalisés en plein champ ont montré, aussi bien chez les lépidoptères que chez les coléoptères, que la multiplication, dans ces conditions, était faible ou même nulle alors que la mortalité était très élevée. Il peut paraître opportun à ce propos de rappeler qu'une seule larve infestante peut tuer un insecte (POINAR, 1966; LAUMOND, non publié).
Un autre point important réside dans la résistance constatée de certaines espèces, que celle-ci soit de nature mécanique (A. octospinosus), immunitaire (mélanisation des Culicidae) ou encore inexpliquée (cas de certains Scarabaeidae). Certaines hôtes peuvent cumuler plusieurs moyens de défense, en particulier les insectes sociaux. Chez A. octospinosus en effet, les adultes sécrètent des substances toxiques pour les nématodes et possèdent par ailleurs, dans leur cavité buccale, un filtre en forme de peigne qui limite la pénétration des grosses particules, ce qui pourrait expliquer la différence de sensibilité selon les stades (KERMARREC, 1975).
L'implantation et le développement des nématodes semblent dépendre également des compétitions qui peuvent entrer en jeu lorsque l'hôte héberge déjà d'autres parasites. Ainsi, alors que H. guyanensis peut être coparasité, aucune infestation n'a pu être obtenue chez des sujets porteurs d'oxyures, tels les larves de Scarabaeidae, les dictyoptères et les diplopodes. L'ensemble des enseignements recueillis au cours de ces séries de tests a contribué à la réalisation d'expérimentations en plein champ dans les conditions de la pratique agricole, tant en France métropolitaine contre les insectes du colza (JOURDHEUIL et al., 1970, 1974) et les lépidoptères Noctuidae des cultures maraîchères (LAUMOND, 1973), qu'aux Antilles contre la pyrale du concombre, Diaphania hyalinata (KERMARREC & MAULEON, 1974) et le charançon du bananier, Cosmopolites sordidus (KERMARREC & MAULEON, 1974).
Envisager l'utilisation des Neoaplectana carpocapsaeen lutte biologique nécessite la prise en considération des conditions écologiques du milieu, afin d'améliorer la survie des larves infestantes dans le sol. Lors des traitements aériens sur végétaux, la coïncidence spatiotemporelle entre le parasite et ses hôtes potentiels doit être rigoureusement assurée. Les risques éventuels d'impact sur les organismes utiles, tels les pollinisateurs, ainsi que sur les vertébrés supérieurs, ne doivent pas être sous-estimés. Enfin, la nécessité d'une production de masse économiquement rentable de ce nouvel auxiliaire reste un préalable obligatoire à son utilisation future.
SUMMARY
Laboratory tests under controlled conditions were carried out in Antibes, Guadeloupe and Madagascar, to investigate the host range of Neoapleetana carpocapsae WEISER. 128 insect species including members of Odonata, Dictyoptera, Isoptera, Phasmida, Orthoptera, Planipennia, Lepidoptera, Diptera, Coleoptera, Hymenoptera, Homoptera, Heteroptera and a few other arthropods, were tested. Results confirmed that the potential host range of N. carpocapsae is very broad in spite of some cases of resistance, mainly in Diptera. The effectiveness rapidity of the nematode, its ability to multiply in the host and some other of its ecological requirements for practical use, were also studied.
BIBLIOGRAPHIE
ABBOTT, W. S. - 1925. A method of computing the effectiveness of an insecticide. - J. Econ. Entomol., 18, 265-267.
ANDREADlS, T. G. & HALL, D. W. - 1976. Neoaplectana carpocapsae : encapsulation in Aedes aegypti and changes in host hemocytes and hemolymph proteins. - Exp. Parasitol., 39, 252-261.
BEDDlNG, R. A. & AKHURST, R. J. - 1975. A simple technique for the detection of insect parasitic rhabditid nematodes in soil. - Nematalagica, 21, 109.
BENHAM, G. & POINAR, G. O. - 1973. Tabulation and evaluation of recent field experiments using the DD136 strain of Neoaplectana carpocapsae WEISER : a review. - Exp. Parasitol., 33, 248-252.
BERESKY, M. A. & HALL, D. W. -1977. The influence ofphenylthiourea on encapsulation, melanization and survival in larvae of the mosquito Aedes aegypti parasitized by the nematode Neoaplectana carpocapsae. - J. Invertebr. Pathol., 29, 74-80.
BLINOVA, S. L. - 1976. (Les nématodes, agents potentiels de lutte biologique pour le contrôle des insectes ravageurs forestiers) (Abstract). ln : 8 Vsesoyuznoe soveshchanie no nematodnym boleznyam sel'skokhozyaistvennykh kul'tur. Tezisy dokladov i soobshchenii. Kishinev, USSR; Izdatel'stva « Shtiintsa », 162.
BUECHER, E. J. & HANSEN, E. L. - 1971. Mass culture ofaxenic nematodes using continuous aeration. J. Nematol., 3, 199-200.
BUECHER, E. J., HANSEN, E. L. & YARWOOD, E. A. - 1970. Grawth of nematodes in defined medium containing hemin and supplemented with commercially available proteins. -Nematalagica, 16, 403-409.
CHENG, H. H. & BU CHER, G. E. - 1972. Field comparison of the NeoapIectanid nematode DD136 with diazinon for contrai of Hylemyia spp. on tobacco. - J. Econ. Entomol., 65, 1761-1763.
DUTKY, S. R. - 1974. Nematode parasites. ln : Proceedings of the summer institute on biological contraI of plant insects and diseases (F. C. MAXWELL & F. A. HARRIS ed.). -Univ. Press Mississipi, Jackson, 647 pp.
DUTKY, S. R. & HOUGH, W. S. - 1955. Note on a para si tic nematode from codling moth larvae, Carpocapsa pomonella [Lepidaptera, Olethreutidae]. - Proc. Entomol. Sac. Wash., 57, 244.
DUTKY, S. R., THOMPSON, J. V. & CANTWELL, G. E. - 1964. A technique for the mass propagation of the DD136 nematode. - J. Insect Pathol., 6, 417-422.
FINNEY, J. R. & MORDUE, W. - 1976. The susceptibility of the elm bark beetle Scolytus scolytus to the DD136 strain of Neoaplectana carpocapsaesp. - Ann. Appl. Biol., 83, 311-312. FINNEY, J. R. & WALKER, C. - 1977. The DD136 strain of Neoaplectana carpocapsaesp. as a potential biological control agent for the European elm bark beetle, Scolytus scolytus. - J. Invertebr. Pathol., 29, 7-9.
GLASER, R. W. - 1932. Studies on Neoaplectana glaseri, a nematode parasite of the Japanese beetle (Popillia japonica). - New Jersey Dept. Agric. Circ., 211, 3-34. - 1940. The bacteria-free culture of a nematode parasite. - Proc. Soc. Exp. Biol. Med., 43, 512-514.
HACKETT, K. J. et POINAR, G. O. - 1973. The ability of Neoaplectana carpocapsae WEISER [Steinernematidae " Rhabditoidea] to infect adult honeybees {Apis mellifera, Apidae " Hymenoptera].Am. Bee J., 113.
HANSEN, E. L., YARWOOD, E. A., JACKSON, G. T. & POINAR, G. O. - 1968. Axenic culture of Neoaplectana carpocapsaecarpocapsae in liquid media. - J. Parasitol., 54, 1236-1237.
HEINRICH s, E. A. - 1973. Bionomics and control of sod webworms. - Bull. Entomol. Soc. Am., 19,94.
HOUSE, H. L., WELCH, H. E. & CLEUGH, T. R. - 1965. Food medium of prepared dog biscuit for the mass production of the nematode DD136 [Nematoda " Steinernematidae]. -Nature, Lond., 206, 847.
JOURDHEUIL, P., LAUMOND, C., BONIFASSI, E. & MILLOT, P. - 1970. Recherches préliminaires sur l'utilisation des nématodes en vue de la lutte contre les insectes des crucifères. - Comm. J. Int. Colza, Paris, 1970, 364-370. - 1974. Essai de lutte biologique avec les nématodes Neoaplectanidae contre les insectes des crucifères. - C.E.T.I.O.M. lnf Techn., 36, 12-16.
KAMIONEK, M. & SANDNER, H. - 1974. The survival of the larvae of Neoaplectana carpocapsaecarpocapsae WEISER outside and aquatic environment un der various conditions of temperature and humidity.Wiadomosei parazytologiczne, 20, 723.
KAMIONEK, M., SANDNER, H. & SERYCZYNSKA, H. - 1974a. The combined action of B e a u v e r i a b a s s i a n a [Fungi impe~recti " Moniliales] and N e o a p l e c t a n a carpocapsaecarpocapsae [Nematoda " Steinernematidae].Bull. Acad. Pol. Sei., 22, 253-257. - 1974b. Combined action of Paeeilomyces farinosus (BROWN & SMITH) [Fungi Imp. " Moniliales] and Neoaplectana carpocapsaecarpocapsae [Nematoda " Steinernematidae] on certain insects. - Acta Parasitol. Pol., 22, 357-363.
KAYA, H. K. - 1977. Development of the DD136 strain of N e o a p l e c t a n a carpocapsaecarpocapsae at constant temperatures. - J. Nematol., 9, 346-349.
KERMARREC, A. - 1975. Étude des relations synécologiques entre les nématodes et la fourmi manioc: Acromyrmex octospinosus REICH. - Ann. Zool. Ecol. Anim., 7, 27-44.
KERMARREC, A. & MAULEON, H. -1974a. Synergie entre le kepone et un ver nématode parasite d'insectes pour détruire Cosmopolites sordidus, le charançon du bananier. - Nouv. Marafch. Vivr. J.N.R.A. Antilles, 9, 24-27.
- 1974b. Les possibilités offertes pour la lutte biologique à l'aide de vers parasites d'insectes aux Antilles. Méthodes et résultats préliminaires. - Nouv. Marafch. Vivr. I.N.R.A. Antilles, 9, 20-23.
LANDAZABAL, A. J., FERNANDEZ, A. F. & FIGUEROA, P. A. - 1973. Control biologico de Spodoptera frugiperda con el nematodo Neoaplectana carpocapsae en maiz (Zea mays). -Acta Agron. Colombia, 23, 41-70.
LAUMOND, C. - 1973. Possibilités d'utilisation pratique d'un nématode entomoparasite contre les noctuelles en serre. - O.I.L.B., rapport réunion « Lutte intégrée en culture sous serre », Littlehamptonn sept. 1973, 60-61.
LAUMOND, C. & BOEMARE, N. - 1976. Relationships between Neoaplectana carpocapsaeassociated bacteria.Abstr. 13th Symp. Int. Nematol., Dublin, sept. 1976.
LUCA, Y. (DE). -. 1976. Destruction des formes imaginales d'Acanthoscelides obtectus SAY [Col. Bruchides] par Neoaplectana carpocapsae WEISER [Nematoda " Rhabditidae]. - Rev. Zool. Agric. Pathol. Veg., 75, 127-131.
LYSENKO, O. & WEISER, J. - 1974. Bacteria associated with the nematode Neoaplectana carpocapsae and the pathogenicity of this complex for Galleria mellonella larvae. - J. Invertebr. Pathol., 24, 332-336.
MOORE, G. E. -1973. Moisture requirements of DD136 strain of Neoaplectana carpocapsaecarpocapsae [Nematoda " Rhabditida] as related to host infection [Scolytidae, forest pests, biological control]. - Exp. Parasitol., 33, 207-211.
NIKLAS. O. F. - 1967 Oie Nemaloden 00136 [Neoaplectana carpocapsae sp.] und Neoaplectana carpocapsae WEiSER 1955 [Rhabditoidea) ais Insek.enpacasiten. Eine 'iteraturObersicht. - Mitt. Biol. Bandesan.rt. Land-Forstwirtsch., Berlin-Oahlem, 24, 40 Pp. - 1969. Ergànzungen zum Literaturboricht Ober die Nematode 00136 ( Neoaplectana carpocapsae WEiSER, strain 00136, Rhabditida). - Nacht. Deat. Plfanzenschatz., 5, 71-78. POINAR, G. O. - /966. Significance of Achromobaeter nematophilus POINAR & THOMAS [Achromobacteraccae : Eubacteriales, in th: development of the nematode DD136 [Neoaplectana carpocapsaesp. : Steinernematidae]. - Parasitol. 56, 385-390.
- 1971. Use of nematodes for microbial control of insects. ln : MicrobiaJ Control of Insects and Miles (H. O. BURGES & N. W. HUSSEY éd.). - Academic Press, New York, 181-203.
- 1972. Nematodes as facu'tative parasites of inseclS. - Annu. Rev.. Entomol., 17, 103-122.
- 1975. Entomogenous Nematodes. (E. J. BR'LL éd.). - Leiden, 317 pp.
POINAR, G. O. & ENN'K, F. - 1972. The use of Neoaplectana carpocapsae [Steineraemalidae : Rhabditoidea] against adult yellowjackets (Vespula spp. Vespidae: Hymenaptera). - J. Invertebr. Pathol., 19, 33J-334.
RAO, Y. R. V., RAO, P. S. P., V ARMA, A. & ISRAEL, P. - 1972. Tests with an insect parasitic nematode DDl36 [Nematada : Steinernematidae] against the rice stem borer, Tryporyza incertalas W ALKER.Indian J. Entomol., 33, 215-217.
SANDNER, H. & STANUSZEK, S. - 1974. The differenciation of nematode populations from the genus Neoaplectana carpocapsae[RhaMitaidea, Steinernematidae) into generations of giant and small forms.- Zesz. Probl. Post. Nauk Rol., 154, 395-407.
SHEI.YASTlNA, N. N. & ZHILYAEVA, ,.I. N. - 1974. (Bactéries associées au nématode entomopathogène, Neoapleetana carpocaosae agriotos). - Byull. Vsesoyuznogo lnst. Gel'mintologii im Ed. K.I. Skryabina, 14, 96.
SIMMONS, W. R. & PO'NAR, G. O. - 1973. The ability of Neoapleetana carpocapsae [Sleineraemalidae: Nematodea], to survive extended periods of dessication. - J. Invertebr. Pathol., 22, 228.230.
SINGH, J. & BARDHAN, A. K. - 1974. Effectiveness of DD136, an entomophilic nematode against insect pests of agricultural importance. - Curr. Sci., 43, 622.
SKIERSKA, B. & SZADZIEWSKA, M. - J976. Laboratory tests for usability of the entomophilic nematodes Steineraemmidae CHITWOOt & CHITWOOD 1937 in biological control of some noxious arthropods. - Bull. Inst. Marine Tropical Med., Gdynia, 27, 207.227. STANUSZEK, S. - 1974. Suggestions for the unification of principles for describing nematodes of Ihe genus Neoaplcetana STEINER, 1929 [Nemaloda : Rhabditoidea, Sleinernematidae). - Zesz. Probl. Post. Nauk Rol.. 154, 465-471.
STEINER, G. - J929. Neoaplectana glaseri n. g. n. sp. [Oxyaridae), a new nemic parasite of the Japanese beclle (Popilliajaponica NEWM). - J. Wash. Acad. Sci., 19, 436-440.
TARAKANOV, V. I..- 1976. Technique pour la culture axénique des nématodes Neoapleetana (Abstract). ln : 8 Vsesoyuznoe soveshchanie no nematodnym boleznyam seJ' skokhozyaistvennykh kuJ'tur. Tezisy dokladov i soobshchenii. Kishinev. USSR. -Izdatel'stvo « Shliintsa ».171-172.
TRIGGIANf. O. & POINAR. G. O. - /976. Infection of adult Lepidoptera by Neoaplectana carpocapsae [Nematoda]. - J. Invertebr.. Pathol., 27, 413-4/4.
VEREMCHUCK. G. V. - 1969. Particularités anatomiques et morphologiques des nématodes appartenant au genre Neoaplcetana [Rhabdilida : Steineraematidae). - Mater. Naacknoi Kan/. Vses. Obshch. Gel'mlntol. Akad. Nauk SSSR. 2, 152-158.
- 1976. Infestation de la Jarve de Erioischia brassicae par les nématodes Neoapleetana). (Abstract). ln : 8 Vsesoyuznoe soveshchanie no nematodnym boleznyam sel'skokhozya/Slvennykh kul'tur. Tezisy dokladov i soobshchenii. Kishinev, USSR. - Izdatel' Stvo « Shliintsa », 163-164.
- WEBSTER. J. M. - 1973. Manipulation of environ ment to facilitate use of nematodes in biocontrol of inseclS. - Exp. Parasitai., 33, 197-206.
WEiSER, J. - 1955. Neoapleetana earpocapsae n. sp. [Anguillultata, Steineraematidae] novy cizopasnik housenek obalece jablecného, Carpocapsa pomonella L. - Vestnik Cesk. Zool. Spolecnosti, 19, 44-52.
WELCH, H. E. & BRONSKILL, J. F. - 1962. Parasitism of mosquito larvae by the nematode DD136 [Nematoda : Neoaplectanidae]. - Can. J. Zool., 40, 1263-/268.