HAL Id: tel-02162632
https://tel.archives-ouvertes.fr/tel-02162632
Submitted on 22 Jun 2019
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
des informations sensorielles
Michael Quiquempoix
To cite this version:
Michael Quiquempoix. Rôle de la connectivité intracorticale dans le traitement des informations sensorielles. Neurosciences [q-bio.NC]. Université Pierre et Marie Curie - Paris VI, 2017. Français. �NNT : 2017PA066181�. �tel-02162632�
1
Université Pierre et Marie Curie
Ecole doctorale n°158 (3C)
Laboratoire Neuroscience Paris Seine / Equipe de recherche Réseaux de Neurones et Rythmes Physiopathologiques
Rôle de la connectivité intracorticale dans le traitement
des informations sensorielles
Par Michael QUIQUEMPOIX
Thèse de doctorat de Neuroscience
Dirigée par Régis LAMBERT
Présentée et soutenue publiquement le 20/06/2017
Devant un jury composé de :
Dr. Frédéric CHAVANE Rapporteur
Dr. Roustem KHAZIPOV Rapporteur
Dr. Ingrid BUREAU Examinatrice
Pr. Stéphane CHARPIER Examinateur
Dr. Thomas BESSAIH Co-encadrant de thèse
3
Remerciements
Je souhaite tout d’abord remercier Hervé Chneiweiss qui m’a ouvert les portes de son laboratoire Neuroscience Paris Seine et qui m’a permis de réaliser ma thèse dans de bonnes conditions de travail.
Je remercie vivement Frédéric Chavane et Roustem Khazipov d’avoir accepté d’être rapporteurs de cette thèse, ainsi qu’Ingrid Bureau et Stéphane Charpier pour m’avoir fait l’honneur de bien vouloir juger mon travail.
Merci à Régis Lambert mon directeur de thèse et Nathalie Leresche, co-chefs d’équipe. Vous m’avez accueilli dans votre équipe en M2 et m’avez soutenu et poussé à donner le meilleur de moi-même jusqu’à la fin. Merci pour votre regard critique et constructif sur mon travail. Merci Nathalie pour toute ton expérience et ton savoir, tu m’as énormément appris non seulement scientifiquement mais également sur le fonctionnement de la recherche académique. Merci Régis d’avoir essayé de m’inculquer un esprit de synthèse, ta manière de réfléchir sur n’importe quel sujet scientifique m’inspire énormément. Toujours très pragmatique et presque algorithmique dans tes analyses, j’aimerai pouvoir un jour jouir de la même sagacité et vivacité d’esprit.
Un grand merci à Thomas Bessaih, qui m’encadre depuis le M2. Tous les sacrifices que tu as faits, toutes les décisions que tu as prises … tout cela n’avait qu’un seul objectif : que je réussisse au mieux. Nous avons passé de nombreuses, que dis-je de très nombreuses heures à parler Science. Tu as essayé de me transmettre toute ta culture, tout ton savoir technique et théorique, sans aucune retenue. Tu m’as formé à l’électrophysiologie et je te dois beaucoup. Merci pour ta confiance et merci d’avoir misé sur moi.
Je remercie Katia Boutourlinski avec qui j’ai pu apprendre énormément et sans qui mon travail de thèse n’aurait pu voir le jour ! Merci pour l’oreille attentive que tu as su me tendre quand c’était nécessaire. Bien entendu un grand merci à Sophie, avec qui j’ai apprécié travailler et qui m’a énormément aidé dans l’aboutissement de ce travail. Merci à Marco et Sarah qui nous ont rejoints récemment merci pour votre bonne humeur, et merci Marco de
4 nous avoir ramené un peu de soleil d’Italie ! Je pense que t’entendre râler en italien pendant tes expériences me manquera énormément !!!
Je tiens à remercier tout particulièrement Patricia Reynaud-Bouret, grâce à qui j’ai pu finir ma thèse dans de bonnes conditions. J’ai pu apprendre énormément à tes côtés, sur un sujet extrêmement éloigné de ma formation initiale … le beau monde des mathématiques et des statistiques. Tu m’as acculturé à une toute autre manière de penser et de voir les neurosciences computationnelles. Tu as su faire preuve d’une pédagogie redoutable et tu m’as offert énormément de ton temps afin que nous puissions mener à bien nos travaux collaboratifs démarrés au cours de ma thèse. J’ai énormément apprécié avoir travaillé à tes côtés, à la fois scientifiquement et humainement.
Je remercie tout mon laboratoire, les différentes équipes du 5ème étage : toute l’équipe de Philippe Faure. En particulier Jérémy, Steve, Romain, Alexandre et bien entendu tous les autres, vous êtes bien trop nombreux pour que je vous cite toutes et tous. J’ai énormément appris à vos côtés et les franches rigolades chaque midi en votre compagnie n’ont fait qu’égayer mes jours passés au labo. Merci les « Faure’s » ! Merci également à toute l’équipe de Bruno Cauli et Bertrand Lambolez, Ludo, Régine et tout le monde vous avez été extrêmement agréables avec moi et je suis fier d’avoir fait votre connaissance. Un merci tout spécial à Tom’ Watson, pour son humour bien écossais et les discussions enrichissantes que j’ai pu avoir avec lui.
Merci à Sylvie Faivre-Weber, qui mérite bien plus que quelques lignes de remerciement perdues dans un manuscrit de thèse … Merci d’être là, sans toi la recherche ne tournerait pas et je dois dire que je suis relativement content et soulager de partir avant toi. Il y aura clairement un « après Sylvie » que je ne saurais imaginer ni ne souhaite connaitre.
Merci à Bernadette Hannesse qui a toujours été extrêmement agréable, serviable et réactive lorsque l’on avait désespérément besoin de son aide.
Bon, une thèse est faite de hauts et bas même si « je ne pense pas qu’il y ait de bonnes ou de mauvaises situations ». J’ai eu l’incroyable chance de pouvoir compter sur quelques collègues devenus des amis proches dont je ne pourrais me passer. Sophie, Juliette, Guillaume, Antoine et Samir … que dire ? Merci ? Bien trop peu. Je m’efforcerai de vous rendre le plus possible ce que vous m’avez apporté au quotidien. Merci d’exister. Merci d’être là. Cette thèse ne peut se défaire de l’empreinte que vous y avez laissée. Merci à tous mes
5 amis du master BIP : Emma, Virginie, Fanny, David, Céline … avec tout ce qu’on a partagé ensemble depuis le début de nos études … Je pense à vous les copains !
Enfin, bien entendu que je ne serais rien sans ma famille, mes parents et mes frères. Que dire qui ne serait pas cliché ? Vous m’avez tant donné, tant encouragé, tant soutenu … Impossible que je puisse être celui que je suis aujourd’hui sans votre présence. Merci à mes frangins et frangines d’adoption, Abdou, Quentin, Guillaume (encore lui ??!!), Bonnie et Funny. Auprès de vous la force était avec moi.
Je terminerai ces remerciements par dédier tout mon travail et tout ce que j’ai de plus cher à mon épouse Canny, qui m’offre au quotidien un refuge, un cocon contre ce monde bien souvent hostile. Elle me rend chaque jour meilleur qu’hier, car elle sait que je suis aujourd’hui moins bon que je ne le serai demain.
6 Un pessimiste voit la difficulté dans chaque opportunité. Un optimiste voit l’opportunité dans chaque difficulté.
7 La perception consciente du monde extérieur repose sur la coordination spatiotemporelle de l’activité des neurones corticaux. L’une des caractéristiques principales des aires corticales primaires chez les mammifères est leur organisation laminaire en six couches et tangentielle en colonnes fonctionnelles au sein desquelles les neurones partagent les mêmes champs récepteurs.
A partir de données anatomiques, un modèle dit canonique de traitement des informations sensorielles au travers des différentes couches des colonnes corticales a été proposé. Le modèle suppose que l’information sensorielle est traitée de façon sérielle. D’abord au niveau de la couche IV, cible principale des afférences thalamiques. Ensuite au niveau des couches II/III superficielles qui sont fortement innervées par les neurones excitateurs de la couche IV. Et enfin par les neurones des couches profondes, V et VI, qui sont innervés par les cellules pyramidales glutamatergiques des couches superficielles. Les neurones pyramidaux de la couche V constituant la principale sortie du néocortex.
Toutefois, il a récemment été montré que les neurones des couches profondes reçoivent également des informations sensorielles directement par des afférences thalamiques, ce qui pose la question du ou des rôles de la connectivité interlaminaire dans le traitement sensoriel opéré au sein des colonnes corticales.
Afin d’aborder cette problématique, j’ai tiré profit de la technique d’électroporation in utero qui permet d’exprimer spécifiquement des protéines photo-activables dans les cellules pyramidales des couches II/III du cortex somesthésique primaire de la souris recevant des informations sensorielles en provenance des vibrisses ; un modèle d’étude très populaire en neurophysiologie de la perception.
Ainsi, j’ai pu évaluer l’impact de manipulations spécifiques et temporellement précises de l’activité des neurones excitateurs des couches superficielles dans le déterminisme des réponses sensorielles des neurones de la couche V évoquées par la stimulation de vibrisses.
En procédant à des enregistrements unitaires multi-sites au sein de différentes couches corticales à la fois chez des animaux anesthésiés et éveillés, j’ai montré que le recrutement des neurones pyramidaux des couches II/III permet d’amplifier les réponses sensorielles des neurones de la couche V. Par ailleurs, l’analyse de ce phénomène d’amplification en fonction de l’intensité des stimulations sensorielles indique que la connectivité interlaminaire joue un rôle majeur dans la modulation du gain des neurones de la couche de sortie du cortex.
8
A. LE NEOCORTEX : L’ECORCE DE LA PERCEPTION SENSORIELLE ... 11
1. LE CONCEPT DE CHAMP RECEPTEUR ... 17
2. ORGANISATION EN COLONNES DES AIRES SENSORIELLES PRIMAIRES ... 19
3. ORGANISATION LAMINAIRE DES AIRES SENSORIELLES PRIMAIRES ... 20
B. LA CONNECTIVITE CORTICALE DU RONGEUR ... 26
1. LE SYSTEME DES VIBRISSES CHEZ LE RONGEUR ... 26
2. DIVERSITE DES NEURONES DU CORTEX A TONNEAUX ... 27
3. CONNECTIVITE FONCTIONNELLE EXCITATRICE DU CORTEX A TONNEAUX ... 33
4. INTEGRATION SENSORIELLE DANS LE SYSTEME DES VIBRISSES ... 38
C. DISSECTION OPTOGENETIQUE DU ROLE DE LA CONNECTIVITE CORTICALE DANS LE TRAITEMENT SENSORIEL. ... 56
1. LES OPSINES : PROTEINES ACTIVABLES PAR LA LUMIERE ... 56
2. LA CHANNELRHODOPSINE-2(CHR2) ... 57
3. LES OPSINES INHIBITRICES : HALORHODOPSINE ET ARCHEORHODOPSINE ... 59
4. DIFFERENTES STRATEGIES D’EXPRESSION DES OPSINES ... 60
4.1. Les vecteurs viraux ... 60
4.2. L’injection de plasmides par électroporation in utero ... 64
5. CONSIDERATIONS TECHNIQUES EN LIEN AVEC L’OUTIL OPTOGENETIQUE ... 66
6. QUELQUES EXEMPLES D’UTILISATION D’APPROCHES OPTOGENETIQUES POUR DISSEQUER LE ROLE DE LA CONNECTIVITE CORTICALE DANS LE TRAITEMENT SENSORIEL ... 67
D. RESULTATS ... 78
E. DISCUSSION GENERALE ... 117
1. MECANISMES SOUS-JACENTS AUX EFFETS DE LA PHOTO-SUPPRESSION DES NEURONES PYRAMIDAUX DES COUCHES 2/3 SUR LES REPONSES SENSORIELLES DES NEURONES DES COUCHES PROFONDES ... 118
2. IMPACT DES NEURONES DES COUCHES 2/3 SUR LES CHAMPS RECEPTEURS DES NEURONES DES COUCHES PROFONDES ... 121
3. IMPACT DE LA PHOTO-SUPPRESSION DES NEURONES PYRAMIDAUX DES COUCHES 2/3 SUR LA PERCEPTION SENSORIELLE ... 122
4. POTENTIELLE DIVERSITE DE CONNECTIVITE DE LA VOIE CANONIQUE L2/3 VERS L5 ... 124
5. ROLE ASSOCIATIF DES NEURONES PYRAMIDAUX DES COUCHES 2/3 ... 129
5.1. Les couches 2/3 sont la cible de connectivités cortico-corticales horizontales de courtes et de longues distances ... 130
5.2. Les réseaux corticaux sont plastiques : altérations de la connectivité des couches 2/3... 132
10
INTRODUCTION
Esse est percipi aut percipere
« Être c’est être perçu, ou percevoir ». Derrière cette citation (G. Berkeley) réside l’idée que la réalité propre de l’être pensant se construit (en partie) au travers de sa représentation du monde alentour ainsi que de la place qu’il y occupe. Cette faculté, présente chez tous les animaux y compris chez l’Homme, est primordiale pour la perpétuation de l’espèce. Les capacités de survie d’un animal dépendent de manière critique de sa faculté à percevoir les informations environnantes, les interpréter, et réagir de manière appropriée au contexte dans lequel il se trouve. Ceci est rendu possible grâce aux opérations effectuées par le cerveau qui traite de manière centrale les informations perçues par les organes sensoriels de l’organisme. Ainsi Aristote définissait chez l’Homme cinq sens majeurs qu’il classifiait en fonction de la nature du signal biophysique transmis : les photons pour la vision, les vibrations acoustiques pour l’ouïe, les composés organiques volatiles et dissouts pour l’odorat et le goût, et enfin les déformations mécaniques pour le toucher.
La compréhension des processus neuronaux qui sous-tendent les mécanismes allant de la perception des informations sensorielles à leur conceptualisation (perception consciente) est une question fondamentale en neurosciences. Pour cela il est nécessaire de décrire l’organisation structurelle des connexions entre les neurones, et de comprendre le fonctionnement contextuel des réseaux neuronaux dans le cadre d’un processus cognitif d’intérêt.
11
A. Le néocortex : l’écorce de la perception sensorielle
S’il est classiquement admis que la perception consciente de l’environnement repose sur la coordination dans le temps et dans l’espace de l’activité des neurones corticaux, trois questions fondamentales se posent : i) quels sont les traitements opérés par le cortex ; ii) quels sont les mécanismes à la base de ces opérations ; et enfin iii) quels sont les substrats structurels et biophysiques par lesquels ces opérations sont implémentées.
Les premières révolutions en neurophysiologie sont issues de travaux réalisés dans le système visuel, somesthésique ou encore moteur de différents modèles d’étude (chat, crapaud, primate, rongeur) et remontent au début du 20e siècle. Les techniques d’enregistrements électrophysiologiques des neurones (unitaires, ou populationnels) ont permis d’aborder l’une des questions fondamentales dans l’étude de l’intégration sensorielle, à savoir comment un neurone intègre et transmet une information en provenance du monde extérieur. Le premier élément de réponse provient des travaux pionniers du prix Nobel (1932) E.D. Adrian, qui a pour la première fois montré un corrélat neuronal à la contraction musculaire : les motoneurones produisent, de manière proportionnelle à l’intensité de la contraction musculaire du crapaud, des évènements électriques de type « tout-ou-rien » que l’on appelle « potentiels d’action » (PA) décrits initialement par le physiologiste allemand Émile du Bois-Reymond (pour revue Rieke, 1999). Adrian a fait une seconde observation primordiale : la quantité de potentiels d’action des récepteurs à l’étirement (du muscle) dépend de la force appliquée au muscle. Il existe donc une relation entre l’intensité d’une stimulation (sensorielle ou motrice) et l’activité des neurones reflétée par le nombre de PA qu’ils émettent par unité de temps. Cela a conduit à l’idée générale qu’un neurone transforme une variable d’entrée (par exemple la force d’un stimulus) en fréquence de décharge.
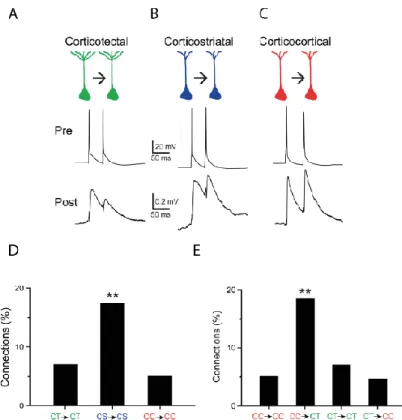
Lors de l’enregistrement intracellulaire d’un neurone, il est possible de lui injecter un courant continu de différentes intensités. La relation entre la fréquence de décharge (F) du neurone et l’intensité du courant (I) injecté appelée « relation entrée-sortie » (relation F-I dans le cas d’une injection de courants ou encore « fonction de transfert » dans un cas plus général). Cette relation permet d’évaluer la manière dont ce neurone peut intrinsèquement transformer l’intensité d’un stimulus en un train de potentiels d’action d’une certaine fréquence. La courbe représentative de la relation F-I est généralement linéaire (ou sigmoïdale dans le cas d’une saturation de la fréquence de décharge). Elle est caractérisée par : i) un seuil de stimulation Ɵ
12 à partir duquel le neurone commence à décharger ii) un EC50 correspondant à intensité du stimulus permettant d’obtenir 50% de la réponse maximale iii) une pente de la partie linéaire (autrement appelé « gain », γ) reflétant le lien de proportionnalité entre l’intensité du courant et la fréquence de décharge et éventuellement par iv) un plateau (Rmax, si la courbe est une sigmoïde) correspondant à la réponse maximale saturante du neurone (Figure 1A). Ces relations « entrée-sortie » peuvent également être mesurées par des protocoles de stimulations sensorielles. Les relations « entrée-sortie » d’un neurone ne sont pas fixes mais peuvent être modulées par plusieurs paramètres tels que l’état d’activation des réseaux neuronaux locaux ou l’attention de l’animal (Andersen and Mountcastle, 1983; Mcadams and Maunsell, 1999; Polack et al., 2013; Mcginley et al., 2015; Vinck et al., 2015). Cette modulation peut résulter en une modification de la valeur seuil du stimulus nécessaire pour faire décharger le neurone ou une modification du gain (Chance et al., 2002; Destexhe et al., 2003; Haider and McCormick, 2009). On parle d’effets multiplicatifs (ou divisifs) lorsque le gain est augmenté (ou diminué), et d’effets additifs (ou soustractifs) lorsque le seuil est modifié (Figure 1B).
Figure 1 : Courbes représentatives des fonctions de transfert ou «courbe de gain» théoriques d’un neurone. Adapté de [Destexhe et al., 2003]
A) Les différents paramètres qui caractérisent une courbe de gain. Rmax, réponse maximale correspondant au plateau de saturation des réponses; EC50, intensité du stimulus permettant d’obtenir 50% de la réponse maximale ; γ, pente de la partie linéaire de la courbe; Ɵ, seuil de la partie linéaire de la courbe.
B) Les différents types de modulation des fonctions de transfert. La courbe contrôle (violette) peut être déplacée vers la droite ou la gauche ce qui correspond à une modulation additive ou soustractive de la fonction de transfert du neurone (courbes bleues). Une variation de la pente (courbe verte) correspond, quant à elle, à une modulation multiplicative de la fonction de transfert (Destexhe et al., 2003).
13 Plusieurs études conduites in vitro et in vivo ont cherché à comprendre les mécanismes cellulaires à la base des modulations des fonctions de transfert des neurones. Il a été proposé que des variations du niveau de potentiel de membrane moyen, de résistance membranaire ainsi que des changements de l’amplitude des fluctuations du potentiel de membrane entraînent des modifications du gain des neurones (Hô and Destexhe, 2000; Chance et al., 2002; Cardin et al., 2008; Altwegg-Boussac et al., 2014).
Le problème lié au codage fréquentiel est qu’il repose sur une fréquence de décharge de potentiels d’action moyennée sur une plus ou moins longue période de temps. Or des expériences comportementales montrent que les organismes ont des temps de réaction très courts : les hommes peuvent par exemple reconnaitre une scène visuelle en quelques centaines de millisecondes, environ 150 ms (Thorpe et al., 1996). Une autre forme de codage par la structure temporelle d’un train de PA (« codage temporel ») a été proposée pour outrepasser les divers inconvénients liés au codage fréquentiel (Bialek et al., 1991; Bialek and Rieke, 1992; Mainen and Sejnowski, 1995; Reinagel and Reid, 2000; Ince et al., 2010). Le codage temporel peut refléter différentes caractéristiques du patron de décharge d’un neurone : l’intervalle de temps entre les PA ou encore le temps de latence séparant le début de la stimulation et le premier PA évoqué. Cependant, cette forme de codage pose également un problème majeur : les neurones n’ont pas connaissance à priori du temps d’arrivée d’un stimulus externe. Donc l’encodage d’un stimulus qui repose sur le temps de latence par exemple n’est utilisable que par l’observateur externe qui a une information préalable des temps de stimulation. Il est également envisageable que d’autres formes de codage d’ordre supérieur soient utilisées pour encoder différents paramètres d’un stimulus, reposant sur l’activité d’une assemblée de neurones plutôt que par l’activité des neurones individuels. Il a par exemple été montré dans le cortex moteur du macaque que la direction du mouvement du bras est codée non pas par la fréquence de décharge d’un neurone unique, mais par celle d’une population de neurones (Georgopoulos et al., 1982, 1986, 1989). En effet, les neurones du cortex moteurs répondent à différentes directions du mouvement avec une sélectivité relativement large (Figure 2A). Ainsi, l’analyse de l’activité de neurones individuels peut entrainer une ambigüité quant à la direction du mouvement. Georgopoulos et collaborateurs proposent que l’activité de chacun des neurones puisse être vectoriellement additionnée pour créer ce qu’ils appellent un « vecteur populationnel ». Ils ont ainsi montré que l’analyse de ces
vecteurs populationnels permet une meilleure prédiction de la direction du
14 Un autre aspect du codage populationnel à considérer est le codage par la corrélation de l’activité des neurones. Les activités corrélées dans le temps peuvent être définies de la manière suivante : lorsque deux neurones sont corrélés, ils ne déchargent pas de potentiels d’action de manière indépendante ; si bien que lorsqu’un neurone décharge, la probabilité de décharge du second est plus forte. Cette relation entraine une synchronie de l’activité entre plusieurs neurones. Plusieurs études ont montré que l’état de synchronie des réseaux locaux est modulé par les propriétés des stimuli. Par ailleurs, ce type de codage est modulé par le niveau d’attention. Ainsi, chez le macaque la synchronie entre des paires de neurones du cortex somesthésique secondaire augmente lorsque l’animal est attentif et diminue drastiquement lorsque son attention est détournée (pour revue : (Salinas and Sejnowski, 2001)).
Figure 2 : La direction des mouvements est encodée dans le cortex moteur par le patron d’activité d’une population de neurones. Adapté de [Georgopoulos et al., 1982]
A) Représentation en rastersde l’activité des neurones du cortex moteur en fonction de la direction du mouvement. Chaque barre verticale représente un potentiel d’action, chaque ligne correspond à un essai. Le neurone illustré est activé par plusieurs directions du mouvement du bras, avec une préférence pour des mouvements orientés entre 90° et 225°. B) Activité populationnelle de plusieurs neurones du cortex moteur en fonction de la direction du mouvement du bras. L’ensemble de ces réponses conduit à un vecteur populationnel qui correspond fidèlement à la direction du mouvement. Les flèches continues représentent les vecteurs populationnels ; les flèches en pointillés représentent la direction du mouvement.
Depuis les travaux pionniers d’Hubel et Wiesel, il est établi que la dynamique spatiotemporelle des entrées synaptiques en provenance du thalamus, la porte d’entrée principale des informations sensorielles vers le cortex, est à la base de la capacité d’encodage par les neurones corticaux de certains attributs d’un stimulus sensoriel comme l’orientation d’une barre dans l’espace (Hubel and Wiesel, 1959). Cependant, loin de passivement recevoir les informations en provenance du thalamus, la manière dont les neurones corticaux encodent
15 les informations sensorielles est dépendante de leurs propriétés intrinsèques et synaptiques. Ainsi, la description des cartes de connectivité fonctionnelle est une étape clé pour comprendre les traitements opérés au sein du cortex.
D’une épaisseur de 3-4 mm, le néocortex humain compte aux alentours de 28x109 neurones (et approximativement le même nombre de cellules gliales). Ces neurones sont interconnectés par le biais d’un vaste nombre de synapses (de l’ordre de 1012). Les premières descriptions anatomiques faites au début du XXe siècle révèlent une organisation laminaire du cortex. C’est en adaptant la technique de coloration dite « à l’imprégnation à l’argent » élaborée par Camillo Golgi à différents tissus du système nerveux central dont le néocortex, que Santiago Ramon y Cajal put mettre en évidence la présence de plusieurs couches corticales ainsi que la morphologie de certaines cellules (Figure 3). Ces couches diffèrent par leur épaisseur ainsi que par la taille, la densité et la morphologie des neurones qui s’y trouvent. Au niveau des aires sensorielles primaires, il est classiquement admis que le cortex est divisé en six couches (Oberlaender et al. 2012 ; Fig. 1). La couche 1 étant la plus superficielle et la couche 6, la plus profonde.
Figure 3 : Dessins de Santiago Ramon y Cajal.
Les dessins de gauche et du milieu décrivent les structures laminaires du cortex visuel (gauche) et du cortex moteur (droite) obtenues avec un marquage de type Nissl. Celui de droite est obtenu en utilisant la technique de révélation de Golgi qui permet de dévoiler l’arborisation dendritique des neurones corticaux.
À partir de ses travaux, Cajal a fait l’hypothèse que le néocortex était échafaudé sur la base de circuits neuronaux stéréotypés, comme ceux qu’il avait découvert dans la rétine, le cervelet, l’hippocampe ou encore la moelle épinière. Malgré la rigueur et l’exhaustivité de ses
16 travaux d’anatomie, Cajal n’a cependant jamais pu valider cette hypothèse. L’intuition de Cajal a été démontrée quelques décennies après sa mort, non pas par des anatomistes mais de manière surprenante par des physiologistes. Ce sont eux qui ont apporté un ensemble de connaissances considérable sur l’organisation du cortex en procédant à des expériences de neurophysiologie in vivo. Cette avancée majeure sur la compréhension globale de l’organisation anatomo-fonctionnelle du cortex est imputée à trois grands neurophysiologistes : V.Mountcastle (1918-2015), et les prix Nobel D.Hubel (1926-2013) & T.Wiesel (1924-). C’est en étudiant les champs récepteurs et les réponses sensorielles des neurones corticaux dans les systèmes somesthésique (V.Mountcastle, chat et macaque) et visuel (D.Hubel & T.Wiesel, chat) qu’ils ont pu proposer l’existence d’un modèle canonique de la connectivité corticale.
Ce modèle stipule que les informations sensorielles sont traitées de manière sérielle au niveau des aires corticales primaires. D’abord relayées depuis le thalamus vers la couche 4, ces informations sont intégrées et transmises vers les couches superficielles 2/3 puis vers les couches 5 et 6 qui constituent les principales voies de sortie du cortex. Toutefois, l’implication de cette connectivité intracorticale interlaminaire dans l’intégration des informations sensorielles n’a pas été totalement démontrée. Au contraire, plusieurs études remettent en cause ce modèle. En particulier, une étude récente montre que les neurones de la couche 5 reçoivent des afférences thalamiques directes et suggère une déconnexion fonctionnelle entre les couches 2/3 et la couche 5 durant le traitement sensoriel (Constantinople and Bruno, 2013). Ainsi, c’est dans ce contexte que je me suis intéressé au cours de ma thèse à l’impact fonctionnel de cette connexion L2/3-L5 sur les processus d’intégration sensorielle.
Je me propose dans un premier temps de faire un rappel historique des travaux pionniers d’Hubel & Wiesel, en décrivant comment à partir de l’étude des champs récepteurs et des projections axonales des neurones du cortex visuels du chat ils ont pu établir le modèle canonique de la connectivité corticale. Ensuite, j’aborderai la description d’un autre modèle extrêmement populaire lorsqu’il s’agit d’étudier la neurophysiologie de la perception : le système somatosensoriel traitant les informations en provenance de l’activité des vibrisses chez la souris. En effet, c’est le système modèle que j’ai utilisé au cours de ma thèse pour étudier le rôle de la connexion corticale interlaminaire L2/3-L5 dans le traitement sensoriel opéré par le cortex. J’ai utilisé ce modèle car il offre, entre autre, l’opportunité unique de procéder à des manipulations génétiques et ainsi d’exprimer des gènes d’intérêts de manière
17 spécifique dans des sous-populations de neurones. J’ai tiré profit de cet avantage pour utiliser une technique récemment développée de manipulation de l’activité neuronale, qui repose sur l’expression de protéines activables par la lumière : l’optogénétique. Je terminerai donc cette introduction par la description de l’outil optogénétique et de son utilisation dans le cadre des études de la connectivité corticales en lien avec le traitement sensoriel.
1. Le concept de champ récepteur
C’est en 1938 que le terme de champ récepteur a été défini comme étant la portion de l’espace qui lorsqu’elle est stimulée évoque une réponse sensorielle dans le nerf optique du crapaud (pour revue voir Spillmann, 2014). L’organisation ainsi que les processus sous-jacents aux champs récepteurs de la rétine ont été par la suite décrits chez le chat. En stimulant différents champs récepteurs de la rétine avec des cercles de lumière de petite taille, il a été montré que les champs récepteurs des cellules ganglionnaires étaient organisés de manière concentrique. Certains de ces champs récepteurs étaient caractérisés par un centre « on » (activable par la lumière) et une périphérie « off » (inhibée par la lumière), et inversement (Kuffler, 1953). Dans le système visuel, ces informations sensorielles sont transmises au cortex visuel primaire par le Corps Géniculé Latéral (CGL) du thalamus dont les champs récepteurs concentriques sont similaires à ceux de la rétine (Hubel and Wiesel, 1961). Au niveau du cortex visuel primaire, il est apparu contre toute attente que l’organisation des champs récepteurs était différente de celle retrouvée au niveau de la rétine (Hubel and Wiesel, 1959). La description de la conformation des champs récepteurs a été effectuée selon le même protocole que celui utilisé dans la rétine, et révèle que le stimulus produisant une réponse optimale avait une forme de barre allongée (Figure 4A). Par exemple, certains neurones ont une région centrale allongée excitatrice, restreinte par deux régions inhibitrices symétriques. La réponse du neurone est maximale si la barre lumineuse est orientée de telle manière à ce que la région excitatrice soit pleinement stimulée. Ainsi, la forme particulière du champ récepteur confère aux neurones corticaux la propriété d’être sélectif à l’orientation d’un stimulus lumineux en forme de barre (Figure 4A). Le mécanisme sous-jacent à la sélectivité à l’orientation a été proposé comme étant la résultante de l’alignement des champs récepteurs concentriques des neurones du CGL, qui convergent vers un même neurone du cortex visuel primaire (Hubel and Wiesel, 1962).
La capacité d’un neurone cortical à répondre à une stimulation lumineuse en forme de barre peut également dépendre de la direction dans laquelle cette barre est mise en
18 mouvement. Dans l’exemple de la Figure 4B, le neurone possède une région centrale inhibitrice restreinte par deux régions excitatrices asymétriques (celle de gauche étant plus étendue que celle de droite). Ainsi, la stimulation qui active d’abord la région excitatrice de gauche évoque moins de PA que celle qui débute par la région excitatrice de droite (Figure
4B : protocole d). Ce phénomène est potentiellement dû à un effet synergique entre la région
inhibitrice centrale et la région excitatrice la plus forte : on peut imaginer qu’un rebond d’activité entrainé par l’arrêt de la stimulation de la région inhibitrice coïncide avec la stimulation de la région excitatrice la plus forte, entrainant une sommation d’activité plus efficace.
Ces cellules corticales que l’on nomme « simple cells » ont également été retrouvées dans d’autres modèles d’études comme le primate (Hubel and Wiesel, 1968) ou la souris (Drager, 1975; Niell and Stryker, 2008).
Figure 4 : Sélectivité à l’orientation et à la direction des neurones « simple cells » du cortex visuel du chat [adapté de Hubel & Wiesel, 1959].
A) neurone cortical sélectif à des barres orientées. Le panel de gauche indique l’orientation des barres. Le panel de droite indique la réponse du neurone enregistré.
B) Sélectivité à la direction d'un neurone dont les régions excitatrices (indiquées par des croix sur le panel de droite) du champ récepteur sont asymétriques. La direction des barres est indiquée sur le panel de gauche, et les réponses correspondantes sur le panel du milieu. En a), la position de la barre est située au niveau de la région inhibitrice du champ récepteur, l’arrêt de la stimulation évoque une réponse en rebond ; en b) la position de la barre est située au niveau de la zone excitatrice ; en c) stimulation concentrique n’évoquant aucune réponse. Enfin en d) la barre orientée de manière préférentielle au champ récepteur du neurone évoque l’activité la plus ample lorsqu’elle est déplacée de manière orthogonale de la région excitatrice la plus faible vers la région excitatrice la plus forte (de droite à gauche).
Toutefois, il existe une diversité des réponses sensorielles et des propriétés des champs récepteurs des neurones du cortex visuel. A titre d’exemple, les cellules corticales qualifiées de « complex cells » présentent la particularité de répondre à des objets de différentes formes,
19 stationnaires ou en mouvement, d’une manière qui ne puisse être prédite par la cartographie de leur champ récepteur (Hubel and Wiesel, 1962).
2. Organisation en colonnes des aires sensorielles primaires
L’étude des réponses sensorielles des neurones du cortex visuel de type « simple cells » a révélé une disparité dans les propriétés des champs récepteurs. Par exemple, certains neurones sont activés par des barres orientées verticalement, alors que d’autres le sont par des barres orientées horizontalement. Hubel et Wiesel se sont posé la question de savoir si cette diversité était associée à une organisation spatiale spécifique des neurones à travers le cortex, ou bien si ceux-ci sont distribués aléatoirement. Pour répondre à cette question, ils ont cartographié les propriétés des champs récepteurs des neurones en fonction de la position spatiale de l’électrode d’enregistrement (Figure 5).
Figure 5 : La structure spatiale des réponses des neurones du cortex visuel révèle une organisation tangentielle du cortex visuel primaire en colonnes de sélectivité à l’orientation (tiré de Hubel & Wiesel, 1962).
Reconstructions de deux descentes parallèles d’électrodes indépendantes (1 et 2). Chaque ligne perpendiculaire à celle représentant le chemin de l’électrode correspond à l’orientation du champ récepteur des neurones enregistrés. Chaque cercle plein correspond à une lésion électrolytique à partir du premier changement d’orientation du champ récepteur. Tant que l’électrode reste orthogonale à la surface du cortex, les neurones enregistrés possèdent des champs récepteurs orientés de manière similaire.
Ils se sont aperçus que temps que la pénétration de l’électrode était perpendiculaire à la surface du cortex, les neurones enregistrés au fur et à mesure de la descente partageaient des propriétés communes de leur champ récepteur dont la principale était son orientation. En revanche, dès l’instant où la pénétration de l’électrode était tangentielle à la surface du cortex, les neurones enregistrés au fur et à mesure de la descente présentaient des sélectivités à
20 l’orientation différentes de leurs champs récepteurs (Hubel and Wiesel, 1962; Hubel and Wiesel, 1963). Toutefois, cette segmentation tangentielle du cortex n’est pas corrélée à une organisation cellulaire anatomiquement distincte.
Initialement décrite par V.Mountcastle dans le cortex somesthésique du chat et du primate, il a ainsi été proposé que tous les neurones qui partageaient des propriétés communes de leur champ récepteur étaient alignés de manière verticale à la surface du cortex selon une disposition en colonne (Mountcastle et al., 1957; Mountcastle, 1997).
3. Organisation laminaire des aires sensorielles primaires
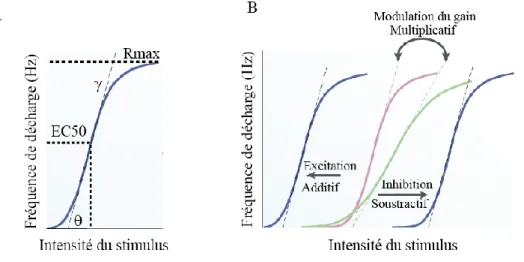
Ce résultat suggère que l’organisation laminaire du cortex pourrait également jouer un rôle important dans les processus d’intégration sensorielle. Gilbert et Wiesel ont abordé cette question en réalisant des enregistrements intracellulaires de neurones corticaux (et du CGL) chez le chat, dans le but de déterminer les propriétés de leurs réponses sensorielles en relation avec leur position laminaire. Cette technique leur a permis de procéder à des reconstructions anatomiques des projections axonales, de l’arborisation dendritique et du corps cellulaire du neurone enregistré en injectant un marqueur cellulaire par l’électrode d’enregistrement intracellulaire (« Horseradish Peroxydase », ou peroxydase de raifort) (Gilbert and Wiesel, 1979).
Les auteurs sont partis du postulat que les axones se connectent aux neurones dont les corps cellulaires sont situés dans la couche dans laquelle ils projettent. Ainsi en visualisant le trajet d’un axone et plus particulièrement là où il se termine, il devient possible de supposer l’existence de connexions synaptiques entre le neurone présynaptique et le ou les neurone(s) en aval appartenant à une couche corticale particulière (position relative de leur corps cellulaire). En effet, les dendrites baso-latérales représentent environ 80-90% de la longueur totale des dendrites (apicales + baso-latérales) et ont statistiquement beaucoup plus de connexions synaptiques que les dendrites apicales. Donc le postulat très simple de Gilbert & Wiesel permet de faire une estimation approximative des règles de connectivités corticales inter- et intralaminaires sur la base de reconstructions anatomiques.
Ils ont ainsi mis en évidence que la couche granulaire (couche 4), décrite ainsi pour sa forte densité de corps cellulaires, est la principale source d’entrée des informations en provenance des structures sous-corticales et plus particulièrement le thalamus (Figure 6A). Les neurones de la couche 4 en forme de cellules étoilées possèdent des champs récepteurs du
21 type « simple cells ». Ces neurones présentent des axones dont un certain nombre de collatérales innervent la couche 4, et d’autres projettent massivement vers les couches supragranulaires (couches 2 et 3) (Figure 6B).
Figure 6 : Reconstructions anatomiques de différents neurones corticaux de la couche 4 et de leurs afférences, adapté de [Gilbert & Wiesel 1979].
A) Deux afférences thalamiques (CGL) projetant dans la couche 4ab et 4c.
B) Cellule étoilée épineuse (spiny stellate) dont le soma se situe dans la couche 4ab, et projette ses axones majoritairement vers les couches superficielles.
Les neurones des couches 2/3 sont majoritairement des cellules pyramidales dont la quasi-totalité d’entre elles sont des neurones de type « complex cells ». Les axones de ces neurones projettent préférentiellement dans les couches infragranulaires (couche 5 mais également couche 6) (Figure 7). Ils présentent également d’importantes ramifications internes aux couches 2/3 et certains axones quittent le cortex visuel pour se terminer dans d’autres aires corticales ipsi- ou controlatérales (projections callosales).
2+3 4ab 4c 5 6 2+3 4ab 4c 5 6
22 Figure 7 : Reconstruction anatomique d’un neurone pyramidal des couches 2/3 de type « complex cells », adapté de [Gilbert & Wiesel 1979].
Les axones des neurones pyramidaux des couches 2/3 projettent dans la couche 5 (et 6), et dans les couches 2/3.
La couche 5 est la principale voie de sortie du cortex ; les neurones qui s’y trouvent projettent vers des structures sous-corticales, mais aussi vers les couches 2/3 et 6 du cortex visuel primaire et d’autres aires corticales (Figure 8A). Les neurones pyramidaux de la couche 5 (dont le soma est de plus grande dimension que ceux trouvés dans les couches 2/3) sont principalement des « complex cells ». La couche 6 est particulière dans le sens où elle reçoit des projections thalamiques en provenance du CGL. Les neurones de la couche 6 peuvent être des « simple cells » ou des « complex cells », et leurs axones projettent principalement vers la couche 4 et également vers le thalamus (Figure 8B).
23 Figure 8 : Reconstructions anatomiques de deux neurones corticaux de la couche 5 et de la couche 6, adapté de [Gilbert & Wiesel 1979].
A) Neurone pyramidal de type « complex cell » dont le soma est situé dans la couche 5. Les axones de cette cellule projettent vers d’autres couches corticales du cortex visuel (2/3 et 6), mais également vers d’autres aires corticales et sous-corticales.
B) Neurone dont le soma est situé dans la couche 6 et qui projette vers la couche 4 et le thalamus (non figuré).
La distribution des différents types de neurones (simple versus complex cells) ainsi que leurs patrons de projections axonales ont conduit les auteurs à établir un modèle de l’intégration sensorielle corticale sériel. Les neurones de la couche 4 sont majoritairement des « simple cells », cellules dont le champ récepteur serait hérité de l’alignement des champs récepteurs des neurones thalamiques qui les contactent. Les neurones pyramidaux des couches 2/3 sont quant à eux des cellules de type « complex cells » et sont principalement contactés par les axones des neurones de la couche 4. Les auteurs proposent que leurs champs récepteurs soient dérivés de la convergence de plusieurs « simple cells ». De la même manière, les projections étendues des neurones de la couche 2/3 vers ceux de la couche 5 expliqueraient la prédominance des neurones de type « complex cells » dans cette couche profonde du cortex. Enfin la couche 6 est constituée de neurones à la fois de type « simple et complex cells ».
Ces résultats tentent d’expliquer l’origine et la distribution des différents types de champs récepteurs au sein des différentes couches, par la description anatomique de la connectivité des afférences thalamo-corticales et cortico-corticales. Ceci a conduit à établir le modèle canonique de la connectivité corticale (Figure 9).
2+3 4ab 4c 5 6 2+3 4 5 6
24 Figure 9 : Modèle canonique de la connectivité corticale.
Les informations sensorielles arrivent dans la couche 4 en provenance du thalamus, sont relayées d’abord aux couches superficielles 2/3 et ensuite à la couche 5 (principale voie de sortie du cortex) et 6. De nombreuses connexions intracorticales ne figurent pas sur ce schéma
Malgré tout, un nombre conséquent d’éléments manquent et un certain nombre de questions restent ouvertes. Certaines connexions alternatives ont été proposées. Par exemple, il a été montré en supprimant par des agents pharmacologiques l’activité neuronale de la couche 4 ou encore du thalamus, que les propriétés des champs récepteurs des couches superficielles (couche 2/3) et profondes (couche 5) n’étaient pas affectées (Malpeli, 1983; Mignard, M ; Malpeli, 1991). Par ailleurs, l’existence d’une projection d’axones d’une sous population de neurones vers une autre n’implique pas nécessairement une connexion synaptique fonctionnelle entre ces deux groupes de neurones. En effet, avec le développement des techniques de microscopie électronique, il a été possible d’observer par exemple que les neurones pyramidaux de différentes sélectivités à l’orientation ne forment pas de connexions synaptiques malgré une courte distance (< 5µm) entre l’élément dendritique et l’axone (Lee et al., 2016).
Ainsi, le modèle canonique de la connectivité corticale n’est basé uniquement que sur des études anatomiques des projections neuronales d’une couche vers une autre, ce qui est
25 discutable. Pour appuyer ce modèle, des enregistrements intracellulaires de paires de neurones situés dans la couche 4, les couches 2/3 et la couche 5 ont été réalisés sur des préparations de tranches du cortex visuel de chat.
Ces expériences ont permis de prouver l’existence de synapses excitatrices fonctionnelles entre les neurones de la couche 4 et ceux des couches 2/3, ainsi qu’entre les neurones des couches 2/3 et ceux de la couche 5 (voir tableau1 en ce qui concerne les probabilités de connexion et les poids synaptiques). Toutefois, bien que les synapses soient fonctionnelles, il reste à déterminer le rôle et l’implication de ces différentes connexions interlaminaires dans le cadre des processus d’intégration sensorielle.
Projection Fréquence de détection Nombre de paires connectées testées Amplitude (mV) Latence (ms) Références
L4E L2/3P 0.1 5 1.1 +/- 0.5 0.9 +/- 0.24 (Bannister and Thomson, 2007) L2/3P L5P 0.5 2 3.2 2.8 (Thomson et al.,
2002)
Tableau 1 : Propriétés des connexions synaptiques du circuit canonique.
Ces travaux ont été réalisés dans le cortex visuel primaire du chat (voir références). L’amplitude correspond à la dépolarisation maximale évoquée dans l’élément post-synaptique par la stimulation intracellulaire de l’élément pré-synaptique. La latence indique le délai entre le potentiel d’action de l’élément pré-synaptique et la genèse du PPSE au niveau de l’élément post-synaptique : le résultat indiqué est cohérent avec une connexion monosynaptique.
Le système visuel du chat est un modèle historique qui a été utilisé pour aborder le rôle de la connectivité corticale dans la perception sensorielle. Cependant, avec l’avènement des techniques de manipulation génétique, un autre système modèle a émergé dans l’étude de la neurophysiologie de la perception : le système somesthésique des rongeurs et plus particulièrement celui de la souris. En combinant des enregistrements électrophysiologiques et des manipulations optogénétiques, j’ai utilisé ce modèle pour tenter d’aborder cette problématique. La description de ce modèle d’étude ainsi que les techniques optogénétiques utilisées font l’objet des chapitres qui suivent.
26
B. La connectivité corticale du rongeur
1. Le système des vibrisses chez le rongeur
Alors que les primates utilisent leurs doigts pour explorer leur environnement proche, les rongeurs utilisent leurs vibrisses, une sorte de moustaches situées de part et d’autre du museau. Avec l’olfaction, le système somesthésique est la plus importante modalité sensorielle chez ces animaux nocturnes dont le système visuel est bien moins développé que chez les carnivores. Les rongeurs utilisent leurs vibrisses pour détecter la position d’un objet, et peuvent récolter diverses informations sur les attributs physiques de cet objet (taille, forme, texture) (Carvell and Simons, 1990). Ainsi le raccourcissement des vibrisses au plus près du museau impacte sévèrement leurs capacités de discrimination tactile (Carvell and Simons, 1996). Les vibrisses sont au nombre de 34 de chaque côté du museau, organisées en matrice de 5 rangées (A-E) contenant chacune 5 à 9 vibrisses (arcs 1 à 9) dont la taille et le diamètre varient. L’aire corticale associée au système des vibrisses est de très grande taille, facile d’accès et constitue la seule région sensorielle du néocortex pour laquelle l’organisation topographique de la connectivité entre les éléments des réseaux neuronaux est associée à un corrélat anatomique clairement identifiable : les « barrels » ou « tonneaux », correspondant à des colonnes corticales (Woolsey and Van der Loos, 1970; Van der Loos and Woolsey, 1973). Les tonneaux peuvent être révélés grâce au marquage à la cytochrome oxydase et ils correspondent à des agrégats de corps cellulaires dans la couche 4 du cortex somesthésique primaire (Figure 10A) (Land and Simons, 1985).
Chaque vibrisse excite un nerf sensoriel qui projette de manière topographique au niveau du tronc cérébral dans deux noyaux trigéminaux : le Pr5 et le Sp5. Chaque neurone du Pr5 ne reçoit qu’une fibre sensorielle et le marquage de ce noyau par la cytochrome oxydase permet de révéler une structure dite en « barrelettes » dont l’organisation est l’image de la distribution spatiale des vibrisses. Les neurones de ces deux structures projettent au niveau thalamique sur les neurones du complexe ventro-basal qui inclut le noyau ventro-postérieur médial (VPM) et le noyau postérieur (PO). Le premier reçoit majoritairement ses afférences du Pr5 alors que le second les reçoit du Sp5. Les neurones du VPM participent à la voie lemniscale et projettent au niveau des colonnes à tonneaux. Le PO, un élément de la voie dite paralemniscale, projette majoritairement au niveau des régions septales situées entre les colonnes à tonneaux, ainsi que dans les couches corticales 1 et 5a du cortex à tonneaux
27 (Figure 10B).
Figure 10 : Schéma du système somatosensoriel du rongeur, adapté de [Deschênes et al. 2005].
A) Section tangentielle à travers la couche 4 du cortex somesthésique primaire (S1) de rat avec un marquage de la cytochrome oxydase, révélant les agrégats cellulaires formant les barrels. Chaque barrel correspond à une colonne corticale et est délimité par des zones dites septales. Tiré de [Land & Simons, 1985].
B) Schéma représentatif des deux principales voies ascendantes des vibrisses du rongeur. La voie lemniscale débute à partir du noyau principal du noyau trigéminal (PrV), projette vers le noyau ventral postéro-médian du thalamus (VPM) et termine au niveau du cortex à tonneaux. La voie paralemniscale implique le noyau supplémentaire (SpV) et le noyau postérieur du thalamus, et termine préférentiellement dans les zones septales du cortex.
2. Diversité des neurones du cortex à tonneaux
L’identification et la classification des différents types de neurones corticaux ont longtemps été considérées comme un prérequis pour comprendre les fonctions cérébrales. L’obstacle majeur pour élucider cette classification a été la difficulté rencontrée pour définir objectivement des classes neuronales. Les types cellulaires ont été traditionnellement décrits sur la base d’une large variété de caractéristiques incluant notamment la localisation laminaire du corps cellulaire, la morphologie somato-dendritique et axonale, les propriétés électrophysiologiques intrinsèques, la physiologie synaptique ou encore la présence ou l’absence de certains gènes marqueurs. La classification basée sur cette vaste gamme de critères reste difficile et n’a pas permis d’aboutir à un consensus, c’est-à-dire que les
28 différentes catégories peuvent se recouvrir et ne sont donc pas robustes. Ainsi cette partie n’a pas la prétention de détailler de manière exhaustive l’ensemble de la (des) classification(s) neuronale(s), mais de souligner les principales caractéristiques des neurones corticaux retrouvées au niveau du cortex somesthésique du rongeur.
La grande majorité des cellules glutamatergiques sont des neurones excitateurs pouvant être divisés en trois grandes classes en fonction de leur morphologie : les cellules épineuses étoilées, les cellules pyramides étoilées et les cellules pyramidales à proprement parlé.
Les neurones épineux étoilés sont nommés ainsi à cause de la forme étoilée de leur arborisation dendritique. Leur corps cellulaire est principalement situé au niveau de la couche 4. La majeure partie de ces neurones délimite les tonneaux (un agrégat cellulaire au niveau de la couche 4 restreint à une colonne) et leur arborisation dendritique est préférentiellement orientée vers le centre du tonneau plutôt que vers les zones septales (cellules asymétriques). Les autres cellules épineuses étoilées situées au centre des tonneaux ou bien dans un septum (entre les colonnes à tonneaux) ont une arborisation dendritique répartie de manière plus uniforme (cellules symétriques) (Harris and Woolsey, 1979). Leurs axones sont principalement orientés de manière parallèle aux colonnes corticales, et projettent majoritairement au niveau des couches 1, 2/3 et 4 mais également dans la couche 6 (Figure
11B).
Les neurones pyramidaux et les neurones pyramidaux étoilés possèdent une morphologie caractéristique de leur corps cellulaire, en forme de pyramide plus ou moins large selon la couche corticale. Les petites cellules pyramidales sont retrouvées essentiellement dans les couches superficielles 2 et 3, tandis que les grandes pyramides peuvent être retrouvées dans les couches infragranulaires 5 et 6 (Figure 11A). Il existe une grande variété morphologique des cellules pyramidales à travers les différentes couches du cortex. La caractéristique partagée par toutes ces cellules est la présence d’une dendrite apicale perpendiculaire à la surface du cortex (exception faite des neurones pyramidaux de la couche 2 les plus superficiels). Les axones des neurones des couches superficielles projettent, comme décrits précédemment, vers la couche 1 et les couches profondes et très largement à l’intérieur même des couches 2/3. Ces neurones envoient également leurs axones, parle corps calleux, vers d’autres aires corticales contra- ou ipsilatérales. Les pyramides de la couche 5 projettent majoritairement vers des structures sous-corticales, mais possèdent également des collatérales qui innervent les couches 2/3 au sein d’une même colonne corticale et à travers
29 plusieurs colonnes adjacentes. Ces neurones sont beaucoup plus grands que ceux des couches superficielles, et peuvent être séparés en deux sous-catégories sur la base de leur morphologie. Les pyramides dont la dendrite apicale est fine et en forme de touffe au niveau de la couche 1, ne ramifiant pas ou très peu dans les autres couches. Les autres neurones pyramidaux possèdent une dendrite apicale plus épaisse et formant de nombreuses ramifications avant d’atteindre la couche 1.
La couche 4 possède également des neurones qualifiés de « pyramides étoilées » qui se distinguent des neurones épineux étoilés par la présence d’une dendrite apicale ascendante. Ces cellules se distinguent également des neurones pyramidaux des autres couches car cette dendrite apicale n’atteint pas la couche 1 et les corps cellulaires n’ont pas à proprement parler une forme de pyramide. Ces neurones représentent 20-25% des cellules de la couche 4 du cortex somesthésique du rongeur (Staiger et al., 2004).
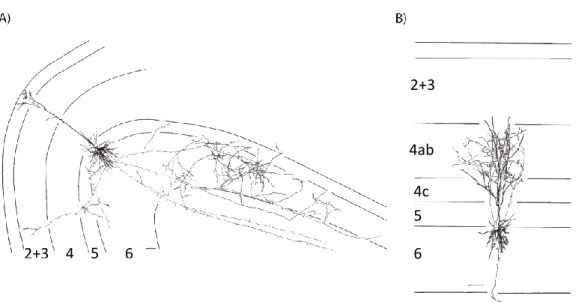
Figure 11 : Principales morphologies des neurones corticaux associées aux types de neurotransmetteurs libérés, adapté de [Peter & Jones, 1894].
À gauche : neurones épineux de type glutamatergiques.
À droite : neurones non-épineux de type GABAergiques ; C, cellules à axones locaux en arcades ; D, cellule de type double bouquets ; E et I, cellules en paniers ; F, cellules de type chandelier ; G, neurones à touffes ; H, neurones de type neurogliaforme.
Les neurones non épineux (Figure 11C-I) sont des interneurones majoritairement inhibiteurs GABAergiques. Ces cellules présentent une vaste diversité morphologique, moléculaire et électrophysiologique. Les principaux interneurones sont les cellules en panier et en chandelier exprimant la Parvalbumine (PV) qui représentent 30-50% des interneurones,
30 et les cellules de type Martinotti exprimant la somatostatine (SOM) et qui représentent 40% des interneurones. Le reste des interneurones sont représentés par des cellules exprimant le peptide vaso-intestinal (VIP) ainsi que par les cellules neurogliaformes.
Les interneurones en panier (PV) projettent leurs axones principalement sur le soma et la partie proximale des dendrites de leurs cellules cibles. Ces interneurones ont tendance à se ramifier localement, au sein d’une colonne corticale plutôt qu’à travers plusieurs colonnes.
Les interneurones en chandeliers sont des cellules particulières au sens où elles seules projettent leurs axones vers le segment initial de l’axone du neurone cible. Cette propriété leur confère la particularité d’empêcher la genèse d’un potentiel d’action en hyperpolarisant l’axone, sans modifier les propriétés intégratives du neurone cible. Cette connectivité permet ainsi de réduire les effets des boucles de rétrocontrôle positif induites par les connexions réciproques excitatrices extrêmement nombreuses dans le cortex. Ces cellules peuvent contacter 60 à 80 neurones cibles et sont retrouvées à travers toutes les couches corticales. Ces cellules expriment également la parvalbumine (pour revue : Harris and Mrsic-Flogel, 2013).
Les interneurones à somatostatine (majoritairement des cellules de Martinotti) ciblent préférentiellement les dendrites distales des neurones pyramidaux ainsi que celles des interneurones inhibiteurs (notamment à parvalbumine). Les cellules à somatostatine sont essentiellement contactées par des neurones excitateurs locaux et inhibées majoritairement par des interneurones exprimant le VIP (Figure 12) (Pfeffer et al., 2013).
Figure 12 : Schéma des connexions corticales inhibitrices des trois principales classes d’interneurones. Tiré de [Pfeffer et al., 2013].
VIP : interneurones à peptide vaso-intestinal ; Sst : interneurones à somatostatine ; Pvalb : interneurones à parvalbumine ; Pyr : neurones pyramidaux. Seules les principales connexions inhibitrices sont schématisées.
Au début des années 80, avec l’avènement des enregistrements électrophysiologiques intracellulaires in vitro (Connors and Gutnick, 1990) sur des préparations de tranches de cerveau, et in vivo sur des animaux anesthésiés (Nuñez et al., 1993), les neurones corticaux
31 ont été séparés en quatre classes qui diffèrent radicalement par leurs patrons de décharges en réponse à des injections de courant dépolarisant.
Les neurones de type Regular spiking (Figure 13 ; RS), essentiellement excitateurs (glutamatergiques), répondent à une dépolarisation soutenue par des trains continus de potentiels d'action (40 à 80Hz) avec une adaptation fréquentielle plus ou moins rapide. Les neurones de type Fast Spiking (Figure 13 ; FS), majoritairement inhibiteurs (GABAergiques), répondent à des injections de courants dépolarisants par des décharges toniques de potentiels d'action courts (<1 ms) et à haute fréquence (jusqu'à 400 Hz) qui ne présentent pas d’adaptation. Ces deux grandes classes correspondant respectivement à des neurones excitateurs et inhibiteurs sont retrouvées dans toutes les couches corticales (II à VI). Les neurones de type Intrinsic bursting (IB ; Figure 13 ; IB), qui sont pour la plupart des neurones excitateurs, génèrent des décharges en bouffées de potentiels d'action (ou "burst"). Ces bouffées sont généralement composées de 2 à 5 potentiels d'action qui s'inactivent progressivement, et sont sous-tendues par de larges dépolarisations membranaires. Les premières données obtenues in vitro (Connors et al., 1982; McCormick et al., 1985; Agmon and Connors, 1989) suggéraient que les neurones de type IB sont spécifiquement présents dans les couches profondes du néocortex, mais des travaux ultérieurs réalisés in vivo dans le cortex du chat ont montré la présence de ces neurones dans toutes les couches corticales (Nowak et al., 2003). Au vu de leur comportement oscillatoire, il avait été initialement proposé que les neurones de type IB pourraient jouer un rôle prépondérant dans la rythmogénèse corticale et en particulier dans la genèse des oscillations à ondes lentes observées durant le sommeil à ondes lentes et dans certaines phases de l’éveil (<10 Hz) (pour revue : Steriade, 2004).
Plus récemment, une quatrième classe de neurones de type Chattering cells qui répondent à l’injection d’un courant dépolarisant par des bouffées de potentiels d’action à haute fréquence (jusqu'à 800 Hz) générés de manière rythmique (40-80 Hz) a été mise en évidence. Les bouffées peuvent se terminer par une dépolarisation sous liminaire caractéristique, appelée after depolarization (ADP). Initialement découverts dans les couches superficielles du cortex visuel primaire du chat par Gray et McCormick (Gray and McCormick, 1996), plusieurs études suggèrent que ces neurones jouent un rôle dans la genèse d'oscillations corticales synchrones dans des gammes de fréquences bêta/gamma (20-80 Hz) évoquées par les stimulations visuelles. Par la suite, le groupe de Steriade (Steriade et al., 1998) a mis en évidence des neurones au comportement similaire qu’il appela Fast
32 rhythmic bursting (Figure 13 ; FRB) dans les couches profondes du cortex moteur et associatif du chat. Certains d’entre eux ont été histologiquement identifiés comme étant des neurones cortico-thalamiques, suggérant leur importance dans la synchronisation des oscillations à haute fréquence dans les boucles cortico-thalamo-corticales.
Figure 13 : Les 4 grandes classes électrophysiologiques des neurones corticaux, adapté de [Steriade, 2004].
(RS) : Regular Spiking répondant à l’injection d’un créneau de courant dépolarisant par un train de potentiels d’actions continus avec adaptation fréquentielle.
(FRB) : Fast-Rythmic-Bursting répondant par des bouffées rythmiques de potentiels d’actions à très haute fréquence. (FS) : Fast Spiking répondant par un train continu de potentiels d’action à haute fréquence sans adaptation.
(IB) : Intrinsic Bursting répondant par des bouffées de potentiels d’action caractérisées par une accommodation de l’amplitude des potentiels d’action.
Existe-t-il une corrélation entre les différents paramètres qui caractérisent un neurone (morphologie, profil de décharge, distribution laminaire) ? Quel que soit l’angle sous lequel cette question est abordée, il est extrêmement difficile d’établir une corrélation franche. Les interneurones GABAergiques présentent une grande variété de morphologies (double bouquets, cellules en paniers, chandeliers, etc.) et différents profils d’expression moléculaires (PV, SOM, VIP, neuropeptide Y etc.) qui ne se recoupent pas. Par exemple, les interneurones à PV peuvent être des cellules en chandelier ou en panier. Par ailleurs, bien que la majorité des interneurones soit de type FS exprimant la PV, les autres interneurones possèdent des propriétés intrinsèques très variées (pour revue : Ascoli et al., 2008) rendant leur classification d’autant plus complexe. Ces neurones sont retrouvés à travers toutes les couches du cortex (à l’exception des neurones VIP retrouvés principalement dans les couches II/III). Concernant les neurones glutamatergiques, les neurones de type RS peuvent être des cellules épineuses étoilées ou des cellules pyramidales. Toutes les cellules pyramidales ne sont pas nécessairement de type RS, et peuvent présenter ainsi des propriétés intrinsèques caractéristiques des IB, FRP ou encore des FS. Il n’est donc pas possible de déterminer la morphologie d’un neurone en se basant uniquement sur ses propriétés intrinsèques, et inversement. La distribution laminaire des différents types de neurones n’est pas spécifique. À l’exception des cellules épineuses étoilées glutamatergiques présentes dans la couche 4, la plupart des neurones sont retrouvés à travers les différentes couches du cortex.
33 Ainsi, la classification des neurones corticaux sur la base de leur morphologie, leurs propriétés intrinsèques et leur profil d’expression génique est très difficile à réaliser. En effet, ces catégories ne sont pas robustes dès lors que tous les paramètres sont pris en compte. Il est tout de même nécessaire d’utiliser ces différentes caractéristiques pour décrire comment les neurones corticaux sont connectés.
3. Connectivité fonctionnelle excitatrice du cortex à tonneaux
L’avantage du cortex à tonneaux est de pouvoir visualiser anatomiquement une colonne corticale, associée à une vibrisse principale. Il est ainsi possible, in vitro, de réaliser des enregistrements intracellulaires de type Patch-clamp en configuration « cellule entière » de plusieurs paires de neurones au sein d’une même colonne de manière systématique. L’imagerie intrinsèque permet d’identifier, in vivo, la colonne corticale correspondant à la vibrisse stimulée : la stimulation induit une réponse hémodynamique dans la zone du cortex à tonneaux recevant les informations sensorielles tactiles en provenance de la vibrisse stimulée. Cette approche offre la possibilité de colorer spécifiquement une colonne corticale cible avec un marqueur membranaire fluorescent (DYE) puis, après extraction du cerveau, de réaliser des expériences in vitro dans la même colonne de manière reproductible (Lefort et al., 2009). D’autres techniques permettent d’étudier la connectivité fonctionnelle corticale, comme le Laser Scanning Photostimulation qui repose sur la photolyse de glutamate encagé pendant des enregistrements intracellulaires in vitro (Katz and Dalva, 1994). Ceci permet de construire une carte détaillée de la disposition spatiale ainsi que de la force des entrées synaptiques qui convergent sur le neurone enregistré. L’avantage de cette technique, outre la bonne résolution spatiale, est de pouvoir stimuler différentes zones contenant potentiellement des afférences pré-synaptiques. Les neurones épineux étoilés représentent environ 80% des neurones excitateurs de la couche 4 du barrel cortex (Lefort et al., 2009), les 20% restant étant des neurones pyramidaux (petites pyramides et pyramides étoilées). Ces neurones sont densément innervés par des projections en provenance du VPM et reçoivent des signaux excitateurs de faibles latences. Bien que cette synapse thalamo-corticale soit peu efficace (l’amplitude des potentiels post-synaptiques excitateurs PPSE est d’environ 1 mV), l’abondance et la synchronie des entrées synaptiques convergentes (environ 85 axones thalamiques par neurone épineux étoilé) sont suffisantes pour activer les neurones de la couche 4 (Bruno and Sakmann, 2006).
![Figure 4 : Sélectivité à l’orientation et à la direction des neurones « simple cells » du cortex visuel du chat [adapté de Hubel & Wiesel, 1959]](https://thumb-eu.123doks.com/thumbv2/123doknet/14696698.563405/19.892.111.749.525.820/figure-sélectivité-orientation-direction-neurones-simple-adapté-wiesel.webp)
![Figure 6 : Reconstructions anatomiques de différents neurones corticaux de la couche 4 et de leurs afférences, adapté de [Gilbert & Wiesel 1979]](https://thumb-eu.123doks.com/thumbv2/123doknet/14696698.563405/22.892.125.798.220.649/figure-reconstructions-anatomiques-neurones-corticaux-afférences-adapté-gilbert.webp)
![Figure 7 : Reconstruction anatomique d’un neurone pyramidal des couches 2/3 de type « complex cells », adapté de [Gilbert & Wiesel 1979]](https://thumb-eu.123doks.com/thumbv2/123doknet/14696698.563405/23.892.208.664.123.513/figure-reconstruction-anatomique-neurone-pyramidal-couches-complex-gilbert.webp)
![Figure 11 : Principales morphologies des neurones corticaux associées aux types de neurotransmetteurs libérés, adapté de [Peter & Jones, 1894]](https://thumb-eu.123doks.com/thumbv2/123doknet/14696698.563405/30.892.107.749.552.851/figure-principales-morphologies-neurones-corticaux-associées-neurotransmetteurs-libérés.webp)