UNIVERSITE MOHAMMED V
FACULTE DE MEDECINE ET DE PHARMACIE
ROYAUME DU MAROC
-RABAT-
Choriocarcinome gestationnel tubaire
A propos d’un cas et revue de la littérature
Mémoire
POUR
L’OBTENTION DU
DIPLOME NATIONAL DE SPECIALITE
EN
GYNECOLOGIE – OBSTETRIQUE
DOCTEUR EL MZABRI ZINEBMme Mounia Yousfi président Professeur de Gynécologie Obstétrique
Mme Amina Lakhdar
Professeur de Gynécologie Obstétrique
Mme Tazi Zakia
Professeur de Gynécologie Obstétrique
Mr. El Hanchi Zaki
Professeur de Gynécologie Obstétrique
Mr Filali Abdelai
Professeur de Gynécologie Obstétrique
A mon professeur et directeur de mémoire, Madame ElyoussfiMounia
Professeur degynécologie obstétrique.
Durant nos années de résidanat, nous avons eu la chance de vous avoir comme enseignante et encadrante malgré vos multiples sollicitations.
Votre abord facile, votre franc parlé, votre démarche scientifique et votre grande expérience en gynécologie obstétrique ont forcé notre admiration.
Chère maitre, veuillez trouver ici l’expression de notre profond respect.
A mes maitres : Pr.s bargache , Pr.A.Ansari, Pr.k.Fathi, Pr.S.ElAmrani
Il m’est impossible de dire en quelques mots ce qu’on vous doit, votre dynamisme et votre sérieux dans l’exercice de votre métier, tellement inspirant et motivant, pour communiquer le désir d’offrir le meilleur de nous-mêmes.
J’espère avoir été à la hauteur de votre confiance et de vos attentes.
Veuillez trouver ici, cher maitre, le témoignage de ma vive gratitude, de mes sentiments de respect .les plus distingués et de ma haute considération.
1
Table des matières
Introduction Générale ... 2
CHAPITRE 1 : Rappels embryologiques ... 4
I. Placentation : ... 5
II. Biologie ... 10
Chapitre 2 : Généralité sur le Choricarcinome ... 12
I. Caractéristiques histologiques ... 13
1. Macroscopique (image 7) ... 13
2. Microscopie : (image 8)... 13
II. Caractéristiques cytogénétiques ... 16
III. Pathogénie ... 16
1. Etiologie de la môle : phénomène d’empreinte parentale : ... 17
2. Evolution vers les TTG: ... 18
a) Facteurs génétiques : ... 18
b) Facteurs immunologiques : ... 19
CHAPITRE 3 : CAS CLINIQUE ... 21
I. OBSERVATION ... 22
II. DISCUSSION ... 30
2
Introduction Générale
Les maladies trophoblastiques sont en général l’apanage des femmes en période d’activité génitale, mais restent décrites lors de la péri-ménopause et ménopause [1]. Il s’agit, pour la plupart, de maladies curables nécessitant une prise en charge spécialisée afin d’apporter aux patientes un maximum de chances de guérison.
Elles présentent un intérêt particulier du fait de leur fréquence relativement élevée dans une population de bas niveau socio-économique et de son potentiel évolutif vers une maladie maligne.
Les tumeurs trophoblastiques gestationnelles (TTG) représentent les formes malignes. Elles font toujours suite à une grossesse, le plus souvent môlaire (môle hydatiforme), elles incluent 4 entités : les moles invasives, les choriocarcinomes, les tumeurs trophoblastiques du site d’implantation et les tumeurs trophoblastiques épithéloides
Le choriocarcinome gestationnel (CG) est une tumeur maligne rare, dérivée du trophoblaste de la femme en âge de procréer. Sa fréquence en Europe et en Amérique du Nord est estimée à 0,2–0,7/1000 grossesses [3], et il représente 12,8 % des maladies trophoblastiques gestationnelles [2].
Il convient de bien séparer les choriocarcinomes gestationnels des non gestationnels. Le diagnostic est difficile à évoquer lorsqu’il n’existe pas d’histoire récente de gestation à l’interrogatoire. Celle-ci peut être passée inaperçue, avoir eu lieu plusieurs années auparavant ou la grossesse précédant le choriocarcinome peut aussi ne pas être la grossesse causale [1]. Certains cas, anecdotiques, ont été décrits chez des femmes ménopausées
Au cours de mon cursus de résidanat en gynécologie-obstétrique, j’ai rencontré un cas de choriocarcinome à localisation extra utérine, tubaire
3
Cas rarissime, m’a conduit à m’intéresser à la physiopathologie de cette maladie et à sa prise en charge diagnostique et thérapeutique.
Mon travail a pour objectif de constituer un outil pratique de diagnostic et de prise en charge permettant de mieux cerner cette pathologie.
La maladie trophoblastique gestationnelle regroupe un ensemble de lésions du placenta lié à une invasion trophoblastique pathologique, avec prolifération, persistance et maturation anormale [6]
Elle englobe des affections ayant une expression clinique, biologique et un potentiel métastatique très variables :
des entités bénignes appelées moles hydatiformes : complètes et partielles
des entités malignes appelées tumeurs trophoblastiques gestationnelles qui incluent les moles invasives, les choriocarcinomes, les tumeurs trophoblastiques du site d’implantation et les tumeurs trophoblastiques épithéloides.
Toutes ses affections sécrètent d’importantes quantités d’hCG.
Le choriocarcinome, encore appelé chorio-épithéliome ou trophoblaste malin, est une tumeur unique en son genre, l’étiologie est inconnue, non décrite chez les animaux. Elle se différencie de la MH par l’absence de villosités choriales. [7]
Il a pour particularité de pouvoir avoir une double origine :
- placentaire (la plus fréquente) ou choriocarcinome gestationnel, né d’un placenta, au cours ou dans les suites d’une grossesse (ectopique ou non 22%, interruption de grossesse spontanée ou provoquée 25%, mole hydatiforme 50%)
4
CHAPITRE 1 :
5
I.
Placentation :
Une semaine après la fécondation, le blastocyste va épuiser ses réserves
nutritives, sa vie libre ne peut donc être que de courte durée. Il définit alors avec l’organisme maternel, par un processus d’implantation, une structure qui lui permettra de se développer au cours de la gestation : le placenta [3].
Le placenta commence donc à se former, 6 à 7 jours après fécondation de l’oeuf, à l’insertion du blastocyste entre les cellules épithéliales de la muqueuse utérine.
Le syncitiotrophoblaste se trouve en périphérie du blastocyste, ses propriétés très invasives permettent au blastocyste de s’ancrer et de s’enfouir complètement au sein de l’endomètre : c’est la nidation (image 1)
Image 1 : Nidation et début de la formation placentaire
Après la nidation, le trophoblaste se différencie suivant deux voies récemment résumées : le syncytiotrophoblaste villeux (ST) et le trophoblaste extra-villeux.
6
Le syncitiotrophoblaste se creuse de lacunes. Les zones inter lacunaires seront envahies par le cytotrophoblaste, ce qui formera les villosités choriales primaires (image 2).
Image 2 : Villosité primaire (12ème jour)
Les villosités choriales secondaires seront constituées par la migration du mésenchyme embryonnaire dans le cytotrophoblaste. La croissance des villosités choriales, par vasculogénèse et angiogénèse, est permise par la prolifération du mésenchyme. Né alors les vaisseaux fœtaux.
Les villosités choriales sont soit ancrées dans l’utérus : ce sont les villosités crampon, soit elles sont dans la chambre intervilleuse : ce sont les villosités flottantes.
Les villosités choriales sont leur structure définitive 8 semaines après la fécondation de l’œuf (image 3).
7
Image 3 : Évolution des villosités placentaires
La première phase de l’invasion trophoblastique, à partir de 8 semaines après la fécondation, est caractérisée par la migration du cytotrophoblaste extra villeux dans la décidua et jusqu’aux artères spiralées du myomètre. La chambre intervilleuse est progressivement envahie par le sang maternel.
La seconde phase est plus tardive. Elle est caractérisée par une invasion endovasculaire des artères spiralées du myomètre.
Les cellules trophoblastiques vont subir une transformation leur conférant une propriété endothéliale. C’est cette transformation qui va déterminer la bonne circulation materno-foetale.
Les cellules épithéliales à la base des villosités crampons ont des propriétés invasives et migratoires. Elles sont regroupées dans la partie proximale de la villosité (image 4).
8
Image 5 :Placenta et circulation fœtale
Par la suite, ces cellules migrent et envahissent l’endomètre maternel. Cette étape nécessite une interaction avec les cellules de l’immunité telles que les macrophages et les cellules Natural Killer (N.K.).
L’allo-greffe, que représente la formation de placenta, n’est pas rejeté par l’organisme maternel grâce à la présence d’antigène spécifiques type HLA-G et la sécrétion de cytokines et autres immunorégulateurs.
9
Image 6 : Le placenta à terme : morphologie interne
10
II.
Biologie
Le trophoblaste permet la nidation de l’oeuf, assure la croissance placentaire en s’interposant entre la circulation maternelle intervilleuse et l’axe
conjonctivo-vasculaire foetal des villosités. Il sécrète la fraction _ de l’hormone gonadotrophine chorionique (βhCG), l’hormone lactogène placentaire (hPL), des hormones stéroïdiennes (oestrogènes, progestérone), des glycoprotéines spécifiques de la grossesse (PS1), divers facteurs de croissance, des substances oncogènes, des protéines d’adhésion telles que E-cadhérine, Mel-CAM ou MUC18 et des intégrines [2 ; 5]. Ces substances participent aux interactions du trophoblaste et de la paroi utérine.
Le syncytiotrophoblaste sécrète de nombreuses hormones polypeptidiques. Ce sont essentiellement l’hCG (hormone chorionique gonadotrope), l’hPL (hormone lactogène placentaire) ou hCS (hormone chorionique somatotrope) et en quantité moindre la GH placentaire. .
L’hCG (humanchorionicgonadotropin), est une hormone formée de deux sous-unités et fortement glycosylées. . L’hCG est l’hormone indispensable au déroulement de la grossesse humaine. Elle permet en effet la transformation du corps jaune cyclique en corps jaune gravidique assurant le maintien de la sécrétion de progestérone ovarienne durant les 6 premières semaines de la grossesse. À cette date, la stéroïdogenèse de l’unité fœto-placentaire supplée aux fonctions ovariennes, illustrant ainsi l’indépendance du système endocrine placentaire vis-à-vis de l’organisme maternel.
Outre son rôle de stimulation de la stéroïdogenèse, l’hCG joue un rôle important dans la différenciation du trophoblaste où ses récepteurs sont présents.
La sécrétion d’hCG par le syncytiotrophoblaste est donc très précoce ; elle
débute dès la deuxième semaine de grossesse, au moment de l’implantation. Elle passe ensuite par un maximum vers le deuxième mois puis diminue très
11
nettement au troisième mois pour rester pratiquement stationnaire jusqu’à l’accouchement.
La synthèse d’hCG par le trophoblaste varie au cours de la grossesse, plus forte au premier trimestre ; elle est modulée par l’AMP cyclique et par les ligands des récepteurs nucléaires aux rétinoïdes et au PPARc. En cas de trisomie 21 fœtale, on observe des concentrations élevées d’hCG, utilisées comme marqueur sérique maternel. La synthèse de cette hormone est altérée dans la trisomie 21. L’hCG a également un effet sur les gonades fœtales. [3]
Il est connu depuis de nombreuses années que le placenta sécrète dans le compartiment maternel des quantités très élevées d’hCS ou hPL et cent fois moindres dans la circulation fœtale. L’augmentation de la sécrétion d’hPL au cours de la grossesse suit l’évolution de la masse placentaire et plus particulièrement celle du syncytiotrophoblaste, lieu de sa synthèse. Durant le troisième trimestre, la production d’hPL peut atteindre 1 à 3 g/jour, représentant 10 % des protéines et 5 % des ARN totaux produits par le placenta [3].
Cependant, son rôle physiologique reste totalement inconnu. Un éventuel rôle métabolique permettant le maintien d’un apport glucosé au fœtus lors d’un jeûne maternel prolongé a été suggéré. Par ailleurs, l’existence de récepteurs spécifiques sur les tissus fœtaux et un effet propre sur la captation
d’acides aminés pourraient laisser supposer que l’hPL est une hormone placentaire à action somatogénique fœtale. [3]
12
Chapitre 2 :
13
I. Caractéristiques histologiques
1. Macroscopique (image 7)
Le choriocarcinome gestationnel est représenté par des lésions nodulaires
habituellement bien circonscrites [9], à développement intracavitaire et/ou intra mural, extrêmement hémorragiques et souvent nécrotiques. Sa taille varie de quelques millimètres à plus de 10cm, pouvant combler entièrement la cavité utérine [10].
Image 7: Aspect macroscopique d’un choriocarcinome utérin en stade précoce (a) et
avancé avec l’aspect très hémorragique typique(b) [11]
2. Microscopie : (image 8)
Cette prolifération tumorale est décrite comme biphasique, incluant des cellules mononucléées identifiées comme étant des trophoblastes intermédiaires et des cellules multinucléées de type syncytiotrophoblastes en proportion variable. Ces différents éléments conservent leurs caractéristiques morphologiques et immunohistochimies propres mais avec des atypies nucléaires plus ou moins marquées. Ces éléments bordent des lacs sanguins et détruisent les parois vasculaires, ce qui rend compte des remaniements hémorragiques et nécrotiques majeurs, essentiellement centraux [9]. Il est classiquement admis qu’il ne doit pas exister de villosités placentaires résiduelles identifiables lors du diagnostic sauf dans les choriocarcinomes survenant au niveau d’un placenta mature [12, 13, 14] .
14
L’activité mitotique et l’indice de prolifération sont élevés mais n’apparaissent pas comme des facteurs pronostiques [9]. Le choriocarcinome pose le problème de diagnostic différentiel surtout avec les retentions persistantes après aspiration molaire, tumeur de site d’implantation placentaire, ainsi que la tumeur trophoblastique épithélioide et le carcinome indifférencié dont L’étude immunohistochimique permet de typer la tumeur à l’aide des anticorps appropriés. Le choriocarcinome non gestationnel au niveau d’une métastase présente également un diagnostic différentiel du choriocarcinome. Son origine gestationnelle sera étayée par l’anamnèse et éventuellement par la mise en évidence du génome paternel au niveau des cellules tumorales.
Les éléments syncitiotrophoblastiques infiltrent le myomètre colonisent les vaisseaux et migrent à distance. Les sites métastatiques sont par ordre décroissant, le poumon (80%), le vagin (30%), le pelvis (20%), le cerveau (20%) et le foie (10%) les autres localisations (gastrointestinales, rénales, mediastinales et spléniques) sont exceptionnelles [10].
15
Image 8: Aspect microscopique du choriocarcinome : Prolifération biphasique sans
villosité placentaire infiltrant le myomètre (a : HES × 20), composée de cellules mononuclées entourées de cellules syncytiotrophoblastiques (b : HES × 200) [8]
16
II. Caractéristiques cytogénétiques
Sa carte génétique est très polymorphe [14]. Il est surtout diploïde d’origine biparentale et il porte une hétéroploïdie habituelle aux carcinomes sans stigmates particuliers permettant d’établir sa filière paternelle exclusive comme le voudrait l’opinion courante d’une filiation d’une môle complète au carcinome trophoblastique [17].
Le carcinome trophoblastique diploïde n’est pas forcement précédé d’une grossesse diploïde : un cas après môle complète tétraploïde et trois autres après môles partielles triploïdes ont été rapportés [17].
On a également souligné des gains et des pertes chromosomiques divers dont certains sont récurrents [17].
Certains choriocarcinomes ont un taux d’ADN aneuploïde, d’autres un taux polyploïde [19].
III. Pathogénie -Trois questions se posent:
D’abord quelle est l’étiologie de la môle?
Quelles sont les raisons de la transformation maligne qui ne touche pas toutes les môles ?
Quelles sont les raisons de cette disparité clinique qui va de la guérison relativement aisée sous traitement voir spontanément, à la mort
17
1. Etiologie de la môle : phénomène d’empreinte parentale :
Contrairement à certaines plantes ou espèces animales, parthénogenèse et
androgenèse aboutissent chez les mammifères et chez l’homme en particulier, à des conceptions hautement pathologiques.
Le phénomène d’empreinte parentale est à l’origine de cette barrière et de l’évolution diamétralement opposée de ces conceptus dont les chromosomes ne proviennent que d’un seul de leurs parents. [17].
La comparaison de l’évolution des môles complètes suggèrent assez
clairement que les génomes provenant du père et de la mère jouent un rôle différent dans les premières phases du développement d’un conceptus. Le premier apparaît plus spécifiquement dédié au développement des annexes et le second à celui de l’embryon. [17].
Ainsi Dans le cas des môles partielles (les triploïdies ayant deux jeux
paternels ou diandries) le déséquilibre dans la contribution chromosomique de chacun des parents perturbe gravement l’orchestration de l’expression des gènes soumis à l’empreinte parentale.
Parmi la soixantaine des gènes actuellement connus pour être soumis à cette empreinte une large majorité présente une fonction importante dans le
développement placentaire et fœtal dont les plus classiques sont H19 etIGF2. Très schématiquement, le déséquilibre génomique en faveur du génome
paternel, implique le développement anarchique des annexes .Celles-ci prennent l’aspect môlaire caractéristique au détriment de l’embryon. Ce dernier disparaît totalement dans le cas des môles complètes diploïdes où les deux jeux sont d’origine paternelle. [15]
18
2. Evolution vers les TTG:
Les môles hydatiformes, peuvent devenir invasives, dégénérer en un choriocarcinome.
a) Facteurs génétiques :
Comme toute tumeur, la transformation maligne résulte d’une cascade
d’événement secondaire à un déséquilibre entre prolifération, différenciation, apoptose et invasion.
On a pu identifier que le déséquilibre des gènes soumis à empreinte, avec expression anarchique de nombreux autres gènes par effet cascade ainsi que l’acquisition et ou la perte secondaire d’oncogène et anti-oncogène sont d’autant éléments pouvant intervenir sur l’évolution cancéreuse.
Les principaux gènes suppresseurs étudiés pour les TTG sont le p53, p21, Rb, GTPase-activatingproteins,et le DOC-2 ;dont l’expression est altérée en cas de choriocarcinome .
En ce qui concerne les gènes oncogènes un nombre limites est identifie jusqu'à présent, essentiellement le c-myc ; c-erb-b-2 ; bcl-2 ; et le mdm-2. Le rôle du nm23-H1 comme un vrai facteur préducteur d’invasion, a été remis en question après une étude américaine publiée en 2007[15].
D’autres mécanismes étaient également suggérés dans la pathogénie de la transformation maligne essentiellement le rôle de la télomerase, l’activité et l’expression de certaines molécules d’adhésion et des métaloproteinases[15]. Les résultats divergents témoignent de la complexité de la pathogénie, et impliquent l’identification d’autres mécanismes et molécules pour mieux éclaircir la pathogénie, déterminer le pronostic et même guider la thérapeutique.
19
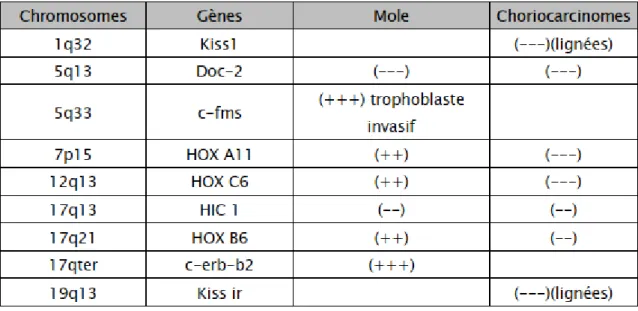
Tableau 2: tableau récapitulatif schématique des gènes et des anomalies chromosomiques récurrentes des môles et des choriocarcinomes.
b) Facteurs immunologiques :
Ils ont également leur importance dans la pathogénie.
Un effet immunosuppresseur :
Les travaux de Markert et al ont suggéré une activité immunosuppressive des choriocarcinomes car les surnagents de leur culture in vitro, inhibent
l’expression des motifs antigéniques CD25, 69, 71, 134, Cd/HLA-Dr sur des lymphocytes stimulés à la PHA. [17].
Le rôle d’HLA-G :
La molécule HLA de classe 1 HLA G, spécifiquement exprimée sur les
cytotrophoblastes à l’interface foetomaternelle, joue un rôle dans l’invasion naturelle en permettant aux cellules qui les portent d’échapper aux lymphocytes T CD8 et aux NK. Elles sont largement exprimées sur les môles. Cette propriété
20
leur semble bien spécifique car aucune expression HLA G n’a été retrouvée chez 75 lignées de tumeurs diverses. [17].
Le rôle d’HLA A-B et d’une éventuelle compatibilité :
On a suggéré qu’une relative compatibilité immunologique HLA entre les deux membres du couple peut intervenir à deux niveaux :
- La facilité de la double fécondation de l’ovocyte
- Le développement de la mole et du choriocarcinome en minimisant les rejets immunologiques.
Mais jusqu'à présent le rôle des antigènes HLA, en particulier A et B, n’est pas encore clarifié. [15]
Le rôle d’une éventuelle immunodépression :
Une étude sénégalaise a essayé de trouver une corrélation entre les TTG et les virus endémique à cette zone essentiellement le VIH. Elle a conclut qu’il n’y a pas d’évidence pour une prévalence augmentée de choriocarcinome chez les sujets porteurs de VIH, mais en revanche que cet état influence le pronostic et le traitement [18].
21
CHAPITRE 3 :
CAS CLINIQUE
22
I. OBSERVATION
Patiente X, âgée de 37ans, admise pour des métrorragies avec des douleurs pelviennes, n’ayant pas d’antécédents particuliers notables, 2em geste 2eme pare avec des accouchements par voie basse, sans notion d’aménorrhée avec des cycles menstruels réguliers.
L’examen a l’admission trouve une patiente apyrétique a 37°, TA a 125/70 mmHg, pouls à 90 impulsions / min.
L’examen gynécologique trouve : un utérus ante fléchi de taille normal, sans masse annexielle palpable avec au speculum présence d’un saignement noirâtre modérés d’origine endo-utérine
Un bilan biologique a été réalisé objectivant : une Hémoglobine 12, 7 g / dl; plaquettes 500 000 / mm3; leucocytes a 9000/mm3, ionogramme sans particularité, β-Hcg a15943 mUI / ml, groupage sanguin A +.
La patiente a subi une échographie trans-vaginale qui a montré une cavité utérine vide et d’aspect normal, sans visualisation de sac gestationnel intra-utérin, avec présence d’un processus tissulaire latéro-utérine droite de 49x36 mm, hétérogène, hyper vascularisée au Doppler, avec visualisation d’un épanchement pelvienne de moyen abondance.
23
Image 1 : échographie transvaginale montrant une cavité utérine normale et un ovaire gauche mesurant 44x22 mm
Image 2 : Echographie transvaginale montrant une cavité utérine normale et une masse annexielle droite mesurant 49x36 mm
24
Image 3 : Échographie montrant du liquide pelvien libre.
Le diagnostic d’une GEU a été suspecté au début, mais grâce a la stabilité hémodynamique de la patiente et vu l’aspect atypique d’une GEU qui a été visualisé sur l’échographie, l’équipe a discuté la réalisation d’un IRM pelvienne en urgence.
Les résultats de l’IRM pelvienne étaient en faveur d’une grossesse extra-utérine.
25
Image 4 : IRM montrant une tumeur annexielle droite correspondant à une grossesse extra-utérine.
26
Une laparotomie d'urgence a été réalisée. Lors de l'exploration, un hémopéritoine de moyenne abondance a été évacué faisant environ 700 cc, Avec la mise en évidence sur la trompe de Fallope droite une masse tissulaire saignante activement envahissant le côté latéral droit de l'utérus;
Les ovaires n’étaient pas touchés, une hystérectomie subtotale inter-annexielle a été réalisée. L’évolution postopératoire s’est déroulée sans incident.
Image: vue macroscopique postopératoire de l'utérus et de l'échantillon de tumeur droite.
L'examen histologique de la pièce opératoire a révélé une invasion de la trompe de Fallope avec des signes de rupture. Aucune formation villeuse n'a été trouvée, l'utérus a été partiellement envahi.
Un diagnostic de choriocarcinome de la trompe de Fallope a été posé.
Pour l'évaluation de l'extension, La patiente a subi un complément d'examens radiologiques.
Une tomodensitométrie abdominale et thoracique a été réalisée montrant des métastases pulmonaires.
27
Radio thoracique montrant un nodule métastatique L’IRM cérébrale était sans particularité
La patiente a été classée en FIGO stade I avec un score pronostique de 6 selon la classification FIGO 2000. suit: âge - score 0 (37 ans), grossesse antérieure - score 2 (grossesse à terme), intervalle de grossesse index – score 0 (patiente a eu
28
un accouchement à terme il y a 3 mois 1/2), prétraitement β valeur HCG - score 2 (10⁴ ->10⁵ ), plus la taille de la tumeur - score 1 (3 - <5cm), site de métastase - score 0 (poumon), le nombre de métastase identifiées – score 1 (1 – 4) et aucune chimiothérapie précédente - score 0 (aucun).
La patiente a été jugée à bas risque et traité par une monochimiotherapie
Tableau 1 : Classification pronostic FIGO 2000
La patiente a reçu une monochimiothérapie avec utilisation du méthotrexate 1 mg / kg par voie intraveineuse les jours 1, 3, 5 et 7 en alternance avec de l'acide folinique 0,1 mg / kg par voie intramusculaire les jours 2, 4, 6 et 8 du cycle. La réponse au traitement a été surveillée chaque semaine en vérifiant les mesures de β-Hcg sérique qui diminuaient progressivement et devenaient négatives après 2 mois,
29
Au cours du suivi, le patient était asymptomatique, aucun effet secondaire de la chimiothérapie n'a été observé. Et avait des règles normales. Le suivi a été réalisé en utilisant des tests de β HCG sur une base hebdomadaire pendant le premier mois, puis deux fois par mois. L'échographie a été réalisée lors de la visite de suivi pour voir toute récidive ou masse résiduelle des niveaux de β HCG en série et l'échographie pendant le suivi était dans les paramètres normaux. On a conseillé à la patiente une contraception et on lui a demandé d'éviter une grossesse pendant un an. Le suivi à 2 ans n'a révélé aucun signe de récidive.
30
II. DISCUSSION
Le choriocarcinome fait partie des tumeurs germinales malignes, il est une tumeur rare possédant un potentiel métastatique par diffusion hématogène. Les sites métastatiques les plus fréquents sont le poumon (80 %), le vagin (30 %), le cerveau (10 %), le foie (10 %) et le rein (1,4 %) [20].
Le diagnostic du choriocarcinome tubaire primitif est difficile car les symptômes cliniques associés sont souvent non spécifiques et peuvent simuler les autres maladies gynécologiques telles que le kyste ovarien, l'abcès tuba-ovarien et la grossesse extra-utérine [21].
Par exemple, Munkdur et al, Ont rapporté un cas de choriocarcinome tubaire se présentant comme une tumeur ovarienne qui a été traitée par adénexectomie et omentectomieinfracolique partielle suivie d'une chimiothérapie à agents multiples [22]. Dans ce cas, un choriocarcinome tubaire a été diagnostiqué accidentellement après l'examen pathologique postopératoire de l'échantillon de salpingectomie qui a été obtenu en raison d'une suspicion de grossesse tubaire rompue.
D’autre part Seema mehrota et UrmilaSingun ont rapporté un cas de choriocarcinome tubaire qui a été diagnostiqué initialement comme une grossesse extra-utérine chronique (le cas pareil de notre patiente). Lors de la laparotomie, ils ont remarqué une masse friable hémorragique dans le flanc gauche, adhérente à l'intestin. Une salpingoophérectomie du côté gauche a été réalisée. Les taux sériques de β HCG (gonadotrophine chorionique humaine) réalisés en période postopératoire étaient élevés. L'histopathologie a mis en évidence un choriocarcinome [23].
L'IRM, l'échographie endovaginale et le Doppler couleur jouent un rôle important dans le diagnostic du choriocarcinome intra-utérin [24]. Cependant,
31
aucun résultat d'imagerie spécifique n'a été défini pour le choriocarcinome extra-utérin; car le polymorphisme radiologique non spécifique peut faire discuter d’autres pathologies bénignes ou malignes.
Dans notre cas, l’échographie a suspecté un processus tumoral annexiel malin mais elle n’était pas visible à l’IRM.
En 2017, Hui-Ru Jia MM a publiée un cas d’une patiente de 39 ans qui s’est présenté au consultation avec des saignements vaginaux irréguliers indolores et une bosse palpable dans le bas de l'abdomen gauche pendant 2 mois après une aménorrhée de 6 semaines. Sa valeur sérique de gonadotrophine chorionique β-humaine a été significativement augmentée [25].
L'échographie a révélé une masse annexielle gauche, qui n'a montré aucun signal de flux sanguin sur l'imagerie de flux doppler couleur. Alors qu’un choriocarcinome semble être hautement vasculaire au Doppler couleur [2], [3]. La raison possible peut être la présence d’une grande proportion de composant kystique qui a empêché le sang à suivre la croissance de la tumeur. La torsion tumorale peut également entraîner une réduction de l'apport sanguin, mais sans preuves pertinentes, car la patiente n'a pas eu de douleur abdominale aiguë et le pédicule de la torsion n'a pas été découvert pendant l'opération.
32
Un autre examen IRM a montré une masse solide kystique bien définie avec une composante kystique représentant une grande proportion dans le bas-ventre gauche. La partie solide avec des signaux mixtes ressemblait à un nid d'abeille. Enfin, le choriocarcinome tubaire gauche a été confirmé par la pathologie.
(A et B) en T1et T2 ont détecté qu'une masse kystique solide de forme ronde avec une marge nette était située à gauche le bas de l'abdomen, la protrusion nodulaire et la partie solide étaient attachées à la paroi de la capsule. Composant solide ressemblant "rayon de miel." (C et D) T2 a détecté que le signal ovarien gauche similaire et la corne utérine gauche étaient tirés par la masse dans la direction supérieure gauche. (E) un composant solide partiel de la masse a montré une diffusion apparente légèrement limitée.
En conséquence, le choriocarcinome tubaire peut être suspecté à l'IRM ou a l’échographie pelvienne lorsque des signes spécifiques liés à la trompe de Fallope sont présents, tels qu'une partie solide montrant un «aspect en nid d'abeille», des ovaires normaux. En combinaison avec la présence d'aménorrhée, les symptômes typiques des saignements vaginaux et les taux sériques de β-HCG qui augmentent considérablement, les radiologues qui sont conscients des
33
néoplasmes des trompes de Fallope peuvent inclure le diagnostic de choriocarcinome tubaire dans leurs rapports avec plus de confiance [24].
D’autre part, Il a été rapporté que les tumeurs trophoblastiques, en particulier le choriocarcinome, produisent jusqu'à cent fois la quantité de β-Hcg sécrétée par une grossesse normale. Ceci est également valable pour notre cas comme le niveau initial de β-Hcg mesuré jusqu'à 15943 mUI / ml et de même pour les cas sus cités.
Par conséquent, la mesure et la surveillance des concentrations de β-Hcg sont les marqueurs les plus utiles pour une d’abord une orientation diagnostic et pour la détection de toute récidive après le traitement.
L'examen histologique d'un échantillon réséqué chirurgicalement est essentiel pour la
confirmation et le diagnostic du choriocarcinome. A savoir que tout acte chirurgical
comme une biopsie ou une ponction trans-pariétale reste très difficile a réaliser vu le caractère d’hyper vascularisation des lésions choriocarcinomateuses
Par conséquent, la vérification histopathologique surtout dans le cadre d’une grossesse extra utérin est essentielle pour la confirmation du diagnostic et l'exclusion de toute autre pathologie tubaire [25].
Dans notre cas, un diagnostic initial de grossesse extra-utérine a été posé à l'admission et le diagnostic final de choriocarcinome a été confirmé par un examen histologique postopératoire.
Le traitement est précédé d’un bilan d’extension complet qui comprend une exploration pulmonaire (radiographie ou scanner), la recherche de métastases hépatiques (échographie ou scanner) et cérébrales (IRM ou scanner) [27].
Ce bilan complémentaire permet de caractériser le CG selon la nouvelle classification FIGO (Tableau 1) [27]. Celle-ci comprend une stadification clinique et un score pronostique déterminé par des facteurs de risque.
Les scores pronostiques sont compris entre 4 et 14, et permettent de distinguer deux groupes : les patientes à faible risque (score de 0 à 6) et à risque élevé
34
(supérieur ou égal à 7) de mauvaise réponse au traitement par chimiothérapie. L’intérêt de cette classification est ainsi d’adapter le protocole thérapeutique aux facteurs de risque [26]
Le traitement de référence du choriocarcinome est la chirurgie avec la chimiothérapie.
Dans le choriocarcinome tubaire, un traitement conservateur pour les femmes plus jeunes peut être établi. Une salpingectomie ou annexectomie sans ablation de l'utérus est effectuée, suivie d'une chimiothérapie [28].
Pour les femmes plus âgées sans désir d'enfant, une annexectomie bilatérale ou une hystérectomie peut être préconisée [29].
Notre patient a subi une hystérectomie.
Pour la chimiothérapie, les trois molécules les plus efficaces sont : le méthotrexate, l’actinomycine-D et l’étoposide [30]. Le principe est d’administrer une monochimiothérapie aux patientes à faible risque, et une polychimiothérapie d’emblée pour les patientes à risque élevé [30,31].
Les protocoles proposés en monothérapie sont : méthotrexate (ou actinomycine-D en alternative) et en polychimiothérapie : APE ou EMA-CO (étoposide, méthotrexate, actinomycine-D, cyclophosphamide et vincristine).
Cette chimiothérapie sera suivie jusqu’à rémission complète, caractérisée par la négativité de taux successifs de βHCG, et complétée par trois cures de
consolidation [30].
La surveillance post-thérapeutique doit être à la fois clinique et paraclinique reposant essentiellement sur le dosage régulier des β-hCG [1,24].
Durant la surveillance, une contraception efficace doit être prescrite pendant au moins un an [1,2]. Toute grossesse ultérieure doit être considérée comme à risque de développer une tumeur trophoblastique gestationnelle et nécessite donc une échographie le plus tôt possible. Après l’accouchement, le placenta doit être envoyé à l’anatomopathologiste et les β-hCG doivent être dosées à six semaines du post-partum [13].
35
La guérison est définie par une normalisation des taux de β-hCG pendant trois semaines consécutives.
L’existence de récidives tardives justifie une surveillance prolongée [1,2]. Dans notre cas, une rémission complète était obtenue 8 semaines de traitement
Conclusion
Le choriocarcinome tubaire est une maladie rare de mauvais pronostic si elle n'est pas traitée. Cette étude nous rappelle l'importance de l'examen histologique de toute grossesse extra-utérine. Le diagnostic de choriocarcinome tubaire peut être posé en suspectant une grossesse extra-utérine avec un taux élevé de βHCG, une salpingectomie doit être réalisée et une chimiothérapie doit être suivie pour améliorer le pronostic et le taux de survie.
36
Bibliographie
[1]Golfier F, Raudrant D, Frappart L, Mathian B, Guastalla JP, Trillet-Lenoir V, et al. First epidemiological data from the French TrophoblasticDiseasereference
center. Am J ObstetGynecol. Feb 2007;196(2). 172:e1–5
[2] Allias F, Bolze PA, Gaillot-Durand L, Devouassoux-Shisheboran M; réseau des maladies trophoblastiques gestationnelles. Gestationaltrophoblasticdisease.
Annales de pathologie. Pages : 47–434. Nov 2014
[3] Steigrad SJ. Epidemiology of gestationaltrophoblasticdiseases. Best PractRes Clin ObstetGynaecol 2003;17(6):837–47.
[4] Minami S, Yamoto M, Nakano R. Immunohistochemicallocaliza- tion of inhibinactivinsubunits in hydatidiform mole and invasive mole. ObstetGynecol 1993 ; 82 : 414-8
[5] Benedet JL, et al. FIGO staging classifications and clinical practice guidelines in the management of gynecologic cancers. FIGO committee on
gynecologiconcology. Int J GynaecolObstet 2000;70(2):209–62.
[6] centre de référence des maladies trophoblastiques. Espace médecins. Disponible sur :
http://www.mole-chorio.com
[7]MESH. Définition du choriocrcinome. Disponible sur : http://www.chu-rouen.fr/page/choriocarcinome
[8] Allias F, Bolze PA, Gaillot-Durand L, Devouassoux-Shisheboran M; réseau des maladies trophoblastiques gestationnelles. Gestationaltrophoblasticdisease.
Annales de pathologie. Pages : 47–434. Nov 2014.
[9] Cheung ANY. Pathology of gestationaltrophoblasticdiseases. Best PractRes Clin ObstetGynaecol 2003; 17: 849-68
[10] Dilbert N et al : Prise en charge des tumeurs trophoblastiques. J.Gyneco.Obstet .Reprod 2006 ; 14 :140-163
[11] BENIRSCHKE K, KAUFMANN P. Pathology of the human placenta. New York: Springer; 2000.
[12] Aonahata M, Masuzawa Y, Tsutsui Y. A case of intraplacentalchoriocarcinome associatedwithplacentalhemangioma. Pathol Int 1998; 48: 897-901.
37 near-term placenta. Virchow Arch 1998; 433: 89-91.
[14] Jacques SM, Qureshi F, Doss BJ. Intraplacentalchoriocarcinomaassociatedwith viable pregnancy : pathologicfeatures and implications for the mother and
infant. PediatricDevelopPathol 1998; 1: 380-7
[15] Li H.W., Tsao S.W. and Cheung ANY ; currentunderstandings of molecular genetics of gestationaltrophoblasticdiseases ; Placenta ; volume 32; 2002 ; pages 20-31.
[16] Xingheng Y., Zhang Z., Yin L. and Jiand S.; the relationshipbetween expression of c-ras, c-erbB-2, nm23 and p53 geneproducts and
development of trophoblastictumor and theirpredictivesignificance for the malignant transformation of complete hydatiforme mole ; Gynecologie Oncology ; 85 ; 2002 ; Pages 438-444.
[17] Coullin P ; Des andor-et parthénogénotes humains (môles hydatiformes et tératomes ovariens) au cancer ; Gynécologie Obstétrique & Fertilité ; Volume
33 ; 2005 ; pages 469-482
[18] Cisse CT, Lo N, Morceau J C, Diadhiou F, Choriocarcinone au Sénégal ; épidémiologie, pronostic et prévention, Gynécologie Obstétrique & Fertilité ; 2002 ; pages 826-869.
[19] WAKEN, TANAKA K, CAPMAN V, MATSUI S, SANDBERG AA. Chromosomes and cellular origin of choriocarcinoma. Cancer Res 1981 : 413137-43.
[20] Regis C, Taieb S, Lesoin A, Baranzelli MC, Blehaut T, Leblanc E : Pré-
sentation inhabituelle d’un choriocarcinome gestationnel. GynecolObstetFertil2006 ; 34 : 716-9.
[21] Gestational trophoblastic disease of the fallopian tube.Muto MG, Lage JM, Berkowitz RS, Goldstein DP, Bernstein MRJ Reprod Med. 1991 Jan; 36(1):57-60.
[22] Fallopian tube choriocarcinoma presenting as ovarian tumour: a case report.
Mundkur A, Rai L, Hebbar S, Guruvare S, Adiga P J Clin Diagn Res. 2015 Jan; 9(1):QD01-2.
[23] Ectopictubalchoriocarcinoma: ararity/Seema Mehrotra,1 Urmila Singh,1 Madhumati Goel,2 and Shilpi Chauhan1Author information Copyright and License information Disclaimer [24] Ha HK, Jung JK, Jee MK, et al. Gestational trophoblastic tumors of the uterus: MR imaging—pathologic correlation. GynecolOncol 1995;57:340–50.
[25] MRI characteristics of primaryfallopian tube choriocarcinoma: a case report / Hui-Ru JiaMMa, Jing Zhang MDa,b, You-Min Guo MDc,*
38
neoplasia. Best PractRes Clin ObstetGynaecol 2003;17(6):893–903.
[27] FIGO staging for gestationaltrophoblasticneoplasia 2000. FIGO oncology committee. Int J GynaecolObstet 2002;77(3):285–7.
[28] Golfier F, Raudrant D, Frappart L, Guastalla J-P, Trillet-Lenoir V, Mathian B, et al. Les môles hydatiformes et les tumeurs trophoblastiques: conduite à tenir pratique. CNGOF.Mises à jour GynecolObstet 2003;XXVII:53-99.
[29] Segal S, Adoni A, Schenker JG. Choriocarcinoma of the Fallopian tube.GynecolOncol 1975;3:(1)40-45.
[30] Ng TY, Wong LC. Diagnosis and management of gestationaltrophoblastic neoplasia. Best PractRes Clin ObstetGynaecol 2003;17(6):893–903.
[31] ACOG Practice Bulletin #53. Diagnosis and treatment of gestationaltrophoblastic disease. ObstetGynecol 2004;103(6):1365–77.
[32] Boufettal H et al. Les môles hydatiformes complètes au Maroc : étude épidémiologique et clinique [Complete hydatiforme mole in Morocco: epidemiological and clinicalstudy]. Journal de Gynécologie, Obstétrique et Biologie de la Reproduction, 2011, 40(5):419–429. [33] Turan T et al. Resultswith EMA/CO (etoposide, methotrexate, actinomycin D,
cyclophosphamide, vincristine) chemotherapy in gestationaltrophoblasticneoplasia.
International Journal of Gynecological Cancer, 2006, 16:1432–1438
[34] Boufettal H et al. Les môles hydatiformes partielles au Maroc : étude épidémiologique et clinique [Partial hydatidiform mole in Morocco: an epidemiological and clinicalstudy]. La Revue de Santé de la Méditerranée orientale, 2012, 18(7):755–761
[35]. Ngan HYS et al. GestationalTrophoblasticNeoplasia, FIGO 2000 staging and classification. International Journal of Gynaecology and Obstetrics: the Official Organ of the International Federation of Gynaecology and Obstetrics, 2003, 83:175–177