Lire
la
première partie
Chapitre VI :
Enrichissement en composés peroxydés
et étude de codopages
et étude de codopages
Ce chapitre sera consacré, dans une première partie, aux résultats préliminaires obtenus lors de l’enrichissement d’apatites avec des espèces anioniques peroxydées, comprenant par exemple les ions peroxyde (O22-) ou superoxyde (O2-) afin de leur conférer
une potentielle propriété antibactérienne. La caractérisation physico-chimique de ces composés sera présentée et des résultats préliminaires d’évaluation microbiologique seront également évoqués. En deuxième partie de ce chapitre seront exposés les premiers essais de codopoage des apatites (incorporation de deux agents potentiellement antibactériens simultanément) ainsi que leurs caractérisations physico-chimiques et microbiologiques préliminaires.
VI.1. La voie anionique – Cas des peroxydes
VI.1.1. Données bibliographiques
VI.1.1.1. Les composés peroxydés
Ces composés constituent une famille dont la structure contient le groupement « peroxo », à savoir une liaison covalente entre 2 atomes d’oxygène : -O-O-. On distingue les composés peroxydés dits « complexes » des composés peroxydés dits « simples ». Les composés peroxydés complexes sont des composés dont le groupement peroxo est lié par des liaisons covalentes au reste de la structure, alors que dans les composés peroxydés simples, le groupement peroxo est lié de manière ionique aux autres éléments de la structure (généralement des ions métalliques). Il est possible de classifier ces composés peroxydés simples en 4 catégories selon la nature de l’ion oxygéné qui les compose (Vol’Nov, 1966) :
- les peroxydes, caractérisés par la présence de l’ion peroxyde O22-. Les deux atomes d’oxygène qui composent cet ion ont chacun un rayon de 1,35 Å et la liaison qui les relie mesure 1,49 Å. Les peroxydes sont diamagnétiques et généralement non colorés.
- Les superoxydes, caractérisés par la présence de l’ion superoxyde O2-. Cet ion peut être représenté comme un ellipsoïde de révolution contenant deux atomes d’oxygène de rayon 1,28 Å, dont la distance O-O est comprise entre 1,32 et 1,35 Å. Ces composés sont paramagnétiques et présentent une couleur jaune.
- Les ozonides, caractérisés par la présence de l’ion ozonide O3-. Cette structure est composée de 3 atomes d’oxygène liés entre eux par des liaisons mesurant 1,19 Å et formant un angle de 100 °. Les ozonides sont paramagnétiques et de couleur rouge.
et étude de codopages
- Les hydroperoxydes, caractérisés par la présence de l’ion hydroperoxyde HO2-. Cette dernière catégorie comprend notamment le peroxyde d’hydrogène, H2O2,
un oxydant et un antiseptique puissant, et l’un des composés peroxydés les plus simples et les plus utilisés.
Les propriétés caractéristiques des composés peroxydés comprennent la formation de peroxyde d’hydrogène par réaction en solution avec des acides dilués, la libération d’O2
par décomposition thermique et la libération d’oxygène par réaction avec l’eau et divers autres agents chimiques (Vol’Nov, 1966).
Ces caractéristiques et la nature oxydante de ces composés, et notamment du peroxyde d’hydrogène, sont à l’origine de nombreuses applications dans divers domaines. On peut par exemple citer leur utilisation pour blanchir certains produits (cellulose de bois, savon, graisse ou encore fourrure), dans la composition de produits détergents, leur addition dans l’industrie alimentaire (mise en conserve, fabrication du pain,…) ou cosmétique, leur participation lors de synthèses organiques ou inorganiques (initiateur de polymérisation, production de matériaux semi-conducteurs, vulcanisation du caoutchouc,…), ou bien encore leur utilisation pour la génération d’oxygène ou la dépollution des effluents (Falcon et al., 1993 ; Vol’Nov, 1966).
De plus, ces ions oxygénés ainsi que le peroxyde d’hydrogène sont également connus pour avoir des effets antibactériens que nous présenterons dans la section suivante.
VI.1.1.2. Les composés peroxydés en biologie et microbiologie
L’oxygène gazeux est un élément essentiel pour une grande majorité d’organismes. Cet oxygène participe à de nombreux processus vitaux au niveau cellulaire comme par exemple la production d’énergie (sous forme d’adénosine triphosphate, ATP) qui se réalise par phosphorylation oxydative impliquant notamment la transformation de O2 en H2O via
une enzyme par la réaction O2 + 4e- + 4H+ 2 H2O (Lushchak, 2001). De la même
manière, diverses réactions enzymatiques impliquent l’oxygène. Cependant, au cours de ces réactions, il peut y avoir formation d’espèces oxygénées réactives (nommées ROS, pour Reactive Oxygen Species), parmi lesquelles on rencontre notamment le radical hydroxyde (HO.) mais également l’ion superoxyde (O2-), l’ion peroxyde (O22-) ou le peroxyde
et étude de codopages
De par leurs propriétés fortement oxydantes, les ROS présentent une certaines toxicité pour les cellules (eucaryotes ou bactéries). Les ROS peuvent interagir avec les protéines en modifiant certains acides aminés (oxydation des groupements thiols de la cystéine ou de la méthionine, …), attaquer l’ADN (causant des ruptures de chaîne, ce qui peut engendrer des mutations et la mort cellulaire) ou encore détériorer les lipides (peroxydation lipidique44) (Farr & Kogoma, 1991 ; Lushchak, 2001 ; Storz et al., 1990). Comme ces ROS sont générés naturellement et nécessaire à la vie, les cellules ont développé des stratégies pour les contrôler, que l’on peut diviser en 3 actions (Lushchak, 2001) :
- Contrôler la génération des ROS
- Rendre les ROS moins toxiques sous l’action d’enzymes antioxydantes ou de « quenchers45 »
- Réparer les éléments endommagés (ADN, protéines,…)
Parmi les enzymes qui luttent contre l’effet des ROS, il est important de mentionner le rôle des superoxyde dismutases et des peroxydases. Les superoxyde dismutases (habituellement abrégées SOD) sont des métalloenzymes catalysant la dismutation de l’ion superoxyde en oxygène et en peroxyde d’hydrogène suivant les réactions :
2 2 ) 1 (
SOD
O
M
SOD
O
M
n n et 2 2 ) 1 ( 22
H
M
SOD
H
O
O
SOD
M
n noù M est un métal de transition comme Fe, Mn ou Cu.
Les peroxydases sont une classe d’enzymes, appartenant à la famille des oxydases46, chargées de décomposer un grand nombre d’espèces contenant le groupement peroxo, du type R-O-O-R’ par la réaction
OH
R
ROH
H
e
ROOR
'
2
2
'
Au sein de ces peroxydases, on retrouve notamment la catalase dont l’action est focalisée sur la dismutation du peroxyde d’hydrogène en oxygène et en eau (2 H2O2 O2 + 2 H2O). A l’instar des superoxyde dismutases, les peroxydases utilisent la
capacité des métaux de transition à exister sous plusieurs états d’oxydation pour exercer leurs actions antioxydantes.
44Formation de radicaux sur la chaine carbonée des lipides
45Entité moléculaire capable de désactiver un état excité créé dans une entité moléculaire par transfert d'énergie, d'électron ou par un
mécanisme chimique
et étude de codopages
Ces enzymes antioxydantes sont généralement présentes chez tous les organismes aérobies (tels que les cellules des mammifères ou les bactéries) et permettent de conserver un équilibre entre le taux de ROS formées et le taux de ROS détruites. Cependant, si cet équilibre est perturbé et que le taux de génération des ROS est trop important, les ROS vont s’accumuler dans la cellule. On parle alors de stress oxydatif. L’accumulation des ROS peut alors engendrer des lésions importantes dans la cellule (dénaturation de protéines altération de l’ADN) et causer sa mort.
C’est d’ailleurs un des modes d’action de l’organisme humain pour lutter contre les infections. En effet, les phagocytes produisent localement des ions superoxyde (O22-) via
une enzyme spécifique, l’oxidase NADPH phagocytique, afin de lutter contre les bactéries (Rada & Leto, 2008 ; Shenep et al., 1985). La génération de ROS est également le mode d’action de certains antibiotiques, tels que les fluoroquinolones (Albesa et al., 2004). C’est
pourquoi il a été reporté dans la littérature l’utilisation de composés peroxydés, et plus particulièrement du peroxyde d’hydrogène (H2O2), en tant qu’agent antibactérien
(Feuerstein et al., 2006 ; Imlay et al., 1988 ; Müller & Janz, 1993 ; Pedahzur et al., 1995 ; Shenep et al., 1985). Le peroxyde d’hydrogène n’est pas le plus toxique des ROS, mais sa stabilité et sa facilité de manipulation (notamment en comparaison avec l’ion O22- ou des
espèces radicalaires telles que HO.) en font un outil de choix pour ces applications. N’étant pas chargée, l’entité H2O2 pénètre facilement à l’intérieur des cellules (Sawai et al., 1998 ;
Shenep et al., 1985). De plus, en présence d’ions de métaux de transition (comme Fe ou Cu), présents dans les milieux biologiques, le peroxyde d’hydrogène peut produire d’autres espèces oxygénées réactives (Juven & Pierson, 1996), comme le radical hydroxyle HO., très toxique et à courte durée de vie, formé par la réaction de Fenton (Fenton, 1894 ; Imlay
et al., 1988) :
O
H
HO
Fe
H
O
H
Fe
2 2 2 3 . 2et étude de codopages
Ainsi, l’introduction directe d’H2O2 à des concentrations millimolaires dans des
cultures bactériennes a montré son efficacité à réduire la croissance de divers micro-organismes, parmi lesquels Escherichia coli ou Streptococcus mutans (Feuerstein et al., 2006 ; Imlay et al., 1988). A titre d’exemple, pour S. mutans, la MIC50 (la concentration minimale nécessaire à réduire de 50 % une population donnée) en H2O2 semble comprise
entre 3 et 30 mM (Feuerstein et al., 2006). Cependant, il apparaît également qu’une surconcentration en H2O2 puisse avoir des effets antagonistes sur l’inhibition bactérienne
conduisant alors à une perte des effets antibactériens (Imlay et al., 1988). Ce phénomène peut possiblement être expliqué par une série de réactions connues sous le nom du cycle de Haber-Weiss (équation (1) à (3)) (Haber & Weiss, 1934), impliquant notamment la réaction de Fenton (équation (1)) :
(1)
Fe
2H
2O
2H
Fe
3HO
.H
2O
(2)
HO
.H
2O
2HO
2.H
2O
(3)
HO
2.Fe
3O
2Fe
2H
Sur la base de ces réactions, Imlay suggère en effet que lorsque la concentration en H2O2
augmente l’équation (2) sera favorisée faisant alors diminuer la concentration en radicaux HO. liés à l’effet antibactérien (Imlay et al., 1988). Il semble donc important de maîtriser les concentrations en H2O2 pour pouvoir en atteindre des propriétés antibactériennes
optimales.
VI.1.1.3. Les apatites peroxydées
L’étude des apatites oxygénées (apatites dont les tunnels contiennent des espèces oxygénées sous différents états d’oxydation) a depuis longtemps attisé la curiosité scientifique (Trombe & Montel, 1978). Il a ainsi été montré que, outre les ions OH-, les tunnels apatitiques (voir section I.2.5.4 du chapitre I) pouvaient accueillir bon nombre de molécules, telles que H2O2 ou O2 (Rey, 1984) ou d’ions moléculaires parmi lesquels figurent
les ions peroxyde (O22-) et superoxyde (O2-) (Dugas & Rey, 1977).
La synthèse d’apatites contenant des ions O22- et/ou O2- peut se réaliser de diverses
manières comme par exemple par coprécipitation à 80 °C et pH 11,8 dans un milieu contenant du peroxyde d’hydrogène (Dugas & Rey, 1977), par calcination d’hydroxyapatite sous atmosphère d’oxygène sec (Trombe, 1971) ou encore par hydrolyse du βTCP en milieu peroxyde d’hydrogène (Simpson, 1969).
et étude de codopages
La détection et la quantification de ces espèces peuvent être réalisées grâce à des techniques d’analyses complémentaires comme la RPE qui permet notamment de détecter les ions superoxyde (paramagnétiques), les spectroscopies vibrationnelles (infrarouge ou Raman), ou bien les dosages chimiques permettant entre autre de quantifier les ions peroxyde O22- ou le peroxyde d’hydrogène (par exemple par titrage au permanganate de
potassium en solution pour le peroxyde d’hydrogène) (Charlot, 1966).
La présence de ces espèces peroxydées est également à l’origine de certaines modifications physico-chimiques sur des systèmes de nature apatitique, dont voici les principales données relevées dans la littérature en comparaison avec l’hydroxyapatite (Trombe, 1971 ; Rey, 1984 ; Yu et al., 2007 ; Zhao et al., 2000) :
- Dans la mesure où les ions peroxyde sont localisés dans les tunnels apatitiques en remplacement des ions OH-, une diminution de l’intensité des bandes infrarouge caractéristiques des ions OH- aux positions de 630 et 3570 cm-1 est observée. Cette dernière semble subir également un décalage vers la position 3567 cm-1 avec l’incorporation des ions O22-. Cependant la spectroscopie IR se
révèle inapte à détecter directement des espèces diatomiques symétriques ; les ions O22-, O2- ou l’oxygène moléculaire (O2) ne peuvent donc être détectés par
FTIR (Rey, 1984).
- La spectroscopie Raman révèle la présence de bandes supplémentaires, lors de l’incorporation des ions O22-, aux positions 3600 et 3622 cm-1 (attribuées à la
vibration d’ions OH- encore présents dans le réseau à proximité d’ions O
22-) et à
750 cm-1 attribuée à la vibration symétrique de l’ion O22-. La présence d’ions O3
2-et/ou O42- engendre également l’apparition de bandes d’absorption Raman larges
et disymétriques à 450 et 800 cm-1.
- Les résultats de DRX, et notamment en termes de paramètres de maille, reportés sur des apatites peroxydées se révèlent dépendants des conditions de préparation des échantillons. Trombe montre que l’incorporation d’ions peroxyde dans le réseau apatitique (d’une apatite obtenue par calcination sous O2)
engendre une contraction des paramètres de maille « a » et « c » (Trombe, 1971), alors que Rey observe, pour des apatites non-stœchiométriques formées par hydrolyse ou coprécipitation, une augmentation significative du paramètre de maille « a » lorsque des groupements peroxydés, tels que O22-, sont présents
et étude de codopages
L’enrichissement des apatites en agents antibactériens par la voie anionique apparaît donc différent de ceux précédemment décrits dans ce travail (effectués par voie cationique). Les environnements des tunnels apatitiques renferment des sites particuliers où des espèces variées peuvent être non seulement incorporées mais également échangées relativement aisément, tout au moins dans certaines conditions expérimentales. Dans ce chapitre, il nous a paru intéressant, en plus des apatites nanocristallines, d’étudier l’enrichissement en ions peroxyde dans des apatites présentant un meilleur état de cristallinité : la comparaison entre ces différents systèmes pouvant en effet permettre, a priori, d’en apprendre davantage sur l’incorporation de telles espèces peroxydées dans un réseau apatitique plus ou moins bien cristallisé.
Seront donc présentés dans les sections suivantes deux modes de synthèse d’apatites :
- Par l’hydrolyse du βTCP (Ca3(PO4)2), réalisée en présence de peroxyde
d’hydrogène, aboutissant à l’obtention d’apatites relativement bien cristallisées. Ces apatites sont généralement faiblement sous-stœchiométriques et révèlent la présence d’ions HPO42- dans leur composition chimique (Rey, 1984).
- Par la voie de synthèse des apatites nanocristallines (par coprécipitation), comme nous avons pu la décrire dans les chapitres précédents, mais qui sera réalisée en présence de peroxyde d’hydrogène.
La caractérisation physico-chimique des composés obtenus par ces méthodes de synthèse sera également présentée. Enfin, les résultats des premiers tests antibactériens que nous avons pu réaliser seront exposés en fin de cette première partie de chapitre (la seconde étant consacrée aux systèmes codopés). Les travaux présentés dans cette partie du chapitre ont été réalisés en collaboration avec Françoise Bosc, technicienne de laboratoire.
VI.1.2. Étude de l’hydrolyse du βTCP – Apatites peroxydées bien cristallisées
De nombreux phosphates de calcium présentent la propriété d’évoluer vers la structure apatitique lorsqu’ils sont placés en solution aqueuse. Tel est le cas par exemple de la brushite (CaHPO4.2H2O) (Montel, 1958 ; Lerch & Lemp, 1966), du phosphate
octocalcique (OCP, de formule Ca8(PO4)4(HPO4)2.5H2O) (Brown et al., 1962) ou bien
encore des phosphates tricalcique α et β (α et β-TCP de formule Ca3(PO4)2)
(Bredig et al., 1932 ; Monma & Kanazawa, 1976). Des études préliminaires sur l’hydrolyse du β-TCP en présence de peroxyde d’hydrogène pour synthétiser des apatites oxygénées ont été reportées dans la littérature (Simpson, 1969 ; Rey, 1984), c’est pourquoi nous avons choisi d’approfondir cette voie de synthèse. Dans cette section nous présenterons donc la
et étude de codopages
synthèse et les résultats obtenus par la voie de l’hydrolyse du βTCP conduisant à la formation d’apatites relativement bien cristallisées et contenant des espèces oxygénées à différents degrés d’oxydation.
VI.1.2.1. Synthèse
Dans ce travail, l’hydrolyse du βTCP (β-Ca3(PO4)2) a été réalisée comme suit :
Une masse 20 mg de poudre de βTCP (obtenue par des synthèses préalablement réalisées au laboratoire) est placée dans un récipient en verre muni d’un système d’obturation auquel est ajouté un volume 60 mL d’eau désionisée. Le récipient est ensuite fermé et placé à l’étuve préalablement portée à 100 þC pendant une durée de 24 heures ; après quoi le milieu est laissé à refroidir puis le composé est filtré sur Büchner et enfin séché par lyophilisation.
Cette voie de synthèse vise à conduire théoriquement à la formation d’(hydroxy-)apatite (ne contenant pas d’espèces oxygénées), qui sera utilisée comme composé de référence non dopé.
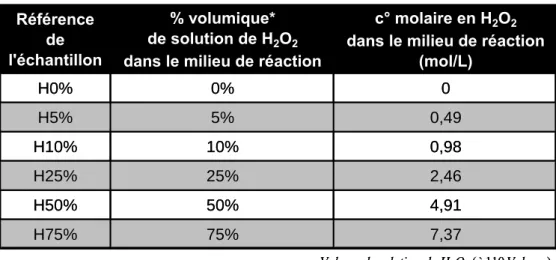
Pour la synthèse d’apatites peroxydées par hydrolyse du βTCP, le protocole suivi est resté identique au précédent mais l’eau désionisée servant à l’hydrolyse a été remplacée par une solution de peroxyde d’hydrogène diluée dans l’eau désionisée en différentes proportions. La solution de peroxyde d’hydrogène initiale utilisée est une solution à 110 volumes (soit 9,82 mol/L de H2O2). Le Tableau VI.78 reporte les concentrations en peroxyde
d’hydrogène testées dans ce travail.
total solution de Volume Volume à O H de solution de Volume 2 2( 110 )
* ce pourcentage correspond à la valeur au rapport :
Référence de l'échantillon
% volumique* de solution de H2O2
dans le milieu de réaction
c° molaire en H2O2
dans le milieu de réaction (mol/L) H0% 0% 0 H5% 5% 0,49 H10% 10% 0,98 H25% 25% 2,46 H50% 50% 4,91 H75% 75% 7,37 total solution de Volume Volume à O H de solution de Volume 2 2( 110 )
* ce pourcentage correspond à la valeur au rapport :
Référence de l'échantillon
% volumique* de solution de H2O2
dans le milieu de réaction
c° molaire en H2O2
dans le milieu de réaction (mol/L) H0% 0% 0 H5% 5% 0,49 H10% 10% 0,98 H25% 25% 2,46 H50% 50% 4,91 H75% 75% 7,37
Tableau VI.78 : Teneurs en peroxyde d’hydrogène testées lors de la synthèse d’apatites peroxydées par hydrolyse du βTCP (* ce pourcentage correspond à la valeur du rapport : volume H2O2 (à 110 volumes) / volume total de
et étude de codopages
VI.1.2.2. Caractérisations physico-chimiques
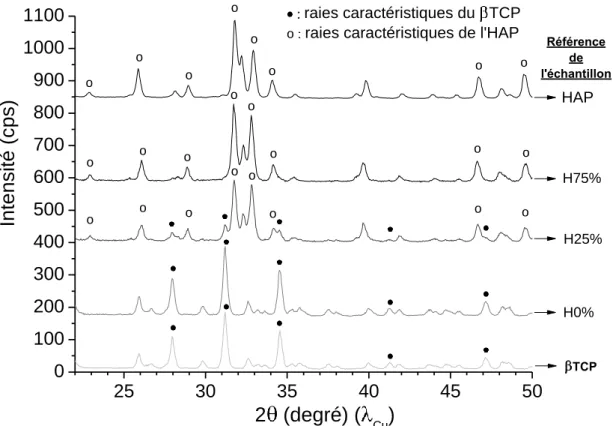
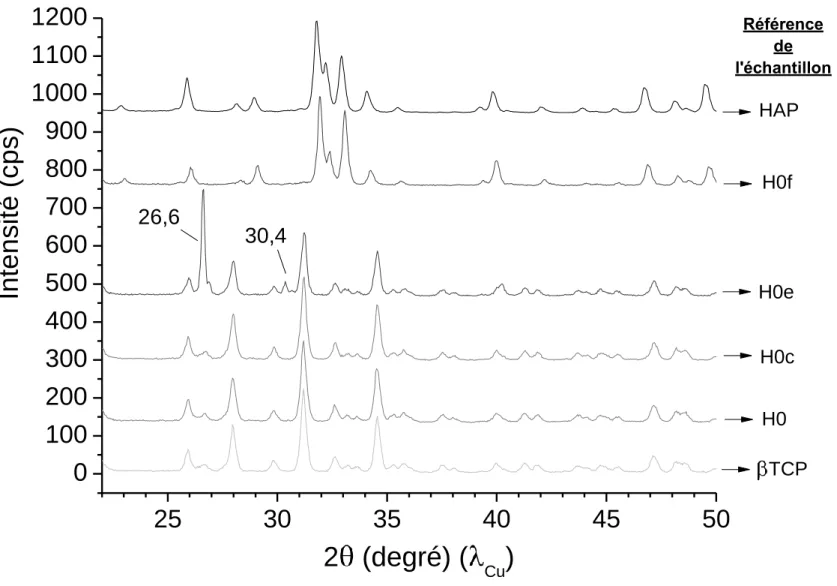
Des analyses par diffraction des rayons X ont été réalisées sur les échantillons synthétisés par hydrolyse du βTCP en milieu peroxyde d’hydrogène. Les diagrammes les plus caractéristiques, en comparaison avec le βTCP utilisé initialement pour la synthèse et avec l’hydroxyapatite (HAP), sont présentés sur la Figure VI.155.
25 30 35 40 45 50 0 100 200 300 400 500 600 700 800 900 1000 1100 H0% H25% H75% o o o o o o o o o o o o o o o o o o o o o o o raies caractéristiques du TCP
o raies caractéristiques de l'HAP
HAP
In
te
n
s
it
é
(
c
p
s
)
2 (degré) (
Cu)
TCP o Référence de l'échantillonFigure VI.155 : Diagrammes de diffraction des rayons X d’échantillons synthétisés par la voie de l’hydrolyse du βTCP avec différentes teneurs en peroxyde d’hydrogène en comparaison avec le βTCP initial et l’hydroxyapatite
et étude de codopages
Les résultats de diffraction des rayons X indiquent que l’échantillon ayant été synthétisé en milieu eau désionisée pure (échantillon H0%) ne se compose que de βTCP sans présence d’hydroxyapatite. Il apparaît donc qu’en absence de peroxyde d’hydrogène dans le milieu réactionnel, l’hydrolyse du βTCP en HAP ne se produit pas.
Les échantillons ayant été synthétisés en milieu eau + peroxyde d’hydrogène montrent qu’à mesure que la teneur en peroxyde d’hydrogène augmente dans le milieu réactionnel, la phase apatitique se forme et sa proportion augmente progressivement aux dépens de la phase βTCP (augmentation de l’intensité des raies de l’HAP et diminution de l’intensité de celles du βTCP). Cependant, parmi les échantillons testés, seul l’échantillon H75% (dont le pourcentage volumique de solution de H2O2 à 110 volumes dans le milieu réactionnel était de 75 %)
présente uniquement les raies de diffraction de la phase HAP, les autres pourcentages formant des systèmes biphasés HAP/βTCP. L’incorporation de peroxyde d’hydrogène dans le milieu favorise donc l’hydrolyse du βTCP mais elle n’est complète que pour des teneurs en peroxyde d’hydrogène importantes.
Le diffractogramme de l’échantillon H75% montre des raies de diffraction fines (contrairement aux diagrammes caractéristiques des apatites nanocristallines biomimétiques). Ainsi, les apatites synthétisées par ce procédé ont un état de cristallinité supérieur aux apatites nanocristallines que l’on a pu décrire dans les chapitres précédents. Une analyse par microscopie électronique à balayage (MEB) réalisée sur ces échantillons, dont les micrographies sont présentées à la Figure VI.156, montre des cristaux de forme aciculaire dont les dimensions sont comprises entre 0,5 et 2 µm de largeur et allant jusqu’à plusieurs dizaines de µm de longueur. La différence d’état de cristallinité entre les apatites nanocristallines et ces échantillons-ci peut donc être expliquée en partie par la taille micrométrique des cristaux des échantillons obtenus par hydrolyse du βTCP (à 100 þC) alors que les apatites nanocristallines présentent des cristaux de taille nanométrique.
et étude de codopages
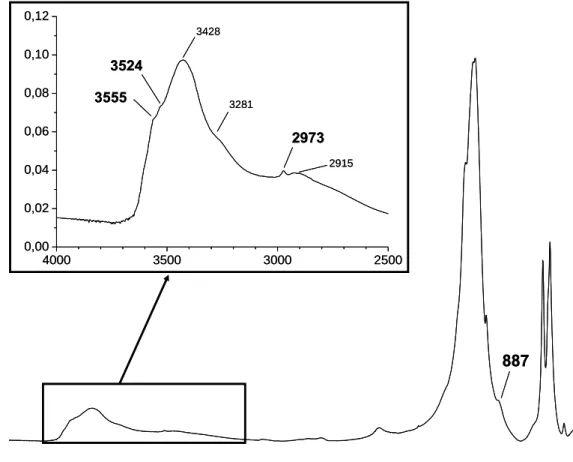
Une analyse par spectroscopie infrarouge a également été réalisée sur le seul échantillon ayant été obtenu ici présentant une structure apatitique monophasée (échantillon H75%). Le spectre FTIR de cet échantillon est présenté à la Figure VI.157.
4000
3500
3000
2500
2000
1500
1000
500
0,0
0,2
0,4
0,6
0,8
1,0
A
b
s
o
rb
a
n
c
e
Nombre d'onde (cm
-1)
887 4000 3500 3000 2500 0,00 0,02 0,04 0,06 0,08 0,10 0,12 2973 3555 3524 3428 3281 29154000
3500
3000
2500
2000
1500
1000
500
0,0
0,2
0,4
0,6
0,8
1,0
A
b
s
o
rb
a
n
c
e
Nombre d'onde (cm
-1)
887 4000 3500 3000 2500 0,00 0,02 0,04 0,06 0,08 0,10 0,12 2973 3555 3524 3428 3281 2915Figure VI.157 : Spectre FTIR de l’échantillon H75%
Le spectre FTIR de cet échantillon indique la présence des bandes de vibration caractéristiques des ions phosphate en environnements apatitiques, à 471 cm-1 (ν2(PO4)), à
560/571/605 cm-1 (ν4(PO4)), à 960 cm-1 (ν1(PO4)) et à 1040/1089 cm-1 (ν3(PO4)). La
décomposition spectrale des bandes situées dans le domaine 400-800 cm-1 révèle également une concentration non-négligeable d’ions HPO42- apatitiques. La présence de la bande FTIR
située à 887 cm-1, attribuée à la vibration de la liaison P-OH des ions HPO42-
(Eichert et al., 2008), confirme également la présence de ces espèces.
En revanche, la décomposition spectrale montre qu’aucun ion en environnements non-apatitiques, ni même d’ions OH
apatitiques, ne sont détectés par spectroscopie FTIR. L’absence d’environnements non-apatitiques est due au mode de synthèse (T = 100 °C) qui ne favorise pas la formation de tels environnements hydratés. L’absence d’ions OH
peut, quant à elle, être reliée à l’incorporation d’espèces, probablement oxygénées, dans les tunnels apatitiques en remplacement des ions hydroxyde. L’absence d’ions OH
est également observée par l’absence de la bande d’absorption caractéristique de ces ions à la position de 3570 cm-1.
et étude de codopages
L’encadré de la Figure VI.157 indique en revanche l’apparition de deux bandes aux positions 3524 et 3555 cm-1 que l’on ne retrouve pas pour l’hydroxyapatite. La littérature ne fait pas mention de ces bandes à notre connaissance. Peut être ces bandes d’absorption sont-elles dues à des ions OH- résiduels dont la vibration est perturbée par des espèces oxygénées localisées à proximité. Enfin, il est également possible d’observer une bande fine à 2973 cm-1
, qui n’a pas, à notre connaissance, été reportée dans la littérature et qui demanderait des analyses complémentaires pour être attribuée (analyses que nous n’avons pas pu réaliser dans ce travail faute de temps).
Nous venons de voir que l’hydrolyse du βTCP en apatite n’était possible que pour de très importantes teneurs en peroxyde d’hydrogène (75 %) dans ces conditions expérimentales. Il ne semble donc pas possible avec ces paramètres de synthèse ni de faire varier la teneur en ions oxygénés incorporés à l’apatite, ni de pouvoir obtenir une référence non dopée. Rey indique que la réaction d’hydrolyse du βTCP est réalisée par des mécanismes complexes où interviennent 4 étapes principales (Rey, 1984) :
- 1) la dissolution partielle de la phase βTCP
- 2) l’augmentation du rapport Ca/P dans le milieu réactionnel - 3) la formation de la phase apatitique
- 4) l’évolution de cette phase vers la stœchiométrie
Toutes ces étapes sont fortement influencées par les conditions de synthèse et dépendent notamment de la température, du pH ou bien du temps de réaction. Nous avons donc réalisé une série d’expériences visant à obtenir des apatites (non dopées) par hydrolyse du βTCP en variant les conditions de synthèse en vue d’obtenir, dans un second temps, des composés enrichis en espèces oxygénées dont il serait possible de faire varier la teneur. Ces expérimentations font l’objet de la section suivante.
VI.1.2.3. Tentatives d’obtention d’apatite non dopée par hydrolyse du βTCP
Dans cette section, nous nous intéresserons donc à l’influence des conditions de synthèse sur l’obtention d’une hydrolyse complète du βTCP en apatite.
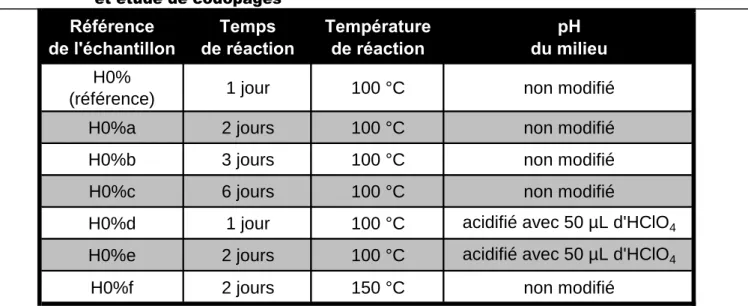
Les paramètres de synthèse que nous avons fait varier afin de réaliser une hydrolyse complète du βTCP sont le temps et la température de réaction ainsi que le pH du milieu réactionnel. Les autres conditions expérimentales (volume de liquide et masse de solide) sont restées identiques à celles décrites dans la section VI.1.2.1 et les paramètres ayant été modifiés sont résumés dans le Tableau VI.79.
et étude de codopages
Référence
de l'échantillon de réactionTemps Température de réaction du milieupH
H0%
(référence) 1 jour 100 °C non modifié
H0%a 2 jours 100 °C non modifié
H0%b 3 jours 100 °C non modifié
H0%c 6 jours 100 °C non modifié
H0%d 1 jour 100 °C acidifié avec 50 µL d'HClO4
H0%e 2 jours 100 °C acidifié avec 50 µL d'HClO4
H0%f 2 jours 150 °C non modifié
Tableau VI.79 : Conditions de synthèse ayant été évaluées pour obtenir une hydrolyse complète du βTCP en apatite
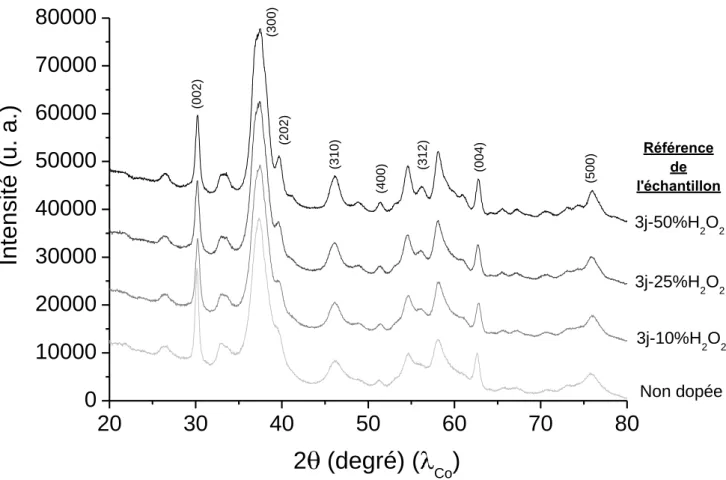
Afin d’évaluer si l’hydrolyse du βTCP a eu lieu et si elle a été complète, une analyse par diffraction des rayons X a été menée sur les échantillons ainsi préparés, dont les résultats sont présentés sur la Figure VI.158. Les résultats indiquent qu’à 1, 2, 3 ou 6 jours de temps de réaction à 100 þC, tous les échantillons ne sont composés que de βTCP, comme le montrent les exemples de diffractogrames (Figure VI.158) des échantillons H0% et H0%c (1 et 6 jours de réaction respectivement). Ainsi, l’augmentation du temps de réaction, même jusqu’à 6 jours, en conservant une température de 100 þC, se révèle inefficace pour amorcer l’hydrolyse du βTCP.
Les données de DRX obtenues pour les échantillons dont la réaction a été conduite après une acidification du milieu réactionnel par ajout de HClO4 avec un temps de réaction de
24 et 48 heures montrent des diffractogrammes caractéristiques de la phase cristalline βTCP et aucune raie de diffraction attribuable à la structure apatitique ne peut être détectée. Ces résultats sont illustrés avec l’exemple de l’échantillon dont le temps de réaction est de 48 heures présenté à la Figure VI.158. Notons toutefois que sur ce diagramme deux raies additionnelles aux positions en 2 de 26,6 ° et à 30,4 vraisemblablement attribuables à la présence de monétite (CaHPO4) sont observées. L’acidification du milieu de réaction n’a donc
pas permis non plus d’engendrer l’hydrolyse totale du βTCP en hydroxyapatite dans ces conditions (100 °C avec 1 ou 2 jours de réaction).
Enfin, concernant l’échantillon dont la synthèse a été réalisée à la température de 150 °C avec un temps de réaction de 2 jours, la diffraction des rayons X révèle un diffractogramme composé uniquement des raies de l’apatite sans présence de βTCP résiduel (Figure VI.158). Il apparaît donc que l’élévation de température à 150 þC, pendant 2 jours de réaction, permette effectivement une hydrolyse complète du βTCP en apatite.
et étude de codopages
25
30
35
40
45
50
0
100
200
300
400
500
600
700
800
900
1000
1100
1200
H0f H0e H0c H0 TCPIn
te
n
s
it
é
(
c
p
s
)
2 (degré) (
Cu)
HAP Référence de l'échantillon30,4
26,6
Figure VI.158 : Diagrammes de diffraction des rayons X d’échantillons synthétisés par hydrolyse du βTCP à 100 °C avec un temps de réaction de 1 et 6 jours (échantillons H0 et H0c), à 100 °C avec un temps de réaction de 2 jours et un pH acidifié avec HClO4 (échantillon H0e) et à 150 °C avec un temps de réaction de 2 jours (échantill H0f) en
et étude de codopages
Ainsi, parmi tous les paramètres de synthèse testés ici, seule une élévation de température à 150 þC (avec un temps de réaction de 2 jours) a permis l’hydrolyse du βTCP en HAP. Il apparaît donc possible, en partant de ces conditions de synthèse et avec ajout de peroxyde d’hydrogène dans le milieu de réaction en différentes proportions, d’obtenir des apatites contenant potentiellement des espèces oxygénées en teneurs variables. Il a été reporté dans la littérature que le rapport solide/solution avait également une influence sur les mécanismes d’hydrolyse du βTCP (Rey, 1984). Il aurait été intéressant d’évaluer ces paramètres mais il n’a cependant pas été possible de mener ces expérimentations durant la période de ce travail.
De manière parallèle à cette étude sur les apatites dont l’état de cristallinité était relativement important, une série d’expérimentations a été réalisée en vue d’obtenir des apatites nanocristallines biomimétiques enrichies en espèces oxygénées. Ces expérimentations font l’objet du paragraphe suivant.
VI.1.3. Étude de la coprécipitation – Apatites nanocristallines peroxydées
Dans ce paragraphe, nous nous intéresserons à la synthèse et à la caractérisation physico-chimique d’apatites nanocristallines en présence de peroxyde d’hydrogène afin de potentiellement les enrichir en espèces oxygénées et leur conférer d’éventuelles propriétés antibactériennes.
VI.1.3.1. Synthèse
Pour réaliser ces synthèses d’apatites nanocristallines en présence de peroxyde d’hydrogène, un protocole similaire à ceux décrits dans les chapitres précédents a été utilisé. Trois échantillons ont été réalisés pour cette étude dont voici le détail du protocole de synthèse :
Une solution A d’ions calcium est tout d’abord préparé par dissolution de nitrate de calcium (Ca(NO3)2.4H2O) à la concentration de 0,3 mol/L dans une solution contenant à la fois
de l’eau désionisée et du peroxyde d’hydrogène en proportion variable. Les concentrations en peroxyde d’hydrogène testées dans cette étude sont reportées dans le Tableau VI.80. Une solution B d’ions phosphate est également préparée en dissolvant (NH4)2HPO4, pour atteindre
une concentration en ions phosphate de 0,6 mol/L, dans une solution d’eau désionisée et de peroxyde d’hydrogène de concentration en peroxyde d’hydrogène identique à celle de la solution A. Un volume de la solution A est ensuite rapidement versé dans un volume double de solution B sous agitation. Le milieu de précipitation est ensuite laissé à maturer pendant 3 jours à température ambiante avant d’être filtré. Le précipité est ensuite lavé à l’eau désionisée et lyophilisé pendant 3 jours. La Figure VI.159 schématise ce protocole de synthèse.
et étude de codopages total solution de Volume Volume à O H de solution de Volume 2 2( 110 )
* ce pourcentage correspond à la valeur au rapport :
Référence de l'échantillon
% volumique*
de solution de H2O2
dans le milieu de réaction
c° initiale en H2O2 (mol/L) 3j-10%H2O2 10% 0,98 3j-25%H2O2 25% 2,46 3j-50%H2O2 50% 4,91 total solution de Volume Volume à O H de solution de Volume 2 2( 110 )
* ce pourcentage correspond à la valeur au rapport :
Référence de l'échantillon
% volumique*
de solution de H2O2
dans le milieu de réaction
c° initiale en H2O2 (mol/L) 3j-10%H2O2 10% 0,98 3j-25%H2O2 25% 2,46 3j-50%H2O2 50% 4,91
Tableau VI.80 : Teneurs initiales en peroxyde d’hydrogène testées pour la synthèse d’apatites nanocristallines en présence de H2O2
Co-précipitation Maturation
3 jours, Tamb FiltrationRinçage Lyophilisation Sol A
Sol B
Ca(NO3)2.4H2O + H2O + H2O2
(NH4)2HPO4+ H2O + H2O2
Co-précipitation Maturation
3 jours, Tamb FiltrationRinçage Lyophilisation Sol A
Sol B
Ca(NO3)2.4H2O + H2O + H2O2
(NH4)2HPO4+ H2O + H2O2
Figure VI.159 : Représentation schématique du protocole de synthèse d’apatites nanocristallines en présence de peroxyde d’hydrogène
VI.1.3.2. Caractérisations physico-chimiques
En premier lieu, la diffraction des rayons X a été utilisée pour caractériser les 3 échantillons dont la synthèse est décrite dans la section précédente. Les diagrammes obtenus sont reportés sur la Figure VI.160.
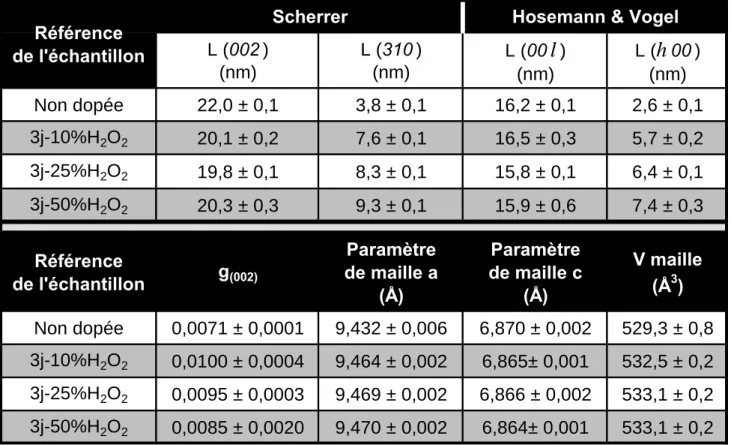
Tous ces diffractogrammes indiquent que les échantillons synthétisés suivant le protocole de synthèse des apatites nanocristallines en milieu peroxyde d’hydrogène présentent une structure apatitique proche de l’échantillon d’apatite nanocristalline synthétisée sans peroxyde d’hydrogène. Aucune phase secondaire ne peut être détectée par DRX dans ces échantillons. Il est également possible d’observer une amélioration de la résolution des diagrammes de DRX avec l’augmentation de la teneur en peroxyde d’hydrogène ajoutée
et étude de codopages
initialement lors de la synthèse, ce qui est particulièrement visible au niveau des raies (202) et (312) (Figure VI.160). Les échantillons synthétisés en présence de peroxyde d’hydrogène ont donc un meilleur état de cristallinité que des échantillons préparés dans les mêmes conditions en absence de peroxyde d’hydrogène.
20
30
40
50
60
70
80
0
10000
20000
30000
40000
50000
60000
70000
80000
(2 0 2 ) (3 1 2 ) 3j-50%H2O2 3j-25%H 2O2 3j-10%H2O2In
te
n
s
it
é
(
u
.
a
.)
2 (degré) (
Co)
Non dopée (0 0 2 ) (3 0 0 ) (3 1 0 ) (4 0 0 ) (00 4 ) (5 0 0 ) Référence de l'échantillonFigure VI.160 : Diagrammes de diffraction des rayons X des échantillons synthétisés par coprécipitation à température ambiante en milieu peroxyde d’hydrogène à différentes teneurs (10%, 25% et 50 % volumique) avec un temps de maturation de 3 jours en comparaison avec une apatite nanocristalline synthétisée par coprécipitation en milieu eau
désionisée pure à température ambiante et maturée 3 jours
Les analyses par profile fitting réalisées sur les diffractogrammes de ces échantillons, dont les résultats sont résumés dans le Tableau VI.81, révèlent que l’amélioration de l’état de cristallinité est principalement due à une augmentation de la valeur de L(310) (modèle de Scherrer) ou de L(h00) (modèle de Hosemann et Vogel). Ces valeurs augmentent continuellement avec l’augmentation de la teneur initiale en peroxyde d’hydrogène, passant de
2,6 nm à 7,4 nm entre 0 et 50 % volumique de solution de peroxyde d’hydrogène, soit un
accroissement de près de 185 %. Cependant la longueur moyenne des cristallites (valeurs L(00l) évaluées ici par les modèles de Scherrer ou de Hosemann et Vogel) ne varie pas significativement (valeur proche de 16 nm suivant le modèle de Hosemann et Vogel).
et étude de codopages
Le paramètre de distorsion dans la direction [002], g002, tend à diminuer graduellement
avec l’augmentation de la teneur en peroxyde d’hydrogène : une baisse d’environ 15 % est
observée lorsque la teneur initiale en peroxyde d’hydrogène passe de 10 à 50 % (Tableau VI.81). Bien que la valeur de g002 soit systématiquement plus grande pour les
échantillons synthétisés en présence de H2O2 que celle déterminée en absence de H2O2, sa
diminution avec l’augmentation de la teneur initiale de H2O2 peut en partie expliquer
l’amélioration de l’état de cristallinité des composés.
L (002 ) (nm) L (310 ) (nm) L (00
l
) (nm) L (h
00 ) (nm) Non dopée 22,0 ± 0,1 3,8 ± 0,1 16,2 ± 0,1 2,6 ± 0,1 3j-10%H2O2 20,1 ± 0,2 7,6 ± 0,1 16,5 ± 0,3 5,7 ± 0,2 3j-25%H2O2 19,8 ± 0,1 8,3 ± 0,1 15,8 ± 0,1 6,4 ± 0,1 3j-50%H2O2 20,3 ± 0,3 9,3 ± 0,1 15,9 ± 0,6 7,4 ± 0,3 Non dopée 0,0071 ± 0,0001 9,432 ± 0,006 6,870 ± 0,002 529,3 ± 0,8 3j-10%H2O2 0,0100 ± 0,0004 9,464 ± 0,002 6,865± 0,001 532,5 ± 0,2 3j-25%H2O2 0,0095 ± 0,0003 9,469 ± 0,002 6,866 ± 0,002 533,1 ± 0,2 3j-50%H2O2 0,0085 ± 0,0020 9,470 ± 0,002 6,864± 0,001 533,1 ± 0,2 Référence de l'échantillon Référence de l'échantillon V maille (Å3)Scherrer Hosemann & Vogel
g(002) Paramètre de maille a (Å) Paramètre de maille c (Å)
Tableau VI.81 : Résultats issus de profile fitting réalisés sur des diffractogrammes de rayons X ( Cu) d’apatites
nanocristallines synthétisées par coprécipitation à température ambiante en milieu peroxyde d’hydrogène avec un temps de maturation de 3 jours en comparaison avec une apatite nanocristalline synthétisée en absence de H2O2 et
maturée 3 jours
Enfin, l’analyse par profile fitting indique une augmentation significative du paramètre de
maille « a », qui passe de 9,432 Å à 9,470 Å, et une diminution en moindre proportion du paramètre de maille « c », passant de 6,870 Å à 6,864 Å, lorsque la teneur initiale en H2O2
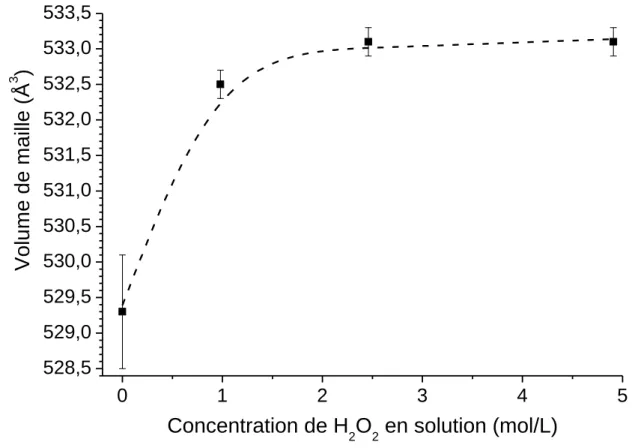
passe de 0 à 50 % respectivement. Cette variation des paramètres de maille engendre une augmentation du volume de maille cristalline lorsque la synthèse est réalisée en présence de H2O2 et ce dès 10 % en H2O2 (Tableau VI.81). Le volume de maille augmente rapidement aux
faibles teneurs en H2O2 incorporées lors de la synthèse (jusqu’à une concentration initiale en
solution de 2,46 mol/L) puis se stabilise à une valeur proche de 533 Å3 (Figure VI.161). Ces données semblent attester d’une incorporation d’espèces chimiques (probablement des espèces oxygénées) de grande taille dans le cœur apatitique des nanocristaux (en comparaison avec celles présentes initialement dans les apatites nanocristallines synthétisées en absence de peroxyde d’hydrogène) engendrant une dilatation de la maille cristalline. En
et étude de codopages
revanche au-delà d’un pourcentage volumique de solution de H2O2 de 25 %, le fait que le
volume de maille n’évolue plus peut signifier que la teneur de ces espèces présentes dans le cœur apatitique a atteint un maximum et que « l’excédent » s’incorpore préférentiellement dans les environnements non-apatitiques de surface des nanocristaux ou ne s’incorpore pas. De plus, ces espèces semblent favoriser une croissance cristalline préférentielle dans une direction perpendiculaire à l’axe c des cristaux (augmentation de la largeur moyenne des cristallites). La présence de peroxyde d’hydrogène dans le milieu de précipitation de ces apatites nanocristallines semble donc jouer le rôle d’accélérateur de croissance cristalline avec la particularité d’un accroissement des dimensions réalisé en largeur/épaisseur des cristallites et non pas en longueur.
0 1 2 3 4 5 528,5 529,0 529,5 530,0 530,5 531,0 531,5 532,0 532,5 533,0 533,5
V
o
lu
m
e
d
e
m
a
ille
(
Å
3)
Concentration de H
2O
2en solution (mol/L)
Figure VI.161 : Évolution du volume de maille cristalline en fonction de la concentration initiale en H2O2 introduite lors
de la synthèse
La microscopie électronique à balayage a été utilisée pour caractériser ces échantillons et déceler une éventuelle évolution de la morphologie des particules (agglomérats de nanocristaux). Les micrographies présentées à la Figure VI.162 ne révèlent aucune différence sur les particules observées par MEB entre les échantillons d’apatites nanocristallines synthétisées en présence ou en absence de peroxyde d’hydrogène. Aucune particule de morphologie différente n’a non plus été observée.
et étude de codopages
Figure VI.162 : Micrographies MEB d’apatites nanocristallines a) de référence (synthétisé en absence de H2O2), ou
synthétisées b) avec 10 %, c) avec 25 % et d) avec 50 % volumique de H2O2 et dont le temps de maturation est de 3
jours
Afin de potentiellement relier les précédents résultats à la teneur en peroxyde dans le solide, des dosages chimiques ont été réalisés sur ces échantillons. Le titrage du peroxyde d’hydrogène a été effectué par une méthode colorimétrique utilisant du permanganate de potassium KMnO4 (Charlot, 1966). Cette méthode fait intervenir le couple oxydo-réducteur :
ions permanganate MnO42- colorés (violet) et ions manganèse Mn2+ incolores selon la réaction :
O
H
O
Mn
H
O
H
MnO
45
2 26
2
25
28
22
Brièvement, pour réaliser ces dosages, les échantillons (sous forme de poudre) d’apatites nanocristallines synthétisés en présence de peroxyde d’hydrogène sont, dans un premier temps, dissous en utilisant de l’acide perchlorique concentré (HClO4). La solution obtenue est
alors titrée par ajout d’une solution de KMnO4 (à 0,02 mol/L) ; le point équivalent est alors
atteint lorsque la coloration violette persiste. Le volume de solution de KMnO4 est mesuré à ce
point afin de calculer la concentration en peroxyde d’hydrogène en solution et de remonter à leur teneur dans le solide.
et étude de codopages
Les résultats de ces dosages effectués sur les échantillons 3j-10%H2O2, 3j-10%H2O2 et
3j-10%H2O2 sont reportés dans le Tableau VI.82.
Référence de l'échantillon Teneur en H2O2 dans le solide (mmol/100mg) 3j-10%H2O2 0,014 3j-25%H2O2 0,013 3j-50%H2O2 0,018
Tableau VI.82 : Résultats de dosage du peroxyde d’hydrogène sur les échantillons d’apatites nanocristallines synthétisés en présence de H2O2
Ces données témoignent tout d’abord de la présence (quantifiable) de peroxyde d’hydrogène dans la composition des apatites nanocristallines. La teneur en peroxyde d’hydrogène contenue dans le solide ne varie cependant pas significativement avec l’augmentation de la concentration en H2O2 introduite dans le milieu de précipitation. Il faut
toutefois noter que la méthode de dosage employée ici ne permet de quantifier que le peroxyde d’hydrogène (et les ions peroxyde) et non les autres composés peroxydés tels que les ions superoxyde, ozonide,… Des analyses complémentaires, notamment de RPE (Résonnance Paramagnétique Electronique), qu’il n’a pas été possible d’effectuer au cours ce travail pas faute de temps, sont nécessaires pour pouvoir détecter et quantifier ces espèces.
Des analyses de spectroscopie vibrationnelle Raman et infrarouge ont été réalisées sur ces échantillons d’apatites nanocristallines synthétisées en présence de peroxyde d’hydrogène afin de potentiellement en apprendre davantage sur les espèces chimiques incorporées aux nanocristaux.
En spectroscopie infrarouge, les spectres ne révèlent que les bandes caractéristiques des apatites nanocristallines sans bandes d’absorption additionnelles lorsqu’est ajouté du peroxyde d’hydrogène au milieu de précipitation (Figure VI.163). Bien que de faible intensité pour l’échantillon non dopé, la bande relative à l’élongation des ions OH
à 3570 cm-1 n’est plus détectée pour les composés synthétisés en présence de peroxyde d’hydrogène (Encadré de la Figure VI.163).
et étude de codopages
4000
3500
3000
2500
2000
1500
1000
500
0,0
0,4
0,8
1,2
1,6
2,0
50 % H2O2 25 % H 2O2 10 % H2O2A
b
s
o
rb
a
n
c
e
Nombre d'onde (cm
-1)
Non dopée 3700 3600 3500 3400 3300 3200 0,0 0,2 0,4 0,6 0,8 35704000
3500
3000
2500
2000
1500
1000
500
0,0
0,4
0,8
1,2
1,6
2,0
50 % H2O2 25 % H 2O2 10 % H2O2A
b
s
o
rb
a
n
c
e
Nombre d'onde (cm
-1)
Non dopée 3700 3600 3500 3400 3300 3200 0,0 0,2 0,4 0,6 0,8 3570Figure VI.163 : Spectres FTIR d’apatites nanocristallines synthétisées par coprécipitation à température ambiante en milieu peroxyde d’hydrogène à différentes teneurs (10%, 25% et 50 % volumique) avec un temps de maturation de 3
jours en comparaison avec une apatite nanocristalline synthétisée en absence de H2O2 et maturée 3 jours
Cette observation est soutenue par les résultats de décomposition spectrale réalisée dans le domaine 400-800 cm-1 qui indique l’absence de bande à 631 cm-1 attribuée aux ions OH- apatitiques pour tous les échantillons synthétisés en présence de H2O2 contrairement à
l’échantillon synthétisé sans (voir section II.2.1 du chapitre II). Ce phénomène pourrait être lié à l’incorporation d’espèces chimiques en sites hydroxyde en remplacement des ions OH
-, bien que de telles espèces ne soient pas détectées par FTIR.
et étude de codopages
La décomposition spectrale révèle également une diminution de près de 50 % de la teneur relative en ions HPO42- non-apatitiques lorsque la synthèse des apatites est réalisée en
présence de peroxyde d’hydrogène. La concentration en H2O2 initiale n’influence cependant
pas significativement la teneur relative en ions HPO42- non-apatitiques : le rapport des intensités
intégrées des bandes FTIR relatif aux ions HPO42- non-apatitiques est égal à 0,08 ± 0,02 ;
0,11 ± 0,01 et 0,08 ± 0,02 pour les échantillons 3j-10%H2O2, 3j-25%H2O2 et 3j-50%H2O2
respectivement. Il est possible de relier cette observation à l’effet accélérateur de croissance cristalline du peroxyde d’hydrogène sur les apatites évoqué à la suite des résultats de DRX décrit précédemment. En effet, au-delà de l’état de cristallinité, c’est peut-être l’état de maturation qui est amélioré par la présence de peroxyde d’hydrogène, incluant également une composition chimique plus proche de la stœchiométrie et contenant moins d’environnements non-apatitiques. La diminution de la proportion d’environnements non-apatitiques pourrait alors être à l’origine de la diminution de la teneur relative en ions HPO42- non-apatitiques observée
par FTIR.
En spectroscopie Raman, on retrouve les bandes caractéristiques des apatites nanocristallines mais, à l’inverse des résultats obtenus par FITR, la présence de bandes d’absorption supplémentaires est également observée, comme le montrent les résultats de la Figure VI.164. Ces bandes supplémentaires forment 3 massifs distincts :
- un massif m1 dans la gamme spectrale 750-850 cm-1, constitué de 3 bandes situées à
793, 827 et 845cm-1
- un massif m2 dans la gamme spectrale 1080-1140 cm-1, constitué de 4 bandes
situées à 1096, 1103, 1114 et 1124cm-1
- et un massif m3 dans la gamme spectrale 2800-3100 cm-1, constitué de 3 bandes
situées à 2858, 2883 et 2940 cm-1.
Enfin, on peut noter la présence de deux bandes d’absorption larges à 881 et 910 cm-1
et étude de codopages
200
400
600
800
1000
1200
3000
3500
0
2000
4000
6000
8000
10000
m
3m
2 3570 2940 2883 2858 1124 1114 1096 / 1103 910 881 845 827 50 % H 2O2 10 % H 2O2In
te
n
s
it
é
(
c
o
u
p
s
)
Nombre d'onde (cm
-1)
Non dopée 793m
1Figure VI.164 : Spectres Raman d’apatites nanocristallines synthétisées par coprécipitation à température ambiante en milieu peroxyde d’hydrogène à différentes teneurs (10% et 50 % volumique) avec un temps de maturation de 3 jours en comparaison avec une apatite nanocristalline synthétisée par coprécipitation en milieu eau désionisée pure à
et étude de codopages
Peu d’informations sont disponibles dans la littérature sur la spectroscopie Raman des apatites peroxydées ou oxygénées. On peut citer les travaux de thèse de Rey (Rey, 1984) portant sur des apatites synthétisées en milieu peroxyde d’hydrogène (par coprécipitation à la température de 80 þC ou par hydrolyse du βTCP). Les résultats de ces travaux indiquent que ces composés apatitiques contiennent divers groupements peroxydés comme des ions peroxyde O22-, superoxyde O2-, des ions O32- et/ou O42- et des molécules H2O2, localisés dans
les tunnels du réseau. Rey réalisa des analyses par spectroscopie Raman sur ces échantillons qui révélèrent des bandes d’absorption attribuables à ces espèces oxygénées dont voici l’attribution donnée par l’auteur :
- une bande à 450 cm-1 attribuée à des édifices moléculaires oxygénés importants tel O32- ou O42-
- une bande large et dissymétrique vers 800 cm-1 attribuée à une vibration O-O de valence simple
- une bande fine à 1150 cm-1 attribuée aux ions superoxyde (O2-)
- une bande intense à 1552 cm-1 attribuée à de l’oxygène moléculaire (O2).
Dans notre étude et d’après les données présentées à la Figure VI.164, la présence des bandes situées à 450 cm-1 (édifices moléculaires oxygénés importants) et à 1552 cm-1 (O2) n’a
pas été observée sur les spectres Raman des échantillons d’apatites nanocristallines synthétisées en présence de peroxyde d’hydrogène. En revanche, les bandes du massif m1
situées entre 750 et 850 cm-1, observées dans ce travail, pourraient correspondre aux bandes observées par Rey autour de 800 cm-1 attribuées à une vibration O-O de valence simple et/ou celle observée par Zhao (Zhao et al., 2000) à 750 cm-1 qui a été attribué à la vibration de O22-.
De plus, les bandes du massif m2 comprises dans la gamme spectrale 1080-1140 cm-1
pourraient être reliées à la bande observée à 1150 cm-1 par Rey attribuée à la vibration des ions superoxyde. La présence d’ions superoxyde peut également être attestée par la couleur jaunâtre de la poudre des échantillons ayant été synthétisés en présence de peroxyde d’hydrogène, comparée à la couleur blanche des échantillons synthétisés en absence de H2O2.
Des analyses complémentaires, notamment par RPE (Résonnance Paramagnétique Électronique), sont nécessaires pour confirmer la présence de telles espèces dans nos échantillons.
Restent les bandes du massif m3 situées entre 2800 et 3100 cm-1 qui ne peuvent être
liées à aucune bande décrite dans la littérature à notre connaissance.
A l’inverse de la spectroscopie infrarouge, la spectroscopie Raman permet de détecter la présence d’ions OH- grâce à la bande d’absorption située à 3570 cm-1
qui est présente à la fois pour les échantillons synthétisés en présence et en absence de peroxyde d’hydrogène. La proximité dans le spectre du massif m3 avec cette bande à 3570 cm-1 pourrait en première
et étude de codopages
environnements locaux des ions OH- dans les tunnels avec la présence d’espèces oxygénées. Cependant, Yu mentionne des bandes d’absorption Raman à 3600 et 3622 cm-1
liées à la vibration d’ions OH
perturbés par des ions O22- (Yu et al., 2007). Ici de telles bandes n’ont pas
été observées.
Enfin, mentionnons la présence des bandes d’absorption situées à 881 et 910 cm-1
, que l’on distingue clairement pour les échantillons synthétisés en présence de H2O2. La position de
ces bandes est proche de celle observée pour des apatites nanocristallines synthétisées en absence de H2O2, que nous avons reporté aux positions de 882 et 916 cm-1 respectivement
(voir section II.1.2.4.2 du chapitre II), cette dernière n’étant qu’un épaulement. La distinction plus claire de ces deux bandes dans le cas des apatites synthétisées en présence de H2O2
pourrait n’être due qu’à une amélioration de la résolution des spectres liée à l’amélioration de l’état de cristallinité observée lorsque la concentration de H2O2 en solution augmente.
Pour conclure, nous venons de voir qu’il était possible de synthétiser des apatites nanocristallines en présence de peroxyde d’hydrogène dans le milieu réactionnel sans former de phases secondaires et ce même à de fort taux de H2O2 (ici 50 %). La présence de peroxyde
d’hydrogène dans le milieu conduit cependant à des modifications physico-chimiques des apatites nanocristallines ainsi précipitées. A mesure que le taux de H2O2 augmente en solution,
les composés ont un état de cristallinité qui s’améliore, ce qui est principalement dû à un accroissement de leur largeur moyenne. Il a également été observé une dilatation du volume de maille cristalline, ce qui suggère une incorporation d’espèces oxygénées dans le réseau apatitique. Bien que des analyses complémentaires, que nous n’avons pu réaliser dans le cadre de ce travail par faute de temps, soient nécessaires pour confirmer la présence de ces espèces et les quantifier, la présence de bandes Raman supplémentaires à celles rencontrées pour les apatites nanocristallines non dopées soutient cette hypothèse.
Dans le dernier paragraphe de cette section, nous nous intéresserons au premier test antibactérien mené sur des apatites nanocristallines synthétisées en présence de peroxyde d’hydrogène. Ce test a été réalisé sur une apatite nanocristalline synthétisée en présence d’un milieu contenant 10 % volumique d’une solution de H2O2 à 110 volumes ayant pour temps de
maturation 1 jour à température ambiante et utilisant Na2HPO4 comme sel de phosphate de
départ (référencée 1j-10%H2O2-Na). Une étape de pré-équilibrage a été réalisée sur ce
composé par lavage du précipité avec une solution de Na3PO4 à pH = 11 comme décrit
précédemment. Notre choix s’est porté sur ces conditions de synthèse (maturation 1 jour et utilisation du Na2HPO4) afin d’obtenir des échantillons ayant un état de maturation faible étant
donc potentiellement plus réactifs. Dans la mesure où le sodium semble jouer le rôle d’inhibiteur de croissance cristalline pour les apatites, il pourrait par ailleurs contrebalancer les effets « accélérateurs » de maturation du peroxyde d’hydrogène. Une brève série d’analyses par DRX, spectroscopie FTIR et Raman, dont les résultats sont discutés ci-après, a été réalisée sur cet échantillon préalablement à son évaluation microbiologique.
et étude de codopages
L’analyse par DRX, dont le diagramme est reporté à l’annexe VI.1, ne détecte qu’une seule phase cristalline : la phase d’apatite nanocristalline.
La spectroscopie infrarouge (dont le spectre est donné à l’annexe VI.2) ne révèle que les bandes caractéristiques des apatites nanocristallines, à l’instar des résultats obtenus pour les précédents échantillons. De même, la décomposition spectrale dans le domaine 400-800 cm-1 indique l’absence de bande OH
détectable (à 631 cm-1) et une diminution des ions HPO42-
non-apatitiques de près de 35 % lorsque la synthèse est réalisée en présence de peroxyde d’hydrogène dans ces conditions (en comparaison avec un échantillon synthétisé en absence de H2O2 maturé 1 jour en utilisant Na2HPO4). Une nouvelle fois, ces résultats peuvent être liés à
un effet « accélérateur » de maturation joué par H2O2 sur ces apatites synthétisées en présence
de sodium générant des composés dont l’état de maturation est plus développé et contenant moins d’environnements non-apatitiques.
Une analyse par spectroscopie Raman a également été réalisée sur cet échantillon et le spectre correspondant est reporté à la Figure VI.165 en comparaison avec un échantillon d’apatite nanocristalline synthétisée en absence de peroxyde d’hydrogène (toujours en utilisant Na2HPO4 avec 1 jour de maturation à température ambiante). Les données obtenues pour
l’échantillon synthétisé en présence de peroxyde d’hydrogène révèlent une nouvelle fois la présence des massifs de bandes d’absorption m1, m2 et m3 dans les fenêtres spectrales
750-850 cm-1, 1080-1140 cm-1 et 2800-3100 cm-1 respectivement (qui ont été reportées précédemment sur la Figure VI.164)). La présence d’ions hydroxyde est également attestée par la bande située à 3570 cm-1 (alors que le spectre FTIR ne présentait pas de bande détectable attribuable aux ions OH-). Cependant, une diminution de son intensité peut clairement être observée en comparaison avec l’échantillon synthétisé sans H2O2, ce qui peut être attribué à
l’incorporation d’espèces peroxydées en remplacement d’ions OH
-. Enfin, un massif m4 de
bandes de faible intensité, dans le domaine 1250-1800 cm-1, peut également être discerné du spectre Raman de cet échantillon. Si quelques bandes de ce massif semblent être observées pour l’échantillon synthétisé sans H2O2 (notamment à 1452 et 1637 cm-1), il est possible de
discerner deux bandes d’absorption aux positions 1299 et 1500 cm-1
uniquement présentes sur le spectre de l’échantillon synthétisé en présence de H2O2. Peut-être est-il possible de relier ces
bandes à celle observée par Rey à 1550 cm-1 qui a été attribuée à de l’oxygène moléculaire (Rey, 1984). Des analyses complémentaires seraient nécessaires pour attribuer ces bandes avec plus de précision.
et étude de codopages
300
600
900
1200
1500
3000
3500
0
1000
2000
3000
4000
5000
In
te
n
s
it
é
(
c
o
u
p
s
)
Nombre d'onde (cm
-1)
m
1m
2m
33570
m
41452
1637
1299
1500
Figure VI.165 : Spectre Raman de l’échantillon d’apatite nanocristalline synthétisée en présence de 10 % volumique de H2O2 avec un temps de maturation de 1 jour, en utilisant
et étude de codopages
En conclusion, nous venons de voir qu’il était possible de synthétiser une apatite nanocristalline monophasée en présence de peroxyde d’hydrogène avec un état de maturation relativement faible en utilisant Na2HPO4 comme sel de phosphate de départ et un temps de
maturation de 1 jour. C’est donc cet échantillon qui a été évalué dans la section suivante afin d’explorer sa potentielle activité antibactérienne.
VI.1.4. Évaluation des propriétés antibactériennes
Comme évoqué dans la section précédente, un test visant à déterminer la potentielle activité antibactérienne d’un échantillon d’apatite nanocristalline synthétisée par coprécipitation en présence d’un milieu contenant 10 % volumique d’une solution de peroxyde d’hydrogène à 110 volumes a été réalisé. Cette apatite a été synthétisée par coprécipitation en utilisant Na2HPO4 comme sel de phosphate de départ avec un temps de maturation en solution de 1
jour et à température ambiante. Le précipité a subi l’étape de pré-équilibrage par lavage avec Na3PO4 à pH = 11. Pour réaliser les tests antibactériens suivants, l’échantillon a été mis sous
forme de pastilles d’un diamètre de 13 mm et de masse 150 mg par compression uniaxiale à température ambiante. La souche bactérienne testée est S. aureus et la méthode utilisée pour quantifier les bactéries en fin de test était la méthode « agar ». Le protocole expérimental de ce test est identique à celui décrit dans la section II.4.4 du chapitre II et le test a été dupliqué. Les résultats de ce test, exprimés en nombre de colonies formées par mL (cfu / mL) et en comparaison avec un échantillon d’apatite nanocristalline non dopée maturée 1 jour (ne présentant pas d’activité antibactérienne) sont reportés à la Figure VI.166.
1,0E+00 1,0E+01 1,0E+02 1,0E+03 1,0E+04 1,0E+05 1,0E+06 1,0E+07
non dopée 10 % H2O2
cfu (1/ml)
Test 1 Test 2
Non dopée 1j-10%H2O2-Na
Limite de quantification S. aureus 1,0E+00 1,0E+01 1,0E+02 1,0E+03 1,0E+04 1,0E+05 1,0E+06 1,0E+07
non dopée 10 % H2O2
cfu (1/ml)
Test 1 Test 2
Non dopée 1j-10%H2O2-Na
Limite de quantification S. aureus
Figure VI.166 : Résultats de tests sur plaque d’agar issus des tests microbiologiques sur souche de S. aureus après mise en contact avec des pastilles d’apatite nanocristalline non dopée ou synthétisée avec 10 % volumique de H2O2 (en