Mémoire de fin de spécialité
Etude prospective de la flore fongique de cinq
plages du Maroc
Spécialité : Analyses Biologiques et Médicales
Présenté par : Dr.
El kharazi Brahim
Encadré par : Pr. Bouchrik Mourad
Royaume du MarocUniversité Mohammed V de Rabat Faculté de Médecine et de Pharmacie
Contents
1 Introduction ... 4 2 Matériels et Méthodes ... 6 2.1 Objectif d’étude... 6 2.2 Critère d’inclusion... 6 2.3 Matériels... 6 2.4 Méthodes ... 8 3 Résultats ... 223.1 Répartition des souches isolées ... 23
3.2 Description des souches isolées ... 27
4 Discussion ... 37
5 Conclusion ... 43
1 Introduction
Les dermatomycoses sont parmi les infections cutanées superficielles les plus fréquentes chez l’homme.
En effet selon différentes études, 10 à 40 % des patients sont infestés par des dermatophytes et 2 à 3 % d'entre eux sont porteurs d'onychomycoses.
Les levures du genre Candida représentent également une étiologie fréquente de dermatomycoses. Ainsi et à titre d'exemple, 5 à 40 % des atteintes unguéales leur sont attribuées.
Ces mycoses superficielles sont en général favorisées par les concentrations humaines qui assurent la transmission et la diffusion des espèces fongiques essentiellement anthropophiles, et cela par l'intermédiaire des sols généralement humides et souillés de squames ou de poils infectés. Ainsi, différents travaux ont permis l'isolement de souches kératinophiles à partir de sols infectés (piscines, mosquées, hammams). Or les plages connaissant une grande affluence en été et constituant un lieu de rencontre de nombreux estivants pourraient constituer un lieu favorable à la contamination et ce, via le sable hébergeant des fragments de kératine infectés par les spores fongiques.
Ce travail propose une étude prospective de la flore fongique du sable de Cinq plages des villes suivants (Rabat, Casablanca, Harhoura, Martil, Tanger) en période hivernale allant de janvier 2019à Mai 2019 et d'en discuter les possibles conséquences sur la santé humaine.
2 Matériels et Méthodes
2.1 Objectif d’étude
Evaluation de la flore fongique (levures, moisissures, dermatophytes) de cinq plages (plage de Rabat, plage de Harhoura, plage Aïn Diab de Casablanca, plage Malabata de Tanger, plage de Martil) dans la période hivernale allant de janvier 2019 à Mai 2019.
2.2 Critère d’inclusion
Sont inclus dans notre étude les plages fréquentées par la population, intensivement visitées par des touristes et des locaux.
2.3 Matériels
2.3.1 Description des lieux de prélèvement
Notre étude a été réalisée sur Cinq sites côtiers, la situation géographique de chaque site a été référenciée à l’aide de l’application (UTM GeoMap)
Nom de la plage Géoréférence
ment Commune Plage de Rabat N 34° 0l’ 58,92"
w
6° 50’ 18,96"Commune urbaine de Rabat
Plage de Harhoura
N 33° 55’ 53,25"
w
6° 57’13,56"
Commune rurale de Harhoura
Plage Malabata de Tanger N 35° 46’ 42,25"
w
5° 47’ 51,10"Commune urbaine Tanger-Médina Plage de Martil N 35° 37’ 23,45"
w
5° 16’ 18,11"Plage Aïn Diab de Casablanca N 33° 35’ 6,38"
w
7° 41’ 25,63" Commune urbaine de CasablancaTableau I : Géoréférencement des zones d’étude et leur commune
Plage de Rabat
La plage de Rabat-Salé, correspond globalement à la partie nord de la bande côtière de La Meseta atlantique. Cette côte est caractérisée par une alternance de falaises qui présentent des schistes, des quartzites et des grès du paléozoïque. Elle forme le centre de la convexité orientale qui s'étend depuis El-Jadida. La direction générale de la côte de Rabat est SW-NE, c'est à dire perpendiculaire à la direction générale des vents du Nord-Ouest, qui sont les plus dominants dans la zone.
La zone appartient au climat méditerranéen marqué par deux saisons principales adoucies par les influences océaniques. Les températures moyennes sont de l'ordre de 12°C pour les mois les plus froids (Décembre - Janvier) et de 22°C pour les mois les plus chauds (Juillet-Septembre). Les
précipitations moyennes annuelles sont supérieures à 550 mm/an.
Plage de Harhoura
La commune de Harhoura relève de la préfecture Skhirat-Temara, de la région Rabat-Salé-Zemmour-Zaër. Elle est limitée au Nord
par
la commune de Yacoub el Mansour, au Sud par la commune de Skhirat, à l’Est par la commune de Témara et à l’ouest par Océan Atlantique. Plage d’Aïn Diab
La plage d’Aïn Diab, de deux kilomètres environ, s’étend entre les deux pointes rocheuses de la Corniche et du marabout Sidi Abderrahman.
Au nord, l’Océan délimite nettement le domaine d’Aïn Diab avec ses deux interfaces littorales : la Corniche et la plage. Au sud, la limite est donnée par les avenues d’Anfa et la route d’Azemmour.
Plage Malabata de Tanger
Située à l’extrémité nord du pays, la préfecture de Tanger-Assilah fait face à l’océan atlantique et au détroit de Gibraltar. Tanger est la seule ville qui donne sur l’Océan Atlantique et la Mer Méditerranée.
Le climat de Tanger est de type méditerranéen tempéré par l’influence océanique et le souffle du chergui, présentant quatre saisons bien marquées : hiver doux et humide, été tiède et sec, intersaisons modérément pluvieuses. Cependant la ville est souvent sujette à de violents phénomènes climatiques comme le vent fort et les pluies intenses. Les précipitations sont comprises entre 700 et 1000 mm par an.
La Plage de Martil
La commune urbaine de Martil s’étend sur une superficie de 33,50 km2. La commune est limitée par la mer à l’Est, les municipalités de M’diq et Tétouan, les communes rurales El Malalyienne et Azla. Son territoire abrite la ville de Martil, un village touristique important (Cabo Négro) et de petites agglomérations (Foum El Oullek, Mahjour, Souani)
2.3.2 Procédure de prélèvement
Un total de 270 prélèvements a été prélevé, correspondant à 54 échantillons de sable pour chacun des cinq plages. Ces échantillons ont été prélevés à l’aide d’une spatule stérilisée, en acier inoxydable.
Sur chaque plage, les prélèvements ont été effectués sur trois niveaux : • Au contact de l’eau (humide) ;
• À la limite entre le sable sec et humide (jonction) ; • et au niveau du sable sec (sec).
À chaque niveau, et sur 9 points du même niveau, deux échantillons d’environ 100 g ont été prélevé, un en superficie et un à 5 centimètres de profondeur
Les échantillons ont été placés dans des pots stériles marqués, et directement transportés au laboratoire, où ils ont été conservés à une température de 4°C.
2.4 Méthodes
Au laboratoire, l’isolement, l’ensemencement et l’identification des champignons ont été faites selon le protocole suivant :
2.4.1 Isolement
Deux techniques d’isolement ont été effectuées sur chaque échantillon de sable.
2.4.1.1 Technique de lavage
Utilisé pour la mise en évidence essentiellement des levures et des champignons filamenteux non dermatophytiques. Elle consiste à la mise en suspension de 20 g de sable dans 20 ml d’eau distillée stérile.
Après centrifugation à 3000 tr/min, 80 microlitres de surnageant ont été ensemencé sur le milieu de Sabouraud chloramphénicol, incubé à 37°C pendant deux à trois semaines.
La croissance des champignons est suivie, noté chaque jour durant toute la durée de l’incubation.
2.4.1.2 Technique de piégeage
Pour la mise en évidence des dermatophytes, la technique de piégeage de Vanbreusghem a été utilisée, elle est basée sur la propriété kératinophile des dermatophytes.
• Préparation
Une touffe de cheveux d’enfants impubères a été recueillie, ainsi que du coton cadré • Stérilisation
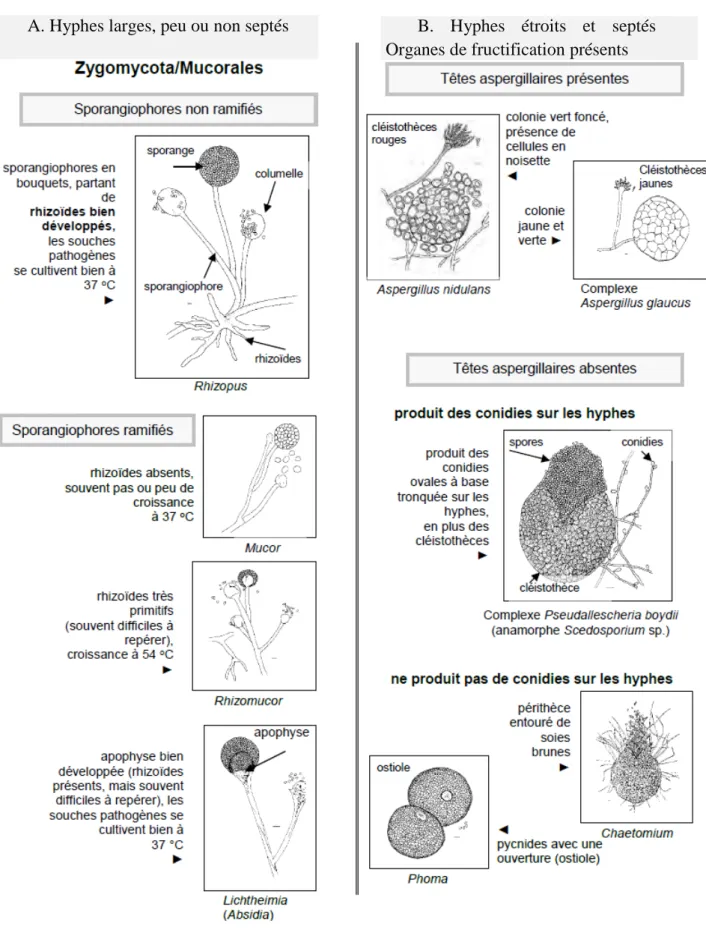
Les cheveux et le coton cardée ont été stérilisés au préalable selon le protocole de stérilisation à la chaleur humide au niveau de service de stérilisation centrale de HMIMV :
Mettre les cheveux (ou le coton cadré) dans une gaine en plastique stérilisable à découper puis thermo-souder, sur les deux côtés, en sachets individuels.
Vérifier l’étanchéité des sachets thermo-soudés
Mettre les paquets à stériliser sur les grilles du stérilisateur de type poupine, non vitré et hermétique.
T° stérilisation Temps de plateau de
stérilisation Temps de séchage
Coton cardée
134°C 18min 45min
Cheveux 121°C 15 min 45min
Tableau 2 : Paramètre de stérilisation des cheveux et du coton cardé • Ensemencement
Dans des boites pétries marquées on met le coton cardé humidifié a l’aide d’un volume suffisant d’eau stérile afin d’éviter la dessiccation de la culture
On ajoute, sur le coton, l’échantillon de sable correspondant puis une touffe de cheveux stérilisée
Après deux mois d’incubation ou dès l’apparition d’une pousse de champignon, les cheveux seront mis en culture sur les milieux de Sabouraud actidione à 25,8°C pendant un mois.
• Repiquage
Le procédée de repiquage se déroule entre deux becs benzène afin d’éviter toute contamination du milieu de culture.
On prélève des poils à partir des boites de pétrie contenant la touffe de cheveux, à l’aide d’une pince fine puis on les met en culture sur les milieux de Sabouraud actidione à 25°C pendant un mois
2.4.2 Identification
2.4.2.1 Champignons filamenteux
L’identification des champignons filamenteux repose sur des critères culturaux, température de croissance et vitesse de pousse, mais surtout sur les critères morphologiques associant l’aspect macroscopique des cultures et la morphologie microscopique
Identification macroscopique
Se base sur la description des colonies
a) Texture
-
Laineuse : mycélium aérien abondant-
Duveteuse : mycélium aérien court-
Poudreuse : mycélium aérien produisant de nombreuses conidies créant une surface d'apparence poudreuse semblable à du sucre ou de la farine-
Glabre : mycélium aérien peu abondant avec surface lisse Topographie : plane, surélevée, cérébriforme, avec stries radialesb) Couleur : surface, revers, pigment diffusible
-
brun, gris, noir = champignon dématié-
blanc ou autre couleur (rouge, vert, jaune, mauve, etc.) = champignon hyalinc) Vitesse de croissance (diamètre de la colonie à 7 jours)
-
rapide : = 3 cm-
modérée : entre 1 et 3 cm-
lente : = 1 cm Identification microscopique
Pour cela on a utilisé la technique du drapeau de Roth :
► Déposer sur une goutte de bleu lactophénol sur une lame porte-objets.
► À l’aide d’une pince, un petit morceau de cellophane adhésif est appliqué par sa face adhésive sur la colonie fongique
► Poser sur la goutte de colorant en évitant la formation de bulles
► Une deuxième goutte est déposée sur la face supérieure de la cellophane puis le tout est recouvert d’une lamelle.
Critères d’identification :
a) Hyphes : septés, non septés, larges (> 4 µm), étroits (< 4 µm)
b) Conidiophores : absents, simples, ramifiés
c) Cellules conidiogènes : annellide, phialide...
d) Conidies : uni- ou pluricellulaires, solitaires, en amas ou en chaînes, forme (ronde, ovale, en massue...)
e) Organes de fructification : périthèces, cléistothèces (sexué), pycnides (asexué)
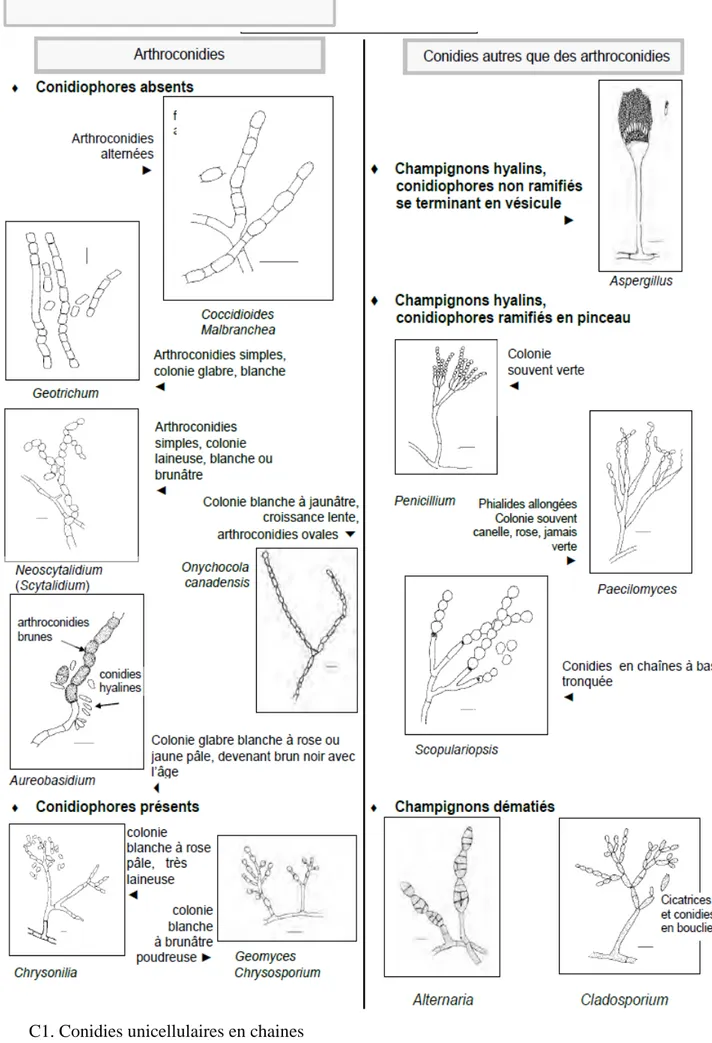
Clé d’identification des champignons filamenteux
Figure 2 : clé d’identification des champignons filamenteux
B. Hyphes étroits et septés Organes de fructification présents A. Hyphes larges, peu ou non septés
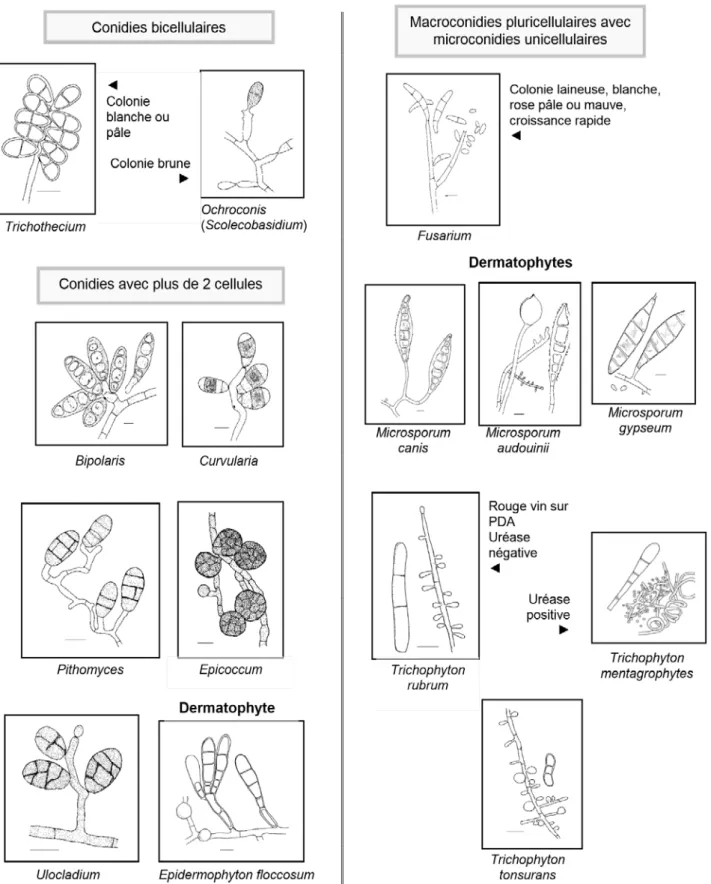
C1. Conidies unicellulaires en chaines
C2. Conides unicellulaires en amas
C3. Conidies solitaires (fixés individuellement sur le conidiophore)
Figure 4 : clé d’identification des champignons filamenteux (suite) Champignons h li Champignons dématiés Phial Exo Tricho Gliocl Tricho Verti Acre
D. conidies pluricellulaires (avec ou sans conidies unicellulaires)
2.4.2.2 Levures
Macroscopique
Elles donnent des colonies lisses, glabres, humides, d’aspect brillant ou mat, parfois rugueuses voire cérébriforme ou muqueuse coulante.
Couleur le plus souvent blanc crème mais peuvent être rouge orangé ou noires ou autres.
Microscopique
L’identification microscopique a été reposée sur :
-un examen direct : une colonie est prélevée et déposer sur une lame porte objet dans une goutte de colorant (bleu coton ou rouge Congo). Cet examen permet de noter la forme, la taille, et le mode de reproduction asexuée (bourgeonnement ou scissiparité) des levures.
Figure 6 : les différentes formes des levures
-tests spécifiques pour l’identification de Candida albicans.
• Le test de blastèse : appelé aussi le teste de filamentation en sérum, il est réalisé en déposant une colonie de levure dans 1 ml de sérum lapin frais. Cette suspension préparée doit être incubée à une température de 37C pendant 3 heures. La détection des filaments (tubes
germinatifs) affirme la présence de Candida albicans
Figure 7 : test de blastèse.
• Le test de chlamydospores : Son but c’est la différenciation de Candida albicans d’autres Candida sp sur la base de la formation des chlamydospores Pour cela, une goutte de
suspension de levure est ensemencée sur milieu de Rice-Cream (gélose à l’extrait de riz) puis incubation entre 23 et 28 °C à la température ambiante pendant 18 à 48 h
Figure 8 : test de chlamydospores.
Identification biochimique
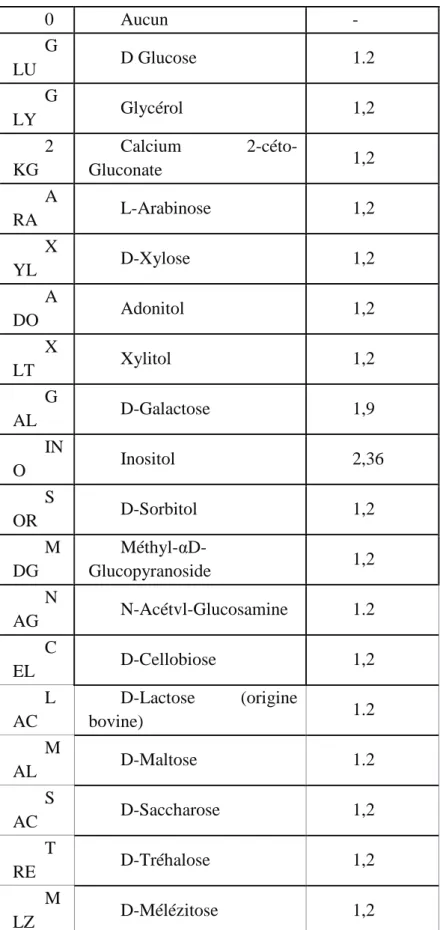
L’étude de la forme des levures ne suffit pas pour la détermination des espèces ce qui nous a pousser à étudier leurs caractères physiologiques avec en particulier, l’étude de l’assimilation des sucres, en utilisant des galeries API et un automate VITEK.
API® 20C AUX (bioMérieux)
a) Principe générale
La galerie API 20 C AUX est constituée de 20 cupules contenant des substrats déshydratés qui permettent d’effectuer 19 tests d’assimilation plus un blanc. Les cupules sont inoculées avec un milieu minimum semi-gélosé et les levures poussent seulement si elles sont capables d’utiliser le substrat correspondant. La lecture de ces réactions se fait par comparaison aux témoins de croissance et l’identification est obtenue à l’aide du Catalogue Analytique ou d’un logiciel
d’identification.
Figure 9 : galerie API® 20C AUX (bioMérieux).
b) Composition de la galerie
T
ESTS SUBSTRATS
QTE (mg/cup.)
0 Aucun - G LU D Glucose 1.2 G LY Glycérol 1,2 2 KG Calcium 2-céto-Gluconate 1,2 A RA L-Arabinose 1,2 X YL D-Xylose 1,2 A DO Adonitol 1,2 X LT Xylitol 1,2 G AL D-Galactose 1,9 IN O Inositol 2,36 S OR D-Sorbitol 1,2 M DG Méthyl- αD-Glucopyranoside 1,2 N AG N-Acétvl-Glucosamine 1.2 C EL D-Cellobiose 1,2 L AC D-Lactose (origine bovine) 1.2 M AL D-Maltose 1.2 S AC D-Saccharose 1,2 T RE D-Tréhalose 1,2 M LZ D-Mélézitose 1,2 R AF D-Raffinose 1,9
Tableau 6 : Composition quantitative et qualitative d’API® 20C AUX (bioMérieux)
c) Mode opératoire
• Préparation de la galerie
-Réunir fond et couvercle d’une boîte d’incubation et répartir environ 5 ml d’eau distillée dans les alvéoles du fond pour créer une atmosphère humide.
-Inscrire la référence de la souche sur la languette latérale de la boîte.
-Retirer la galerie de son emballage individuel et la déposer dans la boîte d’incubation. • Préparation de l’inoculum
-Ouvrir une ampoule d’API Suspension Medium (2 ml) ou une ampoule d’API NaCl 0,85 % Medium (2 ml), ou utiliser un tube contenant 2 ml de la même solution sans additif.
-A l’aide d’une pipette, prélever une fraction de colonie par aspiration ou par touches successives. Utiliser préférentiellement des cultures jeunes (18-24 heures).
-Réaliser une suspension de levures de turbidité égale à 2 McFarland. Cette suspension doit être utilisée extemporanément.
-Ouvrir une ampoule d’API C Medium et y transférer environ 100 µl de la suspension précédente. Homogénéiser avec la pipette en évitant la formation de bulles
• Inoculation de la galerie
-Remplir les cupules avec la suspension obtenue dans API C Medium. Eviter la formation de bulles en posant la pointe de la pipette sur le côté de la cupule. Veiller à créer un niveau horizontal ou légèrement convexe, mais jamais concave
-Refermer la boîte d’incubation et incuber 48-72 heures (± 6 heures) à 29°C ± 2°C. • Lecture et interprétation
Après 48 à 72 heures d’incubation, observer la croissance des levures comparativement à la cupule 0, témoin négatif. Une cupule plus trouble que le témoin indique une pousse positive à noter sur la fiche de résultats.
L'identification est obtenue à partir du profil numérique. Sur la fiche de résultats les tests sont séparés par groupes de trois et une valeur 1, 2 ou 4 est indiquée pour chacun des tests. Un dernier test non indiqué par la galerie est le test de filamentation.
En additionnant l'intérieur de chaque groupe les correspondant des réactions positives on obtient 7 chiffres qui constituent le profil numérique.
L’identification se fait à l'aide du Catalogue Analytique Rechercher le profil numérique dans la liste des profils.
Figure 10 : La fiche de résultats Vitek® YBC (bioMéricux)
VITEK 2TM est un système automatisé composé d’instruments, d’un logiciel et de cartes destinées à l’identification et l’antibiogramme de bactéries et de levures. Le VITEK 2TM utilise la croissance basée sur des profils biochimiques pour déterminer l’identification.
• Le dispositif Vitek® YBC (bioMérieux) comporte 20 tests, ta sensibilité à l’Actidione, l’assimilation du nitrate, l’hydrolyse de l’urée et l’assimilation de 17 sources de carbone. Ce
3 Résultats
Sur les 54 échantillons de sables prélevés pour chaque plage et 270 prélèvements étudiés, 26 souches de champignons ont été isolées des Cinq plages étudiées, avec une fréquence d’isolement de 9,62 %.
Pour les champignons filamenteux non dermatophytiques, il s’agit de : 14 souches d’Aspergillus, dont :
- 7 Aspergillus niger ; - 5 Aspergillus flavus ; - 2 Aspergillus terreus. 4 souches de Fusarium, dont :
- 3 Fusarium oxysporum ; - 1 Fusarium solani.
2 souches de penicillium chrysogenum, ainsi que ; 2 souches de Scedosporium apiospermum et 1 souche de Rhizomucor sp.
Pour les levures, 3 souches de Candida parapsilosis ont été isolées. Concernant les dermatophytes, aucune souche n’a été isolée.
3.1 Répartition des souches isolées
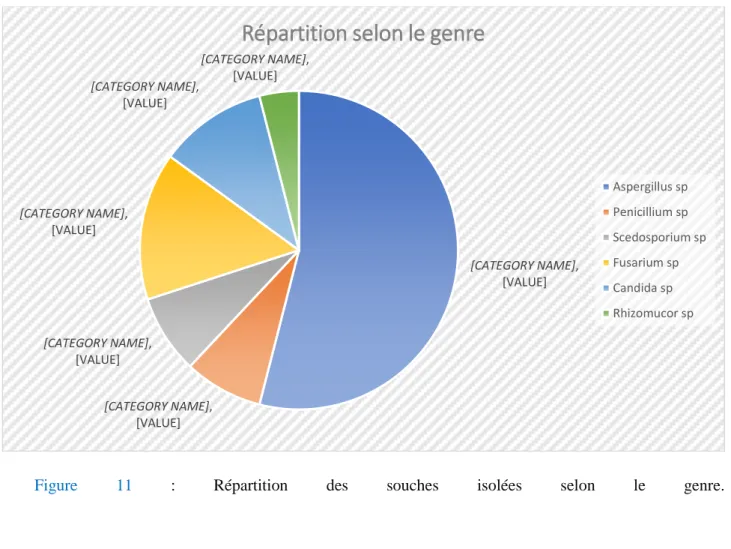
3.1.1 Répartition par genre
Genre Nombre Pourcentage
Aspergillus sp 14 54% Penicillium sp 2 8% Scedosporium sp 2 8% Fusarium sp 4 15% Candida sp 3 11% Rhizomucor sp 1 4%
Figure 11 : Répartition des souches isolées selon le genre. [CATEGORY NAME], [VALUE] [CATEGORY NAME], [VALUE] [CATEGORY NAME], [VALUE] [CATEGORY NAME], [VALUE] [CATEGORY NAME], [VALUE] [CATEGORY NAME], [VALUE]
Répartition selon le genre
Aspergillus sp Penicillium sp Scedosporium sp Fusarium sp Candida sp Rhizomucor sp
3.1.2 Répartition par espèce
Figure 12 : Répartition des souches isolées selon l’espèce
[CATEGORY NAME] [PERCENTAGE] [CATEGORY NAME] [PERCENTAGE] [CATEGORY NAME] [PERCENTAGE] [CATEGORY NAME] [PERCENTAGE] [CATEGORY NAME] [PERCENTAGE] [CATEGORY NAME] [PERCENTAGE] [CATEGORY NAME] [PERCENTAGE] [CATEGORY NAME] [PERCENTAGE] [PERCENTAGE]
Répartition par espèce
Aspergillus niger Aspergillus terreus Aspergillus flavus Penicillium chrysogenum Scedosporium apiospermum Fusarium oxysporum Fusarium solani Candida parapsilosis Rhizomucor sp
Espèce Nombre de souches Pourcentage
Aspergillus niger 7 27% Aspergillus terreus 2 8% Aspergillus flavus 5 19% Penicillium chrysogenum 2 8% Scedosporium apiospermum 2 8% Fusarium oxysporum 3 11% Fusarium solani 1 4% Candida parapsilosis 3 11% Rhizomucor sp 1 4%
3.1.3
Répartition par plage
Espèce /Plage RABAT HARHOURA CASA TANGER MARTIL
Aspergillus niger 3 2 - - 2 Aspergillus terreus - - - - 2 Aspergillus flavus 1 2 - - 4 Penicillium chrysogenum - - - 2 - Scedosporium apiospermum - 2 - - - Fusarium oxysporum - - - - 3 Fusarium solani - - - - 1 Candida parapsilosis 1 - 1 - 1 Rhizomucor sp - 1 - - - Total 5 7 1 2 13
Figure 13 : Répartition des espèces isolées selon la plage étudiée
-On note que le nombre de champignons le plus élevé est celui de la plage de Martil (13 souches) suivie de la plage de Harhoura (7 champignons) et plage de Rabat (5 souches)
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5
MARTIL HARHOURA RABAT TANGER CASA
Répartition selon la plage
Aspergillus niger Aspergillus terrus Aspergillus flavus Penicillium chrysogenum Scedosporium apiospermum Fusarium oxysporum Fusarium solani Candida parapsilosis Rhizomucor sp
3.1.4 Répartition par zone de prélèvement
S
ec Jonction Humide
Aspergillus niger 3 1 3
Aspergillus terrus 2 - -
Aspergillus flavus 2 3 -
Penicillium chrysogenum 1 1 - Scedosporium apiospermum - 1 - Fusarium oxysporum - - 3 Fusarium solani - - 1 Candida parapsilosis 2 1 - Rhizomucor sp - 1 -
Figure 14 : La répartition des espèces isolées selon le niveau de prélèvement
-On note que la plupart des champignons ont été isolés soit dans la zone sec soit dans la Jonction dans les cinq plages étudiées.
0 0,5 1 1,5 2 2,5 3 3,5
Sec Jonction Humide
Répartition selon le niveua de prélèvement
Aspergillus niger Aspergillus terrus Aspergillus flavus Penicillium chrysogenum Scedosporium apiospermum Fusarium oxysporum Fusarium solani Candida parapsilosis Rhizomucor sp
3.2 Description des souches isolées
Aspergillus niger :
Figure 15 : Aspect macroscopique et microscopique d'Aspergillus niger (Photo de laboratoire de parasitologie-Mycologie HMIMV]
Aspect macroscopique sur gélose de Sabouraud-chloramphénicol (droite) et aspect microscopique avec une tête aspergillaire coloré au bleu de lactophénol et des spores, avec schémas de la tête aspergillaire(gauche).
Aspergillus flavus :
Figure 16 : Aspect macroscopique et microscopique d'Aspergillus flavus [Photo de laboratoire de parasitologie-Mycologie HMMIV)
Aspect macroscopique sur gélose de Sabouraud-chloramphénicol avec colonies duveteuses blanches puis jaune (gauche) et aspect microscopique ainsi qu’un schéma d’une tête aspergillaire radiée avec conidiophore long coloré au bleu de lactophénol et des spores (droite).
Aspergillus terreus :
Figure 17 : Aspect macroscopique et microscopique d'Aspergillus terreus [Photo de laboratoire de parasitologie-Mycologie MIMV]
Aspect macroscopique sur gélose de Sabouraud-chloramphénicol avec colonies poudreuses de teinte beige à brun noisette ou cannelle (gauche) et aspect microscopique avec têtes aspergillaire bisériées en colonne évasée (aspect d'éventail) avec conidiophore incolore (bas à droite)
Penicillium chrysogenum
Figure 18 : Aspect macroscopique et microscopique de penidllium chrysogenum [Photo de laboratoire de parasitologie-MycologieH MIMV]
Aspect macroscopique, Recto (A) Verso (B), sur gélose de Sabouraud-chloramphénicol et
Fusarium Oxysporum :
Figure 19 : Aspect macroscopique et microscopique de Fusarium oxysporum [Photo de laboratoire de parasitologie-Mycologie HMIMV)
Aspect macroscopique sur milieu Sabouraud-chloramphénicol, colonies duveteuses avec pigment diffusé dans la gélose (Gauche). Aspect microscopique avec microconidies fusiforme caractéristique du genre Fusarium, conidiophores ramifiés portant des phialides terminales (Droite).
Fusarium Solani :
Figure 20 : Aspect macroscopique et microscopique de Fusarium solani [Photo de laboratoire de parasitologie-Mycologie HMIM, J
Aspect macroscopique avec colonies duveteuse ou cotonneuses blanche avec verso jaune-orangée (gauche) et aspect microscopique avec des macroconidies en forme de fuseau asymétrique ainsi que des chlamydospores présentes en abondance (droit).
Rhizomucor sp :
Figure 21 : Aspect microscopique et macroscopique de Rhizomucor sp [Photo de laboratoire de parasitologie-Mycologie BMIMV]
Aspect microscopique : Les sporocystes sont foncés, recouverts d’aspérités, la columelle est bien développée avec absence d’apophyse (haut).
Scedosporium apiospermum :
Figure 22: Aspect microscopique de Scedosporium apiospermum (Photo de laboratoire de parasitologie-Mycologie HMIMV]
Aspect microscopique : aleuries unicellulaires hyalines (tête de flèche) caractéristique de l’espèce S. apiospermum
Candida parapsilosis :
Figure 23 : Aspect macroscopique et microscopique de Candida parapsilosis [Photo de laboratoire de parasitologie-Mycologie HMIMV]
Aspect macroscopique : Colonies blanches à crème, luisantes et lisses(A) et (B) avec des blastospores ovoïdes(C), l'espèce a été identifiée par le Vitek 2.
4
Discussion
Dans la présente étude, nous avons isolé des champignons filamenteux et des levures dans le sable des Cinq plages marocaines
Concernant les dermatophytes, aucun dermatophyte n’a été isolé dans notre étude, les résultats ont été négatifs aussi bien pour l'incubation que pour le repiquage (méthode de piégeage des dermatophytes).
En comparant notre étude à une enquête sur la flore fongique de deux plages à Casablanca, cinq souches de Trichophyton rubrum ont été identifiées.
Ce résultat peut être expliqué par la nature des conditions climatiques de la période dans laquelle nos prélèvements ont été effectués à savoir la période hivernale.
La prévalence des dermatophytoses est plus importante sous un climat chaud et humide plus propice à la viabilité de ces espèces
Durant la période de notre étude (hivernale), les plages ne sont pas fréquentées par un grand nombre de population, et donc on observe une absence de squames et restes de kératine humaine sur le sable, ceci peut expliquer l'absence d'isolement des dermatophytes dans notre étude.
On note aussi que la majorité des champignons ont été isolés soit dans la zone sec (sable sec) soit dans la zone de jonction, et ceci est expliqué par les conditions qui favorisent la colonisation de ses moisissures à savoir : l'humidité et la température élevée.
Les résultats obtenus dans la présente étude montrent que le sable des Cinq plages ne contient que des moisissures, mais ces derniers peuvent être incriminés en pathologie humaine.
Aspergillus : En plus d’Aspergillus fumigatus qui représente deux tiers des cas en pathologie humaine, les autres espèces qu’on retrouve le plus fréquemment dans la pratique clinique sont Aspergillus niger, A. flavus et A. terreus. Les pathologies pulmonaires aspergillaires présentent un large spectre de manifestations cliniques qui dépend de l’intensité de la réponse immune. On distingue l’aspergillose pulmonaire invasive (API), qui touche en principe un hôte sévèrement immunodéprimé, et l’aspergillose pulmonaire chronique (APC), qui touche des sujets peu ou pas immunodéprimés.
Scedosporium apiospermum : est la forme anamorphe dont le téléomorphe est un ascomycète Pseudallescheria boydii, une moisissure environnementale omniprésente. C’est l’gent de mycétome à grains blancs (Amérique, Afrique du Nord, Europe Centrale). Il est aussi à l'origine d'atteintes pulmonaires (mycétomes, bronchopneumopathies) il colonise fréquemment les bronches d'enfants atteints de mucoviscidose. C'est un opportuniste chez l'immunodéprimé (transplantés ou corticothérapie prolongée), il provoque des atteintes viscérales (système nerveux central, endocardite), des arthrites, kératites et endophtalmies. Il est de plus en plus signalé comme agent causal de maladie fongique invasive chez les hôtes immunodéprimés. Il pose un défi thérapeutique en raison de sa résistance intrinsèque aux antifongiques traditionnels et de sa capacité à se reproduire malgré une sensibilité manifeste.
Fusarium oxysporum : est un parasite phytopathogène qui est incriminé dans La fusariose vasculaire des plantes cultivées comme le bananier, le cotonnier, le melon, la tomate, etc.
Chez l’homme elle peut causer :
- Kératites et endophtalmies dues à un traumatisme végétal ou métallique ou sableux. - Onyxis des pieds provoquant une leuconychie superficielle débutant à la partie
proximale de l'ongle, gagnant le bord libre et évoluant vers une onychomycodystrophie totale.
- Mycétomes à grains blancs en Afrique. - Atteintes cutanées chez les grands brûlés.
- Fusarioses disséminées chez les aplasiques ou neutropéniques.
Fusarium solani. Le complexe d'espèces Fusarium solani est cosmopolite, largement répandu. Saprophyte tellurique, très fréquent dans les sols humides. Parasite phytopathogène important. C’est un agent vasculaire qui se conserve dans le sol sous forme de chlamydospores et infecte les plantes via es racines qu'elles pénètrent directement ou par des blessures d'origine mécanique ou biologique (percées des racines secondaires, piqûres de nématodes...) Il est associé à de nombreuses maladies sur des plantes économiquement importantes (avocats, haricots, pomme de terre, citrus, ...).
C’est est le groupe le plus courant de fusarium associés aux maladies infectieuses humaines. Plusieurs études à ce jour ont révélé des dizaines d'espèces phylogénétiques fortement soutenues au sein de cet important clade évolutif. Dans le sable des plages, les chlamydospores de f. oxysporum peuvent infectée certaines populations, à travers plusieurs portes d'entrée (blessure, plis infectés ...),
surtout les immunodéprimées. Ils sont surtout connus pour être la cause de :
- Kératites mycotiques fréquentes après traumatisme végétal ou après introduction de corps étrangers : métal, pierre, sable, ou liés aux lentilles de contact ;
- Mycétomes à grains blancs siégeant aux pieds, parfois aux mains, surtout rencontrés en Afrique noire et à Madagascar ;
- Fusarioses cutanées et fusarioses des grands brûlés ;
- Cas d’intertrigos et d’onychomycoses, de plus en plus de décrits dans la littérature. Les mucorales sont des redoutables opportunistes, sont des agents de zygomycoses (Rhizopus oryzae, Rhizomucor pusillus, Absidia corymbifera, Mucor circinelloides...), notamment chez les sujets diabétiques et les patients atteints d'hémopathies. Ils sont à l'origine d'atteintes rhinocérébrales, cutanées (chez les grands brûlés) et viscérales (pulmonaires, digestives, rénales...).
Sur la base des résultats obtenus dans cette étude, et à première vue, nous remarquons des concentrations plus élevées et une diversité de mycètes filamenteux dans la Plage de Martil par rapport aux autre sites étudiés, on a constaté que le genre Fusarium (4 souches dont trois Fusarium oxysporum et une souche de Fusarium solani) n’existe qu'au niveau de cette plage.
Si on compare nos résultats avec une étude similaire de Biodiversité fongique du sable de quatre Plages (Beau Séjour, Eden, les Andalouses et Madagh) du Littoral ouest algérien, 12 souches de Fusarium ont été isolées avec une abondance de 5,15% et une fréquence d'isolement de 25%. Par contre aucune souche n'a été isolée dans l'étude de la flore fongique du sable de deux plages à Casablanca.
Une revue de 2012 compilant plusieurs études réalisées sur quatre continents classe les champignons du genre Fusarium à la seconde place en fréquence derrière Scopulariopsis, et devant
Aspergillus, Scytalidium et Acremonium. Une étude indienne de 2016 a identifié par biologie
moléculaire les espèces de Fusarium impliquées dans des onychomycoses. Sur 500 patients atteints d'onychomycoses, la prévalence des infections à moisissures était de 28.7 %, les Fusarium étant la principale moisissure isolée (environ 10 % des onychopathies)
Dans notre étude, 2 espèces de Fusarium sont isolées (F. solani 4 %, F. oxysporum 11 %), c'est un résultat très pertinent en vue de l'absence de ces espèces dans les autres plages étudiées, ce qui nous permettra de conclure une idée importante sur le tropisme géographique du genre fusarium qui rend la plage de Matril un foyer de contamination.
Le littoral méditerranéen présente quelques points de forte densité de population, surtout entre Tanger et Tétouan. Cette-densité s'est accentuée durant la dernière décennie, l'évolution de la population urbaine a connu un rythme relativement plus rapide que celui de l'ensemble du Maroc. Cette évolution s'est accompagnée notamment du développement du tissu industriel dans la région, entraînant un impact négatif sur le milieu marin en particulier.
La topographie côtière de la région de Tétouan est caractérisée par une pente généralement faible, une côte rocheuse et des fonds sédimentaires. Elle se présente également comme un grand bassin versant, ce qui engendre, pendant la période des pluies, un grand écoulement et des ruissellements des eaux pluviales vers la plage de Martil.
Au niveau de cette plage, tous les indicateurs accusent le déversement des eaux usées domestiques. Les grandes quantités d'eaux sanitaires, qui parviennent en mer sans traitement préalable, sont de loin la principale cause de la mauvaise qualité du sable de cette plage. Les déchets ménagers liquides présentent la proportion la plus élevée. D'autres sont canalisés par les
égouts domestiques et s’accumulent sous forme de matières organiques, ce qui offre un environnement propice à la croissance de certains microorganismes dont les champignons
saprophytes.
Les rejets principaux qui affectent la qualité du milieu marin au niveau de cette zone sont représentés par les eaux drainées par Oued El Malah et Oued Martil. Les pluies torrentielles que
'
C M
connaissent ces sites, en période hivernale, drainent les polluants engendrés par l'activité terrestre vers la mer, par le biais de bassins versants à savoir Oued el Maleh et Oued Martil, Ce dernier, connu par sa forte contamination, reçoit les rejets industriels et urbains de la ville de Tétouan.
Figure 24 : Localisation géographique de l'Oued El Maleh
/ Figure 25 : Localisation géographique de l'Oued Martil
Les données disponibles montrent un impact certain de la charge polluante véhiculée par oued Martil, notamment le rejet industriel, une nette élévation de la concentration des hydrocarbures dans la période hivernale surtout au printemps est observée.
-L'analyse mycologique des échantillons du sable prélevés au niveau de la plage Malabata Tanger a révélé l'existence d'une espèce du genre Penicillium (2 souches Penicillium chrysogenum), cette très faible concentration, probablement, est en grande partie causée par les travaux d'aménagement, qui coïncide avec la date de prélèvement, affectant le sable de mer naturel qui a été remplacé par un sable artificiel (construction de la marina de Tanger).
-au niveau des plages Rabat et Harhoura, on note une prédominance de l'espèce Aspergillus niger et cela peut être expliquée, d'une part, par la nature et la situation géographique de la plage Rabat par rapport à l'Oued Bouregreg qui est soumise à de multiples actions de dégradation de son milieu naturel, Plusieurs auteurs ont mis en évidence la contamination de cet estuaire qui est due aux activités domestiques (rejets d'eaux usées) et industrielles (la zone industriel Takadoum)
L'Oued Bouregreg s'étend sur une longueur d'environ 24 km en aval du barrage de Sidi Mohammed Ben Abdellah.
L'embouchure du fleuve est située sur la côte nord-ouest atlantique séparant les villes de Rabat
et Salé. La plus importante altération de l'écosystème est d'origine urbaine. En effet, la ville de Rabat, dont la population dépasse actuellement un million d'habitants engendrent des rejets d'eaux usées émanant des habitations, des unités industrielles et de l'agriculture (élevage de bovins, ovins et volail1e).Ces rejets sont véhiculés par des collecteurs ou déversés directement dans la plage. Par ailleurs, les décharges urbaines installées tout autour de la même plage et les lâchés du barrage de
.
Sidi Mohammed Ben Abdellah engendrent, pendant les périodes pluvieuses, un apport important en eau, anoxique, turbide et chargée en matière organique assurant des conditions propices à la viabilité des champignons (Aspergillus niger 27% dans le cas de la plage de Rabat). Plusieurs voies de contaminations sont cependant possibles : respiratoire, digestive, cutanée, transplacentaire ou trans-coquillière. La contamination par voie respiratoire, par inhalation de conidies présentes dans l'air est la plus fréquente. Ces dernières sont facilement mises en suspension par les mouvements des courants d'air ou par d'autre facteur physique et sont capables de pénétrer profondément dans l'appareil respiratoire du fait de leur petite taille.
La probabilité de contamination est étroitement liée au taux de contamination de l'air ambiant. Ainsi tout ce qui provoque une augmentation de la concentration de conidies peut favoriser l'apparition d'une aspergillose.
Dans cette étude 3 isolats de Candida parapsilosis ont été répertoriés dans cette étude. La faible incidence de C. albicans a été également enregistrée par d'autres chercheurs. Une étude de la flore fongique du sable des deux plages à Casablanca, a isolé 19 champignons levuriformes, dont 10 appartiennent à l'espèce Candida albicans. Pourtant, une seule souche de candida albicans a été isolée en étudiant la Biodiversité fongique du sable de quatre Plages (Beau Séjour, Eden, les Andalouses et Madagh) du Littoral ouest algérien
Enfin, une seule souche appartenant au genre Rhizomucor a été isolée aussi bien dans notre étude que dans une étude de la biodiversité fongique du sable de quatre plages (Beau Séjour, Eden, les Andalouses et Madagh) du Littoral ouest algérien, pourtant aucune souche n'a été isolée par l’étude de la flore fongique du sable de deux plages à Casablanca.
En grande partie périurbaine, la portion de côte étudiée est sujette à de multiples occupations et activités humaines qui affectent de manière directe ou indirecte la qualité du sable, Pêche à la ligne, Pêche à la barque, Récolte de moules, Récolte de poulpes, Récolte d'annélides (pour la pêche).
Sur la partie urbaine du littoral de Rabat et El Harhoura, plus d'une dizaine de rejets d'eau usée débouchent en mer. Ils constituent une source permanente de pollution qui affecterait en permanence cette plage.
5 Conclusion
Cette étude révèle une diversité des agents fongiques isolés du sable de cinq plages marocaines, avec notamment des champignons qui pourraient favoriser la contamination des estivants fréquentant ces plages.
Cette étude doit être complétée par d'autres enquêtes à plus grande échelle comportant la Période estivale afin d'isoler d'autres champignons et surtout des dermatophytes, et pour proposer quelques mesures préventives visant à diminuer le risque de contamination des estivants.
L'analyse de la nature et de la fréquence d'isolement de champignons selon les sites, montre une nette prédominance du genre fusarium au niveau de la plage de Martil, une prédominance d 'Aspergillus niger au niveau de la plage de rabat.
D'une manière spéculative, on peut déduire que la répartition de la flore fongique du sable des plages étudiées dépend en premier lieu de facteurs environnementaux telles que les conditions climatiques et à la présence de matière organique qui provient des eaux usées déversées dans la plage (L'Oued Martil, L'Oued El Maleh pour la plage de Martil) Donc, il semblerait que le sable côtier représente un important réservoir de champignons, mais il peut être important pour les animaux, les plantes, et les écosystèmes terrestres et marins.
Afin d'assurer une qualité optimale du sable des plages marocains, et diminuer la fréquence de contamination. Dans certains pays, en particulier dans les zones de ressource, le nettoyage mécanique de sable est une pratique courante qui peut éliminer les ordures visibles mélangée avec le sable, la réduction des quantités de matière organique et donc réduisant le développement ultérieur de micro-organismes. Ainsi qu'une surveillance constante de la plage afin de prévenir L'accès des animaux. L'utilisation des serviettes propres pour l'usage sur la plage, une bonne hygiène personnelle, l'interdiction des animaux et le nettoyage mécanique régulier sont considérés, par certaines autorités, qui seront importants.
6 Références
N. MACHOURI, UFR Chaire UNESCO. Gestion de l'Environnement et Développement Durable » Université Mohammed V, Faculté des Lettres et des Sciences Humaines, Rabat (Maroc) 2p
Hanane AIT HMEID 2015. Élaboration du schéma d'assainissement de la commune urbaine de Harhoura : contribution à l'étude sectorielle d'assainissement liquide de la province Skhirat-Témara, 44p
Khabali, H; Targuisti K.; Ezzouak F.; Valenzuela L. M. (2011) diagnostic environnemental et urbanistique de la ville de. MARTIL Entre 1966 et 2003
Vanbreusghem R. Techniques biologiques pour l'isolement des dermatophytes du sol. Ann Soc Belge Me'd Trop 1952; 32:173-8.
M. Soussi Abdallaoui *, H. Boutayeb, N. Guessous-Idrissi. La flore fongique du sable de deux plages a Casablanca (Maroc) Analyse et corollaires épidémiologiques [166]. Colin, M. Les équipements du bloc opératoire
Imane ESSAMKAOUI 2012 les onychomycoses à moisissures et pseudo-dermatophytes à L'HÔPITAL MILITAIRE D'INSTRUCTION MOHAMMED V DE RABAT (MAROC) 41p
BOTTON B., BRETON A., FÈVRE M., GAUTHIER S., GUY P., LARPENT J.P. REYMOND P., SANGLIER J.J., VAYSSIER Y., VEAU P. (1990). Moisissures utiles et nuisibles, Importance industrielle. Ed. Masson, Paris.
CAHAGNIER B., RICHARD-MOLARD D. (1998). Analyse mycologique des Moisissures des aliments peu hydratés. Ed. Tee & Doc, 140-158.
CAMPBELL C.K., JOHNSON E.M., PHILPOT C.M., WARNOCK D.W. (1996). Identification of pathogenic fungi, Public Health Laboratory Service.
Aurélie LECELLIER (2013) Caractérisation et identification des champignons filamenteux par spectroscopie vibrationnelle
Bernard TIVOLI. Guide d'identification des différentes espèces ou variétés de Fusarium rencontrées en France sur la pomme de terre et dans son environnement
Menan, H., Ekaza, E., Messou, E., Adoubryn, K., Yavo, W., Kiki-Barro, P., ... & Kouassi, B. T. (2008). Recherche de Candida dubliniensis chez des patients VIH+ à Abidjan (Côte d'Ivoire). Journal de Mycologie Médicale/Journal, 18(4), 228-233
Anonyme. (2003). Mode d'emploi - Milieux en boites de Pétri prêts à l'emploi. BD Mycosel Agar- BD Sabouraud Agar with Chloramphenicol and Cycloheximide.
MESSAOUD CHAHRAZED (2017) Contribution au diagnostic des infections urinaires à Candida au CHU de Tlemcen (Application d'extraits naturels)
Evaluation de Bichrolatex Albicans Versus test de filamentation pour l'identification des levures du genre condida Mme Hayate Benkirane 2014
OUTERBRIDGE C.A. (2006), Mycologie Disorders of the Skin, Clin. Tech. Small Anim. Pract.,
CAF ARCHIA C, ROMITO D., GIOIA C., GUILLOT J., OTRENTO D. (2006), Isolation of Microsporum canis from the hair coat of pet dogs and cats belonging to owners diagnosed with M. canis tinea corporis, European Society of Veterinary Dermatology. 17; 327-33
O. Welsh, L. Vera-Cabrera, and E. Welsh, "Onychomycosis," Clin. Dermatol., vol. 28, no. 2, pp. 151-159, Mar. 2010
A. K. Gupta, C. Drummond-Main, E. A. Cooper, W. Brintnell, B. M. Piraccini, and A. Tosti,
"Systematic review of nondermatophyte mold onychomycosis: Diagnosis, clinical types,
epidemiology, and treatment," J. Am. Acad. Dermatol., vol. 66, no. 3, pp. 494- 502, Mar. 2012
C. Gupta et al. "Genotyping and ln Vitro Antifungal Susceptibility Testing of Fusarium isolates
from Onychomycosis in India, Mycopathologia, vol. 181, no. 7-8, pp.497-504, Aug.2016
D. He et al., "Pathogenic Spectrum of Fungal Keratitis and Specific Identification of Fusarium solani," Investig. Opthalmology Vis. Sei., vol. 52, no. 5, p. 2804, Apr. 2011
ROSES CODINACHS M., ISERN VINS A.M., FERRER ESCOBAR M.D.,FERNANDEZ PEREZ
F. (1988). Microbiological contamination of the sand from the Barcelona city beaches. Revista de
Sanidade.
FIGUERAS M.J., GUARRO J., SOLER L., INZA l., POLO F. (1992). Estudio piloto sobre la
contamination de las playas del litoral Catalan. [ A pilot study on the contamination of Catalounian
beaches.] Proceedings of the 1 ° Congreso Nacional del Medio Ambiente, Madrid
BARTRAM J., REES G.E.D. (2000). Monitoring bathing waters: a practical guide to the design and implementation of assessments and monitoring programmes. London, E & FN Spon. Published on behalf of the World Health Organization, Commission of the European Communities and US Environmental Protection Agency
Guarro J., Gene J. 1992. Fusarium infections Criteria for the identification of the responsible species, Mycoses, 35, 109-114.
Duran J.A., Malvar A., Pereiro M., Pereiro Jr. M., (1989), Fusarium moniliforme keratitis, Acta ophthalmol., Scand. 67, 710-713
Thomas P.A., Geraldine P. 1992.Fungal keratitis due Fusarium and other fungi, J. Mycol. Med., 2, 121-131
[189]. Del Palacio H.A., Guttierez A., Guttierez E.,.1985. Ulcera comeal pour Fusarium solani, Rev. Iber. Micol., 2, 29-35
GHORRI Sana 2015 Isolement des microorganismes possédant une activité anti-Fusarium
Elkaim B. 1971. Contribution à l'étude écologique de l'estuaire du Bouregreg: leproblème de la pollution. Société des sciences naturelles et physiques du Maroc Bulletin 1971 tomeSl.203-212. Cheggour M. 1986. Bioaccumulation de quelques éléments métalliques (Cu, zn, pb, Ni, Cr, Mn, Fe, V) chez un mollusque bivalve, Scrobircularia plana, dans l'estuaire de Bourgeg (côte atlantique marocaine). Bull.Sci.,1989 n°13; pp 125-133.
Cheggour M. 1988. Contribution à l'étude d'un milieu paralique : l'estuaire de Bouregreg (côte atlantique marocaine) ; conditions écologiques globales et étude de la contamination métallique. Thèse de 3ème cycle, E.N.S. Takadoum, Rabat, 337 p
Cheggour M., Texier H., Moguedet G. &Elkaîm B. 1990. Metal exchange in the fauna-sediment
system. The case of Nereisdiversicolor and Scrobiculariaplana in the BouRegreg estuary
(Morocco). Hydrobiologia, 207, 209-219.
Tahiri L., Bennasser L., Idrissi L., Fekhaoui M., El Abidi A. &Mouradi A. 2005. Contamination
métallique de Mytilusgalloprovincialis et des sédiments au niveau de l'estuaire de Bouregreg
(Maroc). Waterqual. Res. J., 40, 1, 111-119.
Dahbi N. 1989. Contribution à l'étude d'un milieu paralique : l'estuaire de Bouregreg (côte
atlantique marocaine) ; hydrologie, hydrodynamique et pollution métallique. Thèse 3ème cycle,
E.N.S. Takadoum, Rabat, 150 p.
Cherkaoui E.,Nounah A. and Khamar M. 2013. The Impact of Pollution on the Bouregreg Estuary
(Morocco, Atlantic Ocean): The Molluscs as an lndicator of Metal Contamination. Journal of
Environrrîental Science and Engineering B 2 (2013) 432- 435 ABDELLATIF BERRAHO 2006 Évaluation du milieu marin
Chermette R, Bussieras J. Abrégé de parasitologie vétérinaire. Fascicule V : mycologie vétérinaire.
Polycopié. Ecole Nationale Vétérinaire d' Alfort, Unité Pédagogique de parasitologie et Maladies
parasitaires, 1993, l 79p.
Saâd HANANE, Hassane JAZIRI,Mohamed DAKK.I.Composition et phénologie du peuplement d'oiseaux d'eau de la zone littorale atlantique de Rabat-Bouznika (Maroc)
Aspergillose pulmonaire invasive et aspergillose pulmonaire chronique Pietro Gianella, Paola Gasche-Soccal, Christian van Delden, Anne-Lise Hachulla, Thierry Rochat Rev Med Suisse 2014; volume 10. 2202-2207
Scedosporium apiospermum infections and the role of combination antifungal therapy and GM-CSF: A case report and review of the literature Chloe Goldman, Matthew J. Akiyama, Julian Torres, Eddie Louie, Shane A. Meehan Med Mycol Case Rep. 2016 Mar; 11: 40–43.
Phylogenetic relationships among members of the Fusarium solani species complex in human infections and the descriptions of F. keratoplasticum sp. nov. and F. petroliphilum stat. nov. Dylan P.G. Shorta Kerry O’Donnellb Ulf Thranec Kristian Fog Nielsen cNing Zhangd Jean H.JubaaDavid M.Geisera