HAL Id: tel-01216781
https://tel.archives-ouvertes.fr/tel-01216781
Submitted on 17 Oct 2015HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
fourmi Mystrium rogeri
Sylvain Londe
To cite this version:
Sylvain Londe. Origines et potentiel évolutif des intercastes chez la fourmi Mystrium rogeri. Evolution [q-bio.PE]. Université Pierre et Marie Curie - Paris VI, 2014. Français. �NNT : 2014PA066320�. �tel-01216781�
Université Pierre et Marie Curie
Ecole doctoraleSciences de la Nature et de l'Homme (ED 227)
Institut d’écologie et des sciences de l’environnement de Paris
Origines et potentiel évolutif des intercastes chez la fourmi
Mystrium rogeri
Par Sylvain Londe
Thèse de doctorat de biologie et écologie
Dirigée par Mathieu Molet et Thibaud Monnin
Présentée et soutenue publiquement le 15 Octobre 2014
Devant un jury composé de :
M. Abbadie, Luc Professeur des universités, Ecole Normale Supérieure, Paris
Président
M. Molet, Mathieu Maître de conférences, Université Pierre et Marie Curie, Paris
Directeur de Thèse
M. Monnin, Thibaud Directeur de recherche, Université Pierre et Marie Curie, Paris
Directeur de Thèse
M. Heinze, Jürgen Professeur, Universität Regensburg, Regensburg Rapporteur M. Nijhout, Frederik Professeur, Duke University, Durham Rapporteur M. Fourcassié, Vincent Chargé de recherches, Université Toulouse III,
Paul Sabatier, Toulouse
3
Remerciements
Tout d’abord un grand merci à mes directeurs de thèse Mathieu Molet et Thibaud Monnin pour leur accompagnement scientifique, leur patience (souvent mise à l’épreuve) et leur implications tout au long de ses trois années de thèse. Je remercie tout particulièrement Mathieu pour ses exigences et ses encouragements, et Thibaud pour son éternelle sérénité et son soutient.
Je voudrais remercier Brian Fisher, Jean-Jacques Rafanomezantsoa, ChrislainRanaivo, Clavier Randrianandrasana pour leur collaboration lors de la collecte des colonies de Mystrium sur le terrain, ainsi que Vincent Debat et Raphaël Cornette du MNHN pour leur implicationlors des analyses morphométriques. Je remercie également Frederik Nijhout et Jürgen Heinze d’avoir accepté de prendre de leur temps pour participer à la critique de mon travail en tant que rapporteurs.
Merci à Martin, Marie et AnneC pour leurs relectures et leurs commentaires. Merci à Romain pour le soin qu’il a apporté aux colonies, merci à Claudia pour ses conseils. Merci à tous les collègues du labo (ou des labos environnants), parmi lesquels je citerais, au risque d’en oublier certains, Marie et Ewen (pour leur accompagnement technique dans les procédures administratives), Thomas (pour ses blagues parfois douteuses, mais souvent drôles), Florence, Alessandro, Anaïs, Marion, Céline, Mélissa, Julien, AnneC, Martin, Pierre Alain… pour leur présence, les discussions constructives et la bonne ambiance de travail (et de pauses) à laquelle ils ont tous contribué.
Merci aux stagiaires qui ont apporté leur aide dans les diverses manipulations de cette thèse, parmi lesquels, Hélène, Juliette, Pauline, et Brian.
5
Sommaire
Remerciements ... 3
Sommaire ... 5
I- CONTEXTE GENERAL ... 9
Les origines de la variation en évolution ... 9
Les origines de la nouveauté en évolution ... 13
Evolution de nouvelles castes par recombinaison développementale ... 17
II-ORIGINES DEVELOPPEMENTALES DES INTERCASTES ... 19
Abstract ... 20
Introduction ... 21
Material and Methods ... 25
Collection ... 25
Digitalization ... 26
Queen-likeness index calculation ... 26
Reaction norms / variation norms ... 28
Allometry ... 28
Results ... 29
Queen-likeness indexes ... 29
Mosaicism ... 29
Shape of variation norms ... 30
Discussion ... 30
Tables ... 40
6
III- VARIABILITE COMPORTEMENTALE DES INTERCASTES ... 41
Introduction ... 42
Material and Methods ... 44
Biological material ... 44
Behavioral data ... 45
Multivariate analyses of location and task ... 45
Specialization calculation ... 46
Dominance scores ... 46
Gyne, worker and intercaste comparisons ... 47
Results ... 47 Behavioral profiles ... 47 Behavioral specialization ... 48 Dominance hierarchy ... 48 Discussion ... 48 Figures ... 51 Tables ... 58 Acknowledgments ... 58 Données complémentaires ... 59
IV- POTENTIEL EVOLUTIF DES PHENOTYPES INTERCASTES ... 63
Introduction ... 63
Matériel et méthodes ... 64
Matériel biologique ... 64
Tests d’accouplements ... 65
Suivi de la ponte d’une intercaste ... 67
Dissections ... 67
Résultats ... 67
7
Suivi de la ponte de l’intercaste accouplée et observations ... 71
Taille de la spermathèque, nombre d’ovarioles et d’oocytes ... 71
Discussion ... 74
V- DISCUSSION ET CONCLUSIONS GENERALES ... 77
Origine de la production d’intercastes ... 77
Coûts et bénéfices de la production d’intercastes ... 79
Potentiel évolutif des intercastes ... 79
Implications théoriques ... 81
Perspectives ... 84
9
I- CONTEXTE GENERAL
Le modèle d’évolution par recombinaison
développementale
Les origines de la variation en évolution
La question de l’inné et de l’acquis est une problématique fondamentale en biologie et en évolution. Charles Darwin (1859) a pu proposer un modèle crédible d’évolution des organismes parce qu’il a distingué la part innée des déterminants biologiques, c'est-à-dire ceux qui sont hérités des parents par une transmission obligatoire, de ceux qui sont acquis à l’échelle individuelle et n’ont un effet que sur la génération présente. C’est en discriminant l’héréditaire du non héréditaire qu’on comprend que les variations dans le programme génétique vont être transmises de génération en génération, relativement à l’augmentation
ou à la diminution du succès reproducteur qu’elles induisent chez les individus qui les portent. La théorie synthétique de l’évolution des années 1940 a ainsi formalisé la distinction entre les différents déterminants du phénotype d’un individu par la relation « P = G + E ». Autrement dit, le phénotype (P) est le produit du développement de l’organisme suivant les instructions du génome (G) hérité de ses parents, dans un environnement donné (E) acquis par l’individu. Comme les déterminants génétiques et environnementaux varient d’un individu à l’autre, à l’échelle de la population, on peut dériver la formule ainsi : Var(P) = Var(G) + Var(E) (Encart 1). Seule l’information génétique étant transmissible, seul l’apport de
10
variation génétique est susceptible d’être filtré par la sélection naturelle de génération en
génération, et va de ce fait influencer l’évolution. La sélection stabilisante (c.-à-d. la contre-sélection des phénotypes trop éloignés de la valeur optimale pour un caractère donné) va se traduire soit par l’élimination des déterminants génétiques qui produisent des phénotypes inadaptés soit par le développement de mécanismes de canalisation génétique (cf. Encart 2) qui va rendre cette variation délétère silencieuse. L’environnement est alors plutôt considéré comme une source de bruit aléatoire vis-à-vis duquel le génome n’a de cesse d’augmenter la robustesse de ses programmes pour en atténuer les effets sur le phénotype. L’ensemble des mécanismes qui permettent au développement de résister à une partie de la variation environnementale pour produire des phénotypes stabilisés autour des valeurs de trait optimales est appelé la canalisation environnementale (Debat and David 2001) (Cf. Encart 2).
Décomposition de la variation phénotypique
= + + + × +
La variation d’origine génétique correspond à la variation induite par la diversité des génomes au sein
d’une population. Elle se divise en deux composantes : une composante additive (Ga) correspondant à la partie
héritable de la variation (héritabilité), et une composante de dominance (Gd), non héritable, qui correspond à
l’interaction entre les différents allèles et les relations épistatiques entre locus. La variabilité génétique a pour source les différents processus de mutation aléatoire, duplication/insertion de fragments de génome, et de recombinaison (Barton and Keightley 2002; David and Samadi 2011).
Des individus génétiquement identiques produits dans des environnements différents aboutissent à des phénotypes différents. Cette variation est dite environnementale (E). Elle correspond à la plasticité phénotypique. Tous les génotypes n'ont pas la même sensibilité vis à vis de la variation de l'environnement et peuvent ainsi présenter des normes de réactions différentes. La variation entre les normes de réaction des différents génotypes correspond à l’interaction entre les variations génétiques et environnementales (GXE)
(Debat and David 2001; Whitman and Agrawal 2009).
Les expérimentations en laboratoire montrent que même pour des lignées d’individus génétiquement identiques élevées dans des conditions environnementales contrôlées, il y a une variation phénotypique
interindividuelle(Varintra). Elle est issue de perturbations aléatoires affectant les processus physiologiques
cellulaires, la communication entre cellules ou leurs taux de croissance, de division et d’élongation. Ce type de variation se traduit notamment par de l’asymétrie fluctuante (différences aléatoires entre le côté gauche et le côté droit des organismes bilatériens) (Møller and Swaddle 1997).
11
Cependant, les avancées de la génétique évolutive du développement tendent à
nuancer cette vision « génocentrique » et suggèrent que les facteurs environnementaux et développementaux peuvent avoir des implications importantes en évolution. En effet, les influences des gènes et de l’environnement sont inextricablement liées dans la production d’un phénotype par le biais du développement. Les effets conjoints des gènes et de l’environnement sont particulièrement évidents dans les cas de plasticité phénotypique. La plasticité phénotypique est la faculté d’un génotype à produire différents phénotypes en réponse à des facteurs environnementaux différents (Debat and David 2001; Whitman and Agrawal 2009). Plasticité phénotypique et dé-canalisation environnementale (l’inverse de la canalisation environnementale) sont donc des concepts interchangeables (Debat and David 2001). Il s’agit d’une caractéristique fondamentale du vivant qui se retrouve chez tous les organismes, du simple fait que l’ensemble des contraintes physiques et chimiques auxquelles sont confrontés les organismes au cours du développement affecte à des échelles variées les réactions moléculaires, les processus cellulaires et l’ontogénie des différents tissus (Sultan 1992). Au cours de l’évolution, cette plasticité, qui au départ n’est qu’un simple effet secondaire non adaptatif des processus biologiques a été assimilée au programme développemental des organismes en tant que réponse adaptative, par le biais d’une sensibilité des processus développementaux à des facteurs environnementaux spécifiques. Parmi les exemples classiques de plasticité phénotypique, on peut citer la capacité des végétaux à ajuster le développement du système aérien et racinaire en fonction de la disponibilité des ressources (Fig. 1.1) (Sultan and Bazzaz 1993; Sultan 2003), l’augmentation compensatoire de la taille du tube digestif en réponse à un appauvrissement de la qualité nutritive du milieu chez une espèce de criquet (Yang and Joern 1994), les différences saisonnières de patrons alaires de certaines espèces de papillons en réponse à la température de leur milieu (Windig 1994) et le développement des individus selon des castes morphologiques différentes chez les hyménoptères sociaux en fonction des conditions d’élevage des larves (Oster and Wilson 1978; Wheeler 1986). La plasticité phénotypique permet ainsi une adaptation à des environnements hétérogènes en leur associant des phénotypes alternatifs (Stearns 1989; Schlichting and Pigliucci 1998).
La plasticité phénotypique est susceptible d’influencer le cours de l’évolution des organismes de différentes façons. En permettant aux individus de s’adapter en une seule
12
génération elle va très fortement influencer leur capacité de survie lors de changements
brutaux de l’environnement, et ce en fonction de l’intensité et de la direction (c.-à-d. la gamme des phénotypes produits) de la plasticité phénotypique (c.-à-d. le “Baldwin effect”; Baldwin 1896, 1902; Crispo 2007). D’autre part, comme elle permet de compenser les effets de la variation génétique par une réponse plastique adaptative, certains gènes vont être soumis à une pression de sélection relâchée, favorisant l’accumulation de variation génétique non exprimée (Sangster et al. 2004; Lahti et al. 2009; Van Dyken and Wade 2010). Cette variation génétique cryptique pourra alors être impliquée ultérieurement dans l’adaptation à de nouvelles conditions environnementales (Moczek 2008; Pfennig et al. 2010).
Figure 1.1 :Variation du phénotype (ici la proportion de biomasse allouée dans le feuillage
relativement au reste de la plante) en fonction des conditions environnementales. La plasticité phénotypique est montrée ici pour 10 génotypes élevés sous serre dans trois traitements de luminosité. D’après Sultan et Bazzaz (1993).
L’influence des facteurs environnementaux dans le cours de l’évolution n’implique en aucun cas l’hérédité des caractères acquis. Elle est possible parce que la plasticité phénotypique repose sur des voies développementales comprenant des bases génétiques
13
qui peuvent répondre à la sélection. Ces bases génétiques sont particulièrement mises en
évidence dans le phénomène d’assimilation génétique (Encart 2). Une découverte importante de Waddington (1942, 1953) montre en effet que, s'ils sont sélectionnés, certains traits induits par des facteurs environnementaux peuvent secondairement être assimilés dans le répertoire développemental des organismes. Au bout de quelques générations de sélection, ils peuvent être exprimés chez tous les individus, même en l’absence des facteurs environnementaux initiaux. Le mécanisme sous-jacent à ce type d’évolution est appelé assimilation génétique. L’explication de ce phénomène est que la perturbation environnementale a pour effet de faire s’exprimer dans le phénotype une partie de la variation génétique qui n’était pas exprimée dans les conditions initiales et ainsi de la soumettre à la sélection naturelle. Si la perturbation environnementale perdure assez longtemps pour qu’il y ait une sélection sur plusieurs générations, et que les nouveaux phénotypes associés sont bénéfiques, alors les allèles qui ont des effets quantitatifs conjoints sur la stabilisation de l’expression de ces nouveaux phénotypes vont être sélectionnés. Il s’agit en fait d’un réajustement de la canalisation autour d’une nouvelle valeur de trait. Des études ont par la suite donné d’autres exemples d’assimilation génétique et démontré son importance en évolution (Pigliucci et al. 2006; Suzuki and Nijhout 2006; Crispo 2007). De manière plus générale, cet ajustement de la canalisation autour de nouvelles valeurs de traits peut également accompagner la déstabilisation des phénotypes suite à des perturbations génétiques (p.ex. mutations). On parle alors d’accommodation génétique (Nijhout and Suzuki 2008; Suzuki and Nijhout 2008).
Les origines de la nouveauté en évolution
La définition de la nouveauté en évolution est une problématique difficile (Gould 2002). Comment concilier la notion de nouveauté, qui implique un aspect du phénotype qui n’était pas présent chez les ancêtres immédiats, avec un cadre théorique basé sur la descendance avec modification ? Où commence la nouveauté le long d’une série de modifications graduelles ? On aurait pu penser s’en sortir en écartant les caractères pour lesquels on trouve un état homologue chez les ancêtres. Cependant pour une innovation aussi évidente que les différents types d’yeux qui furent longtemps considérés comme des cas d’apparition indépendantes chez divers taxons (Land and Fernald 1992), on sait maintenant qu’ils sont tous issus de l’exploitation de gènes et de circuits de régulation déjà
14
présents chez un ancêtre commun (Gehring and Ikeo 1999). D’autres cas d’« homologies
profondes » (cf. « deep homology concept » ; Shubin et al. 2009) concernant les membres des tétrapodes ou certains appendices chez les arthropodes (Prud’homme et al. 2011) montrent que l’évolution procède en recyclant le matériel issu des évolutions passées (Jacob 1977; Shubin et al. 2009; Moczek 2011). West-Eberhard (2003) parle alors d’évolution combinatoire pour décrire la réorganisation du phénotype, certaines parties pouvant être exprimées plusieurs fois au cours du développement ou perdues indépendamment du reste de l’organisme (Raff 1996). L’évolution combinatoire est rendue possible par la modularité des organismes.
Mise en évidence de l’assimilation génétique et de la canalisation
En exposant des larves de drosophiles à de hautes températures, Waddington (1942) observe l’apparition d’adultes présentant des anomalies alaires (caractère dit ‘crossveinless’ : discontinuité dans les nervures transversales). En sélectionnant ces individus pour les croiser entre eux et en soumettant les larves de leurs descendants aux mêmes conditions de hautes températures sur quelques générations, il obtient des individus qui présentent le caractère ‘crossveinless’ spontanément, sans que leurs larves aient été exposées à de fortes températures. Ces observations, qui ont d’abord rappelé l’hérédité des caractères acquis de Lamarck, s’interprètent en fait comme l’expression d’une variation cryptique initialement présente dans le pool génétique des lignées ancestrales, mais qui était restée inexprimée avant la phase de sélection. Au début de l’expérience, les individus qui présentent des anomalies alaires en réponse au stress environnemental, sont porteurs d’allèles ayant tendance à affecter les ailes. Mais ces allèles, séparément, ne peuvent pas s’exprimer sans l’intervention d’un stress déstabilisant le paysage épigénétique global. La sélection de ces individus va alors induire la concentration de tels allèles dans le génome ainsi qu’une modification des systèmes de régulation du développement qui y sont associés jusqu’à la fixation du caractère (Waddington, 1953).On parle alors d’assimilation génétique. La canalisation génétique correspond à la propriété de résistance du développement à une partie de la variation génétique avant sa fixation par assimilation génétique. De manière symétrique on désigne par « canalisation environnementale » l’ensemble des mécanismes qui permettent au développement
de produire des phénotypes constants en dépit des variations environnementales (Debat et David, 2001).
Encart 2. La modularité correspond à la discontinuité des liens qui associent différentes sous parties du phénotype, et se traduit par une compartimentation de l’organisme (Wagner 1995b). Un module est une sous unité du phénotype dont les parties co-varient plus fortement entre elles qu’elles ne co-varient avec les parties des autres modules (Klingenberg 2008). Par exemple les dimensions d’une aile d’insecte sont étroitement corrélées alors
15
qu’elles sont relativement indépendantes des dimensions des pattes. Les modules sont
associés à une évolution semi-indépendante, souvent en relation avec les fonctions pour lesquelles ils sont sélectionnés. Ainsi, la forme des ailes et des pattes étant soumise à des pressions de sélection indépendantes, les morphologies des deux appendices vont évoluer de manière relativement indépendante. L’ontogénie de chaque module étant régulée par des groupes de gènes et des relations épistasiques indépendantes, la modification des réseaux de régulation peut entrainer une réorganisation majeure des sous-unités du phénotype (West-Eberhard 2003).
Mary Jane West-Eberhard (2003, 2005a) a proposé un modèle d’évolution impliquant à la fois la modularité des organismes et la plasticité phénotypique. Il s’agit du modèle d’évolution par recombinaison développementale, selon lequel des nouveaux phénotypes ont pour origine la réorganisation des phénotypes ancestraux suivie par une stabilisation du changement par accommodation génétique. Une particularité majeure de la recombinaison développementale est que la réorganisation du phénotype peut aussi bien être initiée par un apport de variation génétique (p.ex. mutations affectant les gènes architectes du développement) que par un apport de variation environnementale initiant une réponse plastique. On peut résumer l’évolution d’un nouveau phénotype par recombinaison développementale résultant d’une induction environnementale en différentes étapes : (i)On a initialement une population d’individus qui varient dans leur sensibilité aux facteurs environnementaux mais dont la variabilité ne se traduit pas phénotypiquement soit parce que les conditions environnementale qui pourraient induire ces changements ne se produisent pas, soit parce que la canalisation stabilise les phénotypes. (ii)Des changements environnementaux suffisamment importants pour rompre la canalisation entraînent l’expression de cette variabilité au niveau phénotypique. En fonction de la plasticité phénotypique des différents individus de la population, certains modules présentent alors des modifications majeures. Contrairement à des mutations affectant des gènes structuraux qui se traduisent par des effets aléatoires, les modifications occasionnées par la plasticité phénotypique sont beaucoup plus enclines à produire des variants favorables car elles reflètent des voies développementales impliquées dans des adaptations passées chez les génotypes ancestraux. (iii)Les nouveaux phénotypes produits sont soumis à la sélection naturelle. Le nombre de variants phénotypiques peut être relativement important étant
16
donné que toute la population est soumise au changement environnemental. De ce fait des
phénotypes favorables ont beaucoup plus de chance d’augmenter en fréquence suite à l’action de la sélection car ils sont moins sensibles à la dérive génétique qui peut occasionner la perte d’une mutation, même très favorable, en raison du très petit nombre de mutants initiaux. La stabilisation du nouveau phénotype résulte alors de l’assimilation génétique qui va réajuster la chronologie et les différents seuils de réponses impliqués au cours du développement (West-Eberhard 2003, 2005a).
Figure 1.2 : Résumé des interactions entre développement, génome et environnement. La canalisation
génétique et environnementale permet de protéger le développement d’une partie des variations génétiques et environnementales ayant des effets délétères. Les gènes architectes régulent les mécanismes de canalisation et organisent l’expression d’autres gènes de plus haut niveau. Les gènes sensibles aux facteurs environnementaux ajustent l’expression des gènes structuraux, qui synthétisent les éléments constitutifs du phénotype. La sélection agit de manière directe sur les phénotypes, et indirectement sur l’ensemble du génome, par le biais de sa transmission différentielle de génération en génération. Les facteurs environnementaux induisent des variations phénotypiques par le biais desquelles la sensibilité du développement se trouve elle-même sous sélection.
17
Evolution de nouvelles castes par recombinaison développementale
Le modèle d’évolution par recombinaison développementale a ensuite été proposé par Molet et al. (2012) comme étant un mécanisme évolutif jouant un rôle prépondérant dans l’évolution de nouvelles castes chez les fourmis.
Les fourmis sont remarquables de par la diversité et la complexité de leurs systèmes de castes. Ainsi, au sein d’une même espèce, à partir d’un même génotype, la plasticité phénotypique permet le développement des larves selon des voies alternatives distinctes aboutissant à des morphologies, des comportements et des fonctions extrêmement variés(Wilson 1971; Brian 1980). On appelle polyphénisme la faculté à produire des phénotypes alternatifs discrets en fonction des conditions environnementales. Le cas le plus répandu est la spécialisation en deux castes : des individus reproducteurs avec des ailes – les reines –, et des individus non reproducteurs aptères – les ouvrières – (Oster and Wilson 1978). Ce système de castes est associé au mode de « fondation indépendante ». Les jeunes reines (gynes) quittent le nid, sont fécondées pendant l’essaimage (vol nuptial), dispersent, puis fondent seules les nouvelles colonies. Ce mode de fondation est considéré comme étant un caractère ancestral chez les fourmis étant donné que les fourmis ont évolué à partir de guêpes solitaires chez qui la dispersion se fait par le vol (Peeters and Molet 2010).
Il existe cependant de nombreuses espèces présentant des castes supplémentaires ou alternatives. C’est le cas des soldats, (caste d’individus non reproducteurs) et des reines ergatoïdes, qui sont des reproductrices aptères, associées au mode de fondation par fission coloniale. La dispersion des reines se fait alors au sol (pas d’essaimage) par fission de la colonie mère (Holldobler and Bartz 1985; Cherix et al. 1991; Peeters and Molet 2010).
Molet et al. (2012) ont montré qu’il est possible d’interpréter la morphologie des reines ergatoïdes et des soldats comme des mosaïques de caractères de type reine et ouvrière. En effet une reine ergatoïde peut être considérée comme un individu présentant un appareil reproducteur fonctionnel de type reine associé à un thorax d’individu aptère de type ouvrière. De même, un soldat peut être considéré comme un individu présentant des caractères de reines (taille, développement de la tête) et un appareil reproducteur stérile de type ouvrière. De plus, il se trouve que certaines anomalies décrites chez les fourmis, appelées intercastes, correspondent également à des morphologies mosaïques entre reines
18
et ouvrières (Plateaux 1970; Peeters 1991b). En partant de ce constat, Molet et al. (2012)
ont proposé que des nouvelles castes comme les reines ergatoïdes aient pu évoluer par recombinaison développementale à partir des intercastes qui réassocient des partie reines des parties ouvrières suite à des inductions environnementales.
La plausibilité de ce modèle d’évolution de nouvelles castes par recombinaison développementale chez les fourmis sera évaluée en cherchant à apporter des éléments de réponses correspondant à trois grands axes de travail :
I- Détermination de l’origine développementale des intercastes. Dans cette partie, il s’agira de déterminer si les intercastes sont bien des phénotypes mosaïques qui recombinent des parties reine et ouvrières, en quoi cette recombinaison phénotypique est associée au polyphénisme reine/ouvrière, et quels sont les facteurs qui peuvent induire cette production.
II- Evaluation des coûts et bénéfices de la production d’intercastes pour les colonies. Du fait du manque de données concernant le comportement des intercastes chez les fourmis, nous n’avons aucune idée de l’effet de leur production sur le succès des colonies. La sélection opérant à l’échelle de la colonie chez les fourmis, il est essentiel d’étudier les profils comportementaux des intercastes au sein des colonies pour savoir si la production d’intercastes est susceptible d’être sélectionnée. La prédiction qui découle des analyses théoriques de West-Eberhard (2005a) et Molet et al. (2012) est que les comportements des intercastes produits par plasticité phénotypique ont plus de chance d’être fonctionnels que le seraient ceux présentés par des individus issus de variants génétiques.
III- Quel est le potentiel évolutif des phénotypes intercastes. Dans cette partie nous étudierons les liens entre les phénotypes des intercastes et ceux des reines ergatoïdes qui ont évolué à de nombreuses reprises de manière indépendante chez les fourmis. Ceci nous amènera à établir la plausibilité d’évolution des reines ergatoïdes à partir de la production d’intercastes selon le mode d’évolution par recombinaison développementale proposé par West-Eberhard (West-Eberhard 2005a) et Molet et al. (2012).
19
II- ORIGINES
DEVELOPPEMENTALES DES
INTERCASTES
Plasticity and modularity allow for the
production of novelmosaic phenotypes in ants
Cette partie correspond à un article en soumission (Evolution), coécrit par les auteurs suivants :
Sylvain Londe1, Thibaud Monnin1, Raphaël Cornette2, Vincent Debat2, Brian L. Fisher3 and Mathieu Molet1
1 Sorbonne Universités, UPMC Univ Paris 06, UMR CNRS 7618 Institute of Ecology and Environmental Sciences of Paris, Paris, France
2 Muséum National d’Histoire Naturelle; UMR CNRS 7205 ISyEB, Département Systématique et Évolution, Paris, France
3 Department of Entomology, California Academy of Sciences, Golden Gate Park, 55 Music Concourse Drive, San Francisco, California 94118, USA
20
Abstract
Despite the evidence that many qualitative shifts have occurred during evolution, the origin of discrete novelty remains poorly understood. Some authors proposed that novelty may involve recombination of modules from alternative phenotypes. Using a new morphometric procedure, we tested the hypothesis that some anomalous individuals in ants are mosaic phenotypes recombining queen-like and worker-like modules. We then explored the developmental processes generating mosaicism by computing the variation norm (a
proxy of reaction norm) of each module. We found that intercastes are more mosaic than workers and queens, but there is no discontinuity between workers and intercastes. Intercastes are always more queens-like for head, legs and gaster than for thoracic modules, suggesting that the possible combinations are strongly restricted. We found that distinct modules exhibited distinct variation norms. We conclude that intercastes are generated by intermediate levels of environmental factors inducing differential responses among modules. The mosaic pattern is in line with the morphology of wingless queens of congeneric species. Our results therefore suggest that intercastes are mosaics that may be at the origin of the evolution of novel castes. Thus, polyphenism and modularity may facilitate morphological innovation by allowing combinatorial evolution at phenotypic scale.
21
Introduction
Darwinian theory and subsequent developments of populational thinking of the modern synthesis, have led to a good understanding of gradual adaptation for quantitative traits, which is seen as a change in the allelic frequency distribution under selection. Nonetheless, the origin of discrete novelty remains poorly understood despite the evidence that many qualitative shifts have occurred during evolution (Moczek 2008). Numerous examples suggest that such novelties evolved by re-using previously existing structures or
developmental pathways. Research on homeotic genes has shown that novel phenotypes can result from the reorganization of existing ones (Lewis 1963; Gehring and Hiromi 1986). Important novelty including animal eyes and tetrapod limbs also evolved through modifications of complex regulatory circuits already present in ancestors (“deep homology”, Shubin et al. 2009). Such examples of evolutionary tinkering (Jacob 1977; Duboule and Wilkins 1998) show that natural selection acts by modifying structures that are already available. West-Eberhard (2003) and Moletet al. (2012) go further by suggesting that evolutionary novelty may also result from the recombination of alternative phenotypes (i.e. phenotypic recombination). Indeed, some new castes in ants, such as wingless queens and soldiers, are mosaics of winged queen and worker morphologies (Molet et al. 2012, 2014). Therefore, Molet et al. (2012) proposed that these new castes may have evolved by phenotypic recombination. This model of combinatorial evolution is based on the association of two widespread characteristics of living organisms: modularity and plasticity.
Modularity is a universal property of organisms resulting from the branching nature of development (Wagner 1995a; West-Eberhard 2003). Modules are units, the parts of which are strongly integrated by numerous genetic, developmental or functional interactions (Breuker et al. 2006), but are weakly connected to other modules (Klingenberg 2008). Because traits that belong to one module experience the same developmental, genetic or functional constraints, they co-evolve semi-independently from traits of others modules (West-Eberhard 2003; Klingenberg 2008). For instance, modularity allowed birds and bats to evolve fore-limbs that dramatically differ from hind-limbs. A consequence of this “discontinuity” is that highly modular subunits, such as arthropod imaginal discs, can develop numerous times along the body plan or be deleted independently of others traits (Lewis 1963; Morata and Garcia-Bellido 1976; Morata and Lawrence 1979). This property
22
allows for the reorganization of different phenotypic building blocks i.e. combinatorial
evolution (West-Eberhard 2003).
Phenotypic plasticity is the ability of a single genotype to produce alternative phenotypes in response to different environmental factors (Debat and David 2001; Whitman and Agrawal 2009). Continuous variation resulting from environmental factors is called a reaction norm while discrete variation is classified as polyphenism (Stearns 1989). Consequences of plasticity on evolvability are controversial. Some authors consider that plasticity buffers the effect of selection and thus impedes evolutionary changes, because it allows individuals to reach the fitness optima without genetics changes (Price et al. 2003; Schlichting 2004). Others suggest that this buffering against selection increases evolvability because it promotes the accumulation of cryptic genetic variation that may later be fixed by genetic accommodation following environmental changes (Waddington 1953; Price et al. 2003; West-Eberhard 2003; Pfennig et al. 2010).
One of the most extreme examples of phenotypic plasticity is polyphenic taxa with discrete alternative phenotypes. Typically, in social insects with queen and worker, caste determination is environmental (Wheeler 1986, 1991). Environmental factors (e.g. food supply) induce caste-determining signals that drive the development toward alternative phenotypes according to some threshold responses. These alternative phenotypes are both encapsulated in the developmental potential of an embryo, and an egg contains the genetic information required to produce all queen and worker modules. This may facilitate combinatorial evolution by increasing the number of distinct modules available for phenotypic recombination.
Ants are a highly diversified clade with various morphological castes (Hölldobler 1990; Wilson 1990; AntWeb 2014). We suspect phenotypic recombination to have played a role in such diversification. Ants are likely prone to evolving by phenotypic recombination because they associate a polyphenism (queen and worker castes) with a high modularity typical of arthropods. The ancestral and most common caste system features winged queens that perform aerial dispersal and reproduction, and wingless workers that are involved in brood care, foraging, defense, cleaning and construction of the nest. Accordingly, queens have a fully functional reproductive system with a spermatheca, a large articulated thorax
23
with flight sclerites and large wing muscles, and three ocelli. In contrast, workers have an
atrophied reproductive system, a reduced fused thorax lacking wings and flight muscles, and generally no ocelli (Wilson 1971). This ancestral caste system is associated with independent colony foundation, where queens disperse by flight and found new colonies alone (e.g. Peeters and Molet 2010). A derived strategy that evolved independently in many genera is dependent colony foundation (i.e. fission or budding) (e.g. Cronin et al. 2013), where queens disperse on foot together with many nestmate workers. This strategy involves important morphological adaptations, including permanently wingless queens called ergatoid queens in many species (Heinze and Tsuji 1995; Heinze and Keller 2000; Peeters and Ito 2001; Peeters and Molet 2010; Cronin et al. 2013). Molet et al. (2012) have shown that ergatoid queens are mosaics of winged queen and worker morphologies and proposed that they may have evolved by phenotypic recombination. However, the question of the early step of this evolution by recombination remains to be explored: what are the variants that can be selected for and what developmental mechanisms allow their production?
Despite the discrete queen/worker dichotomy, some authors have described individuals that are neither queens nor workers and are called intercastes (Plateaux 1970; Peeters 1991b). Intercastes are rare anomalous adults with various morphologies, visually ranging from almost similar to winged queens to almost similar to workers. Although they are generally not winged, they often have simplified flight sclerites and sometimes wing stubs. They may have a spermatheca and one or several ocelli. Thus, intercastes seem to be mosaic phenotypes recombining queen-like and worker-like traits. They have been described in about 20 species (see Peeters, 1991b for references) and they are likely to be taxonomically widespread. Indeed, they are probably usually either unnoticed due to their rarity or discarded by researchers because of their abnormality. Because some intercastes look morphologically similar to ergatoid queens, we suggest that they may represent the early step of the evolution of ergatoid queens. The production of random mosaic variants would thus be the starting point for the evolution by phenotypic recombination, before selection fixes a specific phenotype, leading to the evolution of a new caste. Accordingly, studying intercastes will contribute to our understanding of caste evolution.
The intuitive concept of mosaic has allowed for the description of intercastes based on discrete traits (Plateaux 1970; Peeters 1991b; Düssmann et al. 1996; Okada et al. 2013).
24
Nevertheless, no quantitative measures of mosaicism have been performed, and
consequently phenotypes with limited mosaicism have probably never been described. However, a continuous range of mosaic phenotypes could exist. Therefore, we first propose a new procedure based on morphometric data to quantify mosaicism. We used this procedure to describe the range of recombination among queen and worker modules and to assess mosaicism level of each individual. We test whether individuals initially classified as intercastes based on discrete characters are also mosaics for quantitative morphometric traits. We then explore the developmental processes generating intercastes. Disruptions in the process of caste determination may be caused by two alternative mechanisms: an abnormal level of environmental factors or an alteration of threshold responses to caste-determining signals (Fig. 2.1). In the first case, mosaicism would result from subtle differences in the shape of the reaction norms among modules. Intermediate levels of environmental factors would lead to different levels of queen-likeness among modules according to the shape of their relative reaction norms (Fig. 2.1.a). In the second case, mosaicism would be caused by alterations of the response thresholds involved in the development of some modules but not others. As a consequence, such altered modules would not fit the typical reaction norm found in normal queen and worker castes (Fig. 2.1.b). The first hypothesis has three corollaries: (1) There are significant shape differences among the reaction norms of distinct modules. For intermediate levels of environmental factors, the developmental response is not the same for all modules; (2) For a given level of environmental factors, mosaicism level is related to the differences among reaction norms. In the theoretical case depicted in figure 1.b, we expect a continuous range of mosaics. With increasing level of environmental factor, mosaicism first increases as reaction norms diverge and then decreases as reaction norms converge; (3) Relative shapes among reaction norms highly constraint possible mosaic combinations. Intercastes cannot recombine queen and worker modules randomly. For a given level of environmental factors, they necessarily are worker-like for modules that have a low developmental response and queen-like for modules that have a high developmental response. None of these statements is predicted by the second hypothesis, hence validating one or several of them would yield support to the first hypothesis. Conversely, disproof of at least one of the corollaries would invalidate the first hypothesis. We used geometric morphometrics to quantify mosaicism in Mystrium
25
rogeri, and test these three statements to conclude about the developmental processes generating intercastes.
Material and Methods
Collection
We collected 60 colonies of Mystrium rogeri in a rainforest in Andrambovato, Madagascar, in November 2011 and January 2013. Each colony contained an average of 6.1 (± 4.2) queens, 40.4 (± 20.5) workers and 15 (± 10.4) males. Out of these 60 colonies, 19 colonies (31 %) had 2.4 (± 1.2) intercastes. In total 1.6 % of females were intercastes. Since a morphometric analysis of all individuals was technically not possible, we focused on three colonies where several intercastes were present (16 queens, 19 intercastes and 100 workers from colony #637, #654 and #647). In addition, to increase our sample of intercastes, we also included other intercastes (n=18) found in 10 out of the remaining 57 colonies. To control for colony effect, we added to each intercaste a worker and a queen (when available) from the same colony. Our final sample thus consisted of 29 queens, 37 intercastes and 124 workers (Table 2.1).
Because intercastes fill in a morphological continuum that spreads between winged queens and workers, we set criteria to decide whether to categorize individuals as intercastes instead of workers or queens. Thus, we used discrete characters visible under a stereomicroscope. Winged queens of M. rogeri have three ocelli that are lacking in workers. Consequently, individuals were classified as intercastes if (1) they had one ocellus, two ocelli, or three reduced ocelli or (2) they were wingless but had wing stubs or relatively unfused flight sclerites.
We worked on the shapes of the head capsule, pronotum, mesonotum and propodeum, on the mean length of the two hind leg tibias, and on the width of the gaster. We used geometric morphometrics in order to extract 2D shape information on four modules (head capsule and three thoracic segments) and linear morphometrics on two modules (tibia length and gaster width). These structures are relevant for our investigation because they are rigid, unarticulated, and dimorphic between winged queens and workers (Fig. 2.2).
26
Digitalization
Polyphenism induces large shape differences between castes, so finding numerous homologous anatomical landmarks is not possible. Therefore we used outlines and landmarks methods (Bookstein 1997). Regarding head shape, we defined two sets of semi-landmarks along the edges of the head capsule and clypeus in dorsal view. Regarding thorax shape, we digitalized one set of semi-landmarks along the edges in dorsal view. The thoracic configuration was then split into three partial configurations: pronotum, mesonotum and propodeum (Fig. 2.2c).
We used TPSDig2 software for digitalization (Rohlf 2009). Each structure was photographed and digitalized twice to take into account small deviations caused by optical biases such as lighting variation or position relative to camera lens (Claude 2008). Measurement error was computed using Procrustes ANOVA (Klingenberg et al. 1998).
For each individual, we calculated an average configuration based on the two sessions. We focused our analysis on symmetrical variance. Thus we reflected lateral semi-landmark configurations across the symmetry axes using the “object symmetry” procedure (Klingenberg et al. 2002). The shape component of each configuration was extracted using the Procrustes superimposition method (Smith et al. 1997; see also Auffray et al. 1996).All structures were first rescaled with their own unitary centroid size in order to extract shape information. Rescaled configurations were then superimposed and rotated around their centroid so as to minimize the sum of squared distances between corresponding semi-landmarks (implementation in R with function of Claude, 2008).
Queen-likeness index calculation
To assess mosaicism, we first computed a queen-likeness index quantifying how similar each module was to typical queen or worker module. The 1D legs length and gaster width directly gave the relative position of all individuals on an axis from worker to queen morphologies. The 2D shapes for the other modules required a reduction of dimensionality. For each of these modules, a queen/worker axis was first constructed using queen and worker data, and intercaste data were then projected on it. The queen/worker axis was computed using Between Group Analysis (BGA) (Culhane et al. 2002; see also Dolédec and
27
Chessel, 1987). When a sample can be dissociated into N groups, BGA generates N-1 axes
using an orthogonal transformation that maximizes between group variances. Hence, we projected all individuals on the eigenvector that had been computed from the co-variance matrices of the centroids of queen and worker groups. Individual position values were then shifted and rescaled in order to obtain a homogeneous queen-likeness index for each module, from “0” for the most worker-like morphology to “1” for the most queen-like morphology. Shifting consisted in subtracting the smallest position value from each position and rescaling consisted in dividing all positions by the largest value. Thus each value V was transformed as V’ = (V – Vmin) / Vmax.
Two more common alternative methods to compute the queen/worker axis were rejected. The first axis of a Principal Component Analysis is not suitable because it does not maximize variance between queens and workers. The first component of a Linear or Quadratic Discriminant Analysis maximizes the discrimination between queens and workers, but it also dramatically distorts the intra-group variances by transforming relations among initial variables (Fukunaga 1990). This could have biased the among-groups measure of mosaicism since our mosaicism estimator is the variance among queen-likeness indexes of each module within individuals.
Mosaicism must quantify, in a single individual, the level of morphological recombination of modules normally occurring in distinct individuals (either in a queen or in a worker). For instance, an individual with a queen-like head and a worker-like pronotum would be considered a mosaic. Therefore, we computed mosaicism as the standard error of queen-likeness index values for the six modules, i.e. the dispersion of queen-likeness index values among modules. We compared the average mosaicism in queens, workers, and
intercastes using Kruskal-Wallis tests. In order to test whether mosaicism patterns were not caused by the queen-likeness index calculation method, we re-calculated mosaicism after inter-individual permutation of queen-likeness index for each module. If actual mosaicism patterns were preserved despite permutation, we would conclude that it was caused by the mosaicism computation method. Conversely, a disruption of mosaicism pattern following the permutations would confirm its biological significance. Slope significance for queens, intercastes and workers were tested by bootstrap procedure (1000 samples).
28
Reaction norms / variation norms
Testing our hypotheses requires investigating the shape of the reaction norms of different modules. A reaction norm describes the range of phenotypes that a genotype can produce when exposed to a range of environments (Johansen 1909; Schmalhausen 1949; Gomulkiewicz and Kirkpatrick 1992). It is visualized by plotting the phenotype against an environmental variable. The environmental variable is not directly available in ants because larvae cannot be isolated nor controlled during their development as they heavily depend on adult care. However caste determination is known to be environmental in most species (Wilson 1971; Wheeler 1986, 1991), so we can use the global queen-likeness of individuals as a correlate of environmental factors driving caste determination. Accordingly, we used global queen-likeness (the average queen-likeness index values for the six modules) as the abscissa of reaction norms. Nevertheless, global queen-likeness may also depend on genetic variations among individuals, so the functions that we obtained were not reaction norms strict sensu but rather “variation norms”.
In order to compare the shapes of variation norms, we extracted for each module the abscissa of the inflection point of a fitted logistic function and the slope at this inflection point. We tested differences between these parameters using a student test on distributions generated from a bootstrap procedure (1000 samples).
Allometry
We computed allometric relationships between queen-likeness index values for each module and we log-transformed the centroid sizes extracted from the Procrustes procedure. Allometric coefficients were calculated for each group separately as advocated by Klingenberg (1996). We used standardized major axis regression in order to take into account errors in both queen-likeness index values and size measurements (Fairbairn 1997). Slope significance and slope differences among groups were tested by bootstrap procedure (1000 samples) (Klingenberg 1996).
29
Results
Queen-likeness indexes
Procrustes ANOVA showed that measurement errors accounted for less than 12% of inter-individual variation (11.4% for head shape, 0.4% for pronotum shape, 2.1% for mesonotum shape, 4.5% for propodeum shape, 10.1% for leg length and 2.2% for gaster width), and were therefore negligible.
Queen-likeness was significantly different for queens and workers for each module, with an overlap for head, legs and gaster (Fig. 2.3). Intercastes queen-likeness was different from and intermediate between queens and workers (P < 1.0-6), except for legs that did not differ from queens (Chi2 = 0.09, P = 0.76). The three thoracic modules of intercastes were more similar to workers than to queens and they overlapped with workers (Fig. 2.3). Workers were significantly more variable than queens and intercastes (P < 1.0-6) except for pronotum (queens/workers: K-squared = 0.75, P = 0.39; intercastes/workers: K-squared = 1.95, P = 0.16) and mesonotum (queens/workers: K-squared = 0, P = 0.98).
Queen-likeness indexes were tested for allometric effect on log-transformed centroid sizes of the corresponding modules. For all modules, queen-likeness indexes showed no significant allometric effect for queens but strong and significantly different allometries for workers and intercastes. The differences of allometric relationships among groups prevented a global correction in order to extract size-independent shape information (Klingenberg 1996).
Mosaicism
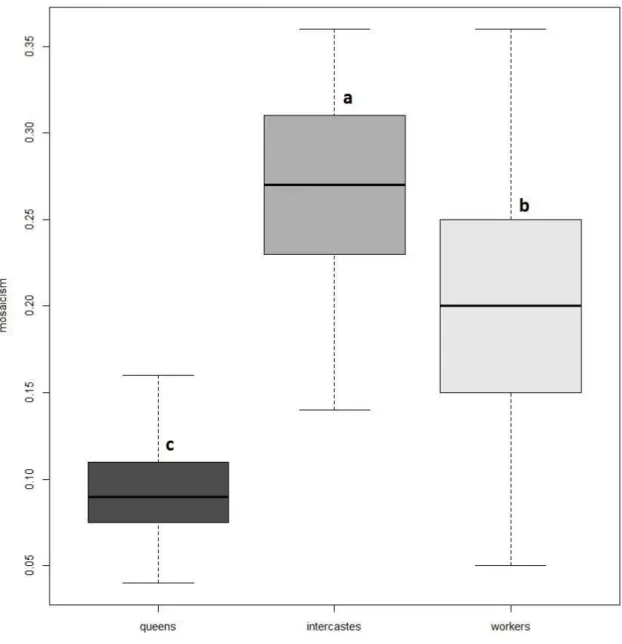
Individual mosaicism was quantified as the standard error of the queen-likeness indexes for the six modules. Mosaicism was higher for intercastes than for queens and workers (intercastes/queens: Chi2 = 34.78, P < 1.0-9; intercastes/workers: Chi2 = 13.96, P = 0.0002), and lower for workers than for queens (Chi2 = 19.66, P < 1.0-6) (Fig. 2.4).
Plotting mosaicism against global queen-likeness of each individual showed that mosaicism is continuous between workers and intercastes (Fig. 2.5). Workers with high global queen-likeness, i.e. more “queen-like”, were more mosaic than workers with low
30
global queen-likeness, and as mosaic as intercastes (P < 1.0-6). Inverse non-significant
tendencies occurred among intercastes (P = 0.08) but not in queens (P = 0.12). Inter-individual permutations of queen-likeness indexes erased the general pattern of mosaicism. This showed that the observed mosaicism patterns reflected a biological tendency and were not a methodological artifact.
Shape of variation norms
The six modules did not follow the same variation norms (Fig. 2.6). The abscissa of the inflection point of the fitted logistic functions was different (P < 1.0-6) for each module pairwise comparison, except for pronotum vs. propodeum (t = -2.58, P = 0.49) and for legs vs. gaster (t = -3.57, P = 1). In addition, the slope at this inflection point was different for each module pairwise comparison (P < 1.0-6).As global likeness increased, queen-likeness of pronotum, mesonotum and propodeum started with a long plateau, and then increased suddenly for global queen-likeness values corresponding to intercastes and queens. In contrast, queen-likeness of legs and gaster increased continuously and quickly for workers until it reached a plateau. The two modules with the most divergent pattern were mesonotum and legs. Their relative reaction norms suggest that intercastes resulting from intermediate levels of environmental factor (hence with an intermediate global queen-likeness) should have a worker-like mesonotum and queen-like legs (Fig. 2.7).
Discussion
Although they were rare (1.6 % of adult females), we managed to obtain a reasonable number of intercastes by collecting 60 colonies of Mystrium rogeri. Our new morphometric procedure to quantify mosaicism showed that intercastes of M. rogeri were more mosaic than workers and queens, and that mosaicism increased continuously from workers to intercastes. We explored the developmental processes generating mosaicism by computing the variation norm (a proxy of reaction norm) of each module. We found that distinct
modules exhibited distinct variation norms. Accordingly, intermediate levels of environmental factors induce intercastes with queen-like legs and gaster and worker-like thorax. All intercastes modules fell within the worker-queen variation norm (Fig. 2.6), supporting the hypothesis that intercastes do not result from the disturbed development of some modules, but rather from differences in the variation norms among modules. We
31
conclude that intercastes are generated by intermediate levels of environmental factors
inducing differential responses among modules.
Based on the shape of their variation norms, thoracic modules, especially the mesonotum, have a tighter window of environmental factors sensitivity (i.e. range of global queen-likeness values for which variation norms have the higher slope) on the queen side than other modules. A worker-like thorax morphology is retained for a wide range of individuals that do not need thoracic structure adapted for flight. This is likely to be adaptive in ants since the production of a queen-like flight thorax is very costly (Oster and Wilson 1978). Selective pressures for a cheap thorax may have mainly acted on the mesonotum, which contains wing muscles. Accordingly, the retention of worker morphology is less noticeable for pronotum and propodeum. Conversely, head, legs and gaster show a large window of sensitivity skewed toward workers. The differences of shape of variation norms induce a hierarchical expression of queen-like and worker-like modules. That is environmental factors producing an individual with a queen-like thorax would also already induce queen-like head, legs and gaster. This is in accordance with Okada et al. (2013), who showed that possible patterns of trait combination are limited.
In literature, the production of large quantities of intermediate phenotypes is usually triggered by manipulating the environment or the physiology of the focal organisms (Windig 1994; Murakami et al. 2002). In the case of M. rogeri, intercastes spontaneously occur in nature and they may be tested by natural selection. Accordingly, we suggest that intercastes have a high evolutionary significance. We found that most mosaics have queen-like head and gaster but worker-like thorax. These phenotypes are congruent with the morphology of ergatoid queens and soldiers, i.e. the two types of novel castes that are suspected to have
evolved by phenotypic recombination (Molet et al. 2012). Indeed, soldiers are individuals recombining a worker thorax (winglessness) with a queen head (defense or seed milling) or a queen gaster (trophic eggs). Similarly, ergatoid queen recombine a worker thorax (winglessness) with queen gaster (reproductive organs). Therefore, ergatoid queens ofM. Oberthueri (Molet et al. 2007a,b), sister species of M. rogeri, could have evolved from intercastes produced in the ancestral species through a process of genetic accommodation (West-Eberhard 2003; Nijhout and Suzuki 2008; Suzuki and Nijhout 2008). Our results thus
32
support the hypothesis that new castes in ants may have evolved from anomalous
queen-worker mosaics.
Intercastes bridge the morphological gap between queens and workers by extending from the distribution of workers and stretching towards queen phenotypes. We found a continuum between workers and intercastes, but a gap between intercastes and queens. This lack of queen-like intercastes could be specific to M. rogeri or to our colonies, which were sampled during a short time window. In contrast, Karimi and Molet (unpublished data) found queen-like intercastes in the closely related species M.mysticum, and so did Plateau (1970) in Temnothorax nylanderi.
Our results contrast with the classical view of a discrete queen/worker caste polyphenism (dimorphism) by revealing a continuous variation norm connecting queens and workers. This is in accordance with studies that show that some polyphenisms actually are reaction norms with statistically underrepresented intermediate morphs in nature (Windig 1994; Nijhout 2003). Discrete variation can either be caused by a discontinuous environment, or by a non-linear developmental response to a continuous environment. The second case involves a sigmoid reaction norm that reduces the environmental window inducing intermediate phenotypes (Nijhout 2003). Our procedure did not enable us to conclude whether nurse workers generate discrete breeding conditions or whether the discrete variation is due to a very small window of sensitivity. Indeed, we do not know if the global queen-likeness that we used to establish variation norms is linearly correlated to environmental factors or not.
Ergatoid queens and soldiers evolved numerous times in ants (Hölldobler 1990; Peeters 1991b; Molet et al. 2012), and they display a tremendous morphological diversity. Yet, a caste of flying sterile workers, as found in bees and wasp, has never been found in ants. Presumably, the lack of strong selective pressures on ant colonies or the poor flight skills of ant queens have prevented the evolution of such costly phenotypes. Nevertheless, we have shown that irrespective of these reasons, the differential reaction norms between modules in ants cannot generate such phenotypes hence they cannot evolve by phenotypic recombination. Developmental processes thus both enhance and restrain the potential of ants to produce new phenotypes and evolve novel castes.
33
Figure 2.1: Alternative hypotheses for the origin of intercaste production. This theoretical case only
shows two morphological modules that can be either queen-like or worker-like depending on the environmental factors experienced by the larvae. Environmental factors include food, temperature, pheromones, and interactions with workers. Queen and worker phenotypes result from extreme levels of environmental factors to the right or the left of the figure. Intercaste production may result from: a) an intermediate level of environmental factors with different shapes of reaction norms among modules; b) an alteration of the threshold response in a particular individual in module 1 but not in module 2.
34
Figure 2.2: Morphological differences between queen (a, black squares in c) and worker (b, empty
circles in c) castes for head capsule, pronotum, mesonotum and propodeum. The graph c shows the outlines and the positions of semi-landmarks after the sliding. Difference of morphology between both castes is amplified by 10 % for head.
35
Figure 2.3: Comparison of queen-likeness indexes for each module between groups (dark grey:
queens; medium gray: intercastes; light grey: workers). Boxes represent median, quartiles and extreme values. Letters indicate differences of distribution within each module. Intercastes queen-likeness was different from and intermediate between queens and workers except for legs that did not differ from queens.
36
Figure 2.4: Comparison of the level of mosaicism distribution between groups (dark grey: queens;
medium gray: intercastes; light grey: workers). Boxes represent median, quartiles and extreme values. Letters indicate differences of distribution of mosaicism among queens, workers and intercastes. Workers are more mosaic than queens, and intercastes are more mosaic than queens and workers.
37
Figure 2.5: Mosaicism as a function of global queen-likeness for each individual (black squares:
queens; grey triangles: intercastes; empty circles: workers). As global queen-likeness increase, mosaicism increase from workers to intercastes. Mosaicism tends to decrease with global queen-likeness for intercastes. They is no quantitative difference between the more queen-like workers and intercastes. Inter-individual permutations of queen-likeness indexes erased the general pattern of mosaicism indicating that it is not a methodological artifact.
38
Figure 2.6: Variation norms for the six modules. Black squares: queens; grey triangles: intercastes;
empty circles: workers. Dashed lines: isomorphic line for which queen-likeness of the focal module (ordinate) is similar to global queen-likeness. Two types of modules could thus be identified. The queen-likeness of the three thoracic modules was lower than the global queen-likeness; and the queen-likeness of non-thoracic modules (head, legs and gaster) was higher than global queen-likeness.
39
Figure 2.7: Variation norms for mesonotum (gray circles and dashed line) and legs (black circles and
solid line). Relative patterns for these two modules suggest that intercastes resulting from intermediate levels of environmental factors (having a intermediate global queen-likeness) should present a low queen-likeness for mesonotum and a high queen-likeness for legs. Conversely it is not possible to produce individual with a high queen-likeness for thorax without a high queen-likeness for legs.
40
Tables
Table 2.1: Number of queens, intercastes and workers from each colony in our sampling
colony queens intercastes workers
#637 1 9 21 #654 13 5 47 #652 1 2 2 #635 5 7 9 #551 0 1 1 #649 4 1 4 #574 0 3 3 #553 1 1 1 #558 0 1 1 #543 1 0* 1 #XXX 0 1 1 #647 2 5 32 #557 1 1 1 total 29 37 124
Note: * Initially there was an intercaste in the colony #543 but it has been damaged during handling and was unusable.
Acknowledgments
This work was funded by a grant from Agence Nationale de la Recherche to MM and TM (project AntEvo ANR-12-JSV7-0003-01).
41
III- VARIABILITE
COMPORTEMENTALE DES
INTERCASTES
Environmentally induced anomalous
phenotypes promoting evolvability in ants
Cette partie correspond à un article en préparation, coécrit par les auteurs suivants : Sylvain Londe1, Thibaud Monnin1, Brian L. Fisher2 and Mathieu Molet1
1 Sorbonne Universités, UPMC Univ Paris 06, UMR CNRS 7618 Institute of Ecology and Environmental Sciences of Paris, Paris, France
2 Department of Entomology, California Academy of Sciences, Golden Gate Park, 55 Music Concourse Drive, San Francisco, California 94118, USA