HAL Id: tel-01246344
https://tel.archives-ouvertes.fr/tel-01246344v2
Submitted on 19 Jul 2017
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of
sci-entific research documents, whether they are
pub-lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destinée au dépôt et à la diffusion de documents
scientifiques de niveau recherche, publiés ou non,
émanant des établissements d’enseignement et de
recherche français ou étrangers, des laboratoires
publics ou privés.
Métabolisme et effets hépatoprotecteurs des derives de
l’Anisyldithiolthione
Amor Sassi
To cite this version:
Amor Sassi. Métabolisme et effets hépatoprotecteurs des derives de l’Anisyldithiolthione. Chimie
thérapeutique. Université Paris Sud, 1986. Français. �tel-01246344v2�
M´
etabolisme et effets h´
epatoprotecteurs des derives de
l’Anisyldithiolthione
Amor Sassi
To cite this version:
Amor Sassi.
M´
etabolisme et effets h´
epatoprotecteurs des derives de l’Anisyldithiolthione.
Chimie th´
erapeutique. PARIS XI, 1986. Fran¸cais. <tel-01246344>
HAL Id: tel-01246344
https://tel.archives-ouvertes.fr/tel-01246344
Submitted on 18 Dec 2015
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of
sci-entific research documents, whether they are
pub-lished or not.
The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destin´
ee au d´
epˆ
ot et `
a la diffusion de documents
scientifiques de niveau recherche, publi´
es ou non,
´
emanant des ´
etablissements d’enseignement et de
recherche fran¸
cais ou ´
etrangers, des laboratoires
publics ou priv´
es.
1
l
\
t<. \ ) \ l.
\
UNIVERSITE PARIS-SUDUNITE D'ENSEIGNEMENT ET DE RECHERCHE DES SCIENCES PHARMACEUTIQUES ET BIOLOGIQUES
Année : 1985 - 1986 Série DOCTORAT no 18
T H E S E présentée
A L'UNITE D'ENSEIGNEMENT ET DE RECHERCHE DES SCIENCES PHARMACEUTIQUES ET BIOLOGIQUES
DE L'UNIVERSITE PARIS-SUD Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITE DE PARIS-SUD MENTION : SCIENCES PHARMACEUTIQUES
par
Monsieur Amor S A S S 1
Titre de la thèse METABOLISME ET ORIGINE DES EFFETS HEPATOPROTECTEURS
DES DERIVES DE L' ANISYLDITHIOL THIONE.
Soutenue le 17 avril 1986
Jury :
M.
Jean AG NERA Y PrésidentM.
Jacques HAKIMM. Michel PLAT
Mme Marie-Odile CHRISTEN
\
THESE DE DOCTORAT DE L'UNIVERSITE PARIS XI MENTION
Sciences pharmaceutiques et biologiques RESUME DE LA THESE
Présentée par monsieur Amor SASSI
Sujet: Métabolisme et origine des effets hépatoprote c teurs des dérivés de l'anisyldithiolthione.
L'anisyldithiolthione (SULFARLEM, ADT) est utilisé comme cholérétique depuis 1947. Cette molécule n' es t pas toxique chez l'homme . De plus, récemment, des propri étés hépatoprotectrices lui ont é té attribuées en se
'-basant sur le fa it que 1 'ADT protége les souris contre la morta li té .,-provoquée par l e paracétamol ou l e tétra chlo rure de carbone (hépatotoxiques)
publiés , LTH).
(O . Foussard . Blanpin et M. O. Christen, résultats non
En 1983, Bueding a constaté que l es taux des transamin~es sanguin~ chez des souris prétraitées par 500 mg/kg d'ADT puis into~ées par le
paracétamol ou l e tétrachlorure de carbone res tent normaux. Ces taux augmentent chez des souris traité es uniquement par le t é trachlorure de carbone ou par l e paracétamol. Ces résultats suggêrent que l'ADT pr év i en t la cytolyse hépatique et confirment qu 'i l posséde des prop r iét és hépa t oprotect r ices mais ne permettent pas d ' expliquer les mécanismes par lesquels il agit. De plus, ces ef f e ts ont été constatés à des doses d'ADT
'
/trés supérieures aux doses utili sées chez l'homme .
Nous nous sommes intéressés à 1 'étude de 1 'origine des effets hépatoprotecteurs de l'ADT.
Le tétrachlorure de carbone et le paracétamol exercent leur toxicité hépatique en induisant une peroxydation des lipides qui produit des radicaux libres toxiques. D'où l'idée d'étudier l'effet de l'ADT s ur la peroxydation des lipides induite in vitro et in vivo .
Dans les expériences in vitro , des microsomes hépatiques de rats traités par le phénobarbital ont été utili sés . La peroxydation des lipides microsomaux a été induite par une production de radicaux libres soit c himiquement , par l e sulfate ferreux qui r é duit en
o•
2 soit e nzymatiquement par la r éduction du cc14 en ~c13
en présence descytochromes P-450 et de NADPH.
Nous avons montré que l'ADT est un bon inhibiteur de la peroxydation d es lipides induite par le CC14 • Il exerce sur la peroxydation des lipides induite chimiquement un effet inhibiteur similaire. Dans ce systême cette
'-inhibibition ne pe ut s'expliquer que par un piégeage des radicaux libres ,..-(effet antioxydant). L'inhibition de la peroxydation des lipides n ' est donc pas simplement due à un blocage du métaboli s me du
cc1
4 encc1
3 •Dans le système chi mique les produits testés vis à vis de la peroxydation de lipides ne sont pas métabolisés. Nous pouvons donc estimer l ' activité spécifique du produit étudié. Ainsi, nous avons pu montrer, aprés une étude comparative de l ' ADT et de certains de ses dérivés, que la structure dithiolthione est indi spensable aux effets anti oxydants de l ' ADT.
Pour é tudier 1 'effet de 1 'ADT sur la pe roxyda ti on des lipides in vivo, nous avons mis au point un t e st pe r me ttant d ' estimer la peroxydation des lipides chez 1 'animal vivant. Les lipides pe roxydé s se fragmentent en
produi sant des hydrocarbures volatils, notamment de
l'~hane
qui peut étre~
dosé pa r chromatog raphie phase gazeuse dans l ' air expiré par l ' animal.Nous avons ut i lisé l e pa racétamo l e t le
cc1
4 pour i nduire une pé roxydati on de s 1 i pides hé pa tiques ch ez la sou r i s et l e rat, et l e paraqua t et la bléomyc i ne pour indui r e une peroxyda tion des lipides pulmonaires.Nous avons obt e nu les p r emi e r s r ésul tats montran t que l'ADT est un inhi b i te ur de la peroxydati on des lipid es i nduite in ~ivo . De plus,
1 ' original ité de nos r é s u l t a t s est d'avoir montré que cet effet est exercé
à de s doses pr oches de ce lle s ut i li sées en thé r apeutique humaine. En effet
à des dos e s de l' ordre de mg/kg , l' ADT inhibite complé tement la perox ydation des l ipide s indui te chez l a s ouris par 500 mg /kg de paracé t amol . Ce t t e i nhibi ti on s ! accompa gne d'une pro t ection import ante contre la mortalité (70% à 5 mg/kg) ou tota le à des doses supérieures ou égales à 25mg/kg. Il est ainsi, l e mei l leur protecteur connu à ce jour vis à vis de l'hépatotoxicité du paracétamol.
L' ADT est aussi un inhibiteur efficace de la peroxydation des lipides hépatiques induite par le
cc1
4 • Il inhibe moins efficacement celle des lipides pulmonaires induite par le paraquat ou par la bléomycine. Il est donc surtout un hépatoprotecteur. Néanmoins, l e fait que l'ADT inh ibe l aperoxydation des lipides i nduite par la bléomycine prouve bien qu ' i l
pi~e ~
les radicaux libres formés in vivo . En effet, il est connu que la toxicitéde la bléomycine est due à sa capacit é de catalyser la production
d ' O~
et non pas à une activation métabolique.L'étude des effets de quelques analogues structuraux de l'ADT et de certains de ses dérivés sur la peroxyda ti on des lipides a montré que la structure dithiolthione joue u n rôle important dans les effets antioxydants de l'ADT in vivo.
La rlerni8re partie rle notre travail §tai t l'§tude du mêtabolisme et de la pharmacocinêtique de l ' AOT.
Nous avons ~enti fif l es mêtabolit es formés apr§s incubation de 1 ' ADT
radioactif en pr§sence de microsomes hépatiques de rats et nous les avons synthétisés chimiquement .
Les métabolites élimin§s dans les urines de rats traités par l' ADT
radioactif ont été aussi isolés et id en tifiés.
Nous avons, enfin, mis au point des conditions de chromatographie liquide haute performance qui nous ont permis de dose r en UV les métabolites de l'ADT dans le sang et les urines humaines .
La comparaison du métabolisme de l'ADT chez l'homme, la souris et le rat a montré qu ' il subit chez ces trois espéces deux r éactions importantes, une 0-déméthylation et une désulfuration oxydative .
P L A N
I - INTRODUCTION GENERALE ... ... .... ... ... . . . ... . ... . . . p.
I-l SULFARLEM : Structure chimique e t indications
thé rapeuti ques ... ... . .. . · ... p .
I-2 Les systèmes enzymatiques du métabolisme des
xénobioti-ques ... . ... .. ... .. .. .. . . ... .. .... ... ... p.
l-2-l La phase let l a phase II . . . ... .. . .. ... p.
I - 2-l-l Les enzymes de l a phase l. ... . ... p.
I-2-l-2 Les enzymes de la phase II. .. .. ... p .
I-2-l - 2-l La glucuroconjugaison . . .... . ... p .
I - 2-1-2-2 La sulfoconjugaison ... p.
I-2- 1-2-3 Formation d ' acides mercaptu~
r1ques . .. ... . . . ... .. ... ... .. .. . ... p.
I-2-1-3 Localisation subcellulaire et tissulaire du cytochrome P- 450 ... ... ... p.
l - 2- 1-4 Multiplicité et inductibilité du
cyto-chrome P- 450 ..•• .. . . ... . .. . .. ... ... . ... . .. p.
l-2-1-5 Constitution d'une monooxygénase à cyto-chrome P-450 . ... .. .. ... ... . . ... . ... p.
)
I-2-l-5-l Le cytochrome F- 450 .. .. ... . . p.
I-2-l -5-2 La NADPH cy t ochrome P- 450
réductase ... .... .... .. . ... .. . . .. p.
I-2-l -5-3 Les lipides .. .. ... . ... ... p.
I -2-l-6 Cycle cata lytique du cyt . P- 450 .. ... . . p .
I-3 Toxicités dues à des agr ession s oxydantes : Implica-tion des dérivés de r éduc Implica-tion de l ' oxygène et rÔle
de la peroxydation des lipides ... . .. ... . . ... . . .... . .. p .
I-3-l Introducti on ... .. ... . . ... .. . . . ... p .
l-3-2 Les dérivés de réduction de l'oxygène . ... . . ... p.
I-3-3 Product i on des dérivés de réduction de l ' oxygène par une cellule aérobie à l ' état physiologique
normal .. ... . . . .. . ... ... .. . P.
I-3-3-l Enzymes produ isant H2o2 e t o; .. .. . .. .. . p. I - 3- 3- l-l Product i on d ' o; et H2o2 par la xanthine oxydase . . .. . . . .. .... ... . . p.
I - 3- 3-l-2 Production d ' o; et H2o2 par la NADPH cyt.P- 450 réductase .. . ... .... . ... p.
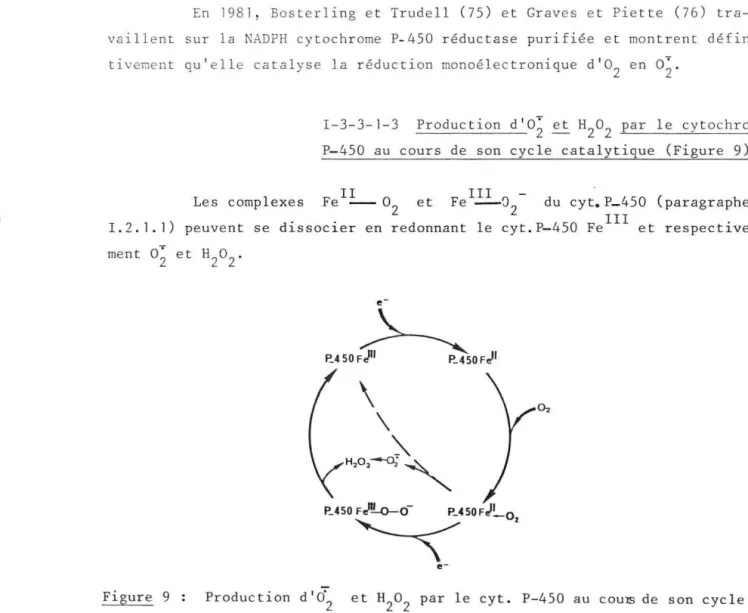
I - 3- 3-l-3 Production d ' o; et H2o2 par l es cytochromes P- 450 .... . . ... . . .. p.
I-3- 3-2 Production d ' o; et H2o2 par
)
I-3-3-2-1 Formation d ' a; et H2a 2au p. cours de l ' autoxydation de l ' hémoglo-bine et l ' oxyhémoglohémoglo-bine... .. .... .. ... p.
I-3-3-2-2 Formation d'a; et H2a 2 dans les mitochondries par autoxydation de certains constituants de la chaine res-piratoire ... ... . . ... p.
I-3-4 RÔle des dérivés de réduc tion de l'oxygène dans la peroxydation des lipides... p.
I-3-4-1 Introduction ... ... . .. ... p .
I-3-4-2 Mécanismes du déclenchement d e la pe-r oxydat i on des lipides ... ... p.
1-3-4-2-1 La phase d ' initiation . ... . .. p .
I-3-4-2-2 La phase de propagation .... . p.
I-3-4-2- 3 La phase de terminaison . .... p .
I-3- 4 - 3 Produits formés lors de la
peroxyda-tien des lipides. ... ... .. .... . ... . p.
I-3-4-4 Techniques de mesure de la peroxydation des lipides... . . . . .. . . ... . .. . . .. p .
I-3-4-4- 1 Dosage du malondialdéhyde ... p.
I-3-4-4-2 Dosage des lipofuschines .... p.
I-3- 4-4-3 Dosage de l ' éthane et du
I-3-5 Les sys t ème s b iol ogiques de défense contre les dér ivés de r édu ct i on de l' oxygène .... .. . . .. .. . p.
I-3-5-1 Le s supe roxydes dismutases (SOD) .. . .. p .
I-3-5- 2 La ca ta lase e t la glutathion pe roxydase p .
I-3-5-3 Les caroténoides . . ... .. . . .. p.
I - 3-5-4 Les antioxyd ants ... . ... . ... . . .... p .
I- 3- 5-4-1 La vit amine E. . . .. . . ... . .... p .
I-3-5-4-2 Le GSH e t l ' a cide as corbique p.
I-3- 5- 5 Au tres s,·s t èmes de dé f e nse .. . .. ... p.
I- 3- 6 Rappo r t ent r e l a pr oduc tion e t la r éduc tion de s
dérivé s oxygénés r é ac tifs à l ' é tat physiolog ique normal ... . . .. .. . .... . .
0 . . • .. . .••• 0 •.• •• 0...
p .I-3-7 Les causes de surproduction des dérivés de r
é-duct i on de l ' oxygène e t l e déc lenchement de la pér oxyda tion des lipide s . ... . ... . .... . . p.
I- 3- 7- 1 Composés exogènes agissant par s
urpro-d • 1 T
uc t1on d 02 ... . .... . ... . ... . p.
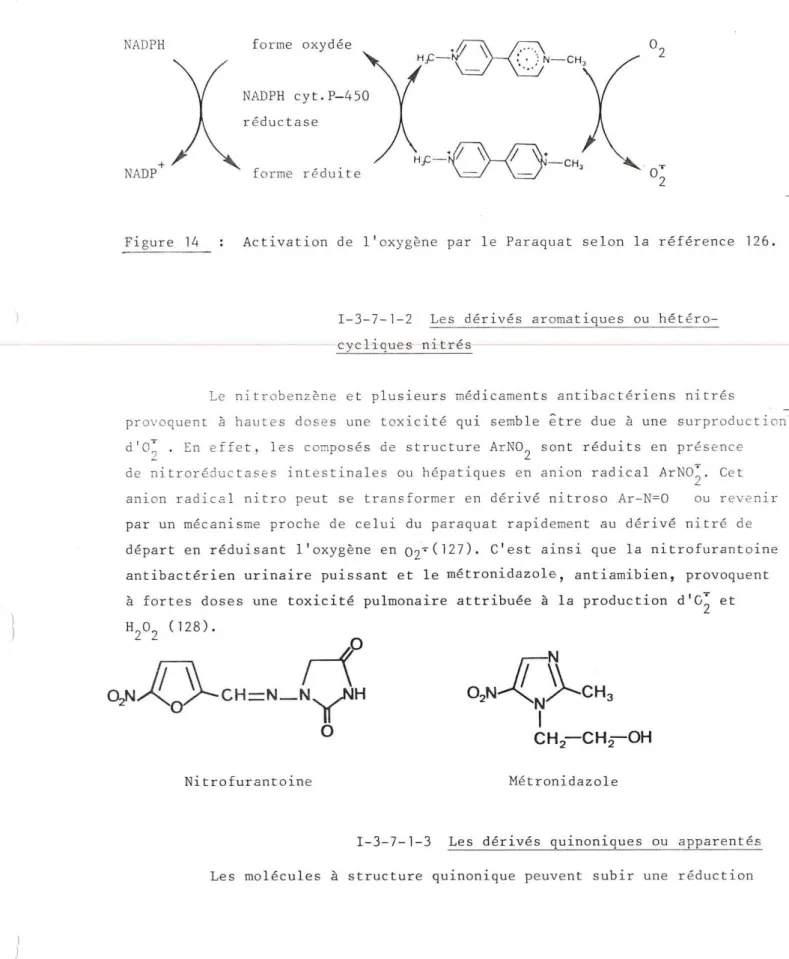
I-3- 7- 1-1 Les se l s de bipyridiniurr.:
Paraquat, diquat . ... ... ... ... .... . . p .
I-3-7-1-2 Les dérivés a r omatiques ou
hétérocyc l iques ni trés : nitrof urantoine, mé tronidazol e . ... .. ... . ... . . p .
I-3-7-1-3 Les dé rivés quinon iques : Adria-mycine, Ménadione ... ... ... .... .. .... p .
I-3-7-2 Composés exogènes qu1 agissent par
produc-tion de radicaux R• réactifs :
cc1
4 .... .. . p.I-3-7-3 Cas particulier du paracétamol ... . .. . p.
I-3-8 Conséquences biochimiques de la peroxyda tion des
lipides. . . . .... . . . .. .. . .. .. ... . .. .. .. .. . p .
I-4 Buts et plan du travail . . . . . . . . p.
I-4- 1 Résumé des situations qui augmentent la production des dérivés de réduc tion de l ' oxygène ... ... . .. p .
I-4-2 Buts . . . ... .. . .. .. . .... .. .. .. .. .. .. ... ... ... p .
I-4-3 Pl an du travail .. . . . ... . .. ... ... .. ... . . . .... .. .. . p .
1 -Métabolisme 1n vitro et 1n v1vo de l' ADT . . ... p .
2- Comport ement de l'ADT vis-à-vis de l a
peroxy-dation des lipides .. . . ... . ... .... . ... p .
2-1 1n vitro ... . .. .. ... p. 2-2 ln V l VO •• , ••••• ••• •• •• •• , • • , •• • • • • · ••• ••• ••• p.
3 - Détermination des mécanismes b i ochimiques et chimiques de l'inhibition de l a péroxydation
I I- METABOLISME ET PHA~~COCINETIQUE DE L ' ADT.. .. .. .... . ... . . p.
Il- l Etude du métabolisme du 14
c
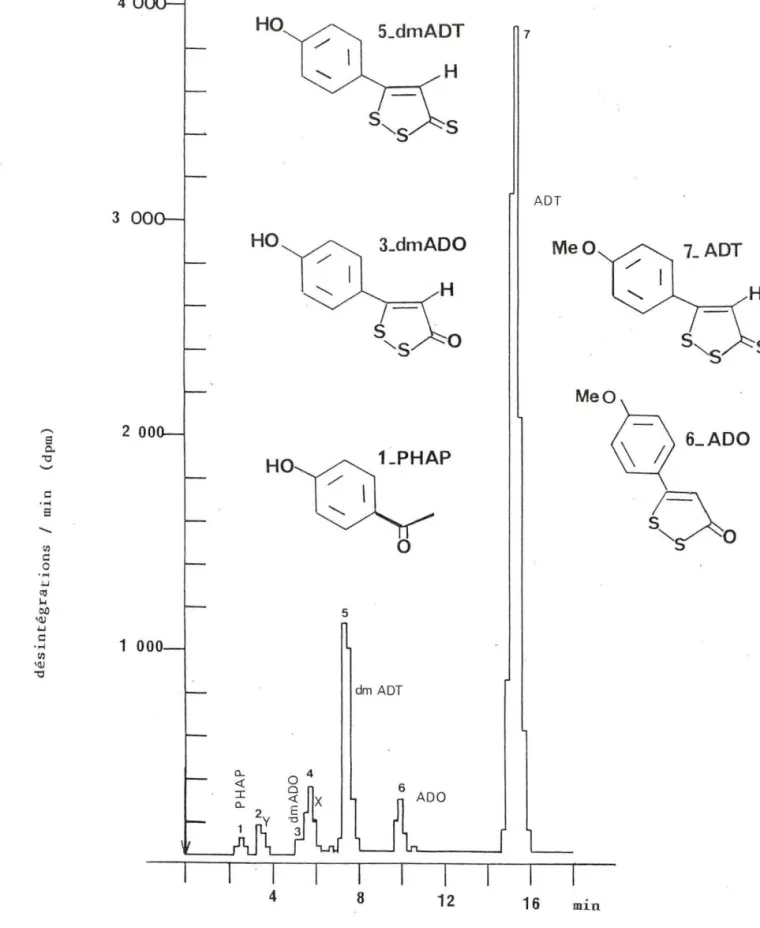
5- ADT 1n v itro.. .... . . ... . . p. II-1- 1 Méthode employée .. . ... .. ... . ... ... . . ... . p.II - 1- 2 Profil CLHP des métaboli tes du 14
c
5- ADT .. ... . . p.ll-1-3 Déterminat ion de la st ru ~ture des métabolites d ' ADT . . ... . . . ... . .. . . ... p .
II-1-4 Etude compara tive des proportion s de chaque
métabolite dans le milieu réactionnel en fonction du temps d ' incubation. .. . . p .
II-1-5 Discu ssion des r ésultats du métabo lisme de
l'ADT in v itro .... .... . ... . ... . . ... p .
II-2 Etude de l'élimination ur1na1r e du 14
c
5-ADT chez le rat p . ll-2-1ll-2- 2
Méthode employée ... • .... .. ... .. ... .. ....
Profil CLHP des métabolites ur1na1res du 14
c
5 - ADT p.ll-2-3 Déterminat ion de la nature des métabolite s ur 1-naires de l'ADT ... ... .. ... .. p .
l l - 2- 4 Bilan de l'élimination ur1na1re e t biliaire ... p .
ll- 2-5 Etude de l'influence de l ' administration r épétée de l'ADT chez l e rat sur son propre mé tabolisme p .
ll- 2-6 Discussion. .. .. . .. . . .. ... . . ... ... . .. . ... . . p . p.
II-2-6-1 Discus s ion des principales transfor-mations métaboliques que l ' ADT subit avant
son é limina tion dans les urine s de rats ... p .
II-2-6-2 Comparaison du métabolisme de l'
Olti-praz e tdel ' ADT . .. . ... . . . .. ... ... p .
II-2-6-3 Discus s ion de l ' effet de l ' adminis-tration r é pétée de l' ADT aux rats sur son
propre métabolisme ... . .... .. ... ... .. . p .
II- 2-6-4 Discussion des différences e ntre le
mét aboli sme in vitro et in v ivo de l'ADT... p.
II-3 Etude de l' él imination urinaire de l ' ADT et de ses métaboli t es chez l ' homme et l a souri s e n ut i lisant de
l' ADT non radioactif ... .... ... p.
II-3-1 Analyse qualitative en CLHP des métabolite s
urina ires de l ' ADT chez l' homme ... .... .. .. p .
II-3-2 Caractérisation de la structure chimique des métabolites de l ' ADT éliminés dans l es urines
humaine s. .. . . ... ... . .... . . ... . . .. ... . . ... p .
II-3-3 Dosage UV des métabolites de l ' ADT dans l es
ur~nes humaines.. . . ... .. . ... p .
II-3-4 Etude des métabolites d'ADT él iminés dans les
u r ines de sour~ s . .. .. ... .... .. ... ... p .
II-3-5 Discussion de l' élimination ur~na~re de l'ADT
\
ll-4 Etude succincte de la pharmacociné tique de l' ADT chez l'homme , l a souri s et l e rat... ... p.
II-4-1 Etude effec tu ée chez l e rat... p .
II-4-1 -1 Nature des d érivés de l' ADT présent s dans l e sang de rat... .. ... .. . .. ... p.
II-4-1-2 Evolution e n fonction du temps de la concentration des métabol ites d'ADT d a n s l e
sang de rats .... . ... . ... .... ... ... p.
II- 4 - 2 E tude e ff ec tué e chez la sour1s . .. . ... ... . p .
II-4-2-1 Nature des dérivés de l ' ADT présents dans l e sang de souris. ... . ... p.
II-4-2-2 Evolution en f onct i o n du temps de la concentration des métabol ites de l' ADT dans
le sang de sour i s. ... . ... . . p.
II-4-3 Etude e ff ectuée chez l'homme. .... ... . . p.
II-4-3-1 Nature des dérivés de l'ADT présents dans le sang humain... p.
II-4-3-2 Evolution en fon c tion du temps de l a concentration des métabolites de l'ADT dans
l e sang humain... . ... .... .... p .
I I-4- 4 Di scu ssion des résultats de l ' étude pharmaco-c inétique pharmaco-chez l'homme , la souri s et le rat p.
\
III- EFFETS DE L ' ADT ET DE SES DERIVES SUR LA PEROXYDATION DES LIPIDES IN VITRO ET IN VIVO : ORIGINE DE SES EFFETS
HEPATO-PROTECTEURS . . . p .
lil- l Etat du probl ème au début de l' étude . . . ... .... ... p .
III-2 Choix des modèles ex pé rime nta~x ... . .... ... . .. . ... p.
III-2-l ln vitro .... .. . . . ... . .. .. . .. ... . ... p . a - Induction de la peroxydation des lipides
microsomaux hépatiques par un système ch imi -que cons titué de sulfate ferreux e t d ' un
réducteur . . . p.
b - Induction de la peroxydation des lipides microsonaux hépatiques pa r un système enzy-matique ut ilisant la réduction de CC 14 par les cyt P-450 comme moyen de production de
radicaux. .. . . .. . . .. . . . .... .. .. .... ... ... p .
III-2- l- l Avantages e t inconvénients du sys tème
CC14 + NADPH + microsomes ... . . . ... ... ...•.. p .
III-2- l-2 Avantages e t inconvénients des sys t
è-mes chimiques ... . ... . .. . ... . . ... . ... .. . . p.
III-2-2 I n v~vo . ... .. ... . ... . .... p.
III-2-2- l Toxic ité induite par l e t étrachlorure
de carbone . . . ... ... ... ... . ... . p.
111-2- 2-3 Tox i c ité indui t e par l e pa r aquat p .
111-2-2-4 Toxic i té induite par la bléomyc in e p.
111-3 Etude des effets de l ' ADT sur l a pe roxydation des
lip i des induite in vitro .. . ... . . .. ... . ... p .
111-3- 1 Effet de l ' ADT s ur l a production de malon-dial déhyde (MDA) due à une peroxydation des lipides indui t e par la réduction e nzyarn t i que de CC14 dans de s rnicrosome s hépatiques de rats ... . .. .. . . ... . . .. p.
lll-3-1 -1 Ciné tique de formation de ma l on-dialdéhyde par ce système.. ... . ... p.
111- 3-1- 2 Dé termination de l a relation entre la dose d ' ADT et l'inhibition de la production de HDA.... .. .... .. .. . .... . ... ... ... . ... .. . p .
III- 3- 2 Inhibition par l 'ADT de la production de HDA au cours de la pe roxydat ion des lipides i ndui te chimi-quement par Feso
4
et un r éducteur dans des mi crosomes hépatiques de r ats ... ... .. ... . .... .. .... . ... . .. p.III -3-2- 1 Cinétique de formation de MDA
par ces systèmes .... . ... . ... . .. . .... p.
111-3-2-2 Dé terminat ion de la relation e ntre la dose d ' ADT e t l' inhi bition de l a produc tion de HDA. . . ... . .. . ... .... .... . ... . p.
III-3- 3 Comparaison de la capacité de l'ADT d'inhiber l a pe roxydation des l ipides à ce lle d'antioxydants
)
III-3- 3-l Rés ult a t s ob t e nu s av ec l e
sys t ème e n zyma t ique ... .. .... .. .... p .
II I- 3-3-2 Résu lta t s ob te nus a v e c l es
systèmes chimiques . . .... . .. .. . . . ... .. p.
I I I - J- 4 Comparaison de l a capac ité d e l'ADT d '
in-h i be r la pe r oxyda tion des lipide s à c e ll~d e c e
r-t a ins d e ses dériv és e r-t d e l'Oir-tipraz p .
III- 3-4-l Compara i son par rappo rt aux
dérivés de l' ADT .... . .. .... .. . . ... p.
III-3-4-2 Comparaison des pouvo1rs
inhi-b it e urs de la perox yda tio n des lipi des de l ' ADT et d e 1 ' oltipraz .. .. ... p .
III-3-5 Effet de l ' ADT sur la production de c2H6
in vi t ro par des microsomes hépatiques de rats i n-c ubés e n p r ésenn-ce de NADPH et d e cc14 . . .... ... .... p.
III-3-5-l Cinétique de formation de c2H6 p.
I II-3-5- 2 Dé t e rmination d e la r e lation
e ntr e la concentr a tion d e l'inhibite ur e t l' ef fet sur la produc tion d'éthan e .. .. . . p.
III-3-6 Disc ussion des résultats concernant les
effe t s d e l ' ADT et de s es dérivé s sur l a pe r oxyda-tian d e s lipide s in vitro .... .. .... ... p.
III-4 Effets de l ' ADT e t d e ses dérivés sur la pe r o xyd a tion
de s lipides induite , in vivo, par l e tét r a c hlorure d e carbone chez l e rat. . ... .. ... . ... .. ... . . . . p .
\
1
III-4-1 Cinétique de production d'éthane par l e
rat intoxiqué par le cc14 comparativement à celle
d 'un rat témoin. . . p .
III-4-2 Effe t de l'ADT sur la péroxyda ti on des
lipides induite par le cc14 chez le rat... p.
III-4-3 Déte rQination de l a relation entre la dose
d ' ADT e t l ' e ffe t inhbiteur de la pe roxydation des
lipides.. ... ... . .... ... ... ... . . .. ... p.
III-4- 4 Compara i son des capac ités de l' ADT d'inhiber
la péroxydation des lipides induite chez le rat par
l e CC11 à celles de certains de ses dérivés ... p. '+
II I-5 Effe t s de l ' ADT sur la mortalit é e t la p ~ r oxy dation
des lipi des provoquées chez la souris pa r injection 1 . p . d'une dose t ox i que de paracé t amol ... . ... p .
III-5-1 Cinét ique de production d'éthane par l a
souris intoxiquée par le paracétamo l comparativement à celle d'une souris t émoin... . . .. . ... . . .. p.
III-5-2 Effets de l'ADT inj ec té i.p. à la sour1s
trois heures avant le paracétamol s ur l' hépatotoxic i té et la péroxyda tion des lipides.... . ... .. p.
III-5- 2- 1 Etude de l'inhibitoin de
l'expi-r ation d'éthane en fonction de la dose d'ADT p.
III-5- 2-2 Corrélation entre l es doses d ' ADT
administrées aux souris, l'inhibition de la peroxydation des lipides et la protection vis-à-vis de la mortal ité induite par le para-cétamol. ... .. ... ... ... .... .. ... .... p .
l
III-5-3 Comparaison des effets hépatoprotecteurs et inhibiteurs de la peroxydation des lipides de l'ADT
à ceux d'hépatoprotec teurs connu s ... p.
III-5-4 Comparaison des effets hépatoprotecteurs et inhibiteurs de la peroxydation des lipides, de l'ADT
à ceux de ses dérivés et de l ' oltipraz... p.
III-5-5 Effets de l' ADT, administré per os à des souris trois heures avant le paracétamo l, sur l'hépa t o-toxicité et la péroxydation des lipides ... p.
JII- 5-6 Effets de l'ADT vis-à-vis de la mortal it é et de la péroxydation des lipides induites par l e paracétamol chez la souri s en fonction du temps d'ad-ministration i . p . de l ' ADT par r appor t au pa racétamol p.
III-5-6-1 Effets de la coadministration
des deux produits.. .. . ... . . ... ... .. p.
III-5-6-2 Effets d ' une administration de
l'ADT postérieure à cel l e du paracétamol.. . p.
III-5-6-3 Effets d'une administration pro-longée de l ' ADT mais longtemps avant le para-cétamol... ... . . ... . . ... p.
III-6 Effet de l ' ADT sur la peroxydation des lipides induite chez la sour i s par le paraquat ... . ..•. ... ... p.
III-6-1 Cinétique de production d ' éthane par de s sou-ris intoxiquées ou non par l e paraquat ... p.
III-6- 2 Inhi bit ion pa r l ' ADT de l a pe roxyda t ion des lipides i nduit e che z l a sour i s par i nj e c t ion de par aqua t s eul e t de pa r aqua t + FeS04 . ..•. p.
III- 6-3 Di scussion par rapport aux r é s ultat s obtenu s ave c l e pa rac é t amo l. . ... . . .. . . ... . ... . . p .
III-7 Ef fe t de l ' ADT sur l a peroxydation de s l ip ide s indu i te chez l a souris par la bl éomycine ... . ... . ... p.
IV - CONCLl'SION GPŒRALE.... . ... . .. . ... . ... . ... .. ... p .
IV- 1 Or ig ine des e ffe t s hé pa t oprotec t eur s de l ' ADT . ... .... . . . p .
IV- 2 Optimi sation de l' ef fet pr o t e cte ur de l ' ADT .. .... .. ... p .
IV- 3 Fac t eurs st ruc t ur aux r es ponsab l e s de l' hé pa toprot ec t i on p .
I V- 4 Sélect i vité de l ' ADT vis- à- v i s de s o r ganes . . . .. ... .. . . . p .
IV-5 Spéculations e t per s pe ctive s.. . . .. .. .. . ... .... . . .. . p.
V - PARTIE EXPERIMENTALE.. ... . p .
V- 1 Préparation des microsomes hépatiques de rats traités par l e phénobarbital... .. ... .... . ... ... .. . . .... p.
V-2 Mé taboli sme de l'ADT 1n v itro .... .. . . . .. . .. . ... .. . .. . .... p.
V-2-1 Cond itions opéra t oires . . . .. ... .. .. . ... . . p.
V- 2- 2 Cond itions d ' ana l yse des mé t abolite s e n CLHP . .... . p.
)
V-2-4 Isolement des métabol ites de l'ADT et détermina-tion de l eur structure par spectrométrie de masse
. . bl Tl
UV-v1s1 e et RMN H... p.
V-2-5 Synthèse des métabolites de l'ADT... p.
V-2-5- 1 Synthèse du paraméthoxyphényl-
5-dithia-1,2-cyclopentène-3-one (Anéthole dithiolone, ADO) p.
V- 2- 5-2 Synthèse du parahydroxyphényl-5-d ithio-1,2-cyclopentène-3-thione (dmADT) et du parahydroxy-phenyl-5-dithia-1,2-cyclopentène-3-one (dmADO) p .
V- 3 Etude de la pharmacocinétique et de l 'élimination urinaire de l'ADT chez le rat, l'h omme et la sour1s ... ... .. .... p.
V-3-1 Administration de l ' ADT et recue il des échantillons sangu ins et urinai res... ... ... p.
V-3-1-1 Chez le rat. ... .. . .... ... p.
V-3-1-2 Chez la sour1s... .. ... . p.
V-3- 1-3 Chez l 'homme. . . p.
V-3-2 Traitement des échanti llons sanguins et ur1na1res p.
V-3-2-1 Incubation avec la sulfatase... p.
V-3-2-2 Incubation avec l a g lucuronidase .. . .. . ... p.
V-3- 3 Analyse en CLHP des ur1nes avant et après
V-3-4 Dosage UV des métabolites sangu1ns ou ur1na1res
après déconjugaison .. ... ... . .. . .. .... ... ... . p.
V-4 Inhibition de la peroxydation des l i pides induite in
vitro .... .. . .. ... .... · .. . ··· ··· · · P·
V-4-1 Conditions opératoires ... .. ... . . .... . ... ... .. p.
V-4-1-1 Inhibition de la production de
malondi-ald éhyde (MDA) par des m1crosomes hépa tiques de rats incubés e n présence de Feso4 et de cys t éine ou d'ascorbate . ... .. ... ... ... . . ... p.
V-4- 1- 2 Inhib ition de la peroxydation des lipides
m1crosomaux h é patiques induite par la réduction métabo li que de
cc14
e n présence de NADPH e t de cyt P-4 50 ... .... . . .... . .... . ... · · · • · · p.V-4-1-2-l Inh ibition de la production
de MDA... ... .. . . .. . . . .. . . .. . ... . .. . . p .
V-4-l - 2-2 Inhibition de la production de
C2H6 ... .. . .. ... . . .. . . .. ... . . ... . . p.
V-4-2 Evaluation quantitative de la peroxyda tion des l i
-pides microsomaux.. . . p.
V- 4-2-1 Mesure de l a concentrat ion de MDA.... .. p.
V-4-2-2 Mesure du t aux d ' éthane... . ... . p .
V- 5 Inhibit i on de la peroxydation des lipdies induite 1n v1vo p.
V-5-l Inhibition de la peroxydation des lipides chez le
V-5-2 Inh i bit i on de l a peroxydat i on des lip i des chez la souris traitée par le paracétamol... . p.
V-5-3 Inhib ition de la peroxydation des lipides chez l a
souris traitée par le paraqua t e t FeS04 . ... . p .
V-5- 4 Inhi bit i on de la peroxydation des lipi des chez la
sour i s traitée par le paraquat seul... .. .... p .
V-5-5 Inhibition de la peroxydation des lipides chez la
souris traitée par la bléomycine e t Feso4 . . . .. p .
V-5- 6 Disposi t if permettant l ' accumu l at i on de l ' éthane
expiré par l ' anima l au cours du temps .. .. .. .. . . p .
V- 5-7 Dosage de l'éthane en chromatographie gazeuse .. p .
)
)
I - INTRODUCTION GENERALE
I-l SULFARLEMR
s
Structure chimique et indications thérapeutiques
p-méthoxyphényl-5 dithia- 1,2 cyclopentène 3-thione (Anisyldithiolthione , ADT)
La molécule d'ADT est le seul princpP actif médicamenteux pr ésentant
s
dans sa fo r mule chimique le motif struc tur alë-s-s.
Elle e ntre dans lacomposition d ' un médicament commercialisé pour la première fo is en 1947 sous le nom de SULFARLEM. C'est un cholérét ique proposé dans le trait ement sympto-matique des t roubles dvspeptiques ( l) :
ballonnement s épigastriques - lenteur à la di ge stion - éruct ations
- flatu l ences - états nauséeux
En 1971, le SULFARLEM S 25 est mis sur le marché. Il a la même composition chimique que le SULFARLEM sauf que la dose d'ADT est de 25 mg par comprimé dragéifié au lieu de 12,5 mg par granule dans le cas du SULFARLEM. On remarque aussi une extension de ses indications thérapeutiques. En plus de son utilisation en tant que cholérétique, il est indiqué dans le traitement . des insuffisances salivaires induites par l'emploi de diverses thérapeutiques
médicamenteuses ou par les irradiations, d'où son utilisation actuelle dans les cas (l) :
- d'hyposialies médicamenteuses dues aux neuroleptiques, antidépresseurs, inhibiteurs des monoaminooxydases, tranquillisants,antiparkinsoniens et autres médications entraînant des sécheresses buccales
- hyposialies consécutives à l'irradiation de la sphère ORL
hyposialies d'origines diverses dès lors qu'il existe encore des poss ibilités de stimulation du parenchyme salivaire .
}1a l gré l'utilisat ion de l 'ADT en médecine humaine depui s 1947 , ses proprié t és biochimiques ont é t é très pe u é tudiées .
7
Les rapports industrie l s int ernes de la firme Lat éma ment ionnent que le prétraitement de souris par l ' ADT avant de leur injecter des fortes doses de t é t rachlorure de carbone ou de paracét amol les pro t ège contre la mort alité . Ces deux molécules é t ant des hépat ot oxi ques , la conclusion tirée est que l' ADT possède des proprié t és hépatoprot ect rices .
En dehors de ces rés ult ats , les seuls t ravaux ment ionnés dans la lit t érature, concernant l es propriétés hépa t oprotect rices de l ' ADT , ont été publiés en 1983 (2) par Bueding e t Coll. Ces auteurs constatent que les souris tra itées par l ' ADT avant de leur i nject er de forte s doses de paracé-t amol ou de CC14 sonparacé-t non seulemenparacé-t proparacé-tégées conparacé-tre la morparacé-t aliparacé-té , mais aussi que les taux des transaminases glu t ama te -pyruvate et glutarna te-oxalo-acéta te ainsi que de sorbitol deshydrogénase dans leur sang sont normaux. Ces taux augmentent chez les souris traitées uniquement par le CC14 ou le paracétamol . Ces r ésultats s uggèrent que l ' ADT prévien t la cytolyse hépa t ique et confirment qu ' il possède des propriét és hépatoprotectrices , mais ne
permet t ent pas d ' expliquer les mécanismes biochimi ques par lesquels i l agit. D'un autre côt é , l e mé t abolisme des dithiolthiones es t mal connu. Parmi cette famille de mol écules , une seule a ét é bien étudiée , c 'es t la 4- mé thyl- 5(2- pyraz i nyl) -1 ,2-di t hiole- 3-thione (OLTIPRAZ) (3) .
En ce qui concerne l' ADT , l e s r ésultats d'une é tude très incompl è t e de son mé tabolisme chez l e r a t et l e chien nous ont é t é communiqués par l a
firme Latéma . Environ 25 % seulement de la dose d'ADT adminis trée ont é té
forme d'ADT déméthylé, l ibr e , sulfo ou glucuroconjuguée. Les autres
métabo-lites (93,5 % des métabolites urinaires) n ' ont pas é t é identifiés .
Dans le sang , des dosages de la radioactiv ité globale ont été ef-fectués après administra tion aux animaux de l ' ADT radioactif , mais aucun mét abolite n ' a été identifié .
Ces r ésultat s ne donnent aucune indication sur l e métabolisme du cycl e dithiolthione.
j
De plus , le métabolisme de l ' Oltipraz ne donne pas de rense i gnements sur celui de l ' ADT. En effet , la présence d'un mé t hyl sur le carbone 4 et d ' une pyrazine sur le carbone 5 du cycle dithi olthi one de l ' Oltipraz au l ieu d ' un hydrogène et de l ' anis ole respectivement dans le cas de l ' ADT change complètement les voies mé taboliques que ces deux molécules subissent .
Etant données les carences de connaissances en ce qui concerne
~ s
le mé tabolisme et les propriétés biochimiques du motif structural C ~- S-S et
l ' utilisa tion de ·l ' ADT depuis près de 40 ans en thé rapeutique humaine sans engendrer de t ox icité , nous nous sommes i ntéressés au métabolisme et aux
activités biologiques de l ' ADT e t en particulier à l ' implication du mo tif
structural original
(C~-S-S)
dans ses effets hépatoprotecteurs .Notre étude comport e deux parties - l'étude du mé tabolisme de l ' ADT
-l'effet de l ' ADT ~t plus particulièrement du motif s tructural
~s
C
-s-s
vis- à-vis des agressions oxydantesI - 2 Les systèmes enzymatiques du métabolisme des xénobiotiques I - 2- 1 La phase I et la phase II
Les xénobiotiques possèdent généralement des groupements
U,BLEAU 1
REACTIONS CATALISEES PAR LE CY TO CHR OME P4 50 MICROSOMIQUE HEPATIOUE
r--D'APRE S WI SLOCKI ET COLL. (8)
TYPE DE REACTION
Réactions d'oxydations :
Hydroxyl a tion aliphatique
Oxydation aromatique
Epoxydatio n d'alc e nes
N-d ésa lky lation e t
désamination oxydative
0- désalkylatio n
1\J -oxydation
Désul furatio n oxydative
Déshalogénation oxydative
Dénitrifica t ion oxydat i ve
Réactions de réduction :
Nitro réduction
Azo r éduction
Réduction des N-o xydes d'amin es
te r tiaires
Ré d uc t io n des arènes oxydes
Dés halogé nat i on réducti ve
EXEMPLE DE SUBSTRAT
Acide laur iq ue
Cyclo hexane
Te s to stero ne
Benzène
Benzo(a)pyrène
Aniline
Afla toxine B1
Benzphétamine
Amph é tamin e
4 nitroanis o le
7- éthoxyco umatine
Amphétami ne s
Para thion
Chlorofor me
2-nitropr opa ne
Amaranthe,.
Imipramin e N-oxyde
Benzo(a)pyrè ne
4 - 5 oxyde
Tétrachlorure de
carbone
(
PRODUIT
Acide
W-hydroxy-laurique
Cyclo h exanol
OH-testoster on e
Phénol
3-0 H benzo(a ) pyrène
4-amino-phénol
Epoxyde en 2- 3
)N-desmé t h y
1-be n z po
lé-tamine
+Formol
Phén y l acétone
4-nitro phénol
+Formol
7-0H-coumarine
+acétaldéhyde
N-OH amphétamines
Para-oxon
Ph osgène
Acétone
+n itrite
RNHOH
Imipramine
Benzo(a) pyr è n e
Chloroforme
4
pénètrent fac ilement dans les cellules . Dans le cytoplasme, le transport se fa it grâce à la ligandine ou à la protéine Z (5). Ainsi , le composé parvient au r ét iculum endoplasmique où il peut être mét abolisé par les enzy-mes de la phase I (fonctionnalisation). Il s ' agit généralement d ' hydroxylation par des monooxygénases à cy t ochrome P-450 , puis par les enzymes de l a phase II (conjugaison) (Figure 1) . Au cours de ces deux phases , un xénobiotique subit
1 "
des
transfo1~1ions
....
sans l esquelles il serait stocké indéfiniment dans les structur es lipophiles des membranes cellulaires. Ains i transformé enmétabo-lites pl us polaires , il est éliminé plus facilement dans la bile ou dans les
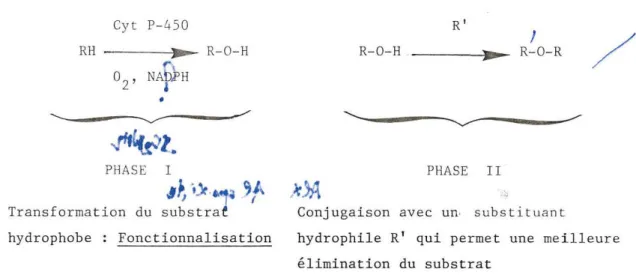
urines (6, 7). Cyt P-450 R'
1
/
RH...
R-0-H R-0-H...
R-0-R 02, NAb'J'H'
PHASE l PHASE II~~ ·~
..
.,~
,,
..
Transformat ion du subs traf Conjugaison avec un· subst i tuant
hydrophile R' qui permet une mei lleure élimination du substrat
hydrophobe Fonctionna lisation
Figure 1 Schéma général du métabolisme d'un xénobiotique
I-2-1-1 Les enzymes de la phase I
Ce sont en général les monooxygénases dépendant du cytochrome
P-450 (cyt. P-450). Ces enzymes dont le rôle génér al est d ' introduire un atome d'oxygène sur l a substance hydrophobe (Figure 1), peuvent catalyser plusieurs t ypes de réactions qui sont résumées dans le Tableau 1 ( 8) .
Ce tableau montre que le cytochrome P-450 peut agir comme catalyseur non seulement de réactions d'oxyda tion mais également de réactions de
réduc-TABLEAU 2
PRINCIPALES REACTIONS DE CONJUGAISON
REACTION DE CONJUGAISON Glucuronidation Glucosidation Sulfatation Méthylation Acétylation
Synthèse des ac ides me rcapturiques
Conjugaison par la glyc ine e t la glut amine
Epoxyde hydrolase
FONCTION CONJUGUEE -OH, -COOH -NH
' 2
J
Ar- OH Ar-NH ' 2' Al-OH
Ar-OH, -NH2 , NH,=N, - SH
q
•
hydrazides ,-so
2, -NH2.s~
ArX, Ar - NO? , Ar-é poxyde s
F\t'k
A._{
't'~.,c,.· ~"
Ar-COOH, Al-COOH
Epoxyde s
D' après les Références 6 et 9. Ar = Aromat i que ; Al = Aliphatique
CoA Coenzyme A GSH glutathion PAPS = phosphoadénosylphosphosulfate REACTIF CONJUGANT UDP glucuronate UDP glucose P.A.P.S. S-adénosylméthionine Ac éty lCoA G- SH Glycine e t glutamine
1
\
tion ; de pl us, le tableau me t bien en évidence la grande variété de subst rats que cet te enzyme est capable de t ransformer.
I-2-l-2 Les enzymes de la phase II
( J
Les xénobiotiques s ubissent , selon leur structure chimique ,
différentes réactions de conj ugaison catalysé es par les enzymes de l a phas e II (Tableau 2). Trois de ces r éac tions nous int éressent direc t ement et seront développées .
a - La sulfo e t la glucuroconjugais on
Elle s concernent l es hydrocarbures aliphatiques ou aroma t i ques qui possèden t des f onc t i ons - OH ou NH2 ainsi que d' autres mol écul es (Ta-bl eau 2).
b - La conj ugaison avec l e glutath i on (GSH )
Elle concerne ] es molécules é l ec t roph i les e t aboutit à l a forma t ion de mer capturat es .
Le résultat ·global est l'augmentation de l'hydrophilie de la molé-cule exogène hydrophobe permettant ainsi son élimination (6, 7, 9).
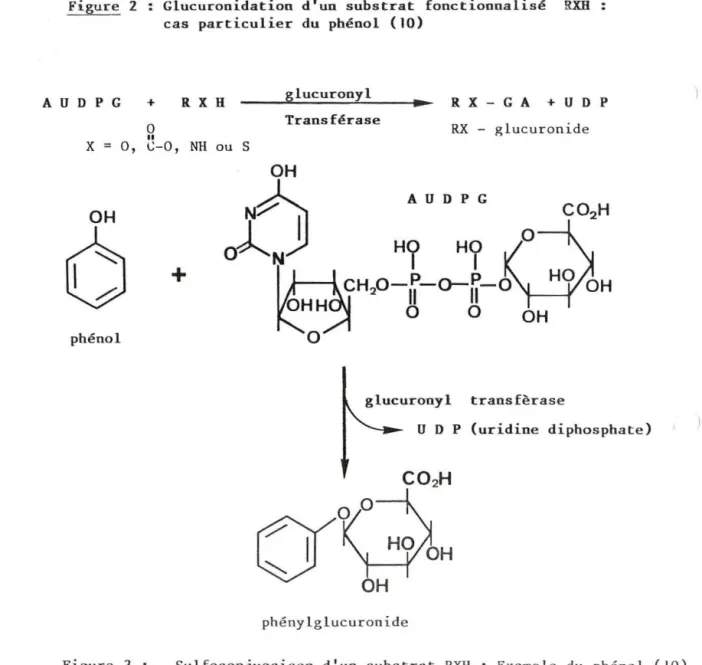
I-2-l-2-l La glucuroconjugai s on (10)
La plupart des xénobiotiques sont éliminés en majorité sous forme de glucuronides. La glucuronidation est une réaction de condensation de l'acide D-glucuronique s ur la molécule à éliminer. Elle nécess ite une acti-vation de l'acide glucuronique en ac ide a-uridine-5'-diphosphoglucuronique
(AUDPG). Les molécules glucuronidées sont plus acides que l es molécules
de départ grâce au groupement carboxylique libre qu'elles acqui èrent (Figure 2) . Les glucuronides sont de ce fait plus i onisés à pH physiologique. Ce genre de composés traverse difficilement les membranes cellulaires et ne subit
.. !l'
Figure 2 Glucuronidation d'un substrat fonctioonalisé RXB cas particulier du phé nol (10)
A U D P G + R X H
0
----~g~lu~c_u~r~o~o~y~l~--~~-- R X _ G A + U 0 p
Transférase RX - glucuron ide
x
Il X=
O, C-0, NH ou SOH
6
phénol Figure JOH
p+
B
1
HO
CH20-P-o--P-o
OH
Il
Il
0
0
OH
0
glucuronyl transfèrase U D P (uridine diphosphate )phényl g luc u ronide
Sul focon jugaison d'un subs trat RXH : Exe mp l e du phé no l (10) sulfokinase
P A P S + R X H R-X- S03H + J 'pho sphoa dé nos tne-5 ' ·
phos pha te ( PAP)
=0 ou NH
OH
6
+
phé no l P A P SNH2
0-1O=P-0-6
o-N
1
2'1
4' 5'1
l'CH-CHOH-CH-CH - CH
0 - P - 0503
2Il
~----00
k
s ul fokinase~ ~pA
p(J(OSO,H
qu ' une très faible r éabsorption rénale ce qu1 accé l ère l eur é limination .
I-2-1-2-2 La sulfoconjugaison ( 10)
Cette forme de conjugaison est mo1ns importante que ce lle impliquant l ' acide glucuronique en raison de la concentration limitée de l a ce llule
en sulfates. La su lfocon j ugaison nécessite. d ' abord l'activat ion des sulfates
so
4 en 3 ' -phosphoadénosine-5 ' -phosphosul fate (PAPS) par une série de réactionsqui utilisent de l'ATP. Le transfert d'un groupement sulfate du PAPS à l a molécu le réceptrice est catalysé par une su l fokinase .
Parmi l es molécules sulfoconjuguées figurent des phénols, des a lc oo ls et des COQposés aminés . La Figure 3 r eprésente une réaction générale de sulfoconjugaison ains i que l' exemple de conjugaison du phénol .
I-2-1-2-3 Formation d' ac ides mercapturiques (10)
Le glutathion ( ~-glu t amy l-cysteinyl-glycine) se coQbine avec dive r s agents alkylants ou arylants (Tableau 2) pour conduire à des mercaptu-rates facileQent éliminés dans les urines.
La Figure 4 représente l es différentes réactions qu'un glutathion-conjugué subit pour aboutir au mercaptur ate .
Les autres types de conjugaison ne nous intéressent pas directement et ne seront donc pas développés ici.
I-2-1-3 Localisation subcellulaire e t tissulair e du cytochrome P-450
Le cytochrome P-450 r es ponsable de la détoxification des xénobio-tiques est principalement localisé dans le réticulum endoplasmique (microsomes) des hépat ocytes (11). D' autres t i ssus contiennen t égaleme nt du cytochr ome
P-450 ; ce sont par exemp l e : l es reins (12), les poumons (13), l'intestin (13 , 14), les glandes surrénales (15), les t es ticules ( 16), les ovaires (1 7),
Figure 4 NH2
1
GLUTATHION (GSH) HOOC - CH - CH2 - CH2 - CO - NH - CH - CO - NH - CH2 - COOH NH2 1 HOOC CH-+
RX GLUTATHION- S-TRANSFERASE~
CH - S-R 1 2CH2 - CH2 - CO - rH - CH - CO - NH - CH2 - COOH
"f
-GLUTAHYLTRA.\!SPEPTIDASE CH -S-R 1 2~
H N -2 CH - CO - NH - CH2 - COOH 1 R S -PEPTIDASEt
R- S - CH2 - CH - COOH 1 ACETYLTRANSFERASE CH2 - CH -'COOH+
1 NH - C - CH3Il
u
0Il
- C - S - CoA acétyl CoA HS - CoA
~~E~~P-~~~~~~ coe nzyme A
Synthèse d'un mercapturate à partir d ' un s ubs Ï:ra-t--RX.--Rx peut être un
)
J
7
la peau (18) et l e cerve au ( 19).
Dans l e foie, l es reins , l es g l andes surrénal es et l es gonades ,
l es mitochondr i es contiennent éga l ement des cytochrome s P-450 ( 20, 2 1, 22, 23 ) . Mais à l'opposé des cy t ochromes P-450 du réticulum e ndopl asmique des ce l lules hépatiques , pulmonaires ou rénales , ce type de cytochromes possède une étr oite spéc ific ité de subs trat et de réaction : hydroxylation des s téroïdes dans l es surrénales et l es gonades , 1-
a
-hydroxyl ase de la vit D3 rénale, hydr oxylation d ' acides biliaires hé patiques . . .I-2- 1-4 Multiplicité e t inductibilité du cytochrome P-450
Du faitqu'un grand nombre de molécu l es de structures chimiques complètement différentes son t substr ats du cytochrome P-450 , le problèDe de l'unicit é ou de l a mu l tiplicité du cytochrome P- 450 s ' es t pos é . On pensait
au départ qu 'il s ' agissa i t d ' une e nz~me unique et aspécifique . Mais l es constan-~ tes améliorat i ons des techniques de purif i cation enzymat ique ont abouti à
l ' i so l ement de différents cy t ochromes P-450 et ont du même coup apporté la preuve de l a diver s ité de ces e nzymes . Ac tue llement , plusieurs isoenzymes du cy t ochrome P-450 ont é té i sol ées à partir des membrane s microsomales de fo i E de rat s et de souri s (24, 25, 26) .
Les cytochromes P-450 sont di ffé r emment induc tib l es , l a r ésultante du phénomène d ' induction es t une augmentation de la concentration des cy t . P-450 dans le foie (Tableau 3). Cette induction procède d'une synthèse de novo d '
hé-mop~otéines puisqu ' e l l e peut ê tre bloquée par l es inhibite urs de l a synthè s e
protéique comme l ' actinomycine, l e cyc l ohexi mide e t la puromycine (27 , 28) .
Nous r emarquons dans l e Tableau 3 , qu'un seul inducteur augmente différemment plusieurs activité s enzymatiques . Ce t ab l eau résume l es effets des induc teurs c lass iques , phénobarbital, 3-méthyl c hol ant hrè ne et l ' aroc lor
1254 (biphényl- polych l or é) s ur l es act ivités monooxygénasiques dépendant du cytochrome P- 4 50 : L ' aniline hydroxy l ase est pe u se ns ible aux induc teurs ( 29, 30 ), l a benzph é tamine-N-d éméthy l ase es t principa l ement augmen t ée par l e phéno-barbital, l a be nzo(a)pyrène hydroxy l ase et la 7-éthoxycoumarine-0-dééthy l ase
Tab l eau 3
EFFETS DU PHENOBARBITAL (PB), du 3-METHYL-CHOLANTHRENE (3 MC) ET DE L'AROCHLOR 1254 SUR LES MICROSOMES HEPATIQUES DE RATS
TRAITEMENT 0 PB
Protéines micr osomales (a) 17 23
Cytochrome P-450(b) 0 . 7 2.3
Aniline hydroxylase (c) 0.6 l. 15
Benzphétamine-N-déméthyl ase (c) 2 . 7 24.3
Benzopyrène-hydroxy l ase (c ) 0 . 07 0 . 27
7- éthoxycoumarine-0-déé thylase (c) 0 . 2 2 . 2
lnhib.ü i on par la métyrapone 52 72
2 . 10-\1( d)
.
p:lr l' ~-naphtoflavone 10-5M(d) 5 3
(a) mg protéines x
g-
1 foie (poids frais)(b) nmol x mg- 1 protêines
(c ) nmol x min- 1 x mg proté ines
(d) pourcentage d'inhibition
d ' après Alvares e t Kappas ( 29) et Ullrich (3 1) 3 MC 17 1. 7 l. 35 2.3 0.9 5 .4 0 90 AROCHLOR 1254 23 2 1.13 ~ 12 . 2 0. 7
-)
J
B
. 0
l e 3-méthylcho lanthrène . De plus la sensibilité aux inhibiteurs var1 e fort ement se lon le traitement des animaux .
Ces résultats sont une illustration de l'existence de plus ieurs isoenzymes du cyt. P-450 à large spécif icit é de substrats.
I-2-1-5 Constitution d' une monooxygénase à cytochrome P- 450
C' est un complexe multienzymatiqu~ localisé dans la membrane du
r é ticulum endoplasmi que e t constitué de 3 é léments indispe nsables à son ac t i -v ité (Tableau 4 ). Il s ' agi t de fla-voprotéines et de cytochromes qui f onct i onne n t
c or.~e de s transporte urs d'électrons ou des a c tivateurs de l'oxygène mo l éculai r e .
Au cour s d ' é t ape s nécess itant de l ' oxygène e t des nucl éotides pyridinique s r édu i ts, l ' ensemb l e de ces r éac tion s permet de trans former les x énob io tique s en 1~é tab o lit e s plus po l a ires .
I - 2-1 - 5- 1 Le cy t ochrome P-450
C' e st une hémoproté ine déc rite pour la première fois par Klinge nbcrg (32) et Grafinke l (33) . Elle doit son nom à la position du pic d'absorption
à 450 nm (bande de soret) qui apparait sur l e spectre UV-visible du complexe cyt . P-450 r édujt-r.O .
- La partie protéique est constituée d'une seule chaine polypeptidique et di ffère selon les i soenzymes par sa composition en aminoacide s . Une portion de cett e protéine est fortement hydrophobe . C' es t sur cette partie, appelée si t e actif, que vont se fixer l es substrats par des interactions hydrophobes non spéc ifiques .
- L'hème, iso l é du milieu aqueux par l a protéine, est la protoporphyrine IX d f u e r, ans aque e e e r, d l l l l f ' l' -a etat d'. 10n e rr1que e f . F III , est 1e aux quatre 1· ' ·
atomes d ' azote du cyc l e porphyrinique . D' autre par t l e cytochr ome P- 450 natif (A, Figure 6) es t e n équil ibre sous deux formes : une forme haut spin,
penta-...
~~~ ~
~
~
'\t
~
Tableau:..
,~
/'
4 COMPOSANTS DU SYSTEME D' OXYDATIONS MICROSOMALES HEPATIQUES ET LEURS FONCTIONS
Op
~
__.-" GROUPE PROSTHETIQUE Fer - Protoporphyrine IX
FONCTIONS
2 Site de liaison de 1'02 c t de diver s substrots Dé t ermine la spécificité de substrat du système
avec des spécificités de s ubstrat cr oisées
formes multiples
NADPH - CYTOCHROME P- 450 REDUCTASE
GROUPE PROSTHETIQUE FMN e t FAD
FONCTION Transferts d ' électrons du NADPH au cytoc ~r ome P-450
PHOSPHOLIPIDES
COMPOSANT ACTIF Phospha tidylcho line (55
%)
e t autres phospholipidesFONCTION Facil itent l e tran sfert d'élect r ons de lo réductase au cytochrome
P- 450 et la for mation de compl exe entre les deux composants mais i ls ne sont pas transporteurs d ' électr ons par eux- mêmes .
iii
coordinée, où l' hème est fixé de façon non covalente à la protéin e qui l' en-t oure par l'inen-te rmé diaire d'une liaison axiale enen-tre l'ion Feiii e en-t un li gand thiolate provenant d'une cystéine (34) et une forme bas spin, he xacoor d jnée ,
d . , 1· . . l l III f . ' ·
par une eux ~ eme ~a~s o n ax~a e entre e Fe et une onct~on - OH d un am1no-acide ou de H2
o.
I-2-1-5- 2 La NADPH cyt P-450 réductas e
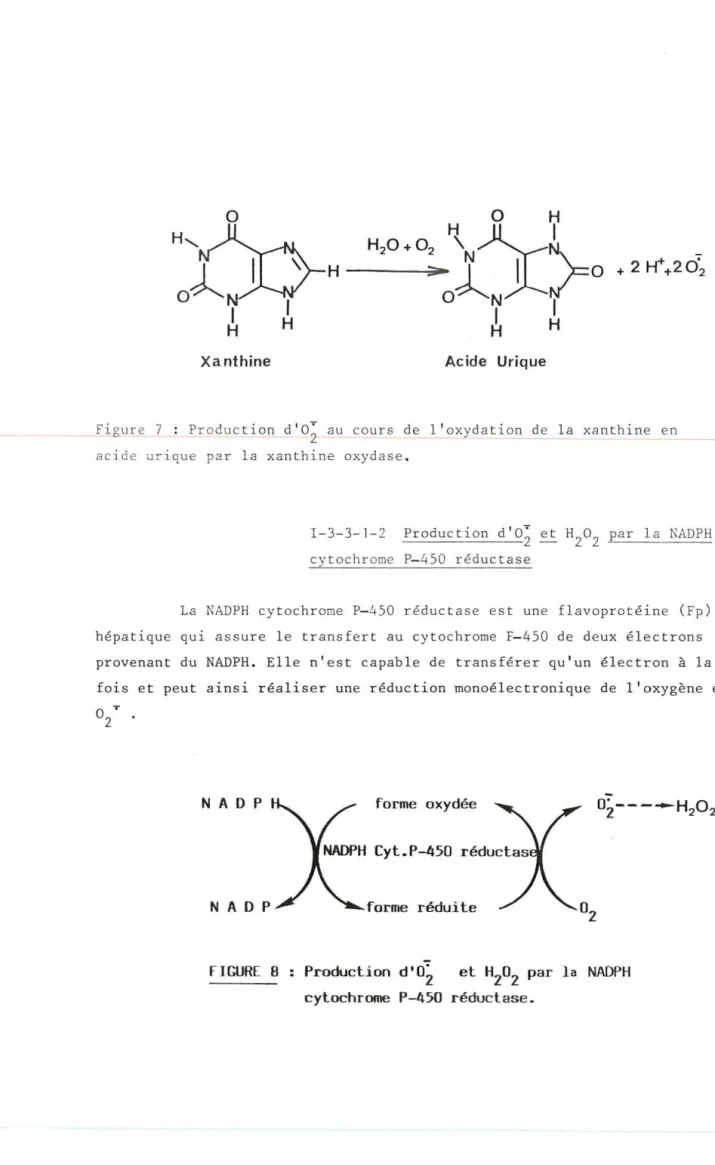
C' e st une enzyme réductrice qu~ aisure le transfert au cy t.P-450
des élect r ons pr ovenant du nicotinamide adénine dinucl é otide phos pha t e rédu i t (NADPH) . Ce tte enzyme oicrosona l e est une fl avopro t é ine de poi ds mol écu l a ire 80 . 000, S ê pur i fi ca ti on à parti r du foie e t ses pr opr i é t és ont é t é décr i t e s par St r obe l e t Col l . (35) . El le ne contie nt pas de mé t aux , mais de ux cofa c t eur s f l av in ique s La flavi ne mononucl éotide (FHN ) et l a fla v i ne adé nine d inuc l éo-t ide ( FAD) (1 nol e de chaque c ofac éo-t e ur / mole d'enzyme ) ( 36).
I- 2-1- 5- 3 Les lipides
Les l ipides s on t l ' un de s tro is composan t s i ndis pensab l e s au fonc tionnement cataly t i que du système oxyda tif des micros ome s (37, 38). La phos -phatidylchol ine en est le composant majeur (55
%).
Bien que le mécanisme de l'effe t des lipides sur l' activité du système ne soit pas bien connu, il s emble qu'ils facilit e nt l a formation du complexe substrat-cyt.P-450 a~ns~ que letransport de s éle ctrons entre la NADPH cyt.P-450 réductase et le cytochrome P-450 ( 39) . De plus, il est probable que les lipides ont un rÔle protec teur e t sta bili sateur du cy t.P-450 ; en effet, lorsque celui-ci est isolé de la membrane microsomale et solubilisé, il peut se dénaturer rapidement en cyto-chrome P-420. Les li pides minimisent cette conversion. Les détergents non ioniques , par leur struc ture physicochimique , peuvent lorsqu'ils sont lié s au cytochrome P-450 jouer ce même rÔle protecteur et assurer le fonc tionnement catalytique du système oxydatif reconstitué (40).
Les lipides modulent aussi la fixation du substrat sur le cytochrome P-450 (4 1). Il s jouent égaleme nt un rÔle import R n ~ dans l'induction ~n v ~vo
)
) )
1!1
du cyt. P-450 microsomal hépatique par l e phénobarbita l (42).
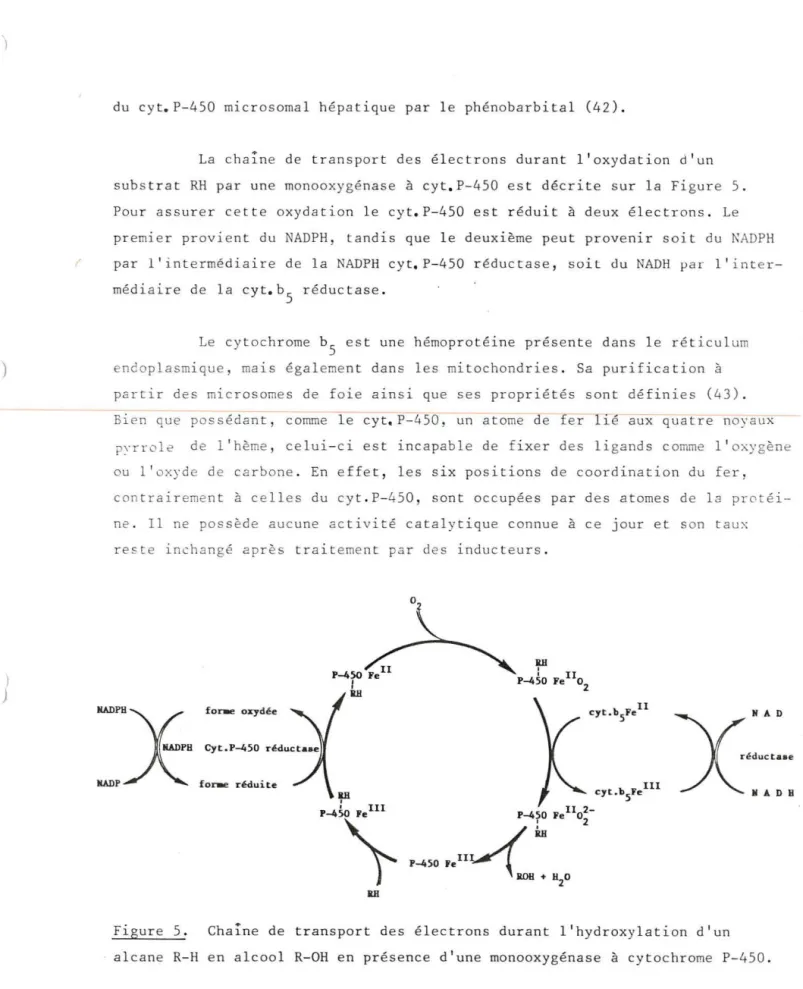
La chaine de t ransport des é l ectrons durant l' oxydat i on d'un subs trat RH par une monooxygénase à cyt. P-450 est décri te sur l a Figure 5 . Pour ass ure r ce t te oxyda t i on le cyt. P- 450 es t rédu i t à deux électrons . Le premier provient du NADPH, tandis que l e deuxième pe ut provenir soit du ~ADPH par l ' intermédiaire de la NADPH cyt. P- 450 r éductase , soi t du NADH ~ar l 'inte r-médiaire de l a cyt. b5 réductase.
Le cytochrome b5 est une hémoprotéine présente dans l e réticulum endoplasmique, mais égalemen t dans les mitochondries . Sa purifi cation à
partir des microsomes de foie a1ns1 que ses propriétés sont définies (43). Bien que possédant , comme le cyt. P-450, un atome de fer lié aux quatre noyaux pyrrole de l'hème , celui- ci est incapable de fixer des li gand s comme l'oxygène ou l'oxyde de carbone . En effe t , les six positions de coordination du f e r, contrairement à celles du cyt . P-450, sont occupées par des atomes de l a protéi-ne . Il protéi-ne possède aucuprotéi-ne ac tivité catalytique connue à ce j our et son t aux re ste inchangé après traiteme nt par des inducteurs.
I!ADPYc
IIADPH lllADPfo.-- oxydée
fo.-- rédui te
Figure 5. Cha ine de t r a n spor t des é l ectr ons duran t l'hydroxylation d'un alcane R-H en alcool R-OH en présence d ' une monooxygénase à cytochrome P-450 .
j
)
1 1
I - 2-1-6 Cycle catalytique du cytochrome P-450
1 - Dans une première étape , l e substrat l ipophile RH v i en t se fi xer dans l a cavité hydrophobe de l'hémoprotéine pour f ormer un complexe enzyme-substrat RH-cyt . P-450 Fe(III ) Ceci provoque une modifica-tion conformamodifica-tionnelle de l a prot éine et son passage à l ' état haut spin ; ain::; i l ' é4u ilibre e ntre l es f ot-mes bas spin e t hau t spin (B)
es t déplacé vers l a deuxi ème forme .
2 - Réduct i on du Fe(I II ) par un élec tron pr ovenant du NADPH v1a l a KADPH cyt . P-450 réductase e t format i on du complexe RH-cyt. P- 450 Fe(II) . Cette étape nécessite la présence d ' un phospholipide
(Strobel e t Coll . 39) qui facilitera it l e transfert d ' électrons (44) .
3 - Fixation réversible d'une molécule d' oxygène sur l e site de c oordi-na tion vacant du Fe(II) pour former le comp l exe oxyc y toch ro~e P- 4~u
(D) qui pourrait conduire à un complexe superoxo du Fe(III) ( 33) .
P-450 Fe( II )( 0 2)
forme mésomère qui fa it apparaitre la structure de l'anion supe r oxyde
4 - Réduc tion de ce complexe par un second électr on qui conduit à un compl exe peroxo àu Fe(III), c' es t un compl exe à oxygène actif (E) qui peut s'écrire sous les formes suivantes :
2- III
-P-450 Fe( III)(02 ) ou -P-450 Fe -0-0
5 - Le c omplexe (E) est très instable , il se décompose pa r transfe r t d'un atome d' oxygène sur l e s ubst rat et élimi nation d ' une mol écule d' eau.
La r éaction g l obale s ' écrit
De ux mécanismes sont actuellement proposés (45) pour expliquer l'inte rcalation d'un atome d'oxygène sur un substrat R-H.
a) Le complexe peroxo pourrait après protonation réagir comme un peracide :
P-450 Feiii -0-0 + H +
P-450 Feiii_O-OH + RH
P-450III - 0-0H P-450III -OH + ROH
b) Un coDplexe oxo du fer, intermédiaire, sera it formé par double prot onat ion et élimination d' e au :
+ H P-450 Feiii - 0- 0 + H+
~P-450
Fe 111-0-0H ,_ P-450Fe = 0 + H20v
4 V IV . Ill P- 50 Fe =0 ~ P-450 Fe -0 + RH----1,_._
ROH + P- 450 Fe~~~~1[.,.
..
Dans ce cas. la cassure de la l iaison 0-0 se produit avant le transfèrt de l'atome d' oxygène au subs trat .
De nombreux arguments sont en faveur de la de uxième hypo thèse
- Certaines hémoprotéines (catalase, peroxydases) réagissent avec H2
o
2 en provoquan t une cassure de la lia i son 0- 0 e t en produisant un compl exe oxo du fer, comme cela a pu être montré sans ambiguité par des méthodes spectroscopiques en raison de la plus grande stabilité de ces intermédiaires(46).
- H2
o
(Hp) Fe III + H2
o
2----+.,----~
- H ..~
(HP)Feiii - OOH - - ---:11 + ....~
(Hp)Fe V=O+ H
On est e n présence d'une situation tout-à-fait anal ogue avec l e cyt ochrome P-450, l'oxygène subissant une réduction à deux é l ectrons,
con- 2-dui sant ainsi à l ' état peroxydique 02 .
1 )
13
III +
Cyt. P-450 Fe + 0 2 + 2 e + H ---~---- Cyt.P-459 Fe III -OOH
- H 0 2 + H +
v
Cyt.P-450 Fe =0
Il est possible de remp l acer l' oxygène (en présence de NADPH) par divers oxydants donneurs d ' atome d'oxygène tel que l'iodosobenzène
c
6H6Io (47) des hydroperoxydes ROOH(48),
NaOCl (49)ou Nai04 (50) sans changer considéra-blement les spéc ificités d ' oxydat ions cata ly sées par le cyt. P-450 in vitro, a1ns1 que les distributions des produits.Il est donc généra l ement admis que le complexe à oxygène act if contient un seul atome d ' oxygène plutôt qu ' un g r oupe peroxo .
I-3 Toxicité due à des agressions oxydantes I mp l i cation des dérivés de réduction de l ' oxygène et rÔle de la péroxydation des lipides
I-3-1 Introduction
L ' oxygè ne est indispensable à l a v1e de toutes l es ce llul es aéro-bies. Sa réduction e n eau au niveau des mitochondries appo rt e l ' énergie
nécessaire à la phosphorylation de l' adénosin e diphosphate (ADP) e n adénosine triphosphate (ATP) (51). Cet ATP contient des liaisons phosphate (P-P) riches en énergie et const itue l e principal réservoir é nergétique que l a ce llule utilise pour accompl ir un g r and n omb r e de réactions métabo liques (51) .
La réduction de l'oxygène au n1veau des mitochondries fait inter-venlr des r éact i on s d' oxydoréduct ion couplées et se passe a u n iveau de la chaine resp iratoir e composée de catalyseurs de transfert d' é l ectrons (nucléa-tides pyridiniques, flavoprotéines (Fp), fer non héminique (Fe NH), protéines fer - soufre (Fe-S), ubiquinone
(Q),
cyt ochromes dont des cyt. b et cet laJ
)
•-'
cytochrome oxydase) (52). Environ 95% de l' oxygène ce llul aire subissent une réduc ti on à 4 é l ec trons par la cytochrome oxydase mitochondriale et sont transformés e n une seule étape en eau sans passage par des intermé-diaires réactifs libres (53). En effet des dérivés de l ' oxygène réduit
par-tiellement on t été détectés ma is l iés à l' enzyme (54) .
(II)
4 cyt . c + Cyt . oxydase ----11.-~ 4 cyt.c (III) + cyt. oxydase
(réduit)
a
2 + cyt . oxyàase (réduit)+ 4H+---1•~
cyt . oxydase (oxydé)+ 2 H2a
ou
+ 4 H 2 H-a-H
Les 5% d'oxygène restant sont réduits par étapes au n1veau des mitochond ri(~S ou d ' autres compartimen t s de l a cellule au cours de réaction s enzymatiques où apparaissent des intermédiaires réactifs dangereux, respon-sables d'une peroxydation des lipides (55, 56) .
I-3-2 Les dérivés de réduction de l'oxygène
La réduction monoél ectronique de l'oxygène moléculaire conduit à
la forma tion de l'anion- radical superoxyde
a·
2·a - a·
- - ----11 ... ~ •a - a
Cette réduction a été r éal isée expérimentalement par des systèmes phys i co-chimiques (57) etenzymatique s (58) et
a;
a été détectée sans ambiguité par différentes méthodes physiques (59) et chimiques(6a).
rap1-Î
dement des réactions qu1 produisent d ' autres dérivés de réduction de l ' oxygène très r éac tifs .
- a;
se dismute en effet spontanément dès sa format i on dans le milieu de réaction. Cette dismutation est très r apide e t produit H2o2 etl ' oxygène singulet ( 1o2). D' un autre cÔté, il a été montré qu' e n prés e nce de s uperoxyd e dismutase (SOD : Me talloenzyme qui catalyse la dismutation d e
a;-),
la dismutationd'a·
2 produit l ' eau oxygénée et l ' oxygène moléc ulaire30
à l ' état fondamenta l triplet ( 61) . 2
2
a·
2 + 2 H +,._
H202 + 10 2(~~·4-j
2
a·
2 + 2 H + SOD....
H202 + 30 2(
LW~~,.,.J).
2 -
a;
peu t d o nne r selon la r éaction d'Ha be r-We iss, e n présence d'H2o2 d e s r adicaux ·o H très r éac tifs (62) :a·
2 + + ·oH +La formation des radicaux "OH par cette réaction a été étudiée dans des systèmes chimiques et biologiques et e l le s ' est avérée très lente . Ce n ' est qu ' en présence de traces de métaux de transitions ché l atées ou non que l a production d'"OH est importante (63).
a·
2 + + H + - - ---11 catal yseur .... ~ +·aH
+En présence de Fe111, la réaction d ' Haber-Weiss se fait en deux étapes distinctes : Réaction de Fenton
a·
2 + Feiii __________ ~...,.~+
+