Les troubles de l’équilibre acido-basique
Texte intégral
Figure

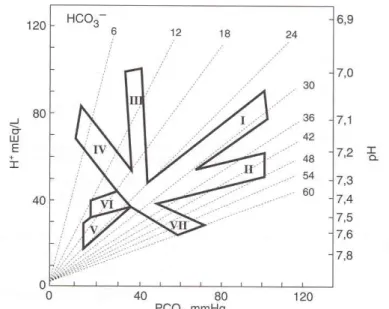

Documents relatifs
– POUR POUR : : L’acidose (sévère intra/extra cellulaire) est L’acidose (sévère intra/extra cellulaire) est néfaste pour l’organisme…. néfaste
- les hyperkaliémies de transfert : acidoses métabolique ou respiratoire, acidification trop rapide d’une alcalose métabolique, insuffisance surrénale aiguë, stimulants
En chimie, une solution tampon est une solution qui maintient approximativement le même pH malgré l'addition de petites quantités d'un acide ou d'une base, ou malgré
L’eau absorbée doit être éliminée dans les 4h, le test est positif si moins de 380 ml sont éliminés en 2h après absorption de 600 ml. Les
Deux entit´es forment un couple acide-base si on peut passer d’une entit´e `a l’autre par gain ou perte d’un proton H +.. L’acide est not´e AH et la base
l'acide carbonique H2CO3 et HCO3 pour le bicarbonate se retrouvent dans la même solution.. L'acide carbonique H2CO3 est un acide faible et se dissocie dans les solutions
Elle est utilisée dans le domaine de la médecine pour déterminer le pH sanguin à partir des concentrations en ion bicarbonate et en acide carbonique... Les
Excès de bases: C’est la différence entre la valeur des bases tampons calculée du sujet étudié et celle des bases tampons d’un individu normal (47 mmol/l). - une valeur