يولعلا ثحبلاو يلبعلا نيلعتلا ةرازو
République Algérienne Démocratique et Populaire
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique
يحي نب قيدصلا محمد تعهبج
-لجيج
-Université Mohammed Seddik Ben Yahia - Jijel -
Faculté des Sciences de la Nature et de la Vie
Département : Biologie Moléculaire et Cellulaire
Mémoire de Master
Filière : Sciences biologiques
Option : Biochimie
Thème
Membres de Jury :
Présenté par :
Présidente : Dr. LAHOUEL.A * Zebila Meryem Examinatrice : DR. BOUHAFS.L * Chouikh Nesrine Encadreur : Dr.DERAI.E * Bousba Lemia
Année universitaire : 2018 - 2019 Numéro d’ordre :………….. تعيبطلا مولع تيلك ةبيحلاو تيولخلاو تيئيزجلا بيجولويبلا نسق
Effet du picolinate du chrome sur les altérations
cérébrales induites par le fructose alimentaire chez
Sommaire
Liste des abréviations Liste des figures
Introduction ……….1
Chapitre I : le système nerveux et l’homéostasie énergétique 1. Généralités sur le système nerveux …………..……….…2
2. La régulation de l’homéostasie énergétique par le SN ... 6
2.1. Les acteurs de la régulation hypothalamique de la prise alimentaire ... 6
2.2 Interactions entre le système nerveux central et les organes métaboliques périphériques ... 9
Chapitre II : le fructose
1. Généralités ... 112. Métabolisme du fructose ... 11
3. Fructose et insulinoresistance……….14
3.1. Insuline et les mécanismes affectés dans l’insulino-résistance…...………....14
3.2. Mécanismes moléculaires de l’insulino-résistance induit par le fructose………...15
4. Fructose et comorbidités neuropsychiatriques………..…….17
4.1. Fructose et altérations cognitives………....17
4.2. Fructose et Troubles de l’humeur………19
4.3. Fructose et stress oxydatif………...20
Chapitre III : le chrome 1 .Généralités………..21
2..Métabolisme du chrome……….21
3. Le chrome dans les compléments alimentaires……….….22
4 .Chrome et les altérations métaboliques……….……….23
4.1Chrome et insulinorésistance……….23
4.2 chrome et déclin cognitif et dépressif………...……..26
4.3Chrome et stress oxydatif………..……27 PREMIERE PARTIE : SYNTHESE BIBLIOGRAPHIQUE
Chapitre III: matériel et méthodes
1. Matériel biologique et conditions d’élevage……….………...………..28
1.1. Produits utilisés………..….28
1.2. Répartition et traitements des animaux…………..……….28
2. Méthodes ………..29
2.1. Tests neurocomportementaux ………....29
2.1.1.Évaluation de la mémoire à court terme par le test de labyrinthe en Y ….….………...29
2.1.2.Evaluation du comportement de type anxieux ………...……….30
2.1.3.Evaluationducomportement dépressif par le test de suspension caudale … ………..32
2.2 . Prélèvement des échantillons………...….33
2.2.1. Prélèvement sanguin……….. 33
2.2.2.Prélèvementdes organes………...…....33
2.3.Dosage des paramètres biochimiques………...35
2.3.1. La glycémie………...35
2.3.2. Test de tolérance au glucose………35
2.3.3. L’insuline……….35
2.3.4. Indice HOMA-IR……….35
2.3.5. Le glycogène……….………...36
2.4. Dosage des paramètres du stress oxydatif……….36
2.4.1. Préparation de la fraction cytosolique du foie et du cerveau………...36
2.4.2. Dosage de Malondialdéhyde (MDA)………...37
2.4.3. Dosage du glutathion réduit (GSH)……….37
2.4.4. Dosage de l’activité des enzymes antioxydantes………..……...38
2.4.4.1. Dosage de l’activité de la catalase cytosolique……….38
2.4.4.2. Dosage de l’activité de la glutathion peroxydase………...………...39
2.4.4.3.Dosage de Super oxyde dismutase (SOD)………...…..40
2.5. Dosage des protéines tissulaires………...……….…………..40
2.6. Analyse histologique………...41
2.7. Analyses statistiques………41
Chapitre V: résultats et interprétation
1. Influence du traitement sur l’évolution pondérale, la consommation alimentaire et hydrique des
animaux ………...…..42
1.1. Sur l’évolution pondérale...42
1.2. La consommation alimentaire et hydrique………...…..43
2. Tests neurocomportementaux………...44
2.1. Évaluation de la mémoire à court terme ……….………..…44
2.2. Evaluation du comportement dépressif………..45
2.3. Evaluation du comportement anxieux………...46
3. Influence du traitement sur les paramètres glucidiques……….47
3.1 .La glycémie à jeun………..47
3.2. Test de tolérance au glucose(HGPO)……….48
3.3 .L’Insulinémie………..49
3.4 .L’Indice HOMA………..49
3.5. Le taux de glycogène hépatique.……….50
4. Effet de traitement sur les paramètres du stress oxydatif………..51
4.1. Sur le taux de Malone di aldéhyde (MDA)……….51
4.2. Sur le niveau du GSH réduit………...52
4.3. Sur l’activité des enzymes antioxydants ……….53
4. 3.1. Sur l’activité de la glutathion peroxydase (GPx)………53
4.3.2. Sur l’activité de la catalase (CAT)………..…....54
4 .3.3. Sur l’activité du Super oxyde Dismutase (SOD)……….55
5. analyse histologique………...57
5.1. Effet du traitement sur l’histologie hépatique……….57
5.2. Effet du traitement sur l’histologie cérébrale………..57
Discussion………..61
Conclusion……….67
Références bibliographiques………68 Annexes
AGRP: Agouti Related Protein. ACC: Acetyl-CoA carboxylase AMP : Adénosine MonoPhosphate. ANC : Apports Nutritionnels Conseillés.
α-MSH: Alpha-Melanocyte Stimulating Hormone.
BHE : Barrière Hémato-Encéphalique PKB : Protéine Kinase B.
CA 1 : Cornu Ammonis 1. CA 2 : Cornu Ammonis 2. CA 3 : Cornu Ammonis 3.
CART: Cocaine and Amphetamine Related Transcript.
DAG : Diacylglycérol.
DHAP : Dihydroxyacétone Phosphate. DMN : Dorsomedial Nucleus.
EM : Eminence Médiane. FAS : Fatty Acid Synthase. G6PD:Gucose-6-Phosphate Déshydrogénase.
GABA : Gamma- Amino ButyricAcid. GLP-1 : Glucagon-Like Peptide-1. GTF: Glucose Tolerance Factor. HDL: High-Density Lipoprotein. IL-6: Interleukine 6.
IR : insulin receptor.
IRS : insulin receptor substrate. KHK: ketohexokinase.
LCR : Liquide céphalo-rachidien. LH : lateral hypothalamus.
LMWCR:Low-Molecular-Weight-Chromium binding substance.
LPL: LipoProtéine Lipase. MAP kinase : Mitogen-Activated Protein Kinases.
MC3R: Melanocortin 4 Receptor MC4R: Melanocortin 4 Receptor. NOX-4: Nicotinamide adénine dinucléotide phosphate Oxydase 4. NPY: Neuropeptide Y.
NPV: Nucleus Paraventricularis PI3 K : Phosphatidyl Inositol 3 Kinase.
Pkcε: Protéine kinase c-epsilon. POMC: Pro-opio-Mélanocortine Protéine ß A : Protéine bêta-amyloïde. PVN : Paraventricular Nucleus.
ROS: Reactive Oxygen Species. SNA: Système Nerveux Autonome. SNC: Système Nerveux Central. SNP: Système Nerveux Périphérique. TGF-β1: Transforming Growth Factor beta 1.
TNF-α: Tumor necrosis factor-alpha VLDL: Very Low Density
Lipoprotein.
VMN : Ventromedial nucleus. XO: Xanthine Oxydase.
Figure 1: structure de l'encephale……….………..……...3
Figure 2: les lobes et les structures de surface du cerveau ……….……….……...…3
Figure 03: Représentation schématique de la synapse chimique………....…...……….…...….6
Figure 04: Structure du noyau arqué (ARC)……….………...………...8
Figure 05: Les voies de régulation hypothalamique de la prise alimentaire……….…….…….8
Figure 06: Intégration des signaux périphérique au niveau du noyau arqué……….…...10
Figure 07: Absorption intestinale du fructose …...………….………...…...11
Figure 08 : Métabolisme du fructose ………...…….13
Figure0 9 : Principales voies de signalisation par l'insuline…...15
Figure 10: L'exposition chronique au fructose entraîner aune résistance à l'insuline hépatique…...16
Figure 11: Mécanismes par lesquels la consommation excessive de fructose induit une insulinorésistance hépatique………..….17
Figure 12: La structure chimique de picolinate de chrome ……….……….22
Figure 13: L’action de chrome sur la signalisation insulinique ………..……….24
Figure14 : La régulation de la translocation de GLUT4 par le chrome ...…...24
Figure15: L’action du chrome via la chromoduline ………...………26
Figure 16: Procédure comportementale dans le labyrinthe en y ………..…....30
Figure 17: schéma du labyrinthe en croix surélevé………...…...31
Figure18: Dispositif du test de suspension caudale ……….……….………32
Figure 19: Protocole expérimental ……… ……….………..…...34
Figure 20 : variation du poids corporel chez les 3 groupes pendant 4 semaines de traitement…...42
Figure 21 : variation de la consommation alimentaire et hydrique des trois groupes (T), (Fr) et (Fr+Cr) au cours de l'expérience ………...………..…43
Figure 22: Effet du traitement sur la mémoire à court terme des souris expérimentales ……….…44
Figure 23: Le temps d'immobilité des souris des 3 groupes (T), (Fr) et (Fr+Cr) dans le test de suspension caudale ………....45
Figure 24: Effet du traitement sur le niveau d'anxiété ………..……….…..46
Figure 25: Variation de la glycémie à jeun (g/l) chez les groupes (T), (Fr) et (Fr+Cr) ……….….47
Figure 26: Evolution de la tolérance au glucose chez les groupes (T), (Fr) et (Fr+Cr) …...………48
Figure 27: Effet du traitement sur de l’insulinémie et l’indice HOMA-IR chez les trois groupes de souris (T, Fr et Fr+Cr)...49
Figure 28: Effet du traitement sur de la concentration de glycogène hépatique chez les trois groupes de souris (T, Fr et Fr+Cr) … ………..……50
Figure 29: Effet de traitement sur le taux de MDA au niveau du foie et du cerveau entre les trois groupes de souris (T, Fr et Fr+Cr) ………..………51 Figure 30: Effet du traitement sur la concentration de GSH au niveau du foie et du cerveau entre les trois groupes de souris (T, Fr, Fr+Cr) ………...52 Figure 31: Effet du traitement sur l’activité enzymatique de la GP-X au niveau du foie et du
cerveau entre les trois groupes de souris (T, Fr, Fr+Cr)………...…..53 Figure32: Effet du traitement sur l’activité enzymatique de la catalase au niveau du foie et du cerveau chez les trois groupes de souris (T, Fr, Fr+Cr) ………..54 Figure 33: Effet du traitement sur l’activité enzymatique de la SOD chez les groupes
(T), (Fr) et (Fr+Cr) ………....56 Figure 34 : Observation microscopique d’une coupe histologique du foie……….………..58 Figure 35: Observation microscopique d’une coupe histologique du cortex cérébral………..59 Figure 36: Observation microscopique des coupes histologiques des régions de l’hippocampe des souris des trois groupes ………..…………..60
1 Introduction
L’insulino-résistance est un problème majeur de santé publique généralement attribuée à un dysfonctionnement de l’insuline au niveau du muscle squelettique, du foie et ou du tissu adipeux (Bahlil, 2010).
Au cours des cinq dernières décennies, la prévalence de l’insulinorésistance est augmentée de façon spectaculaire dans le monde en raison d’une modification des habitudes alimentaires, avec des régimes souvent plus riches en graisses et en sucres ajoutés en particulier en fructose (Gatineau, 2015). Elle est étroitement associée à plusieurs pathologies tels que l’obésité, la dyslipidémie, le diabète de type 2, l’hypertension artérielle (HTA) (Bihan et al., 2007).
Outre ses conséquences métaboliques, plusieurs études suggèrent que l’insulinorésistance peut également affecter le système nerveux central (SNC), d'une part, elle peut affecter la régulation centrale de l'appétit. D'autre part, elle semble avoir un impact sur la fonction cognitive en affectant les différents paramètres comportementaux (mémoire, dépression et l’anxiété) (Lowette et al., 2015).
Pour cette raison, de nombreuses études se sont intéressées aux effets physiologiques de certains suppléments nutritionnels pouvant être bénéfiques dans la prévention de l’insulinorésistance en proposant que l'amélioration de l’action de l’insuline et le contrôle glycémique peuvent améliorer les altérations associées à l’insulinorésistance (khanam et Pillai, 2007). Parmi les suppléments d’intérêt, le picolinate du chrome (CrP), un complément alimentaire qui joue un rôle clé dans l’homéostasie glucidique via un effet potentialisateur de l’insuline (Roussel, 2009). Cependant, malgré l’évidence de leur intérêt potentiel dans la prévention de l’insulino-résistance, jusqu’à présent, une seule étude clinique a été effectuée en Algérie par harani et ses collaborateurs en 2012 sur l’efficacité du chrome ou il a trouvé que le chrome semble avoir un effet crucial dans le contrôle métabolique.
Dans ce contexte aucune étude expérimentale en Algérie n’a été faite sur le rôle du picolinate du chrome dans la prévention des maladies métaboliques.
Au vu de ces données, notre étude vise à étudier l’effet protecteur du picolinate du chrome sur les altérations cérébrales pouvant être induites par une insulinorésistance provoquée par un régime riche en fructose chez des souris de souche wistar.
2
Chapitre I: Système nerveux et homéostasie énergétique
1. Généralités sur le système nerveux
Le système nerveux est un système complexe permettant les interactions entre l’organisme et son environnement en captant, intégrant et émettant l’information (Messé, 2010). Il est divisé en deux grandes parties : le système nerveux central (SNC) et le système nerveux périphérique (SNP).
1.1. Le système nerveux central (SNC) : est un système entouré par des membranes protectrices retenant également du liquide céphalo-rachidien (LCR) (Messé, 2010). Il est constitué de deux sous-parties : l’encéphale et la moelle épinière.
1.1.1. L’encéphale : est la partie du SNC contenue dans la boîte crânienne. Il comprend 3 régions : Le cervelet : situé immédiatement sous le cerveau et en arrière du tronc cérébral (MacLean, 1990). Il est impliqué dans l’intégration et la coordination des mouvements et du tonus musculaire (Delmas et Brémond-Gignac, 2008).
Le tronc cérébral : situé entre la moelle épinière en bas, et le diencéphale en haut. Il comporte trois parties ; le mésencéphale (pédoncules cérébraux), la protubérance annulaire, et le bulbe rachidien (Nachite, 2013). Il contrôle plusieurs fonctions vitales comme la respiration, la circulation et la digestion (Sherwood, 2006).
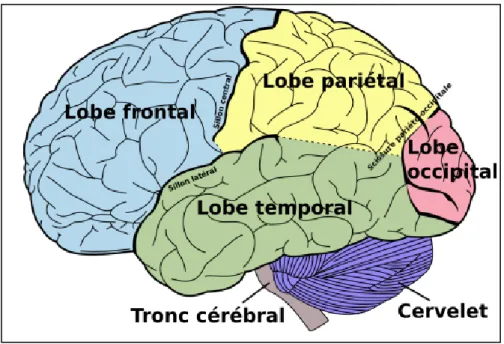
Le cerveau : constitue la partie la plus volumineuse de l’encéphale. Il est très développé dans l’espèce humaine où il représente environ 80% du poids de l’encéphale (Sherwood, 2006). Il se divise en deux parties : le diencéphale et le télencéphale (Nachite, 2013) (Figure1).
Le télencéphale comporte deux hémisphères cérébraux quasi symétriques qui sont liés essentiellement via le corps calleux (Chayer et Freedman, 2001).
L’hémisphère droit commande le côté gauche du corps tandis que l’hémisphère gauche commande le côté droit du corps (Sherwood, 2006). Chaqu’un de ces hémisphères comporte deux régions bien distinctes, une région périphérique qui est la substance grise comportant les corps des cellules nerveuses et une région centrale faite de substance blanche. Cette dernière contientessentiellement les prolongements axoniques des neurones (Chayer et Freedman, 2001).
Chaque hémisphère est subdivisé par des scissures dont La scissure de Sylvius et la scissure de Rolando sont les deux principales scissures (Messé, 2010). Ces dernières divisent le cortex cérébral en plusieurs lobes (Sally et Georg, 2001). À leur tour, ces différents lobes sont creusés par des sillons qui forment des plis appelés également circonvolutions ou gyri (Messé, 2010) (figure2).
3
Figure 1: schéma montrant l’encéphale (Delmas et Brémond-Gignac, 2008).
4 (Tableau 01) :
Tableau 1 : Les cinq lobes cérébraux et leurs fonctions.
Le diencéphale, une région autonome importante du cerveau, (pp1 and world association, 2014). Il comprend : Le thalamus (un volumineux noyau gris constitue le lieu de terminaison de la plupart des voies sensitives, l’hypothalamus (situé à la base du cerveau, au-dessus du tronc cérébral et sous le thalamus. Il intervient dans la régulation des processus physiologiques et comportementaux variés et participe au contrôle de l’homéostasie énergétique et l'épithalamus (composé essentiellement d’une glande pinéale (ou épiphyse) (Delmas et Brémond Gignac, 2008)
1.1.2. La moelle épinière
La moelle épinière est un long cylindre du tissu nerveux fait suite à l’encéphale, en continuité du bulbe rachidien, ou moelle allongée (Bucher, 2013). La partie centrale de la moelle épinière, qui joue un rôle dans les réflexes, est constituée de substance grise. En périphérie, la moelle épinière est constituée de faisceaux ascendants de substance blanche conduisant les influx nerveux vers l'encéphale et des faisceaux descendants conduisant les influx qui en partent. Trente et une paire de
nerfs rachidiens partent de la moelle épinière (pp1 and world association, 2014). Lobes Fonction
Le lobe frontal Impliqué dans le contrôle volontaire des muscles squelettiques, le processus intellectuel et dans la communication verbale.
Le lobe pariétal Intervient dans les sensations cutanées et musculaires, la compréhension et dans l’élaboration des mots (PP1 and WORLD ASSOCIATION, 2014)
Le lobe temporal L’hétérogénéité anatomique et histologique correspond à des fonctions cognitives diverses, dont notamment l’audition et le langage (Hammoud, 2016). Il est aussi impliqué dans la mémoire grâce à l’hippocampe (Delmas et Brémond-Gignac, 2008), une structure bilatérale appartient à la cinquième circonvolution du lobe temporal (Gerardin, 2012).
Le lobe occipital Responsable du traitement initial des messages visuels (Sherwood, 2006). Le lobe insulaire Joue un rôle dans la mémoire et l’intégration des autres activités cérébrales
5
Il correspond à l’ensemble des formations nerveuses situées hors de l’étui crânien (Riche, 2006). Sa fonction principale est de faire transporter les informations de ou vers les organes périphériques (Viallet-Le Borgne-Godener, 2010). Ce système est formé principalement par des nerfs crâniens qui partent de l'encéphale, et des nerfs rachidiens qui partent de la moelle épinière (pp1 and world association, 2014).
Il comprend deux voies : La voie sensitive ou afférente, composée de fibres nerveuses qui transportent les influx vers le SNC et la voie motrice (ou efférente) qui permet le transport des influx du SNC vers les muscles et les glandes.
1.3. Tissu cérébrale et la transmission synaptique
Le tissu cérébrale est constitué de deux sortes de cellules ; les cellules nerveuses ou neurones et la glie ou cellules gliales(pp1 and world association, 2014).
Les cellules non neuronales ou gliales n’ont pas de rôle direct dans la transmission des messages, mais des fonctions indirectes essentielles : soutiennent et protègent le tissu neuronal. Elles sont 10fois plus nombreuses que les neurones (Amiel-Tison et Gosselin, 2010).
Les cellules nerveuses ou neurones sont les unités fonctionnelles du système nerveux (Zayed et
al., 2003). Elles ont pour fonction de recevoir, générer et transmettre des signaux nerveux en
assurant les différentes fonctions cérébrales (Amiel-Tison et Gosselin, 2010).
Le lieu où se produit la transmission d’un signal d’un neurone à un autre est appelé une synapse. L’élément du neurone qui produit un signal est appelé pré-synaptique, tandis que l’élément qui reçoit un signal est appelé post-synaptique (Behdad, 2015) (figure 3).
La transmission des informations est assurée par deux sortes de synapses : les synapses électriques (de fonctionnement très rapide) et les synapses chimiques (de fonctionnement plus lent). Ces dernières sont en beaucoup plus grand nombre (Amiel-Tison et Gosselin, 2010).
Lorsqu’un potentiel d’action atteint la terminaison synaptique au cours d’une transmission chimique, il excite les vésicules synaptiques, ces dernières libèrent des neurotransmetteurs (comme l’acétyle choline, dopamine, sérotonine) dans la fente synaptique. Les neurotransmetteurs traversent alors la fente synaptique jusqu’au post-synaptique pour qu’ils se lient avec les récepteurs des dendrites, ce qui permet à certains types d’ions de passer à travers la membrane. L’activation des récepteurs de dendrite modifie son potentiel et donne ainsi naissance à un signal de sortie post-synaptique (Behdad, 2015).
6
l’apparition de certaines maladies, comme la dépression. En effet plusieurs troubles psychiatriques ou neurologiques découlent de modifications chimiques dans la neurotransmission (Zayed et al., 2003).
Figure 3 : Représentation schématique de la synapse chimique (Behdad, 2015).
2. La régulation de l’homéostasie énergétique par le SNC
L’homéostasie énergétique se définit comme un état d’équilibre entre les apports fournis par la prise alimentaire et les dépenses énergétiques de l’organisme. La stabilité du poids corporel et de la masse grasse sont le reflet de cet état d’équilibre (Couvreur, 2011).
L’homéostasie énergétique est régulée à plusieurs niveaux. Schématiquement, il existe un dialogue entre la périphérie et SNC (Broberger, 2005).
Le SNC joue un rôle clé dans la détection et le contrôle du statut énergétique de l'organisme (Meyers et al., 2012). Il possède en particulier une structure spécifique, l’hypothalamus, sensible à des informations provenant des organes périphériques ou de l’intestin (qui le renseignent sur l’état nutritionnel de l’organisme (De Vadder et Mithieux, 2015).
2.1. Les acteurs de la régulation hypothalamique de la prise alimentaire
L’hypothalamus est considéré comme le chef d’orchestre de la régulation homéostatique de la balance énergétique et du poids corporel (Disse, 2012). C’est une structure diencéphalique constituée d’une quarantaine de noyaux (correspondant à des groupements spécifiques de populations neuronales) parmi lesquels le noyau arqué (ARC), ventromédian(VMN), dorsomédian (DMN), paraventriculaire (PVN) et l’hypothalamus latéral LH), qui joue un rôle fondamental dans la régulation de l’homéostasie énergétique (Berthoud, 2002).
7
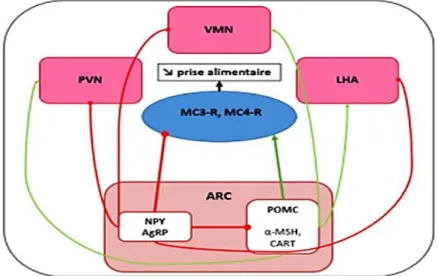
l'alimentation et le métabolisme (Myers et al., 2012). Il est situé près de l'éminence médiane (EM), qui est riche en capillaires fenêtrés qui mènent à une barrière hémato-encéphalique (BHE). Le EM facilite le transport des signaux hormonaux et nutritifs périphériques et leur détection par les neurones ARC (Rodr guez et al., 2010). De ce fait, l'ARC intègre les signaux neuronaux périphériques, métaboliques, hormonaux et nutritionnels de la circulation périphérique (Sam et al., 2012). Au sein de l’ARC, deux populations neuronales d’intérêt participent à la régulation de la prise alimentaire (Disse et al., 2016) (figure 04).
Une population de neurones anorexigènes exprimant la POMC (Proopiomélanocortine), précurseur protéique de deux classes de peptides : les mélanocortines (comme l’ α -MSH : Melanocyte Stimulating Hormone) et les B-endorphines. La plupart des neurones à POMC du noyau arqué expriment aussi le peptide CART (Cocaïne and Amphetamine-Related Transcript). Les peptides α -MSH qui exercent leur effet anorexigène par leur liaison aux récepteurs MC4R (melanocortin 4 receptor) et MC3R (Adan et al., 1994) et les peptides CART ont une action inhibitrice sur la prise alimentaire (Elias et al., 1998 ; Fan et al., 1997 ; Kristensen et al., 1998).
Une population de neurones orexigènes Co-exprime le neuropeptide Y (NPY) et l’agouti-related peptide (AgRP) (Ollmann, 1997). Les neuropeptides exprimés par ces cellules stimulent la prise alimentaire (Kohno et Yada, 2012). Notons qu’un tiers de ces neurones NPY-AgRP expriment un 3ème neurotransmetteur connu pour stimuler la prise alimentaire : le GABA (Olgiati et al., 1980 ; Horvath et al., 1997).
Le NPY exerce ses effets orexigènes par l’intermédiaire essentiellement des récepteurs de type Y1 et Y5 et le GABA, par des récepteurs de type GABAa. En revanche, le mode d’action de l’AgRP est sensiblement différent puisqu’il agit de manière antagoniste sur le système anorexigène de l’ARC. En effet, l’AgRP est un antagoniste des récepteurs MC4-R de l’α- MSH (Gouazé, 2012) (figure 5).
8
Figure 4 : Structure du noyau arqué (ARC) (Benyaich, 2017). Benyaich A., Benyaich K. 2010
ARC : noyau arqué ; NPY : neuropeptide Y ; AgRP : « agouti related protein » ; POMC :
proopiomélanocortine ; α-MSH : hormone alpha stimulante de la mélanocortine.
Les neurones du noyau arqué expriment de multiples récepteurs d’hormones. La leptine (Gutiérrez-Juárez et al., 2004), mais aussi l’insuline et les métabolites tels que le glucose ou les acides gras (Thorens et Larsen , 2004), ont directement accès au noyau arqué au niveau de l’éminence médiane (Balland et Prévot, 2014).
Figure 5: Les voies de régulation hypothalamique de la prise alimentaire (Benyaich et Benyaich, 2017).
VMN: noyau ventromédial ; PVN: noyau paraventriculaire ; LHA: zone latéral de
l’hypothalamus ; MC3-R: récepteur 3 à la mélanocortine ; MC4-R: récepteur 4 à la mélanocortine ; ARC: noyau arqué ; NPY : neuropeptide Y ; AgRP : « agouti related protein » ;
9
2.2. Interactions entre le système nerveux central et les organes métaboliques périphériques Le maintien de l’homéostasie énergétique repose en grande partie sur la capacité du SNC à évaluer le statut énergétique de l’organisme via la perception de nombreux signaux circulants (Gouazé, 2012). Ces signaux peuvent être :
2.2.1. Des signaux nutritionnels
Des nutriments tels que le glucose, les acides gras et les acides aminés fournissent des informations sur la disponibilité des nutriments pour le cerveau.
2.2.2. Des signaux gastro-intestinaux
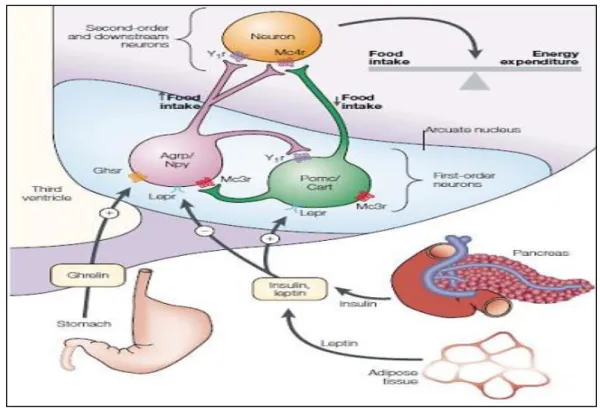
Plusieurs hormones synthétisées par le tractus gastro-intestinal régulent la prise alimentaire à court terme. Ces peptides sont produits en réponse à l’activation des baro- et chémorécepteurs signalant au tractus gastro-intestinal la présence et la densité énergétique des aliments ingérés. L’information est ensuite relayée au système nerveux central, permettant alors de réguler la prise de nourriture (Wynne et al., 2004). Parmi ces signaux on distingue : Les signaux anorexigènes : peptide YY3-36, cholecystokinines, GLP-1 et Le seul signal orexigène connu à ce jour : la ghréline. (Couvreur, 2011) qui est sécrétée par l'estomac lors d'un jeûne et favorise la prise de nourriture (Cummings et al., 2002)(figure 6).
2.2.3. Signaux d'adiposité
L’action des signaux précédemment décrits est indispensable au contrôle de la prise alimentaire, cependant elle n’est pas suffisante pour induire à elle seule des modifications durables de la balance énergétique. La régulation à plus long terme est assurée par des signaux périphériques dits signaux d’adiposité (Couvreur, 2011). Ils font référence aux signaux périphériques qui circulent proportionnellement à la quantité totale de graisse stockée et informent le cerveau de l'état d'énergie stockée (Sandoval et al., 2008 ; Seeley et Woods, 2003).
Parmi ces signaux les plus décrits dans la littérature : la leptine (produite par le tissu adipeux) et l’insuline (produite par le pancréas) (Couvreur, 2011) (figure 6).
10
Figure 06: Intégration des signaux périphériques au niveau du noyau arqué (Gouazé, 2012).
Les signaux de régulation à long terme tels que la leptine et l’insuline sécrétées proportionnellement au degré d’adiposité, sont intégrés au niveau du noyau arqué de l’hypothalamus (Couvreur, 2011) en inhibant les neurones AgRP/NPY et stimulant les neurones POMC/Cart adjacents. Un niveau plus bas d’insuline et de leptine active les neurones AgRP/Cart alors qu’il inhibe les neurones POMC/Cart. En revanche, la ghreline qui est un peptide circulant secrété par l’estomac peut activer les neurones AgRP/NPY et ainsi stimuler la prise alimentaire (Gouazé, 2012).
Les neurones du noyau arqué émettent ensuite des projections vers les noyaux hypothalamiques de 2ème ordre tels que le noyau paraventriculaire ou l’aire hypothalamique latérale. Une boucle de régulation s’établit entre le système nerveux central et la périphérie via le système nerveux autonome (Couvreur, 2011).
11
Chapitre II : Le fructose
1. GénéralitésLe fructose peut provenir soit des aliments naturels soit des aliments industriels en tant que sucres ajoutés (Gninou , 2017). Comme le glucose et le saccharose, sont naturellement présents, à des teneurs variables, dans les fruits et les légumes (sources également de vitamines et de fibres). À ces sources naturelles de fructose s’ajoute le fructose incorporé dans les produits alimentaires, sous forme de sucre ajouté dans les boissons sucrées, les confiseries, le chocolat, les pâtisseries, certaines céréales de petit déjeuner, les glaces, les desserts lactés, etc. D’autres sources de fructose sont le miel (qui contient environ 40% de fructose) et les sirops sucrants. Ces produits sont soit consommés, soit ajoutés dans des préparations domestiques ou industrielles (Delarue et al., 2014).
2. Métabolisme du fructose
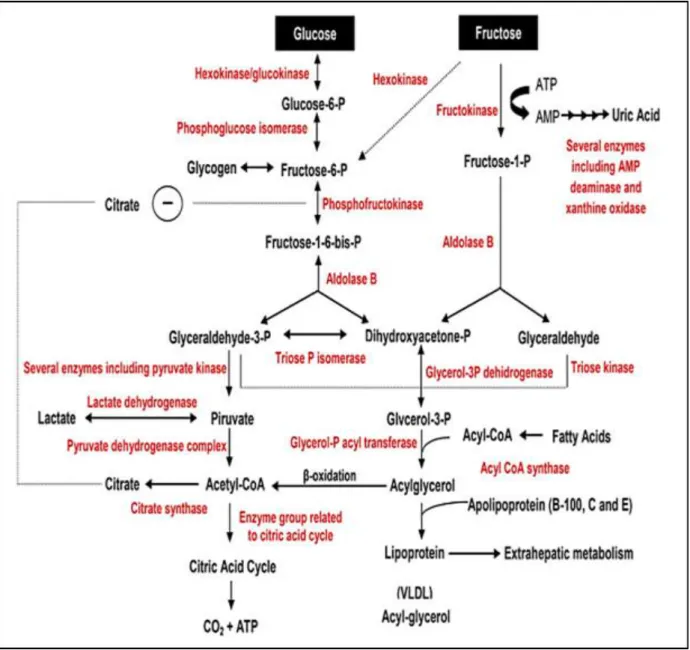
Après la prise alimentaire, le fructose est transporté à l’intérieur de l’entérocyte indépendamment du sodium par le transporteur GLUT5. Il est ensuite, pratiquement, parvenu dans la circulation systémique via GLUT2 situé au pôle basolatéral(Gatineau, 2015) (figure 7).
12
Une faible proportion du fructose (moins de 10 % ingérée est métabolisée par la muqueuse digestive et aboutit à la formation de lactate alors que la majeure partie représentant les 80-90% restants est dirigée vers le foie par la veine porte et métabolisée dans l’hépatocyte (Mayes , 1993) dont les premières étapes de son métabolisme sont insulino-indépendantes et par conséquent le fructose est métabolisé en grande partie en absence de sécrétion d’insuline et sans augmentation du glucose plasmatique (Mellouk, 2013).
Dans les hépatocytes, le fructose va être rapidement et très efficacement phosphorylé en fructose-1P par la fructokinase, avec l’utilisation d’une molécule d’ATP (Mayes, 1993). Suite à l’action de la fructokinase, le fructose-1P est transformé par l’aldolase B en trioses phosphate : le glycéraldéhyde et le di-hydroxyacétone phosphate (DHAP), rejoignant ainsi la voie de la glycolyse. Ces trioses phosphate vont alors être convertis en majorité en glucose (~50%) et en glycogène (~15%) via la néoglucogenèse (Koo et al., 2008). Le glycéraldéhyde peut également être phosphorylé par la triokinase en glycéraldéhyde-3P (Mayes, 1993), ensuite oxydé en pyruvate. Ce pyruvate sera alors soit réduit en lactate (~25% du fructose ingéré) (Bjorkman et al.,1984), soit décarboxylé en acétylcoenzyme A (acétyl-CoA), par la pyruvate déshydrogénase. Via le cycle de Krebs, l’acétyl-CoA va être converti en citrate, alors disponible pour la lipogenèse de novo (De Novo Lipogenesis – DNL) (moins de 5% du fructose ingéré). De plus, le DHAP peut également être converti en glycérol 3 phosphate, pouvant conduire à la synthèse de triglycérides (Coleman et Lee, 2004) (figure 8).
13
14 3. Fructose et insulinoresistance
3.1. Insuline et les mécanismes affectés dans l’insulino-résistance
L’insuline est un polypeptide d’environ 6kDa.Il s’agit d’un hétérodimère composé de deux sous-unités, la chaîne A et la chaîne B, reliées entre elles par deux ponts disulfures (Henri, 2011). Il est produit par les cellules β du pancréas (Kojima, 2006). Cependant, certaines études font état d’une production par d’autres types cellulaires. Il pouvait être synthétisé par certaines cellules du foie, de la rate ou encore du tissu adipeux (Suckale et Solimena, 2010).
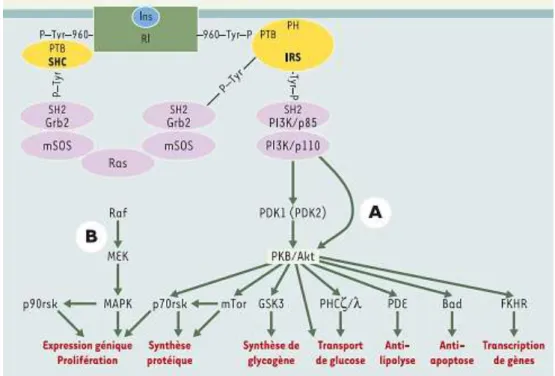
L’insuline est une hormone anabolique. Elle joue un rôle majeur au niveau de l’organisme, dans la mise en réserve et l’utilisation des substrats énergétiques, qu’ils soient glucidiques ou lipidiques : entrée de glucose, synthèse de glycogène et lipogenèse, inhibition de la glycogénolyse, de la néoglucogenèse et de la lipolyse. Elle exerce également des fonctions sur le métabolisme protéique (augmentation de la synthèse et inhibition de la protéolyse), la croissance et le contrôle de l’apoptose (Saltiel et Kahn , 2001) (figure 9 ).
L’ensemble de ces effets résulte de la liaison de l’hormone à un récepteur spécifique présent à la surface de toutes les cellules de l’organisme, mais exprimé surtout dans ses trois tissus cibles, le foie, le muscle et le tissu adipeux. Ce récepteur possède une activité tyrosine-kinase qui permet une autophosphorylation du récepteur puis la phosphorylation sur des résidus tyrosine des protéines substrats, protéines IRS (insulin receptor substrates) en priorité, et la création de complexes macromoléculaires d’activation à proximité du récepteur.
Les deux voies majeures d’activation sont celle de la phosphatidylinositol-3 kinase, activant la protéine kinase B, impliquée dans les effets métaboliques, et la voie des MAP (mitogen activated protein)-kinases, impliquée dans les effets nucléaires, la croissance et la différenciation.
Le contrôle négatif du signal de l’insuline peut venir de la dégradation de l’hormone ou de la déphosphorylation du récepteur. Surtout, il va provenir de la phosphorylation de résidus sérine/thréonine sur le récepteur et les protéines IRS. Cette phosphorylation peut être activée par de nombreux acteurs impliqués en pathologie dans la résistance à l’insuline, comme un hyperinsulinisme, le TNFα (tumornecrosis factor α) ou les acides gras libres libérés en excès par le tissu adipeux et transformés dans la cellule en acyl CoA (acyl coenzyme A).
15
Un rôle délétère des molécules libérées par le tissu adipeux est proposé dans la genèse de l’insulinorésistance hépatique et musculaire (Capeau, 2003) caractérisée par une diminution de la sensibilité des cellules de l’organisme à l’action de l’insuline, induisant une augmentation de l’insulinémie, et conduisant ainsi directement ou indirectement aux différentes autres anomalies du syndrome métabolique. Elle s’accompagne d’une élévation de la glycémie, et peut engendrer un diabète de type II (Benaraba, 2007).
Figure 9: Principales voies de signalisation par l’insuline: voies PI3 kinase et MAP kinase
3.2 Mécanismes moléculaires de l’insulino-résistance induite par le fructose
L'exposition chronique au fructose peut induire des altérations de la sensibilité à l’insuline via plusieurs mécanismes.
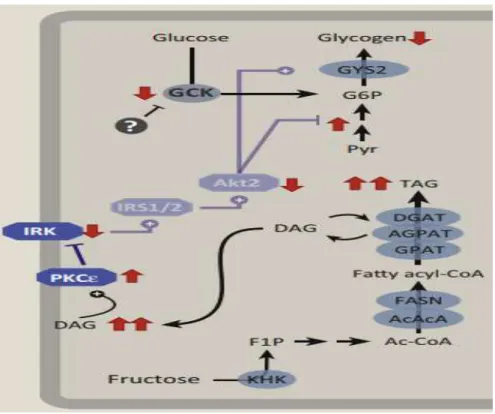
L’administration d’un régime riche en fructose peut entrainer une lipogenèse persistante et par conséquent le contenu hépatique en diacyglycérol (DAG) est augmenté, entraînant l'activation de la protéine kinase c-epsilon (PKCε). Cela nuit à l'activation du récepteur de l'insuline (IRK), en diminuant l'activation des kinases en aval, telles que le substrat-1/2 du récepteur de l'insuline (IRS1 /2) et l'Akt2, limitant ainsi la capacité de l'insuline à supprimer la gluconéogenèse et à activer la synthèse de glycogène (Herman et Samuel ,2016) (figure 10).
16
Figure 10: L'exposition chronique au fructose entraînera une résistance à l'insuline hépatique (Herman et Samuel, 2016)
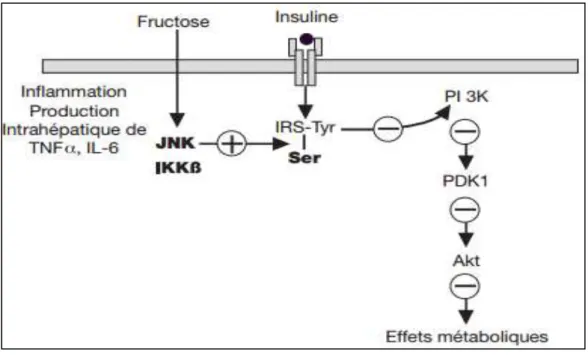
Un régime riche en fructose peut aussi entraîner une stimulation de l’inflammation et la production de cytokines pro-inflammatoires comme TNFα et IL-6. Ces cytokines activent des protéines kinases comme JUN et IIKβ qui phosphorylent le substrat du récepteur de l’insuline (IRS) sur des sérines. IRS phosphorylé sur des sérines est alors incapable de déclencher la voie de signalisation de l’insuline, ce qui se traduit par une diminution des effets métaboliques de l’insuline (insulinorésistance) (Girard, 2008) (figure 11).
17
Figure 11: Mécanismes par lesquels la consommation excessive de fructose induit une insulinorésistance hépatique (Girard, 2008)
Un autre mécanisme par lequel le fructose induit une altération de la sensibilité à l’insuline est que le métabolisme du fructose entraine une augmentation de l’acide urique, lui-même responsable d’une dysfonction endothéliale par diminution de la vasodilatation, pouvant conduire à une résistance tissulaire à l’insuline (Gninou, 2017).
4. Fructose et comorbidités neuropsychiatriques
Outre les altérations biologiques, le fructose est également un facteur de risque important de développer des troubles neuropsychiatriques, tels que des altérations cognitives et des troubles de l’humeur.
4.1 Fructose et altérations cognitives
Les effets du fructose sur la fonction cognitive restent un peu obscur. Des études plus anciennes suggèrent un effet protecteur similaire au glucose (Messier et White, 1987), mais l’augmentation récente de la consommation de fructose a entraîné une augmentation du nombre d’études portant spécifiquement sur les modifications de la mémoire et de la cognition liées aux éléments nutritifs, révélant ainsi un lien entre la consommation de fructose et des troubles cognitifs (Lowette et al., 2015).
18
La mémoire est une fonction complexe dépendante de l’intégrité de plusieurs structures cérébrales. En psychologie, il a été proposé de distinguer deux grands types de mémoire (Fourrier, 2016):
La mémoire à court terme : une mémoire active, impliquant à la fois le stockage temporaire (de l’ordre de quelques dizaines de secondes) d’informations de manière limitée en quantité, en vue de leur restitution immédiate dans une période inférieure à une minute (Bérubé, 1991). La mémoire à long terme : qui par opposition à la mémoire à court terme, est la capacité à retenir une information pendant une durée beaucoup plus importante (Fourrier, 2016).
L’insuline joue un rôle important dans le contrôle de la fonction synaptique du cerveau, renforce également les connexions synaptiques. Comme l'insuline peut traverser la barrière hémato-encéphalique, elle peut déclencher des processus neurologiques importants pour l'apprentissage et la mémoire ( Merkola, 2012) .
Consommer de grandes quantités de fructose peut entraîner une résistance à l'insuline dans le cerveau. En effet, de nombreuses études ont mis en avant le lien entre la sensibilité à l’insuline cérébrale et la fonction cognitive.
Au niveau du système nerveux central (Mielke et al., 2005) , un régime riche en fructose peut induire un défaut de phosphorylation de la tyrosine des neurorécepteurs à l’insuline et de leurs substrats (IRS-1), ainsi qu’une moindre phosphorylation de l’Akt cérébrale en réponse à l’insuline, qui pourraient être à l’origine d’une détérioration des fonctions synaptiques et une altération de la mémoire. L’inhibition de la kinase Akt entraînerait une déphosphorylation de la « glycogène synthase kinase-3» (GSK-3β) qui conduit à une hyperphosphorylation de la protéine « tau», processus impliqué dans l’apparition de la maladie d’Alzheimer (Noble et al., 2005; Schubert et al., 2004). De plus, en cas d’hyperglycémie, il se crée une compétition entre le peptide -amyloïde (A) et l’insuline, pour l’enzyme de dégradation de l’insuline, entraînant une accumulation de peptide A, conduisant à la formation de plaques séniles impliquées dans la maladie d’Alzheimer (Ho et al., 2004).
Malgré l’importance de son rôle, l’insulino-résistance ne semble pas responsable à elle seule de l’altération de la fonction cognitive due au fructose puisque l’inflammation pourrait, elle aussi, médier les effets du fructose sur le déclin cognitif et la neuro-dégénérescence.
19
En effet, l’inflammation induite par un régime riche en sucre est retrouvée au niveau cérébral, où les concentrations de certain cytokines pro-inflammatoires Akt au niveau de l’hippocampe ont été augmentées suite à la consommation d’un régime riche en fructose (Hsu et al., 2015) et inversement corrélées aux capacités cognitives. De plus, le cerveau dispose de peu de défenses anti-oxydantes, ce qui fait de lui un organe particulièrement sensible au stress oxydant. Or, la présence de ROS a également été associée au développement de maladies neurodégénératives. Elle favorise notamment l’agrégation des protéines anormales telles que les protéines tau et A, impliquées respectivement dans la maladie d’Alzheimer (Li et al., 2013 ).
4.2. Fructose et Troubles de l’humeur
En plus d’être un facteur de risque pour des altérations cognitives, le fructose est également associé à un plus grand risque de développer des troubles de l’humeur, regroupant à la fois les symptômes dépressifs et les troubles anxieux.
La dépression est un trouble mental qui affecte l’humeur d’une personne, les pensées et le comportement physique. Elle est caractérisée par la tristesse, l’angoisse et le ralentissement psychomoteur (De Perrot et Weyeneth, 2004)
Alors que l’anxiété est une émotion qui peut être décrite comme étant une peur anticipée. Contrairement à la peur qui survient face à un danger réel, l’anxiété se déclenche face à un danger potentiel, incertain. Elle peut donc exister en l’absence d’événements menaçants et sa cause n’est pas forcément consciente. L’anxiété se traduit également par des réactions physiologiques (accroissement de la pression artérielle, tachycardie, sueurs…) et comportementales (augmentation de la vigilance et des réponses d’évitement) voisines de celles de la peur (El Hage, 2012).
Il existe plusieurs explications biologiques plausibles pour une association de la consommation habituelle de fructose et du risque des troubles de l’humeur qui en découlent (Knüppel et al., 2017).Premièrement , la sérotonine (fréquemment appelée "l'hormone heureuse") comporte une grande variété de tâches , l' un d'eux consiste à agir en tant que neurotransmetteur, ce qui nous permet de nous sentir "heureux". La sérotonine est produite à partir du tryptophane, un acide aminé essentiel ou le corps ne peut synthétiser cet acide aminé lui-même mais doit le prendre à partir de la nourriture ingérée. Le tryptophane formera un complexe stable avec le fructose dans l'intestin et ne pourra donc pas être absorbé par l'organisme en présence d'une concentration élevée de fructose. Pour cette raison, de nombreux personnes atteintes de malabsorption du fructose ont un tryptophane insuffisant et,
20
partant, une quantité de sérotonine insuffisante. Le résultat sera, entre autres problèmes, un état de dépression. (Ledochowski et al ., 2000)
L’une des découvertes les plus récentes et les plus inattendues concernant les édulcorants artificiels comme le fructose est leur effet sur les bactéries intestinales, appelées collectivement microbiome qui est responsable de la fabrication de plus de 30 neurotransmetteurs, dont la sérotonine, le GABA, la dopamine et l'acétylcholine.
Un microbiome dysfonctionnel peut être à l'origine de l'anxiété, de la dépression et de nombreux autres troubles liés au cerveau. Les édulcorants artificiels changent notre microbiome, ce qui peut avoir un impact profond sur le cerveau, l’humeur et la santé mentale. Et cela dû à la présence de plus de 100 millions de neurones dans les intestins qui sont maintenant considérés comme un «second cerveau» ou «cerveau de secours» (Alban, 2019). Une autre hypothèse est que la consommation de glucides a été associée à une augmentation des marqueurs inflammatoires circulants, ce qui peut déprimer l’humeur (Kivimäki et al., 2014).
Enfin, l'obésité pourrait constituer un facteur de médiation entre un régime alimentaire riche en sucre et la dépression(Te Morenga et al., 2013) non seulement via des facteurs inflammatoires mais aussi psychosociaux, tels que la discrimination ( Jackson et al., 2015). 4.3. Fructose et stress oxydatif
L’administration de sucres simples, comme le fructose, présente un stress oxydatif pour l’organisme, accompagné d’une production importante des radicaux libres indépendamment d’une élévation de la glycémie (Le, 2008). Dès la première semaine d'un régime riche en saccharose ou fructose, différents marqueurs reflètent une aggravation du stress oxydant, et ce à travers une diminution du contenu en glutathion réduit (GSH) et des enzymes antioxydants (superoxyde dismutase, glutathion peroxydase, catalase) (Garait, 2006).
21
Chapitre III: Le chrome
1. GénéralitésLe chrome est un élément chimique de symbole Cr et de numéro atomique Z=24.C'est un métal d'une couleur blanc grisâtre. Son étymologie vient du grec chroma signifiant couleur, car les composés du chrome sont diversement colorés (Burdin, 2014). Le chrome présent de nombreux degrés d’oxydation. Il existe sous forme de nombreux espèces chimiques dont deux sont majoritaires :le chrome hexavalent VI, Cr6+
,
toxique mutagène, présent en particulier en milieu industriel et le chrome trivalent III, Cr, un oligoélément essentiel ayant un rôle dans le métabolisme du glucose, des protéines et des lipides. C’est sous cette forme qu’on retrouve le chrome dans l’alimentation, les compléments alimentaires et les spécialités pharmaceutiques (Cefalu et Hu, 2004).Les aliments les plus riches en chrome sont la levure de bière, le foie, le jaune d’œuf, les épices et les fruits oléagineux (noix, noisettes, amandes). Les céréales complètes, le chocolat noir, le café et le thé sont également sources de chrome. Au contraire, les produits laitiers, les fruits et légumes et surtout les produits raffinés ne contiennent qu'une faible teneur. Les apports nutritionnels conseillés (ANC) en chrome sont de 50 à 70 µg/jour pour l'adulte. et de 125 µg/jour pour les personnes à partir de 70 ans ((Burdin, 2014).
2. Métabolisme du chrome
Le chrome ne traverse la membrane cellulaire que de façon très limitée, par simple diffusion passive ou pinocytose. Cependant, bien que le processus d’absorption intestinale du chrome n’ait pas encore été clairement identifié, des mécanismes actifs sont également envisagés (Navarro Alarcόn et al., 2005).En effet, bien que limité, le taux d’absorption gastro-intestinale du Cr6+ est plus important que celui du Cr3+. Cependant le Cr (VI) étant rapidement réduit dans tous les tissus, la majorité du chrome présent dans l’organisme est sous la forme Cr (III) (Berner et al.,2004).
L'absorption d'origine alimentaire est très faible, entre 0,5 et 2% de la dose ingérée (Anderson et al.,1983). Une fois absorbé, le chrome est lié à la transferrine dans le sang et va se distribuer dans tout l'organisme : au niveau des os, du foie, de la rate, des poumons, des reins, des muscles et du tissu adipeux. Il peut être stocké pendant deux semaines dans les muscles et le tissu adipeux, et jusqu'à un an dans le foie et la rate. Enfin, l'excrétion rénale est la voie principale (à 80%), suivie par l'élimination biliaire (à 10%). L'excrétion urinaire peut
22
être amplifiée par l'apport de sucres d'absorption rapide, le stress ou l'exercice (Roussel et al., 2009).
3. Le chrome dans les compléments alimentaires
Le chrome est largement utilisé sous forme de compléments alimentaires. Dans les compléments, le chrome peut être apporté sous forme minérale (chlorure), de faible absorption modulée positivement par des facteurs tels qu’amino-acides ou acide ascorbique, ou bien sous forme organique biologique comme les levures, mieux absorbées. D'autres formes telles que pidolate, chrome-niacine, chrome histidine et le picolinate (Benaraba, +2007 ; Martin, 1998) .Ce dernier étant la forme la plus utilisée pour étudier les effets biologiques du Cr (Wiernspergeret, 2010).
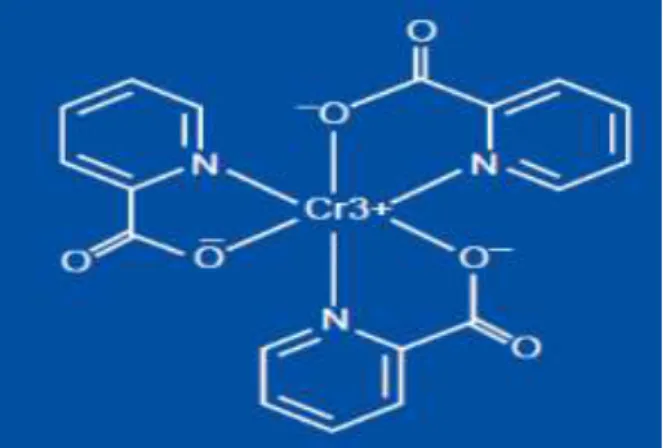
Le picolinate de chrome est un complexe de coordination formé par le Chrome trivalent chélaté avec trois molécules d'acide picolinique (Mozaffari et al.2009) (figure 12).
Le picolinate de chrome a également des effets positifs sur le taux de cholestérol, les maladies cardiovasculaires, la capacité antioxydante et anti-inflammatoire, ainsi que sur la dépression et l’anxiété, au-delà des modifications physiques (par exemple, modification de la composition corporelle (Volek et al., 2006; Abebe et al .,2010 ; Al-Rasheed et al.,2013 ; Dubey et al., 2015).
23
4. Chrome et altérations métaboliques
Il est bien établi que l’intervention nutritionnelle améliore considérablement la résistance à l’insuline. Le chrome a été postulé comme une telle intervention nutritionnelle basée sur des preuves dans des études chez l'animal et chez l'homme (Mertz, 1993). L'hypothèse est que l'amélioration de la résistance à l'insuline à la suite d'une telle intervention réduit les niveaux d'insuline et améliore le contrôle glycémique (Anderson et al., 1997).
4.1. Chrome et l’insulinorésistance
Le rôle du chrome dans le métabolisme du glucose a été souligné dès 1955 avec l'identification du facteur de tolérance au glucose (glucose tolérance factor: GTF) (Sreekanth
et al., 2008). Il s'agit d'une structure moléculaire complexe qui contient deux molécules
d'acide nicotinique par atome de Cr et trois acides aminés : la glycine, la cystéine et l'acide glutamique. Ce facteur joue le rôle de co-hormone de l'insuline et permet un transport vers les récepteurs cellulaires et la fixation de l'insuline sur les membranes par des ponts, disulfures. Tout d'abord, il va augmenter le nombre de récepteurs à l'insuline et renforcer la liaison insuline/récepteur. Il amplifie l'internalisation de l'insuline et améliore la sensibilité des cellules β. Enfin, il active la translocation des transporteurs du glucose Glut 4 et Glut 1, afin de libérer le glucose (figure 13).
Le chrome active également la tyrosine kinase, enzyme nécessaire aux réactions de phosphorylations de l'insuline, puis inhibe la phosphotyrosine kinase, qui inactive le récepteur à l'insuline. Il est responsable de l'augmentation de la phosphorylation du récepteur à l'insuline (Anderson, 1998).
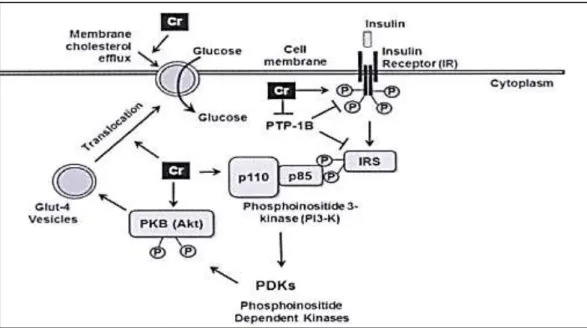
La régulation de la translocation de GLUT4 par le chrome peut être indépendante des protéines de signalisation insuline telles que l'IR, IRS-1, PI3-kinase, ou Akt (figure 14). Au lieu de cela, le chrome augmente la fluidité de la membrane en diminuant le taux de cholestérol membranaire (Hua et al., 2012).
24
Figure 13 : L’action de chrome sur la signalisation insulinique (Roussel, 2009)
1 :L’activation de la tyrosine kinase ; 2 : L’inhibition IR Phosphatase ; 3 : l’augmentation de
l’insuline Binding ; 4 :L’augmentation de nombre des récepteurs a l’insuline ; 5 : L’augmentation de la phosphorylation des IR ; 6 :L’augmentation de la phosphorylation IRS-1 ; 7 : l’activation du transport du glucose ; 8 : L’activation de la translocation des GLUT-4.
25
Le chrome fait partie d'un Système de glucose / insuline qui maintient le Contrôle de l'homéostasie glycémique dans l'organisme (Lamson et Plaza, 2002). Il peut fonctionner comme une partie de l'oligopeptide à faible poids moléculaire LMWCr (low-molecular-weight-chromiumbinding substance ou chromoduline) d'environ 1500 DA (Cefalu et al.,2004 ; Davis et Vincent, 1997) . Cet oligopeptide est composé de glycine, cystéine, acide glutamique, et de l'acide aspartique (Davis et Vincent,1997). Il a la capacité de se lier à quatre atomes de chrome et ne montre sa pleine activité biologique que sous cette forme
(Yamamoto et al 1989).Vincent et al. (1999) ont expliqué les mécanismes d'absorption des
ions chrome et d'activation du récepteur kinase de l'insuline par la chromoduline (Vincent,1999)
Selon le mécanisme proposé, LMWCr est présent dans le cytoplasme et le noyau des cellules sensibles à l’insuline sous une forme inactive appelée «apochromoduline». Lors de la liaison à l'insuline, le récepteur de la transferrine est activé, ce qui conduit en outre à l'internalisation du complexe chrome -transferrine dans la cellule. L'internalisation de ce complexe provoque l'activation de la pompe à protons dépendante de l'ATP, la diminution du pH, la libération de Cr de la transferrine et puis sa liaison par la chromoduline. Après la liaison de quatre atomes de chrome, une molécule de chromoduline est convertie en une "holochromoduline" biologiquement active qui est liée à la sous-unité bêta du récepteur de l'insuline, préalablement activée par l'hormone, entraînant l'activation du récepteur tyrosine kinase et l'amplification du signal d'insuline. En conséquence, l'activation du système de transduction du signal de l'insuline intracellulaire conduit à la co-localisation de la protéine GLUT4 (protéine 4 du transporteur de glucose) sur la membrane cellulaire. GLUT4 est le principal transporteur du glucose qui intervient dans le transport du glucose à travers la membrane cellulaire (Chen et al., 2006) (figure 15).
26
Figure 15 : L’action de chrome via la chromoduline (Moukarzel, 2009)
4. 2. Le chrome et déclin cognitif et dépressif
L’altération du métabolisme du glucose et la baisse de la sensibilité à l’insuline ont été mis en cause dans les troubles cognitifs et la dépression (Husaini et al., 2004 ; Rubin et
al.,2004). Suggérant que le système central de neurotransmetteurs monoaminergiques pourrait être impliqué dans l'effet antidépresseur du picolinate de chrome (Khanam et Pillai, 2006). Le picolinate de chrome administré dans de l'eau de boisson augmentait de manière significative les taux de sérotonine dans le cerveau tout en réduisant les taux plasmatiques de corticostérone (Dubey et al, 2015). le Cr pourrait être un candidat potentiel pour le traitement des affections qui coexistent avec des troubles du métabolisme du glucose, tels que la dépression et l'anxiété (Docherty et al., 2005).
Récemment, Krikorian et al, ont aussi rapporté les effets bénéfiques d’une supplémentation en chrome sur la mémoire et l’état dépressif de personnes âgées présentant un déclin cognitif.
27 4.3. Chrome et stress oxydatif
Paradoxalement, bien que la résistance à l’insuline soit une des principales causes de stress oxydant, le lien entre stress oxydant et résistance à l’insuline est peu pris en compte. Le chrome agissant comme potentialisateur de l’insuline et comme antioxydant pourrait être un élément clé de cette relation (Roussel, 2009). Plusieurs études d’intervention ont de plus rapporté un effet antioxydant de la supplémentation en chrome. Ces résultats suggèrent un effet antioxydant indirect qui passerait par la régulation des cytokines pro-inflammatoires et par celle de l’insulinémie, marqueurs biologiques dont l’élévation dans le sang est associée à l’élévation du stress oxydant (Roussel et Hininger, 2009).
Etude expérimentale
28 1. Matériel biologique et conditions d’élevage
Nous avons utilisé dans cette étude expérimentale des souris mâles de souche Wistar Albinos pesant entre 30 et 40 g provenant de l’institut pasteur Alger (Algérie).
Avant toute expérimentation, les animaux sont maintenus dans des cages (à raison de cinq animaux par cage) qui sont menues par des mangeoires et des biberons d'eau. Ils sont habitués aux conditions d’élevage pendant deux semaines : cycle contrôlé de lumière/obscurité (12 h/12h), température ambiante maintenue à (22°C ± 2°C), humidité 40%, nourriture et eau
ad libitum.
1.1. Produits utilisés
Dans notre travail, nous avons utilisé le fructose (20%) sous forme cristallisé dissout dans l’eau potable pour induire une insulinorésistance et le picolinate de chrome ; un supplément alimentaire sous forme de comprimé nu a été utilisé comme traitement.
1.2. Répartition et traitements des animaux
Après une période d'adaptation de deux semaines, les animaux ont été répartis en trois groupes expérimentaux (n = 5 souris par groupe) dont chacun d’entre eux est soumis à un régime différent pendant 4 semaines.
Groupe 1 : soumis à un régime alimentaire normal. (Lot témoin T)
Groupe 2 : soumis à un régime riche en fructose (20%) dans l’eau potable (Lot Fr), (Min Yang et al., 2018)
Groupe 3: soumis à un régime riche en fructose (20%) dans l’eau potable supplémenté par gavage gastrique en picolinate de chrome (100μg/kg). (Lot Fr+Cr), (Marmett et Nunes, 2016) .
La prise de poids est notée trois fois par semaine alors que le taux de consommation alimentaire et hydrique est évalué chaque jour. La glycémie à jeun est mesurée une fois avant le traitement et une fois chaque semaine pendant la période d’expérimentation (4 semaines).
29 2. Méthodes
2. 1.Tests neurocomportementaux
Trois tests neurocomportementaux ont été réalisés pour les trois groupes des souris (test de labyrinthe en Y, labyrinthe en croix surélevé, suspension caudale). La réalisation de ces différents tests a été effectuée avant le traitement, 8 jours après le début du traitement et à la fin du traitement sauf le test de suspension caudale qui a été effectué le 27ème jour de l’expérimentation.
Les expériences comportementales ont été réalisées le matin entre 8h30 et 12h. Pendant toute la durée de l’essai, nous sommes tenus à conserver un silence absolu et rester rigoureusement immobiles.
2.1.1. Évaluation de la mémoire à court terme par le test de labyrinthe en Y Principe
Le test de labyrinthe en Y permet de tester la mémoire à court terme dépendante de l’hippocampe (Fourrier, 2016). Il est basé sur la tendance naturelle des rongeurs à explorer d’une façon spontanée et alternée les différents bras du labyrinthe (Hughes,2004).
Dispositif et procédure
Le dispositif est un labyrinthe en forme de Y a trois bras identiques (25 ×14 ×5 cm), notés bras de départ, bras familier et le bras nouveau , séparés l’un de l’autre par un angle de 120° et convergeant vers un point central. (Youssef et al., 2008).
Le test comportemental se déroule en deux sessions, l’une d’acquisition, l’autre de rappel, séparé par un délai de rétention choisi de 30 min.
Lors de la session d’acquisition, l'un des bras a été fermé (bras nouveau) et la souris n'a pu explorer que deux bras pendant 5 min, le bras "de départ ", et le bras "Familier" (Figure 16). Lors de la session de rappel, qui a eu lieu après un délai de rétention de 30min, la souris est placée dans son précédent bras « bras de départ» et permettait un libre accès aux trois bras
pendant 5 min. Un animal qui se souvient des bras de départ et familier passera alors plus de temps à explorer le bras nouveau.
Les paramètres mesurés comprenaient le temps passé dans chaque bras, à partir duquel un indice de discrimination (ID) a été calculé selon:
BN: bras nouveau, BD: bras de départ, BF: bras familier
30
Un ID significativement plus élevée que le niveau de chance (33,33%) indique une reconnaissance (de Cossío et al 2017).
Figure 16 : Procédure comportementale dans le labyrinthe en y (photographie originale).
2.1.2. Evaluation du comportement de type anxieux par le test de labyrinthe en croix surélevé
Etant donné l’hétérogénéité et la complexité des symptômes de l’anxiété chez l’Homme, les tests utilisés chez les rongeurs ne permettent pas de modéliser la pathologie dans son ensemble mais plutôt des symptômes de façon individuelle. Les tests les plus couramment utilisés sont ceux basés sur le conflit entre la tendance à approcher un environnement nouveau et celle à éviter une zone potentiellement dangereuse (Fourrier, 2016).
Principe
Les comportements de type anxieux des animaux ont également été évalués dans le test du labyrinthe en croix surélevé (Fourrier, 2016).Ce test exploite le conflit, chez les rongeurs, entre la peur des espaces ouverts et le désir d’explorer un nouveau environnement, les bras fermés représentent la sécurité, alors que les bras ouverts offrent une valeur exploratrice. Un animal anxieux aura naturellement tendance à préférer les espaces clos et sombres au espaces ouverts et éclairés. Partant de ce principe, l’anxiété comportementale est mesurée par le degré d’évitement des espaces ouverts du labyrinthe. Ce modèle a été initialement décrit par Pellow et al (1985). BF BN BD Après 30 min
31 Dispositif et procédure
Le dispositif est en forme de croix (Figure),surélevé à 65 cm au-dessus du sol. Il comporte quatre bras opposés deux à deux ; deux de ces bras sont fermés par des parois (25 × 5 × 16 cm) tandis que deux autres sont ouverts (25 × 5 × 0,5 cm). Les bras sont reliés par une plate-forme centrale (5 cm × 5cm) (Komada et al, 2008) (Figure 17).
Les souris ont été placées individuellement dans la zone centrale du labyrinthe, face à un bras ouvert, et autorisées5 min d'exploration gratuite. Avant chaque test, l'arène était nettoyée avec de l’alcool (Guimarães et al.,2016).
Figure 17 : Schéma du labyrinthe en croix surélevé (photographie originale).
L'indice d'anxiété a été calculé selon Cohen et al., (2013), Contreras et al. (2014) comme suit:
Temps passé dans les bras ouverts Nombre d’entréesdans lebras ouvert
L’indice d'anxiété = 1 -
Durée du test Nombre total d'entrées
+
2
32
2.1. 3. Evaluation du comportement dépressif par le test de suspension caudale (TST) Principe
Le test de suspension caudale (TST) a été utilisé afin de déterminer le comportement de type dépressif. Le principe de ce test repose sur la mesure de la durée des mouvements déployés au cours d’une situation stressante, qui implique le stress hémodynamique d'être pendu de façon incontrôlable par leur queue. Après une phase d’agitation, l’animal cesse de bouger et se fige adoptant un comportement de désespoir, équivalent à un état dépressif chez l’homme. Le temps d’immobilité a été ainsi enregistré (Steru et al.,1985).
Procédure
le test de suspension caudale (TST) a été effectué Le 27ème jour de l’expérimentation, , les souris ont été suspendues pendant 6 min par un scotch doux (sparadrap)placé au bout de la partie caudale de l’animal (à 1cm du bout de la queue), sur le rebord d’une table, à une hauteur de 50cm (Figure 18), de tels qu’elles ne peuvent s’échapper, ou s’agripper sur les surfaces voisines (Steru et al., 1985).
Généralement, après une période de mobilité d’échappement, la souris s’immobilise et adopte un comportement dit de désespoir. Elle a été considérée être immobile quand elle n'a montré aucun mouvement du corps et pendu passivement.
La durée d'immobilité a été mesurée par un chronomètre pendant les 6 minutes du test.
33 2.2. Prélèvement des échantillons
2. 2.1. Prélèvement sanguin
Le sang est prélevé par décapitation sur des souris à jeun. Le sang est recueilli dans des tubes héparines, centrifugé à 3000 tours/minute pendant 10 minutes. Le plasma est recueilli conservé à -20°C en vue d’analyse d’un paramètre biochimique (l’insuline).
2. 2.2. Prélèvement des organes
Après la dissection, le foie, et le ceveau ont été prélevés, débarrassés de leurs tissus adipeux, rincés dans une solution de chlorure de sodium (NaCl) à 0.9%, puis pesés.
Les tissus destinés aux dosages des protéines, de glycogène, du MDA, du glutathion réduit et les enzymes antioxydantes (la catalase, la superoxyde dismutase et la glutathion peroxydase) ont été maintenus immédiatement à -20°c. Les tissus destinés à l’étude histologique ont été conservés dans une solution de formol tamponné.