HAL Id: hal-02785304
https://hal.inrae.fr/hal-02785304
Submitted on 4 Jun 2020
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Analyses de flux de sèves par RMN bas champs sur un
système modéle
Faïz Abdallah
To cite this version:
Faïz Abdallah. Analyses de flux de sèves par RMN bas champs sur un système modéle. Ingénierie des aliments. 2017. �hal-02785304�
ABDALLAH Faiz
ANALYSES DE FLUX DE SEVES PAR RMN BAS CHAMPS SUR UN
SYSTEME MODELE
Tuteurs INRA : Guilhem PAGES Amidou TRAORE Jean Marie BONNY
ABDALLAH Faiz
ANALYSES DE FLUX DE SEVES PAR RMN BAS CHAMPS SUR UN
SYSTEME MODELE
Tuteurs INRA : Guilhem PAGES Amidou TRAORE Jean Marie BONNY
INRA-Centre Auvergne-Rhône-Alpes
REMERCIEMENTS
Tout d’abord, je tiens à remercier l’équipe d’AgroResonance de l’INRA de Theix pour m’avoir accueillie durant ces trois mois de stage à travers lesquels j’ai pu notamment acquérir des connaissances et de compétences en RMN bas-champ.
La présentation de ce rapport me donne l’occasion de remercier tout particulièrement mes deux maitres de stage Mr Guilhem PAGES et Amidou TRAORE ainsi que mon directeur de stage, Mr Jean Marie BONNY d’abord pour leur accueil convivial et ensuite pour le temps qu’ils m’ont consacré tout au long de ce stage. Leur encadrement, soutien et précieux conseils m’ont permis de mener à bien ce projet.
Je voudrais aussi remercier mon tuteur de stage Mr Pascal GUILLO qui a su répondre à mes questions et a suivi l’évolution de ce stage.
Pour finir, je voudrais porter une attention particulière à toute l’équipe pédagogique de l’IUT PAUL SABATIER de CASTRES ainsi qu’à l’ensemble des intervenants professionnels du département Chimie.
INRA-Centre Auvergne-Rhône-Alpes
RESUME
Avec le dérèglement climatique, les évènements climatiques extrêmes (chaleurs, pluie, …) sont de plus en plus fréquents. Pour comprendre et prédire la résilience des plantes à ces périodes de stress, il est indispensable de connaitre les mécanismes de protection et de reprise d’eau à l’échelle individuelle. Or, actuellement il n’existe aucune méthode analytique pour réaliser de telles mesures dans l’environnement. L’objectif du projet dans lequel s’inscrit mon stage est de mettre en place une méthode analytique basée sur la résonance magnétique nucléaire (RMN) bas champs pour pouvoir effectuer des mesures in-situ et non-invasives sur les plantes pour répondre à des problématiques agro-écologiques.
Durant mon stage, il m’a été confié deux missions : (1) la calibration de l’instrument avec lequel j’allais effectuer les mesures et (2) de faire les mesures de flux sur un système modèle. Ma première mission a donné lieu à la rédaction d’un mode opératoire qui a été intégré dans le système de management qualité de la plateforme. Pour ma deuxième mission, mon système modèle était composé d’un tube en caoutchouc à l’intérieur duquel circulait de l’eau. J’ai démontré qu’un signal RMN provenait du tube en caoutchouc. En exploitant la différence dans le temps de relaxation T2 entre l’eau et le caoutchouc, il est possible d’observer sélectivement chacun des signaux RMN. L’étude du signal RMN en fonction de la profondeur nous a permis d’imager l’intérieur du tube. En ajoutant un codage et décodage de la position spatiale des molécules, nous avons obtenu des propagateurs de vitesse pour l’eau circulant à l’intérieur du tube. Les résultats obtenus en fonction de la profondeur de mesure correspondent à ceux qui étaient attendus pour un flux laminaire. Mon travail a permis de réaliser les premières mesures de flux sur le nouvel appareil de la plateforme, le prochain travail sera de mesurer les flux sur les arbres dans les champs.
Mots clés : Agro-écologie Calibration Flux Relaxométrie RMN Bas champ
INRA-Centre Auvergne-Rhône-Alpes
ABSTRACT
Climatic changes lead to more and more extreme climatic events like hydric stress or heavy rain. Understanding plant resilience mechanisms is a key point to manage ecosystems and predict the effect of extreme events. However, it does not exist an analytical tool allowing such study directly in the ecosystem (i.e., in-situ). The global aim of the project is to set up a non-invasive and in-situ analytical method based on low field nuclear magnetic resonance (NMR) to measure water content and flow in plants.
During my internship, I was given two missions. First, I had to calibrate the spectrometer and second, to measure flow in a model system. For the first part of my work, I produced modus operandi which was registered inside the platform quality management system. In the second one, I developed a model system based on a rubber line pipe in which water was flowing. I demonstrated that the rubber line pipe gave an NMR signal with a short relaxation time T2. Contrasting the measurement thanks to the T2 difference between both species, it was possible to selectively observe each NMR signals. I obtained an image of the water inside the rubber pipe. By spatially labeling the spins, I measured flow rate. The maximum and averaged flow rates were in accordance with what was expected. Furthermore, the image of the flow rate showed a parabolic profile as expected under laminar flow conditions.
I measured the flow with this new spectrometer. As my results were encouraging, the following experiments will be to measure the flow in a real tree.
Keys words : Agro-ecological Calibration Flow Low fied NMR Relaxiometry
INRA-Centre Auvergne-Rhône-Alpes
SOMMAIRE
REMERCIEMENTS ________________________________________________________________ 2 RESUME _______________________________________________________________________ 3 ABSTRACT _____________________________________________________________________ 4 ABREVIATIONS __________________________________________________________________ 6 INTRODUCTION _________________________________________________________________ 7 PRESENTATION DE L’INRA _________________________________________________________ 8 PRESENTATION DU PROJET _______________________________________________________ 11 I. Problèmes posés : __________________________________________________________ 11I.1 Comment rendre la RMN portable : ________________________________________________ 11 I.2 Applications dans le monde végétal : _______________________________________________ 11
II. La RMN bas champ : ________________________________________________________ 14
II.1 Description du NMR MOUSE : ___________________________________________________ 14
II.2 Quelques notions théoriques sur les temps de relaxation : ____________________________ 15
III. Travail effectué : ___________________________________________________________ 17
III.1 Calibration de l’appareil ________________________________________________________ 17
III.1.1 Mesure de la durée de l’impulsion à 90 ___________________________________________________ 18 III.1.2 Détermination du temps d’écho minimum ________________________________________________ 18 III.1.3 Réglage de la profondeur : _____________________________________________________________ 18 III.1.4 Récapitulatif de l’ensemble des mesures :_________________________________________________ 19
III.2 Mesure de flux dans un système modèle __________________________________________ 20
III.2.1 Caractérisation des éléments composant le système ________________________________________ 20 III.2.2 Profil du système modèle : _____________________________________________________________ 21 III.2.3 Mesures de flux : _____________________________________________________________________ 22 III.2.4 Profil de la vitesse : ___________________________________________________________________ 23
III.3 Premières mesures sur un arbre : ________________________________________________ 24
III.3.1 Profil de l’arbre : _____________________________________________________________________ 25
CONCLUSION __________________________________________________________________ 27 REFERENCES ___________________________________________________________________ 28 TABLE DES ILLUSTRATIONS _______________________________________________________ 29 ANNEXES _____________________________________________________________________ 32
INRA-Centre Auvergne-Rhône-Alpes
ABREVIATIONS
CEPIA: Caractérisation et Elaboration des Produits Issus de l’Agriculture INRA: Institut National de la Recherche Agronomique
IRM: Imagerie par Résonance Magnétique QuaPA : Qualité Produit Animaux
RF : Radio Fréquence
INRA-Centre Auvergne-Rhône-Alpes
INTRODUCTION
Le monde du vivant a vu le jour grâce à la présence d’eau sur Terre. Cet élément est indispensable à tout système biologique aussi bien animal que végétal. Chez les végétaux, l’eau influence profondément la capacité à produire ainsi que la qualité de cette production. Le flux d’eau dans la plante se fait via la sève brute (constituée principalement d’eau et de sels minéraux). Au cours de périodes de sécheresse, ce flux est significativement altéré.
Avec le réchauffement climatique, les stress hydriques sont de plus en plus fréquents que ce soit pour les communautés végétales prairiales ou les arbres. Le manque d’eau induit par une sécheresse, même ponctuelle, peut avoir des conséquences dramatiques voire irréversibles sur les récoltes et sur le fonctionnement de l’écosystème. Malgré les avancés récentes, il existe un manque de connaissances des mécanismes de protection de la plante face à la déshydratation ainsi que sur les processus de réhydratation au cours de périodes de sécheresse. La caractérisation de la quantité et de l’état de l’eau sans dégrader les écosystèmes est donc primordiale tant pour les sciences et les industries agricoles que pour l’écologie. En effet, une meilleure compréhension de ces phénomènes permettra de mieux appréhender les besoins en eau des végétaux et de mettre en place les outils appropriés d’aide à la décision.
Cependant, ce challenge reste difficile à relever à cause du manque de techniques analytiques adaptées. En effet, les moyens analytiques actuels servant à la mesure du flux de sève sont soit invasifs soit trop compliqués à mettre en œuvre in situ. Le développement et la validation d’un instrument de mesure pour estimer à la fois localement et in situ les flux de sèves seraient une étape clef dans ce défi.
Le caractère non invasif et non destructif de la Résonance Magnétique Nucléaire (RMN) en fait une technique analytique de choix pour étudier l’eau et ses propriétés : état de liaison, concentration, mobilité … Son application en imagerie (IRM), où elle est devenue un outil de diagnostic majeur, est un bon exemple de sa puissance analytique. L’IRM serait donc une technique idéale pour étudier les flux de sève ainsi que les propriétés dynamiques de l’eau. Cependant, l’application in situ aux plantes de cette approche est largement compromise par la taille et le poids des équipements actuels. Aujourd’hui, certains constructeurs proposent des appareils IRM bas champs qui ont l’avantage d’être portables et donc plus aptes pour répondre à la problématique posée. La plateforme AgroResonance a décidé d’investir dans un appareil IRM transportable, le NMR MOUSE, pour aborder des problématiques agro-écologique.
Ma mission au sein de la plateforme s’est inscrite dans le cadre de ce projet. Mes tâches ont été de deux ordres. Tout d’abord, j’ai réceptionné, installé et calibré l’appareil IRM pour ensuite étudier la sensibilité de l’instrument lors de la mesure de flux.
INRA-Centre Auvergne-Rhône-Alpes
PRESENTATION DE L’INRA
L’Institut national de la recherche agronomique (INRA)
L’INRA est le premier institut de recherche agronomique en Europe et le deuxième en sciences agricoles au niveau mondial. Les thématiques de recherche de l’INRA sont au service d’enjeux de taille pour la société : alimentation, agriculture et environnement. Ses missions sont diverses et variées en allant par exemple de la prévention des zoonoses1 à la mise en place d’une alimentation saine et durable.
L’INRA publie environ 4100 articles dans des revues scientifiques chaque année. Son budget annuel est de 881 millions d’euros, dont 77% en provenance du ministère chargé de la Recherche. Cet organisme de recherche est constitué d’environ 8200 agents titulaires, dont un peu plus de 50% de femmes et 1815 chercheurs titulaires. L’INRA participe à la formation par la recherche en accueillant environ 2600 stagiaires dont 500 doctorants chaque année.
Les forces de recherche de l’INRA se déclinent dans 250 unités de recherche et 48 unités expérimentales. Ces entités sont organisées scientifiquement autour de 14 départements de recherche, reparties géographiquement sur 17 centres implantés sur tout le territoire, y compris en outre-mer.
En terme d’innovation, l’institut dépose chaque année une trentaine de nouveaux logiciels, crée une douzaine de nouvelles variétés végétales et possède 354 brevets (dépôt d’une cinquantaine chaque année).
Le Centre Auvergne-Rhône-Alpes
L’unité Qualité des Produits Animaux (QuaPA) au sein de laquelle j’ai effectué mon stage est implantée sur le site de Theix du Centre INRA Auvergne-Rhône-Alpes. Ce centre est un pivot pour l’INRA, puisqu’il est le troisième de ses 17 centres de recherches en nombre de personnel. En effet, il rassemble 10% de l’effectif total de l’institut soit environ 1000 agents permanents, réparties dans 30 unités de recherche, expérimentales ou d’appui. Ces unités relèvent de 13 des 14 départements scientifiques de l’INRA. Le budget annuel du centre est d’environ 80 millions d’euros.
Les thématiques de recherche développées sur le centre sont multidisciplinaires et s’insèrent dans une large gamme allant des ressources biologiques (animales, végétales, microbiennes) au territoire en passant par le produit et l’Homme.
INRA-Centre Auvergne-Rhône-Alpes
Le Département Caractérisation et Elaboration des Produits Issus de l’Agriculture (CEPIA)
Le département CEPIA, auquel appartient l’unité QuaPA, réuni plus de 500 chercheurs et enseignants-chercheurs répartis sur une douzaine de régions dans 23 laboratoires. Ses études sont basées sur les processus (chimiques, biologiques, …) mis en jeu lors de la transformation de matières premières. Les domaines de recherche sont vastes et concernent notamment les domaines de l’alimentation (pain, fromage, jus de fruit, etc…) et des produits alimentaires (colorants, aromes, texturants), des matériaux (composites à base de chanvre par exemple ou plastiques végétaux) ou encore des molécules pour la chimie (tensioactifs, colles), l’énergie (biocarburants), ou la pharmacie (principe actifs).
L’unité QuaPA
L’unité QuaPA a été constituée en 2005. Elle est rattachée au département CEPIA et est située sur le site de Theix du Centre INRA Auvergne-Rhône-Alpes. Elle comprend 36 permanents et accueille régulièrement une dizaine de doctorants et post doctorants.
Les objectifs scientifiques de l’unité permettent de mieux répondre à certains défis sociétaux. En effet, il s’agit d’approfondir les adaptations nécessaires à la transition alimentaire mondiale, plus particulièrement aux besoins en protéines, à la durabilité des systèmes de production, et aux besoins de certaines populations ciblées (séniors, sportifs…). Pour répondre à ces objectifs, l’unité QuaPA concentre ses recherches selon deux axes :
La conception d’aliments spécifiques. Ceci demande de tenir compte de leur acceptabilité et de leur devenir après ingestion. La conception raisonnée de nouveaux aliments passe aussi par l’élaboration, l’analyse et la représentation de systèmes modèles ou réels ;
L’amélioration de la durabilité des systèmes alimentaires dans un contexte de transition. Cette amélioration est réalisée au travers des recherches de l’unité sur la sécurité chimique des produits, la limitation des pertes en produits d’origine animale et les coproduits animaux.
Le projet est mis en œuvre dans le cadre de la structure de QuaPA en trois équipes de recherche disciplinaires :
- Imagerie et Transfert (IT) ;
- Micro-contaminants, Aromes et Sciences Séparatives (MASS) ; - Biochimie et Protéines du Muscle (BPM).
L’unité gère également deux plateformes analytiques : - AgroResonance ;
INRA-Centre Auvergne-Rhône-Alpes La plateforme AgroResonance
Mon stage s’est déroulé au sein de la plateforme analytique AgroResonance. Une plateforme analytique est un ensemble composé de personnels qualifiés autour d’un équipement de haut niveau technologique ouvert à la communauté scientifique. AgroResonance est spécialisée en imagerie et spectroscopie RMN et répond à des questions de recherche dans les domaines de l'agroalimentaire, du végétal, de la nutrition et de la santé. Elle collabore aussi bien avec la communauté scientifique (CNRS, Facultés, CHU, …) qu’avec les entreprises privées.
De par son rattachement à l’unité QuaPA, la plateforme mène des recherches sur des matrices agro-alimentaires. De par son organisation en plateforme, elle travaille également sur des systèmes biologiques variés et plus particulièrement sur des modèles animaux pour lesquels elle dispose d’un savoir-faire spécifique (anesthésie et suivie des animaux, soins pré-post-opératoires). L’équipe est pluridisciplinaire et comprend actuellement 6 agents INRA, une ingénieure du CHU et deux doctorants.
La plateforme AgroResonance est équipée de trois spectromètres de RMN de dernière génération permettant de couvrir une large gamme d’application en imagerie ou spectroscopie RMN. Le Tableau 1 résume les principales caractéristiques de chacun des aimants.
Tableau 1 : Comparaison des différents spectromètres disponibles sur la plateforme.
Ayant constaté une forte demande dans l’analyse de végétaux directement dans les champs, AgroResonance a décidé d’acheter un appareil IRM bas champ transportable. La plateforme s’est orientée vers un spectromètre commercialisé par Magritek et dénommé NMR MOUSE.
Biospec 47/40 Avance 400 Biospec 117/16 Champ magnétique 4.7 T 9.4 T 11.7 T
Orientation Horizontale Verticale Horizontale
Fréquence 1H 200 MHz 400 MHz 500 MHz
Résolution moyenne ~1 mm ~10 µm ~100 µm
Application typique réalisée sur la Plateforme
Imagerie sur un large champ de vue avec éventuellement
des contraintes physico-chimique (saumon, jambon, …)
Micro-imagerie et spectroscopie in-vitro (tissus
fixés, plantes, …)
Imagerie et spectroscopie localisée in vivo chez le petit
animal
Taille maximale de
INRA-Centre Auvergne-Rhône-Alpes
PRESENTATION DU PROJET
I. Problèmes posés :Mon stage a coïncidé avec l’arrivée sur la plateforme d’un spectromètre IRM bas champ appelé NMR MOUSE. Au cours de mon stage, deux problématiques m’ont été proposées. La première a consisté en la réception, l’installation et l’acceptance du matériel acheté grâce à la réalisation de tests de calibration. Ma seconde mission a consisté à tester la sensibilité de la mesure de flux sur cet appareil. En effet, la mesure du flux est une option unique, réalisée à la demande de la plateforme par le fabriquant. Il est donc important dans un premier temps d’acquérir des connaissances basiques sur cette option.
Avant de rentrer dans le détail de mon travail de stage, une étude bibliographique sur les applications in-situ de la RMN dans le monde végétal va être effectuée.
I.1 Comment rendre la RMN portable :
La découverte de la RMN a été faite en 1938 par le physicien austro-hongrois Isidor Isaac RABI. Les premières mesures ont été réalisées de façon indépendante par Felix Bloch et Edward Mills Purcell en 1946. Au fil des années, cette technique a su s’imposer et aujourd’hui elle occupe une place importante dans notre quotidien comme nous pouvons le constater à travers de nombreuses applications telles que l’imagerie médicale, la spectroscopie moléculaire, … . A travers ces applications, la RMN est utilisée à haut champ magnétique (de 1 T pour les imageurs médicaux les plus vieux jusqu’à 23,5 T pour le spectromètre RMN ayant le champ magnétique le plus élevé) pour augmenter sa sensibilité dans le macroscopique comme le microscopique. C’est cependant ce haut champ magnétique avec une excellente homogénéité qui nécessite un équipement encombrant, onéreux et lourd, ainsi que la présence d’un personnel qualifié pour son utilisation et son entretien. Pour « alléger » la RMN, il est indispensable de diminuer le champ magnétique pour travailler avec de petits et légers aimants permanents. Cette diminution du champ magnétique entraine une perte de sensibilité et de résolution. Avec ce type d’appareil, seules les molécules d’eau, présentent en grande concentration dans les échantillons biologiques sont observables et seules des mesures de relaxation peuvent être réalisées.
I.2 Applications dans le monde végétal :
De par sa sensibilité aux noyaux d’hydrogène et grâce à la forte concentration en eau dans les échantillons biologiques, l’IRM est une méthode de choix pour aborder les questions liées au stress hydriques dans les plantes. Par exemple, il a été montré par IRM que l’état hydrique du bourgeon ainsi que ses connections avec le xylème est un élément clé déterminant la capacité du bourgeon à récupérer d’une sécheresse extrême [1]. Toutefois, de telles études ne sont possibles que lorsque le matériel végétal a été extrait de son milieu naturel pour être transporté jusqu’au laboratoire.
INRA-Centre Auvergne-Rhône-Alpes
Pour conserver les interactions entre le matériel végétal et son environnement, il faudrait « sortir la RMN du laboratoire ».
Quelques études ont été réalisées dans ce sens avec des aimants prototypes développés à façon dans des laboratoires de recherche (Figure 1). Nous pouvons par exemple citer le « Tree Hugger » [2] qui est un aimant ayant une forme de C ou le « NMR-CUFF » [3], un aimant fermé pouvant s’ouvrir sans appliquer trop de force (aimant Hallbach cylindrique).
Figure 1 : Représentation schématique du Tree Huger (gauche) et du NMR Cuff soit en position d’analyse (c’est-à-dire fermé, au centre), soit en position ouverte (droite).
Ces deux systèmes ont été utilisés pour réaliser des études in-situ sur le cycle de l’eau dans les plantes. Ces études ont permis de démontrer que l’apport en eau était directement lié à la luminosité. Par exemple, la figure 2 montre l’évolution du signal RMN enregistré avec le NMR Cuff dans un arbre. Le signal RMN est corrélé avec le cycle lumineux (barres noires pour la nuit et blanches pour le jour). Il apparait clairement que l’arbre refait ses réserves en eau au cours de la nuit. Des résultats similaires ont été obtenus avec le Tree Huger.
INRA-Centre Auvergne-Rhône-Alpes
Figure 2 : Signal RMN enregistré dans un tronc d’arbre avec le NMR CUFF en fonction du temps. La luminosité est représentée par les barres noires et blanches pour la nuit et le jour, respectivement. L’augmentation du signal RMN est directement corrélée avec l’ensoleillement.
Même si des résultats prometteurs ont été obtenus avec ces types d’appareil, des limitations de deux types peuvent facilement être mis en évidence. Tout d’abord, ces équipements sont des prototypes fabriqués à façon et il n’est pas aisé de s’en procurer un. Ensuite, la taille du matériel biologique qui peut être étudié est limitée par l’entraxe de l’aimant. Pour des versions portables, le diamètre maximum de la plante ne peut être que de quelques millimètres.
Une troisième technologie pour réaliser de l’IRM à bas champ est commercialement disponible, il s’agit d’un aimant plan à la surface duquel l’échantillon est directement posé. Cette solution ne présente aucune limitation quant à la taille ou la forme du matériel qui peut être étudié. De plus, grâce à l’inhomogénéité du champ magnétique perpendiculairement à la surface de l’aimant, seul une coupe de quelques dizaines à quelques centaines de micromètres d’épaisseur sera enregistrée. En fixant cet aimant sur un ascenseur de haute précision (déplacement minimum de 10 µm), il est possible d’étudier les propriétés de l’eau en fonction de la profondeur. Cet équipement commercialisé par la société Magritek® est nommé NMR MOUSE. Plusieurs exemples d’applications ont montré l’intérêt du NMR MOUSE : pour suivre le séchage du béton dans des constructions [5], pour étudier, sans les dégrader, les caractéristiques des peintures dans des représentations murales [6] ou encore pour dater des momies [7]. Tandis que dans sa version commerciale cet appareil permet de réaliser des études dans la direction de la profondeur, il n’est pas approprié pour mesurer des flux dans les arbres dont la direction serait parallèle à la surface de l’aimant. Pour effectuer de telles mesures, il est nécessaire d’ajouter une bobine de gradients de champs magnétiques. Une telle solution technologique est possible à mettre en œuvre comme démontré par la preuve de concept effectuée il y a une quinzaine d’années [8,9].
C’est cet appareil qu’a acheté AgroResonance sur lequel une bobine de gradients parallèle à la surface de l’aimant a été ajoutée. Ainsi avec cet équipement, les membres de la plateforme veulent aborder les questions agro-écologiques sans limitation intrinsèque sur la taille ou la forme de l’échantillon, avec une bonne résolution spatiale et avec la possibilité, unique au monde, de mesurer les déplacements ordonnés dans les végétaux.
INRA-Centre Auvergne-Rhône-Alpes
II. La RMN bas champ :
II.1 Description du NMR MOUSE :
Le NMR Mouse est un spectromètre RMN constitué d’un aimant bas champ à 0.3 T et d’une console RMN portable. Le champ magnétique généré par l’aimant est fortement inhomogène dans la direction perpendiculaire à la surface de l’aimant (axe z). Cette inhomogénéité qui est un inconvénient à haut champ magnétique est utilisée ici comme un gradient de sélection de coupe. En effet, seul les noyaux situés à une certaine distance de l’aimant seront excités. L’aimant est monté sur un ascenseur qui permet de faire varier sa position. Grâce au déplacement de l’aimant et à la sélection de coupe, il est possible d’étudier de manière non-invasive l’échantillon en fonction de la profondeur avec une bonne sélectivité spatiale (50-100 µm).
De par son faible champ magnétique, seules les molécules d’eau sont détectées par cet appareil. Il est possible d’étudier les caractéristiques locales de l’eau : quantité, relaxation et diffusion. La mesure la plus utilisée est la relaxation T2 qui rend directement compte de l’interaction de l’eau avec son environnement (voir paragraphe suivant). Pour pouvoir mesurer les flux dans les arbres dont la direction sera parallèle à la surface de l’aimant, il est nécessaire d’ajouter une bobine de gradients
de champ magnétique. Une telle bobine permet de coder spatialement la position des molécules puis de la décoder pour en extraire des informations sur le déplacement.
Gradient
Aimant
Ascenseur
Console RMN Echantillon
INRA-Centre Auvergne-Rhône-Alpes
Figure 3 : Photo du NMR MOUSE utilisé lors de mon stage. L’aimant est posé sur un ascenseur haute résolution pour mesurer le signal RMN à différentes profondeurs.
II.2 Quelques notions théoriques sur les temps de relaxation :
Lors d’une expérience de RMN, les spins (1H par exemple) d’un échantillon placé dans ou sur l’aimant sous l’influence du champ magnétique statique B0 s’orientent parallèlement ou antiparallèlement à ce champ : on parle de levée de dégénérescence des niveaux énergétiques. L’excès de spins orientés parallèlement à B0 se traduit par l’apparition d’une aimantation nucléaire macroscopique M0 alignée avec B0. Celle-ci peut être écartée de sa position d’équilibre au moyen d’impulsions radiofréquences (RF) brèves générées par un champ magnétique B1 perpendiculaire au champ statique B0. L’aimantation nucléaire peut ainsi être manipulée à volonté. Dans la plupart des expériences, elle est soit inversée (impulsion à 180° ou π), soit amenée dans le plan de mesure perpendiculaire à B0 (impulsion à 90° ou π/2) où l’amplitude du signal RMN enregistré aux bornes de la bobine de détection sera maximale. Après l’arrêt de la perturbation (B1), l’aimantation nucléaire est animée d’un mouvement de précession autour de B0 à la fréquence de Larmor ou de résonance ν0.
Temps de relaxation
La relaxation de l’aimantation de spin correspond à l’ensemble des phénomènes qui ramène l’aimantation vers sa position d’équilibre après l’avoir préalablement perturbée. Pour comprendre le retour à l’équilibre de l’aimantation après l’avoir perturbée, un repère d’axe z colinéaire à la direction du champ magnétique statique B0 est généralement défini.
Lorsque l’aimantation est écartée de sa position d’équilibre, après avoir été soumise à un champ RF, la projection du vecteur aimantation laisse apparaître une composante Mz dirigée selon l’axe z, qualifiée d’aimantation longitudinale et une composante Mx,y contenue dans le plan (x, y), dite aimantation transversale (Figure 4).
INRA-Centre Auvergne-Rhône-Alpes
Figure 4 : Aimantation nucléaire à l’équilibre (gauche) et après perturbation (droite). Après perturbation, l’aimantation est décomposée avec sa partie longitudinale (Mz) et transversale (Mx,y) ainsi que sa fréquence de précession de Larmor0.
Le retour à l’équilibre thermodynamique de l’aimantation nucléaire est assuré par la disparition de l’aimantation transversale dans le plan (x, y) et la reconstruction de l’aimantation longitudinale selon l’axe z. Ces deux processus sont totalement disjoints et sont respectivement caractérisés par deux constantes de temps : le temps de relaxation transversal T2 (temps de relaxation spin-spin) et le temps de relaxation longitudinal T1 (temps de relaxation spin-réseau) et dont les valeurs peuvent s’étendre de quelques millisecondes à plusieurs dizaines de secondes. La figure 5 est une représentation théorique de l’évolution de l’aimantation dans les plans longitudinal et axial.
Figure 5 : Allure théorique de l’évolution de l’aimantation après une perturbation en fonction du temps
0 1 2 3 4 5 6 7 8 9 10 11 0 2 4 6 8 10 12 intensité temps (ms)
T
1T
2
INRA-Centre Auvergne-Rhône-Alpes
III.
Travail effectué
:III.1 Calibration de l’appareil
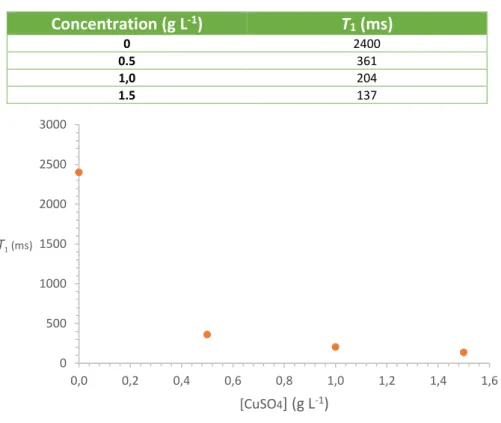
Il est important de pouvoir réaliser les opérations de calibration à la fois rapidement et dans des conditions quantitatives. Pour cela, les spectroscopistes utilisent de l’eau dopée. Cela consiste à ajouter un sel paramagnétique à l’eau pour diminuer le temps de relaxation T1 et ainsi pouvoir diminuer le temps de répétition (pour des conditions quantitatives, le temps de répétition doit être ≥ 5x T1).
Tableau 2 : Valeurs du temps de relaxation T1 en fonction de la concentration en CuSO4.
Concentration (g L-1) T 1 (ms) 0 2400 0.5 361 1,0 204 1.5 137
Figure 6 : Evolution du temps de relaxation T1 en fonction de la concentration en sulfate de cuivre.
Au regard de ces résultats, j’ai choisi de travailler pour réaliser les calibrations avec de l’eau dopée à 1.0 g L-1. Les opérations de calibration sont réalisées pour chaque configuration en 5 étapes :
Réglage la durée de l’impulsion RF ; Réglage du temps d’écho minimum ; Ajustement de la profondeur ;
Réglage du temps de décalage de l’écho ; Mesure du bruit.
Pour réaliser ces différentes étapes, j’ai produit un mode opératoire qui a été ajouté dans le système de management de la qualité ISO 9001 de la plateforme (annexe 1).
Dans mon rapport, je ne détaillerai que les opérations les plus critiques, à savoir les 3 premières.
0 500 1000 1500 2000 2500 3000 0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 T1(ms) [CuSO4] (g L-1)
INRA-Centre Auvergne-Rhône-Alpes
III.1.1 Mesure de la durée de l’impulsion à 90
Pour obtenir le signal maximal en RMN, les spins doivent être basculés d’un angle de 90° par rapport à leur état de relaxation. Pour réaliser cette mesure, j’ai fait varier la durée de l’impulsion RF puis j’ai observé l’évolution de l’intensité du signal en fonction de la durée de l’impulsion (Figure 7).
Figure 7 : Intensité du signal RMN en fonction de la durée de l’impulsion RF.
La détermination de la durée de l’impulsion RF se fait directement à partir de la Figure 7 en lisant la durée pour laquelle l’intensité maximale a été obtenue. Dans cet exemple, la durée de l’impulsion à 90° a été mesurée à 9 µs.
III.1.2 Détermination du temps d’écho minimum
Le but de ce réglage est de déterminer le temps minimum entre deux impulsions RF. Ce délai est nécessaire pour dissiper des courants résiduels dus aux impulsions avant de pouvoir enregistrer le signal RMN.
Pour cela et en absence d’échantillon, nous allons diminuer le temps d’écho jusqu’à obtenir du signal provenant du courant résiduel de notre impulsion RF. La Figure 8 illustre le principe de la méthode avec à gauche le signal qui doit être observé (du bruit) et à droite le signal enregistré lorsque le délai entre les impulsions RF est trop court.
Figure 8: Signal observé avec un temps d’écho assez long (gauche) et trop court (droite) pour dissiper les courants résiduels III.1.3 Réglage de la profondeur :
INRA-Centre Auvergne-Rhône-Alpes
La profondeur de la mesure affichée par le logiciel doit être calibrée pour correspondre à la profondeur réelle. Pour ce faire, l’épaisseur d’une boite de pétrie est mesurée. Le signal RMN en fonction de la profondeur est ensuite enregistré. Une perte de signal est attendue à la profondeur correspondant à l’épaisseur de la boite de pétrie.
La boite de pétrie utilisée avait une épaisseur de 800 µm. Le profil enregistré avec les paramètres par défaut a montré une perte du signal RMN à une profondeur de 1250 µm (figure 9 gauche). Après une correction de la profondeur maximale de mesure dans le logiciel (-450 µm), un nouveau profil est enregistré (figure 9 droite) et la perte du signal est bien observée pour une profondeur de 800 µm, correspondant à l’épaisseur du pétrie.
Figure 9 : Profils pour calibrer la profondeur de mesure. A gauche, profil effectué avant la calibration (perte du signal à 1250 µm au lieu de 800 µm) et à droite après la calibration.
III.1.4 Récapitulatif de l’ensemble des mesures :
Le spectromètre RMN a été livré avec deux sondes de détection. Le travail de calibration a été effectué avec chacune de ces sondes et les différentes configurations possibles. Les tableaux ci-dessous résument l’ensemble des résultats de calibration.
Tableau 2 : Calibration des différentes configurations du NMR MOUSE avec la sonde ‘large’.
Spacers [mm] Depth [mm] Pulse length [µS] Rf-att² [dB] TEmin² [µs] Bruit Signal 100µm Echo shift [µs] Phase [°] 20 4800 5 -7/0 62 0.8 15.79 1.1 243 15 10000 9 -7/0 70 0.8 8.09 1.2 239 10 15100 14 -7/0 80 0.8 3.64 1.2 236 5 20400 21 -7/0 93 0.8 1.58 1.1 236 0 25500 28 -7/0 107 0.8 X 1.2 236
Tableau 3 : Calibration des différentes configurations du NMR MOUSE avec la sonde ‘Small’.
Spacers [mm] Depth [mm] Pulse length [µS] Rf-att² [dB] TEmin² [µs] Bruit Signal 100µm Echo shift [µs] Phase [°] 20 5100 5 -7/0 60 0.8 5.29 1 55 15 10150 10 -7/0 58 0.8 2.05 1 55 10 15350 19 -7/0 80 0.8 0.71 1 55
INRA-Centre Auvergne-Rhône-Alpes
III.2 Mesure de flux dans un système modèle
J’ai dans un premier temps travaillé avec une solution mimant la sève brute (voir composition en annexe 2). Les paramètres de relaxation (ce qui est important pour les expériences) étant similaires à ceux de l’eau, j’ai finalement travaillé avec de l’eau.
III.2.1 Caractérisation des éléments composant le système
Le système modèle est composé d’un tube en caoutchouc avec de l’eau circulant à l’intérieur. De par la possibilité offerte par l’aimant de mesurer le signal RMN à différentes profondeurs, il est possible de soit mesurer le signal généré par le composant du tube uniquement (Figure 10, coupe 1), c’est-à-dire le caoutchouc, soit d’observer le signal du mélange (Figure 10, coupe 2).
Figure 10 : Schéma représentant le tube d’eau avec les différentes coupes spatiales effectuées en fonction de la profondeur.
Nous avons mesuré le temps de relaxation transversal T2 pour chacun des composants du système. Pour cela, nous avons (1) placé l’eau dans un bécher ou (2) placé la coupe de sélection dans le caoutchouc uniquement (Figure 10, coupe 1). Nous obtenons les décroissances exponentielles illustrées sur la Figure 11. L’intensité du signal RMN en fonction du temps est représentée avec les points verts représentant les points expérimentaux et la courbe bleu représentant la courbe théorique permettant d’ajuster le signal.
Sur la figure 11, les données sont ajustées avec modèle monoexponentiel dont la T2 obtenue est de 125 ms pour l’eau et 9 ms pour le caoutchouc.
1 2
INRA-Centre Auvergne-Rhône-Alpes
Figure 11 : Evolution du signal RMN en fonction du temps pour de l’eau dans un bécher (à gauche) et pour le caoutchouc (à droite). Lorsque la mesure est effectuée au milieu du tube (Figure 10, coupe 2), l’ajustement du signal RMN impose l’utilisation d’un modèle à deux exponentielles (Figure 12), démontrant la présence de deux populations ayant des T2 différents. La valeur estimée de ces temps de relaxation, 200 et 7 ms, correspondent respectivement à l’eau à l’intérieur du tuyau et au caoutchouc. Chaque temps de relaxation T2 possède une ordonnée à l’origine qui nous renseigne sur la proportion de chaque population (environ 40% du signal est attribué au caoutchouc et 60% à l’eau).
Figure 12: Evolution du signal RMN en fonction du temps lorsque la mesure est effectuée dans le tuyau (figure 10, coupe 2).
III.2.2 Profil du système modèle :
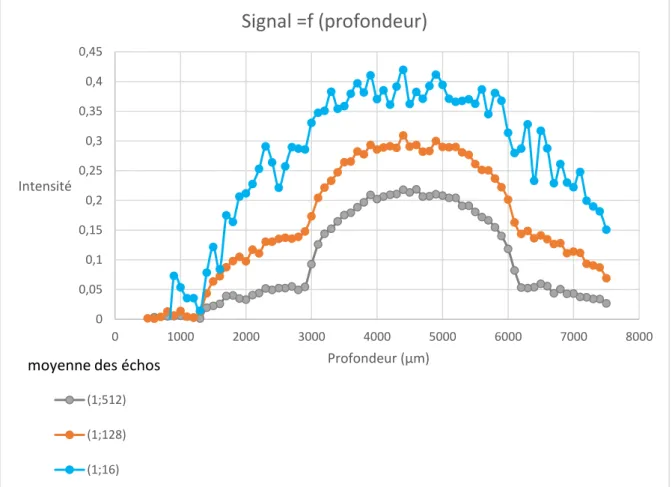
Afin de savoir à quelle profondeur nous allons nous placer pour effectuer nos mesures, nous décidons d’étudier le signal RMN en fonction de la profondeur. Comme nous avons pu démontrer précédemment (partie 3.2.1) que les T2 du caoutchouc et de l’eau étaient très différents, nous avons la possibilité de contraster l’information. En effet, si seuls les premiers points du signal sont moyennés, alors le signal observé correspond non seulement à celui du caoutchouc mais aussi à celui de l’eau. A l’inverse, si nous moyennons tous les points, le signal RMN du caoutchouc, qui a un T2 court, est significativement diminué et seul le signal de l’eau circulant dans le tube est observé. La figure 13 représente le signal RMN en fonction de la profondeur. La courbe bleue représente la
INRA-Centre Auvergne-Rhône-Alpes
moyenne des premiers points du signal RMN tandis que la courbe grise représente la moyenne de l’ensemble des points enregistrés. Pour la première courbe, le signal provient de toutes les espèces contenant des protons tandis que pour la seconde, nous observons uniquement le profil de l’eau, c’est-à-dire du diamètre interne du tube. La mesure de la largeur du signal gris nous donne une distance de 3100 µm en parfaite adéquation avec la valeur nominale fournie par le constructeur (i.d. 3.2 mm)
Figure 13: Signal de l’eau en fonction de la profondeur dans le tuyau. III.2.3 Mesures de flux :
Nous déterminons un débit nous permettant d’être en régime laminaire (Re=8), impliquant un profil parabolique de la vitesse en fonction de la profondeur dans notre tube. Les flux sont mesurés à différentes profondeurs. La figure 14 représente les résultats des mesures de flux réalisés à deux profondeurs. 0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0,45 0 1000 2000 3000 4000 5000 6000 7000 8000 Intensité Profondeur (µm)
Signal =f (profondeur)
(1;512) (1;128) (1;16)
INRA-Centre Auvergne-Rhône-Alpes
Figure 14: propagateur à différente profondeur représentant la vitesse en fonction de l’amplitude
Pour une zone située proche de la surface du tube (6000 µm), nous notons, une faible distribution des vitesses avec une valeur maximale autour de 2 mm s-1. A l’inverse, pour une mesure au milieu du tube (4600 µm), nous observons une forte distribution des vitesses avec deux pics ayant des maximas pour des vitesses aux alentours de 4 et 14 mm s-1. Cette distribution de vitesse est expliquée par plusieurs facteurs :
1. La mesure est effectuée sur l’ensemble du tube (diamètre externe du tube inférieur à la largeur de la sonde RMN) ;
2. Le flux est dans un régime laminaire ;
Ainsi, représenté en 3D, le profil du flux ne doit pas être qualifié de parabolique mais d’ellipsoïdes. La mesure RMN étant effectuée sur une coupe de cette ellipsoïde, plus la coupe sera localisée au milieu du tube, plus la distribution de vitesse sera importante, reflétant le profil parabolique à l’intérieur de la coupe de mesure.
III.2.4 Profil de la vitesse :
Pour interpréter les résultats de mesure de la vitesse en fonction de la profondeur, nous mesurons deux vitesses : la vitesse maximale déterminée grâce au sommet du pic présentant la vitesse la plus élevée et la vitesse moyenne calculée par pondération de l’intensité du signal à la vitesse de mesure (Figure 15). 0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 -20 -10 0 10 20 Am p litu d e (a.u .) Vitesse (mm/s)
Propagateur à une profondeur
de 6000 µm
0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 0,04 0,045 -20 -10 0 10 20 Am p litu d e (a.u .) Vitesse (mm/s)Propagateur à une profondeur
de 4600 µm
INRA-Centre Auvergne-Rhône-Alpes
Figure 15: Superposition de la vitesse moyenne et maximale en fonction de la profondeur. Pour se situer dans l’espace, le profil de l’intérieur du tube a été ajouté.
A partir de la mesure du débit (4 mL min-1) et des dimensions du tube (3,2 mm de diamètre interne), nous avons calculé une vitesse moyenne de 8,2 mm s-1 et maximale de 16,4 mm s-1. La vitesse moyenne expérimentale mesurée au centre de notre tube est d’environ 7,5 mm s-1 et atteint 15 mm s-1 en vitesse maximale (Figure 15). Les vitesses mesurées par l’IRM sont donc en adéquation avec les valeurs attendues.
Nous pouvons également remarquer sur la figure 15 (1) la présence du profil parabolique des vitesses caractéristiques d’un régime laminaire et (2) une bonne superposition des vitesses avec le profil du tube.
III.3 Premières mesures sur un arbre :
Les arbres sont constitués de vastes canaux de distributions de nutriments nommés des xylèmes (sève montante) et phloèmes (sève descendante). La sève brute (ascendante) est principalement constituée de minéraux et de l’eau tandis que la sève élaborée (descendante) est constituée de sucres formés sous l’effet de la photosynthèse et de l’air. Lors des variations climatiques, plus précisément de forte sécheresse, la quantité d’eau dans ces plantes diminue car la plante est moins ressourcée. Cela peut entrainer des conséquences directes sur sa récolte (baisse de la qualité et de la quantité). Afin d’étudier cette question aux enjeux majeurs tant d’un point de vue agricole qu’écologique, les flux de nos arbres vont être mesurés à l’aide du NMR Mouse. La figure 16 illustre l’installation expérimentale que j’ai utilisée.
0 2 4 6 8 10 12 14 16 -0,05 0 0,05 0,1 0,15 0,2 0,25 0 1000 2000 3000 4000 5000 6000 7000 8000 Vitesse (mm/s) Intensité Profondeur (µm)
INRA-Centre Auvergne-Rhône-Alpes
Figure 16: Photo du montage expérimental permettant de réaliser les mesures sur les arbres.
III.3.1 Profil de l’arbre :
La figure 17 montre le signal RMN en fonction de la profondeur. Nous pouvons constater que le maximum de signal se trouve à 5200 µm. Cela correspond à l’endroit ou circule le plus d’eau dans la plante et donc là où se trouve le vaisseau principal. C’est donc à cette profondeur que la mesure du flux de sève de l’arbre ce fera.
INRA-Centre Auvergne-Rhône-Alpes
Figure16 : Signal RMN enregistré sur le tronc d’un arbre en fonction de la profondeur.
INRA-Centre Auvergne-Rhône-Alpes
CONCLUSION
Mon stage a consisté à réaliser les premières mesures sur un système RMN bas champ qui venait d’être acheté par la plateforme. Mes deux missions principales ont été de (1) calibrer l’appareil pour valider la réception et (2) mesurer le flux sur des systèmes modèles. Afin de mener à bien mon projet, une formation théorique et pratique a été nécessaire avant de pouvoir de prendre en main le spectromètre. Mon travail sur la calibration de l’appareil m’a donné l’opportunité de rédiger un mode opératoire qui a été intégré au système de management de la qualité (ISO 9001) de la plateforme. J’ai ainsi produit un document qui sera utilisé dans le futur par les scientifiques de la plateforme et pu me rendre compte de la rigueur et de l’exactitude à apporter à ce type de document. J’ai créé un système modèle de la sève circulant dans les arbres grâce à un tube en caoutchouc dans lequel de l’eau pouvait circuler. La caractérisation du système modèle m’a permis de démontrer qu’un signal RMN du caoutchouc était enregistré et que son temps de relaxation T2 était significativement plus court que celui de l’eau. En exploitant cette différence dans les propriétés physiques, j’ai pu enregistrer une image de la concentration d’eau à l’intérieur du tube. Grâce à une bobine de gradients supplémentaire, j’ai pu coder et décoder la position spatiale des spins pour mesurer leur vitesse de déplacement. Ces mesures de flux ont été
corrélées avec la position de la mesure pour obtenir une image du flux dans les tubes. Les valeurs des flux obtenus sont en accord avec les valeurs attendues. De plus, l’image du flux correspond bien au profil attendu pour un flux laminaire, c’est-à-dire un profil parabolique.
L’ajout de ce spectromètre au sein de la plateforme va permettre d’élargir les offres de la plateforme et d’ouvrir la voie à d’autres applications telles que les mesures de flux de sève dans les arbres ou la caractérisation de l’eau dans les graminées. La plateforme pourra ainsi aborder les questions liées au dérèglement climatique et plus particulièrement au stress hydrique. En
développant cette technique in-situ, la plateforme espère proposer un outil analytique performant pour aborder les questions agro-écologiques.
D’un point vue technique et social, j’ai eu la chance d’aller me former sur le spectromètre en Allemagne en même temps que mes maitres de stage. Ceci est une opportunité qui n’est pas offerte à tout le monde et je suis un des rares étudiants formé sur cet instrument unique en son genre et utilisé dans des applications diverses et variées en partant de l’indentification des momies jusqu’à au séchage du béton. Au cours de ce stage, j’ai pu découvrir le monde de la recherche et la rigueur scientifique nécessaire pour mener à bien les expériences et le projet de recherche. J’ai également été confronté à la difficulté de l’analyse et de l’interprétation des résultats. J’ai dû mettre en place les expériences permettant de valider mes hypothèses.
INRA-Centre Auvergne-Rhône-Alpes
REFERENCES
[1] Barigah TS, Bonhomme M, Lopez D, Traore A, Douris M, Venisse JS, et al. Modulation of bud survival in Populus nigra sprouts in response to water stress-induced embolism. Tree Physiol. 2013; 33:261-74.
[2]. Jones M, Aptaker PS, Cox J, Gardiner BA, McDonald PJ. A transportable magnetic resonance imaging system for in situ measurements of living trees: The Tree Hugger. J Magn Reson. 2012; 218:133-40.
[3]. Windt CW, Soltner H, Dusschoten D, Blümler P. A portable Halbach magnet that can be opened and closed without force: The NMR-CUFF. J Magn Reson. 2011; 208:27-33.
[4] Windt CW, Blümler P. A portable NMR sensor to measure dynamic changes in the amount of water in living stems or fruit and its potential to measure sap flow. Tree Physiology 2015. [5] Van Landeghem M, d'Espinose de Lacaillerie J-B, Blümich B, Korb J-P, Bresson B. The roles of hydration and evaporation during the drying of a cement paste by localized NMR. Cement and Concrete Research 2013;48(0):86-96.
[6] Haber A, Blümich B, Souvorova D, Del Federico E. Ancient Roman wall paintings mapped nondestructively by portable NMR. Anal Bioanal Chem 2011;401(4):1441-1452.
[7] Blümich B, Perlo J, Casanova F(2008, May) Mobile single-sided NMR. Prog Nucl Magn Reson Spectrosc 52(4):197-269
[8] Casanova F, Blümich B. Two-dimensional imaging with a single-sided NMR probe. J Magn Reson 2003;163(1):38-45.
[9] Casanova F, Perlo J, Blümich B. Velocity distributions remotely measured with a single-sided NMR sensor. J Magn Reson 2004;171(1):124-130.
INRA-Centre Auvergne-Rhône-Alpes
TABLE DES ILLUSTRATIONS
Figure 1 : Représentation schématique du Tree Huger (gauche) et du NMR Cuff soit en position d’analyse (c’est-à-dire fermé, au centre), soit en position ouverte (droite). ... 12 Figure 2 : Signal RMN enregistré dans un tronc d’arbre avec le NMR CUFF en fonction du temps. La luminosité est représentée par les barres noires et blanches pour la nuit et le jour, respectivement. L’augmentation du signal RMN est directement corrélée avec l’ensoleillement. ... 13 Figure 3 : Photo du NMR MOUSE utilisé lors de mon stage. L’aimant est posé sur un ascenseur haute résolution pour mesurer le signal RMN à différentes profondeurs. ... 15 Figure 4 : Aimantation nucléaire à l’équilibre (gauche) et après perturbation (droite). Après perturbation, l’aimantation est décomposée avec sa partie longitudinale (Mz) et transversale (Mx,y) ainsi que sa fréquence de précession de Larmor0. ... 16 Figure 5 : Allure théorique de l’évolution de l’aimantation après une perturbation en fonction du temps ... 16 Figure 6 : Evolution du temps de relaxation T1 en fonction de la concentration en sulfate de cuivre. ... 17 Figure 7 : Intensité du signal RMN en fonction de la durée de l’impulsion RF. ... 18 Figure 8: Signal observé avec un temps d’écho assez long (gauche) et trop court (droite) pour dissiper les courants résiduels ... 18 Figure 9 : Profils pour calibrer la profondeur de mesure. A gauche, profil effectué avant la calibration (perte du signal à 1250 µm au lieu de 800 µm) et à droite après la calibration. ... 19 Figure 10 : Schéma représentant le tube d’eau avec les différentes coupes spatiales effectuées en fonction de la profondeur. ... 20 Figure 11 : Evolution du signal RMN en fonction du temps pour de l’eau dans un bécher (à gauche) et pour le caoutchouc (à droite). ... 21 Figure 12: Evolution du signal RMN en fonction du temps lorsque la mesure est effectuée dans le tuyau (figure 10, coupe 2). ... 21 Figure 13: Signal de l’eau en fonction de la profondeur dans le tuyau. ... 22 Figure 14: propagateur à différente profondeur représentant la vitesse en fonction de l’amplitude ... 23 Figure 15: Superposition de la vitesse moyenne et maximale en fonction de la profondeur. Pour se situer dans l’espace, le profil de l’intérieur du tube a été ajouté. ... 24 Figure 16: Photo du montage expérimental permettant de réaliser les mesures sur les arbres. .... 25
Tableau 1 : Comparaison des différents spectromètres disponibles sur la plateforme... 10 Tableau 2 : Calibration des différentes configurations du NMR MOUSE avec la sonde ‘large’. ... 19 Tableau 3 : Calibration des différentes configurations du NMR MOUSE avec la sonde ‘Small’. ... 19
INRA-Centre Auvergne-Rhône-Alpes
Tableau 4 : Performances fournies par le constructeur dans les différentes
configurations avec la sonde Large. ... 34 Tableau 5 : Performances fournies par le constructeur dans les différentes configurations avec la sonde Small. ... 34 Tableau 6 : différents composés présents dans la sève brute ... 45 Tableau 7 : espèces disponibles à la plateforme ... 45
INRA-Centre Auvergne-Rhône-Alpes
ANNEXES
Tuteurs INRA : Guilhem PAGES Amidou TRAORE Jean Marie BONNY
INRA-Centre Auvergne-Rhône-Alpes
ANNEXES
ANNEXE 1 : Calibration du NMR Mouse
Evolution du document
Version Date Description
1 17-05-2017 Création
Ce mode opératoire a pour objectif de décrire les calibrations des différents paramètres du NMR Mouse.
1 Définitions
NMR Mouse : nom du système de mesure ;
Spacers : plaques de 5 mm ou 10 mm d’épaisseur pour augmenter la distance entre l’aimant et l’antenne RF (augmentation de la sensibilité de la mesure au dépend de la profondeur de celle-ci) ; Gradients : plaque de 10 mm d’épaisseur permettant de réaliser des gradients de champs magnétiques parallèles à la surface de l’aimant ;
Antenne Large : antenne RF de 4 cm de côté ; Antenne Small : antenne RF de 2 cm de côté.
2 Utilisateurs
Plateforme RMN INRA
INRA-Centre Auvergne-Rhône-Alpes Fournisseur 3 Documents de référence
Les documents du SMQ sont consultables par les membres de l’équipe sur l’espace de travail collaboratif SILVERPEAS :
https://collaboratif.inra.fr/weblib/look/defaultLoginInra.jsp?DomainId=null&ErrorCode=null&logo ut=null
4 Matériels et Réactifs nécessaires, contraintes de la méthode
- Boite de pétrie - Pied à coulisse - Eau
- Sulfate de cuivre (CuSO4) - Gants + blouse
5 Principe de la méthode
Pour une configuration donnée (antenne, nombre de spacers de 5 mm avec ou sans gradient), la calibration du NMR Mouse consiste en la mesure de différents paramètres :
1) Réglage de l’impulsion à 90 ;
2) Détermination de la phase du récepteur ; 3) Détermination du temps d’écho minimum ; 4) Mesure du bruit ;
5) Réglage de la profondeur ;
6) Mesure du signal RMN dans des conditions normalisées.
Certaines de ces mesures (impulsion 90°, TE min, Signal) ont été préalablement effectuées par le constructeur avant livraison. Les tableaux ci-dessous reprennent ces valeurs de référence.
INRA-Centre Auvergne-Rhône-Alpes
Tableau 4 : Performances fournies par le constructeur dans les différentes configurations avec la sonde Large.
Tableau 5 : Performances fournies par le constructeur dans les différentes configurations avec la sonde Small.
6 Description de la méthode 6.1 Description de l’appareil
INRA-Centre Auvergne-Rhône-Alpes Antenne + Spacer Gradient Aimant
INRA-Centre Auvergne-Rhône-Alpes
6.2 Préparation des mesures
6.2.1 Mesure de l’épaisseur de la boite de pétri
Eboite de pétri = h1-h2= 0.78 mm (le jour de l’écriture du MO).
6.2.2 Préparation de l’eau dopée
Dans une fiole jaugée de 100 mL, introduire 150 mg de sulfate de cuivre penta hydraté. Compléter avec de l’eau jusqu’au trait de la jauge. Bien mélanger.
Introduire délicatement votre solution dans la boite à pétri à l’aide d’une pipette pasteur jusqu’à mi-hauteur.
Poser délicatement votre boite de pétri sur la sonde RMN.
Les temps de relaxation de la solution dopée sont de 140 et 70 ms pour le T1 et le T2, respectivement.
6.3 Mesures de calibration
6.3.1 Enregistrement des données
Avant de commencer, il faut noter qu’ici d’innombrables acquisitions sont réalisées. Les données doivent être sauvegardées sous : « C:\data\CQ\[SONDE]\[CONF] » avec [SONDE] soit « PM25Large » soit « PM25Small » et [CONF] la configuration utilisées pour la calibration (g pour gradient et s pour la taille totale des spacers utilisés).
h2 h1
INRA-Centre Auvergne-Rhône-Alpes
Les fichiers seront ensuite nommés de la façon suivante : AAMMJJ_[EXP] _ExpNum avec [EXP] étant RFpulse, Echotime, Bruit, profiledepth en fonction de l’expérience effectuée.
6.3.2 Déclaration de la configuration matérielle au logiciel
Sous Prospa V3.39, cliquer sur l’onglet « Window » et choisir les fenêtres que l’utilisateur souhaite faire apparaitre (1D, 2D, …):
Cliquer sur « PM25/Select probe Head » et dans la rubrique « probe » choisir le type sonde utilisé : deux choix seront présents par défaut (1H-L= sonde large) et (1H-S= sonde small). Ensuite, dans « Spacer » choisir l’épaisseur totale entre la sonde et l’aimant (par exemple : avec 1 spacer de 5 mm et le gradient de 10 mm, on a 15 mm de spacer) puis cliquer sur « Update ».
Nom de l’expérience Emplacement du fichier
INRA-Centre Auvergne-Rhône-Alpes
Cliquer ensuite sur « Edit » pour afficher les paramètres de cette configuration.
Lorsqu’un paramètre est modifié, ne pas oublier de mettre à jour sa valeur dans la fenêtre « Editor » de la configuration de la sonde puis d’enregistrer le fichier et de cliquer sur « Update » dans la fenêtre « Select sensor/probe ».
6.3.3 Mesure de l’impulsion à 90°
Dans le menu « PM25 », choisir la séquence « Cal ».
Dans la fenêtre qui s’ouvre, dans l’onglet « Pulse séquence » modifier les paramètres pour incrémenter la durée de l’impulsion à 90° (« init puls », « increment » & « number of increm »). Faire en sorte que la valeur attendue pour l’impulsion à 90° se trouve dans cette fenêtre.
INRA-Centre Auvergne-Rhône-Alpes
Il faut retenir la valeur de l’amplitude maximale comme durée pour l’impulsion à 90°. Ici elle est
égale à 9 µs.
6.3.4 Réglage de la phase du récepteur
Aller dans « CMPG fast », régler les paramètres suivants « pulse length, Echoshift, echotime et Rx phase » en reportant les valeurs qui sont par défauts sur la fenêtre « Editor ».
Ensuite, ajuster la valeur de la phase dans « Rx Phase » jusqu’à ce que le signal imaginaire soit égal à 0.
INRA-Centre Auvergne-Rhône-Alpes Exemple :
6.3.5 Détermination de la valeur de l’echo shift
Aller dans « Cal », puis sur l’onglet « Pulse séquence », mettre la valeur de l’impulsion à 90° dans « Pulse length » et « Init Pul ». Mettre à 0 « Increment » et à 1 le « Number of incr » (l’impulsion à 90° ne changera pas).
Dans l’onglet « Acquisition », régler le nombre de points complexes de telle sorte à ce que : Nbr de points * dwell time = pulse length
Pour une pulse length à 9 µs et un dwell time à 0.5 µs, le nombre de point complexe à renseigner est donc 18.
Lancer l’expérience en cliquant sur « Run » Signal imaginaire
INRA-Centre Auvergne-Rhône-Alpes
Remarque : Il faut ajuster « l’écho shift » jusqu’à ce que la même amplitude de part et d’autre de la partie réelle soit observée.
6.3.6 Détermination du temps d’écho minimum
Il est mesuré dans les mêmes conditions que lors de la détermination de la phase du récepteur.
Ici il ne faut pas oublier de décocher l’option « Phase cycle » sous l’onglet « Acquisition ».
Enlever l’échantillon de la surface de l’aimant pour n’enregistrer que du bruit.
Mettre un temps d’écho élevé (90µs par exemple) et regarder le niveau du bruit en appuyant sur « Run ».
Diminuer progressivement le temps d’écho et trouver la valeur minimale avant l’apparition d’un signal. Il s’agit du temps d’écho minimum.
INRA-Centre Auvergne-Rhône-Alpes
Penser à recocher l’option « Phase cycle ».
6.3.7 Mesure du bruit
Une fois nos conditions définies, nous allons mesurer le bruit. Pour cela, dans le menu « PM25 » puis « service », cliquer sur « HOME » pour que l’aimant remonte à sa position la plus haute. Ensuite, dans le menu « PM25 », sélectionner « Monitoring Noise », et cliquer sur « RUN » (toujours aucun échantillon à la surface de l’aimant).
INRA-Centre Auvergne-Rhône-Alpes Voici le resultat : 6.3.8 Réglage de la profondeur
Aller sur « PM25\Profile », définir une plage de profondeur pour laquelle la surface du contenant sera atteinte. Comme ici, l’épaisseur de notre boite de pétri est d’environ 0.78mm, nous choisissons de commencer à 2500 µm de profondeur ( « Initial depth »). L’analyse se terminera à 200 µm de profondeur (« Final depth »).
INRA-Centre Auvergne-Rhône-Alpes
Le signal s’atténue à environ 1200 µm au lieu des 800 µm attendu. Pour corriger, aller dans la fenêtre « Editor », puis dans « Max depth » corriger la valeur pour prendre en compte cet écart (ici -400 µm). Cliquer sur « update ». Relancer le profil et vérifier que la perte du signal se fait à la bonne profondeur :
6.3.9 Mesure de l’intensité du signal
Aller dans « PM25\CMPG fast », reporter les valeurs par défauts dans les paramètres (utiliser le temps d’écho minimum). Enregistrer une expérience en effectuant 32 accumulations. La résolution est fixée à 100 µm.
INRA-Centre Auvergne-Rhône-Alpes
6.3.10 Enregistrement des résultats
Consigner les résultats dans le tableau prévu à cet effet avec la configuration utilisée (classeur à côté de l’aimant).
ANNEXE 2 : Mesure des flux :
Préparation de la solution de sève :
Afin de simuler des conditions réelles, nous allons nous référer à un système model qui n’est ni plus ni moins qu’une solution de sève brute synthétique.
Protocole :
Tableau 6 : différents composés présents dans la sève brute
Ions 𝑪𝒂𝟐+ 𝑴𝒈𝟐+ 𝑲+ 𝑵𝒂+ 𝑵𝑶 𝟑 − 𝑷𝑶 𝟒 𝟑− Saccharose Acides aminés pH Concentration ( mmol /L) 4.7 1.4 5.2 2.0 NA 2.2 ND 2.2 5.7
Tableau 7 : espèces disponibles à la plateforme
Espèces Cation (concentration en mg/L) Anion (concentration en mg/L) 𝑴𝒈𝑪𝒍𝟐. 𝟔𝑯𝟐𝑶 𝑀𝑔2+ : 34 𝐶𝑙− : 99.54 NaCl 𝑁𝑎+ : 46 𝐶𝑙− : 71.1 𝑯𝟑𝑷𝑶𝟒 X 𝑃𝑂43− : 208.94 KCl 𝐾+ : 202.8 𝐶𝑙− : 387.66 Ca𝑪𝒍𝟐 𝐶𝑎2+ : 188 𝐶𝑙− : 334.17
INRA-Centre Auvergne-Rhône-Alpes Exemples de calculs : 𝑴𝒈𝑪𝒍𝟐. 𝟔𝑯𝟐𝑶 : C=1.4 mmol/L Cmmg2+= 1.4*24.3=34.02 mg/L Masse à peser=1.4*203.31=284.63 mg 𝑯𝟑𝑷𝑶𝟒 C=2.2 mmol/L d=1.69g/ml P=85% C=17.24*0.85=14.909 mol/L 𝑉𝑚 =𝐶𝑓∗𝑉𝑓 𝐶𝑚 = 2.2∗10−3¨¨ 14.909 = 1.476 ∗ 10 −4𝐿 Soit Vm=148 µL