HAL Id: tel-02426264
https://tel.archives-ouvertes.fr/tel-02426264
Submitted on 2 Jan 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Interaction immunitaire dans un modèle
Drosophiles-parasitoïde : effet de la température et
potentiel évolutif du venin en lien avec l’espèce hôte
Fanny Cavigliasso
To cite this version:
Fanny Cavigliasso. Interaction immunitaire dans un modèle Drosophiles-parasitoïde : effet de la tem-pérature et potentiel évolutif du venin en lien avec l’espèce hôte. Interactions entre organismes. Université Côte d’Azur, 2017. Français. �NNT : 2017AZUR4134�. �tel-02426264�
École doctorale Sciences de la Vie et de la Santé (ED85)
Unité de recherche : UMR 1355, Université Côte d’Azur, INRA, CNRS, ISA
Thèse de doctorat
Présentée en vue de l’obtention du grade de Docteur en Sciences de la Viede
L’UNIVERSITE CÔTE D’AZUR
Spécialité : Biologie des Interactions et Écologie
Par
Fanny Cavigliasso
Interaction immunitaire dans un modèle
Drosophiles – parasitoïde : effet de la
température et potentiel évolutif du
venin en lien avec l’espèce hôte
Dirigée par Marylène Poirié Codirigée par Dominique Colinet
Soutenue le 22 décembre 2017 Devant le jury composé de :
Frédéric FLEURY Professeur, Université de Lyon 1 Guillaume MITTA Professeur, Université de Perpignan Denis BOURGUET Directeur de Recherche, INRA Montpellier Cécile SABOURAULT Professeur, Université Nice Sophia Antipolis Marylène POIRIE Professeur, Université Nice Sophia Antipolis
Rapporteur Rapporteur Examinateur Examinatrice Directrice de thèse
Abstract
Immune interactions in a Drosophila – parasitoid model :
effect of the temperature and evolvability of the venom in relation to the host species
Endoparasitoid wasps are insects whose larvae develop inside the body of other arthropods, leading to their death. They are thus often used as auxiliaries in biological control. The success of parasitoids notably relies on their ability to suppress the host immune response, consisting in the formation of a multicellular melanized capsule around the parasitoid egg, and regulate their physiology. The most prevalent strategy involves venom injection by the female at oviposition. However, the impact of abiotic parameters on the mechanisms involved in parasitism success and the evolvability of the venom protein composition depending on the host have rarely been investigated.
In this work, I have used Leptopilina boulardi, a parasitoid of several Drosophila species that shows a high intraspecific variability of both parasitism success according to the host and venom protein composition. Based on this model, I defined two goals i) evaluate the impact of temperature on parasitism success while disentangling its effect on the two partners (host immunity; parasitoid venom composition), ii) evaluate the evolvability of parasitism success and venom protein composition of a parasitoid wasp depending on different host strains and species.
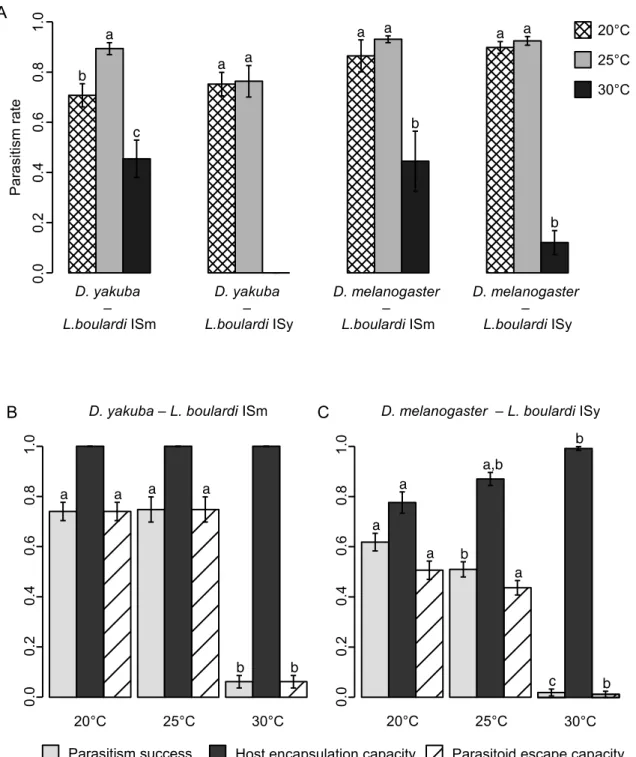
As to the impact of temperature (20, 25, 30°C), we observed a higher parasitism success with temperature increase which is explained differently according to the host species and parasitoid line. Indeed, no effect of temperature was observed for the capacity of D. yakuba to encapsulate an injected oil drop, whereas it decreased at 30°C for D. melanogaster. Venom composition analysis (a semi-automated analysis of SDS-PAGE venom individual profiles, combined with a specific analysis with antibodies) clearly differentiated the protein composition according to the temperature during the last stages of development, suggesting a phenotypic plasticity of this trait. Specific analyzes at least partially correlated the variation in parasitism success and the change in venom composition with temperature.
As to the second goal, I have been involved in a first experimental evolution that evidenced a rapid evolution of the venom protein composition depending on the D. melanogaster host strain, susceptible or resistant. I also performed a second experimental evolution using different host species that highlights a differential evolution of both parasitism success and venom protein composition, according to the host species. The rapid and differential evolution of venom protein composition in response to the hosts used suggests that the venom of L. boulardi would contain a combination of proteins “specialized” to each host as well as "broad-spectrum" proteins for some of the hosts tested. Finally, we tested the role in virulence of some of the proteins contained in bands identified as “evolving” on a given host using the RNA interference approach.
In conclusion, this work evidences i) an impact of temperature on the parasitoid success with a phenotypic plasticity of the venom composition and ii) a high evolvability of the venom protein composition with the selection of specialized but also broad-spectrum factors in response to different hosts. The implication of these results on the regulation of natural host populations and for biological control are discussed in the context of global change.
Résumé
Interactions immunitaires dans un modèle Drosophiles - parasitoïde : effets de la température et potentiel évolutif du venin en lien avec l'espèce hôte
Les guêpes endoparasitoïdes sont des insectes dont le stade larvaire s’effectue aux dépens d’un autre arthropode, conduisant à sa mort. Elles sont ainsi utilisées comme auxiliaires de lutte biologique pour lutter contre les ravageurs. La réussite des parasitoïdes dépend de leur capacité à neutraliser la réponse immunitaire de l'hôte - formation d’une capsule multicellulaire, mélanisée, autour de l’œuf du parasitoïde, nommée encapsulement - et à réguler sa physiologie. La stratégie la plus commune repose sur l’injection de venin lors de l'oviposition et l’effet de ses composants protéiques. Cependant, l’effet de paramètres abiotiques sur le succès d’un parasitoïde n’a pas été explicité et l’effet de paramètres liés à l’hôte sur l’évolution de la composition du venin n’a quasiment pas été abordé.
Dans cette thèse, j’ai utilisé Leptopilina boulardi, un parasitoïde d’espèces de drosophiles qui présente une forte variabilité intraspécifique et interindividuelle de réussite parasitaire sur ses hôtes et de composition protéique du venin. Ce modèle d’interaction m’a permis de proposer deux objectifs : i) évaluer l’effet de la température sur la réussite d’un parasitoïde en distinguant l’effet sur les deux partenaires (immunité de l’hôte ; composants protéiques du venin), ii) tester l’effet d’un maintien du parasitoïde sur différents hôtes (évolution de la réussite parasitaire et de la composition du venin) via une approche d’évolution expérimentale.
Pour l’effet température (20, 25, 30°C), le meilleur succès parasitaire aux températures les plus élevées, s’explique différemment selon l’espèce hôte et la lignée de parasitoïde. En effet, un test de mélanisation de gouttes d’huile injectées dans l’hôte montre une absence d’effet de la température chez D. yakuba versus une plus faible réponse à 30°C chez D. melanogaster. L’analyse du venin (méthode de comparaison inter-individuelle de profils protéiques avec estimation de l’intensité des bandes identifiées) différencie clairement la composition protéique selon la température lors des derniers stades de développement, suggérant une plasticité phénotypique de ce trait. Enfin, des analyses spécifiques ont permis de corréler au moins partiellement la variation de succès parasitaire et le changement de composition du venin avec la température.
Pour le potentiel d’évolution du venin, j’ai participé à une approche d’évolution expérimentale qui a montré une évolution rapide de sa composition protéique en lien avec la résistance de l’hôte D. melanogaster. J’ai conduit une autre évolution expérimentale pour tester l’impact de l’espèce hôte et mis en évidence une évolution différentielle du succès parasitaire qui suggère un certain niveau de spécialisation de L. boulardi selon l’espèce hôte considérée. L’évolution différentielle de la composition du venin (approches globale et spécifique) selon l’espèce hôte indique que le venin qui assure le succès parasitaire sur différents hôtes contiendrait une combinaison de protéines « spécialisées » pour réussir sur chaque hôte ainsi que des protéines à effet « large-spectre » sur certains des hôtes testés. Enfin, j’ai testé le rôle dans le succès parasitaire de certaines des protéines identifiées comme « sélectionnées par l’hôte via une approche d’ARN interférence.
Ce travail montre i) un effet température sur la réussite d’un parasitoïde avec une plasticité de composition du venin et ii) un fort potentiel pour une évolution rapide de cette composition selon l’espèce hôte. L’importance de ces résultats pour le contrôle naturel des espèces hôtes et la lutte biologique est discutée dans un contexte de changement climatique.
Remerciements
Avant de remercier les personnes impliquées dans cette thèse, je voudrais commencer par remercier celles qui m’ont fait découvrir le monde de la recherche. Cette première personne est Alexandra Brun-Barale qui, pendant une journée, m’a montré en quoi consistait son travail. A ce moment-là, je me suis dit que c’était ce que je voulais faire. Cependant, il y a parfois une différence entre ce que l’on s’imagine le temps d’une journée et la réalité au quotidien. Pour le tester, j’ai donc effectué un premier stage d’un mois dans l’équipe où j’ai réalisé cette thèse et, de ce fait, je tiens à remercier Marylène Poirié et
Dominique Colinet de m’avoir accueilli et fait confiance pour ce stage. Ce stage a confirmé
mon envie de continuer dans la recherche et faire une thèse. Après l’obtention de la licence et du master à Nice, j’ai décidé de postuler pour une bourse ministérielle dans l’optique d’effectuer ma thèse au sein de l’équipe ESIM dans laquelle j’ai effectué mon stage de Master 2. Je remercie à nouveau Marylène et Dominique pour m’avoir donné l’opportunité de passer ce concours et remercie les membres du jury pour m’avoir octroyé une bourse ainsi que l’école doctorale ED85, l’Institut Sophia Agrobiotech (INRA, CNRS, Université de Nice) et l’Université Côte d’Azur.
Les premières personnes à remercier pour cette thèse sont mes deux encadrants
Marylène et Dominique, sans qui cette thèse n’aura pas été la même… Je les remercie pour
leur patience et tout le temps qu’ils ont consacré à la correction des papiers, du manuscrit (de l’oral prochainement) ainsi que des présentations pour les congrès. Je sais que ça n’a pas été toujours facile alors merci de m’avoir aidé jusqu’au bout.
Je remercie également les rapporteurs Frédéric Fleury et Guillaume Mitta ainsi que les membres du jury Cécile Sabourault et Denis Bourguet d’avoir accepté de lire et d’évaluer cette thèse.
Je remercie à nouveau mes encadrants ainsi que Jean-Luc Gatti pour les discussions à propos des idées d’expériences, d’interprétations et d’analyses. Un grand merci également à
Hugo Mathé-Hubert pour son aide dans les analyses statistiques et pour m’avoir fait
découvrir les joies des analyses discriminantes et MANOVA. Je le remercie également d’avoir réalisé sa thèse avant moi et avoir eu des problèmes l’ayant conduit à mettre au point une nouvelle méthode d’analyse des profils protéiques de gels 1D que j’ai grandement utilisée durant cette thèse.
Je remercie également Christian Rebuf pour avoir préparé le milieu nutritif sur lequel les drosophiles (et les parasitoïdes indirectement) se développent et m’avoir fait ainsi gagner un temps précieux.
Je remercie également toutes les personnes de l’INRA et en particulier de l’équipe ESIM (Laury Arthaud-Hugonin, Aurélie Babin, Marion Cardinaud, Dominique Cazes,
Dominique Colinet, Jean-Luc Gatti, Chami Kim, Laurent Kremmer, Séverine Lemauf, Chen Luo, Abir Oueslati, Gaurav Pandharikav, Marylène Poirié, Christian Rebuf, Sophie Tares-Amichot et Bin Wan) ainsi que ma colocataire de bureau Claire Michelet
avec qui j’ai pu échanger et discuter d’aspects scientifiques ou autres.
Je remercie l’ISA dans son ensemble pour le cadre dans lequel m’a thèse s’est déroulée ainsi qu’une attention particulière pour le personnel de la cantine, notamment Guy et
Christophe pour la qualité et la quantité des repas ainsi que leur bonne humeur.
Je remercie également Clara Sanchez et Vincent Tolassy pour leur aide et l’attention qu’ils ont portés à la réalisation d’expériences lors de leur stage volontaire d’un mois et qui m’ont permis d’avoir une première expérience dans l’encadrement de stagiaires.
Je remercie mes drosophiles et surtout mes petits parasitoïdes pour avoir survécu lors de la seconde évolution expérimentale et permis d’analyser l’évolution de leur venin. Merci pour l’ensemble des résultats que j’ai obtenu grâce à leur « sacrifice pour la science ».
Je remercie également la pharmacie d’Amiens qui nous a procuré quelques millilitres d’huile de paraffine, seule huile que nos drosophiles reconnaissent et encapsulent.
Enfin quelques notions particulières pour Marion et ses gâteaux qui ont été grandement appréciés.
Un énorme merci également à Chami, Aurélie, Laurent et Bin avec qui j’ai passé de très bons moments à l’INRA mais aussi en dehors autour d’un verre, d’une glace ou en balade et qui ont grandement participé au fait que cette thèse a été pour moi une très bonne expérience. Merci Bino de m’avoir fait découvrir quelques spécialités chinoises et m’avoir appris une phrase et un mot de chinois (j’attends juste l’été pour pouvoir la sortir). Merci
Aurélie pour tes messages quotidiens d’encouragement lors de cette fin de thèse. Merci à toi Laurent pour ton aide, pour tes petites blagounettes et pour tout le reste.
Merci également à ma famille pour avoir été là et m’avoir accompagné en particulier
Sommaire
PARTIE 1 ... 9
Introduction et généralités ... 9
1.1. Environnement et communauté d’espèces ... 11
1.2. Interaction hôte – parasitoïde ... 13
1.2.1. Définitions et généralités ... 13
1.2.2. Les mécanismes de défense de l’hôte ... 15
1.2.3. Variation immunitaire et déterminisme de la résistance chez 2 espèces de drosophile 18 1.2.4. Stratégies de virulence des parasitoïdes ... 19
1.2.5. Complexité et diversité interspécifique de la composition en protéines du venin... 22
1.3. Modèle biologique Drosophila – Leptopilina boulardi ... 25
1.3.1. Variabilité intraspécifique du succès parasitaire ... 25
1.3.2. Variabilité intraspécifique de la composition du venin ... 27
1.3.3. Variabilité inter-individuelle de la composition du venin et évolution ... 31
1.3.4. Outils disponibles ... 31
Objectifs de la thèse ... 35
PARTIE 2 ... 38
Effet d’un facteur abiotique, la température, sur l’interaction immunitaire Drosophile – L. boulardi . 38 2.1. Introduction ... 38
Article n°1 : Impact of temperature on the immune interaction between the parasitoid Leptopilina boulardi and two Drosophila host species ... 44
Présentation de l’article ... 44
Impact of temperature on the immune interaction between the parasitoid Leptopilina boulardi and two Drosophila host species ... 46
2.2. Synthèse et perspectives de la partie 2 ... 93
PARTIE 3 ... 101
Évolution de la composition en protéines du venin de L. boulardi en réponse à la sensibilité/résistance de l’hôte et à différentes espèces hôtes... 101
3.1. Introduction ... 101
3.1.1. Apport de l’évolution expérimentale ... 101
3.1.2. Intérêt du modèle Drosophila – L. boulardi ... 103
3.2. Évolution de la composition en protéines du venin de L. boulardi en réponse à la sensibilité/résistance de l’hôte ... 104
Processus évolutifs ... 104
Article n°2 : The venom of the parasitic wasp Leptopilina boulardi rapidly and differentially evolves on a resistant versus susceptible D. melanogaster host... 108
The venom of the parasitic wasp Leptopilina boulardi rapidly and differentially evolves on a
resistant versus susceptible D. melanogaster host ... 110
3.3. Évolution du succès parasitaire et de la composition en protéines du venin de L. boulardi en réponse à différentes espèces hôtes ... 153
Stratégies de virulence sur différentes espèces hôtes ... 153
Article n°3 : Experimental evolution of parasitism success and venom composition of the parasitoid wasp Leptopilina boulardi on different Drosophila host species... 157
Présentation de l’article ... 157
Experimental evolution of parasitism success and venom composition of the parasitoid wasp Leptopilina boulardi on different Drosophila host species ... 161
3.4. Synthèse et perspectives de la partie 3 ... 231
PARTIE 4 ... 243
Étude fonctionnelle (ARN interférence) du rôle de plusieurs protéines de venin « sélectionnées sur un hôte » dans le succès parasitaire de L. boulardi ... 243
4.1. Introduction ... 243
4.2. Matériel et méthodes ... 245
4.3. Résultats ... 249
4.4. Synthèse et perspectives de la partie 4 ... 257
PARTIE 5 ... 263
Discussion générale, perspectives et conclusion ... 263
PARTIE 1
Introduction et généralités
Objectifs de la thèse
PARTIE 1
Introduction et généralités
L’environnement biotique et abiotique des espèces est impacté par des changements climatiques naturels, souvent amplifiés par l’activité humaine. L’urbanisation conduit notamment à l’émission de gaz à effet de serre impliqués dans le changement de température à la surface du globe. Les changements climatiques peuvent perturber le développement ou la physiologie de certains organismes ainsi que leurs interactions (Chapin et al., 2000 ; Sala et al., 2000 ; Tylianakis et al., 2008 ; Wolinska & King 2009). À l’inverse, ils peuvent permettre l’installation d’espèces dans un nouvel environnement abiotique qui leur convient (Raitsos et al., 2010 ; Chen et al., 2011). L’arrivée ou la disparition d’espèces dans un environnement n’est pas sans conséquence sur l’ensemble de la communauté d’espèces (Gilman et al., 2010), notamment pour les niveaux trophiques supérieurs qui devront par exemple s’adapter à de nouvelles proies ou hôtes.
Les changements climatiques, tout comme l’arrivée de nouvelles espèces, peuvent impacter les interactions parasitaires dont les interactions hôte-parasitoïde - importantes pour la régulation naturelle des populations d’insectes et dans le cadre de la lutte biologique - auxquelles je me suis tout particulièrement intéressée au cours de ma thèse. Plus spécifiquement, j’ai analysé l’impact de deux facteurs environnementaux, la température et l’hôte, sur l’interaction hôte – endoparasitoïde. Dans cette interaction, les deux organismes sont ectothermes et donc directement impactés par la température extérieure qui influence leur température corporelle. De ce fait, un changement de température peut directement et fortement impacter chaque partenaire de l’interaction, mais également indirectement le parasitoïde dont la survie dépend de l’hôte dans lequel il se développe. La première question à laquelle je me suis consacrée concerne plus précisément l’impact de la température sur l’interaction hôte-parasitoïde au niveau physiologique et immunitaire, dans le sens où elle peut moduler le niveau de résistance de l’hôte et/ou le niveau de virulence du parasitoïde. Un changement de température pourrait également conduire à une modification de la répartition d’une espèce hôte avec un déplacement vers une zone plus favorable, cet hôte devenant ainsi indisponible pour le parasitoïde ou le parasitoïde se déplaçant à son tour vers la zone favorable (Delava et al., 2014). Le potentiel d’adaptation d’une espèce parasitoïde à un changement de résistance de l’hôte ou à la présence de nouvelles espèces hôtes potentielles
dans l’environnement, et notamment la rapidité avec laquelle cette espèce pourrait évoluer sous sélection fait l’objet de la seconde partie de ma thèse.
Le modèle biologique d’étude est l’endoparasitoïde Leptopilina boulardi (Figitidae) en interaction avec plusieurs espèces de Drosophile. Ce modèle présente l’avantage d’être bien étudié tant au niveau de l’issue de l’interaction que des aspects immunitaires chez l’hôte et des facteurs de virulence chez le parasitoïde. L. boulardi présente une forte variabilité intraspécifique de réussite parasitaire en fonction de l’espèce ou souche hôte, avec deux lignées bien caractérisées. Une variation de résistance de l’hôte à une de ces lignées existe également chez Drosophila melanogaster et D. yakuba. Au niveau immunitaire, cette variabilité résulte chez l’hôte d’une différence de capacité à encapsuler l’œuf du parasitoïde et chez le parasitoïde d’une différence de capacité à empêcher la réponse immunitaire, généralement via l’injection de venin par la femelle lors de l’oviposition.
La réponse d’encapsulement et la composition du venin (chez les espèces pour lesquelles ce dernier est essentiel) sont des paramètres clés pour comprendre le succès ou l’échec des parasitoïdes. Cependant, ils peuvent être potentiellement impactés par l’environnement ce qui n’a été que peu étudié pour la capacité d’encapsulement de l’hôte et jamais en ce qui concerne la composition du venin des parasitoïdes. C’est pourquoi, dans un contexte de changement climatique et avec un questionnement de biologie évolutive, j’ai combiné plusieurs approches (microinjection, observation sous loupe binoculaire, évolution expérimentale et biochimie) afin i) d’évaluer l’effet de la température sur ces deux paramètres (encapsulement et composition du venin) et ii) de tester l’effet de l’hôte (résistance, espèce hôte) sur l’évolution de la réussite parasitaire et la composition du venin. L’évolution de la résistance chez l’hôte et de la virulence chez le parasitoïde a déjà été montrée en laboratoire par plusieurs études (Fellowes et al., 1998 ; Green et al., 2000 ; Dupas et al., 1999 ; Dion et al., 2011 ; Rouchet & Vorburger 2014 ; Dennis et al., 2017), l’originalité de mon travail étant de m’intéresser à la base physiologique de la virulence, via l’analyse du venin, et à son potentiel d’évolution.
Dans la première partie de la thèse, l’introduction, je présenterai rapidement les différents types de réponse des organismes à un changement environnemental. Je me focaliserai ensuite sur l’interaction hôte – parasitoïde en présentant les mécanismes de résistance et de virulence des partenaires respectifs, leur diversité, et en discutant l’intérêt de ce modèle pour l’étude du potentiel d’évolution en réponse à un changement environnemental tel que la température ou l’hôte. L’introduction s’achèvera par la présentation du modèle biologique Drosophila – L. boulardi avec une attention particulière portée aux avantages de ce modèle, la variation
intraspécifique de réussite parasitaire et de composition protéique du venin décrite chez L. boulardi.
La seconde partie, présentée sous forme d’un article scientifique, décrira l’effet de trois températures différentes sur la réussite parasitaire et s’intéressera à la plasticité phénotypique de l’interaction immunitaire via l’étude de la capacité d’encapsulement de deux espèces de Drosophile et de la composition du venin des deux lignées de L. boulardi.
La troisième partie concernera le potentiel évolutif des parasitoïdes et plus spécifiquement celui de la composition du venin, en lien avec la résistance de l’hôte ou l’espèce hôte, analysé par une approche d’évolution expérimentale (articles 2 et 3).
Une quatrième partie présentera les résultats d’une approche fonctionnelle visant à tester le rôle dans le succès parasitaire de certaines protéines du venin identifiées lors des évolutions expérimentales comme sélectionnées sur certains hôtes.
Enfin, le manuscrit s’achèvera sur une discussion générale et perspectives.
1.1.
E
NVIRONNEMENT ET COMMUNAUTÉ D’
ESPÈCESLes organismes peuvent faire face aux changements environnementaux via différentes réponses non exclusives. La première est la plasticité phénotypique des traits d’histoire de vie qui constitue une réponse majeure à court-terme (Pigliucci, 2005). La plasticité se définit comme la capacité d’un génotype à produire différents phénotypes dans différents environnements (Pigliucci, 2005). Un des exemples les plus marquants de plasticité phénotypique concerne la détermination du sexe dépendante de l’environnement chez certains « reptiles », par exemple la tortue peinte (Chrysemys picta) dont la température d’incubation des œufs détermine le sex-ratio de la progéniture (Janzen, 1994 ; Urban et al., 2014). De nombreux autres exemples de plasticité phénotypique ont été observés chez différents organismes chez lesquels on peut observer des modifications morphologiques, physiologiques ou comportementales (Wheeler, 1986 ; Weider & Pijanowska, 1993 ; Agrawal, 2011 ; Urban et al., 2014). Par exemple, la présence de prédateurs entraîne une modification morphologique et comportementale chez certains amphibiens (Relyea, 2001), le type d’alimentation fourni aux larves de certains hyménoptères sociaux détermine leur rôle ultérieur dans la colonie (Wheeler, 1986) ou encore un changement de température ou d’alimentation peut affecter l’issue de l’interaction hôte – parasite (Wolinska & King, 2009). L’effet de l’environnement sur l’interaction hôte – parasite a souvent été étudié du fait que « tout être vivant est concerné
par le parasitisme, soit en tant qu’hôte, soit en tant que parasite » (Price, 1980). L’hôte constitue l’environnement principal du parasite auquel il doit s’adapter pour survivre et l’environnement abiotique comme la souche hôte influencent le succès parasitaire (Coats & Park 2002 ; Salvodon et al., 2005). Un changement de température peut, par exemple, impacter le taux et le succès d’infection des paramécies ou daphnies par des bactéries (Mitchell et al., 2005 ; Fels & Kaltz, 2006) ou la sensibilité du puceron Acyrthosiphon pisum à l’infection par un champignon (Stacey et al., 2003).
Une autre réponse face aux changements environnementaux est la migration vers un environnement plus favorable. Une méta-analyse réalisée par Chen et al. (2011) a mis en évidence un changement de la répartition d’espèces terrestres vers des altitudes et latitudes plus élevées de 11 m et 16,9 km par décennie, respectivement, en réponse au réchauffement climatique. Le changement de répartition s’observe également chez des espèces marines (Perry et al., 2005). Ces migrations d’individus peuvent entraîner des disparitions locales d’espèces alors que chaque être vivant vit constamment en interaction avec un ou plusieurs autres êtres vivants via des relations de prédation, compétition, mutualisme ou parasitisme. Si une espèce disparaît localement, les organismes qui en sont dépendants, notamment les prédateurs ou parasites, devront soit se déplacer à leur tour soit s’adapter pour se nourrir/se développer aux dépens d’autres individus proies ou hôtes. Pour les parasites, un changement d’hôte ne s’effectuera que via une sélection de traits impliqués dans le contournement des défenses et la régulation de la physiologie de ce nouvel hôte. Cette évolution constitue une réponse à long terme aux changements environnementaux. Deux conditions sont nécessaires à l’évolution par sélection d’un caractère donné : (i) l’existence d’une variation héritable du trait pour ce caractère et (ii) une différence de valeur sélective associée à la variation de ce caractère dans l’environnement considéré (sélection) (Brandon, 1978). Si l’environnement est constant, la sélection peut conduire à terme à une fixation des allèles « avantageux ». En revanche, si l’environnement est variable dans le temps et/ou l’espace, les pressions de sélection multiples vont favoriser le maintien de différents allèles dans les différentes conditions et ainsi le maintien de la variabilité (Kurtz et al., 2002 ; Rolff et al., 2003). Par exemple, la variation de résistance entre différentes populations de lin a conduit à la sélection de souches avirulentes et virulentes du champignon Melampsora lina réparties en fonction des différents niveaux de résistance de l’hôte (Thrall & Burdon, 2003).
1.2.
I
NTERACTION HÔTE–
PARASITOÏDE1.2.1. Définitions et généralités
Les changements environnementaux sont particulièrement importants pour les organismes strictement dépendants d’un hôte puisque leur survie dépend non seulement de leur capacité à s’adapter à ces changements mais aussi de celle de leur hôte. C’est le cas des insectes parasitoïdes qui effectuent leur développement larvaire aux dépens d’un hôte, généralement un autre insecte, conduisant à sa mort (Godfray, 1994). Leur mode de vie est ainsi à mi-chemin entre prédation et parasitisme : parasitisme car ils interagissent de façon prolongée avec leur hôte, un seul hôte leur étant nécessaire, prédation car ils se nourrissent des tissus de l’hôte ce qui conduit à sa mort (Godfray, 1994). Ce mode de vie est très répandu puisqu’il concernerait 10 à 20% des espèces d’insectes connues soit plus de 200 000 espèces selon les estimations, et il est particulièrement fréquent chez les hyménoptères (Pennacchio & Strand, 2006). On distingue différents types de parasitoïdes en fonction de leur mode de vie (Godfray, 1994 ; Quicke, 1997). Certains, appelés koinobiontes, permettent à l’hôte de poursuivre son développement après parasitisme, contrairement aux parasitoïdes idiobiontes qui paralysent l’hôte de manière permanente ou le tuent au moment de l’oviposition. On distingue aussi les endo- et les ectoparasitoïdes dont l’oviposition se fait respectivement à l’intérieur et à la surface du corps de l’hôte. Ces distinctions sont en partie redondantes puisque la plupart des endoparasitoïdes sont des koinobiontes et la plupart des ectoparasitoïdes sont des idiobiontes.
La relation entre un endoparasitoïde koinobionte et son hôte est particulière puisque le parasitoïde doit supprimer les défenses de son hôte pour pouvoir se développer et s’en nourrir tout en maintenant ses fonctions vitales durant une grande partie de son développement. La mort prématurée d’un hôte peut en effet conduire à celle de l’endoparasitoïde qui ne pourra pas boucler son cycle de reproduction. Une telle interaction où les deux partenaires meurent, se nomme « interaction non-hôte ». Dans le cadre des interactions hôtes, deux issues sont possibles : l’échec parasitaire, du le plus souvent à une défense immunitaire réussie de l’hôte conduisant à la mort de l’œuf du parasitoïde, ou le succès parasitaire lorsque le parasitoïde échappe aux défenses de l’hôte ce qui conduit à l’émergence d’un parasitoïde adulte.
Au cours de ma thèse, je me suis intéressée à une guêpe endoparasitoïde koinobionte, Leptopilina boulardi, qui parasite des larves de drosophile de second stade (L2). L’hôte infesté se développe jusqu’au stade pupal au cours duquel le parasitoïde achève de consommer son hôte puis effectue sa métamorphose pour émerger 10 jours plus tard (Kopelman & Chabora, 1984) (Figure 1.1).
Figure 1.1. Cycle de vie de Drosophila spp. parasitée par Leptopilina boulardi. La durée du
cycle de vie d’une drosophile est d’environ 10 jours à 25°C et comporte 3 stades larvaires (L1 à L3) et un stade pupal. L. boulardi parasite généralement des larves hôtes de stade L2. En cas d’échec parasitaire du à la réponse immunitaire de la drosophile, l’œuf de parasitoïde est encapsulé et meurt à l’issue de l’interaction. Si l’injection de venin à l’oviposition a permis à L. boulardi d’empêcher l’encapsulement, le développement se poursuit dans l’hôte et il y aura succès parasitaire. La larve du parasitoïde achève de consommer les tissus de l’hôte lors de la pupaison de l’hôte puis utilise la pupe de l’hôte pour effectuer sa métamorphose. Le cycle de L. boulardi jusqu’à émergence dure entre 20 et 24 jours. D’après Carolina Biological Supply Company et la thèse d’Aurore Dubuffet (2006).
1.2.2. Les mécanismes de défense de l’hôte
Différents mécanismes de défense ont été sélectionnés par l’hôte pour lutter contre un parasitoïde. La première ligne de défense, principale stratégie de lutte contre les parasitoïdes idiobiontes, consiste à éviter ou empêcher le dépôt de l’œuf du parasitoïde. Divers mécanismes peuvent être impliqués tels que la réduction du niveau des stimuli utilisés par un parasitoïde pour détecter l’hôte. Une stratégie efficace pour un phytophage consiste, par exemple, à consommer une plante émettant peu ou pas de composés volatiles dont l’effet est d’attirer les parasitoïdes, même si cette plante est de moins bonne qualité (Ohsaki & Sato, 1994 ; Dicke, 2000). De même, certaines formes de mines formées par les phytophages qui se nourrissent et vivent à l’intérieur des tissus de la plante seraient plus efficaces que d’autres pour empêcher le parasitoïde de trouver son hôte (Sinclair & Hughes, 2010). Ensuite, lorsqu’un parasitoïde arrive au contact de l’hôte, différentes stratégies comportementales peuvent permettre d’empêcher l’oviposition comme chez les pucerons dont la panoplie de comportements de défense va des coups de pattes (« kicking ») pour éloigner le parasitoïde, à l’émission de sécrétions « collantes » qui l’obligent à se nettoyer longuement, en passant par la simulation consistant à se laisser tomber sur le dos « pour feindre d’être mort » ce qui fait apparaître le puceron comme un hôte « de mauvaise qualité » (Kunert et al., 2010, Le Lann et al., 2014). Les drosophiles, comme D. melanogaster, présentent aussi des comportements physiques de défense, contorsions et roulades (« rolling »), les mouvements étant supposés permettre d’éviter le parasitisme (Hwang et al., 2007).
Une fois l’œuf de parasitoïde introduit dans l’hôte, il va être reconnu comme un corps étranger (« non soi ») et déclencher une réponse immunitaire. Dans le cas d’un « objet » de grande taille, comme un œuf de parasitoïde, la réponse chez les insectes est l’encapsulement qui consiste essentiellement dans le dépôt de couches multiples de cellules hémocytaires autour de l’œuf parallèlement à l’activation d’une cascade enzymatique, la cascade phénoloxydase (PO), qui conduit à la production et au dépôt de mélanine tout en générant des espèces réactives de l’oxygène (ROS) et de l’azote (NOS) présumées responsable de la mort du parasitoïde (Carton et al., 2008 ; Nappi, 2010).
Ce mécanisme d’encapsulement est particulièrement bien décrit chez D. melanogaster, organisme pour lequel trois catégories de cellules immunitaires ou hémocytes, participent au processus d’encapsulement : les plasmatocytes, les lamellocytes et les cellules à cristaux (Lemaitre & Hoffmann, 2007 ; Carton et al., 2008 ; Nappi, 2010, Fauvarque & Williams, 2011 ; Vlisidou & Wood, 2015) (Figure 1.2). Dans la larve de drosophile, les hémocytes,
produits par la glande hématopoïétique ou d’origine embryonnaire, sont retrouvés soit en circulation dans l’hémolymphe soit sous formes d’îlots sessiles présents sous la cuticule. Dans les larves saines de D. melanogaster, les plasmatocytes (cellules d’environ 10-15µm) représentent plus de 90% des hémocytes et ont pour principale fonction la phagocytose des corps étrangers de petite taille comme les bactéries. L’œuf de parasitoïde étant trop gros pour être phagocyté, les plasmatocytes adhèrent au chorion de l’œuf pour former une première couche cellulaire qui est ensuite reconnue par les lamellocytes (Vlisidou & Wood, 2015). Les lamellocytes sont de grosses cellules de faible épaisseur (20-50 µm) dont la proportion passe de moins de 5% en absence de parasitisme à plus de 40% au maximum après parasitisme par L. boulardi (Rizki & Rizki, 1992). Plusieurs couches successives de lamellocytes vont ensuite se former qui constitueront la capsule proprement dite (Vlisidou & Wood, 2015) (Figure 1.2). L’adhésion et l’étalement des hémocytes autour de l’œuf nécessitent une réorganisation du cytosquelette impliquant notamment les GTPases Rac1 et Rac2 (Williams et al., 2005 et 2006).
Trois gènes codant des pro-phénoloxydases (PPO) sont présents dans le génome de D. melanogaster, deux de ces protéines étant produites dans les cellules à cristaux et une dans les lamellocytes. La conversion de ces précurseurs inactif en phénoloxydases actives est contrôlée par une cascade de protéases à sérines, régulée par des inhibiteurs de la famille des serpines, ces composants étant pour l’essentiel présents dans les cellules à cristaux mais encore peu identifiés chez la drosophile (Tang, 2009 ; Nam et al., 2012). Lors de la réaction d’encapsulement, un dépôt de mélanine est ainsi observé au niveau de la capsule (Lemaitre et Hoffman, 2007) qui proviendrait principalement de l’activation de deux PPO : PPO2 (cellules à cristaux) et PPO3 (lamellocytes) (Dudzic et al., 2015) (Figure 1.2). Les ROS et NOS produits suite à l’activation de la cascade PO, qui sont supposés responsables de la mort du parasitoïde, seraient confinés au niveau du corps étranger via la capsule et ainsi rendus non délétères pour l’organisme hôte (Vass & Nappi, 2000).
Figure 1.2. Illustration du processus d’encapsulement chez Drosophila melanogaster. A.
Représentation schématique des principaux composants jouant un rôle lors de l’encapsulement d’un œuf de parasitoïde. Les plasmatocytes (première couche cellulaire) et les lamellocytes (couches cellulaires suivantes) forment une succession de couches de cellules autour de l’œuf de parasitoïde. En parallèle, l’activation d’une cascade de protéases à sérine régulées par des serpines conduit à l’activation de prophénoloxydase (PPO) en PO active, conduisant à la synthèse de mélanine et la production de radicaux cytotoxiques. B. Œuf de parasitoïde en cours d’encapsulement avec agrégation des hémocytes autour de l’œuf et début de mélanisation. C. Capsule mélanisée observée à l’intérieur d’une larve de drosophile. Les photos sont issues de Fauvarque et al. (2011) (A), Carton et al. (2008) (B) et Carton et al. (2005) (C).
Plasmatocyte Lamellocyte Cellule à cristaux
Première couche de cellules autour de l’oeuf Succession de couche de cellules autour de l’oeuf GTPases Rac1 et Rac2 PPO3 PPO2 Mélanine Radicaux cytotoxiques PO3 active Cascade de protéases à sérine régulées par des
serpines
PO2 active A
B C
1.2.3. Variation immunitaire et déterminisme de la résistance chez deux espèces de drosophile
La réussite de la réponse immunitaire (mesurée par le taux d’encapsulement) peut varier en fonction de l’environnement abiotique (Blumberg, 1997 ; Fellowes et al., 1999 ; Gherlenda et al., 2016) mais aussi entre espèces et souches hôtes et bien sûr en fonction du parasitoïde considéré (Rivers & Denlinger, 1995 ; Ferrari et al., 2001 ; Dubuffet et al., 2009 ; Dupas et al., 2013). Chez la drosophile, une variation de niveau de réponse immunitaire a été observée entre espèces, la réponse produite par D. yakuba étant par exemple généralement plus efficace que celle de D. melanogaster (Eslin & Prévost, 1998). Une corrélation entre le nombre de cellules immunitaires et le niveau de réponse d’encapsulement de plusieurs espèces de drosophile a par ailleurs été suggérée (Eslin & Prévost 1998, Kacsoh & Schlenke, 2012). Enfin, il est possible de sélectionner artificiellement pour une augmentation de la résistance à différents parasitoïdes comme montré dans des lignées de D. melanogaster (Fellowes et al., 1999).
Suite à l’observation d’une variation de résistance à la lignée de parasitoïde ISy dans une population de D. melanogaster, des lignées isofemelles ont été utilisées pour sélectionner la résistance vs sensibilité à cette lignée. Des études génétiques ont ensuite permis de mettre en évidence que la résistance, présente à une fréquence élevée dans les populations naturelles (Figure 1.3), est due à un gène majeur (Rlb), à 2 allèles. Un gène de résistance majeur à une lignée du parasitoïde Asobara tabida (Rat) a également été identifié, ces deux gènes étant localisés sur le même chromosome (Carton et al., 1992 ; Benassi et al., 1998 ; Poirié et al., 2000). La résistance à la même lignée de L. boulardi est aussi présente chez D. yakuba, le gène majeur identifié étant nommé Rlby (Dubuffet et al., 2007) (Figure 1.3). Le gène Rlb a été ultérieurement localisé sur le chromosome 2 par des expériences de transfert de chromosomes et 2 souches (résistante et sensible) ont été créées. La souche résistante est issue du transfert du chromosome 2 « résistant » dans le background « sensible » suivi de backcross successifs : les 2 souches R et S diffèrent donc uniquement par une région d’environ 100kb localisée sur le chromosome 2 contenant le gène Rlb (Hita et al., 2006). Cette région contiendrait une dizaine de gènes, parmi lesquels les gènes edl/mae et CG33136 ont été identifiés comme gènes candidats dans la résistance à L. boulardi (Hita et al., 2006). L’implication de edl/mae dans la prolifération et la différentiation cellulaire serait tout à fait compatible avec la différence de phénotype observée entre les souches R et S, à savoir une différence dans le timing du pic du nombre d’hémocytes après parasitisme par L. boulardi ISy.
Figure 1.3. Déterminisme génétique de la résistance de D. melanogaster et D. yakuba à L. boulardi. Cases foncées, échec parasitaire (encapsulement) ; cases blanches, succès parasitaire. La variation de résistance chez chacun des deux hôtes D. melanogaster (A) et D.
yakuba (B) est due à un gène majeur diallélique (Rlb, Rlby). Le succès de la lignée ISm de L.
boulardi est spécifique de l’espèce hôte alors que celui de la lignée ISy est spécifique du génotype de l’hôte. D’après Dubuffet et al. (2009).
1.2.4. Stratégies de virulence des parasitoïdes
Dans notre définition, axée sur l’aspect immunitaire des interactions, la virulence est définie comme la capacité d’un parasitoïde à empêcher ou surmonter la réponse immunitaire de l’hôte conduisant au succès parasitaire. Elle peut passer par une stratégie d’immunoévasion ou d’immunosuppression locale ou systémique. L’immunoévasion consiste, par exemple, à choisir un hôte, un stade de développement ou un tissu hôte présentant une immunité réduite. Ainsi, le parasitoïde Asobara tabida parasiterait préférentiellement D. subobscura, hôte chez lequel il n’a pas encore été observé de réponse d’encapsulement (Van Alphen & Janssen, 1981 ; Eslin & Doury, 2006). Il est aussi considéré que les parasitoïdes oophages font face à une faible défense immunitaire ou que le dépôt des œufs dans la tête, peu accessible aux cellules immunitaires, serait favorable au parasitoïde (Godfray, 1994 ; Strand & Pech, 1995 ; Moreau, 2003). Les œufs de certains parasitoïdes sont « camouflés » dans les tissus de l’hôte, comme chez une souche de A. tabida dont la couche externe de l’œuf, ou chorion, adhère aux tissus de l’hôte, l’œuf entouré de tissus évitant ainsi l’encapsulement (Eslin et al., 1996). Enfin, une dernière possibilité consiste à produire des œufs non reconnus comme « non soi »
Drosophila melanogaster Drosophila yakuba
S R 1880 1907 ISm ISy L ep to p il in a b o u la rd i Rlb- Rlb- Rlb+ Rlb+ Rlby- Rlby- Rlby+ Rlby+ A B
par l’hôte grâce à la présence de protéines spécifiques à la surface du chorion (Hu et al., 2008 ; Nalini et al., 2008 ; Dorémus et al., 2013).
La stratégie d’immunosuppression est essentiellement basée sur l’injection de composants produits par l’appareil à venin ou les ovaires par la femelle parasitoïde lors de l’oviposition. On en distingue principalement quatre types : les polydnavirus (PDV), les « virus-like particules » (VLP), les vénosomes et les protéines de venin (Gatti et al., 2012 ; Drezen et al., 2014 ; Poirié et al., 2014 ; Strand & Burke, 2014 ; Burke & Strand, 2015 ; Moreau & Asgari, 2015).
Les PDVs :
Certains groupes de parasitoïdes de la superfamille des Ichneumonidea utilisent des virus symbiotiques appelés polydnavirus (PDV) pour réussir à se développer dans leur hôte. Il existe deux types de PDV, les Bracovirus et les Ichnovirus identifiés respectivement chez les Braconidés et les Ichneumonidés. Ils sont issus évolutivement de deux événements indépendants d’intégration d’un génome viral dans le génome « ancêtre » du groupe d’espèces parasitoïdes associé à ces virus (Drezen et al., 2014 ; Drezen et al., 2017). Les Bracovirus proviendraient de la domestication d’un nudivirus (Bézier et al., 2009 ; Drezen et al., 2017), le virus « capturé » par l’ancêtre des Ichneumonidés concernés appartenant à une famille virale encore non décrite (Volkoff et al., 2010 ; Drezen et al., 2017). Le génome des PDVs est retrouvé sous 2 formes différentes : une forme linéaire intégrée au génome du parasitoïde assurant leur transmission verticale obligatoire et une forme segmentée, composée de multiples cercles d’ADN double brin, présente dans les virions. Les gènes présents sur ces cercles proviennent essentiellement de la guêpe et ils sont impliqués dans le succès parasitaire sur l’hôte (Volkoff et al., 2010 ; Drezen et al., 2014 et 2017). Les virions, produits dans une région spécialisée des ovaires des femelles parasitoïdes appelée calice ovarien, sont injectés dans l’hôte au moment de l’oviposition. Les gènes de PDV sont alors transcrits via la machinerie cellulaire de l’hôte, leur expression étant indispensable au succès du parasitoïde (Drezen et al., 2014).
Les VLPs :
Le terme de virus-like particules (VLPs) est un terme générique désignant des structures ressemblant morphologiquement plus ou moins à des virus mais s’en distinguant notamment par l’absence d’acides nucléiques (Gatti et al., 2012). Les VLPs décrites dans la littérature possèdent des formes, structures et fonctions (mal connues) variables en fonction des espèces et souches de parasitoïdes (Gatti et al., 2012). Elles peuvent être produites au niveau des
ovaires comme celles décrites chez l’Ichneumonidé Venturia canescens. Ces VLPs contiennent des protéines d’origine « guêpe » et sont retrouvées chez l’hôte au niveau de la surface de l’œuf du parasitoïde auquel elles confèrent une protection, probablement via un phénomène d’immunosuppression locale (Pichon et al., 2015 ; Drezen et al., 2017). L’origine des VLPs de V. canescens a récemment été identifiée : elles proviennent de la capture d’un virus ancêtre de type nudivirus qui aurait remplacé l’ichnovirus (PDV) présent auparavant dans cette espèce (Pichon et al., 2015 ; Drezen et al., 2017).
Les vénosomes :
Certaines VLPs sont produites dans le venin et semblent d’origine essentiellement vésiculaire comme chez les parasitoïdes des genres Leptopilina et Ganaspis. Elles ont ainsi été baptisées vénosomes. Chez L. heterotoma et L. victoriae, il a été montré que les vénosomes induisent un changement de morphologie des lamellocytes de D. melanogaster empêchant ainsi a priori leur adhésion et la formation d’une capsule (Rizki & Rizki, 1990 ; Morales et al., 2005 ; Gatti et al., 2012). On trouve également des vénosomes dans le venin de L. boulardi dont je parlerai dans la partie « modèle biologique ».
Les protéines de venin :
Contrairement au venin de la plupart des animaux venimeux qui est associé à la fonction de prédation ou de défense (Fry et al., 2009), le venin des endoparasitoïdes, de composition essentiellement protéique, leur permet de réguler l’immunité et la physiologie de l’hôte (voir notamment pour synthèse Poirié et al., 2009 et 2014 ; Asgari & Rivers, 2011 ; Moreau & Asgari, 2015). À titre d’exemple, la protéine Vn.11 de Pteromalus puparum affecterait les hémocytes de l’hôte, réduisant leur nombre et de ce fait la capacité d’encapsulement (Wu et al., 2008). De nombreux parasitoïdes inhibent également le processus de mélanisation via la cascade PO (Colinet et al., 2009 ; Tian et al., 2010 ; Teng et al., 2016). Le parasitoïde Aphidius ervi injecte une gamma glutamyl transpeptidase (GGT) qui induit la castration du puceron hôte, augmentant ainsi les ressources disponibles pour le développement de la larve parasitoïde (Falabella et al., 2007). Le venin peut agir en synergie avec d’autres facteurs comme chez Chelonus inanitus dont les protéines de venin agiraient en synergie avec les PDVs pour faciliter leur entrée dans l’hôte (Kaeslin et al., 2010). Il peut également ne pas avoir d’effet détecté dans le succès parasitaire comme chez Hyposoter didymator, un Ichneumonidé à PDV (Dorémus et al., 2013).
Comme chez les autres animaux venimeux, certaines protéines de venin des parasitoïdes sont supposées provenir de la duplication d’un gène codant une protéine souvent impliquée dans un processus physiologique clé suivie de l’expression spécifique et beaucoup plus forte d’une des deux copies dans l'appareil à venin (Poirié et al., 2014 ; Mrinalini & Werren, 2017). Il n’y a cependant pas encore eu de réelle étude de l’importance de ce processus chez les parasitoïdes alors que d’autres mécanismes semblent également à l’œuvre. Il a en effet été montré récemment qu’un gène codant une chitinase abondante dans le venin de différentes espèces de la superfamille des Chalcidoidea proviendrait d’un transfert horizontal depuis un champignon parasite unicellulaire (Martinson et al., 2016). Plus récemment encore, un mécanisme de recrutement par co-option de gènes en copie unique pour une fonction dans le venin via des mécanismes de régulation en cis de leur expression a été proposé chez Nasonia vitripennis et trois espèces apparentées (Martinson et al., 2017).
1.2.5. Complexité et diversité interspécifique de la composition en protéines du venin
Avec le développement de nouvelles technologies de séquençage et de spectrométrie de masse, il a été possible d’étudier et d’analyser la composition en protéines de venin d’un certain nombre de parasitoïdes (de Graaf et al., 2010 ; Vincent et al., 2010 ; Zhu et al., 2010 ; Colinet et al., 2013a et 2014 ; Goecks et al., 2013 ; Burke & Strand, 2014 ; Yan et al., 2016 ; Mathé-Hubert et al., 2016 ; Manzoor et al., 2016 ; Sim & Wheeler 2016 ; Liu et al., 2017 ; Zhao et al., 2017). Ces études ont révélé une composition en protéines de venin complexe et variée (voir pour synthèse Poirié et al., 2014 et Moreau & Asgari, 2015). On trouve, par exemple, entre 49 et 176 protéines différentes identifiées selon l’espèce ou la lignée de Leptopilina considérée et les approches transcriptomiques choisies pour focaliser sur les transcrits de venin les plus abondants (séquençage Sanger pour Colinet et al., 2013a) ou dresser un panel exhaustif de transcrits (séquençage haut débit Illumina d’ADNc d’abdomens femelles pour Goecks et al., 2013). Cependant, bien que de nombreux rôles potentiels aient été proposés pour certaines d’entre elles, la grande majorité des protéines, y compris parmi les plus abondantes, n’ont pas de fonction prédite ni même de domaine caractéristique. Le rôle des protéines du venin des parasitoïdes reste donc largement inconnu et de nouvelles fonctionnalités pourraient être décrites dans les prochaines années.
Certaines familles de protéines sont présentes dans le venin de nombreuses espèces de parasitoïdes comme, par exemple, les protéases à sérine trouvées chez certains Braconidés (Aphidius ervi, Microplitis demolitor), Ichneumonidés (Chelonus inanitus, Cotesia rubecula, H. didymator, Pimpla hypochondriaca), Pteromalidés (N. vitripennis, Pteromalus puparum) et Figitidés (L. heterotoma). À l’inverse, certaines familles de protéines n’ont à ce jour été identifiées que chez une seule espèce ou un seul genre, comme le facteur de paralysie « pimplin » présent uniquement dans le venin de P. hypochondriaca (Parkinson et al., 2002 ; Poirié et al., 2014) ou les protéines de la famille RhoGAP trouvées chez L. boulardi et L.
heterotoma (voir modèle biologique).Curieusement, l’identification d’une protéine donnée ne
semble pas forcément liée à la proximité phylogénétique. Ainsi, certaines protéines sont décrites dans le venin d’espèces voire de groupes éloignés mais pas dans des espèces proches, même s’il faut rester prudent car une protéine pourrait être effectivement présente dans le venin tout en étant en quantité trop faible pour être détectée. On peut citer le cas de l’aspartylglucosaminidase (AGA) identifiée chez le braconide A. tabida (et absente chez A. japonica) mais aussi chez le figitide L. heterotoma (et absente chez L. boulardi) (Moreau et al., 2004 ; Colinet et al., 2013a). Enfin, la composition en protéines de venin peut varier entre espèces proches. Par exemple, deux espèces du parasitoïde Psyttalia, l’une généraliste, P. concolor, l’autre spécialiste, P. lounsburyi partagent un peu moins de 50% des protéines du venin (Mathé-Hubert et al., 2016) (Figure 1.4). La différence de composition du venin est encore plus marquante pour deux espèces du genre Leptopilina, qui diffèrent également par leur caractère généraliste (L. heterotoma) ou spécialiste (L. boulardi), en particulier si on s’intéresse aux protéines les plus abondantes dans le venin. En effet, aucune des protéines du venin majeures n’est commune à ces deux espèces de Leptopilina (Colinet et al., 2013a) alors qu’elles parasitent plusieurs hôtes communs comme D. melanogaster ou D. simulans (Figure 1.4). Ces différences de composition pourraient, au moins en partie, provenir de modifications de l’expression des gènes codant les protéines de venin concernées suite à des modifications de leur régulation en cis comme récemment montré chez quatre espèces apparentées dont deux du genre Nasonia (Martinson et al., 2017).
Figure 1.4. Comparaison inter- et intraspécifique de la composition protéique du venin pour Psyttalia spp. et Leptopilina spp. A. Profils électrophorétiques des protéines du venin pour deux populations de P. lounsburyi (PlAS : Afrique du Sud ; PlK : Kenya) et pour P. concolor (Pc). B. Diagramme de Venn montrant le nombre de protéines de venin partagées par les deux espèces de Psytallia. C. Profils électrophorétiques des protéines de venin pour les deux lignées ISm et ISy de L. boulardi (Lbm et Lby, respectivement) et pour L. heterotoma (Lh). D. Diagramme de Venn montrant le nombre protéines de venin considérées comme abondantes (uniséquences avec plus de 10 ESTs) en commun entre les deux espèces de Leptopilina et les deux lignées de L. boulardi. Figures issues de Mathé-Hubert et al. (2016) et Colinet et al. (2013a). Les gels SDS-PAGE ont été colorés au nitrate d’argent. Les masses moléculaires sont données en kDa.
A
B
C
1.3.
M
ODÈLE BIOLOGIQUED
ROSOPHILA–
L
EPTOPILINA BOULARDIMon modèle d’étude est constitué par L. boulardi et trois espèces de drosophile, D. melanogaster, D. yakuba et D. simulans, parmi les quelques espèces du sous-groupe melanogaster auxquelles il est fortement inféodé. Ce modèle présente plusieurs avantages majeurs. Le premier, détaillé dans la partie 1.3.1 ci-dessous et déjà mentionné plus haut, est qu’une variabilité intraspécifique du succès parasitaire a été abondamment décrite chez L. boulardi avec deux lignées bien caractérisées. Le deuxième intérêt du modèle est que ces deux souches présentent également une variabilité importante de composition protéique du venin (voir partie 1.3.2 ci-dessous) et qu’une variabilité interindividuelle de cette composition a été mise en évidence par l’équipe (voir partie 1.3.3 ci-dessous). Enfin, différents outils, détaillés dans la partie 1.3.4, étaient disponibles sur ce modèle dont j’ai pu bénéficier au cours de ma thèse.
1.3.1. Variabilité intraspécifique du succès parasitaire
L. boulardi, considéré comme spécialiste, est inféodé dans nos régions à D. melanogaster et D. simulans (Fleury et al., 2009). Toutefois, une population issue du Congo a été montrée comme moins virulente contre D. melanogaster mais capable de parasiter quelques espèces de drosophiles présentes en Afrique tropicale dont D. yakuba (Carton et al., 1992). Cette différence de gamme d’hôte pourrait être due à un nombre d’espèces hôtes potentielles plus élevé en région tropicale que dans les régions méditerranéennes (Dupas et al., 2003). Cette population congolaise et une population méditerranéenne originaire de Tunisie sont représentées par deux lignées isofemelles bien caractérisées et maintenues en laboratoire.
La lignée ISm (stock de Gif-sur-Yvette n°431), représentative des populations méditerranéennes, contourne la défense immunitaire de toutes les souches connues de D. melanogaster alors qu’elle est toujours encapsulée par D. yakuba (Figure 1.5). La lignée ISy (stock de Gif-sur-Yvette n°486), représentative de la population congolaise, parvient à empêcher l’encapsulement dans ces deux espèces, mais son succès dépend du génotype sensible ou résistant de l’hôte (Figure 1.5). En effet, les œufs de cette lignée sont rarement encapsulés par la souche S de D. melanogaster (stock de Gif-sur-Yvette n°1089) alors que leur taux d’encapsulement par la souche R (stock de Gif-sur-Yvette n°1088) est supérieur à 80% (Carton et al., 1992). Pour rappel, les souches R et S de D. melanogaster diffèrent uniquement par une région du chromosome 2 contenant le gène de résistance à la lignée ISy
(voir partie 1.2.3 ci-dessus). Au cours de ma thèse, j’ai également utilisé une souche de D. melanogaster sympatrique de ISm, appelée D. melanogaster Nasr (stock de Gif-sur-Yvette n°1333) dans ce manuscrit, sensible aux deux lignées de L. boulardi. Deux souches de référence ont également été décrites chez D. yakuba, l’une sensible (stock de Gif-sur-Yvette n°1880D), l’autre résistante (stock de Gif-sur-Yvette n°1907) à la lignée ISy de L. boulardi (Dubuffet et al., 2007). La souche 307, collectée à Sao Tome, a cependant été préférée à la souche 1880D en raison en raison d’un meilleur succès parasitaire observé au cours de ma thèse (100% sur D. yakuba 307 contre 60% sur D. yakuba 1880D). Enfin, j’ai également utilisé une souche d’une troisième espèce de drosophile, D. simulans, originaire du Japon et sensible aux deux lignées de L. boulardi (Figure 1.5).
Figure 1.5. Résultat des interactions entre les deux lignées ISm et ISy de L. boulardi et les
souches des espèces hôtes D. melanogaster, D. yakuba et D. simulans. Hôte
D. melanogaster D. yakuba D.
simulans
Parasitoïde S R Nasr 1880 1907 307 Japon
L. boulardi
I Sm
Succès Succès Succès Echec Echec Echec Succès
I Sy
1.3.2. Variabilité intraspécifique de la composition du venin
La variation de composition du venin au sein d’une même espèce de parasitoïde n’a presque pas été étudiée mais l’équipe a montré récemment que les lignées ISm et ISy de L. boulardi ne partagent que 57% et 71% des protéines venimeuses ce qui correspond à un peu plus de la moitié des protéines abondantes (Colinet et al., 2013a). Les principales protéines étudiées à ce jour présentent des différences quantitatives ou qualitatives entre lignées (Colinet et al., 2010, 2013a) qui pourraient expliquer leur variation de succès parasitaire selon l’espèce et la souche hôte.
Une des protéines les plus abondantes chez la lignée ISm du parasitoïde L. boulardi appartient à la famille des RhoGAPs et est appelée LbGAP (Labrosse et al., 2005). LbGAP cible in vitro les Rho GTPases Rac1 et Rac2 de D. melanogaster (Colinet et al., 2007), essentielles au processus d’encapsulement (Williams et al., 2005 et 2006). Son internalisation dans les lamellocytes de l’hôte suite au parasitisme induirait des modifications de leur morphologie via un effet sur le cytosquelette, le niveau de déformation de ces cellules étant corrélé positivement au nombre de spots LbGAP qu’elles contiennent (Colinet et al., 2007). L’équipe a montré récemment que le transport de LbGAP dans les lamellocytes est assuré par les vénosomes (Wan et al., soumis). L’utilisation d’anticorps anti-LbGAP a permis de proposer un rôle de la protéine LbGAP dans la virulence de L. boulardi contre la souche R de D. melanogaster (Colinet et al., 2010). En effet, l’injection de l’anticorps dans les larves hôtes avant parasitisme par L. boulardi ISm augmente le taux d’encapsulement. Par ailleurs, la protection conférée par l’injection de venin de la lignée ISm aux œufs de la lignée ISy dans cette même souche hôte est considérablement réduite si le venin injecté a été préalablement incubé avec l’anticorps contre LbGAP. Le transport de LbGAP dans les lamellocytes est assuré par les vénosomes (Wan et al., soumis). LbGAP est produite en quantité 50 fois plus abondante dans le venin que son homologue chez ISy, LbGAPy qui partage 95% de similitude avec LbGAP et cible également Rac1 et Rac2 in vitro (Colinet et al., 2010). Cette différence quantitative qui pourrait participer à la différence de réussite des deux lignées sur D. melanogaster R s’expliquerait par une différence de régulation en cis de la transcription du gène, l’allèle lbgap étant exprimé à un plus haut niveau que l’allèle lbgapy (Colinet et al., 2010). Plus récemment, huit autres protéines de venin contenant également un domaine RhoGAP ont été identifiées pour les deux lignées de L. boulardi avec également des différences d’abondance pour certaines d’entre elles entre les deux lignées (Figure 1.6, Tableau 1.1) (Colinet et al., 2013a). Le rôle de ces RhoGAPs est encore inconnu, toutes ces
protéines étant mutées a minima au niveau d’une arginine nécessaire à l’activité GAP et/ou un ou plusieurs des acides aminés participant à l’interaction avec les Rac GTPases (Colinet et al., 2013a). La détection d’une évolution sous sélection positive pour certains de ces sites importants pour l’activité GAP, notamment, suggère une diversification fonctionnelle de ces RhoGAPs mutées et un rôle différent de celui d’une RhoGAP classique (résultats non publiés de l’équipe).
Figure 1.6. Profil électrophorétique des protéines contenues dans le venin et localisation des
bandes correspondant aux serpines et aux RhoGAPs identifiées pour L. boulardi ISm et ISy. Les gels SDS-PAGE ont été colorés au nitrate d’argent. Les masses moléculaires sont données en kDa. D’après Colinet et al. (2013a).
LbGAP LbGAP1.1 LbGAP1.2 LbGAP3 LbGAP5 LbGAP1.3 LbGAP2.1 LbGAP4 LbGAP2.2 LbGAPy LbGAPy3.1 LbGAPy3.2 LbGAPy4 LbGAPy1.1 LbGAPy5 LbGAPy1.2 LbGAPy2 LbGAPy6 ISm ISy LbSPNm LbSPNy 250 - 130 - 95 - 72 - 55 - 36 - 28 - 17 - 11 -
Tableau 1.1. Classement par ordre d’abondance (rang) des protéines de venin de la famille
des serpines et de la famille des RhoGAP identifiées dans les deux souches de L. boulardi (Colinet et al. 2013a). L’abondance d’une protéine a été estimée via le nombre d’ESTs correspondantes en transcriptomique (EST) et le nombre de « matches » avec des peptides identifiés en protéomique avec Mascot (Mascot). Une * signifie qu’aucun peptide n’a été trouvé pour la protéine correspondante dans l’analyse de Colinet et al. (2013a) mais que des peptides ont été identifiés ultérieurement par l’équipe une fois la séquence complétée (résultats non publiés).
A l’exception de LbGAP, première protéine de venin de cette famille à avoir été identifiée, les protéines RhoGAP trouvées dans le venin sont nommées en fonction de leur abondance respective (LbGAP1 rang 2 puis LbGAP2 rang 4 chez ISm par exemple). Les séquences dont l’identité est supérieure à 70% ont été regroupées (par exemple, LbGAP1.1, LbGAP1.2 et LbGAP1.3). Les cases vides montrent une absence de la séquence correspondante dans l’autre souche.
L. boulardi ISm L. boulardi ISy
Protéine Rang EST Mascot Protéine Rang EST Mascot
LbSPNm 1 106 138 LbSPNy 1 59 58 LbGAP 6 37 42 LbGAPy > 43 1 0* LbGAP1.1 2 87 88 LbGAPy1.1 6 20 26 LbGAP1.2 24 6 35 LbGAPy1.2 > 20 5 0* LbGAP1.3 28 4 48 LbGAP2.1 4 58 26 LbGAPy2 13 15 10 LbGAP2.2 10 30 35 LbGAP3 25 6 7 LbGAPy3.1 > 18 6 1 LbGAPy3.2 > 24 3 1 LbGAP4 > 36 2 1 LbGAPy4 14 14 25 LbGAP5 > 36 2 5 LbGAPy5 > 43 3 0* LbGAPy6 > 43 2 0*