HAL Id: tel-01115741
https://hal.sorbonne-universite.fr/tel-01115741
Submitted on 12 Feb 2015HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Caractérisations biochimiques et génétiques des
complexes pigment-protéines dans le procaryote marin
Prochlorococcus : origine évolutive et rôle dans
l’adaptation phosynthétique aux conditions lumineuses
Laurence Garczarek
To cite this version:
Laurence Garczarek. Caractérisations biochimiques et génétiques des complexes pigment-protéines dans le procaryote marin Prochlorococcus : origine évolutive et rôle dans l’adaptation phosynthétique aux conditions lumineuses. Biochimie, Biologie Moléculaire. Institut National Agronomique de Paris-Grignon, 2000. Français. �tel-01115741�
Au vu de la législation sur les droits d'auteur, ce travail de thèse demeure la
propriété de son auteur, et toute reproduction de cette oeuvre doit faire l'objet
d'une autorisation de l'auteur. (cf Loi n°92-597; 1/07/1992. Journal Officiel,
2/07/1992)
I
NSTITUT NATIONAL AGRONOMIQUEP
ARIS-G
RIGNONThèse
Pour obtenir le grade de
D
OCTEUR DE L’
INSTITUT NATIONAL AGRONOMIQUEP
ARIS-G
RIGNONSoutenue le 27 juin 2000 par
Laurence G
ARCZAREKC
ARACTERISATION BIOCHIMIQUE ET GENETIQUE DES COMPLEXES PIGMENT-PROTEINES CHEZ LE PROCARYOTE MARIN
P
ROCHLOROCOCCUS: O
RIGINE EVOLUTIVE ET ROLE DANS L'
ADAPTATION DE L’
APPAREILPHOTOSYNTHETIQUE AUX CONDITIONS LUMINEUSES
Laboratoire d'accueil
UPR9042/UFR937
: S
TATIONB
IOLOGIQUE DER
OSCOFFDirecteur de Thèse : Frédéric P
ARTENSKYComposition du jury
Mme Lise Caron, Chargé de Recherche CNRS, ENS Paris
Rapporteur
Mme Susan Loiseaux DeGoër, Directeur de Recherche CNRS, SBR Roscoff
Rapporteur
Mr Hans C. P. Matthijs, Professeur associé, Université d'Amsterdam
Examinateur
Mr Jean Claude Meunier, Professeur de l'INA-PG
Président
Mr Frédéric Partensky, Chargé de Recherche CNRS, SBR Roscoff
Examinateur
REMERCIEMENTS
Je tiens avant tout à remercier très chaleureusement Frédéric Partensky qui a dirigé ce travail de thèse. Je le remercie pour m'avoir entraînée avec enthousiasme et dynamisme dans ses idées florissantes et pour avoir encouragé les miennes. Sa disponibilité, sa confiance et son ouverture aux discussions argumentées m'ont permis de trouver tout le soutien qui m'était nécessaire au cours de ces quatre années.
Mes remerciement s'adressent également à André Toulmond pour m'avoir ouvert les portes de la Station Biologique de Roscoff et à Daniel Vaulot pour son accueil au sein de l'équipe Diversité du phytoplancton, ses conseils toujours pertinents et le support matériel de ce travail de thèse.
Je remercie Jean Claude Meunier pour m'avoir donné accès à la formation de spécialisation de biochimie de l'INA-PG qu'il dirige et pour avoir accepté d'être membre de ce jury.
J'adresse un remerciement tout particulier à Wolfgang Hess et Georg van der Staay pour leur très précieuse collaboration. L'intérêt et l'enthousiasme qu'ils ont tous deux porté à ce travail ont été d'une aide inestimable.
Merci à tous ceux qui ont contribué plus ou moins directement à ces travaux de recherche lors d'expériences diverses : Jean Claude Thomas pour m'avoir accueilli dans son laboratoire à l'ENS (Paris), Julia Holzendorff pour le temps qu'elle m'a consacré lors de ma visite à l'Université de Humbolt (Berlin), l'équipage de la Thalassa pour leur disponibilité à toute épreuve, Nicole Guyard et Maryse Colin pour leur efficacité à dénicher les articles aux références souvent incomplètes et enfin Olivier Colin et Claude Leroux pour leurs multiples assistances dans le maniement d'Unix et des logiciels de biologie moléculaire.
Je remercie également l'ensemble de l'équipe des Green's, qui plus encore que n'importe qui a permis de faire de cette thèse un moment agréable aussi bien scientifiquement qu'humainement.
Enfin je remercie les membres du jury : Lise Caron, Susan Loiseaux DeGoër, Nicole Tandeau de Marsac, Jean Claude Meunier et Hans Matthijs qui ont accepté de juger ce travail de thèse.
TABLE DES MATIERES
CHAPITRE I : INTRODUCTION ... 11
I- L
ES PROTEINES DE L'
APPAREIL PHOTOSYNTHETIQUE LIANT LA CHLOROPHYLLE... 13
I.1- PHOTOSYNTHESE OXYGENIQUE... 13
I.2- LA PIGMENTATION DE L'APPAREIL PHOTOSYNTHETIQUE... 16
I.3- PROTEINES PIGMENTAIRES DE L'APPAREIL PHOTOSYNTHETIQUE... 18
I.3.1- Les complexes du centre ... 19
I.3.1.1- Le complexe du centre du photosystème II... 20
Le centre réactionnel du PS II (D1/D2) : CR II...20
CP47 et CP43...22
CP43' (IsiA)...23
I.3.1.2- Le centre réactionnel du PS I (PsaA/ PsaB) : CR I... 24
I.3.2- Les complexes antennaires ... 26
I.3.2.1- Les phycobilisomes des cyanobactéries et des algues rouges ... 26
I.3.2.2- Les protéines à Chl a/b des plantes supérieures ... 28
Antenne collectrice associée au PS II...29
Antenne collectrice associée au PS I...31
I.3.2.3- Les antennes collectrices procaryotiques à Chl a/b... 32
I.3.2.4- Les antennes collectrices des algues ... 33
Les algues à Chl a/b ...33
Les algues à Chl a et phycobiliprotéines (Rhodophyta)...34
Les Algues à Chl a/c ...34
I.3.2.5- Protéines apparentées aux Lhc... 35
Protéines induites par le stress (ELIP, HLIP)...35
Gènes putatifs présentant des homologies avec les Lhcs...36
I.4- ADAPTATION AUX VARIATIONS LUMINEUSES... 37
I.4.1- Adaptation à court terme ... 38
I.4.1.1- Transition Etat1-Etat2... 38
I.4.1.2- Le cycle des xanthophylles ... 40
I.4.1.3- Agrégation de l'antenne LHC II... 40
I.4.2.1- Réponses physiologiques à la lumière... 41
I.4.2.2- Réponses moléculaires à la lumière ... 42
Régulation des protéines des centres réactionnels par la lumière...42
Régulation des protéines d'antenne par la lumière...44
Expression des protéines photosynthétiques en lumière jour-nuit...45
II- P
RESENTATION DU MODELE D'
ETUDE, P
ROCHLOROCOCCUS... 47
II.1- MISE EN EVIDENCE DE PROCHLOROCOCCUS ET POSITION PHYLOGENETIQUE... 48
II.1.1- Découverte de Prochlorococcus ... 48
II.1.2- Position phylogénétique par rapport aux cyanobactéries typiques... 49
II.2- PARTICULARITES CELLULAIRES... 50
II.2.1- Ultrastructure... 50
II.2.2- Taille du génome et composition en bases... 50
II.3- CARACTERISTIQUES PHOTOSYNTHETIQUES... 51
II.3.1- Composition pigmentaire ... 51
II.3.1.1- Chlorophylle ... 51
II.3.1.2- Caroténoïdes... 53
II.3.1.3- Phycoérythrine ... 53
II.3.2- Photoacclimatation et photoadaptation ... 53
II.3.3- Caractérisation de l'appareil photosynthétique ... 55
II.4- DISTRIBUTION OCEANIQUE DE PROCHLOROCOCCUS... 57
II.5- DIVERSITE GENETIQUE DE PROCHLOROCOCCUS... 59
II.5.1- Diversité des souches de Prochlorococcus en culture... 59
II.5.2- Diversité des populations naturelles de Prochlorococcus... 61
III- D
EMARCHE ADOPTEE AU COURS DE CE TRAVAIL DE THESE... 62
IV- L
ISTE DE PUBLICATION EFFECTUEES PENDANT LA THESE... 63
CHAPITRE II : MATERIEL ET METHODES... 64
I- D
ESCRIPTION ET CULTURE DES SOUCHES DISPONIBLES AU LABORATOIRE... 64
I.1- SOUCHES CULTIVEES A LA STATION BIOLOGIQUE DE ROSCOFF... 64
II- M
ETHODE DE CARACTERIS ATION DES COMPLEXES PIGMENTS-
PROTEINES... 66
II.1- METHODE D’ISOLEMENT ET DE CARA CTERISATION DU PHOTOSYSTEME I... 66
II.1.1- Extraction des thylacoïdes... 66
II.1.2 - Isolement du photosystème I ... 66
II.1.2.1- Solubilisation des thylacoïdes... 66
II.1.2.2- Séparation des complexes Chl-protéines ... 67
Séparation des complexes Chl-protéines sur gel non dénaturant...67
Isolement des complexes protéiques par gradient de saccharose...67
II.1.3- Analyse du photosystème I... 68
II.3.1.1- Analyse de la composition protéique du PS I sur gel d’électrophorèse. ... 68
II.3.1.2- Détection immunologique... 68
II.3.1.3- Caractérisation des fractions enrichies en PS I... 69
Spectrofluorimétrie...69
Spectrophotométrie ...69
Chromatographie liquide à haute pression (HPLC)...69
Microscopie électronique...69
III- O
UTILS MOLECULAIRES... 70
III.1- TECHNIQUES D’EXTRACTION DES ACIDES NUCLEIQUES... 70
III.1.1- Extraction de l'ADN total... 70
III.1.2- Extraction d'ADN plasmidique à l’aide du kit "Flexiprep". ... 71
III.1.3- Extraction des ARN totaux ... 71
III.1.4- Extraction de l'ADN bicaténaire des bactériophages ... 72
III.2- AMPLIFICATION D'ADN PAR REACTION EN CHAINE DE LA POLYMERASE (P.C.R.)... 72
III.3- ANALYSE DES ACIDES NUCLEIQUES... 72
III.3.1- Analyse électrophorétique ... 72
III.3.1.1- Analyse de l’ADN sur gel d'agarose 0.8 % ... 72
III.3.1.2- Analyse de l’ADN sur gel de polyacrylamide ... 73
III.3.1.3- Analyse de l’ADN par electrophorèse en champs pulsé (PFGE)... 73
III.3.1.4- Analyse des réactions de séquence sur gel de polyacrylamide 6% ... 73
III.3.1.5- Analyse des ARN sur gel d'agarose 1.5 % / formaldéhyde 4 % / MEN 1X ... 74
III.3.1.6- Purification de fragments d'ADN sur gel d'agarose avec le kit "Wizard" (Pharmacia Biotech) ... 74
III.4- TECHNIQUE D’HYBRIDATION DES ACIDES NUCLEIQUES... 74
III.4.1- Marquage radioactif d'une sonde ADN par amorçage aléatoire ("Random Priming") ... 74
III.4.2- Marquage radioactif d'une sonde ARN... 75
III.4.3- Southern blot ... 75
III.4.4- Northern blot ... 76
III.4.5- Méthode de protection à la RNase ("R.P.A.") ... 76
III.4.6- Criblage d'une banque phagique ... 77
III.4.6.1- Préparation de bactéries compétentes ... 78
III.4.6.2- Titrage de la banque de phages ... 78
III.4.6.3- Criblage de la banque de phages ... 78
III.5- SEQUENÇAGE... 79
III.5.1- Clonage du produit de PCR... 79
III.5.2- Réaction de séquence... 79
III.6- ALIGNEMENT ET ANALYSE PHYLOGENETIQUE DE SEQUENCES... 79
IV- A
NALYSES STRUCTURALES DES SEQUENCES PROTEIQUES... 80
IV.1- PRINCIPE DE L'ANALYSE DE GROUPES HYDROPHOBES ("HCA")... 80
IV.1.1- La représentation HCA... 80
IV.1.2- Interprétation des diagrammes ... 81
IV.1.3- Intérêt de l’HCA dans l'alignement de séquences primaires... 82
CHAPITRE III : LE PHOTOSYSTEME I... 83
Article 1 : Isolation and characterization of the photosystem I from two strains of the …….. 86
marine oxychlorobacterium Prochlorococcus.
CHAPITRE IV : L’ANTENNE MAJEURE A CHL A/B ... 100
Article 2 : Multiplication of antenna genes as a major adaptation to low light in a marine prokaryote. ……….. 102
Article 3 : Expression and phylogeny of the multiple antenna genes of the low-light adapted Prochlorococcus strains CCMP1375. …………...……….. 107
CHAPITRE V : DYNAMIQ UE DES GENES PHOTOSYNTHETIQUES... 119
Article 4 : Differential expression of antenna and core genes in the oxychlorobacterium Prochlorococccus PCC 9511 strains grown under L/D cycle ……..………..…… 120
CHAPITRE VI : ORIGIN E EVOLUTIVE DES PROTEINES PIGMENTAIRES ... 130
Article 5 : A revisited scheme for the evolution of transmembrane Chl-binding proteins using Hydrophobic Cluster Analysis ……… 132
CHAPITRE VII : CONCLUSIONS ET PERSPECTIVES... 145
Mise en évidence des particularités de l'appareil photosynthétique de Prochlorococcus et conséquences sur les propriétés de photoadaptation ...145
Spéciation chez Prochlorococcus et estimation de la diversité génétique ...148
Origine et évolution des protéines photosynthétiques de Prochlorococcus...150
BIBLIOGRAPHIE ... 152
ANNEXES ... 179
Annexe 1 (Article 6) : Photosynthesis apparatus of chl b and d-containing oxyphotrophic bacteria.
Annexe 2 (Article 7) : Characterization of the photosytem I subunits PsaI and PsaL from two strains of the marine oxyphototrophic prokaryote Prochlorococcus.
Annexe 3 (Article 8) : Rapid evolutionary divergence of photosystem I core subunits PsaA and PsaB in marine prokaryotes.
TABLE DES ILLUSTRATIONS
Fig. 1: Représentation générale des centres réactionnels des complexes photosynthétiques connus parmi les phyla des eubactéries et des plantes supérieures ………...13 Fig. 2 : Diagramme schématique de la chaîne de transport d’électron dans les membranes thylacoïdales eucaryotiques……….…14 Fig. 3 : Schéma en "Z" représentant le transfert d'électrons dans la membrane des thylacoïdes depuis l'eau jusqu'au NADP………..15 Fig. 4 : Formules structurales des chlorophylles, des chromophores des phycobilines et des
caroténoïdes des algues………..16 Fig. 5 : Modèle structural du complexe protéique du PSII incluant les cofacteurs du transfert
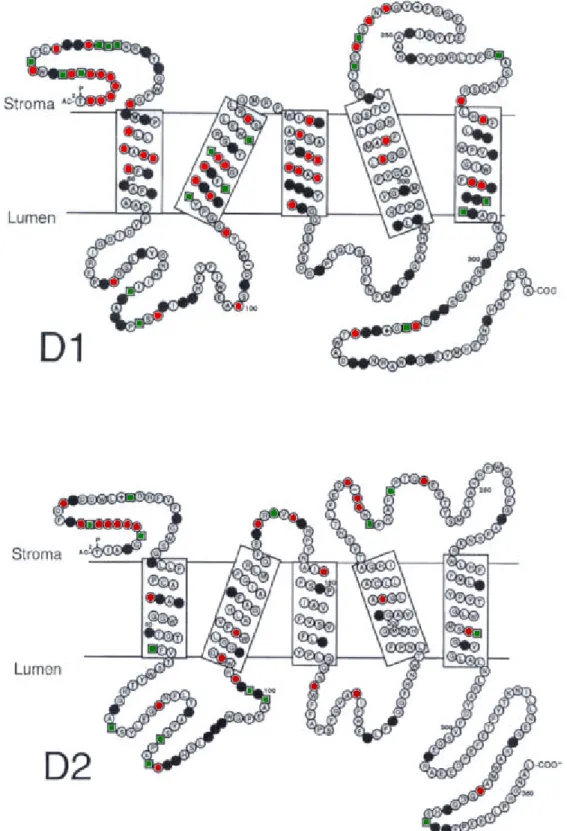
d’électrons……….20 Fig. 6 : Modèles topologiques des polypeptides D1 et D2. ……….. 21 Fig. 7 : Schéma représentant l'origine supposée des différentes sous-unités des centres réactionnels photosynthétiques de type II. ………22 Fig. 8 : Modèles topologiques du CP43 et CP47 établis à partir de séquences consensus de 10 espèces. ………...22 Fig. 9 : Modèle d'organisation des polypeptides et des cofacteurs du PS I chez les cyanobactéries… 24 Fig. 10 : Représentation schématique des hélices α de PsaA et PsaB………...25 Fig. 11 : Schéma représentant l'origine supposée des différentes sous-unités des centres réactionnels photosynthétiques de type I………...26 Fig. 12 : Structure d'un phycobilisome. ………27 Fig. 13 : Structure du LHCII de pois déterminé par cristallographie……… 30 Fig. 14 : Représentation schématique des réponses de l'appareil photosynthétique à l'absorption
d'intensités lumineuses croissantes.………..37 Fig. 15 : Shéma de la distribution latérale des complexes protéiques supramoléculaires dans la
membrane thylacoïdale………..39 Fig. 16 : Changements transcriptionnels et post-transcriptionnels dans l'expression des différents gènes psbA après transfert d'une culture de Synechococcus sp. PCC 7942 de faible éclairement ("low light") à forte intensité lumineuse ("high light").……….. 43 Fig. 17 : Analyse par cytométrie en flux d'un échantillon prélevé dans le Pacifique équatorial …….. 48 Fig. 18 : Arbre phylogénétique non raciné de 53 cyanobactéries et 10 séquences de plastes de la petite sous-unité de l'ARNr élaboré selon la méthode de maximum de likelihood………. 49 Fig. 19 : Photographie en microscopie électronique d'une coupe de Prochlorococcus………50 Fig. 20 : Comparaison des structures de la chlorophylle (A ; Chl a1 et Chl b1) et de la divinyle
Fig. 21 : Distribution verticale des populations de Prochlorococcus à forte et faible fluorescence rouge
dans le Pacifique subtropical près d'Hawaï………...54
Fig. 22 : Gel SDS-PAGE coloré au Bleu de Coomassie des protéines thylacoïdales des souches de Prochlorococcus MED4 et SS120 cultivées sous différentes conditions de lumière………55
Fig. 23 : Distribution mondiale de Prochlorococcus sur la base de 8400 mesures effectuées en milieu naturel par cytométrie en flux. ………..58
Fig. 24 : Distributions verticales typiques de Prochlorococcus et Synechococcus………...59
Fig. 25 : Arbre phylogénétique des isolats de Prochlorococcus basé sur la séquence du gène de l’ARNr 16S………..………..60
Fig. 26 : Lieu d’isolement des principales souches cultivées de Prochlorococcus………..…...64
Fig. 27: Méthode de détection immunologique………..………... 68
Fig. 28 : Méthode d’extraction des ADN de Prochlorococcus……….70
Fig. 29 : Méthode d’extraction des ARN de Prochlorococcus……….71
Fig. 30 : Méthode d’extraction d’ADN bicaténaire de bactériophages……….72
Fig. 31 : Analyse de l’ADN par électrophorèse en champs pulsé (PFGE) ………...73
Fig. 32 : Synthèses d ’une sonde ARN pour Northern blot ou protection RNAse………75
Fig. 33 : Analyse des ARN par protection Rnase………..76
Fig. 34 : Solutions et milieux utilisés pour la bactériologie……….. 77
Fig. 35 : Criblage d’une banque de phages………..………..78
Fig. 36 : Principe de la méthode d’analyse de clusters Hydrophobes………...82
Fig. 37 : Diagramme montrant l'appareil photosynthétique et son organisation potentielle par homologie avec l'appareil photosynthétique des cyanobactéries. ………...145
Fig. 38 : Répartition spectrale de la lumière en fonction de la profondeur dans les eaux oligotrophes………….……….147
Fig. 39 : Schéma hypothétique de l'évolution des procaryotes et des eucaryotes photosynthé- tiques oxygéniques à partir d'un ancêtre commun possédant de la Chl b et des phycobilisomes……150
Tab. 1 : Principaux pigments caractéristiques des plantes supérieures, des procaryotes photosynthétiques et des différentes classes ou divisions d'algues………... 17
Tab. 2 : Complexes du centre contenant de la Chl a chez les cyanobactéries et les chloroplastes….. 19
Tab. 3 : Protéines antennaires à Chl a/b des plantes supérieures ……….29
Tab. 4 : Caractéristiques pigmentaires et cytologiques des principaux groupes d'algues eucaryotes... 33
Tab. 5 : Comparaison de la pigmentation des oxychlorobactéries, d’Acaryochloris, des cyanobactéries contenant des phycobilisomes et de Dunaliella tertiolecta………...52
Tab. 6 : Liste des souches cultivées de Prochlorococcus pour lesquelles des données ont été publiées.………..………..……….65
TABLE DES ABREVIATIONS
ADN Acide désoxyribonucléique
ADNr 16S ADN codant pour la sous-unité 16S de l’ARN ribosomal ADP Adénosine diphosphate
Amax Absorption maximum
AP Allophycocyanine
APS Persulfate d’amonium ARN Acide ribonucléique
ARNr 16S Sous-unité 16S de l’ARN ribosomal ARNm Acide ribonucléique messager ATP Adénosine tri-phosphate BSA Bovine serum albumine
Car Caroténoïdes Chl Chlorophylle Chl a1 Monovinyle chlorophylle a Chl a2 Divinyle chlorophylle a Chl b1 Monovinyle chlorophylle b Chl b2 Divinyle chlorophylle b CR Centre réactionnel Da Dalton DDM n-dodécyl-β-D-maltoside dNTP Déoxunucléotide tri-phosphate DsLi Dodécyl sulfate de Lithium
EDTA Acide tétra-acétique diaminoéthylène
ELIP "Early light inducible proteins" (protéine induites de façon précoce par la lumière)
Fd Ferredoxine
GbRC "Green sulfur bacteria reaction center" (centre réactionnel des bactéries vertes sulfureuses)
HL "High light-adapted clade" (cla de adapté à forte lumière)
HLIP "High light inducible proteins" (protéines induites par une forte lumière) HPLC Chromatographie liquide à haute pression
IPTG Isopropylthio-β-D-galactoside
K Degré Kelvin
Kb Kilobases
kD Kilodalton
LB Luria-Bertani
LHC Light harvesting complex (complexe collecteur de lumière) LL "Low light-adapted clade" (clade adapté à faible lumière)
Mn Manganèse
min. Minute
mM Milli molaire MPa Milli Pascal
MSH "membrane spanning helices" (hélices transmembranaires) NADPH Nicotinamide adénine dinucléotide phosphate
OEC "Oxygen evolving complex" (complexe de dégagement d’oxygène) OG Octylglucoside (n-Octyl-β-D-glucopyranoside)
ORF "Open reading frame" (cadre ouvert de lecture)
PAGE "Polyacrylamide gel electrophoresis" (gel d’électrophorèse de polyacrylamide)
pb Paire de bases
PBS Phycobilisomes
PbRC "Purple bacteria reaction center" (centre réactionnel des bactéries pourpres)
PC Phycocyanine
Pcb "Prochlorophyte chlorophyll-b binding protein" (Protéine liant la chlorophylle la Chl b des prochlorophytes)
PCR "Polymerase chain reaction" (réaction de polymérisation en chaîne)
PE Phycoérythrine
PEC Phycoérythrocyanine
PFGE "Pulse fiel gel electrophoresis" (electrophorèse en champs pulsé)
Phe Phéophytine
PMSF phenylmethylsulfonylfluoride
m/v Masse à volume
PSC Photosystème de Chlorobium (bactéries vertes Sulfureuses) PSH Photosystème des héliobactéries
PQ Plastoquinone
PS I Photosystème I PS II Photosystème II
P700 1er donneur d’électron du PS I
QA Quinone acceptrice primaire du photosystème II QB Quinone acceptrice secondaire du photosystème II
RFLP "Random fragment length polymorphism" (polymorphisme de longueur de fragment de restriction)
SB14 Zwittergent 3-14 (, n-tétradécyle -N, N-diméthyle-3ammonio-1-propanesulfonate) SDS Sodium dodecyl sulfate
SSC "Side scatter" (diffusion de la lumière à 90° qui est fonction de la taille cellulaire)
TAE Tampon Tris/ammonium/EDTA
TBE Tampon Tris/borate/EDTA
TE Tampon Tris/EDTA
TEMED N, N, N’, N’-tetraméthyle -éthylènediamine v/v Volume à volume
X-Gal 5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside
∆pH Différence de pH de par et d’autre de la membrane thylacoïdale du fait du gradient de proton transmembranaire
C
HAPITRE
I
Chapitre I : Introduction : Les protéines pigmentaires 11
INTRODUCTION
La diversité des moyens mis en œuvre par les organismes photosynthétiques pour recueillir et utiliser la lumière disponible dans leur environnement constitue l'un des facteurs prépondérants expliquant la très large distribution des végétaux à la surface de notre planète. Cependant, les éléments déterminant cette capacité d'adaptation aux conditions lumineuses naturelles restent encore fortement méconnus. En effet, le processus de photosynthèse implique la coordination d'un grand nombre de réactions qui sont séparées aussi bien d'un point de vue spatial que temporel. Ces processus débutent au niveau des membranes thylacoïdales par l'absorption de la lumière par les pigments de l'antenne et par la photochimie primaire par les pigments des centres réactionnels. Ils aboutissent à la répartition de l'énergie et du pouvoir réducteur accumulés, vers les différentes voies métaboliques de l'organisme. Ainsi, la photosynthèse peut être représentée comme un réseau de réactions étroitement interconnectées participant à la production de l'énergie, à la fixation du carbone et à la réduction du potentiel d'oxydoréduction. Il en résulte une interconnexion similaire des mécanismes de régulation de ces différents processus, qui rend difficile la perception des réponses induites par un facteur environnemental particulier tel que la lumière.
Au cours de cette étude, nous nous sommes concentrés sur les complexes protéiques liant des pigments chlorophylliens de l'appareil photosynthétique. Ils sont responsables de l'absorption de l'énergie lumineuse et de la première étape de sa conversion en énergie chimique. De par ces propriétés, les protéines pigmentaires apparaissent particulièrement intéressantes pour aborder l’étude des processus d'adaptation de l'appareil photosynthétique à l'environnement lumineux.
L'organisme sur lequel est basé le travail de cette thèse est un procaryote photosynthétique appartenant au groupe des cyanobactéries. Cet organisme a la particularité de posséder un système collecteur de lumière (antenne) liant des dérivés divinylés de chlorophylle a (Chl a2) et b (Chl b2)
(Chisholm et al. 1992, Chisholm et al. 1988, Goericke and Repeta 1992). Cette antenne constitue une originalité importante par rapport aux cyanobactéries communes qui possèdent une antenne constituée de structures complexes, les phycobilisomes. De ce fait, Prochlorococcus et les autres procaryotes à Chl b seront désignés dans la suite de ce manuscript par le terme cyanobactéries à Chl b (Burger-Wiersma et al. 1989), sans que cela implique une quelconque relation phylogénétique entre ces organismes. L'étude d'un procaryote tel que Prochlorococcus, possédant une pigmentation inhabituelle, devrait permettre de mieux appréhender la plasticité de l'appareil photosynthétique, en fonction des pigments impliqués dans la capture de l'énergie lumineuse et dans les fonctions photochimiques. De plus, Prochlorococcus constitue un modèle écologiquement représentatif puisqu'il s'agit du procaryote oxyphototrophique le plus abondant à l'heure actuelle dans l'océan. Sa très large
distribution écologique, à la fois verticale et horizontale, en font un modèle de choix pour étudier l'impact des contraintes environnementales et en particulier de la lumière, sur l'appareil photosynthétique. Enfin, Prochlorococcus et les autres cyanobactéries à Chl b ont joué un rôle important dans le débat concernant la nature de l'ancêtre procaryotique, à l'origine des plastes des algues vertes et des plantes supérieures. Nous avons également essayé d'apporter quelques éléments de réponse à ce débat.
Les paragraphes suivants feront un bilan des connaissances concernant les aspects évolutifs et structuraux des protéines pigmentaires photosynthétiques et détailleront les principales caractéristiques de Prochlorococcus qui font de ce genre un modèle intéressant de ce point de vue.
I- L
ES PROTEINES DE L'
APPAREIL PHOTOSYNTHETIQUE LIANT LA CHLOROPHYLLEI.1- PHOTOSYNTHESE OXYGENIQUE
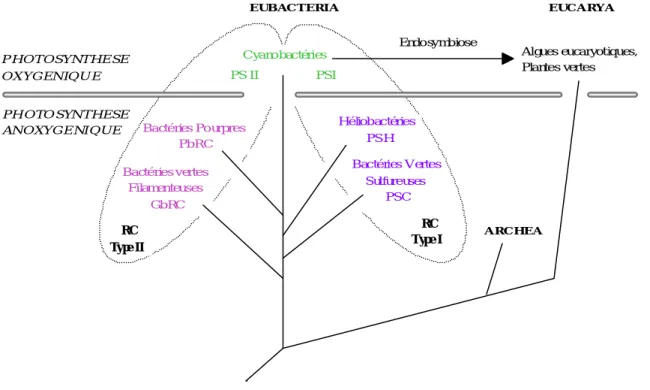
En dehors des eucaryotes photosynthétiques, les organismes phototrophiques sont aussi largement répartis entre les phyla du domaine eubactérien y compris les bactéries vertes sulfureuses, les bactéries vertes filamenteuses, les bactéries pourpres, les héliobactéries et les cyanobactéries (Fig. 1 ; Woese 1987, Woese et al. 1990).
Fig. 1 : Représentation générale des centres réactionnels des complexes photosynthétiques connus parmi les phyla des eubactéries et des plantes supérieures (d'après Schubert et al. 1998).
Parmi ces organismes, seules les plantes supérieures, les algues et les cyanobactéries sont capables de photosynthèse oxygénique qui nécessite la coopération de deux photosystèmes (PS). Les bactéries photosynthétiques autres que les cyanobactéries sont anoxygéniques et ne fonctionnent qu'avec l'un ou l'autre des deux photosystèmes (Schubert et al. 1998). Selon la théorie endosymbiotique, une cellule de type cyanobactérien aurait été incorporée dans une cellule eucaryote, à une ou plusieurs reprises au cours de l'évolution, ce qui aurait progressivement conduit à l'apparition des plastes des algues et des plantes supérieures, étendant ainsi la photosynthèse oxygénique aux eucaryotes (Loiseaux-de Goër 1994, Margulis 1996, Selosse and Loiseaux-de-Goër 1997, Stiller and Hall 1997).
EUB AC TERIA EUC A RYA
A RC HEA Cyanobactéries PS II PSI Endosymbiose Algues eucaryotiques, Plantes vertes Bactéries Pourpres PbRC Héliobactéries PS H Bactéries vertes Filamenteuses GbRC Bactéries Vertes Sulfureuses PSC RC Type II RC Type I P H O T O SY NT H E SE O X Y G EN IQ U E PH O TO SYN T H ESE AN O XY G E NIQ U E
Chapitre I : Introduction : Les protéines pigmentaires 14
Chez les organismes photosynthétiques oxygéniques, le s deux complexes membranaires photosynthétiques que sont les photosystèmes (PS), coopèrent pour produire des molécules de haute énergie telles que l'ATP et le NADPH. Chaque photosystème est en général constitué de deux parties : les complexes de l'antenne périphérique capturant la lumière et les composants du complexe du centre qui comprend le centre réactionnel (CR) en lui même et une antenne interne permettant le transfert de l'énergie d'excitation de l'antenne externe au CR. Cependant, chez les cyanobactéries, les antennes collectrices sont absentes au niveau du photosystème I (PS I). Ces complexes membranaires sont associés à des molécules de chlorophylles (Chl) et de caroténoïdes qui permettent l'absorption et le transfert de l'énergie solaire (Gantt 1996). Jusqu'aux années 60, on a pensé que les molécules de Chl formaient une couche entre les deux épaisseurs de lipoprotéines de la membrane (Weier et al. 1966). Cependant un transfert maximum d'énergie nécessite un contact étroit et une orientation favorable entre les molécules de Chl et les composants des centres réactionnels. On sait maintenant que les membranes photosynthétiques sont en fait constituées de complexes intrinsèques transmembranaires et que les molécules de Chl sont liées par des liaisons faibles à un ensemble de polypeptides constituant ces complexes (Kühlbrandt et al. 1994).
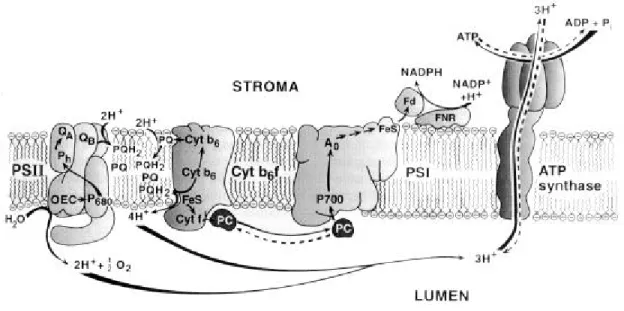
L'énergie lumineuse est tout d'abord captée par les pigments situés au niveau de l'antenne associée au photosystème II (PS II), puis est transférée au centre réactionnel du PS II en passant par les molécules de Chl a associées aux antennes mineurs du PS II (CP47 et CP43). Le centre réactionnel du PS II est essentiellement composé des protéines D1 et D2 qui sont associés à tous les pigments et les cofacteurs nécessaires à la séparation initiale de charge (Fig. 2 ; Diner and Babcock 1996, Gounaris et al. 1989).
Fig. 2 : Diagramme schématique de la chaîne de transport d’électron dans les membranes thylacoïdales eucaryotiques (Ort et Yocum, 1996)
Le premier donneur d'éle ctrons du PS II est constitué d'un dimère de Chl a absorbant à environ 680 nm et liés aux protéines D1 et D2 : le P680 (Barber and Kühlbrandt 1999). Il reçoit des électrons d'un complexe de dégagement d'oxygène (OEC : "Oxygen Evolving Complex"), dont le groupement Mn4 en position centrale permet l'oxydation des molécules d'eau par la lumière. Les électrons issus de
l'oxydation de l'eau sont tout d'abord utilisés pour réduire la plastoquinone (PQ) par l'intermédiaire de la phéophytine (Phe) et passent ensuite le long d'une chaîne de transfert d'électrons via le complexe cytochrome b6/f et le PS I. Ce dernier est le réducteur final de la chaîne de transfert d'électrons et
fonctionne comme une oxydoréductase plastocyanine (PC)-ferrédoxine (Fd), impliquant la Chl a, la phylloquinone et des groupement Fer-Soufre comme cofacteurs (Scheller et al. 1997). Deux protéines de 80 kDa (PsaA et PsaB) constituent les sous-unités majeures du PS I et lient la plupart des pigments et des donneurs et accepteurs d'électrons (A0 (Chl a), A1 (phylloquinone), FA, FB et FX (3 clusters
[4Fe-4S])) (Brettel 1997, Golbeck 1987, Malkin 1996, Nugent 1996, Setif 1992). Le premier donneur d'électrons du PS I, le P700, a été identifié comme étant un dimère de Chl qui absorbe à environ 700 nm (Krauss et al. 1993).
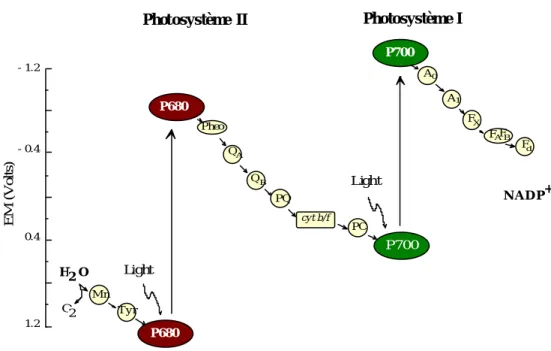
Les protons ainsi transportés à travers la membrane thylacoïdale établissent un gradient électrochimique qui est ensuite utilisé pour permettre la synthèse d'ATP et la production de réductants. L'isolement des différents transporteurs d'électrons et la détermination de leur potentiel d'oxydoréduction a permis d'établir le schéma en Z qui rend compte de leur organisation au sein de la membrane photosynthétique (Fig. 3 ; Hill and Bendall 1960).
Fig. 3 : Schéma en "Z" représentant le transfert d'électrons dans la membrane des thylacoïdes eucaryotiques depuis l'eau jusqu'au NADP. L'échelle des ordonnées permet de situer la valeur moyenne du potentiel redox des transporteurs d'électrons (d'après Hill et Bendall, 1960). Mn : Cluster Manganese ; Tyr : Tyrosines ; QA et QB : Quinones ; Pheo : Phaeophytine ; PQ : Plastoquinone ; cyt b/f : cytochrome
b6/f ; PC : plastocyanine ; A0 et A1 : Accepteurs ; FA , FB et F X : Centre Fer-Soufre.
QA E M ( V o lt s ) Light Photosystème II Photosystème I 1.2 0.4 - 0.4 - 1.2 Mn Tyr H O2 O2 P680 P680 Pheo QB PQ cy t b/f PC P700 Light P700 A0 A1 FX FAFB Fd N A D P+
Fig. 4 : Formules structurales des chlorophylles, des chromophores des phycobiliprotéines et des caroténoï des des algues (d'après Ragan, 1981).
R: CH CH 2 Chlorophylle c : Chlorophylle c : R : CH CH2 3 R 2 CH2 CH2CH3 CH3 R1 H H 3C CH2 CH2 C O OC H20 39 C C O O CH 3 C O H N N N N Mg CH Chlorophylle a: R1: CH3 R2: CH3 Chlorophylle b: R1: CH3 R2: CHO CH2 R CH3 H C 3 CH CH C O OH C C O OCH3 C O CH3 H3 C N N N N M g CH H CH3 CH3 CH 2 O CH2 CH2 O C H C3 O N H N H N N H CH CH CH 3 CH3CH2 CH2 O C O H O H Phycoérythrobiline H CH 3 CH3 CH3 O CH2 CH2 O C H C3 O N H N H N N H CH CH3 CH 3 CH2 CH2 O C O H O H CH 2 Phycocyanobiline
beta- carotène alpha-carotène
. O O HO HO OC OCH 3 Fucoxanthine HO OH Lutéine . O O HO H O O H OH HO Zéaxanthine Violaxanthine O OH O H O Siphonaxanthine H O O CH O H2 OH Néoxanthine CAROTENES
CHLOROPHYLLES PHYC OBILINES
1
On estime que ce processus de photosynthèse oxygénique doit être apparu il y a environ 3 500 millions d’années (Awramik 1992). De ce fait, il est remarquable de constater que les comparaisons de séquences, aussi bien parmi les espèces eucaryotiques que procaryotiques, révèlent pour de nombreuses protéines photosynthétiques clés, un très fort degré de conservation (Ort and Yocum 1996). Par ailleurs, la cristallisation du PS I a permis d'élucider sa structure et d’établir des modèles hypothétiques d’organisation du centre réactionnel du PS II (Green and Durnford 1996, Schubert et al. 1997). La similitude dans la cinétique de séparation de charge entre les systèmes des bactéries anoxygéniques et les photosystèmes I et II des organismes oxyphototrophes suggère que les processus fondamentaux qui guident le transfert des électrons d'un composant à l'autre sont probablement les mêmes dans chacun des deux types de centres réactionnels (Reith 1996). Les principales différences entre les organismes photosynthétiques actuels résident donc plutôt au niveau de la composition en pigments associés aux antennes capturant la lumière et/ou de la nature des antennes elles-mêmes.
I.2- LA PIGMENTATION DE L'APPAREIL PHOTOSYNTHETIQUE
Il existe une formidable diversité de pigments au sein des plantes supérieures, des différentes classes d'algues et des cyanobactéries, répartis entre les centres réactionnels I et II et les antennes capturant la lumière (Tableau 1). Tous les pigments photosynthétiques, y compris ceux des centres réactionnels, sont capables d'une absorption directe de la lumiè re solaire (Owens 1996). Leur capacité d'absorption de la lumière est déterminée par la section optique d'absorption dépendant de la longueur d'onde, qui est spécifique de chaque pigment. Il semble que dans certains cas, de très faibles modifications des voies métaboliques soient nécessaires pour induire la synthèse d'un pigment plutôt que d'un autre (Sayre and von Wrobelboerner 1994, von Wettstein et al. 1995). Ainsi, la conversion de la Chl a en Chl b nécessite uniquement l'oxydation d'un groupement méthyl en formyl et la conversion de la Chl a en Chl d, l'oxydation d'un groupement vinyl en formyl (Fig. 4).
Toutes les protéines pigmentaires à Chl lient à la fois des Chl et des caroténoïdes (Green and Durnford 1996). Les Chl assurent l'essentiel de la capture de l'énergie lumineuse, alors que les caroténoïdes jouent le plus souvent un rôle de protection de l'appareil photosynthétique contre l'excès d'énergie lumineuse (cf. section I.4-adaptations aux variations lumineuses ; Frank and Cogdell 1996, Vishnevetsky et al. 1999, Yamamoto and Bassi 1996). Cependant, les caroténoïdes peuvent aussi contribuer de façon significative à la stabilisation de la structure de la protéine (Havaux 1998) ou à la capture de l'énergie lumineuse comme cela a été observé chez certains organismes marins (Frank and Cogdell 1996, Hiller et al. 1991). Dans tous les cas, l'association des Chl et des caroténoïdes semble essentielle pour obtenir un repliement correct des protéines qui les lient (Paulsen 1995).
Chapitre I : Introduction : Les protéines pigmentaires 17
Tableau 1 : Principaux pigments caractéristiques des plantes supérieures, des procaryotes photosynthétiques et des différentes classes ou divisions d'algues. PBS = Phycobilisomes ; a =
Prochlorococcus, b = Prochlorothrix, c = Prochloron. Les pigments présents à l'état de traces chez ces trois organismes sont présentés dans le tableau 1 en annexe 1. Code : ++ = pigment majeur (>10 %), + = pigment mineur (1-10 % de la chlorophylle ou des carotenoïdes totaux), - = pigment absent ou non détécté (d'après Jeffrey et Mantoura, 1996)
Divi sions ou classes PIGMENTS
Plantes supérieures Cyanophyceae à PBS Cyanophyceae à Chl
b
(Oxychlorobacteria) Rhodophyta Cryptophyta Chlorophyceae Prasinophyceae Euglenophyta Eustigmatophyta Bacillariophyceae Pelagophyceae Chrysophyceae Raphidophyceae Fucoph
yceae Prymnesiophyta Dinophyta Chlorophylles (Chl) - - - - Chl a ++ ++ ++b,c ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ Chl b ++ - ++a,b,c - - ++ ++ ++ - - - - Chl c (c1, c2,c3, Mg DVPa5) - - ++a,c - ++ - - - - ++ ++ ++ ++ ++ ++ ++ Divinyl Chl a - - ++a - - - - Divinyl Chl b - - ++a - - - - Carotènes (αα ou ββ) + ++ ++a,b,c ++ + + + + + + + + + + + + Xanthophylles - - - - Alloxanthine + - - - ++ - - - - Lutéine + - - - - ++ ++ - - - - Néoxanthine - - - ++ ++ + - - - - Prasinoxanthine - - - ++ - - - - Violaxanthine - - - ++ ++ - ++ - - - - Zéaxanthine - ++ ++a,b,c ++ - + - - - - Fucoxanthine + - - - ++ ++ ++ ++ ++ ++ - 19'-HF - - - ++ - 19'-BF - - - ++ - - - ++ - Diadino et diatoxanthine - - - ++ - ++ ++ ++ ++ ++ ++ ++ Péridinine + - - - ++ Biliprotéines - - - - Allophycocyanine - ++ - ++ - - - - Phycocyanine - ++ - + ++ - - - - Phycoérythrine - ++ -b,c+/-a ++ ++ - - - -
Des protéines liant spécifiquement des caroténoïdes ont cependant récemment été mises en évidence dans la membrane plasmique, dans le cytosol ou à la surface des cellules de certains organismes, où elles auraient aussi un rôle de photoprotection (Vishnevetsky et al. 1999, Wu and Krogmann 1997).
Tous les eucaryotes photosynthétiques et les cyanobactéries possèdent de la Chl a qui se caractérise par un pic d'absorption à environ 440 nm dans le bleu et à environ 675 nm dans le rouge. L'incorporation de pigments accessoires tels que la Chl b, la Chl c, les phycobiliprotéines ou certains caroténoïdes, dont les pics d'absorption sont situés à des longueurs d'onde où l'absorption de la Chl a est faible, permet ensuite d'élargir la gamme spectrale dans laquelle l'absorption de la lumière est possible. Ainsi, la fucoxanthine et la péridinine, présentes chez certaines algues, permettent d'étendre la capacité de capture de la lumière d'environ 80 à 100 nm vers la partie rouge du spectre (Lüning 1990). Les contributions photosynthétiques de nombreux autres caroténoïdes tels que la diadinoxanthine, la diatoxanthine, l'hétéroxanthine ou encore la néofucoxanthine sont beaucoup moins évidentes.
La détermination de structures protéiques au niveau atomique a permis de montrer qu'il existe une homologie substantielle parmi les complexes d'antenne à Chl du point de vue de leur composition pigmentaire, de l'orientation et de la distance des pigments les uns par rapport aux autres, ainsi que des sites permettant la liaison des molécules de Chl (Kühlbrandt et al. 1994). En particulier, les résidus histidine au niveau des hélices transmembranaires sont de très bons candidats pour lier les molécules de Chl (Krauss et al. 1993, Kühlbrandt and Wang 1991, Kühlbrandt et al. 1994). De même, les résidus glutamine et asparagine, les groupements carbonyl et les molécules d'eau peuvent fournir des ligands supplémentaires des molécules de Chl (Kühlbrandt et al. 1994). Ces propriétés communes à l'ensemble des protéines pigmentaires supposent par ailleurs une conservation de la séquence et de la structure de ces protéines.
I.3- PROTEINES PIGMENTAIRES DE L'APPAREIL PHOTOSYNTHETIQUE
Les protéines liant les pigments sont essentiellement constituées de polypeptides transmembranaires présentant un nombre variable d'hélices α transmembranaires (MSH's pour "membrane spanning helices") selon les familles de protéines. De par leurs caractéristiques fonctionnelles, elles peuvent être divisées en deux groupes : les complexes du centre et les complexes capturant la lumière (antenne intrinsèque ou phycobilisomes).
Chapitre I : Introduction : Les protéines pigmentaires 19
I.3.1- Les complexes du centre
Les complexes du centre des deux photosystèmes PS I et PS II sont formés d'une part par le centre réactionnel proprement dit et d'autre part par une antenne interne (ou proximale, CP47/CP43) qui lie la majorité des molécules de Chl a et permet le transfert de l'énergie d'excitation de l'antenne au CR. Les CR sont les composants des photosystèmes où interviennent la photochimie primaire de séparation de charge et les processus de transfert d'électrons. Ils sont très conservés d'un point de vue structural et fonctionnel chez tous les organismes photosynthétiques oxygéniques (Nitschke and Rutherford 1991, Rutherford and Nischke 1996). Chez les eucaryotes et la plupart des cyanobactéries, les protéines pigmentaires constituant ces complexes lie nt presque exclusivement de la Chl a et du β -carotène (cf. Tableau 2), et ces protéines sont toutes codées par le génome chloroplastique chez les eucaryotes (Green and Durnford 1996). En revanche, le β-carotène est remplacé par de l'α-carotène chez Prochlorococcus et Acaryochloris marina qui utilise la Chl d comme pigment majeur (Chisholm et al. 1988, Miyashita et al. 1997).
Tableau 2 : Complexes du centre contenant de la Chl a chez les cyanobactéries et les chloroplastes (Valeurs consensus de différentes sources, d'après Green et Durnford, 1996)
Complexe Pigment/cofacteurs Gène Polypeptide Masse
apparente Photosystème I Photosystème II Autres Complexe de centre (CP1) Centre réactionnel (CR) CP47 (CPa-1) CP43 (Cpa-2) CP43' (CPIV-4) 75-100 Chl a 12-15 β-carotènes phylloquinone Cluster 4Fe-4S 4-6 Chl a 2 phéophytine 2 plastoquinone 1 Fe sans heme 1-2 β-carotène 20-22 Chl a 2-4 β-carotènes 20 Chl a 5 β-carotènes psaA psaB psbA psbD psbB psbC isiA PsaA ou PSI-A PsaB ou PSI-B D1 ou PsbA D2 ou PsbD CP47 ou PsbB CP43 ou PsbC CP43' ou IsiA 58 à 70 kDa 58 à 70 kDa dimère d'environ 60 kDa 47 kDa 43 kDa 34 kDa
I.3.1.1- Le complexe du centre du photosystème II
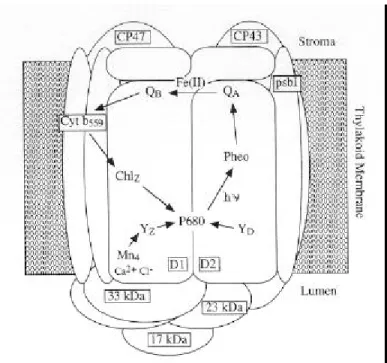
Le complexe du centre du PS II comprend toutes les protéines, les pigments et les cofacteurs nécessaires pour transférer les électrons de l'eau à la plastoquinone réduite (Diner and Babcock 1996, Ghanotakis and Yocum 1990). Ce complexe est composé de 10 sous-unités protéiques principales (Fig. 5) : les polypeptides D1 et D2, les sous-unités α (psbE) et β (psbF) du cyt b559, 2 protéines
transmembranaires CP43 et CP47, le produit du gène psbI (environ 4kDa), et 3 polypeptides extrinsèques de 17, 23 et 33 kDa, associés du côté lumen de la membrane (Irrgang et al. 1995, Satoh 1993, Seibert 1993, Stewart and Brudvig 1998).
Fig. 5 : Modèle structural du complexe protéique du PSII chez les cyanobactéries incluant les cofacteurs du transfert d’électrons (Stewart et Brudvig, 1998).
Les protéines de 17 et 23 kDa sont absentes chez les cyanobactéries où elles sont remplacées par le cyt c550 et une protéine de 12 kDa (Shen and Inoue 1993). Parmi ces polypeptides, seuls 4 d’entre eux
fixent des pigments : ceux formant le centre réactionnel (D1 et D2) et les deux protéines d'antennes du centre, CP47 et CP43 (Barber and Kühlbrandt 1999, Satoh 1996). Les autres protéines du PS II ne semblent pas fixer de molécules de Chl, mais elles pourraient avoir un rôle important dans l'assemblage du centre réactionnel du PS II in vivo (Tang et al. 1990).
Le centre réactionnel du PS II (D1/D2) : CR II
Les deux polypeptides majeurs du centre réactionnel, D1 (codé par psbA) et D2 (codé par psbD), possèdent une masse moléculaire d'environ 30 kDa (Diner and Babcock 1996). L'origine de la lettre D est due au profil de migration "diffus" dans les premiers SDS-PAGE réalisés avec ces
Fig. 6 : Modèles topologiques des polypeptides D1 et D2 et mise en évidence des acides aminés conservés. La séquence consensus a été établie à partir de 38 espèces différentes. Les acides aminés conservés sont indiqués selon leur code à une lett re, les cercles rouges correspondent aux acides aminés non conservés, les cercles noirs aux résidus hydrophobes remplacés de façon conservative et les carrés verts aux résidus hydrophiles remplacés de façon conservative (Bricker et Ghanotakis, 1996).
protéines (Satoh 1982). Ces deux sous-unités ont tendance à former un dimère que l'on détecte sur SDS-PAGE aux alentours de 60 kDa.
De nos jours, un grand nombre de gènes codant pour D1 et D2 ont été séquencés à partir d'une variété importante d'organismes allant des cyanobactéries aux plantes supérieures. Chez les plantes, psbA est présent sous la forme d'une copie unique ininterrompue, alors que deux copies contenant des introns semblent présentes chez les algues vertes et 3 copies ininterrompues chez la plupart des cyanobactéries (psbA1 à 3 ; Golden 1994, Golden et al. 1986, Schaefer and Golden 1989a). Pour les cyanobactéries à Chl b, deux copies ont été mises en évidence chez Prochlorothrix hollandica (Morden and Golden 1989) et seulement une copie chez Prochlorococcus SS120 (Hess et al. 1995). Par ailleurs, deux copies du gène psbD sont présentes chez les cyanobactéries à phycobilisomes et chez Prochlorothrix (Golden 1994). L'une d'entre elles est individualisée dans le génome, alors que la seconde est en opéron et chevauche le gène psbC codant pour l'antenne interne CP43, de la même façon que dans les chloroplastes des plantes supérieures (Holschuh et al. 1984).
Malgré la variabilité du nombre de copies de chacun de ces gènes, les variations des séquences au niveau protéique sont très faibles puisque plus de 60 à 70 % des acides aminés de D1 et D2 sont conservés entre les cyanobactéries et les plantes supérieures (Svensson et al. 1991). De plus, les zones les plus variables sont essentiellement situées aux extrémités 5' et 3' des protéines. Seul le produit supposé de psbAI chez Synechocystis PCC 6803 et PCC 6714 présente des variations de séquence importantes par rapport aux autres copies du gène psbA (Ajlani et al. 1989, Jansson et al. 1987), mais il a été montré que ce gène n'était pas transcrit dans ces souches (Mohamed et al. 1993). Les gènes multiples codent pour deux formes distinctes de la protéine D1, excepté chez Prochlorothrix hollandica. Le plus fort degré de conservation de ces protéines est trouvé au niveau des 5 hélices transmembranaires prédites par graphe d'hydropathie (Trebst 1986 ; Fig. 6). Dans ces régions, les acides aminés susceptibles d'intervenir dans la fixation des pigments et des cofacteurs sont presque tous conservés. Il en est de même pour certains résidus susceptibles d'intervenir dans la liaison du cluster manganèse (Debus 1992, Rutherford and Nischke 1996, Rutherford et al. 1992, van der Bolt and Vermaas 1992).
Bien que les similitudes soient moindres, ces protéines présentent aussi des homologies avec les CR des bactéries pourpres et des bactéries vertes filamenteuses (Blankenship 1992, Deisenhofer and Michel 1989, Michel and Deseinhoffer 1988). Ces CR sont hétérodimériques et sont regroupés sous le terme centre de type quinone (Type II) dans lesquels la phéophytine (ou la bacteriophéophytine) et une paire de quinones servent d'accepteurs d'électrons terminaux. Les similarités de séquence entre les sous-unités protéiques D1/D2 du CR II et les sous-unités correspondantes du CR des bactéries pourpres (L et M) sont de l'ordre de 20-25 % (Hearst and Sauer 1984, Michel et al. 1986, Rhee et al. 1998, Williams et al. 1984). De plus, d'après les données cristallographiques du CR de Rhodopseudomonas viridis, les protéines L et M possédent également 5
Fig. 8 : Modèles topologiques du CP43 et CP47 établis à partir de séquences consensus de 10 espèces. Les acides aminés conservés sont indiqués selon leur code à une lettre, les cercles rouges correspondent aux résidus non conservés, les cercles noirs aux résidus hydrophobes remplacés de façon conservative et les carrés verts aux résidus hydrophiles remplacés de façon conservative (Bricker et Ghanotakis, 1996).
hélices transmembranaires. Enfin, les deux sous-unités de ces CR (L/M et D1/D2) possèdent aussi d'importantes similarités de séquence (Michel et al. 1986, Svensson et al. 1991). C'est pourquoi, il a été suggéré que les deux polypeptides constituant ces CR hétérodimériques sont issus de la duplication d'un gène ancestral unique (cf. Fig.7 ; Michel et al. 1986, Svensson et al. 1991). D1 et D2 étant beaucoup plus semblables que ne le sont L et M, les deux sous-unités de chacun des CR sont probablement issues d'une duplication de gènes indépendante ayant eu lieu après la divergence du PS II et des lignées bactériennes anoxygéniques (Coleman and Youvan 1993, Williams et al. 1986).
CP47 et CP43
CP47 (CPa-1) et CP43 (CPa-2) sont des composants protéiques membranaires du PS II qui fonctionnent comme des antennes internes (Pakrasi 1995). Ces deux protéines lient la plupart de la Chl a (12 à 25 molécules) et du β-carotène du complexe du centre PS II (Bricker 1990, Rhee et al. 1998) et transfèrent l'énergie d'excitation issue des antennes majeures vers les Chl du centre réactionnel P680 (Pakrasi 1995). Des expériences de mutagenèse dirigée ont montré que ces protéines pigmentaires ont également un rôle structural et fonctionnel important (Pakrasi and Vermaas 1992, Vermaas 1993). De plus, CP43 et CP47 pourraient lier de petites quantités de lutéine en plus du β-carotène (Bassi et al. 1993).
D'un point de vue structural, CP47 et CP43 présentent des similitudes importantes (Bricker 1990, Sayre and von Wrobelboerner 1994). Chacune de ces protéines possède six hélices transmembranaires et les extrémités N- et C-terminales sont situées au niveau de la surface stromale (Fig.8 ; Bricker 1990, Sayre and von Wrobelboerner 1994, Vermaas et al. 1987). La principale différence entre ces protéines est la taille de la boucle entre les hélices transmembranaires 5 et 6 qui est plus longue de 151 résidus dans le CP47 (Bricker 1990). La boucle du CP47 est en contact avec le polypeptide de 33 kDa (produit du gène psbO) et serait impliquée dans la stabilisation du cluster manganèse (Bricker 1990, Enami et al. 1997, Frankel and Bricker 1995, Sayre and von Wrobelboerner 1994, Vermaas et al. 1987).
CR de type II ancestral
CR II hétérodimérique CR hétérodimérique
D1 D2 L M
Fig. 7 : Schéma représentant l'origine supposée des différentes sous-unités des centres réactionnels photosynthétiques de type II.
Chapitre I : Introduction : Les protéines pigmentaires 23
De même, le CP43 qui semble localisé du côté opposé au complexe D1-D2-cytochrome b559, pourrait avoir un rôle similaire (Enami et al. 1997, Harrer et al. 1998). Ces caractéristiques structurales ont récemment été confirmées par la détermination de la structure 3D du CR II à une résolution de 8 Å (Rhee et al. 1998).
Le séquençage chez plusieurs espèces des gènes psbB et psbC, codant respectivement CP47 et CP43, a montré la très forte conservation de ces protéines. En effet pour CP47, 80 % des acides aminés sont identiques ou remplacés de façon conservative entre les différents organismes examinés, contre 85 % pour CP43 (Bricker and Ghanotakis 1996). De plus, les résidus potentiellement impliqués dans la liaison des molécules de Chl sont très bien conservés dans les six hélices transmembranaires des protéines CP43 (8 résidus H) et CP47 (12 résidus H) de différentes espèces (Deisenhofer et al. 1985, Kühlbrandt and Wang 1991, Shen et al. 1993). De même que pour les autres protéines pigmentaires, ces résidus sont groupés du côté stroma ou lumière des surfaces membranaires (Zuber et al. 1987).
CP43' (IsiA)
Une protéine de 34 kDa associée au complexe du PS II est synthétisée en abondance chez certaines cyanobactéries en conditions de stress dû à une carence en fer (Riethman and Sherman 1988a, Riethman and Sherman 1988b, Strauss 1994). Elle présente des homologies de séquence importantes avec le CP43 (Laudenbach and Straus 1988, Leonhardt and Straus 1992). Pour cette raison, elle a été nommée CP43' mais les termes CPVI-4, CPIIIb ou encore IsiA sont aussi employés. La structure de cette protéine diffère du CP43 par la longueur de la boucle entre les hélices transmembranaires prédites 5 et 6, qui est plus courte de 92 résidus chez IsiA. De plus, la conservation des résidus histidines dans les hélices transmembranaires prédites par profil d'hydropathie suggère que la capacité de liaison des molécules de Chl est certainement similaire au CP43 (Bricker 1990, Laudenbach and Straus 1988, Vermaas and Ikeuchi 1991).
Puisque les phycobilisomes sont rapidement dégradés en conditions de stress nutritionnel, il a été proposé que cette protéine fonctionne comme un complexe d'antenne auxiliaire qui compenserait la perte des phycobilisomes pendant le stress dû au fer (Pakrasi et al. 1985). Cette protéine pourrait également constituer une réserve de Chl qui contribuerait à l'assemblage des complexes du centre réactionnel dans les premiers stades de récupération du stress dû au fer (Burnap et al. 1993, Riethman and Sherman 1988b). En fait, l'inactivation d'IsiA par mutagenèse dirigée chez Synechococcus PCC 7942 a montré que cette protéine a plus probablement un rôle de photoprotection (Park et al. 1999). IsiA permettrait en effet de protéger le PS II d'une excitation excessive en condition de limitation en fer en agissant comme un dissipateur non radiatif de l'énergie lumineuse.
I.3.1.2- Le centre réactionnel du PS I (PsaA/ PsaB) : CR I
Dans le photosystème I, le centre réactionnel et l'antenne interne sont combinés en un seul "super-complexe" pigment-protéine qui accepte les électrons de la plastocyanine ou du cytochrome c6
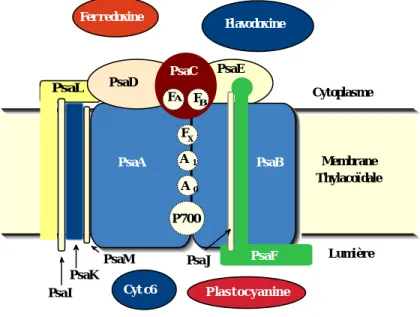
pour les transférer à une molécule de type ferrédoxine codée par le gène psaC (Chitnis et al. 1995, Golbeck 1992, Golbeck 1993). Les cofacteurs du PS I qui participent à la chaîne de transfert d'électrons sont liés aux protéines PsaA, PsaB et PsaC (Chitnis et al. 1995, Scheller et al. 1997). Le complexe PS I contient aussi 8 autres polypeptides dont certains contiennent des segments transmembranaires, mais aucune de ces protéines ne semblent fixer de molécules de Chl (cf. Fig. 9 ; Chitnis et al. 1995, Green and Durnford 1996).
Fig. 9 : Modèle d'organisation des polypeptides et des cofacteurs du PS I chez les cyanobactéries. La position exacte du PsaM par rapport aux autres sous-unités n'est pas connue. Les transporteurs d'électrons identifiés par spectroscopie comprennent le donneur primaire d'électrons, P700 (une paire spéciale de Chl
a), les accepteurs primaires et secondaires d'électrons, A0 (Chl a) et A1 (phylloquinone) et 3 clusters Fer-Soufre, FA, FB et FX (d'après Chitnis et al. 1995 et Krauss et al. 1996).
PsaA et PsaB constituent les deux sous-unités majeures du centre. Il s'agit de deux polypeptides hydrophobes qui possèdent une masse moléculaire apparente similaire, qui varie de 58 à 70 kDa selon les organismes. Ces deux protéines lient un total de 75-100 molécules de Chl a et 12-15 molécules de β-carotène (cf. Tableau 2 ; Green and Durnford 1996). La structure d'un complexe PS I de cyanobactérie à été déterminée récemment à une résolution de 4,0 Å par cristallographie aux rayons X (Schubert et al. 1997). PsaA et PsaB possèdent chacun 11 hélices transmembranaires renfermant la majorité des résidus chargés de ces protéines (Fig.10 ; Krauss et al. 1993) et deux larges hélices de surface parallèles au plan de la membrane (Schubert et al. 1997).
PsaM PsaJ
PsaA PsaB
PsaC PsaD
PsaE
Fer redoxine Flavodoxine
PsaL
PsaI PsaK
Cyt c6 P las t oc yanine
PsaF Lumière Cytoplasme P700 Membrane Thylacoïdale FA F B FX 1 A 0 A
Chapitre I : Introduction : Les protéines pigmentaires 25
Fig. 10 : Représentation schématique des hélices α de PsaA et PsaB. Les boucles inter-hélices identifiées α avec certitude sont représentées en trait continu et celles supposées ou ambiguës en pointillés. La longueur des hélices αα individuelles (+/- 3 acides aminés) est indiquée en caractère gras (Schubert et al. 1997).
Les gènes codant pour ces protéines ont été séquencés chez plusieurs organismes procaryotiques et eucaryotiques (Fish et al. 1985, Mühlenhoff et al. 1993, Smart and McIntosh 1991). Les similitudes de séquences entre les cyanobactéries d’eau douce et les eucaryotes sont d’environ 95 % pour PsaA et plus de 95 % pour PsaB. De plus, psaA et psaB présentent entre eux un pourcentage d'identité de 40-45 %, ce qui suggère qu'ils sont issus de la duplication d'un gène ancestral qui aurait ensuite divergé (Pakrasi 1995). La comparaison de ces séquences a permis de mettre en évidence que deux résidus cystéines présents à la fois dans PsaA et PsaB pourraient fournir des sites de fixation du cluster Fer-Soufre Fx ([4Fe-4S] ; McDermott et al. 1989, Petrouleas et al. 1989, Scheller
et al. 1997). Ces sites semblent également essentiels pour l'assemblage du CR I (Smart and McIntosh 1993). En revanche, les sites de fixation des cofacteurs P700, A0 et A1 sur les polypeptides PsaA et
PsaB ne sont pas encore connus. Cependant, plusieurs résidus histidine sont particulièrement bien conservés dans PsaA et PsaB (His522, 523 et 530 dans PsaB de Chlamydomonas) et il a été proposé que l'His 522 ou 523 coordonne le P700, alors que l'His 530 coordonnerait A0 (Cui et al. 1995).
Par ailleurs, la comparaison des séquences de ces protéines avec celles des CR homodimériques des bactéries vertes sulfureuses (Buttner et al. 1992a, Buttner et al. 1992b) et des héliobactéries (Liebl et al. 1993) suggère une lignée commune de ces CR avec les CR I des organismes photosynthétiques oxyphototrophes (Lockau and Nitschke 1993, Trost et al. 1992). En effet, tous ces organismes ont des CR de type Fer-Soufre (Type I) qui possèdent des clusters Fe4-S4 à
et al. 1992). De plus, d'après les analyses d'hydropathie, chacun des polypeptides composant ces CR possède également 11 hélices transmembranaires (Liebl et al. 1993). Enfin, les protéines constituant les CR des bactéries vertes sulfureuses et des héliobactéries présentent 14 à 17 % d'homologie avec les deux sous-unités PsaA et PsaB du maïs (Buttner et al. 1992b, Golbeck 1993, Liebl et al. 1993, Nitschke and Rutherford 1991). Il semble donc que psaA et psaB soient apparus par duplication de gène et que la divergence de la lignée PS I par rapport aux CR bactériens soit intervenue avant l'événement de duplication conduisant aux centres hétérodimériques (cf. Fig.11 ; Trost et al. 1992, Wolfe and Hoober 1996).
I.3.2- Les complexes antennaires
Les protéines pigmentaires des complexes d'antenne sont responsables de l'absorption de l'énergie lumineuse et de la première étape de sa conversion en énergie chimique chez les organismes photosynthétiques oxygéniques. A l'inverse des centres réactionnels, il existe une très grande diversité de pigments et de protéines constituant les complexes pigments-protéines d'antenne, particulièrement au sein des classes algales (Hiller et al. 1991).
I.3.2.1- Les phycobilisomes des cyanobactéries et des algues rouges
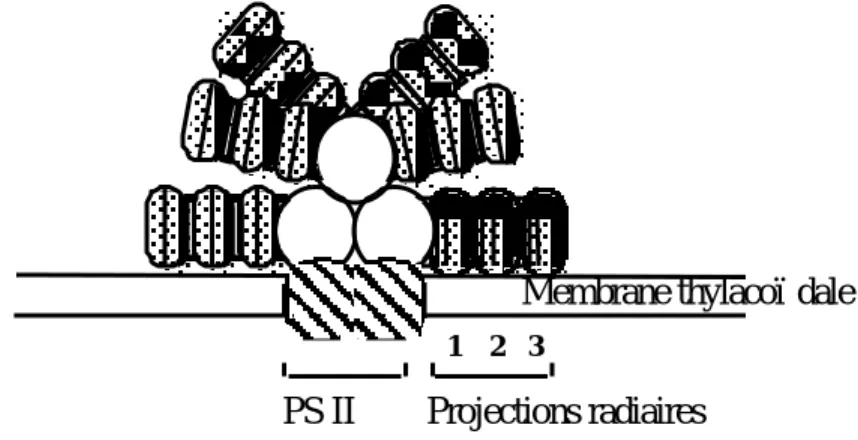
Chez les cyanobactéries et les rhodophytes, la capture de l'énergie lumineuse est assurée par des complexes extrinsèques à phycobiliprotéines sous forme d'aggrégats moléculaires fixés à la surface externe des thylacoïdes : les phycobilisomes (Gantt and Conti 1966, Sidler 1994). Ces complexes supramoléculaires sont constitués de deux principaux éléments structuraux (cf. Fig. 12 ; MacColl 1998). La partie centrale de l'édifice est composée de deux, trois ou parfois quatre structures cylindriques qui permettent le contact et l'ancrage des phycobilisomes à la membrane thylacoïdale (Porter et al. 1978, Searle et al. 1978). Ces éléments permettent le transfert de l'énergie des régions
CR de type I
ancestral Fig. 11 : Schéma représentant l'origine supposée des
différentes sous-unités des centres réactionnels photosynthétiques de type I.
CR I hétérodimérique CR homodimériques
PsaA PsaB P840 PshA
héliobactéries
bactéries vertes sulfureuses
Chapitre I : Introduction : Les protéines pigmentaires 27
distales des phycobilisomes aux complexes CP47 des membranes thylacoïdales. La partie externe des phycobilisomes est généralement constituée de six projections radiaires qui partent du centre et sont formées d'un nombre variable de disques cylindriques.
Fig. 12 : Structure d'un phycobilisome. Dans ce schéma, les six projections radiaires sont constituées de trois jeux de double disque, indiqués de 1-3, liés entre eux par des polypeptides de liaison (zones noires ; d'après Sidler, 1994).
Ces complexes supramoléculaires sont constitués à 85 % d’une famille de protéines pigmentées et solubles dans l’eau, les phycobiliprotéines (Glazer and Fang 1973, Klotz et al. 1986, Tandeau de Marsac and Cohen-Bazire 1977). Les 15 % restant sont formés de polypeptides de liaison, qui ne lient pas de chromophores. Chaque phycobiliprotéine est un hétérodimère constitué de sous-unités α et β qui présentent des homologies de séquence importantes (Tandeau de Marsac et al. 1990, Tandeau de Marsac et al. 1988). Il existe 4 classes prédominantes de phycobiliprotéines. L'allophycocyanine (AP ; absorption maximum (Amax) ~ 650 nm) est trouvée exclusivement dans le
centre des phycobilisomes, alors que les projections radiaires peuvent contenir selon les espèces et les conditions environnementales de la phycocyanine (PC ; Amax ~ 620 nm), ainsi que de la
phycoérythrine (PE ; Amax ~ 560 nm) ou de la phycoérythrocyanine (PEC ; Amax ~ 540 nm). Les
phycobilisomes absorbent donc la lumière visible dans une gamme de longueur d'onde de 540 à 660 nm, où l'absorption liée aux pigments chlorophylliens est faible (Porter et al. 1978, Searle et al. 1978, Sidler 1994). La migration de l'énergie lumineuse captée est très rapide et s'effectue depuis l'extrémité distale des projections radiaires vers la portion proximale, et enfin vers le cœur des phycobilisomes (Sidler 1994). Cette énergie est ensuite transférée à la Chl a des centres réactionnels photosynthétiques. L'isolement de complexes phycobilisomes-PS II a permis de vérifier que l'énergie est transférée vers le CR II (Gantt et al. 1986). Cependant, il semble que l'attachement des phycobilisomes au PS I soit également possible et permettrait d’augmenter l’efficacité du PS I chez Synechococcus (Mullineaux 1992, Mullineaux 1999). La confirmation de ces résultats nécessiterait l'isolement de complexes PS I fonctionnels similaires aux particules phycobilisomes-PS II déjà isolées (Gantt et al. 1986).
2 3 1
Membrane thylacoïdale
Chez les cyanobactéries possédant des phycobilisomes, la Chl a est le seul type de Chl présent et aucune antenne transmembranaire associée aux centres réactionnels I et II n'a été mise en évidence (Tan et al. 1995, Wolfe et al. 1994a). A l'inverse, les algues rouges possèdent en plus des phycobilisomes, une antenne transmembranaire à Chl a associée au PS I (cf. section I.3.2.4-antenne collectrice des algues, Tan et al. 1995, Wolfe et al. 1994b). Les Cryptophycées constituent aussi un cas unique car elles synthétisent à la fois des complexes intrinsèques à Chl a/c (cf. section I.3.2.4-antenne collectrice des algues, Ingram and Hiller 1983, Rhiel et al. 1989) et des phycobiliprotéines (PC ou PE) localisées dans la lumière des thylacoïdes (Lichtlé et al. 1987). Dans cette classe d'algues, les phycobiliprotéines sont plus petites que celles des algues rouges et des cyanobactéries et ne possèdent pas les séquences d'acides aminés nécessaires à l'aggrégation sous forme de phycobilisomes (Gantt 1996).
Enfin, au sein même de la radiation des cyanobactéries, trois oxyphototrophes (Prochloron, Prochlorothrix et Prochlorococcus) utilisent une antenne à Chl a/b comme principal complexe collecteur de lumière (Partensky et al. 1999). L'absence de phycobiliprotéines a longtemps été considérée comme le principal caractère unissant ces trois organismes (Lewin, 1975, 1977 ; Burger-Wiersma et al., 1986 ; Chisholm et al., 1988, 1992). Cependant, les gènes codant les sous unités α et β des phycobiliprotéines ont récemment été mis en évidence et séquencés chez plusieurs souches de Prochlorococcus adaptées à faible lumière (cf. section II.3.3-appareil photosynthétique ; Hess et al. 1996, Ting et al. 1998, Hess et Campbell, pers. com.). De plus, bien que les recherches effectuées pour mettre en évidence d'autres types de phycobiliprotéines (PC ou AP) soient restées infructueuses jusqu'à maintenant (Hess, pers. com.), des études par immunocytochimie ont montré que la phycoérythrine est probablement localisée dans la lumière des thylacoïdes et semble fonctionnelle pour la capture de la lumière (Hess et al. 1999, Lokstein et al. 1999). De même, la présence de "mini-phycobilisomes" a été observée chez le procaryote oxyphototrophe Acaryochloris marina qui utilise la Chl d comme pigment majeur (Marquardt et al. 1997). Ces structures visibles en microscopie électronique sont essentiellement constituées de phycobiliprotéines fixant la phycocyanine et l'allophycocyanine. A l'inverse, l'étroit resserrement des membranes thylacoïdales chez Prochlorococcus, Prochlorothrix hollandica et Prochloron, observé en microscopie électronique à transmission, semble confirmer l'absence de phycobilisomes chez ces organismes (Partensky et al. 1999).
I.3.2.2- Les protéines à Chl a/b des plantes supérieures
Chez les plantes supérieures, six complexes pigments-protéines principaux ("Light harvesting complex" (LHC) II, LHC Ia, LHC Ib, CP29, CP26 et CP24) ont été identifiés (Green and Durnford 1996). Chacun de ces complexes est constitué de protéines intrinsèques à la membrane, codées au