HAL Id: tel-03197839
https://tel.archives-ouvertes.fr/tel-03197839
Submitted on 14 Apr 2021HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Effets de la symbiose endomycorhizienne sur la tolérance
au stress hydrique chez le riz
Branly Wilfried Effa Effa
To cite this version:
Branly Wilfried Effa Effa. Effets de la symbiose endomycorhizienne sur la tolérance au stress hydrique chez le riz. Sciences agricoles. Université Montpellier, 2020. Français. �NNT : 2020MONTG035�. �tel-03197839�
1
apport de gestion
2015
THÈSE POUR OBTENIR LE GRADE DE DOCTEUR
DE L’UNIVERSITÉ DE MONTPELLIER
En Ecophysiologie et adaptation des plantes
École doctorale N°584 GAIA
Unité de recherche UMR DIADE
Présentée par Branly Wilfried EFFA EFFA
Le 16 Décembre 2020
Sous la direction de Pascal GANTET
et Laurent LAPLAZE
Devant le jury composé de
Benoit LEFEBVRE, DR, INRAESandra BENSMIHEN, CR, CNRS
Pierre CZERNIC, Pr, Université de Montpellier
Abdala Gamby DIEDHIOU, Maître de Conférences, Université Cheikh Anta Diop Alexandre GRONDIN, CR, IRD
Pascal GANTET, Pr, Université de Montpellier Laurent LAPLAZE, DR, IRD
Rapporteur Rapporteur Président du jury Examinateur Examinateur Directeur de Thèse Co Directeur de Thèse
Effet de la symb iose endomy corh iz ienne sur la
toléra nce au stres s hy dr ique chez le r iz
I
Effet de la symbiose endomycorhizienne
sur la tolérance au stress hydrique chez
I
DEDICACES
À MES ASCENDANTS
ET
II
REMERCIEMENTS
Mes remerciements s’adressent en premier lieu à mon Seigneur Jésus Christ qui m’a gardé pendant ce travail et qui continue de me garder.
Je remercie le Ministère de la Recherche Scientifique et le Ministère de la Fonction Publique du Gabon pour l’accord de cette thèse. Je remercie les anciens Commissaires Généraux du CENAREST Samuel MBADINGA et Daniel Franck IDIATA, et l’actuel Commissaire Général Alfred NGOMANDA pour leurs soutiens. Je remercie les anciens Directeurs de l’Institut de Recherches Agronomiques et Forestières (IRAF) François NDJELASSILI et Auguste NDOUTOUME NDONG, et l’actuel Directeur Jacques François MAVOUNGOU, pour leurs encouragements.
Je tiens par la suite à remercier les membres du jury. Je veux dire toute ma reconnaissance à Pierre CZERNIC qui a bien accepté de le présider, à Benoit LEFEBVRE et à Sandra BENSMIHEN d’avoir bien voulu être rapporteur de ce travail, et à Abdala Gamby DIEDHIOU d’avoir accepté d’y participer comme membre invité.
J’exprime toute ma déférence à Pascal GANTET et à Laurent LAPLAZE, respectivement directeur et codirecteur de thèse, pour leurs encouragements, leur sympathie, leur grande disponibilité et surtout leur amitié. Vous avez contribué énormément au renforcement de mes capacités dans la recherche, et les nombreuses discussions que nous avons eues m’ont été et me seront d’une aide précieuse. J’ai été très honoré de travailler au sein de l’équipe CERES. Je tiens à témoigner toute ma reconnaissance et mes remerciements les plus sincères à Alexandre GRONDIN qui a supervisé ce travail. Merci de tout cœur pour ta confiance, ta disponibilité, tes nombreux conseils et ton amitié.
Merci aux membres de mes comités de thèse Lionel MOULIN, Claudine FRANCHE, Abdala Gamby DIEDHIOU. Merci pour le temps que vous m’avez accordé, vos conseils avisés et votre soutien.
Merci à l’Ecole Doctorale GAIA d’avoir accepté ma candidature, et à Marc BOUVY pour sa sympathie.
III Merci à l’UMR DIADE de m’avoir accueilli pour y réaliser mes travaux de thèse, et à Alain GHESQUIERE pour les apports scientifiques lors de nos discussions. Merci à Bruno BARTHELEMY, Carole BESSIERE et Virginie CHAMPION pour votre diligence dans la gestion des démarches administratives.
Merci aux membres de l’équipe CERES pour l’accueil chaleureux. Merci à Daniel MOUKOUANGA pour les conseils et la fraternité. Merci à Isabelle BOURRIE pour la gentillesse. Merci à Françoise LAZENNEC pour les encouragements. Merci à Mickael LUCAS pour sa convivialité, son soutien et son amitié. Merci à Soazig GUYOMARC’H pour les histoires partagées, les moments de joie et son amitié. Merci à Antony CHAMPION pour les conseils et la sympathie. Merci à Vincent VADEZ pour les discussions enrichissantes. Merci aux post doctorants Carla DE LA FUENTE CANTÓ, Kevin BELLANDE, Kwanho JEONG, AMIR HAJJARPOOR, James BURRIDGES et Mariama NGOM pour les discussions enrichissantes, les appuis techniques et l’amitié. Merci aux doctorants Jérémie LAVARENNE, Mathieu GONIN, Duy-Chi TRINH, Trang Hieu NGUYEN, Awa FAYE, Marie Thérèse MOFINI, Donald TCHOUOMO, Theo PINGUET-POQUET, Raphael PILLONI pour les moments passés ensemble. Merci à Jean Rémy BROSSIER pour la sympathie et les échanges footballistiques. Merci à Anne Sophie PETITOT pour la disponibilité. Merci à Mame Sokhatil NDOYE pour l’appui et la sympathie. Merci à Marie Rose Ndella THIAW, à Alexie TECHER et tous les stagiaires de licence et master que j’ai croisés pendant ces 3 ans pour leur sympathie.
Merci à Didier BOGUSZ pour l’amitié, les conseils, les encouragements et les rencontres de handball.
Merci à Stéphane JOUANNIC et Hélène ADAM pour la sympathie et les encouragements. Merci à François SABOT, Phillipe CUBRY et Harold CHRESTIN pour les données sur les génotypes d’Oryza glaberrima séquencés.
Merci à Laurence ALBAR et Harold CHRESTIN pour les semences de riz africain.
Merci à toutes les personnes impliquées dans le projet MycoRice. Merci à l’équipe du LEPSE Claude WELCKER, Llorenç CABRERA-BOSQUET, Nathalie LUCHAIRE, Benoît SUARD, Romane. Merci à l’équipe venue de Consejo Superior de Investigaciones Científicas (Granada/Spain), Ricardo AROCA, Maria Del Carmen PERALVAREZ, Gabriela QUIROGA GARCÍA. Merci aux enseignants du département de Biologie Végétale de l’Université Cheikh Anta Diop (Dakar/Sénégal), Aboubacry KANE, Abdala Gamby DIEDHIOU. Merci
IV aux chercheurs de la station régionale du sahel d’Africa Rice (Saint-Louis/Sénégal) Baboucarr MANNEH, Daouda MBODJ. Merci aux membres de l’équipe CERES de l’IRD (Montpellier/France), Pascal GANTET, Laurent LAPLAZE, Vincent VADEZ, Antony CHAMPION, Alexandre GRONDIN, Mame Sokhatil NDOYE, Daniel MOUKOUANGA, Kwanho JEONG, Marie Rose Ndella THIAW.
Merci à Harold CHRESTIN pour la disponibilité, les partages et surtout l’amitié.
Merci à Sophie CHERON, Emilie THOMAS, Jamel ARIBI, William RIBIERE pour leur disponibilité, leur sympathie et leur appui en serre.
Merci à Daniel GRIMANELLI pour les discussions enrichissantes.
Merci au LCM pour l’accueil lors de ma formation sur les mycorhizes et Merci Saliou FALL pour les conseils, la disponibilité et l’amitié. Merci à Cheikh NDIAYE et Abdala Gamby DIEDHIOU mes formateurs pour leur disponibilité et leurs encouragements. Merci à Mathieu Ndigue FAYE, Francis DOREGO, Maimouna CISSOKO, Marie Claire DASILVA, Halima MAIGUIZO, Paul TENDENG, Mariama GUEYE, Tania WADE, Antoine LE QUERE, Abdoulaye SOUMARA, Niokhor BAKHOUM, Seynabou SENE, Fatou DIOUF, Issa DIEDHIOU, Fatoumata FALL, Arlette ZAIYA, Aïda NDIAYE, Diariétou NIANG, Darius NZEPANG, Barkissa FOFANA, Ndeye Seyni FAYE pour la convivialité. Merci à Nathalie DIAGNE pour les partages et l’amitié.
Merci à Ndjido Ardo KANE et Laurent LAPLAZE pour les facilités au sein du LMI LAPSE lors de mes travaux.
Merci à Myriam COLLIN, Hélène ADAM et Soazig GUYOMARC’H pour les facilités au laboratoire d’histologie.
Merci à Daniel MOUKOUANGA pour les facilités et l’appui technique au laboratoire « Zone Transfo ».
Merci à Gilles BÉNA pour l’offre de participation à la Conférence Internationale Phytobiome en 2018.
Merci à Jérôme DUMINIL pour les encouragements et l’amitié. Merci à Leila ZEKRAOUI pour les partages.
Merci à Virginie VAISSAYRE pour sa disponibilité et sa gentillesse.
Merci à Maty KANE, Manuelle RIVAL, Hoissine BEN ALI, Sayouba OUEDRAOGO et Pape SONKO pour leur sympathie.
V Merci à tous les membres de Gentrop pour les facilités.
Merci aux directeurs des UMR DIADE, IPME, MIVEGEC et de l’ED GAIA pour le soutien et l’accompagnement lors de l’organisation des PhDays2018. Merci aux directeurs de thèse et aux doctorants qui ont acceptés de jouer le jeu. Merci à Adrian WALLNER et à Jérôme BOURRET avec qui j’ai organisé cet évènement.
Merci à Michèle, Ghislain, Elvira, Amadou, Zamblé, Katina, Derrick, Cheikh, Amidou, Moussa, Oumarr, Mariam, Estelle, Christelle, Lorraine, Dorgelès, Boniface, Maram, Aurore, Lison, Gaëlle, Linda, Abby, Ai My, Ngan, Rayan, Manon, Kader, Sarah, Juliette, Thomas, Mariano, Eldys et à tous les doctorants et post-doctorants que j’ai côtoyés à l’IRD pour leur sympathie.
J’exprime toute ma reconnaissance à Lucien Eugene OBAME, Mesmin NDONG BIYO’O, Crépin ELLA MISSANG, Ibrahima NDOYE, Richard EKAZAMA, Toussaint BENGONE NDONG, Gertrude BANG, Dick Sadler DEMIKOYO, Louis Sylvain ALLOGO ENGO. Ma gratitude s’adresse à Jeanine BINDANG M’ESSONE, Pulchérie BONGO MAVOUNGOU, Clotilde ABESSOLO MEYE, Andréa OBELLA, Dyana NDIADE BOUROUBOU, Corinne OYE ANDA, Yonnelle Déa MOUKOUMBI, Flore Aurélie MOLOUBA, Stéphane MIBEMU GUIBINGA, Nellie MOUSSOUNDA DOGBE, Ambroise NDONG BIE, Natacha EFOUA TOMO, Hugues Calixte EYI NDONG, Serge EKOMY ANGO, Hendrix MBENG NDONG, Pamphile NGUEMA NDOUTOUME, Annaïs MEZUI, Yves BAGAFOU, Paul OBIANG ANGWE, ABAGA OBIANG, Nicaise RABENKOGO, Jean Hervé MVE BEH, Jean Daniel MBEGA, Jean Félicien LIWOUWOU, Blaise MBOYI, Jean Noël BIBANG BI NGUEMA, Jean Aimé YOGA, Dieudonné NDZENG BORO, Jean Paul MAYEKI, Léon NGUIMBI, Dieudonné EKOMY, Steeve NGAMA, Edgard FABRE, Gervais KOUDAOU, Sandrine BAYENDIT, Myrianne ANDEIME, Alain Serges ONDO AZI, Yves Armand EMANE, Rachel PAMBO, Yolande ITSIEMBOU, Jean Olivier NZIENGUI MOBEYI, Michel NGUELE, Serge NGAMI, Nestor ENGONE OBIANG, Boris MAKANGA, Arthur MBINA, Valérie NGARE, Clara Nadège MOUSSOUNDA, Viviane TSASA, Olga YEYI, Irène AWAGUISSA, Bertille AVOMO, Jacque CHELE, Joseph EBEZO, Simon MEYE M’ESSONE.
Ma gratitude s’adresse également à : A tout le personnel du CENAREST. Aux enseignants chercheurs de l’USTM Aux enseignants de l’ENEF
VI Aux collègues du MinAgri
A tous les fidèles et pasteurs des Eglises Evangéliques Réformées de Montpellier, St-Matthieu-de-Tréviers et Cœur d’Hérault.
A tous les fidèles et pasteurs de l’Eglise Protestante du Sénégal, en particulier à ceux de la paroisse de Khor à Saint Louis.
A tous les fidèles et pasteurs de l’Eglise Evangélique du Gabon.
Aux Sœurs de Saint François d’Assise pour le logement, les partages et leur gentillesse. À la famille milanaise
Au groupe du YA
Enfin, je ne saurai terminer sans remercier mes frères et sœurs, mes amis et connaissances parsemés dans le monde pour la chaleur humaine.
I
Table des matières
DEDICACES... I REMERCIEMENTS ...II
INTRODUCTION GÉNÉRALE ...1
I. Le riz ...2
I.1 Origine et domestication ...2
I.2 Principaux agrosystèmes rizicoles ...6
I.3 Morphologie et développement de la plante de riz ...7
I.3.1 Les parties aériennes ...7
I.3.2 Le système racinaire ... 10
I.3.3 Cycle de développement du riz ... 13
I.4 Les contraintes biotiques et abiotiques affectant la culture du riz ... 15
I.4.1 Contraintes biotiques ... 15
I.4.2 Contraintes abiotiques ... 17
I.5 Stratégies d’amélioration de la tolérance au déficit hydrique... 26
I.5.1 Les traits racinaires bénéfiques pour la tolérance au déficit hydrique... 26
I.5.2 Identification de QTL contrôlant la tolérance au déficit hydrique ... 27
II. Symbioses ... 29
II.1 Symbioses fixatrices d’azote ... 30
II.2 Symbiose mycorhizienne ... 31
II.3 Impacts de la symbiose endomycorhizienne sur la croissance des plantes et enjeux agronomiques ... 33
II.3.1 Les facteurs favorisant la mise en place de la symbiose ... 33
II.3.2 Impacts bénéfiques et délétères de l’interaction plante-CMA ... 34
II.3.3 Les contextes agronomiques à privilégier ... 35
Problématique et objectifs ... 36 Références bibliographiques ... 37 CHAPITRE 1 ... 67 Résumé ... 68 Abstract ... 69 1. Introduction ... 69 2. Am symbiosis establishment ... 72
2.1 Pre-infection signaling events ... 73
II
2.3. Arbuscule development and function ... 78
3. Rice morphological and ecological factors controlling Amf infection ... 80
3.1 Rice root morphology, anatomy and exudation ... 80
3.2 Rice cropping systems ... 81
4. Improvement of rice growth and resistance to salinity and drought stress by Am symbiosis ... 84
4.1. Nutrient uptake for improved growth in nutrient deficient soils ... 86
4.2. Ionic balance and water status for improved growth in saline soils ... 87
4.3. Water uptake for improved resistance to drought ... 89
5. AMF: opportunities and challenges for rice breeding ... 91
5.1. Finding the right rice host-AMF combination for the right environment ... 93
5.2. What to breed for? ... 94
6. Conclusion ... 96
References ... 97
CHAPITRE 2 ... 122
Résumé ... 123
I. Introduction ... 123
II. Matériel et méthodes ... 126
1. Matériel fongique et végétal ... 126
2. Substrats et inoculation ... 126
2.1 Essai préliminaire ... 127
2.2 Essai de validation des conditions de cultures ... 128
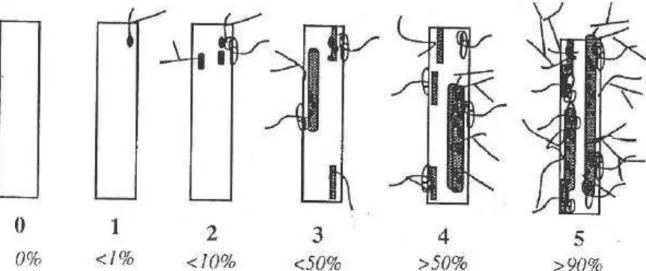
3. Mesure du taux de colonisation des racines par Ri ... 128
4. Mesure de l’acquisition d’eau ... 131
5. Analyse statistique des données ... 132
III. Résultats ... 135
1. Sélection du substrat ... 135
2. Validation des conditions d’inoculation dans les conditions de culture PhenoArch ... 140
IV. Discussion ... 145
1. Sélection du substrat ... 145
2. Validation des conditions d’inoculation dans les conditions de culture PhenoArch ... 145
V. Conclusion et perspectives ... 147
Références bibliographiques ... 148
CHAPITRE 3 ... 152
Abstract ... 156
I. Introduction ... 157
III
III. Results ... 164
IV. Discussion ... 183
References ... 189
ANNEXES CHAPITRE 3 ... 196
DICUSSION GENERALE ET CONCLUSION ... 216
1
2
I.
Le riz
Le riz constitue l’aliment de base de plus de la moitié de l’humanité (Sahu et al. 2018). Outre son utilisation directe dans l’alimentation humaine, les grains de riz servent à fabriquer des boissons, gâteaux, produits pharmaceutiques, aliments diététiques et bien d’autres. Les sous-produits de transformation et la paille sont utilisés en alimentation animale. Les balles de riz servent de combustible et les cendres d’engrais. La paille est également utilisée comme litière, comme matière première pour la fabrication de pâte à papier, ou encore pour la fabrication de papier mural et même comme substrat pour la culture de champignons.
Le genre Oryza a été classé dans, la tribu des Oryzeae, sous famille des Oryzoideae et la famille des Poaceae (Roschevicz 1931; Ndjiondjop et al. 2018). Il renferme une vingtaine d’espèces (Kellogg 2009; Jacquemin et al. 2013) parmi lesquelles deux sont cultivées pour l’alimentation humaine. Il s’agit d’O. sativa L. (Candolle 1883) ou riz asiatique et d’O.
glaberrima Steud (Portères 1956) encore appelé riz africain.
I.1 Origine et domestication
La domestication est un processus évolutif complexe dans lequel l'utilisation humaine d'espèces végétales et animales entraîne des changements morphologiques et physiologiques, appelés « syndrome de domestication » (Harlan 1975), qui distinguent les espèces domestiquées de leurs ancêtres sauvages (Hancock 2005). La domestication d'espèces végétales a été l'une des innovations les plus importantes de l'histoire humaine qui s’est produite au néolithique il y a 10 000 à 13 000 ans, et qui a conduit des groupes de chasseurs-cueilleurs à former des sociétés agricoles sédentaires (Diamond 2002).
L’espèce O. sativa L aurait été domestiquée à partir de l’espèce sauvage O. rufipogon Griff en Asie dans la vallée de Yangtze en Chine (Figure 1) il y a environ 8 000 à 9 000 ans (Higham, et Lu 1998 ; Li Liu et al. 2007; Fuller et al. 2010; Fuller et Qin 2010; Molina et al. 2011) et en Inde il y a environ 4000 ans (Fuller et al. 2010) d’après les résultats des études archéologiques. Son introduction dans les autres continents a commencé par l’Afrique ; tout d’abord dans la région orientale, probablement au premier siècle de notre ère par des commerçants indiens (Linares 2002), puis dans la région occidentale par les Portugais 14 siècles plus tard (Portéres 1962). L’Europe, quant à elle, a vu l’introduction du riz cultivé
3
asiatique, premièrement au 8éme siècle en Espagne, puis au 15ème siècle en Italie et en France (Musset 1942; Portères 1956 ; Jacquot et al. 1997). C’est à la fin du 17ème siècle que le riz
asiatique aurait été introduit par les espagnols en Caroline du sud, en Amérique du nord, et moins d’un siècle plus tard en Amérique du sud.
La domestication du riz africain, O. glaberrima Steud, s'est produite bien plus tard que celle du riz asiatique, mais certainement avant l'introduction du riz asiatique en Afrique (Sarla et Swamy 2005; Sweeney et McCouch 2007). O. glaberrima a été décrite et proposée comme nouvelle espèce par le botaniste Steudel en 1855, il l’a distinguée d’O. sativa sur la base de la finesse des épillets et des feuilles (Portères 1956). Des botanistes français après des études menées sur l’origine d’O. glaberrima ont en 1914 reconnu que cette espèce avait pour lieu d’origine l’Afrique de l'Ouest (Carney 2000). Il a fallu attendre les années 1970 pour que la communauté scientifique internationale reconnaisse O. glaberrima comme une nouvelle espèce ayant été domestiquée en Afrique de l'Ouest (Carney 2000). Des hypothèses ont été proposées concernant le processus de domestication d'O. glaberrima. Selon Portéres (1962), le riz africain a d'abord été domestiqué à partir de son parent sauvage O. barthii (anciennement O. breviligulata) dans le delta intérieur du haut Niger, actuelle République du Mali (Figure 1), il y a environ 3500 ans. O. glaberrima est diploïde (2n = 24) et a le même type de génome (AA) que son progéniteur O. barthii, et O. longistaminata dont O. barthii est dérivée. O. barthii est plus largement distribuée en Afrique qu’O. glaberrima. Cependant, O.
longistaminata est plus largement distribuée en Afrique subsaharienne et à Madagascar
(Khush 1997 ; Brar et Khush 2003) .
De son centre principal de domestication, O. glaberrima s'est diffusée vers deux centres secondaires, l'un le long de la côte sénégambienne et la Guinée Bissau où elle a été cultivée dans des conditions irriguées et le second dans la forêt guinéenne entre la Sierra Leone et la partie Ouest de la Côte d'Ivoire où elle a été cultivée dans des conditions pluviales (hautes terres) (Traoré 2006). Sur la base de preuves linguistiques et archéo-botaniques fragmentées, Harlan et Stemler (1976) ont proposé une théorie alternative, déclarant que O. glaberrima a été domestiquée dans différentes localités par d'anciennes populations humaines de chasseurs-cueilleurs qui ont récoltées et sélectionnées des formes d'O. barthii trouvées dans des forêts claires et des zones de savane.
Toutefois, des études utilisant des données génomiques ont confirmé l'hypothèse de Portéres (1962) affirmant que O. glaberrima a été domestiquée de son ancêtre annuel O.
4
barthii dans une seule région le long du fleuve Niger au Mali (Li et 2011; Cubry et al. 2018);
(Wang et al. 2014) . Par la suite, les zones de culture du riz africain ont été étendues à plusieurs pays africains, du delta du fleuve Sénégal à l'Ouest au lac Tchad à l'Est. O.
glaberrima a également été trouvée en dehors des régions Ouest-africaines, dans les îles de
Pemba et Zanzibar en Tanzanie (Bezançon 1993 ; Vaughan 1994).
O. glaberrima a été introduite dans les pays américains, en particulier dans les Caraïbes,
le Brésil, la Guyane, le Salvador, le Panama et la Caroline aux États-Unis pendant la période de la traite négrière, par des riziculteurs ouest-africains asservis (Vaughan 1994; Carney 2004; van Andel et al. 2016).
Des études portant sur l'évolution des réseaux de gènes associés à des traits morphologiques ont apporté des éclairages sur la domestication du riz africain (Sweeney et McCouch 2007). Parmi eux, l'architecture de l'inflorescence et la grosseur des graines sont quelques-uns des principaux traits morphologiques modifiés lors de la domestication du riz. Il a été récemment démontré que la complexité plus élevée de la panicule d'O. glaberrima par rapport à celle de son parent sauvage O. barthii est associée à un méristème de rachis plus large et résulte d'altérations précoces de l'expression des gènes liés aux ramifications pendant le développement reproductif chez O. glaberrima (Ta et al. 2017). Le grain d’O. glaberrima est généralement plus court que celui de son ancêtre, O. barthii. Ce caractère a été associé à une mutation, chez O. glaberrima, du gène GL4 qui régule l'élongation longitudinale des cellules des glumes externes et internes (W. Wu et al. 2017).
5
Figure 1 : Planisphère indiquant les bassins et les périodes de domestication des deux espèces de riz cultivées et les principales dates de dispersion vers d’autres continents
6
I.2 Principaux agrosystèmes rizicoles
O. sativa et O. glaberrima sont cultivés sous divers régimes hydriques (Bezançon 1995;
Seck et al. 2012). Les deux principaux types d’agrosystèmes rizicoles sont: les agrosystèmes aquatiques comprenant la riziculture inondée où le riziculteur ne contrôle pas le niveau de la lame d’eau de la rizière et la riziculture irriguée où le riziculteur contrôle la présence et le niveau de la lame d’eau de la rizière, et l’agrosystème sec correspondant à la riziculture pluviale ou l'apport d'eau dépend des précipitations (Bezançon 1995; Seck et al. 2012). Selon le climat, il est possible de réaliser 1 à 3 cycles de culture du riz par an (3 cycles / an dans le delta du Mékong et 2 cycles par an en Afrique de l’Ouest).
Les agrosystèmes aquatiques représentent la grande majorité des superficies rizicoles mondiales. Ainsi, sur 167,13 millions d'hectares de riz cultivé dans le monde en 2018 (FAOSTAT, 2020), uniquement 21,53 millions d'hectares sont consacrés à la riziculture pluviale. En Asie, la riziculture pluviale représente 13,4 % des superficies totales consacrées au riz contre 75% en Amérique latine et 40% en Afrique (dont 50 % en Afrique de l'Ouest). En Afrique de l’Ouest, et plus précisément au Nigéria, en Sierra Léone, au Togo, au Mali et au Sénégal, O. glaberrima est cultivé par de petits riziculteurs (Teeken 2015). Les superficies consacrées à la culture d’O. glaberrima représentent près de 20% des rizières de l’Afrique de l’Ouest (Plant Resources of Tropical Africa, PROTA), avec des rendements moyens de 3 t/ha (Jacquot et al. 1997) et des rendements potentiels de 5 à 6 t/ha (Shaibu et al. 2018; M. N. Ndjiondjop et al. 2018).
Malgré son faible niveau de production, O. glaberrima possède des capacités de tolérance accrues aux stress biotiques (Thiémélé et al. 2010) et abiotiques (Wambugu et al. 2013) en comparaison avec O. sativa. Ainsi, O. glaberrima possède des caractères à intérêt agronomiques intéressants (M.-N. Ndjiondjop et al. 2018.) de par sa tolérance aux stress nutritifs (Ghesquiere et al. 1997 ; Linares 2002; Sarla et Swamy 2005), à la sécheresse (Jones et al. 1997 ; Bocco et al. 2012 ; M. N. Ndjiondjop et al. 2012; Kartika et al. 2020) et à la salinité (Platten et al. 2013 ; Meyer 2014). O. glaberrima possède par exemple un allèle du gène PSTOL1 améliorant la tolérance à la carence en phosphore (Pariasca-Tanaka et al. 2014). Afin de combiner ces traits d’O. glaberrima à ceux relatifs aux hauts rendements présents chez O. sativa, des programmes de sélection interspécifiques ont été lancés par AfricaRice au début des années 1990. Ces travaux ont conduit au développement de variétés NERICA (pour
7
NEw RICe for Africa ; Eklou A. Somado 2008). Ces variétés ont été développées en utilisant une sélection conventionnelle, deux rétrocroisements, et une culture d'anthères pour briser la barrière d'infertilité existant entre O. glaberrima et O. sativa (M.-N. Ndjiondjop et al., 2018). Les NERICA possédant des rendements et capacités à tolérer des environnements difficiles (Eklou A. Somado 2008) ont eu des impacts positifs sur la sécurité alimentaire et sur les revenus des riziculteurs en Afrique subsaharienne (Obilana et Okumu 2005).
I.3 Morphologie et développement de la plante de riz
I.3.1 Les parties aériennes
Le riz est une plante herbacée annuelle présentant une tige qui talle, des feuilles sessiles plates en forme de lame et une panicule terminale (Figure 2 ; Lacharme 2001). Chaque panicule peut contenir 50 à 300 fleurs, à partir desquels les grains se forment. Les plantes de riz mesurent généralement entre 0,6 mètres (m) à 2 m, mais peuvent présenter des hauteurs allant jusqu’à 6 m dans le cas des riz flottants.
O. sativa L., est subdivisé en deux sous espèces O. sativa ssp. japonica et O. sativa ssp. indica. La sous espèce japonica est celle rencontrée dans des zones subtropicales
ou tempérées, elle a des feuilles étroites, une taille courte à intermédiaire et un tallage moyen. Les épillets peuvent être non-aristés ou porter de longues arêtes. Ils ne s'égrènent pas facilement, les grains de cette sous espèce sont courts et arrondis avec une teneur en amylose comprise entre 0 et 20 % (Bioversity International-IRRI-AfricaRice 2007).
La sous espèce indica quant à elle est surtout rencontrée dans des régions tropicales et subtropicales au climat chaud et humide, elle se caractérise par des feuilles larges à étroites, une stature de la plante grande à intermédiaire (sauf pour les cultivars demi-nains) et par leur aptitude au tallage. Les épillets ne portent pas d'arêtes (non-aristés) et s'égrènent plus facilement. Les grains sont relativement longs et minces, légèrement aplatis et ont une teneur en amylose comprise entre 23 % et 31 % (Bioversity International-IRRI-AfricaRice 2007).
O. glaberrima Steud, est principalement cultivée en Afrique de l’Ouest (Bezançon 1994).
Les tiges sont sans ramifications, le limbe foliaire est linéaire lancéolé (en forme de fer de lance et atténué aux deux extrémités), la ligule courte (3-4 mm) est orbiculée (plate et ronde),
8
l'inflorescence est une panicule compacte qui reste érigée à maturité et très peu ramifiée (ramifications primaires et secondaires portant les épillets). Les épillets sont oblongs orbiculés et les glumes, souvent à l'état très réduit, peuvent dépasser la taille du grain chez certaines variétés. Les glumelles, glabres ou non, peuvent être colorées. La glumelle inférieure (lemma) possède cinq nervures avec quelque fois la nervure ventrale qui se prolonge pour donner naissance à une barbe (arête), la glumelle supérieure (palea) quant à elle ne possède que trois nervures (Wopereis et al. 2008). La fleur est composée d'un ovaire prolongé par deux stigmates plumeux, et entouré de six étamines. Le caryopse fréquemment pigmenté (de couleur rouge) ne dépasse que très rarement 9 millimètres (mm) de long. L'égrenage spontané est assez marqué (Bezançon 1995).
O. glaberrima se caractérise par une ligule courte et tronquée et par une panicule dressée.
Ceci la distingue facilement d’O. sativa qui possède une ligule longue et bifide avec une panicule légèrement retombante à la maturité et un caryopse pigmenté.
9
Figure 2: (a) Plante de riz, échelle : 1/15, (b) structure de la ligule et l’auricule, échelle : 10X, (c) structure de la panicule, échelle : 1/6, (d) structure de l’épillet, échelle : 6X (Dessins de Nicholas Polato, archive.gramene.org), et (e) structure du grain, échelle : 5X (Lacharme 2001).
10
I.3.2 Le système racinaire
Le système racinaire assure les fonctions vitales d’absorption de l’eau et des éléments minéraux ainsi que l’ancrage dans le sol (Waisel et Eshel 1992). Il contribue aux équilibres hormonaux qui contrôlent la croissance et le fonctionnement de la plante, et constitue également une source de matière organique pour le sol.
L'architecture d'un système racinaire est le résultat de processus de développement dynamique et inclut deux concepts : la forme du système racinaire et sa structure. La forme définit l'emplacement des racines dans l'espace et la façon dont le système racinaire occupe le sol. Sa quantification est généralement réalisée en mesurant des variables telles que la profondeur des racines, l'expansion latérale des racines, les longueurs et les densités des racines (Hodge et al. 2009). La structure racinaire décrit la variété des composants constituant le système racinaire (racines et segments racinaires) et leur relation.
Le riz possède un système racinaire fasciculé et fibreux (en faisceau de filets minces) composé de différents types de racines ramifiées (Coudert et al. 2010). Quatre types de racines ont été identifiés chez le riz : la radicule ou racine primaire, les racines coronaires, et les racines latérales petites et grandes (figure3 ; Rebouillat et al. 2009). L'activité des méristèmes apicaux racinaires, qui se différencient au cours de l'embryogenèse (Benfey et Scheres, 2000) génère la radicule qui représente la première racine à croître pendant la germination. Des racines coronaires embryonnaires peuvent émerger du nœud du coléoptile (Sabatini et al., 2003). D’autres racines coronaires post-embryonnaires émergent ensuite des nœuds de la tige principale et des talles (Rebouillat et al. 2009). La racine primaire et les racines coronaires peuvent se ramifier pour générer deux types de racines secondaires : les grandes racines latérales caractérisées par un géotropisme positif et une croissance indéterminée, et les petites racines latérales courtes, agéotropiques et montrant une croissance déterminée (Coudert et al. 2010). Les grandes racines latérales sont généralement longues et épaisses (80 à 150 μm de diamètre) tandis que les petites sont courtes et minces (50–60 μm de diamètre ; Dievart et al. 2013).
Il existe une grande variabilité inter- et intraspécifique pour l’architecture racinaire. Par exemple, il a pu être observé que les variétés de riz pluvial possèdent généralement des systèmes racinaires plus profond que ceux des riz inondés, leur permettant d’aller chercher
11
l’eau en profondeur (Kawata et al. 1977 ; Reyniers et al. 1978). De plus, le système racinaire d’un même génotype peut varier considérablement en fonction de la composition du sol, et en particulier de la disponibilité de l'eau et des nutriments minéraux (Malamy 2005). En effet, les racines sont des organes plastiques, capables d’adapter leur développement aux caractéristiques du sol. Les plantes peuvent modifier leur architecture racinaire en initiant des primordia racinaires latéraux et en influençant le nombre et la croissance des racines coronaires et latérales (Hodge et al. 2009). Les variétés de riz résistantes à la sécheresse présentent généralement un système racinaire plus profond et plus fortement ramifié que les variétés sensibles à la sécheresse (Price et al. 1997). D’autres études menées chez le génotype de riz IR64 ont montré que, contrairement à la longueur des petites racines latérales, la longueur des grandes racines latérales est significativement accrue en condition de stress hydrique comparativement à une condition bien irriguée (Kano-Nakata et al. 2019).
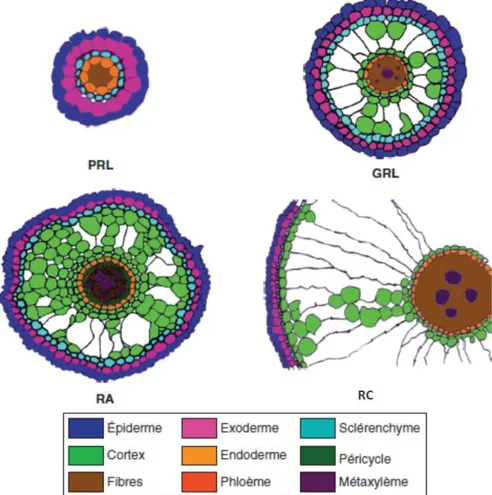
L’anatomie radiale des racines de riz est quant à elle caractéristique des plantes semi-aquatiques, avec des tissus spécialisés leur permettant de croître dans un sol saturé en eau (Rebouillat et al. 2009). L’anatomie racinaire est composée de cellules épidermiques dans sa partie la plus externe et d’une stèle dans sa partie interne (figure 4 ; Rebouillat et al. 2009). Les tissus intermédiaires de la radicule, des racines coronaires et des grandes racines latérales du riz sont composés de l'exoderme, du sclérenchyme, du cortex et de l'endoderme (Rebouillat et al. 2009; S. Henry et al. 2016). Les petites racines latérales se caractérisent par une absence de cortex (Kwata et al. 1977 ; Rebouillat et al. 2009). L'épiderme, l'exoderme, le sclérenchyme et l'endoderme sont constitués chacun d'une seule couche de cellules, alors que le cortex est constitué de 4 à 5 couches de cellules dans la radicule (S. Henry et al. 2016) et de plus de 10 couches de cellules dans les racines coronaires (Dievart et al. 2013). Le cortex peut se différencier en aérenchyme qui représentent des lacunes (Evans 2003; Rebouillat et al. 2009; Dievart et al. 2013; Kawai et al. 1998). Les parois des cellules du sclérenchyme et de l'endoderme contiennent des molécules hydrophobes tels que la subérine qui représentent des barrières apoplastiques contrôlant le transport radial de l'eau et des nutriments du sol vers la stèle et pourraient jouer un rôle de support mécanique (Henry et al. 2012 ; Gregory, 2006 ; Dievart et al. 2013). Les aérenchymes jouent un rôle majeur dans la tolérance aux conditions d'inondation et assure un flux continu d'oxygène des parties aériennes vers le système racinaire, ce qui permet la croissance des racines dans des conditions anoxiques (Rebouillat et al. 2009; Dievart et al. 2013; S. Henry et al. 2016). Le cortex a une fonction importante mais variable dans la physiologie racinaire de nombreuses espèces et est impliqué dans le stockage
12
d’amidon principalement ou dans les interactions symbiotiques telles que les symbioses endomycorhiziennes (Lux et al. 2004) Lors des symbiose endomycorhiziennes les arbuscules qui sont les sites d’échanges de nutriments entre les partenaires symbiotiques se forment dans le cortex (Paszkowski 2006).
La stèle qui comprend le xylème et le phloème de la racine, est très importante pour l’absorption et la translocation de l’eau et des nutriments des racines vers les parties aériennes de la plante (Uga et al. 2008). La taille et le nombre de vaisseaux du xylème racinaire ont un impact sur la conductivité et le transport de l’eau (Kondo et al. 2000). Les petites racines latérales sont composées d’une stèle sans métaxylème central, alors que les grandes latérales sont caractérisées par un nombre plus important de tissus internes organisés autour d’une stèle présentant un métaxylème central (Kono et al. 1972).
Figure 3: Système racinaire du riz (d’après Rebouillat et al. 2009). A : système racinaire d’une plantule de riz âgée d’une semaine (cv Nipponbare. japonica); B : système racinaire d’une plante de riz âgée de 40 jours; C : vue détaillée d’une racine coronaire. ra: radicule; rc: racine coronaire; prl: petite racine latérale; grl: grande racine latérale. Échelles (A, C) : 1 cm, (B): 5 cm.
13
Figure 4: Anatomies radiales comparées des quatre types racinaires chez le riz (d’après Dievart et al. 2013), Représentation schématique de l’organisation radiale d’une radicule (RA) de riz âgée de 7 jours, d’une racine coronaire (RC), d’une grande racine latérale (GRL) et d’une petite racine latérale (PRL)
I.3.3 Cycle de développement du riz
Le cycle de développement du riz varie de 3 à 6 mois (figure 5 ;Yoshida 1981) et se divise en trois phases :
Ø La phase végétative qui s’étend de la germination à l’initiation paniculaire ; Ø La phase reproductive qui s’étend de l’initiation paniculaire à la floraison ; Ø La phase de maturation qui s’étend de la floraison au remplissage du grain.
La durée de la phase végétative (figure 5) est très variable en fonction des variétés, des conditions climatiques et des pratiques culturales. Elle est notablement affectée chez certaines variétés par la photopériode et la température. Elle comprend les stades suivants : le stade germinatif, le stade plantule, le stade tallage et le stade d’élongation du chaume.
14
Figure 5 : phase végétative chez O. glaberrima var CG14 (gauche) et O. sativa ssp japonica var Nipponbare, 7 semaines après semis (photo : Effa Effa, 2019)
La phase reproductive comporte les stades d’initiation paniculaire, de montaison et d’épiaison. Elle est caractérisée par la naissance de la panicule et le développement des épillets et des organes reproducteurs. Elle a une durée comprise entre 30 et 35 jours, quelles que soient la variété et la saison (Yoshida 1981 ; Wopereis et al. 2008). Elle n’est pas affectée par la photopériode, cependant elle est très sensible aux températures basses, au déficit hydrique et à la salinité, qui peuvent occasionner la stérilité des organes reproducteurs des épillets, ce qui se traduit par des épillets vides au moment de la récolte (Wopereis et al. 2008).
La phase de maturation commence après la fécondation. L’ovaire gonfle, le caryopse (grain de riz) se développe jusqu’à la maturité. La durée de la phase de maturation varie de 30 à 65 jours (Yoshida, 1981), quel que soit la variété et la saison et comporte les étapes suivantes : grain de riz au stade laiteux, grain de riz au stade pâteux et grain de riz au stade mature (grain dur ; Wopereis et al. 2008). Elle est sensible aux températures élevées, aux vents violents et au déficit hydrique durant les 15 premiers jours qui suivent le stade pâteux. Le drainage des parcelles ou arrêt de l’irrigation au stade pâteux est bénéfique pour le riz car il permet d’homogénéiser la maturation et facilite la récolte (Wopereis et al. 2008).
15
Figure 5 : Descripteurs agronomiques des phases de développement du riz
I.4 Les contraintes biotiques et abiotiques affectant la culture du riz
Le riz est cultivé sous des climats tropicaux (O. glaberrima et O. sativa ssp indica) à tempérés (O. sativa ssp japonica), à des altitudes allant de 0 m à 3000 m (Renard, 1986), et dans des écosystèmes aquatiques ou pluviaux. Dans ces différents environnements, les effets néfastes des changements climatiques exposent le riz à une multitude de stress biotiques et abiotiques qui entrainent une baisse des rendements (F. Zhang et al. 2016).
I.4.1 Contraintes biotiques
Les principales contraintes biotiques impactant la riziculture sont la pyriculariose, le flétrissement bactérien et le virus de la panachure jaune (figure 6). La pyriculariose, maladie fongique du riz est causée par un champignon ascomycète, Magnaporthe oryzae, et est la contrainte biotique qui menace le plus la production rizicole au monde (Deng et al. 2017 ;
16
Wilson et Talbot 2009). La meilleure approche pour faire face à l’impact de la pyriculariose est de connaître l'agent pathogène et les conditions favorisant son apparition afin de mettre en œuvre des pratiques culturales permettant de maintenir des rendements acceptables (Asibi et al. 2019). Environ 100 gènes/allèles et 500 QTLs associés à la résistance à la pyriculariose ont été identifiés (Ashkani et al. 2015). Parmi ces gènes, seuls 25 appelés Pi ont été clonés et caractérisés avec succès ( Li et al. 2019). Cependant, la résistance qu’ils confèrent au riz s’estompe au bout de 3 à 5 ans en raison de la grande variabilité et de la rapidité évolutive des populations du champignon (Devi et al. 2015). Afin de solutionner ce problème, les sélectionneurs s’orientent vers la création des variétés de riz renfermant plusieurs gènes de résistance à la pyriculariose (C.-J. Wu et al. 2004).
Le virus de la panachure jaune du riz, de l’anglais Rice Yellow Mottle Virus (RYMV), a été décrit pour la première fois sur le riz cultivé asiatique (O. sativa) en 1970 au Kenya (Bakker 1970) et s’est depuis propagé dans près de la moitié des pays africains (Amancho et al. 2009). Cependant, sa datation moléculaire suggère une émergence il y a environ 2 siècles en Afrique de l’Est (Pinel-Galzi et al. 2016). Le RYMV est transmis par des coléoptères adultes, principalement ceux de la famille des Chrysomelidae (Bakker 1970 ; Banwo et al. 2001 ; Kouassi et al. 2005). Pour faire face à cette maladie virale du riz, des études menées sur deux espèces de riz cultivés, Tog5681 (O. glaberrima) et Gigante (O. sativa), ont permis de mettre en évidence un gène, nommé RESISTANCE TO RICE YELLOW MOTTLE VIRUS-1 (RYMV1) présent sur le chromosome 4 (Ndjiondjop et al., 2001 ; Albar et al., 2006). Un deuxième gène de résistance au RYMV, RESISTANCE TO RICE YELLOW MOTTLE
VIRUS-2 (RYMVVIRUS-2) présent sur le chromosome 1, a été mis en évidence chez Tog7VIRUS-291 (Thiémélé et
al. 2010; Orjuela et al. 2013). Il a été suggéré que l’introgression de ces gènes de résistance
RYMV1 et RYMV2 dans des cultivars O. glaberrima par des croisements intra spécifiques
permettrait d’accroître leurs rendements (Ndjiondjop et al. 2018). Ces nouvelles lignées intra-spécifiques sont en cours d'évaluation en milieu africain par les sélectionneurs d'AfricaRice (Ndjiondjop et al. 2018).
Le flétrissement bactérien du riz, dû à la bactérie Xanthomonas oryzae pv Oryzae (Xoo), a été caractérisé pour la première fois dans la préfecture de Fukuoka au Japon en 1884 (Niño-Liu, et al. 2006). Il peut causer des pertes de rendement annuelles chez le riz allant de 10% à 50%, voire 100% dans des conditions sévères (Niño- Liu et al. 2006; Mansfield et al. 2012 ; Zhang et Wang 2013). Les dégâts les plus importants sont rencontrés dans les rizières d’Asie
17
du Sud-Est. Cependant certaines rizières d’Afrique de l’Ouest ne sont pas épargnées par les attaques de Xoo même si l’ampleur des dégâts demeure plus faible (Niño-Liu et al. 2006; Oliva et al. 2019). Les blessures sont les principaux sites d'entrée de Xoo dans la plante, lui donnant accès aux vaisseaux du xylème où il se multiplie activement avant de provoquer le flétrissement des feuilles (Köplin et al. 1992; Ray et al. 2000). Le xanthane, exopolysaccharide, est l'un des facteurs de virulence les plus importants produits en grandes quantités par Xoo (Sahu et al. 2018). Dans la plante hôte, le xanthane bloque l’écoulement de l'eau dans les vaisseaux du xylème (Denny 1995). La synthèse du xanthane est régulée par les gènes gumB à gumM situés dans un seul cluster de gènes de 12 kb qui est exprimé sous forme d'opéron à partir d'un promoteur en amont du premier gène, gumB (Katzen et al. 1998; Vojnov et al. 1998, 2001).
Une quarantaine de gènes (de type Xa) de résistance au flétrissement bactérien ont été identifiés, chez les variétés cultivées d’O. sativa et les espèces de riz sauvages, et décrits (Verdier et al. 2012; Kim et Reinke 2019). L’introgression de ces gènes dans les variétés de riz sensibles permettrait de réduire les dégâts causés par Xoo.
Figure 6 : Symptômes foliaires de pyriculariose (a), de panachure jaune (b) et de flétrissement
bactérien (c) chez le riz
I.4.2 Contraintes abiotiques
La croissance et la productivité du riz sont très affectées par des stress abiotiques tels que le froid, les fortes températures, les inondations, la salinité et la sécheresse (Zhang et al. 2016). Nous nous intéresserons aux effets de la température et de la sécheresse car ceux-ci représentent des contraintes majeures pour la riziculture en Afrique.
18
I.4.2.1 Les effets de la température
La somme des températures nécessaires au riz pour accomplir son cycle de développement varie de 3000°C pour les variétés précoces à 4400°C à 6400°C pour les variétés tardives. Les températures optimales pour la germination et la croissance du riz sont comprises entre 25 ̊ C et 30 ̊ C (Shakiba et al. 2017). Les températures au-dessous de 20°C ont un impact négatif sur la riziculture (Yoshida, 1981; Van Nguyen et Ferrero 2006), de la germination au stade reproductif, en provoquant une diminution des rendements (Andaya et Mackill 2003 ; Fujino et al. 2004 ; Ma et al. 2009 ; Koseki et al. 2010 ; Cruz et al. 2013). La montaison s’avère le stade le plus sensible aux basses températures (Satake and Hayase 1970 ; Kuroki et al. 2007 ; Saito et al. 2010). Lorsque le riz est soumis à des basses températures à ce stade, il en résulte une formation incomplète du pollen qui aboutit à la stérilité des épillets (Singh et al. 2005) et une diminution de rendements pouvant varier de 0,5 à 2,5 t / ha (Singh et al. 2005). En outre, les symptômes identifiées chez le riz soumis au froid vont de l’enroulement, le jaunissement, le rabougrissement, le flétrissement et le brunissement des feuilles, en fonction de la gravité et de la durée du froid (Virgilio C. Andaya et Tai 2007; Lou et al. 2007). Cependant, le riz recèle différents degrés de tolérance au froid. En effet, les variétés japonica sont généralement plus tolérantes au froid que les variétés indica (Glaszmann et al. 1990; Pan et al. 2015 ; Lv et al. 2016), même s’il existe aussi des variations dans les niveaux de tolérance au froid parmi les variétés japonica (Mackill 1995 ; Saito et al. 2004, 2010). Les mécanismes de protection du riz face au froid consistent en particulier à activer l'expression des gènes et des protéines modifiants la composition des membranes en lipides par l’accumulation de polypeptides hydrophobes (Cui et al. 2005 ; Morsy et al. 2010). De nombreux QTLs associés à la tolérance au froid à différents stades de développement du riz ont été identifiés (Takeuchi et al. 2001; Andaya et Mackill 2003; Andaya et Tai 2007; Koseki et al. 2010), dont plusieurs ont pu être caractérisés (Zhao et al. 2016). Parmi ces gènes,
qLTG3-1 qui code une protéine de fonction encore inconnue est associé au contrôle de la
germination (Fujino et al. 2008). En combinant la cartographie QTL et l'analyse des puces à ADN, Liu et al. (2013) ont identifié un gène, LOC_Os07g22494, étant fortement associé à la tolérance au froid chez le riz. Cependant, les mécanismes génétiques régulant la tolérance au froid demeurent peu connus (Lv et al. 2016). Le développement de cultivars de riz tolérants au froid est donc un enjeu majeur pour les chercheurs impliqués dans des programmes de la sélection rizicole (Andaya et Mackill 2003).
19
Les températures élevées (> 35°C ; Yoshida 1981) ont des effets néfastes sur la production de riz (Shi et al. 2017). Au stade de floraison, elles peuvent entraîner l'échec de la pollinisation, augmenter la stérilité mâle et provoquer une réduction significative du rendement (Jagadish et al. 2010). Au stade du remplissage des graines, les fortes températures réduisent l'approvisionnement en nutriments des feuilles vers les graines, raccourcissent la durée de remplissage des graines et par conséquent diminuent la qualité nutritionnelle des graines (J. Kim et al. 2011). Les prédictions montrent que le rythme actuel d'augmentation de la température réduirait la production de riz de 41% à la fin du 21e siècle (Khan et al. 2019). Les génotypes cultivés sous températures élevées qui maintiennent un niveau de fertilité des épillets permettant d’aboutir à des rendements satisfaisants pourraient s’avérer utiles pour l’amélioration de la tolérance aux fortes températures (Weerakoon et al. 2008).
I.4.2.2 Le stress hydrique
L'augmentation de la demande en eau due à la croissance démographique et à l'activité économique, urbanisation et l'industrialisation principalement, ont des effets importants sur la réduction mondiale des réserves en eau douce, avec les impacts les plus forts observés en Afrique (Schlosser et al. 2014). D’ici à 2050, les effets combinés de la croissance démographique (augmentation de 1 à 1,3 milliards de la population mondiale) et des changements climatiques pourraient conduire près de 1,8 milliards de personnes (dont 80% dans les pays en développement) à vivre avec des quantités d’eau ne leur permettant pas de couvrir leurs besoins , (Schlosser et al. 2014). Ainsi, la raréfaction en eau demeure la menace la plus critique pour la sécurité alimentaire (Bouman et al. 2007; Farooq et al. 2009).
Le riz est la culture la plus consommatrice d'eau (Datta et al. 2017). Il faut environ 3000 litres d'eau pour produire un kilogramme de riz en riziculture irriguée (Bouman et al. 2007). Dans ces conditions, les besoins moyens en eau d’une plante de riz pendant la durée de son cycle sont d’environ 1240 litres (Yoshida 1981). En riziculture pluviale, les besoins en eau d’une plante de riz pendant la durée de son cycle sont d’environ 450 litres pour les variétés à cycle court et 650 litres pour les variétés à cycle long. La phase qui nécessite le plus d’eau se situe entre l'épiaison et le stade grain laiteux où la plante de riz a besoin de 5 à 6 litres d’eau par jour (Jacquot et Courtois 1983).
Au regard de ces besoins importants d’eau pour la riziculture, la disponibilité de l’eau est un facteur limitant pour la production rizicole (V. Singh et al. 2017). Les mécanismes
20
d’adaptation au stress hydrique peuvent être de l’ordre de l’évitement ou de la tolérance (Levitt 1980). L’évitement consiste pour la plante à accomplir son cycle de végétation et de floraison avant la période de sécheresse. Les mécanismes de tolérance regroupent un ensemble de procédés de nature physiologique permettant à la plante de s’adapter à la réduction de la ressource en eau en maintenant, jusqu’à un certain point, une activité métabolique Les mécanismes d’adaptation à la sécheresse impliquent des réponses moléculaires ayant un impact sur la physiologie de la plante entière et intègrent des modifications de la croissance des parties aériennes, de l'architecture racinaire, de l'absorption d'eau et de la transpiration (Messina et al. 2015). Un grand nombre de mécanismes adaptatifs ont été mis en évidence chez le riz soumis à un déficit hydrique parmi lesquels: l’ajustement osmotique au niveau des racines (Hsiao et Xu 2000; O'toole 1982), l’augmentation de la pénétration des racines dans le sol (O’toole, 1982), et l’augmentation de la densité racinaire en profondeur (O'toole 1982; Gowda et al. 2011).
a) Gènes et voies de signalisation induite en réponse au stress hydrique
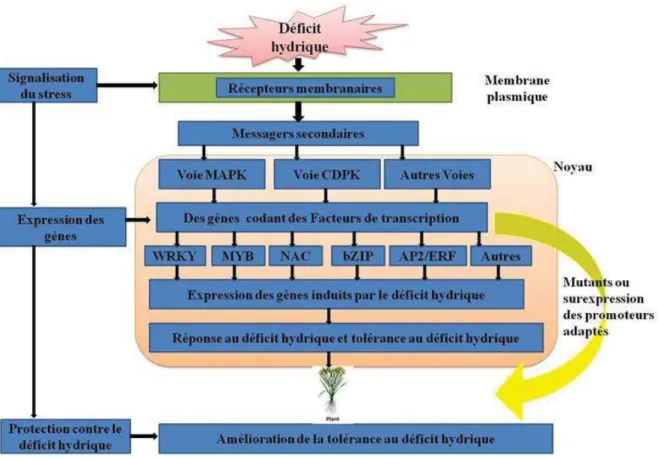
Le riz en condition de déficit hydrique active la voie de signalisation dépendante de l’acide abscissique (ABA ; Maruyama et al. 2012). La concentration en ABA augmente considérablement en réponse au déficit hydrique (Kumar 2019). L’augmentation de la quantité d'ABA induit la fermeture des stomates et l'accumulation de métabolites et des protéines de stress (Kwak 2003; P. Wang et Song 2008). La perception des signaux de déficit hydrique est transmise de la membrane plasmique vers le noyau (Sanders et al. 1999; Ramanjulu et Bartels 2002) grâce à des récepteurs kinase (RLK) et des Mitogen Activated Protein Kinases (MAPK) capables d’induire la phosphorylation d’autres protéines (Das et Pandey 2010 ; Seybold et al. 2014). De nombreux facteurs de transcription (FTs) régulant cette signalisation en condition de déficit hydrique ont été identifiés chez le riz (figure 7). Ces FTs se lient aux éléments cis-régulateurs des gènes codant pour des protéines appartenant aux familles bZIP, AP2/ERF, MYB, NAC, WRKY, NF-Y, CAMTA, et bHLH (Licausi et al. 2013 ; Castilhos et al. 2014). L'analyse moléculaire des promoteurs de gènes de réponse de la voie dépendante de l’ABA a conduit à l'identification du motif ABRE qui a pour séquence principale ACGTGG/T (Marcotte et al. 1989). Ce motif peut notamment être reconnue par les FTs bZIP (Hobo et al. 1999). La surexpression de certains de ces FTs permet d’induire une tolérance au déficit hydrique. Par exemple, la surexpression du gène ONAC022, du riz,
21
améliore la tolérance au déficit hydrique grâce à la voie dépendante de l’ABA (Hong et al. 2016).
Dans la voie indépendante de l'ABA, les facteurs de transcription DEHYDRATION RESPONSIVE ELEMENT BINDING PROTEIN (DREB) du riz tels que DREB, DREB1/CBF et DREB2 jouent un rôle clé dans la tolérance au déficit hydrique (Srivasta et al. 2010 ; Nakashima et al. 2014). Des protéines LATE EMBRYONIC ABUNDANT (LEA), qui sont impliquées dans la tolérance au déficit hydrique, peuvent s'accumuler dans les tissus végétatifs en condition de stress hydrique ainsi que dans les graines au cours de leur déshydratation (Goyal et al. 2005). Par exemple, la surexpression des gènes OsEM1 et
OsLEA3-1 qui codent pour des protéines LEA induit la tolérance au déficit hydrique chez le
riz en améliorant l’intégrité des organes (Xiao et al. 2007; Yu et al. 2016).
L'auxine, une phytohormone particulièrement importante pour le développement racinaire (Ren et al. 2016), joue également un rôle dans la tolérance au déficit hydrique du riz (Kim et al. 2020). En effet, la surexpression des gènes OsPIN3t (Q. Zhang et al. 2012),
OsGH3.2 (Du et al. 2012) et OsGH3.13 (S.-W. Zhang et al. 2009) et du gène auxin/IAA OsIAA6 (Ljung 2013) qui cible le récepteur auxinique TIR1, induit une meilleure tolérance au
déficit hydrique (Kim et al. 2020). De plus, la surexpression du facteur de réponse à l'éthylène (JERF1) augmente la teneur en proline, diminue les pertes en eau, augmente la synthèse d’ABA et régule l’expression des gènes de synthèse de l’ABA, et améliore ainsi la tolérance au déficit hydrique du riz (Z. Zhang et al. 2010).
22
Figure 7 : Gènes et voies de signalisation impliqués dans la tolérance au déficit hydrique chez le
riz, adapté de Kumar (2019)
b) Mécanismes physiologiques d’adaptation au stress hydrique
En présence d’une faible humidité du sol, le riz développe des mécanismes d’adaptation (figure 8) que sont : les mécanismes d’esquive, les mécanismes d’évitement, et les mécanismes de tolérance, à travers des changements morpho physiologiques (Levitt 1980 ; Kumar et al. 2017; Panda et al. 2021; Fukai et Cooper 1995).
Mécanismes d’esquive
Le mécanisme d’esquive au déficit hydrique est défini comme la capacité d'une plante à terminer son cycle de développement avant la survenance du déficit hydrique. Il comprend essentiellement deux mécanismes, le développement phénologique rapide et la plasticité de développement (Kumar et al. 2017). Le développement phénologique rapide permet aux plantes, dans des conditions d’approvisionnement en eau limitée, de produire des fleurs puis des graines avec un minimum de croissance végétative (Kumar et al. 2017). La plasticité de
23
développement quant à elle permet aux plantes, pendant une période de pluies abondantes, d’avoir une bonne croissance végétative et de produire abondamment des fleurs puis des graines (Kumar et al. 2017).
Mécanismes d’évitement
Le mécanisme d’évitement du déficit hydrique est défini comme la capacité d’une plante à maintenir le potentiel hydrique de ses tissus relativement élevé en dépit d'une faible humidité du sol. Les génotypes de riz qui évitent le déficit hydrique ont généralement des racines profondes et épaisses avec une grande capacité de ramification et de pénétration dans le sol, un rapport racines/partie aériennes élevé, une élasticité à l’enroulement des feuilles, une fermeture stomatique précoce et une résistance cuticulaire élevée (Blum et al. 1989; H. Wang, Inukai, et Yamauchi 2006).
La fermeture des stomates réduit la perte en eau des feuilles et diminue les échanges gazeux entre la plante et l'atmosphère, ce qui impacte le taux de photosynthèse et finalement réduit le rendement de la culture mais permet la survie des plantes en condition de déficit hydrique à court terme (Price et al. 2002). La régulation de la conductance stomatique au cours du stress hydrique résulte de signaux provenant du système racinaire qui restent encore peu compris (Medrano et al. 2002).
L'enroulement des feuilles réduit la perte d'eau là où la fermeture stomatique est incomplète et réduit la charge thermique sur la feuille en réduisant la surface exposée (Yeo et al. 1997). Il existe des interdépendances complexes entre la transpiration, l'assimilation et la température des feuilles, de sorte que l’enroulement des feuilles a une importance adaptative. D'un point de vue agronomique, l’enroulement des feuilles est généralement considéré comme une indication de la sensibilité au déficit hydrique du riz (Yeo et al. 1997).
La cuticule est organisée en une couche continue de lipides hydrophobes qui recouvre les organes aériens des plantes en formant une barrière protectrice contre l’environnement extérieur (Zhou et al. 2013). Elle est synthétisée par les cellules épidermiques et est composée de cutine et de cires (Zhou et al. 2013).Les cires cuticulaires constituent la structure primaire de la cuticule et permet aux plantes de limiter les pertes d’eau non stomatique (Riederer et Schreiber 2001). Chez le riz soumis à un déficit hydrique, il y a surexpression du gène OsGL1-6 qui est impliqué dans la biosynthèse de la cire cuticulaire (au niveau des feuilles) dont l’accumulation induit la tolérance au déficit hydrique (Zhou et al. 2013).
24
Dans les racines, une réduction marquée du diamètre des racines coronaires, conduisant à des racines relativement plus fines pour économiser les ressources hydriques a été observé lors d’un déficit hydrique (A. Henry et al. 2012). De plus, la formation de racines latérales augmente, ce qui augmente leur surface d'absorption d'eau ( Kim et al. 2020). La diminution du risque de cavitation des vaisseaux du xylème sous déficit hydrique est attribuée à la diminution du diamètre ou du nombre de ces vaisseaux (A. Henry et al. 2012). Le diamètre des cellules du sclérenchyme augmente alors que leur subérisation et la formation de cellules de l’aérenchyme diminuent (A. Henry et al. 2012).
Mécanismes de tolérance
Le mécanisme de tolérance au déficit hydrique est la capacité des plantes à survivre malgré une faible teneur en eau dans leurs tissus (Fleury et al. 2010). Génétiquement, la tolérance au déficit hydrique du riz est un trait complexe et polygéniques, impliquant des mécanismes morpho-physiologiques (Jenks, Hasegawa, et Jain 2007) tels que le maintien de la turgescence par ajustement osmotique, l'élasticité accrue des cellules, la diminution de la taille des cellules et la conservation de l’intégrité des structures protoplasmiques (Sullivan et Ross 1979).
25
Les relations plante – eau conduisent à l'établissement d'un continuum sol-plante-atmosphère (Steudle 2001). La circulation de l’eau s’effectuant du potentiel hydrique le plus élevé au potentiel hydrique le plus faible. Le potentiel hydrique de la plante (Y) peut être décomposé en potentiel osmotique (Ys), potentiel de turgescence (Yp) et potentiel matriciel : la force que la plante doit exercer pour puiser l'eau dans le sol (Ym). Ces éléments sont reliés par :
- Y= - Ys - Ym ± Yp
Le potentiel matriciel est souvent confondu avec le potentiel osmotique dans le cas de la plante. La plante doit maintenir un certain niveau de turgescence pour assurer son activité métabolique. Les cellules restent turgescentes en induisant l'accumulation de solutés (Bais et al. 2003). Les substances osmorégulatrices peuvent être soit des ions inorganiques, tels que K+ et Na+, soit un composé organique qui ajuste le potentiel osmotique cytoplasmique,
comme la bétaïne et la proline (Sade et al. 2009).
Le déficit hydrique entraîne des altérations des fonctions métaboliques, dont l'une des plus importantes est la réduction ou l’arrêt de la synthèse des pigments photosynthétiques (parmi lesquels la chlorophylle), ce qui réduit la production de la biomasse et le rendement (Sahebi et al. 2018). Les chlorophylles a et b, que l'on trouve généralement dans les plantes supérieures, sont sensibles au déficit hydrique, la réduction de leur teneur entraîne une augmentation de la peroxydation lipidique et des radicaux libres, et la dégradation de la membrane chloroplastique (Sahebi et al. 2018).Les caroténoïdes et les anthocyanes sont des pigments qui aident le riz à tolérer le déficit hydrique. Le système antioxydant joue un rôle clé pour la réponse fonctionnelle du riz au déficit hydrique (Wang et al. 2019). Parmi les antioxydants il y a des molécules tels que l’acide ascorbique, le glutathion, les tocophérols ; des enzymes régénérant des formes réduites d'antioxydants et les enzymes interagissant avec les dérivés réactifs de l’oxygène telles que la superoxyde dismutase, les peroxydases et les catalases (Blokhina, Virolainen, et Fagerstedt 2003) ; des caroténoïdes ont diverses fonctions dans l’interception de la lumière, la structure du photosystème chloroplastique et la photo protection (Sahebi et al. 2018) en piégeant l'oxygène singulet et les radicaux peroxy-lipidiques, ainsi qu'en inhibant la peroxydation lipidique et en générant des super oxydes (Deltoro et al. 1998) ; des anthocyanes grâce à leur noyau aromatique agissent comme
26
stabilisateur de membrane pendant les épisodes de déficit hydrique (Farooq et al. 2010); des composés phénoliques (en plus des tocophérols) tels que les flavonoïdes, les tanins et les précurseurs de la lignine qui agissent souvent comme des composés piégeurs de dérivés réactifs de l’oxygène (Blokhina, Virolainen, et Fagerstedt 2003) ; le couple ascorbate-glutathion situé dans les chloroplastes et fournissant à la plante une photo-protection en piégeant le peroxyde d'hydrogène (Noctor et Foyer 1998).
I.5 Stratégies d’amélioration de la tolérance au déficit hydrique
Les racines assurent le transport de l’eau du sol vers la plante (Kavar et al. 2008). Ce sont donc les premiers organes exposés au déficit hydrique et elles représentent donc une cible potentielle pour l’amélioration de la tolérance au stress hydrique (Koevoets et al. 2016).
I.5.1 Les traits racinaires bénéfiques pour la tolérance au déficit hydrique
Le système racinaire d'une plante est son principal site de perception de la sécheresse (Yang et al. 2004; Ghosh et Xu 2014). Les propriétés physiques du sol ont un impact sur la capacité de stockage d'eau disponible pour la plante et surtout sur les caractéristiques d'enracinement des plantes. Les cultivars de riz adaptés aux zones humides développent généralement plus de racines dans les couches superficielles du sol alors que les cultivars adaptés aux zones sèches développent généralement plus de racines en profondeur (A H Price et al. 2002; Yadav et al. 1997; Sharp 2002). Les systèmes racinaires avec une forte densité de longueur des racines en profondeur sont souvent considérés comme plus aptes à acquérir l’eau en profondeur et procurer une meilleure adaptation au déficit hydrique (Vadez 2014).
La capacité des racines à réagir aux changements d'humidité du sol serait importante pour la tolérance au déficit hydrique (Ingram et al. 1994). (International Workshop: Dynamics of Roots and Nitrogen in Cropping Systems of the Semi-Arid Tropics et al. 1996) ont indiqué que la plasticité phénotypique de la morphologie du système racinaire est un trait clé de la tolérance au stress des cultures. La plasticité racinaire ou la capacité des plantes à modifier leurs phénotypes racinaires pour s’adapter aux conditions environnementales fluctuantes (Figure 9 ; International Workshop: Dynamics of Roots and Nitrogen in Cropping Systems of the Semi-Arid Tropics et al. 1996; Jonathan M. Niones et al. 2012) est une caractéristique intéressante chez le riz. En effet, la plasticité de certains caractères racinaires du riz permet
27
d’améliorer ses performances en conditions de stress (Sandhu et al. 2016). Par exemple, L’élongation et la forte ramification des racines latérales du riz en condition de déficit hydrique améliorent son absorption d'eau, sa photosynthèse et sa biomasse aérienne (Kano-Nakata et al. 2011; Tran et al. 2015; Suralta et al. 2010; Kano et al. 2011; Kano-(Kano-Nakata et al. 2013). Lorsque le riz est soumis à un déficit hydrique transitoire (Niones et al. 2012), l’augmentation des aérenchymes racinaires induit le maintien de la biomasse sèche des parties aériennes et du rendement en grains (Niones et al. 2013).
Figure 9 : La croissance et la prolifération des racines de différents génotypes de riz (Nip, sl 13, sl 34, sl 45, sl 50) dans des pots sous deux conditions d’humidité du sol, 100% d’humidité de sol et 15% d’humidité du sol (déficit hydrique), 38 jours après le semis (D’après Farooq et al. 2009).
I.5.2 Identification de QTL contrôlant la tolérance au déficit hydrique
La plupart des programmes de recherche sur la tolérance des plantes au déficit hydrique ont conduit à l'identification de loci contrôlant des caractères quantitatifs (QTLs) associés à une meilleure efficacité d’utilisation de l’eau et/ou à une meilleure osmoprotection (Fukai et