HAL Id: tel-01587723
https://tel.archives-ouvertes.fr/tel-01587723
Submitted on 14 Sep 2017
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Rôle de l’altération de la perméabilité vasculaire
endoneurale dans la genèse des douleurs neuropathiques
périphériques post-traumatiques : Implications des voies
de signalisation TLR4, Sonic Hedgehog et
Wnt/ß-caténine
Nathan Moreau
To cite this version:
Nathan Moreau. Rôle de l’altération de la perméabilité vasculaire endoneurale dans la genèse des douleurs neuropathiques périphériques post-traumatiques : Implications des voies de signalisation TLR4, Sonic Hedgehog et Wnt/ß-caténine. Neurosciences [q-bio.NC]. Université Pierre et Marie Curie - Paris VI, 2017. Français. �NNT : 2017PA066039�. �tel-01587723�
Université Pierre et Marie Curie
Ecole doctorale Cerveau – Cognition – Comportement
Centre de Psychiatrie et Neurosciences - INSERM UMR 894 Equipe « Douleur, Neuroinflammation et Stress »
Rôle de l’altération de la perméabilité vasculaire
endoneurale dans la genèse des douleurs neuropathiques
périphériques post-traumatiques
Implications des voies de signalisation TLR4, Sonic Hedgehog et Wnt/β-caténine
Par Nathan MOREAU
Thèse de doctorat de Neurosciences
Dirigée par le Pr Yves BOUCHER
Présentée et soutenue publiquement le 1er mars 2017Devant un jury composé de :
DALLEL Radhouane PU-PH (Clermont-Ferrand) Examinateur
BOUCHER Yves PU-PH (Paris) Directeur de thèse
POISBEAU Pierrick PU (Strasbourg) Rapporteur
LANDRY Marc PU (Bordeaux) Rapporteur
BOUHASSIRA Didier DR1 (Boulogne) Examinateur
POHL Michel DR1 (Paris) Examinateur
MELIK PARSADANIANTZ Stéphane DR1 (Paris) Examinateur
« L’étude de la douleur rend la médecine humaine en tous ses gestes. »
Pr René LERICHE, 1944
Chirurgien français
Remerciements
Je tiens à remercier chaleureusement Pr Radhouane DALLEL, Pr Marc LANDRY, Pr Pierrick POISBEAU, Dr Annabelle REAUX-LE GOAZIGO, Dr Didier BOUHASSIRA et Dr Stéphane MELIK PARSADANIANTZ de me faire l’honneur de leur présence dans mon jury de thèse. Leurs contributions respectives dans le domaine de la neurobiologie et de la physiopathologie de la douleur ont été essentielles à la mise en place et la réalisation de ce travail de recherche.
Je tiens également à remercier tout particulièrement mes directeurs d’équipe, Dr Michel POHL et Dr Luis VILLANUEVA pour leur gentillesse, leur encadrement, leur disponibilité et nos échanges très enrichissants pendant ces 4 années passées ensemble.
Au Pr Yves BOUCHER, mon directeur de thèse, toujours présent et à l’écoute, avec qui j’ai tant apprécié travailler, discuter et échanger sur ce travail et sur la médecine de la douleur. Je suis extremement honoré d’avoir pu faire ma thèse dans de si bonnes conditions, sous la direction de quelqu’un qui restera pour moi le modèle prototypique d’un grand professeur. A ma Candice, pour son amour et son soutien constant durant cette thèse.
A Philippe ZIZZARI et Annie MAUBORGNE, les piliers du CPN, sans qui rien n’aurait été possible dans ce centre de recherche. Veuillez trouver ici le témoignage de ma grande reconnaissance pour votre dévouement et votre implication exemplaires.
Aux irréductibles du CPN, Alexandra, Rachel, Julia, Marie, Thomas et tous les autres. A ma famille et son soutien sans faille. A Vincent qui me manque.
A mes amis et leur patience angélique vis à vis de mes absences.
A mes maitres, Pr Jean-Baptiste CHARRIER, Dr Benjamin SALMON, Dr Anne-Laure EJEIL, Dr Loredana RADOI, Dr Charles-Daniel ARRETO et Dr Claude Bernard WIERZBA pour tout ce qu’ils m’ont appris et tout ce qu’ils continuent à m’apprendre.
Résumé
Les douleurs neuropathiques sont un ensemble complexe et hétérogène de douleurs pathologiques, résultant d’une lésion ou d’une pathologie du système nerveux central ou périphérique. Parmi elles, les douleurs neuropathiques périphériques post-traumatiques résultant d’un traumatisme accidentel ou iatrogène sont de diagnostic et de traitement souvent très difficiles.
A la suite d’une lésion nerveuse périphérique, de multiples altérations cellulaires et moléculaires se produisent au sein du parenchyme nerveux, participant à la régénération physiologique du nerf, mais induisant dans certains cas le développement d’une cicatrisation dysfonctionnelle pouvant se traduire sur le plan phénotypique par l’apparition d’une douleur neuropathique chronique.
La régulation de la perméabilité micro-vasculaire au sein de l’endonèvre du nerf lésé joue un rôle essentiel dans ces phénomènes de cicatrisation nerveuse physiologique et pathologique, via notamment l’infiltration locale de cellules immunitaires réparatrices.
L’objectif de ce travail était d’étudier le rôle spécifique de l’altération de la barrière hémato-nerveuse au niveau du site lésé dans le développement des douleurs neuropathiques périphériques post-traumatiques.
Nous avons montré à l’aide de modèles de constriction chronique du nerf sciatique et/ou du nerf infra-orbitaire complétés par des cultures cellulaires de cellules endothéliales (hCMEC/D3), que la disruption précoce de la barrière hémato-nerveuse est un évènement clé de la neuropathie, favorisant l’infiltration de substances algogènes et d’immunocytes dans le parenchyme nerveux, induisant une neuroinflammation locale, une sensibilisation des fibres nerveuses afférentes primaires et le développement d’une douleur neuropathique périphérique. Parmi les mécanismes régulateurs de l’homéostasie de cette barrière, l’altération des voies de signalisation morphogénétiques Sonic Hedgehog et Wnt/β-caténine, mais également de la voie de l’immunité innée TLR4, au niveau des cellules endothéliales endoneurales, favorise la disruption de cette barrière en diminuant la synthèse des protéines
de jonctions serrées (occludine, claudines), molécules clés de l’intégrité de la barrière hémato-nerveuse.
De plus, l‘implication différentielle de ces voies de signalisation dans des modèles de neurite et de neuropathie apporte un éclairage nouveau à la transition phénotypique entre neurite et neuropathie.
Cette implication différentielle permet de proposer un profil moléculaire neuropathique, témoignant de la présence d’altérations moléculaires irréversibles au sein du parenchyme nerveux lésé. Ainsi, alors que la neurite s’accompagne d’une perméabilité vasculaire endoneurale réversible, la neuropathie pourrait être considérée comme une pathologie de la perméabilité vasculaire chronique irréversible.
Mots-clés : douleur neuropathique ; barrière hémato-nerveuse ; Sonic Hedgehog ; TLR4 ; Wnt/β-caténine
Abstract
Neuropathic pain defines a complex and heterogenous group of chronic painful disorders secondary to a lesion or disease of the central or peripheral nervous system. Among them, painful post-traumatic peripheral neuropathies resulting from accidental or iatrogenic nerve trauma are often very difficult to diagnose and treat.
Following peripheral nerve injury, multiple cellular and molecular alterations occur within the nerve’s parenchyma, participating in physiological healing of the nerve, but can also lead to the development of dysfunctional nerve healing, translating as chronic neuropathic pain. The regulation of endoneurial microvascular permeability within the injured nerve plays a pivotal rôle in physiological and pathological nerve healing, notably via the local infiltration of pro-regenerative immunocytes.
The main goal of this work was to study the specific role of local blood-nerve barrier disruption in the development of painful post-traumatic peripheral neuropathy.
In sciatic nerve and/or infra-orbital nerve chronic constriction injury models and in vitro endothelial cell cultures (hCMEC/D3), we showed that early disruption of the blood-nerve barrier is a key event in the development of neuropathy, allowing local infiltration of algogenic substances and immunocytes within the nerve’s parenchyma, responsible for local neuroinflammation, peripheral sensitization of primary afferent fibers and peripheral neuropathic pain development.
Among the homeostatic regulatory mecanisms of this barrier, the alteration of morphogenetic signaling pathways Sonic Hedgehog and Wnt/β-catenin, but also innate imunity receptor TLR4 pathway, in endoneurial endothelial cells, mediate the disruption of the blood-nerve barrier by downregulating key tight-junction proteins (occludin, claudins).
Furthermore, the differential implication of these signaling pathways in models of neuritis and neuropathy shed light on the phenotypical transition between neuritis and neuropathy. Such differential implication allowed us to propose a new neuropathic molecular profile, illustrative
of the irreversible molecular alterations that occur within the injured nerve’s parenchyma. Therefore, as neuritis is associated with reversible endoneurial vascular permeability, neuropathy could be considered a disease of irreversible chronic vascular permeability. Key-words : neuropathic pain ; blood-nerve barrier ; Sonic Hedgehog ; TLR4 ; Wnt/β-catenin
Publications et Communications
Publications
Endoneurial endothelial crosstalk between Wnt/β-catenin and Sonic Hedgehog pathways underlies the early disruption of the infra-orbital blood-nerve barrier following chronic constriction injury.
MOREAU N., MAUBORGNE A., COURAUD P.-O., WEKSLER B., ROMERO I.A., VILLANUEVA L., POHL M., BOUCHER Y.
Molecular Pain, 2016 [soumis]
Neuroinflammation in dental primary afferents as a risk factor for painful post-traumatic trigeminal neuropathy (PPTTN) : a retrospective study.
DIEB W., MOREAU N., CHEMLA I., DESCROIX V., BOUCHER Y. Rev Sto Chir Maxillo-Fac, 2016 [soumis]
Hedgehog pathway-mediated vascular alterations following trigeminal nerve injury. MOREAU N., MAUBORGNE A., VILLANUEVA L., POHL M., BOUCHER Y.
Journal of Dental Research, 2016 Nov 16. doi: 10.1177/0022034516679395 [Epub ahead of print] Early alterations of Hedgehog signaling pathway in vascular endothelial cells after peripheral nerve injury elicit blood-nerve barrier disruption, nerve inflammation and neuropathic pain development.
MOREAU N., MAUBORGNE A., BOURGOIN S., COURAUD P.O., ROMERO I.A., WEKSLER B.B., VILLANUEVA L., POHL M., BOUCHER Y.
Pain, 2016;157(4):827-39.
Communications affichées
Endoneurial endothelial crosstalk between Wnt/β-catenin and Sonic Hedgehog pathways underlies the early disruption of the infra-orbital blood-nerve barrier following chronic constriction injury.
MOREAU N., MAUBORGNE A., VILLANUEVA L., POHL M., BOUCHER Y.
6th international congress on neuropathic pain - NeuPSIG2017, 15/06/2017 au 18/06/2017, Göteborg, Suède [résumé soumis]
Neuroinflammation périphérique et altérations de la barrière hémato-nerveuse après traumatisme de nerfs périphériques – Implications des voies morphogénétiques SHH et Wnt/β-caténine dans la genèse des neuropathies périphériques
MOREAU N., DIEB W., MAUBORGNE A., BOUCHER Y.
2ère Journée Recherche de Garancière, 21/10/2016, UFR d’Odontologie, Université Paris Diderot
Neuroinflammation périphérique et altérations de la barrière hémato-nerveuse après traumatisme de nerfs périphériques – Rôles de la signalisation SHH dans le développement des neuropathies périphériques
MOREAU N., MAUBORGNE A., POHL M., BOUCHER Y.
Saliency of blood-nerve barrier disruption in peripheral neuroinflamation and painful neuropathies
MOREAU N., MAUBORGNE A., POHL M., BOUCHER Y.
9ème congrès de l’European Pain Federation (EFIC), 03/09/2015, Vienne, Autriche
Saliency of blood-nerve barrier disruption in peripheral neuroinflammation and painful neuropathies
MOREAU N., MAUBORGNE A., POHL M., BOUCHER Y.
Journée scientifique de l’école doctorale « Cerveau, Cognition, Comportement », 12/03/2015, Université Pierre et Marie Curie
Communications orales
Neuroinflammation périphérique et altérations de la barrière hémato-nerveuse après traumatisme de nerfs périphériques – Implications des voies morphogénétiques SHH et Wnt/β-caténine dans la genèse des neuropathies périphériques
Communication orale associée au poster, 2ère Journée Recherche de Garancière, 21/10/2016, UFR
d’Odontologie, Université Paris Diderot
Saliency of blood-nerve barrier disruption in peripheral neuroinflammation and painful neuropathies: Implications of the Hedgehog signalling pathway
Journée scientifique de l’école doctorale « Cerveau, Cognition, Comportement », 05/04/2016, Université Pierre et Marie Curie
Neuroinflammation périphérique et altérations de la barrière hémato-nerveuse après traumatisme de nerfs périphériques – Rôles de la signalisation SHH dans le développement des neuropathies périphériques
Communication orale associée au poster, 1ère Journée Recherche de Garancière, 09/10/2015, UFR
d’Odontologie, Université Paris Diderot
Saliency of blood-nerve barrier disruption in peripheral neuroinflammation and painful neuropathies : implications of the Hedgehog signalling pathway
European Pain Federation Krakow Pain School, 06/07/2015, Cracovie, Pologne
Altération de la barrière hémato-nerveuse : Support de la neuroinflammation périphérique et des neuropathies douloureuses ?
Sommaire
Avant-propos 12
Introduction 13
1. Définition des douleurs neuropathiques 14 2. Etiologies et épidémiologie des douleurs neuropathiques 15 3. Impact individuel et socio-économique des douleurs neuropathiques 16 4. Sémiologie générale des douleurs neuropathiques 17 5. Approches expérimentales et modélisation des douleurs neuropathiques 23 6. Spécificités des douleurs neuropathiques post-traumatiques 26
I – Physiopathologie des douleurs neuropathiques périphériques post-traumatiques 28
I-1 Physiologie de la nociception périphérique 29
I-1-1 Structure et ultrastructure du nerf périphérique 29
I-1-2 Vascularisation du nerf périphérique et rôles de la barrière hémato-nerveuse 34
I-1-3 Organisation fonctionnelle vasculo-nerveuse : les unités neuro-vasculaires 40
I-1-4 Transmission nociceptive physiologique 41 I-2 Altérations nerveuses post-traumatiques 46
I-2-1 Altérations tissulaires et cellulaires post-traumatiques 46
I-2-2 Cicatrisation nerveuse physiologique et pathologique : de la neurite à la neuropathie 54 I-3 Nociception pathologique et douleurs neuropathiques 60
I-3-1 Phénomènes de sensibilisation périphérique et centrale 60
I-3-2 Rôle de la neuroinflammation locale dans la sensibilisation périphérique 69
II – Etude de l’impact de l’altération de la perméabilité vasculaire endoneurale
dans les phénomènes de sensibilisation périphérique des neurones nociceptifs primaires 72
II-1 Contexte scientifique : Altérations de la barrière hémato-nerveuse et neuroinflammation
Périphérique 73
II-2 Objectifs de recherche 78 II-3 Matériels et méthodes 79
II-3-1 Animaux 79
II-3-2 Chirurgie 79
II-3-3 Evaluation de la perméabilité de la BHN 87
II-3-4 Comportement : évaluation de la sensibilité mécanique à l’aide de filaments de von Frey 89
II-3-5 Cultures cellulaires 90
II-3-6 Extraction d’ARN et RT-PCR semi-quantitative 91
II-3-7 Extraction protéique et quantification par ELISA 92
II-3-8 Immunohistochimie 93
II-3-9 Données et analyses statistiques 94
II-4 Résultats 95
II-4-1 Mise en évidence de l’altération de la barrière hémato-nerveuse dans deux
modèles de neuropathies spinale et trigéminale 95
II-4-2 Développement de la neuroinflammation locale dans deux modèles de neuropathies
spinale et trigéminale 100
II-4-3 Exploration des déterminants de la perméabilité vasculaire endoneurale post-traumatique 103 II-4-4 Différences et similitudes des nociceptions spinale et trigéminale 142
II-4-5 Implication des voies TLR, SHH et Wnt/β-caténine dans l’apparition du phénotype
douloureux neuropathique 147
II-5 Discussion 163
II-5-1 Altérations de la perméabilité vasculaire endoneurale et développement des
neuropathies périphériques 163
II-5-2 Morphogènes et douleurs pathologiques 174
III – Perspectives en recherche translationnelle : hypothèse du priming inflammatoire
dans le développement des douleurs neuropathiques trigéminales post-traumatiques 181
III-1 Contexte clinique : Les Douleurs Neuropathiques Trigéminales Post-Traumatiques iatrogènes 182 III-2 L’hypothèse du « priming inflammatoire » dans la genèse des DNTPT 183
III-2-1 Observations cliniques sur 56 cas de DNTPT 183
III-2-2 Rationnel biologique : rôle de l’inflammation orale médiée par le LPS bactérien et
activation de la voie TLR4 189
III-3 Approche expérimentale : Etude de la stimulation préemptive TLR4 dans un modèle de
neurite et un modèle de neuropathie trigéminales 191 III-4 Premiers résultats 191
III-4-1 Altérations moléculaires différentielles dans les modèles IoN-SNS et IoN-CCI après
prétraitement par LPS 191
III-4-2 Exploration d’un potentiel « profil moléculaire neuropathique » 201 III-5 Implications cliniques 204
III-5-1 Rôle promoteur de l’inflammation dans le développement des neuropathies
post-traumatiques iatrogènes ? 204
III-5-2 Altérations constitutives de la voie Wnt/β-caténine ou de la voie Sonic Hedgehog et
risque de développement de neuropathies périphériques 205
Limites 207
Conclusion 209
Table des illustrations 211
Liste des abréviations 216
Références bibliographiques 220
Avant-propos
« Mal nommer les choses, c’est ajouter au malheur du monde. »
Albert Camus La nomenclature scientifique répond à des impératifs de rigueur et de transparence, nécessaires à la bonne diffusion et compréhension du savoir scientifique.
Afin d’en faciliter sa compréhension, ce travail a été rédigé selon les nomenclatures suivantes :
• Règles générales de nomenclature :
Sauf exception, ce travail a tenté de répondre au style édicté par le National Center for
Biotechnology Information (https://www.ncbi.nlm.nih.gov/books/NBK995/)
• Nomenclature des gènes et protéines :
Chaque gène ou protéine étudié dans ce travail a été nommé selon la nomenclature internationale de la NCBI Gene database (https://www.ncbi.nlm.nih.gov/gene). En
accord avec les conventions internationales en vigueur, la typographie suivante a été respectée (pour les sigles uniquement, les versions complètes restant en minuscules) :
o Modèles humains : gène PROTÉINE o Modèles murins : Gène PROTÉINE
• Sémantique de la description du phénotype douloureux chez l’animal :
Bien qu’il semble évident que les animaux (et notamment les rats) puissent présenter des comportements aversifs traduisant la perception d’un stimulus nociceptif, la notion même de douleur, au sens d’une expérience multidimensionnelle complexe (incluant des composantes affectives, émotionnelles, motivationnelles, etc…), est difficile à envisager stricto sensu chez l’animal (Vierck et al., 2008).
Par soucis de simplification, les termes « hyperalgésie », « allodynie » ou « douleur neuropathique » seront utilisés pour décrire le comportement animal observé (le cas échéant), selon leurs définitions respectives en médecine humaine, bien qu’il soit difficile d’appréhender rigoureusement ce type de sémiologie douloureuse chez l’animal.
Introduction
Les douleurs neuropathiques définissent un ensemble complexe et hétérogène de douleurs pathologiques, le plus souvent chroniques, de diagnostic et traitement souvent extrêmement difficiles.
Comme de nombreuses autres formes de douleurs chroniques, elles impactent sévèrement la qualité de vie des patients et entraînent de lourdes conséquences sanitaires et économiques pour la société (Breivik et al., 2006 ; Smith et al., 2013).
Du fait de l’errance diagnostique importante associée à ses pathologies et de stratégies thérapeutiques souvent peu efficaces (Costigan et al., 2009a ; Xu et al., 2012), ces douleurs peuvent être considérées comme un véritable fléau de santé publique (Xu et al., 2012 ; Smith et al., 2013).
L’amélioration de la compréhension et de la prise en charge de ces pathologies douloureuses très hétérogènes représente donc un enjeu majeur sur le plan sociétal, économique et scientifique.
1. Définition des douleurs neuropathiques
L’association internationale pour l’étude de la douleur (International Association for the
Study of Pain, IASP) définit la douleur neuropathique comme « une douleur provoquée par une lésion ou pathologie du système nerveux somato-sensoriel » (IASP, 2012).
Historiquement, la première définition de la douleur neuropathique a été introduite officiellement en 1994 par l’IASP, en remplacement de l’ancien terme de « douleur de désafférentation », la définissant comme « une douleur initiée ou causée par une lésion
primaire ou un dysfonctionnement du système nerveux ». En 2008, un groupe de travail initié
par le Special Interest Group in Neuropathic pain de l’IASP (NeuPSIG) soulignait la nécessité de distinguer la douleur neuropathique de la douleur nociceptive survenant indirectement lors de pathologies neurologiques ou de pathologies douloureuses avec des changements neuroplastiques secondaires survenant au sein du système nociceptif. Il proposa ainsi une nouvelle définition en supprimant le terme « dysfonctionnement » : « une douleur
survenant en conséquence directe d’une lésion ou maladie affectant le système somato-sensoriel ». Une version très légèrement modifiée de cette définition fut ensuite proposée par
le comité de taxonomie de l’IASP puis validée : « une douleur causée par une lésion ou
pathologie du système nerveux somato-sensoriel ».
L’omission du terme « dysfonctionnement » permettait ainsi d’exclure les pathologies impliquant des changements mal définis du système nerveux et des pathologies sans altération reconnue du système nerveux somato-sensoriel, de la définition des douleurs neuropathiques. La restriction de la définition des douleurs neuropathiques au système nerveux somato-sensoriel est importante car certains types de douleurs telles que des douleurs musculo-squelettiques consécutives à des pathologies du système nerveux moteur (ex : les douleurs de spasticité) ne doivent pas être confondues avec des douleurs neuropathiques.
Enfin, le terme « primaire » a été omis de la dernière définition du fait de la difficulté de distinguer précisément des causes primaires et secondaires de douleurs neuropathiques ; néanmoins cette omission suggère que des pathologies douloureuses nociceptives, qui sur le long terme peuvent générer des lésions du système nerveux somato-sensoriel, pourraient être finalement considérées comme en partie neuropathiques (Finnerup et al., 2016).
L’évolution de la définition « officielle » de la douleur neuropathique témoigne de la difficulté à établir précisément une entité nosologique pour un ensemble de pathologies d’étiologies et de mécanismes physiopathologiques variés.
2. Etiologies et épidémiologie des douleurs neuropathiques
Les douleurs neuropathiques peuvent avoir des étiologies distinctes et la notion de « douleur neuropathique » renvoie à une description clinique d’un tableau douloureux et non à un diagnostic (IASP, 2012).
La diversité étiologique des douleurs neuropathiques (Figure i-1) illustre les difficultés majeures rencontrées dans le diagnostic et le traitement de ces douleurs, en particulier pour les praticiens non spécialistes.
Figure i-1. Pathologies associées aux douleurs neuropathiques (d’après Stillman M, 2006).
Les douleurs neuropathiques peuvent ainsi avoir des origines (Bouhassira et Attal, 2007) : -‐ traumatiques (section nerveuse, compression d’origine iatrogène, traumatisme
médullaire…),
-‐ compressives (« piégeage » ou pincement d’un nerf dans un défilé anatomique, conflit vasculo-nerveux…),
-‐ toxiques (neuropathie post-chimiothérapie…), -‐ métaboliques (neuropathie diabétique),
-‐ infectieuses (névralgie post-herpétique…),
-‐ ischémique (Accident Vasculaire Cérébral [AVC] cortical ou sous cortical).
Historiquement, compte-tenu d’une définition relativement vague et de l’absence de critères diagnostiques simples, valides et reconnus, il était très difficile de réaliser des études épidémiologiques en population générale pour établir une prévalence globale des pathologies douloureuses neuropathiques. Cependant, l’amélioration récente de la définition des douleurs neuropathiques et le développement de tests diagnostiques simples (Douleur Neuropathique en 4 questions [DN4], Neuropathic Pain Symptom Inventory [NPSI], PainDETECT …) ont facilité la mise en place d’études épidémiologiques sur la douleur neuropathique (Bouhassira et Attal, 2007). Certaines études anciennes suggéraient que la douleur neuropathique affecterait 2 à 3 % de la population générale (Hall et al., 2006 ; Bouhassira et al., 2008) mais des études plus récentes suggèrent que la prévalence de douleurs présentant des caractéristiques neuropathiques se situe plutôt entre 7 et 10% de la population générale (Van Hecke et al., 2014).
3. Impact individuel et socio-économique des douleurs neuropathiques
Les douleurs neuropathiques chroniques ont un impact majeur sur la qualité de vie, tant sur le plan des relations familiales et sociales que des relations professionnelles (absentéisme professionnel), comme en témoignent diverses enquêtes épidémiologiques en population générale (Oster et al., 2005), en médecine générale ou dans des centres spécialisés (Galvez et al., 2007 ; Bouhassira et Attal, 2007).
Cet impact, corrélé à l’intensité douloureuse, peut être comparé à celui du cancer ou des pathologies cardiovasculaires sévères (Meyer-Rosberg et al., 2001).
De plus, il est souvent plus élevé que celui de patients présentant la même lésion nerveuse mais non douloureuse. Par exemple, chez les blessés médullaires, la douleur peut impacter
davantage la qualité de vie des patients que le déficit neurologique associé (Westgren et Levi, 1998).
L’impact individuel de la douleur neuropathique est également notable sur le plan psychologique et/ou psychiatrique. Ainsi, les patients douloureux neuropathiques présentent souvent des symptômes dépressifs, anxieux et des troubles du sommeil. Le retentissement émotionnel de ces douleurs est d’autant plus important que les patients estiment recevoir un bénéfice insuffisant de leurs traitements, souvent acquis au prix d’effets indésirables conséquents, responsables de leur arrêt dans plus de deux tiers des cas (Meyer-Rosberg et al., 2001). De plus, l’absence de reconnaissance précoce de ces douleurs peut contribuer à alourdir l’impact émotionnel négatif de ces dernières (Davies et al., 1994).
Au niveau professionnel, il est intéressant de noter que les patients présentant des douleurs ayant des caractéristiques neuropathiques sont plus souvent en arrêt de travail que ceux qui ont des douleurs non-neuropathiques (Torrance et al., 2006). Jusqu’à un patient sur deux peut ainsi voir son activité professionnelle affectée par la douleur neuropathique (McDermott et al., 2006 ; Tolle et al., 2006).
Sur le plan économique, ces douleurs neuropathiques peuvent générer des coûts directs et indirects importants pour la société, comme en témoigne une étude évaluant 602 patients douloureux neuropathiques (d’étiologies variées) consultant en médecine générale, qui montrait que 76% des patients avaient consulté un médecin au moins une fois au cours du mois écoulé et que 20% des patients avaient consulté 4 fois ou plus (McDermott et al., 2006). D’après une autre étude basée sur les données de compagnies d’assurance américaines de 55 686 patients douloureux neuropathiques, le coût annuel de prise en charge de ces patients représentait 3 fois celui de patients témoins, non neuropathiques (Berger et al., 2004).
4. Sémiologie générale et méthodologie diagnostique des douleurs neuropathiques
Suite à la nouvelle définition des douleurs neuropathiques, le NeuroPSIG proposa une démarche diagnostique permettant d’évaluer le degré de certitude avec lequel une origine neuropathique peut être évoquée pour un tableau douloureux donné (Finnerup et al., 2016).
Trois niveaux de certitude, stratifiés selon la présence d’arguments anamnestiques, cliniques et para-cliniques en faveur d’une douleur neuropathique, ont ainsi été proposés :
-‐ douleur neuropathique possible, -‐ douleur neuropathique probable, -‐ douleur neuropathique certaine. Cette démarche est résumée dans la Figure i-2.
Douleur neuropathique possible :
En premier lieu, l’interrogatoire du patient pourra suggérer que la cause de la douleur puisse être liée à une lésion ou une pathologie neurologique et à aucune autre cause, telle que l’inflammation ou un dommage tissulaire non-neuronal. Il sera important d’évaluer les descripteurs de la douleur, la présence d’anomalies sensitives non douloureuses ainsi que la présence de facteurs aggravants/calmants de la douleur.
Des descripteurs tels que « brûlure », « chaleur », « choc électrique », « élancement », « piqûre » ; une douleur au tact léger ou au froid ainsi que des sensations non douloureuses telles que des fourmillements ou un engourdissement suggèrent (de façon non pathognomonique) une origine neuropathique.
La combinaison de plusieurs descripteurs « neuropathiques » a une haute valeur discriminative et peut être explorée via des questionnaires tels que le Leeds Assessment of
Neuropathic Symptoms and Signs (LANSS), le Neuropathic Pain Questionnaire (NPQ), le
questionnaire Douleur Neuropathique en 4 questions (DN4), le questionnaire painDETECT ou le questionnaire ID-Pain.
Figure i-2. Démarche diagnostique face à une douleur potentiellement neuropathique (d’après Finnerup et al., 2016).
En outre, deux critères sont essentiels pour pouvoir évoquer une douleur neuropathique « possible » :
1) Présence d’un antécédent de lésion ou de maladie neurologique significative :
Il doit y avoir une suspicion clinique d’une lésion nerveuse somato-sensorielle comme par exemple une poussée de zona ou une lésion nerveuse post-traumatique. Le délai d’apparition est variable selon les pathologies impliquées, mais une corrélation étroite entre l’apparition de la douleur et la lésion est fortement évocatrice de neuropathie. En revanche, pour certaines pathologies telles que l’AVC ou la neuropathie diabétique, plusieurs mois voire plusieurs années peuvent s’écouler entre la lésion initiale et l’apparition de la douleur neuropathique.
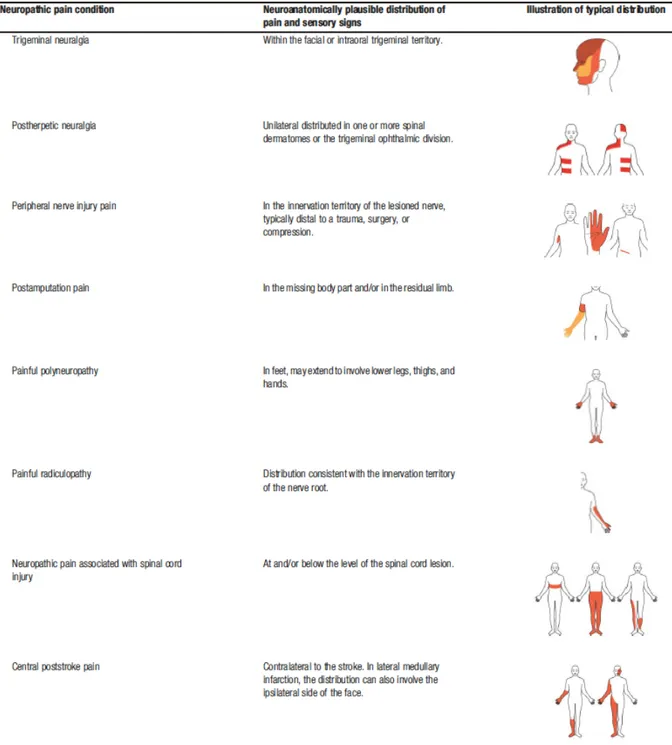
2) La distribution de la douleur est neuro-anatomiquement plausible :
La distribution douloureuse doit être anatomiquement cohérente avec la localisation de la lésion nerveuse somato-sensorielle suspectée. Cela peut être assez difficile à évaluer à l’échelle du patient individuel car la douleur peut n’occuper qu’une petite partie du territoire d’innervation d’un nerf périphérique ou d’une zone de représentation somatotopique du corps dans le système nerveux central, voire à l’inverse s’étendre au delà de telles limites. Dans tous les cas, la topographie douloureuse devra être cohérente avec la topographie lésionnelle suspectée dans les grands tableaux douloureux neuropathiques.
La distribution neuro-anatomique habituelle des grands tableaux douloureux neuropathiques est illustrée dans la Figure i-3 :
Figure i-3. Distribution neuro-anatomique usuelle des signes et symptômes observés dans les pathologies douloureuses neuropathiques les plus fréquentes (d’après Finnerup et al., 2016).
Douleur neuropathique probable :
Le niveau suivant de certitude repose sur des arguments issus de l’examen clinique, qui devra idéalement objectiver la présence de signes sensitifs négatifs, c’est à dire la perte partielle ou totale d’une ou plusieurs modalités sensitives concordant avec la lésion ou pathologie du système nerveux somato-sensoriel suspectée (ex : toucher léger, froid…). La démonstration de la perte d’une ou plusieurs modalités sensitives et la topographie précise de cette perte sont les éléments clés pour déterminer l’origine de cette altération sensitive. Bien que des pertes de
modalités sensitives puissent être observées dans des douleurs nociceptives, elles ne sont pas limitées sur le plan topographique au territoire de la zone lésée (contrairement aux douleurs neuropathiques).
Cette évaluation clinique s’appuiera sur différents tests et « outils » diagnostiques (Figure i-4).
Figure i-4. Techniques d’évaluation clinique des différentes modalités sensitives (d’après Finnerup et al.,
2016).
Il est important de noter que des signes sensitifs positifs (tels que l’hyperalgésie à la pression) sont moins prégnants dans l’évaluation de la probabilité d’une douleur neuropathique, surtout si leur distribution ne respecte pas le territoire de la zone lésée. En effet, de tels signes peuvent être observés dans le cas de douleurs inflammatoires, de douleurs inexpliquées, d’anxiété ou d’insomnies et peuvent être affectés par le stress et les émotions négatives. De plus, certaines pathologies neuropathiques ne requièrent pas nécessairement une perte sensitive comme critère diagnostique. C’est notamment le cas des canalopathies héréditaires ou de certaines lésions nerveuses. Par exemple, la névralgie trigéminale peut être considérée comme une douleur neuropathique particulière, en ceci que des déficits sensitifs sont rarement observés à l’examen clinique (sauf via des tests sensoriels quantitatifs [QST]). En revanche, le déclenchement stéréotypé de crises douloureuses consécutives à la stimulation d’une zone gâchette est très évocateur du diagnostic. Enfin, dans le cas des canalopathies qui se présentent sous la forme d’accès douloureux paroxystiques, l’examen clinique peut être normal entre les crises. Ainsi des antécédents de symptômes caractéristiques pourront remplacer les signes sensitifs positifs dans l’élaboration du diagnostic de telles pathologies neuropathiques.
Dans la majorité des cas, des changements sensitifs au toucher léger, à la vibration, à la piqûre, au froid ou au chaud pourront être objectivés à l’examen clinique, mais des analyses plus poussées de type QST pourront s’avérer nécessaires. Evidemment, dans les cas de
douleurs profondes somatiques ou viscérales, une telle évaluation clinique est particulièrement délicate.
Douleur neuropathique certaine :
Le dernier niveau de certitude requiert un test diagnostique objectif pour confirmer la lésion ou la pathologie du système nerveux somato-sensoriel. Ceci n’est pas forcément possible en environnement non spécialisé.
Ces tests diagnostiques incluent :
-‐ la Tomodensitométrie (TDM), l’Imagerie par Résonnance Magnétique (IRM) ou d’autres techniques d’imageries pour confirmer la présence d’un AVC, d’une Sclérose en Plaques (SEP), d’une lésion de la moelle épinière ou une lésion nerveuse ;
-‐ une biopsie cutanée pourra révéler une diminution de la densité intra-épidermique en fibres nerveuses ;
-‐ des explorations neurophysiologiques pourront également être envisagées telles que des tests de conduction nerveuse, l’étude de la composante R1 du réflexe de clignement ou la microneurographie ;
-‐ des tests génétiques pourront confirmer la possibilité d’une douleur neuropathique héréditaire.
De tels examens ne seront pas nécessaires face à une douleur post-amputation ou une lésion nerveuse objectivée en peropératoire par le chirurgien, dans la mesure où la lésion nerveuse est certaine dans ce contexte clinique particulier.
L’objectivation d’une lésion du système somato-sensoriel n’établit cependant pas formellement un lien de causalité avec la douleur neuropathique ressentie, d’autres étiologies douloureuses pouvant coexister ou se surajouter au tableau clinique.
A ce stade, il est important de se rappeler que la douleur peut toujours être causée par une pathologie nociceptive non neurologique et qu’il persiste donc toujours une incertitude quant à l’origine d’un tableau douloureux, même fortement évocateur de neuropathie (Finnerup et al., 2016).
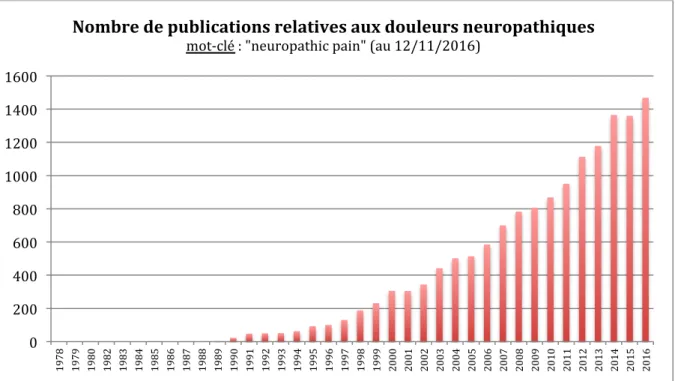
5. Approches expérimentales et modélisation des douleurs neuropathiques Pendant longtemps, la survenue de symptômes douloureux dans un territoire rendu « anesthésié » par une lésion nerveuse périphérique ou dans un membre disparu (douleur « fantôme » des amputés) était considérée hautement paradoxale. Cependant, les schémas physiopathologiques ont beaucoup évolué dès la fin des années 1980, principalement grâce au développement de modèles animaux de lésions nerveuses, mimant une « symptomatologie » rappelant celle observée en clinique chez les patients neuropathiques (Bouhassira et Attal, 2007), ce qui s’est traduit par un engouement majeur pour la recherche fondamentale et clinique comme en témoignent les données bibliométriques de la base de données MEDLINE, résumée dans le tableau i-1, ci-après :
Tableau i-1. Données bibliométriques sur le nombre de publications relatives aux douleurs neuropathiques
(base de donnée MEDLINE).
Ces modèles animaux ont permis de révéler la multiplicité et la complexité des modifications périphériques et centrales impliquées dans les douleurs neuropathiques et d’en faciliter la compréhension à l’échelle cellulaire et moléculaire. Ainsi, la complexité des douleurs neuropathiques a pu être mise en évidence, une lésion donnée pouvant entrainer plusieurs mécanismes physiopathologiques différents et un même mécanisme physiopathologique pouvant être associé à des lésions diverses. Ces données expérimentales et cliniques tendent à confirmer la nature « trans-étiologique » des douleurs neuropathiques (Bouhassira et Attal, 2007). 0 200 400 600 800 1000 1200 1400 1600 1978 1979 1980 1982 1983 1984 1985 1986 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015 2016
Nombre de publications relatives aux douleurs neuropathiques
A ce jour, il existe plusieurs dizaines de modèles animaux de douleurs neuropathiques, principalement des modèles de neuropathies périphériques, séparables schématiquement en deux grandes catégories :
-‐ les modèles « étiopathogéniques » qui reproduisent une lésion (ex : traumatisme nerveux périphérique) ou un mécanisme lésionnel (ex : métabolique ou toxique), tels que les modèles de section nerveuse (abandonnés aujourd’hui car induisant des autotomies chez l’animal et générant un comportement douloureux très éloigné de celui observable chez l’homme) ou les modèles métaboliques (ex : neuropathie diabétique) ou toxiques (ex : neuropathie chimio-induite) ;
-‐ les modèles « symptomatiques » qui visent à reproduire une symptomatologie proche de celle observée en clinique, tels que la constriction chronique du nerf sciatique, la transection partielle du nerf sciatique ou la ligature des nerfs spinaux.
Les principaux modèles animaux de douleurs neuropathiques périphériques et centrales sont présentés dans le tableau i-2 :
Modèles animaux de « douleurs neuropathiques » (d’après Bouhassira et Attal, 2007)
Lésions périphériques Lésions centrales
Neuropathie traumatique
• Section nerveuse et névrome expérimental (Wall et al., 1979)
• Section des racines dorsales (Lombard et al., 1979) • Ecrasement du nerf sciatique (Kerns et al., 1991) • Cryoneurolyse du nerf sciatique (DeLeo et al., 1994) • Constriction chronique du nerf sciatique (Bennett et Xie,
1988)
• Transection partielle du nerf sciatique (Seltzer et al., 1990)
• Ligature des nerfs spinaux (Kim et al., 1992)
• Constriction chronique du nerf infra-orbitaire (Vos et al., 1994)
• Résection des nerfs caudaux (Na et al., 1994) • Enserrement du nerf sciatique (Mosconi et Kruger,
1996)
• Dénervation partielle (Decorsted et Woolf, 2000) • Lésion partielle du nerf saphène (Walzack et al., 2005)
Neuropathie métabolique
• Diabète induit par la stretptozotocine (Wuarin-Bierman et al., 1987)
• Lésion médullaire « photochimique » (Xu et al., 1992) • Lésion médullaire par injection de cytokines (Yezierski
Neuropathie toxique
• Traitement par la vincristine (Aley et al., 1996) • Traitement par le taxol (Authier et al., 2000) • Traitement par le cisplatine (Authier et al., 2000) • Traitement par l’oxaliplatine (Ling et al., 2006)
Neuropathie inflammatoire
• Névrite du nerf sciatique (Eliav et al., 1999)
Tableau i-2. Principaux modèles animaux de « douleurs neuropathiques » (d’après Bouhassira et Attal, 2007). Malgré le nombre conséquent de modèles animaux développés ces 30 dernières années et leur utilisation importante en recherche fondamentale et préclinique, ces modèles présentent des limitations qu’il convient de souligner.
La principale limite de ces modèles est leur faible prédictibilité clinique, en particulier en termes d’effets de nouveaux agents pharmacologiques. Ainsi de nombreuses molécules (antidépresseurs, antiépileptiques, etc…) ayant un effet anti-nociceptif prononcé chez l’animal peuvent ne présenter qu’un effet modeste chez l’homme, remettant en question la pertinence clinique de ces modèles (Bouhassira et Attal, 2007).
De plus, la plupart des modèles animaux de douleurs neuropathiques périphériques impliquent une lésion nerveuse partielle, se manifestant par une hypersensibilité aux stimuli nociceptifs et non nociceptifs dans le territoire non lésé avoisinant. Cependant, ces modèles ne distinguent pas les mécanismes cellulaires et moléculaires spécifiquement impliqués dans la genèse de la douleur neuropathique des conséquences plus générales de la lésion nerveuse, incluant les phénomènes de régénération nerveuse, le stress cellulaire ainsi que les altérations des voies métaboliques cellulaires et des voies de survie cellulaire qui en résultent (Costigan et al, 2009b).
Enfin, la définition de « douleur » impliquant plusieurs composantes (sensori-discriminative, affective, motivationnelle, etc…), il est souvent impossible d’évaluer stricto sensu de telles composantes et donc impropre de parler d’évaluation de la « douleur » chez l’animal. Il s’agit donc plutôt d’évaluer des réactions aversives à un stimulus nociceptif, qui ne sont que des marqueurs indirects de « douleur » chez l’animal (Vierck et al., 2008).
Néanmoins, malgré ces limitations et en l’absence d’alternatives fiables et envisageables (sur le plan technique, financier et surtout éthique), ces modèles restent une approche expérimentale intéressante pour l’étude des mécanismes physiopathologiques des différents types de douleurs, en particulier des douleurs neuropathiques.
6. Spécificités des douleurs neuropathiques post-traumatiques
Les douleurs neuropathiques post-traumatiques représentent une part importante de l’ensemble des douleurs neuropathiques. Parmi elles, les douleurs neuropathiques périphériques post-traumatiques d’origine iatrogène sont les plus fréquentes.
Globalement, les lésions nerveuses périphériques sont rencontrées dans 3 à 8 % de la population mondiale (Hughes, 2002) et les lésions nerveuses post-chirurgicales sont fréquemment observées pour les nerfs suivants (Bouhassira et Attal, 2007) :
-‐ nerf thoracique (après thoracotomie), -‐ nerf intercostobrachial (après mastectomie),
-‐ nerf crural (après pose de prothèse totale de hanche ou chirurgie abdominale), -‐ nerf médian ou de ses branches (après chirurgie d’un syndrome canalaire), -‐ nerf saphène (après stripping de varices),
-‐ nerf alvéolaire inférieur ou nerf lingual (après avulsion de dents de sagesse), -‐ nerf infra-orbitaire (après chirurgie sinusienne).
Sur le plan mécanistique, la douleur neuropathique périphérique post-traumatique serait le reflet de l’excitabilité aberrante des neurones de la corne dorsale médullaire provenant de modifications moléculaires et cellulaires dans la corne dorsale après lésion nerveuse périphérique (Costigan et al., 2009a). Les douleurs spontanées et provoquées consécutives à une lésion nerveuse résulteraient ainsi de l’hyperexcitabilité de neurones sensitifs primaires ou secondaires générée notamment par des neurotrophines ou des cytokines pro-inflammatoires libérées par des cellules pro-inflammatoires activées, dont la microglie (activée au niveau de la corne dorsale médullaire) et les macrophages envahissant le site lésionnel et les ganglions de racines dorsales des zones de projections des neurones primaires lésés (Hu et al., 2007). Ce rôle majeur de l’inflammation dans la genèse de la douleur neuropathique périphérique post-lésionnelle est confirmé sur le plan expérimental par la diminution voire l’abolition de la douleur après des interventions pharmacologiques visant à bloquer soit diverses cytokines ou protéines du complément, soit l’activation microgliale consécutive à la lésion nerveuse (Hu et al., 2007).
D’autres altérations se surajoutent à la physiopathologie complexe de ces neuropathies douloureuses telles que d’autres interactions neuro-immunes, la genèse de potentiels d’actions
ectopiques ainsi que la facilitation et désinhibition de la transmission synaptique (Costigan et al., 2009a).
Les mécanismes physiopathologiques à l’origine des douleurs neuropathiques périphériques post-traumatiques seront détaillés dans la première partie de ce travail, avec une attention particulière pour les altérations nerveuses post-traumatiques au niveau cellulaire et moléculaire ainsi qu’aux perturbations de la nociception périphérique qui en résultent.
Première partie :
Physiopathologie des douleurs neuropathiques
périphériques post-traumatiques
I – Physiopathologie des douleurs neuropathiques périphériques
post-traumatiques
I-1 Physiologie de la nociception périphérique
I-1-1 Structure et ultrastructure du nerf périphérique
Les nerfs périphériques sont responsables de la transmission nerveuse afférente du système nerveux périphérique (SNP) vers le système nerveux central (SNC) ainsi que de la transmission nerveuse efférente du SNC vers le SNP, essentielle à la mise en place de fonctions effectrices telles que la locomotion.
Cette transmission nerveuse se fait sous la forme d’impulsions électriques générées et dirigées par un processus séquentiel de dépolarisation axonale puis de repolarisation, un processus dépendant de flux calciques et potassiques au niveau de la membrane neuronale. Ce processus est crucial pour le fonctionnement physiologique humain ; de fait, le gradient ionique au sein des nerfs périphériques doit être étroitement régulé pour prévenir des variations de concentrations locales en sodium ou potassium qui altèreraient la transmission nerveuse. De la même façon, les solutés et les macromolécules pouvant influencer l’équilibre ionique au niveau des nerfs périphériques doivent également être étroitement régulés (Ubogu, 2013). Sur le plan histologique, les nerfs périphériques sont composés de fibres nerveuses et d’un ensemble de populations cellulaires responsables du maintien de l’homéostasie ionique et immunitaire, incluant : cellules endothéliales, fibroblastes, cellules de Schwann, cellules satellites, cellules dendritiques, macrophages résidents et mastocytes (Sapienza et al., 2014). Les macrophages résidents et les mastocytes pourraient agir comme les premiers acteurs de la réponse à une lésion de l’endonèvre (la zone la plus centrale du nerf) et participer à la réaction immunitaire innée en réponse à des pathogènes exogènes. Des lymphocytes T peuvent être également exceptionnellement observés dans des nerfs sains, jouant probablement un rôle dans la surveillance immunitaire (Ubogu, 2013).
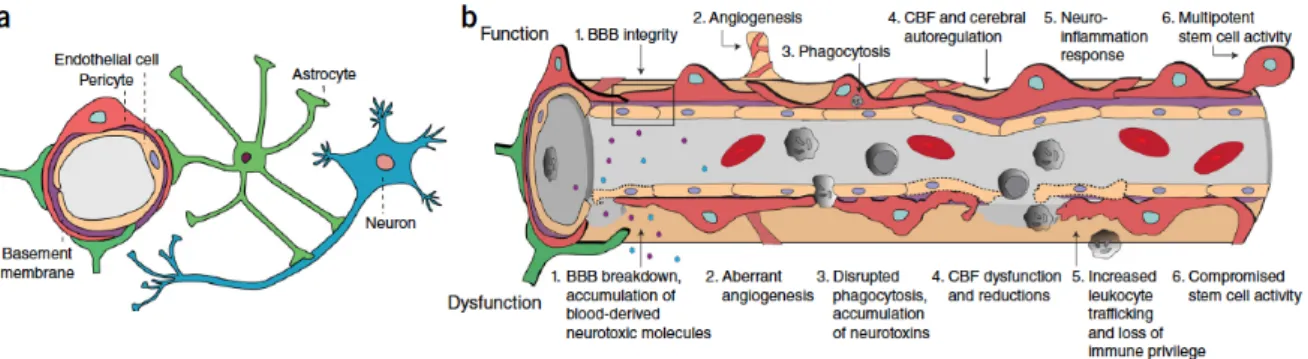
Au niveau anatomique, les nerfs périphériques sont composés de 3 couches conjonctives concentriques (de la périphérie vers le centre) : l’épinèvre, le périnèvre et l’endonèvre (Figure I-1). La structure de ces couches est intimement liée à leur fonction de barrière, protégeant les structures nerveuses conductrices (Peltonen et al., 2013).
Figure I-1. Structure du nerf périphérique. Vue schématique (gauche) et en microscopie confocale à
fluorescence (droite) des 3 couches couches du nerf : l’épinèvre (epineurium), le périnèvre (perineurium) et l’endonèvre (endoneurium). BV = Blood Vessel (d’après Peltonen et al., 2013 [gauche] et Ubogu, 2013 [droite]).
L’épinèvre (epineurium) est composé principalement d’une matrice extracellulaire (MEC) collagénique qui entoure la totalité du nerf et ses différents fascicules. Il contribue à la résistance à la traction du nerf mais ne forme pas directement de barrière (Peltonen et al., 2013).
Le périnèvre (perineurium) isole des groupes d’unités « axone-cellule de Schwann » pour former des fascicules nerveux constituant ainsi la barrière principale entre l’endonèvre et les tissus extra-fasciculaires (épineuraux). Le périnèvre est composé de couches concentriques de cellules périneurales (d’origine fibroblastique) larges et plates (Figure I-1 gauche). Le nombre de couches cellulaires périneurales varie selon le nombre et la taille des fascicules du nerf ; les fascicules les plus larges, retrouvés dans le nerf sciatique, pouvant compter jusqu’à 15 couches. L’épaisseur du périnèvre diminue vers la périphérie du nerf où les plus petits fascicules peuvent ne comporter qu’une ou deux couches périneurales. Des petites poches de MEC sont également présentes entre les différentes cellules périneurales (Peltonen et al., 2013). Cette MEC est composée de différents collagènes fibrillaires et micro-fibrillaires ainsi que de fibronectine qui procurent au périnèvre sa capacité à moduler les forces de traction
externes permettant ainsi la régulation de la pression endoneurale et la protection du nerf contre de telles forces, nocives pour le nerf (Pina-Oviedo et Ortiz-Hidalgo, 2008).
Les cellules périneurales peuvent produire un nombre important de molécules composant la MEC. Chaque couche de cellules périneurales est entourée d’une membrane basale importante qui dans les plus gros nerfs peut atteindre 500 nm d’épaisseur et qui agit comme une barrière moléculaire supplémentaire. Les cellules périneurales sont connectées les unes aux autres via des jonctions serrées, formant une véritable barrière périneurale. Cette barrière de diffusion, métaboliquement active, permet le maintien de l’homéostasie de l’endonèvre, dont le maintien d’une pression intra-fasciculaire constante. La barrière périneurale présente 3 composants structurels et fonctionnels (Peltonen et al., 2013) :
1) une membrane basale entourant chaque couche de cellules périneurales,
2) des jonctions serrées entre les cellules périneurales avoisinantes composées d’occludine, de Zonula-Occludens-1 (ZO-1), de claudine-1 et claudine-3 (avec également la possibilité de dimères de claudines : claudine 1/1, claudine 1/3 ou claudine 3/3) (Figure I-1 gauche),
3) un transport trans-cellulaire actif à travers les cellules périneurales (seul le GLUT-1 a été localisé pour le moment au niveau du périnèvre humain et de rat).
Des études de perméabilité et d’électrophysiologie ont montré que cette barrière périneurale est une barrière serrée mais sélective. Elle sert à protéger le nerf et restreint notamment la diffusion des analgésiques au niveau du nerf périphérique. Elle joue également un rôle important dans la réparation nerveuse post-traumatique. Ainsi, à la suite d’une lésion nerveuse compressive, une ouverture de la barrière périneurale se produit induisant une perturbation de l’homéostasie nerveuse (Peltonen et al., 2013). Dans le modèle expérimental de « fenêtre périneurale », l’excision localisée du périnèvre induit une démyélinisation focale des fibres nerveuses au centre des fascicules. A une semaine, des signes de régénération peuvent être observés avec réapparition d’une couche périneurale fine et de jonctions serrées (Sugimoto et al., 2002). Dans un modèle de lésion nerveuse périphérique, après ligature du nerf sciatique pendant 24 heures, l’expression périneurale de claudine-1 était récupérée en 2 jours. Les jonctions gap réapparaissaient plus tardivement à 5 jours et la régénération nerveuse était complète à 7 jours (Hirakawa et al., 2003).
L’endonèvre contient des groupes d’unités « axone-cellule de Schwann » enchâssées dans une MEC composée de fines fibrilles de collagènes, ayant une consistance de gel. Les axones de chaque unité sont recouverts de cellules de Schwann qui forment la gaine myélinisée ou
amyélinique. Les membranes cellulaires des cellules de Schwann myélinisantes s’enroulent autour de l’axone formant ainsi une structure multi-lamellaire (Figure I-2). Figure I-2. Structure de l’endonèvre. Vue
schématique représentant les fibres nerveuses myélinisées (MF) et non myélinisées (UMF) entourées de fibroblastes endoneuraux (F) et de micro-vaisseaux endoneuraux (V), le tout protégé par la barrière périneurale (Peri) (d’après Mizisin et Weerasuriya, 2011).
La gaine de myéline ainsi formée est divisée en compartiments de myéline compacte et non-compacte. La myéline non-compacte est présente uniquement en 3 endroits :
1) à proximité des nœuds de Ranvier (région para-nodale),
2) dans les incisures de Schmidt-Lanterman localisées à l’intérieur de la gaine de myéline compacte,
3) dans les mésaxones (zones d’accolement de deux parties de la même membrane plasmique d’une cellule de Schwann qui s’invagine puis s’enroule autour d’un axone) internes et externes, là où il existe le plus grand espacement entre les 2 parties de la même membrane plasmique (Figure I-3).
Figure I-3. Formation des mésaxones lors de la myélinisation des axones par les cellules de Schwann. Vue schématique représentant une cellule de Schwann s’enroulant autour d’un axone pour former la gaine de myéline (schéma obtenu à l’adresse : http://www.db-gersite.com/HISTOLOGIE/HISTGENE/histgen1/histgen7/h istgen7.htm)
Cette division de la myéline en zones compactes et non-compactes est matérialisée par la présence de jonctions autotypiques entre les membranes de la même cellule de Schwann. La fonction exacte de ces jonctions autotypiques est encore inconnue, mais il a été suggéré qu’elles séparent la membrane externe et le compartiment extracellulaire de la zone de
myéline compacte, mais également qu’elles lieraient les membranes entre elles pour renforcer leur résistance mécanique (Peltonen et al., 2013). De plus, ces jonctions contenant des claudines, elles pourraient avoir un effet sur la conduction nerveuse, tel que suggéré par les résultats de modèles murins KO pour la Claudine-19 (Miyamoto et al., 2005).
Ces jonctions autotypiques incluent des jonctions adhérentes, serrées et gap, mais il semblerait que la composition de ces dernières diffère de leurs équivalents épithéliaux. La composition des jonctions autotypiques des cellules de Schwann a surtout été étudiée chez les rongeurs qui expriment Claudine-1, 2, 5, 19 et ZO-1, 2 dans les cellules de Schwann. La Claudine-19 est très exprimée dans les nerfs périphériques de souris, localisée aux incisures de Schmidt-Lanterman, à la région paranodale et aux mésaxones internes et externes. La Tricelluline a également été montrée chez la souris dans les mêmes localisations. En revanche, ni la claudine-19 ni la tricelluline n’ont été étudiées chez l’humain (Peltonen et al., 2003).
En revanche, les claudines-1, 2 et la ZO-1, de même que l’E-cadhérine ont été retrouvées dans la région paranodale chez l’homme. Les incisures de Schmidt-Lanterman sont composées quant à elles de claudine-1, 2, 3, 5, ZO-1, occludine et E-cadhérine. Les mêmes composants (claudine 1, 2, 3, ZO-1, occludine et E-cadhérine) ont été retrouvés dans les mésaxones à l’exception de la claudine-5 (Figure I-4).
Figure I-4. Composition des jonctions autotypiques des cellules de Schwann. Vue schématique représentant la
localisation des jonctions autotypiques (points rouges) et les protéines de jonction qui les composent (* chez les rongeurs) (d’après Peltonen et al., 2013)
De façon étonnante, des mutations humaines des gènes codant pour les claudines 1, 14, 16 ou
19 ont été décrites mais aucune ne s’accompagne d’une symptomatologie au niveau des nerfs
périphériques. De plus, la mutation de la claudine-19 humaine n’altère pas le système nerveux périphérique, malgré sa grande expression dans les jonctions autotypiques des cellules de Schwann chez la souris (son expression n’ayant pas été étudiée chez l’homme dans cette localisation pour le moment) (Peltonen, et al. 2013).
I-1-2 Vascularisation du nerf périphérique et rôle de la barrière hémato-nerveuse
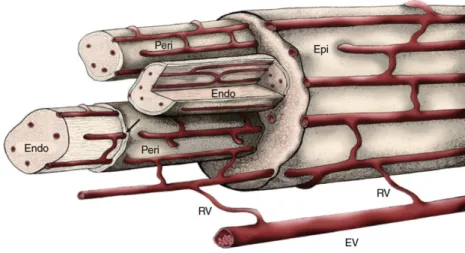
Les nerfs périphériques ayant une organisation structurelle en plusieurs couches (épinèvre, périnèvre et endonèvre), ils présentent un réseau vasculaire anastomotique irriguant ces différentes couches (Figure I-5). Le réseau vasculaire des nerfs périphériques provient de branches radiaires d’artères avoisinantes, formant le « vasa nervorum » qui parcoure le nerf dans le sens longitudinal au sein de l’épinèvre. Ces vaisseaux génèrent des ramifications qui traversent plus profondément le nerf au niveau de l’épinèvre, formant des petites artères et artérioles, jusqu’aux artérioles pré-capillaires qui parcourent la surface externe du périnèvre. Ces vaisseaux produisent alors des branches qui pénètrent les couches concentriques du périnèvre pour entrer dans l’endonèvre, formant des capillaires. Ces capillaires se drainent au sein de veinules post-capillaires plus larges au sein de l’endonèvre, puis de veinules émergeant à travers le périnèvre. Les veinules et les petites veines parcourent l’épinèvre longitudinalement, se rejoignant pour former des veines plus importantes, drainant le nerf périphérique dans des veines avoisinantes via des branches radiaires.
Figure I-5. Vascularisation du nerf périphérique. Vue schématique de la vascularisation (artèrielle) des
Sur le plan ultrastructural, le réseau vasculaire des nerfs périphériques est composé de multiples jonctions serrées denses aux électrons entre les cellules endothéliales de l’endonèvre, avec de petites vésicules intracellulaires de pinocytose de 50-100 nm de diamètre. Ces cellules endothéliales ne sont pas fenêtrées, à l’inverse des cellules endothéliales épineurales et périneurales contenant de nombreuses fenestrations et n’ayant pas de jonctions serrées. Ces cellules endothéliales microvasculaires endoneurales peuvent donc être considérées comme des cellules endothéliales microvasculaires spécialisées (dont les caractéristiques moléculaires sont résumées dans le tableau I-1), formant une véritable barrière hémato-nerveuse (à l’instar de la barrière hémato-encéphalique ou de la barrière hémato-testiculaire par exemple).
Cellules endothéliales endoneurales humaines (d’après Ubogu, 2013)
Marqueurs vasculaires endothéliaux UEA1, FvW
Ligands/récepteurs de facteurs de croissance
VEGF, GFRα1 (mais pas son ligand le GDNF)
Protéines de jonctions serrées et adhérentes claudines 1, 2, 5, 12, 19
occludine, ZO-1, 2
JAM-A, VE-cadhérine et β-caténine
Transporteurs Transporteurs ioniques :
phosphatase alcaline
Transporteurs de nutriments :
GLUT-1, MCT-1, CRT, LAT-1
Transporteurs de xénobiotiques :
P-gp, MRP1, OATP-C, OAT-3
Molécules d’adhésion cellulaire et chémokines
Molécules d’adhésion cellulaire :
E-sélectine, P-sélectine, CD34, ICAM-1, JAM-A, VCAM-1 ; FN CS1, PECAM-1
Chimiokines :
Expression constitutive : CXCL1-3, CXCL5, CXCL7, CXCL8,
CXCL10, CCL4, CCL22, CCL23, CCL24, CCL26
Expression induite : CCL2, CCL20, CCL27, CXCL9, CXCL11
Tableau I-1. Composants moléculaires des cellules endothéliales endoneurales humaines. UEA1 = Ulex
Europaeus Agglutinin 1 ; FvW = Facteur de von Willebrand ; VEGF = Vascular Endothelial Growth Factor ; GFRα1 = GDNF Family Receptor α1 ; GDNF = Glial cell-line Derived Neurotrophic Factor ; ZO = Zonula Occludens ; JAM = Junctional Adhesion Molecule ; VE-cadhérine = Vascular Endothelial-cadhérine ; GLUT-1 = GLUcose Transporter 1 ; MCT-1 = MonoCarboxylate Transporter 1 ; CRT = CReatine Transporter ; LAT-1 = L-type Amino acid Transporter 1 ; P-gp = P-glycoprotein ; MRP-1 = Multidrug Resistance Protein 1 ; OATP-C = Organic Anion Transporting Polypeptid C ; OAT-3 = Organic Anion Transporter 3 ; CD = Cluster of Differenciation ; ICAM-1 = InterCellular Adhesion Molecule 1 ; VCAM-1 = Vascular Cell Adhesion Molecule 1 ; FN CS1 = FibroNectin containing the CS1 region ; PECAM-1 = Platelet Endothelial Cell Adhesion Molecule 1 ; CXCL = Chemokine (C-X-C motif) Ligand ; CCL = Chemokine (C-C motif) Ligand (d’après Ubogu, 2013).
Du fait de l’absence de système lymphatique au niveau de l’espace endoneural, des altérations de la pression capillaire se traduiront par une accumulation liquidienne rapide et l’apparition d’un œdème endoneural, entrainant des lésions neuronales locales (Mizisin et Weerasuriya, 2011).
Par ailleurs, l’absence de jonctions serrées au niveau des cellules endothéliales macrovasculaires épineurales, de même que la présence de fenestrations entre ces cellules, suggère que des solutés, macromolécules et autres substances d’origine sanguine peuvent diffuser dans l’épinèvre et influencer la constitution du fluide interstitiel. L’épinèvre étant principalement constitué de trames de fibres conjonctives disposées longitudinalement (nécessaires au maintien de l’intégrité structurelle du nerf), ces substances peuvent diffuser librement au sein de cette couche (Ubogu, 2013).
Ainsi, la barrière périneurale protège l’endonèvre de la diffusion passive de substances issues du fluide interstitiel épineural alors que les cellules endothéliales microvasculaires endoneurales, en contact direct avec les substances issues du sanguin circulant, forment -quant à elles- la barrière hémato-nerveuse (BHN), protégeant le microenvironnement nerveux endoneural des agressions extérieures (Ubogu, 2013).
La structure de la BHN est différente de son pendant central, la Barrière Hémato-Encéphalique (BHE). Les cellules endothéliales hautement différenciées qui composent à la fois la BHE et la BHN sont complètement entourées d’une membrane basale au sein de laquelle sont retrouvés de nombreux péricytes. En revanche, dans la BHE, la partie abluminale de ce complexe cellule endothéliale/péricyte/membrane basale est entourée d’une structure unique dénommée « membrane gliale limitante périvasculaire », distincte de la membrane basale endothéliale, composée de laminines ainsi que d’une couche de pieds astrocytaires. A l’inverse, ni la membrane gliale limitante périvasculaire ni les pieds astrocytaires ne sont présents dans la BHN (Figure I-6).
Figure I-6. Comparaison de la structure de la Barrière Nerveuse (BHN) et de la Barrière Hémato-Encéphalique (BHE). A noter l’absence de membrane gliale limitante périvasculaire, de pieds astrocytaires et d’espace périvasculaire dans la BHN (d’après Kanda, 2013).
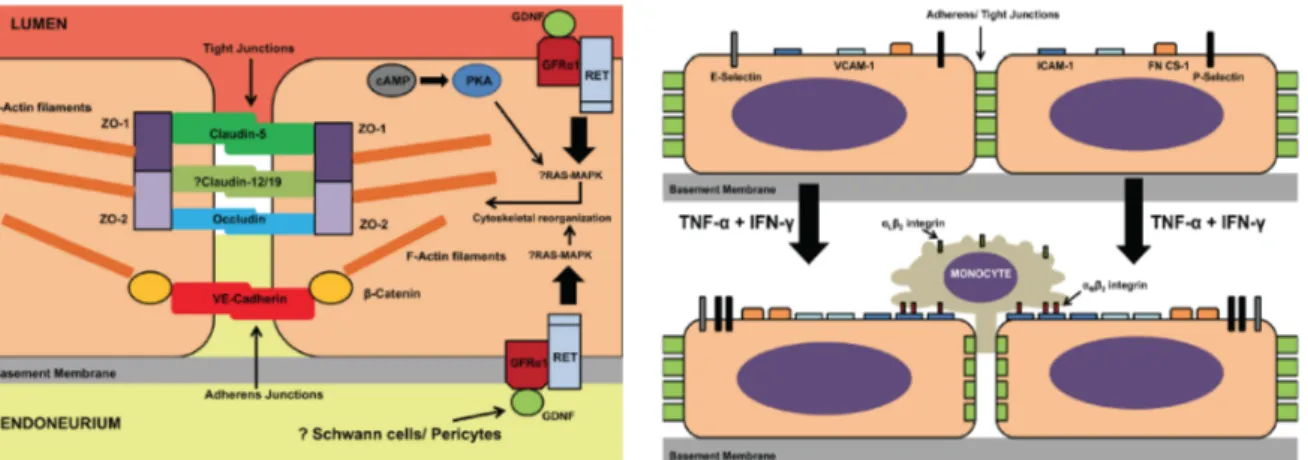
Parmi les composants moléculaires de la BHN, l’occludine, la claudine-5, la claudine-12, la ZO-1 et 2 et la JAM-A (Figure I-7 gauche) participent à la régulation du transport paracellulaire ainsi que la migration leucocytaire (diapédèse leucocytaire) via notamment des récepteurs membranaires tels que l’InterCellular Adhesion Molecule-1 (ICAM-1) (Figure I-7 droite).
Figure I-7. Composition protéique des jonctions serrées de la Barrière Hémato-Nerveuse (BHN) et rôle dans le transport paracellulaire. Vue schématique des principales protéines de jonctions serrées (et adhérentes) de la BHN (gauche) et rôle dans la diapédèse leucocytaire, après stimulus inflammatoire (droite) (d’après Ubogu, 2013).