DEPARTEMENT DE BIOLOGIE
Réf : ……./UAMOB/F.SNV.ST/DEP.BIO/2017
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV Filière : Sciences Biologiques
Spécialité : Analyses Biologiques et Biochimiques
Présenté par :
MAMERI Said
Thème
Bactéries multirésistantes dans l’environnement
Recherche dans les eaux usées
de la ville de Bouira
Soutenu le :
29 / 06 / 2017Devant le jury composé de :
Nom et Prénom Grade
M. KADRI A. MCA Univ. de Bouira Président
Mme. MEDBOUA C. MAA Univ. de Bouira Promoteur
M. CHERGUI A. MAA Univ. de Bouira Examinateur
Je dédie le présent travail :
A ma femme ; Sonia , A mes enfants ; Sophia et Lysa.
Je dédie également ce travail :
À toutes celles et à tous ceux qui souffrent dans le silence, souvent par la faute des autres, et demeurent dignes face à l’adversité et à toute épreuve.
Aux victimes de l’ignorance et de la bêtise humaine…
Remerciements
Je voudrais rendre hommage à ma femme et mes enfants de m’avoir encouragé à reprendre le chemin de l’université et pour leur soutien tout au long de ma formation, sans quoi le présent travail scientifique n’aurait jamais vu le jour.
Je veux souligner particulièrement la contribution de mon enseignante et promotrice Madame Chafiaa Medboua. Je tiens à la remercier de m'avoir fourni un encadrement scientifique et les facilités matérielles nécessaires à mon projet d’étude. Ses ouvrages, ses conseils, sa forte présence et ses encouragements ont été très appréciés mais, surtout, déterminants. Je lui exprime toute ma gratitude.
J’exprime toute ma reconnaissance à mes enseignants M. Kadri N. et M. Chergui A. de m’avoir honoré en acceptant de présider le jury et d’examiner le présent travail.
Je suis également redevable aux professeurs, au personnel et la communauté estudiantine de la Faculté SNV - Département de Biologie pour leur contribution à ma formation. A toutes et à tous, merci.
Je n’omettrais pas de remercier le personnel, en particulier les cadres de la STEP de la ville de Bouira ; je veux nommer M. Noual M. et M. Noual A. de m’avoir permis de réaliser une partie de cette étude dans des conditions agréables.
Mes remerciements à M. Saraoui H. de m’avoir assisté dans la traduction documentaires. Je remercie, en fin, les anonymes pour leur soutien même silencieux mais,…sincère!
SOMMAIRE Liste des abréviations
Liste des tableaux Liste des figures Liste des annexes
Introduction………..1
Partie I : SYNTHESE BIBLIOGRAPHIQUE LA RESISTANCE BACTERIENNE AUX ANTIBIOTIQUES I- Les antibiotiques dans l’environnement………..3
1. Généralités ………...3
2. Les antibiotiques dans les eaux usés………...4
II- La résistance aux antibiotiques dans l’environnement………..4
1. Généralités ………...4
2. Sources et mouvements des gènes de résistance bactérienne aux antibiotiques dans l’environnement………..5
3. Supports génétiques et mobilité de la résistance aux antibiotiques………...5
III. Les eaux usées et la résistance aux antibiotiques……….6
1. La résistance aux antibiotiques dans les STEPs……….6
2. Impact des STEPs sur le transfert d’éléments génétiques conférant la résistance bactérienne aux antibiotiques……….7
3. Conséquences de la pollution aux antibiotiques et de la résistance bactérienne………7
IV. Mécanismes de résistance aux antibiotiques………8
1. Mécanismes non enzymatiques………..8
2. Mécanisme enzymatique………...10
V- Les bactéries multi-résistantes……….12
1. Les bacilles à Gram négatif………..12
2. Les Staphylocoques………...17
Partie II : ETUDE EXPERIMENTALE
MATERIELS ET METHODES
I. Présentation de la zone d’étude : STEP-ville de Bouira………20
1- Description ………...20
2. Objectifs de traitement et caractéristiques de conception……….20
3. Description du procès épuratoire………..21
II-Prélèvement………...24
III-Analyse physico-chimique………...24
IV-Analyse microbiologique ………24
1. Mise en culture et enrichissement……….24
2. Isolement et purification………...25
3. Identification des souches bactériennes………25
4. Etude de la sensibilité des souches bactériennes aux antibiotiques………..26
5. Recherche des β-lactamases à spectre étendu (BLSE) par le test de synergie (DD-test)….27 6. Recherche des β-lactamases à spectre étendu (BLSE) par le test de Hodge………...27
Partie III : RESULTATS ET DISCUSSION I. Prélèvements………..29
II. Analyse physico-chimiques des échantillons………...29
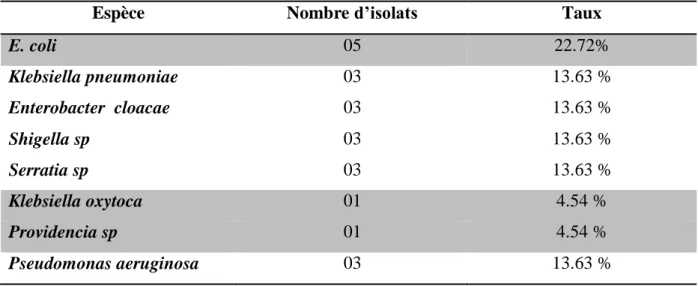
III. Isolement et identification des souches………...29
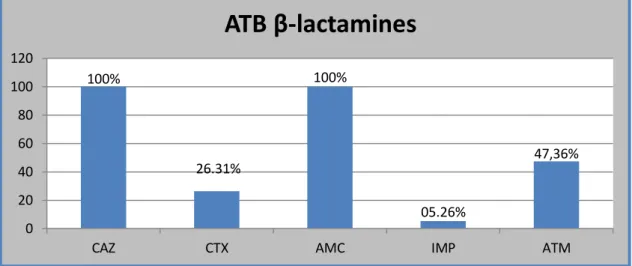
IV. Résistance des souches d’entérobactéries aux antibiotiques………31
IV.1. Résistance aux β-lactamines………31
IV.2. Résistance aux autres familles d’antibiotiques………32
V. Résistance des souches de Pseudomonas aeruginosa aux antibiotiques ………33
V.1. Résistance aux β-lactamines……….33
V.2. Résistance aux autres familles d’antibiotiques……….34
VI. Analyse des phénotypes de résistance aux β-lactamines par le test de synergie (DD-test)………34
VII. Recherche de la production des carbapénèmases par le test de Hodge………35
VIII. Discussion générale……….36
Conclusion………41
Références bibliographiques Annexes
Liste des abréviations AmpC: Chromosomal located céphalosporinase
ATB : Antibiotique ATBM : Antibiogramme
BLSE: β-lactames à spectre étendu BMR : Bactéries multi résistantes
CA-SFM : Comité de l’Antibiogramme de la Société Française de Microbiologie C1G : Céphalosporines de 1re génération
C2G : Céphalosporines de 2ème génération C3G : Céphalosporines de 3ème génération C4G : Céphalosporines de 4ème génération
CAZ : Céftazidime
CMI : Concentration minimale inhibitrice CO : Carbone organique
CTX-M : Céphotaximase – Munich
CTX-M: Cefotaximase, first isolated at Munich
DBO5 : Demande biochimique en oxygène pendant 5 jours DCO : Demande chimique en oxygène
DD-test : Double disque test
EDTA: Ethylenediamine tetra acetic acid EGM : Éléments génétiques mobiles
ERV : Entérocoques résistants à la vancomycine GN : Gélose nutritive
LPS: Lipipolysacchadides MES : Matière en suspension MH : Mueller Hinton
MO : Matière organique MS : Matière sèche
NPP: Nombre le plus probable
OMS: organisation mondiale de la santé OXA: Oxacillinase
PCR: Polymérase Chain Reaction PLP: Protèine de liaison aux pénicillines R: Résistant
S : Sensible
SARM : Staphylococcus aureus résistant à la méthicilline STEP : Station de traitement et d’épuration des eaux usées TEM: Temoniera
TSI: Tri Suger Iron
UFC: Unité Formant colonie VAN : Vancomycine
Liste des figures
Figure 1 : Schéma descriptif du procès épuratoire des eaux usées au niveau de la STEP-
Ville de Bouira (ONA-Bouira, 2013)……….23
Figure 2 : Station de relevage n° 2-STEP de la ville de Bouira: Prélèvement d'eau usée…..24
Figure 3 : Souches de bacilles à Gram négatif isolées sur milieu Mac Conkey……….……29
Figure 4 : Galerie biochimique du genre Klepsiella………30
Figure 5 : Répartition des souches bactériennes isolées………..30
Figure 6 : Taux de résistance vis-à-vis des β-lactamines……….32
Figure 7 : Taux de résistance vis-à-vis des autres familles d’antibiotiques……….33
Figure 8: Test de sensibilité aux antibiotiques………33
Figure 9 : Exemple de DD-test négatif………35
Liste des tableaux
Tableau I: Objectifs de traitement (ONA-Bouira, 2013)………..…20
Tableau II: Caractéristiques de conception (ONA-Bouira, 2013)……….21
Tableau III : Mise en culture et enrichissement………..25
Tableau IV : Liste des antibiotiques testés………..26
Tableau V: Répartition des souches par espèces……….31
Tableau VI : Taux de résistance des souches de Pseudomonas aeruginosa vis-à-vis des β-Lactamines………..34
Tableau VII: Taux de résistance des souches de P. aeruginosa vis-à-vis des a ut r e s
Liste des annexes Annexe 1
Concentration des antibiotiques dans les eaux usées (Kim et aga, 2007)
Annexe 2
Composition des réactifs et des milieux de culture (Le Minor et Richard, 1993)
Annexe 3
Résultats d’analyses des paramètres physicochimiques des eaux usées -Avril et mai 2017 (ONA-Bouira, 2017)
Annexe 4
Résultats des Tests d’isolement des souches bactériennes
Annexe 5
Résultats des tests biochimiques des souches de bacilles à Gram négatif isolées
Annexe 6
Valeurs critiques des diamètres de zones d’inhibition pour les entérobactéries (CA- SFM, 2017)
Annexe 7
Valeurs critiques des diamètres de zones d’inhibition pour les Pseudomonas (CA- SFM, 2017)
Annexe 8
Résultats des diamètres de résistance des bacilles à Gram négatif aux β-lactamines
Annexe 9
Résultats des diamètres de résistance des bacilles à Gram négatif aux autres familles d’antibiotiques
1
Introduction
La problématique de la multirésistance bactérienne aux antibiotiques est plus que jamais d’actualité. Elle demeure entière et risque de s’aggraver si des médications alternatives ne viennent pas urgemment y remédier.
En effet, la résistante aux antibiotiques a été, et demeure à présent, la conséquence de l’utilisation abusive et de la mauvaise utilisation de ces composés dans la médecine humaine et vétérinaire, mais aussi en tant que facteurs de croissance pour les animaux d’élevage (Schluter et al., 2007 ; Tamtam et al., 2008). D’ailleurs, c’est ainsi que des résidus d’antibiotiques peuvent être retrouvés dans les effluents d’eaux usées, notamment celles provenant des hôpitaux, des usines de production pharmaceutique, des fermes et autres bâtiments d’élevage (Sabate et al., 2008).
Par ailleurs, la dissémination de souches résistantes, voire multirésistantes, et l’apparition de nouveaux mécanismes de résistance, notamment les β-lactamases à spectre élargi, posent de sérieux problèmes au monde médical actuel. Cette accumulation de mécanismes de résistance est devenue problématique, car elle conduirait à une impasse thérapeutique en raison de l’émergence de souches dites totorésistantes vis-à-vis du panel d’antibiotiques actuellement disponibles sur le marché (Medboua, 2010). Les problèmes posés et les conséquences engendrées se manifestent à trois niveaux : Thérapeutique pour le clinicien qui doit prescrire un antibiotique efficace et éviter la sélection de mutants résistants ; microbiologique, car certaines résistances sont difficiles à détecter au laboratoire et nécessitent la mise en œuvre de méthodes spécifiques (β-lactamases à spectre élargi) et enfin, épidémiologique pour les équipes du contrôle de l’infection qui doivent limiter la dissémination des souches résistantes.
Etant le réceptacle des bactéries et des antibiotiques, la station de traitement et d’épuration des eaux usées (STEP) peut, d’une part, constituer un endroit idéal pour le transfert des gènes de résistance et à l’émergence de bactéries résistantes (Tafoukt, 2011), et d’autre part, être l’ultime rempart avant le rejet des bactéries résistantes dans l’environnement, et ce, du fait qu’elle soit l’interface entre les activités humaines et l’environnement immédiat. D’où l’importance, voire la nécessité d’une maitrise des paramètres et autres facteurs précurseurs de la résistance bactérienne.
2 Au niveau local, le manque de données, ainsi que de travaux effectués sur la présente thématique, nous ont encouragés à engager notre travail en guise d’ébauche à la problématique relative à la résistance bactérienne aux antibiotiques dans notre l’environnement. C’est dans ce contexte que s’inscrit notre étude qui consiste à isoler, puis identifier, à partir des eaux usées de la ville de Bouira, des souches bactériennes multirésistantes (BMR) aux antibiotiques. Elle a pour but d’évaluer, globalement, la place des BMR et de déterminer leurs profils de résistance au sein des genres bactériens concernant les Staphylocoques, les bacilles à Gram négatif et enfin, les Entérocoques.
Dans ce travail, l’isolement des souches a été réalisé à partir des eaux usées collectées au niveau de la STEP de la ville de Bouira. Pour ce faire, nous avons organisé notre méthodologie de travail selon les étapes successives suivantes:
Purification, puis identification des souches isolées ;
-à-vis des antibiotiques ;
Parallèlement aux analyses ci-dessus décrites, nous avons procédé au dosage des paramètres physico-chimiques des eaux usées prélevées.
PARTIE I
SYNTHESE
3
LA RESISTANCE BACTERIENNE AUX ANTIBIOTIQUES
I- Les antibiotiques dans l’environnement 1. Généralités
L’utilisation des antibiotiques est multiple. Outre le domaine thérapeutique humain, elle intervient dans le traitement des maladies et la production alimentaire de croissance des animaux, ainsi que dans le traitement prophylactique des végétaux. En conséquence de quoi, les effets des antibiotiques dépassent largement leur champ d’intervention et c’est ainsi que les antibiotiques d’infiltrent dans les eaux usées et des eaux souterraines, comme ils peuvent dériver par voie aérienne (Allen et al., 2010).
Sur le plan de l’investigation, des études menées dans certains pays ont révélé la présence d’antibiotiques à des concentrations de l’ordre de microgramme ou nanogramme par litre. Les différents sites environnementaux ciblés concernent des eaux usées municipales, effluents d’hôpitaux et ceux des usines de traitement des eaux usées, eaux de surface et même certaines eaux souterraines. Les composés détectés appartiennent à différentes classes d’antibiotiques, telles que les quinolones, macrolides, tétracyclines et sulfamides (Kümmerer, 2004).
En dépit du fait que les β–lactamines ne soient pas persistants dans l’environnement, ils ont tout de même été détectés dans les stations de traitements des eaux usées. Toutefois, de nombreux antibiotiques ne sont pas éliminés, à l’instar de méropenème, céfotiame ou nitrothiazole, d’autres comme les quinolones et fluoroquinolones sont peu biodégradables : la ciprofloxacine présente dans des eaux de fleuves est dégradée complètement au bout de trois mois, alors que seulement 20% de l’acide oxolinique sont dégradés après 05 mois. On montré aussi que la fixation des quinolones au sol et aux sédiments tarde leur biodégradation, néanmoins le traitement des eaux usées élimine efficacement les quinolones par la voie, outre celle de la biodégradation, de la photodégradation (Martinez, 2009).
Les concentrations élevées d’antibiotiques trouvés dans les eaux usées et les sols traités avec du fumier sont circonscrites dans les zones où il ya de l’activité humaine, à contrario, ces concentrations sont faibles dans les environnements vierges. Suite à quoi, les évaluations des risques prennent en compte les domaines ayant des charges élevées en antibiotiques et contenant des microorganismes associés à l’homme pour analyser l’effet de la pollution due aux antibiotiques sur les écosystèmes naturels (Martinez, 2009).
4
2. Les antibiotiques dans les eaux usés
Les agents antimicrobiens utilisés en thérapies humaine, animale et végétale ainsi que leurs résidus atteignent les systèmes d’égouts. Leurs concentrations dans les eaux usées, bien que nettement inférieures aux doses thérapeutiques, sont soupçonnées d’affecter les bactéries sensibles et de sélectionner des souches résistantes (Quczkiewicz et al., 2010).
Le dosage des antibiotiques dans les effluents (en amont) et dans les eaux usées traités dans une station de traitement et d’épuration (en aval) montre que des concentrations en antibiotiques ont été constatées dans ces dernières (annexe 1), ce qui suggère qu’il n’ya qu’une élimination partielle d’antibiotiques dans les STEPs. Malgré ces faibles concentrations, leur apport continu à ces dernières soulève des préoccupations quant à leurs potentiels effets indésirables écologiques et leur contribution au développement de la résistance aux agents antimicrobiens, influant ainsi sur la santé, notamment humaine (Kim et Aga, 2007).
II- La résistance aux antibiotiques dans l’environnement 1. Généralités
En pathologie humaine, les bactéries résistantes aux antibiotiques sont surtout les entérocoques résistants à la vancomycine (ERV), les Staphylococcus aureus résistants à la méthicilline (SARM), et les Pseudomonas multirésistants.
Concernant les causes de cette résistance, l’accent est mis sur l’utilisation abusive d’antimicrobiens dans les hôpitaux et les élevages (Kümmerer, 2004).
Des études indiquent que des bactéries phytopathogènes, résistantes au cuivre et/ou à la Streptomycine, ont été isolées des cours d’eau même loin des zones agricoles et où ces cours d’eau ne sont pas utilisés pour l’irrigation des cultures (Vanneste et al., 2008). Des souches d’E.coli résistantes aux antibiotiques ont été fortement retrouvées dans les eaux souterraines rurales.
Même si l’origine exacte de la résistance n’a pas été déterminée, les eaux de ruissellement du fumier dans les fermes ou des fuites d’eaux usées provenant des fosses septiques constitueraient des voies claires d’entrée des bactéries résistantes dans les eaux souterraines (Kümmerer, 2004).
5
2. Sources et mouvements des gènes de résistance bactérienne aux antibiotiques dans l’environnement
Il est généralement reconnu que l’environnement naturel abrite une grande diversité de gènes de résistance aux antibiotiques (Aminov, 2009). Les gènes de résistance existent naturellement dans l’environnement grâce aux pressions de sélection exercée dans la nature. L’homme a appliqué une pression de selection supplémentaire sur les gènes de résistance aux antibiotiques en raison des grandes quantités d’antibiotiques que nous produisons, consommons et utilisons en médecine et en agriculture. Les forces physiques et biologiques causent une large diffusion des gènes de résistance à travers de nombreux environnements (Allen et al., 2010).
Le transfert des gènes de Strepromyces à d’autres microorganismes du sol potentiellement pathogène pour l’homme a été montré pour un transfert vers une mycobactérie atypique. On peut aussi imaginer qu’il ya ingestion de microorganismes du sol porteurs de gènes de résistance par des animaux, puis transfert de ces gènes à des bactéries peuplant les écosystèmes animaux, puis passage chez celui-ci avec l’alimentation. Des gènes de résistance pourraient être aussi administrés à l’homme avec certaines préparations antibiotiques où ils ont été retrouvés. (Kim et al., 2007)
3. Supports génétiques et mobilité de la résistance aux antibiotiques
Ordinairement, il est supposé que la propagation rapide des déterminants de la résistance aux antibiotiques chez les souches bactériennes est en rapport avec la présence et les propriétés des éléments mobiles. On a considéré, dans un premier temps, que ces éléments étaient des plasmides et des transposons retrouvés dans plusieurs groupes systématiques bactériens. Plus tard, des transposons conjugatifs ont été détectés et leur rôle dans le transfert de gènes entre les bactéries à Gram positif et à Gram négatif a été étudié. Cependant, les principaux mécanismes de l’apparition de la résistance des bactéries aux antibiotiques et leur émergence étendue ont été clarifiés seulement ces dernières années, suite à la découverte d’intégrons et l’analyse de leur structure (Mindlin et al., 2009).
Les divers types d’entités (plasmides, transposons, intégrons et phages) sont susceptibles de diriger les transferts génétiques selon différents modes; les bactériophages avec la transduction, les transposons et les intégrons avec le déplacement et la capture de gènes, les plasmides transférables avec la conjugaison, ou encore la transformation par internalisation d’ADN libre extracellulaire (Sota et Top, 2008 ; Kelly et al., 2009).
6
III. Les eaux usées et la résistance aux antibiotiques 1. La résistance aux antibiotiques dans les STEPs
La dynamique des bactéries et des gènes codant pour la résistance aux antibiotiques dans les STEPs est actuellement peu connue. Ces stations reçoivent des bactéries qui sont déjà exposées aux antibiotiques provenant des ménages, hopitaux et animaleries. Elles sont considérées comme des points chauds pour le le transfert horizontal de gènes à cause de leur richesse nutritionnelle et de la forte densité bactérienne (Tennstedt et al., 2003 ; Schluter et
al., 2007). Des bactéries résistantes et multi-résistantes telles que E.coli, Acinetobacter, Pseudomonas, sont présentes dans les eaux usées municipales. La résistance aux β–
lactamines, aux quinolones, à la tétracycline et autres sulfamides à été constatée chez des bactéries retrouvée dans des eaux usées et des boues d’épuration du monde entier (Kümmerer, 2009).
Le nombre des bactéries résistantes aux antibiotiques dans les eaux usées est significativement plus élevé que dans l’environnement naturel. Des études effectuées en Allemagne ont mis en évidence la présence de bactéries résistantes aux antibiotiques dans les biofilms recueillis à partir des eaux usées des hôpitaux et des municipalités, l’eau des rivières et l’eau potable. Des entérocoques résistants à la vancomycine et des entérobactéries hydrolysant les β–lactamines ont été retrouvées dans les biofilms d’eaux usées que dans ceux des rivières ou d’eau potable. De même pour les gènes codant pour la résistance aux antibiotiques, tels que vanA, mecA et ampC (Schwartz et al., 2003).
Le processus de traitement des eaux usées pourrait augmenter la proportion de bactéries résistantes à la sortie d’une STEP. Les processus biologiques sur la base des boues activées, en raison de la forte densité de cellules, sont considérés comme des facteurs favorisant la dissémination de la résistance chez les bactéries (Quczkiewicz et al., 2010).
Les différences dans la conception des STEPs et de leur fonctionnement peuvent aussi influer sur le sort des bactéries résistantes et des gènes de résistance aux antibiotiques dans les eaux usées. Ainsi, il a été évalué le sort des populations bactériennes résistantes à la tétracycline dans le processus biologique de traitement des eaux usées. Une augmentation de la charge organique et celle de la résistance est constatée, les deux aboutissent à l’amplification de la résistance à la tétracycline (Kim et al., 2007).
7
2. Impact des STEPs sur le transfert d’éléments génétiques conférant la résistance bactérienne aux antibiotiques
Les stations d’épuration ont été reconnues comme un réservoir de bactéries résistantes aux antibiotiques et de gènes de résistance, y compris les plasmides codant pour la résistance aux antibiotiques, qui peuvent conférer une résistance à la plus part sinon toutes les classes d’antibiotiques cliniquement significatives, telles que les macrolides, les tétracyclines, les céphalosporines, les fluoroquinolones, les aminosides et les β–lactamines. L’accumulation de différents gènes de résistante aux antibiotiques sur des plasmides peut être augmentée dans l’environnement des STEPs (Rahube et Yost, 2010).
Au cours de ces dernières années, différents plasmides conjugatifs de multirésistance ont été obtenus à partir de stations d’épuration municipales. C’est ainsi que des plasmides codant pour la résistance à la gentamicine ont été isolés des eaux usées.
L’étude des connaissances acquises sur l’analyse génomique comparative complète de plasmides isolés à partir des bactéries des boues d’épuration et de plasmides isolés à partir des bactéries cliniques et d’autres environnements, fournit des preuves claires quant à l’échange génétique entre les bactéries pathogènes des humains, des animaux et des plantes, et les bactéries de l’environnement, y compris celles des eaux usées (Schluter et al., 2007).
Le réservoir des éléments génétiques mobiles (EGM) de la résistance aux antibiotiques dans les stations d’épuration comprend les éléments conjugatifs transposables (transposants et séquences d’insertion) et les intégrons. La combinaison de ces éléments avec les plasmides conjugatifs forme un environnement où ces plasmides peuvent rapidement acquérir ces EGM via la transposition ou la recombinaison et deviennent des mosaïques de multiples éléments génétiques de la résistance (Rahube et Yost, 2010).
3. Conséquences de la pollution aux antibiotiques et de la résistance bactérienne
L’utilisation des antibiotiques à des fins cliniques ou de l’élevage sélectionne des microorganismes résistants. Il est donc prévisible que les résidus provenant des hôpitaux ou des fermes contiennent deux types de polluants : les antibiotiques et les gènes de résistance. Néanmoins, le sort des deux types de polluants est probablement différent. Plusieurs antibiotiques sont des composés naturels qui ont été en contact avec le macrobiote de l’environnement des millions d’années durant et sont donc biodégradables et peuvent même servir de source de nutriments pour plusieurs microorganismes.
8 Les antibiotiques synthétiques, comme les quinolones, peuvent être plus réfractaires à la biodégradation. Toutefois, ils sont encore dégradés à des vitesses différentes dans des environnements naturels. Le processus de dégradation est lent à basse température en hiver, et la composition et l’humidité du sol ont clairement un impact sur la dégradation des antibiotiques. De plus, la libération constante d’antibiotiques dans les effluents hospitaliers et les résidus des fermes rend ces derniers constamment pollués, quelque soit la dégradation de l’antibiotique (Martinez, 2009).
Comme bactéries résistantes et gènes de résistance détectés dans des effluents hospitaliers et dans les eaux usées, on citera vanA et mecA pour les premiers, et vanA, ampC, gènes de résistance à la gentamicine, P. aeruginosa, Acinetobacter spp., Campylobacter spp., E.coli,
Pseudomonas spp., Enterococci. (KUmmerer, 2004) IV. Mécanismes de résistance aux antibiotiques
Afin de résister aux antibiotiques, les bactéries utilisent quatre principaux types de mécanismes, à savoir : la diminution ou la suppression de la pénétration de l’antibiotique dans la bactérie (imperméabilité), la modification de la cible bactérienne de l’antibiotique, l’efflux actif en dehors de la cellule bactérienne, et enfin, l’inactivation enzymatique (Tennstedt et al., 2003).
1. Mécanismes non enzymatiques 1.1. Diminution de la perméabilité
La membrane bactérienne externe agit comme une barrière sélective par la combinaison d’une bicouche lipidique très hydrophobe avec protéines, formant ainsi des pores ayant des propriétés et des dimensions spécifiques.
Dans un grand nombre d’espèces bactériennes, l’existence de résistance aux antibiotiques est due à des modifications dans les lipides ou les protéines qui composent la membrane, mettant en valeur l’importance que joue cette dernière dans la sensibilité aux antibiotiques.
Les médicaments hydrophiles tels que les β-lactamines, utilisent les porines pour accéder à l’intérieur de la cellule, pendant que les macrolides et d’autres médicaments hydrophobes diffusent à travers la bicouche lipidique (Delcour, 2009).
Le nombre de molécules de porines présentes conditionnera le passage des antibiotiques, d’où le lien étroit de la résistance par ce mécanisme avec la diminution ou la perte de porines (Pourriat et Martin, 2005).
9 Dans la pratique, plusieurs résultats ont montré la relation existante entre la porine et la sensibilité aux β-lactamines et aux fluoroquinolones. Les analyses d’isolats résistants aux antibiotiques (Klebsiella, Enterobacter, Proteus, Pseudomonas, Serratia) ont révélé que la disparition des porines, associée à la production d’enzymes bactériennes, détruit le cycle β-lactame (β-lactamases), ce qui constitue un élément clé dans la résistance aux β-lactamines. La disparition d’une porine chez Pseudomonas aeruginosa a été rapportée dans le cas de la résistance à l’Imipenème (Pagès, 2004).
1.2. Modification de la cible
La cible cellulaire peut être modifiée par modification enzymatique ou par mutation, de manière à réduire l’affinité de l’antibiotique pour la cible. La résistance aux fluoroquinolones, par exemple, peut être effectuée par mutation dans la cible de l’antibiotique. Ces mécanismes sont spécifiques pour un seul antibiotique ou pour une classe entière d’antibiotiques. Quant à la cible, elle n’est, parfois, pas modifiée, mais la bactérie est capable de synthétiser une nouvelle cible résistante à l’antibiotique. Dans ce cas, on parle de substitution de cible (Guillemot et Leclercq, 2005).
1.3. Système d’efflux
Parmi les catégories majeures des transporteurs de la membrane bactérienne figurent les pompes d’efflux. Ce sont des protéines intégrantes de la membrane qui utilisent l’énergie cellulaire pour expulser activement des antibiotiques ou des toxines de la cellule, d’où la mise en évidence, surtout, de ce rôle de détoxification (Nishino et al., 2009).
Par efflux actif, la résistance intrinsèque à de nombreux antibiotiques est très répandue parmi les bactéries Gram négatif et exprimée dans la plus part des cas de façon modérée. Cependant, si plusieurs pompes sont co-exprimées ou face à une hyperexpression des gênes codant des transporteurs, elle peut atteindre un niveau élevé. Aussi, des associations entre l’efflux actif et les autres mécanismes de résistance existent. C’est le cas, par exemple, de la synergie entre l’efflux et des mutations dans les gênes des topoisomérases lors de la résistance aux fluoroquinolones de Streptococcus, dont l’exportation de ces derniers favoriserait la sélection de mutants par exposition à des concentrations insuffisantes de l’antibiotique (Cattoir, 2004).
10
2. Mécanisme enzymatique
C’est un mécanisme qui s’exprime par la production d’enzymes qui, à leur tour, inactivent les antibiotiques par hydrolyse ou par modification, ce qui aboutit à la formation de dérivés inactifs. On citera parmi les enzymes les plus connues les β-lactamases.
2.1. Les β-lactamases
Ce sont des hydrolases qui catalysent l’hydrolyse irréversible de la liaison amide du cycle β-lactame, inactivant ainsi les β-lactamines. Elles peuvent être chromosomiques ou plasmidiques et produites d’une manière inductible ou constitutive, elles sont sécrétées dans l’espace périplasmique chez les bactéries Gram négatif ou dans le liquide extracellulaire chez les bactéries à Gram positif (Essack, 2001).
Les β-lactamases sont réparties, selon leur mécanisme catalytique, en deux types : les sérines-β-lactamases, utilisant un site actif à sérine pour hydrolyser le noyau β-lactame et les métallo-β-lactamases, nécessitant la présence de Zn+2 (Jacoby et Bush, 2005).
2.1.1. Production des β-lactamases
A l’heure actuelle, la production des β-lactamases est le mécanisme de résistance prédominant des bactéries à Gram négatif vis-à-vis des β- lactamines. Au début des années 1980, seules quelques enzymes de type plasmidiques comme TEM-1, TEM-2 et SHV-1 étaient connues, mais rapidement après l’introduction des antibiotiques à large spectre tels que les céphalosporines de 3eme génération, sont apparues des β-lactamases à spectre étendu ou BLSE. Depuis, les β-lactamases ne cessent de se diversifier, d’élargir leur spectre d’activité et leur diffusion parmi de nombreuses espèces d’entérobactéries, Pseudomonas sp et
Acinetobacter sp (Faure, 2009).
Les β -lactamases sont nommées selon leur substrat préféré (IMP, OXA), leur propriété biochimique (SHV), gènes (AmpC), bactéries (PSE), patients (TEM), hôpital (MIR), région (OHIO) et selon leurs auteurs (HMS). Des enzymes modifiées ont la même désignation en lettre, mais possèdent un chiffre différent, qui est affecté selon l’ordre de leur description (TEM-1, 2, 3, . . . etc) (Jacoby, 2006).
2.1.2. Les β-lactamases à spectre étroit de type TEM, SHV et OXA
Plusieurs β -lactamases plasmidiques ont été retrouvées chez les bacilles à Gram négatif. La plus connue chez les entérobactéries est la β -lactamase TEM-1 qui est responsable de la résistance à l’ampicilline observée chez environ 50% des souches d’E. coli (Livermore, 1995).
11 Les β -lactamases de type SHV ont longtemps été endémiques au genre Klebsiella, avec un profil de résistance similaire aux β -lactamases de type TEM (Roy, 2000).
Les enzymes OXA donnent généralement de faibles taux de résistance aux pénicillines avec des CMI pour l’ampicilline chez E. coli de l’ordre de 128 à 256 µg/ml et celle des ureidopénicillines de 4 à 16 µg/ml.
Les enzymes TEM-2, SHV-1 et OXA-1 sont aussi répandues chez les entérobactéries, mais sont moins fréquentes que TEM-1. Ces enzymes hydrolysent les céphalosporines de première génération, et toutes les pénicillines excepté la témocilline et n’ont pas d’activité apparente sur les nouvelles céphalosporines (céphalosporines de troisième et quatrième générations) (Livermore, 1995).
2.1.3. Les β-lactamases à spectre étendu (BLSE)
Les BLSE ont aujourd’hui une répartition mondiale. Leur prévalence varie d’une région à une autre, d’une ville à une autre et même d’un hôpital à un autre. L’un des facteurs spécifiques de risque d’acquisition des BLSE chez les patients hospitalisés est la longue hospitalisation (Giske et al., 2009).
Jusqu’à la fin des années 90, la majorité des BLSE détectées étaient des dérivés de TEM-1/2 et de SHV-1, après évolution de ces enzymes anciennes par mutation(s) ponctuelle(s). A partir de 1995, de nouvelles BLSE notamment les CTX-M ont émergé de façon rapide chez les entérobactéries. Contrairement aux BLSE de type TEM et SHV, les mécanismes de diffusion de CTX-M semblent plus complexes, mettant en jeu la diffusion des plasmides et/ou d’autres éléments génétiques. Les autres BLSE (ex PER, VEB) restent plus rares et sont principalement détectées chez P. aeruginosa et Acinetobacter sp (Cattoir, 2008).
2.1.4. Les carbapénèmases
Les carbapénèmes (imipénème, ertapénème et méropénème) sont aujourd’hui parmi les traitements de choix des infections sévères dues aux entérobactéries productrices de β- lactamases à spectre étendu (BLSE), mais leur utilisation pourrait être compromise par l’émergence de souches de bactéries résistantes également aux carbapénèmes (Cuzon et al., 2010).
12
V- Les bactéries multi-résistantes
Les bactéries sont dites multi résistantes (BMR) aux antibiotiques lorsque, du fait de l’accumulation des résistances naturelles et acquises, elles ne sont plus sensibles qu’à un nombre restreint d’antibiotiques utilisables en thérapeutique. La multirésistance concerne les bactéries responsables d’infections communautaires à l’exemple des pneumocoques ou les bacilles de la tuberculose et les bactéries responsables d’infections nosocomiales ou associées aux soins. Certaines résistances sont particulièrement importantes à prendre en compte, car elles concernent des espèces bactériennes qui sont à la fois commensales susceptibles de disséminer dans la population générale et à fort potentiel pathogène. C’est le cas des
Staphylococcus aureus résistants à la méticilline (SARM) et des entérobactéries productrices
de β-lactamases à spectre étendu (EBLSE) (Boukhatem, 2013)
1. Les bacilles à Gram négatif
Ils occupent une place importante en pathologie humaine. Généralement, on les divise en deux grands groupes : les entérobactéries et les bacilles à Gram négatif non fermentaires (Liassine, 2000).
Les entérobactéries sont responsables de nombreuses infections communautaires et infections nosocomiales, notamment urinaires et respiratoires. Quant aux bacilles à Gram négatif non fermentaires (Pseudomonas sp, Acinetobacter ssp…etc), ils sont à l’origine d’infections nosocomiales diverses, surtout chez les immunodéprimés (VIH, leucémiques, cancéreux,…).
L’importance de ces bacilles à Gram négatif est liée à leur multi-résistance aux antibiotiques disponibles actuellement, ce qui a suscité de nombreuses études ces dernières décennies (Gueye, 2007).
1.1. Entérobactéries
1.1.1. Taxonomie et habitat
Les entérobactéries appartiennent à la famille des Enterobacteriaceae et renferment les genres Escherichia, Salmonella, Klebsiella, Shigella. En 1937, Rahn rassembla ces genres bactériens dans le genre unique Enterobacter.
La subdivision des genres et espèces est basée sur la comparaison des caractéristiques physiologiques, biochimiques, antigéniques et génétiques des bactéries (Joly et Reynaud, 2002).
13 La plupart des espèces qui composent cette famille sont des hôtes normaux ou pathogènes du tube digestif de l'homme et des animaux. Ils peuvent persister en dehors d'organismes vivants, on les rencontre dans le sol, l'eau et dans certaines denrées alimentaires (Fauchère et Avril, 2002).
1.1.2. Définition et caractéristiques
Ce sont des bacilles à Gram négatif. Certaines espèces peuvent être très polymorphes, notamment le genre Proteus. Elles sont non sporulées, le plus souvent mobiles, mais immobiles dans le cas des bactéries des genres Klebsiella, Shigella et Yersinia, elles sont aérobies-anaérobies facultatives, fermentent le glucose avec ou sans production de gaz et réduisent les nitrates en nitrites (sauf certaines souches d'Erwinia et Yersinia). Elles n'ont pas d'oxydase et possèdent une catalase (sauf Shigella dysenteriae sérotype 1). Ces caractères permettent de différencier les entérobactéries des autres bacilles à Gram négatif pouvant être cultivés sur des milieux ordinaires. Après culture des entérobactéries, les colonies lisses brillantes et sous les formes S « smooth »sont formées après 18-24 heures d'incubation à 35-37 °C. Après plusieurs repiquages d'une souche, les colonies deviennent rugueuses et ayant des formes R «rough ». (Avril et al., 2000 ; Joly et Reynaud, 2002).
Les colonies des bactéries produisant une capsule, notamment de Klebsiella
pneumoniae, sont muqueuses et plus grandes que les colonies habituelles. Dans le cas des
espèces Proteus vulgaris et Proteus mirabilis qui sont particulièrement mobiles, il se produit fréquemment un envahissement de la surface des milieux solides, gagnant en 24 heures la totalité de la surface.
II existe cependant des entérobactéries ayant une croissance faible dont les colonies sont naines, c'est le cas de certaines espèces des genres Shigella et Yersinia. Pour ces dernières par exemple une incubation d’au moins 48 heures à 37°C est nécessaire (Joly et Reynaud, 2002 ; Bidet et Bingen, 2007).
Les entérobactéries sont des chimio-organotrophes, beaucoup sont prototrophes : à partir d'une source unique de carbone (sucre, ...) et d'énergie (électrons), elles sont capables de synthétiser tous les éléments nécessaires à leur survie et à leur croissance (Avril et al., 2000).
1.1.3. Identification du genre et espèce
L’identification des différents genres et espèces repose sur plusieurs caractères biochimiques (Joly et Reynaud, 2002):
- Étude des voies métaboliques de la fermentation des sucres et des polyalcools ; - Production d'un métabolite terminal et recherche d'enzymes ;
14
1.1.4. Caractères antigéniques
L'étude des différents caractères antigéniques permet de classer en sérotypes les souches appartenant à une même espèce ou au même genre. La détermination des sérotypes à un grand intérêt épidémiologique pour certaines entérobactéries pathogènes comme
Salmonella, Shigella et E. coli (Avril et al., 2000).
Il existe plusieurs types d’antigènes :
- Antigène commun : appelé « antigène de Kunin » ou (ECA), est présent chez toutes les entérobactéries sauf certaines Erwinia.
- Antigène O ou somatique : localisé au niveau de la paroi bactérienne, de nature lipopolysaccharidique.
- Antigène H ou flagellaire : n'existant que chez les bactéries mobiles, de nature protéique. - Antigène K ou capsulaire : constitué d'une couche externe polysaccharidique ou protéique.
1.1.5. Pouvoir pathogène
Outre son action en agriculture et chez les animaux, le pouvoir pathogène des entérobactéries chez l'homme est considérable. Dans la majorité des cas, l'origine de l'infection est soit endogène à partir des flores bactériennes, soit exogène provenant de milieu extérieur.
Les entérobactéries sont responsables de nombreuses infections qui sont non spécifiques: - Les infections communautaires : des infections urinaires provoquées par E. coli, des intoxications alimentaires provoquées par les Salmonelles, des infections pulmonaires provoquées par Klebsiella pneumoniae.
- Les infections nosocomiales : des infections urinaires, des plaies opératoires, des infections pulmonaires, des septicémies.
En plus des bactéries déjà citées dans les infections communautaires avec un profil de multi résistance on cite: Enterobacter sp , Serratia sp (Avril et al., 2000 ; Joly et Reynaud, 2002).
1.2. Le genre Pseudomonas 1.2.1. Taxonomie et habitat
La simplification de cette classification a été réalisée par Stanier qui a étudié principalement l’assimilation des substances carbonées, et par Palleroni qui a classé les espèces de Pseudomonas en 5 groupes génomiques; les Pseudomonas vrais appartiennent au groupe I. Le genre Pseudomonas a été restreint à une cinquantaine d’espèces après l’apport des travaux génétiques. Il est classé dans la famille des Pseudomonadaceae ( Martin, 2007).
15 Ces bactéries se retrouvent plus particulièrement dans les milieux humides tels que les eaux douces, les eaux de mer et les eaux thermales. Elles se retrouvent en plus petite quantité dans les eaux stagnantes riches en matières organiques. Elles sont considérées comme une flore commensale chez l'homme ou l'animal (Avril et al., 2000).
1.2.2. Caractères bactériologiques
a) Caractères morphologiques et culturaux : Bacilles à Gram négatif, en forme de
bâtonnets, mobiles, non sporulés.
La culture est facile sur milieu complexe avec une source simple de carbone, la température de croissance variée de 4 à 45°C selon les espèces.mais pas à 4°C.
Les colonies de P. aeruginosa sont polymorphes, muqueuses, bombées, opaques, visqueuses parfois coulantes comme pour Klebsiella (Avril et al., 2000).
Le genre Pseudomonas comprend des espèces fluorescentes produisant des pigments spécifiques ( la pyocyanine et la pyoverdine).
b) Caractères biochimiques : Le genre Pseudomonas est chimio- organotrophe avec un
métabolisme strictement respiratoire, est oxydase positive, certaines espèces réduisent le nitrate en anaérobiose avec synthèse d'une nitrate-réductase, utilisent comme source de carbone et d’énergie une diversité de substrats hydrocarbonés (avril et al., 2000).
Pseudomonas aeruginosa dégage une odeur aromatique caractéristique de seringa 1.2.3 Pouvoir pathogène virulence
Les Pseudomonas sont peu virulents pour l'individu normal, par contre ils sont considérés comme des agents infectieux redoutables lorsque les défenses immunitaires du sujet sont altérées. P. aeruginosa est l'exemple type de la bactérie pathogène opportuniste. Chez les brûlés, cette infection est l'une des causes majeures de mortalité (Avril et al., 2000).
Les toxines élaborées et les composés de la paroi des espèces du genre Pseudomonas sont des facteurs essentiels de la virulence. On distingue principalement : une hémolysine thermostable, des exo-enzymes (protéases, phospholipases) et des toxines protéiques (exotoxine, entérotoxine) (Garrity et al., 2010).
1.3. Le genre Acinetobacter ssp 1.3.1. Taxonomie et habitat
Dans la ‟Approved List of Bacterial Names” deux espèces différentes, A.
calcoaceticus et A. lwoffii, ont été répértoriées, en se basant sur le fait que certains Acinetobacter peuvent acidifier le glucose tandis que d'autres non (Peleg et al., 2008).
16 Longtemps considéré comme un représentant de la famille des Neisseriaceae, le genre
Acinetobacter comprend actuellement 32 espèces.
C’est un germe ubiquitaire retrouvée dans les sols, l’eau potable, les eaux de surface ainsi que
dans diverses denrées alimentaires.
Des souches d’Acinetobacter ssp sont fréquemment isolées des eaux usées et des boues activées des stations d'épuration. Elles sont capables de stocker les phosphates sous forme de polyphosphates (Lambert, 2007). En revanche, selon une étude récente, A.
baumannii a été isolé dans plusieurs sources, comme la nourriture (Giamarellou et al., 2008).
Chez l'homme et les animaux, les Acinetobacter ssp font partie de la flore cutanée normale. D'une manière globale, l’espèce pathogène ou saprophyte la plus fréquemment isolée est
Acinetobacter baumannii (Euzéby, 2010). 1.3.2. Caractères bactériologiques
a)Caractères morphologiques et culturaux : Ce sont des coccobacilles à Gram
négatif, non sporulées, parfois capsulés, immobiles (Peleg et al., 2008).
L’isolement des souches en milieu solide peut être obtenu après incubation à température comprise entre 30 et 37°C (entre 15°C et 44°C pour Acinetobacter baumannii) sur des milieux conventionnels comme la gélose au sang et sur les milieux dédiés aux bacilles à Gram négatif comme la gélose Mac Conkey. Les colonies apparaissent en générale lactose négatif sur les milieux lactosés.
En pratique, l’identification des diverses espèces repose sur la capacité de développement à 37-41 et 44°C pendant 48 heures, l’hydrolyse de la gélatine et les galeries d’identification (Lambert, 2007).
b) Caractères biochimiques : Ce sont des aérobies stricts, catalase (+), oxydase (-),
prototrophes, (Avril et al., 2000). Ils ne réduisent généralement pas les nitrates en nitrites mais, ils oxydent le glucose et d'autres sucres en acide gluconique, la production d'hydrogène sulfuré, indole, bêta-galactosidase et DNase. Quelques souches produisent une uréase ou une phénylalanine désaminase d'activité faible (Gillespie et Hawkey, 2006).
1.3.3. Pouvoir pathogène et virulence
L’incidence des infections à A. baumannii a considérablement augmentée durant les 20 dernières années, en particulier dans les unités de soins intensifs et de chirurgie (Giamarellou et al., 2008). Acinetobacter ssp est responsable d'infections urinaires chez les malades sondés et peut être isolé aussi chez des malades âgés, fragilisés par une intervention chirurgicale majeure (Avril et al., 2000).
17 Parmi les facteurs de virulence, on reconnaît un lipopolysaccharide (LPS) impliqué dans le choc septique endotoxinique, des protéines de membrane externe à l’origine de réponse inflammatoire (Joly-Guillou et Bergogne-Bérézin, 2006).
2. Les Staphylocoques
2.1. Généralités sur le genre Staphylococcus
Les staphylocoques sont des bactéries commensales de la peau et des muqueuses de l’homme et de l’animal. L’homme est le principal réservoir naturel de Staphylococcus.
Chez l’homme, les staphylocoques en particulier les espèces S. aureus et S. epidermidis font partie de la flore résidente cutanée de nombreux individus qui sont des « porteurs asymptomatiques » (Wylie, Deborah, & Nowicki, 2005).
Les SARM sont des staphylocoques dorés qui ont développé des résistances à plusieurs antibiotiques dont la méticilline, ils sont résistants à toutes les ß-lactamines et très souvent résistants aux aminosides, aux macrolides et aux fluoroquinolones Ils représentent 5 à 10% des germes isolés dans les infections nosocomiales.
2.2. Taxonomie et classification
Selon Bergey (1994), la classification du genre Staphylococcus est :
Famille: Staphylococcaceae, Genre: Staphylococcus avec 38 espèces et des sous-espèces. Dix sept de ces espèces sont retrouvées chez l’Homme. D’autres sont présentes chez les animaux ou dans les aliments (Aouati, 2009). Parmi celles retrouvées chez l’Homme, trois espèces occupent une place privilégiée essentiellement dans la pathologie humaine: S. aureus,
S.epidermidis et S. saprophyticus. Les autres sont rarement impliquées 2.3. Caractères phénotypiques et culturaux
Les staphylocoques sont des cocci à Gram positif, isolés ou groupés en amas, immobiles, non sporulés, parfois encapsulés, catalase-positive et oxydase-négative. La production d’une coagulase, d’un pigment caroténoïde jaune doré et la présence d’une protéine A de paroi caractérisent Staphylococcus aureus. Les autres espèces sont regroupées sous le terme destaphylocoques à coagulase négative (SCN), dont le représentant principal est S.
18
2.4. Pathogénicité et virulence
Les infections par les staphylocoques sont caractérisées d’une part par les caractères destructif, profond et suppuré de la porte d’entrée ou des foyers métastatiques, la rapide dissémination des métastases septiques et l’existence de signes généraux marqués, et d’autre part, la possibilité d’une persistance prolongée plusieurs dizaines d’années (Chaala, 2013). Les SARM se trouvent sur la peau ou dans les narines des patients. Ils peuvent provoquer des infections de la peau en cas de plaie, des infections sur site opératoire, des pneumonies, des infections urinaires ou des infections du sang.
3. Les Entérocoques
L’Entérocoque résistante à la vancomycine (ERV)
3.1. Caractéristiques : Forme ronde avec un petit flagelle, famille : Enteroccocaceae, règne :
Bactéria, dimension : 0.6 à 2 micromètre
3.2. Habitat
Les Entérocoques constituent une flore autochtone de l’appareil digestif, des conduits uro-génitaux et de la cavité orale de l’homme. Plusieurs espèces cohabitent au sein d’une même niche écologique mais une spécificité existe : Et. faecalis et Et. faecium sont les espèces les plus fréquemment rencontrées chez l’homme. Les entérocoques sont à l’origine de nombreuses pathologies; en effet, ils sont une des premières causes des infections nosocomiales. Et. faecalis est responsable à lui seul de 80 à 90% des contaminations et Et.
faecium est impliqué dans la majorité des cas restants. Ces germes sont responsables, chez
l’adulte, d’endocardites, de méningites, de pneumonies (Mundy et al., 2000; Kayser, 2003). Les souches d’entérocoques sont intrinsèquement résistantes à plusieurs agents antimicrobiens et elles peuvent facilement acquérir des résistances aux antibiotiques, elles sont résistantes par exemple aux glycopeptides (vancomycine, triméthoprime), sulfaméthoxazole, ciprofloxacine, bacitracine, rifampicine, érythromycine, céfotaxime, quinolones et autres antibiotiques (Mathur et al., 2005 ; Klein et al., 1998). Mais elles sont très susceptibles aux framycétines, streptomycines, et aminoglucosides (Pantip et al., 2007).
3.3. Resistance des entérocoques
-résistance intrinsèque : naturelle .C’est celle des ERV.
19
3.4. Pouvoir pathogène
Le fait que les entérocoques sont considérés comme des souches multirésistantes (Franz et al., 1999;. Kayser et al., 2003) explique qu’elles peuvent servir de réservoirs de gènes de résistance aux antibiotiques transmissibles aux bactéries pathogènes. Par exemple, le gène tetM d’Et. faecalis est fréquemment rencontrés chez les bactéries pathogènes à Gram positif ou à Gram négatif (Neisseria meningitidis, Listeria innocua) (Roberts, 1996; Chopra & Robert, 2001).
Au sein des hôpitaux, on réalise des tests de dépistage pour détecter l’ERV, et ce, par crainte qu’il transmette sa résistance aux antibiotiques à d’autres bactéries beaucoup plus dangereuses.
PARTIE II
MATERIELS
ET
20
I-Présentation de la zone d’étude :
STEP-ville de Bouira1- Description
La station d'épuration de la ville de Bouira est implantée en amont du barrage Tilesdit sur la rive d’oued Hous et située à 1 km à la sortie-Est du chef-lieu de la ville de Bouira. D’une capacité nominale de 129200 équivalent habitant et étalée sur une superficie de 10 hectare dont 06 hectare couvert, elle recueille les eaux usées urbaines et pluviales de la ville de Bouira. Elle a été réalisée dans le but de protéger le barrage Tilesdit qui est la source principale d’irrigation et d’alimentation en eau potable de certaines villes et villages de Bouira.
La mise en exploitation de la station est intervenue le 01 juin 2013 et est placée sous la tutelle de l’Office National de l’Assainissement « ONA ».
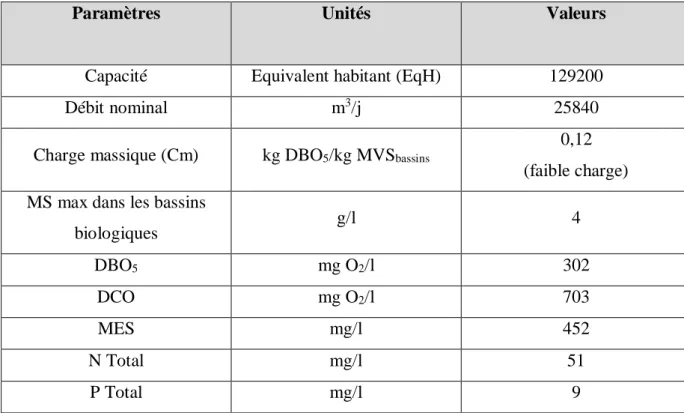
2. Objectifs de traitement et caractéristiques de conception
Les objectifs de traitement exprimés par les seuils fixés dans le manuel d’exploitation de la station et les caractéristiques de conception pour les eaux entrant dans la station d’épuration sont ceux donnés, respectivement, dans les tableaux I et II.
Tableau I : Objectifs de traitement (ONA-Bouira, 2013)
Paramètres Seuils DBO5 ≤ 20 mg O2/l DCO ≤ 120 mg O2/l MES ≤ 30 mg/l N-NH4 ≤ 4 mg/l N-NO3 ≤ 8 mg/l P Total ≤ 2 mg/l pH 6,5-8,5 Température (C°) 12-20
21
Tableau II : Caractéristiques de conception (ONA-Bouira, 2013)
Paramètres Unités Valeurs
Capacité Equivalent habitant (EqH) 129200
Débit nominal m3/j 25840
Charge massique (Cm) kg DBO5/kg MVSbassins 0,12 (faible charge) MS max dans les bassins
biologiques g/l 4 DBO5 mg O2/l 302 DCO mg O2/l 703 MES mg/l 452 N Total mg/l 51 P Total mg/l 9
3. Description du procès épuratoire
Classiquement, une station d’épuration des eaux usées comprend plusieurs unités de traitement, placées en série et qui assurent consécutivement: un prétraitement mécanique de l’effluent, une décantation primaire, un traitement biologique, une décantation secondaire, une désinfection, et enfin, le traitement des boues récoltées à partir des bassins de décantation (CNFME, 2005).
La figure 1 illustre les principales étapes ci-dessus citées de traitement et d’épuration des eaux usées au niveau de la STEP de la ville de Bouira.
a)S’agissant du traitement de l’eau : L’eau usée est collectée et relevée à l’aide d’une
station de relevage vers la STEP. Elle passe en premier lieu par un dégrillage grossier à nettoyage manuel qui sert à l’élimination des grosses impuretés (ф˃50 mm), puis par un dégrillage fin automatique qui élimine les impuretés moyennes (ф ˃08 mm).
Lorsque l’eau arrive dans les deux lignes de dessablage/déshuilage, l’élimination du sable se fait par simple décantation et les huiles par flottation en injectant de l’air sous-pression par les deux suppresseurs d’air. Par la suite, l’eau passe par le répartiteur pour qu’elle soit mélangée avec la boue de retour (zone de contact) pour former la boue activée et se dirige vers les bassins biologiques.
22 Chaque bassin comprend une partie anoxie où l’oxygène libre est nul pour favoriser la dénitrification (réduction des nitrates NO3- en nitrites NO2- , puis en azote gazeux N2), et une partie aérobie pour l’oxydation biologique de la pollution carbonée et azotée (nitrification), avec une éventuelle déphosphoration biologique qui est favorisée par le système d’aération syncopée. Ces bassins sont aérés par des aérateurs de surface horizontale (rotor-mammouths) et agités avec des agitateurs submersibles.
Après la dégradation biologique de la pollution carbonée, azotée et phosphorée, l’eau se dirige vers les deux clarificateurs pour une séparation du mélange hétérogène eau épurée/boue par simple décantation de cette dernière. L’eau épurée déverse des lames des clarificateurs vers les chicanes de désinfection, puis vers le milieu récepteur (Oued D’hous, dans le cas présent) (ONA-Bouira, 2013).
b) S’agissant du traitement des boues : Une partie des boues soutirées des clarificateurs est
recyclée dans les bassins biologiques en se mélangeant avec l’eau brute au niveau du répartiteur (zone de contact), l’autre partie est extraite vers l’épaississeur pour qu’elle soit épaissie, puis orientée vers le stabilisateur aérobie, et enfin, vers la déshydratation mécanique qui consiste à déshydrater mécaniquement la boue à l’aide de deux presses à bande et avec ajout de polymère cationique, comme il est possible, aussi, de sécher la boue naturellement dans les lits de séchage (ONA-Bouira, 2013).
23
Figure 1 : Schéma descriptif du procès épuratoire des eaux usées au niveau de la
24
II-Prélèvement
Les différents prélèvements d’échantillons d’eau usée ont été effectués aseptiquement au cours de plusieurs campagnes de terrain, étalées sur une période de deux mois (du 05 avril 2017 au 29 mai 2017). Ils ont été réalisés au niveau de deux points distincts, à savoir :
-En amont de la station de relevage (à l’arrivée de la STEP) ; -En aval du bassin de désinfection (à la sortie de la STEP).
Les échantillons sont collectés dans des flacons stériles en verre de 500 ml, puis acheminés directement vers le laboratoire d’analyses microbiologiques et celui d’analyses physico-chimiques (Figure 2).
Figure 2 : Station de relevage n° 2-STEP de la ville de Bouira: Prélèvement d'eau usée
III-Analyse physico-chimique
Elle consiste à analyser les paramètres physico-chimiques des eaux usées prélevées. Il s’agit essentiellement d’estimer les concentrations des matières en suspension (MES), la demande biochimique en oxygène (DBO), la demande chimique en oxygène (DCO), l’azote organique (NH4), les nitrates (NO3), les nitrites (NO2), les phosphates (PO4), la turbidité, le PH, la température (T°) et la conductivité.
IV-Analyse microbiologique
Elle porte sur la recherche des bactéries multi-résistantes aux antibiotiques, à savoir : les Staphylocoques résistants à la méthicilline, les entérocoques résistants à la vancomycine, et les bacilles à Gram négatif résistants aux antibiotiques, notamment les β-lactamines à spectre étendu (BLSE).
25
1. Mise en culture et enrichissement
Une série de 03 tubes à essai contenant 10 ml de bouillon d’enrichissement est préparée. Les deux premiers tubes contiennent du bouillon nutritif, le 3ème tube renferme du bouillon Rothe. A chaque tube est additionnée une concentration précise d’antibiotique donné et 01 ml d’échantillon d’eau usée. Il s’agit, respectivement, de l’Oxacilline (OXA), la Céftazidime (CAZ) et la Vancomycine (VAN) (Tableau III). L’incubation se fait à 37°C pendant 24heures.
Tableau III : Mise en culture et enrichissement
Milieu d’enrichissement Antibiotique (en µg) Germes
Tube 1 Bouillon nutritif 03 µg / Oxacilline Staphylocoques
Tube 2 Bouillon nutritif 03 µg / Céftazidime bacilles à Gram négatif
Tube 3 Bouillon nutritif 04 µg / Vancomycine Entérocoques
2. Isolement et purification
Afin d’isoler les différentes souches bactériennes à partir du milieu d’enrichissement, on procède par des ensemencements dans différentes boites de Petri contenant les milieux de culture sélectifs, comme suit:
-Sur gélose Chapman pour l’isolement des Staphylocoques, puis incubation à 37°C/24heures en aérobiose ;
-Sur gélose Mac Conkey pour l’isolement des bacilles à Gram négatif, puis incubation à 37°C/24heures en aérobiose;
-Sur gélose nutritive ou la gélose au sang pour l’isolement des Streptocoques, puis incubation à 37°C/24heures en anaérobiose.
On réalise par la suite, à partir des cultures positives, une purification des souches, et ce, par le repiquage de 03 à 05 colonies caractéristiques des souches bactériennes respectives sur les mêmes milieux de culture sélectifs.
3. Identification des souches bactériennes
L’identification des souches bactériennes est réalisée par des tests de coloration et des tests biochimiques (Le Minor et Richard, 1993) basés sur :
26 - La dégradation du glucose, du lactose et la production de gaz et de H2S sur gélose TSI ;
- La recherche d’uréase, la production d’indole et d’une TDA sur milieu Urée Indole ; - La fermentation du mannitol et la mobilité sur milieu Mannitol-Mobilité ;
- L’utilisation du citrate sur milieu Citrate de Simmons. La composition de ces milieux est donnée en annexe 2.
4. Etude de la sensibilité des souches bactériennes aux antibiotiques
Antibiogramme
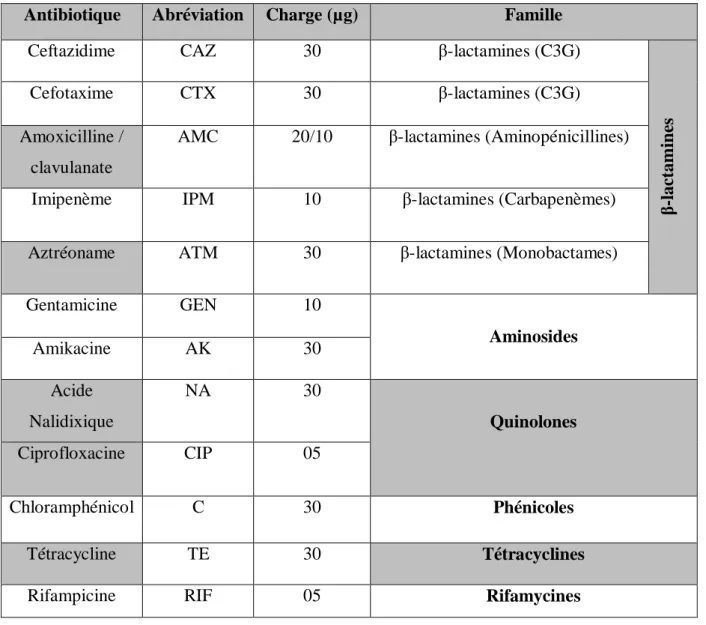
Les souches d’entérobactéries purifiées et identifiées ont été testées vis-à-vis d’une série de 12 antibiotiques et 06 antibiotiques pour les Pseudomonas (Tableau IV).
Tableau IV : Liste des antibiotiques testés
Antibiotique Abréviation Charge (µg) Famille
Ceftazidime CAZ 30 β-lactamines (C3G)
β-lact am in es Cefotaxime CTX 30 β-lactamines (C3G) Amoxicilline / clavulanate
AMC 20/10 β-lactamines (Aminopénicillines)
Imipenème IPM 10 β-lactamines (Carbapenèmes)
Aztréoname ATM 30 β-lactamines (Monobactames)
Gentamicine GEN 10 Aminosides Amikacine AK 30 Acide Nalidixique NA 30 Quinolones Ciprofloxacine CIP 05 Chloramphénicol C 30 Phénicoles Tétracycline TE 30 Tétracyclines
27 La sensibilité aux antibiotiques est évaluée par le test de l’antibiogramme standard, par diffusion sur gélose Mueller Hinton (MH), conformément aux recommandations du Comité de l’antibiogramme de la société française de microbiologie (CA-SFM, 2017).
a)Milieu : Mueller Hinton (MH)
b) Inoculum : On procède par la préparation d’une suspension, à partir d’une culture de
24heures sur gélose non sélective ; la gélose nutritive (GN) en dissociant 4 à 5 colonies dans 05 ml d’eau physiologique stérile. L’inoculum est ajusté jusqu’à l’obtention d’environ 108 bactéries / ml. Après homogénéisation de la suspension, on prépare une dilution 10-1 qui est l’équivalent d’environ 107 bactéries /ml (CA-SFM, 2010).
c)Ensemencement: Les boites de Petri sont ensemencées avec la suspension diluée 10-1, par
écouvillonnage, puis les disques d’antibiotiques à tester sont déposés à l’aide d’une pince stérile. L’incubation se fait à 37°C/24heures.
d) Lecture et interprétation: Après avoir mesuré les différents diamètres des zones
d’inhibitions obtenues autour des disques d’antibiotiques testés, on interprétera les résultats obtenus en Sensible (S) ou Résistante (R), sur la base des critères définis par le CA-SFM-2017 (annexes 6 et 7).
5. Recherche des β-lactamases à spectre étendu (BLSE) par le test de synergie (DD-test)
Cette recherche concerne les souches bactériennes résistantes aux β-lactamines, précisément les céphalosporines de 3ème génération, à savoir : la céfotaxime (CTX) et la céftazidime (CAZ).
Ce test consiste à placer des disques d’antibiotiques (CAZ, CTX, ATM), d’une concentration de 30 µg pour chaque disque, à une distance de 20 mm (centre à centre) d’un disque combiné d’amoxicilline et d’acide clavulanique (AMC) avec, respectivement, des charges de 20 µg et 10 µg.
Les boites de Petri sont incubées à 37°C pendant 24heures.
L’augmentation de la zone d’inhibition entre le disque de AMC et les disques de CAZ, CTX ou ATM signifie la production d’une BLSE ( Jarlier et al., 1988).
28
6. Recherche des β-lactamases à spectre étendu (BLSE) par le test de Hodge
Il repose sur l’utilisation d’un disque de 10 µg d’imipenème et l’ensemencement d’une souche de référence par écouvillonnage sur gélose Mac conkey à l’aide d’une suspension à 108 bactéries, diluée au 1/10e (107 bactéries).
Dans notre cas, la souche de Pseudomonas aeruginosa, résistante à l’imipenème par imperméabilité membranaire, est utilisée comme témoin négatif.
La souche-test suspectée de produire une carbapenèmase est ensemencée en stries depuis le disque vers le bord de la gélose sur une longueur d’au moins 20 mm. L’incubation se fait à 37°C/24heures.
Le test est interprétable en cas de déformation de la zone d’inhibition de la souche de référence le long de la strie de la souche témoin positif. Si une déformation semblable est observée avec la souche test suspecte, celle-ci peut-être considérée comme productrice d’une carbapenèmase.