Les traumatismes thoraciques sont fréquents (10 % des polytraumatisés) et graves (15 % de mortalité). Ils s’accompagnent d’épanchements pleuraux (aérique, sanglant ou mixte) dans plus d’un cas sur deux [1].
Texte intégral
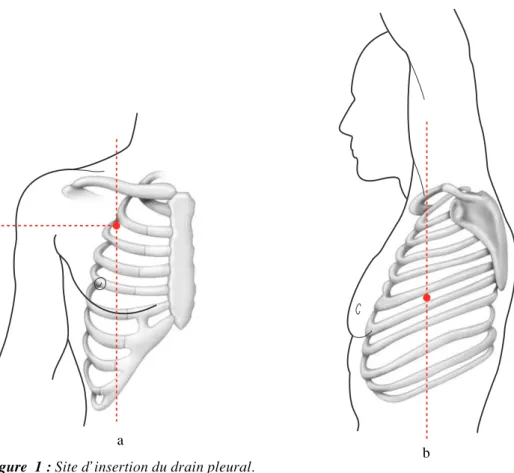
Figure


![Tableau I Réduction de l’empyème emèypmE % t o t a l % s o u s TBA snas%TBA ceva% émrefTT ceva% trevuoTT 931=n]93[zelaznoG 1 , 4 0 2 , 9 N D N D 911=n]73[slohciN 2 , 5 0 5 , 4 0 5 , 8 9421=n]41[nakilliM 2 , 4 N D N D 2 , 4 3 , 6 612=n]23[gnilleH 2 , 6 3 2](https://thumb-eu.123doks.com/thumbv2/123doknet/2426540.46775/14.658.79.575.529.746/tableau-réduction-empyème-emèypme-émreftt-trevuott-zelaznog-nakillim.webp)
Documents relatifs
Seuls les épanchements parapneumoniques compliqués doivent faire l’objet d’un traitement évacuateur reposant sur la mise en œuvre de ponctions pleurales
Les lésions pleuropulmonaires (épanchements et contusion de toute nature) favorise l'hypoxie puis l'hypercapnie. S'installe rapidement un cercle vicieux qui conduit à la défaillance
Les intoxications par des champignons sont la conséquence, le plus souvent, d’une confusion avec d’autres champignons comestibles mais, dans certains cas
In this section we compare the Steklov-Poincar´e approaches SP0 (5.3) and SP (5.2) with the extended interface problems (XIP) (5.4), (5.5), (5.6) and (5.7) presented in this work
0 2 3 GALLERY 1 6 VIEW OF THE CEREMONIAL ROOM OF THE CASTLE OF ZIZERS 17 th Century 0 MUSICAL INSTRUMENTS CASTLE OF ZIZERS 17 th Century 5 CASTLE OF ZIZERS 17 th Century 7
jections on decadal to centennial timescales point to changes in seawater pH (Caldiera.. Bellerby et al. Title Page Abstract Introduction Conclusions References Tables Figures ◭ ◮ ◭
• Emballage dans un sachet stérile mis dans un 2e emballage avec de la glace (4 ° C), sans contact direct avec la glace. • Patient a jeun, perfusion(antalgiques
Destruction irréversible de l'encéphale caractérisée par un cœur battant, un coma profond aréactif, une perte des réflexes du. tronc cérébral et une perte de la