Manifestations cardiaques du SAPL 1
ABREVIATIONS
Manifestations cardiaques du SAPL 2 aCL : anticardiolipines.
AIT : accident ischémique transitoire. AAN : anticorps antinucléaires.
aPL : antiphospholipides.
AVCI : accident vasculaire cérébral ischémique. AVK : anti- vitamine K.
ß2-GPI : béta2 glycoprotéine I. CRP : protéine C activée.
ELISA : Enzyme-Linked Immunosorbent Assay. ETO : échographie trans-œsophagienne.
ETT : échographie trans-thoracique. FE : fraction d’éjection.
HBPM : héparine de bas poids moléculaire. HNF : héparine non fractionnée.
IEC : inhibiteur de l’enzyme de conversion. IDM : infarctus du myocarde.
LA : anticoagulant lupique ou Lupus anticoagulant. LES: lupus érythémateux systémique.
LDL : lipoprotein low density. PE : phosphatidyléthanolamine.
SAPL : syndrome des antiphospholipides. TCA : temps de céphaline active.
TP : taux de prothrombine.
TTD: temps de thromboplastine diluée.
Manifestations cardiaques du SAPL 3
Sommaire
Manifestations cardiaques du SAPL 4
1/Historique...8
2/Définitions...8
3/ Rappel physiopathologique...17
4/Objectif de notre travail ...18
OBSERVATIONS...19
1/ première observation... ...20
2/ deuxième observation...25
3/ troisième observation...32
DISCUSSION ET REVUE DE LA LITTETATURE ...39
I. ÉPIDÉMIOLOGIE
...40II. ASPECTS CLINIQUES DU SAPL
...41A. Manifestations cardiaques du SAPL ...41
a) Atteinte valvulaire ...41
b) Atteinte coronaire………...46
c) Thrombus intracardiaque...51
d) Dysfonctions ventriculaires...52
e) Atteinte péricardique...53
Manifestations cardiaques du SAPL 5
g) Hypertension artérielle pulmonaire………..54
B. Autres manifestations cliniques du SAPL ...54
1/ Thromboses veineuses et artérielles………..……….54
2/ Aspects obstétricaux du SAPL...55
3/ Manifestations neurologiques………...56
4/ Manifestations dermatologiques………...57
5/ Manifestations rénales...59
6/ Complications respiratoires………...60
7/ Manifestations digestives et hépatiques...60
8/ Complications hématologiques………...60
9/ Complications endocriniennes…………..………...61
10/ Complications ostéo-articulaires...61
11/ Syndrome « catastrophique » des antiphospholipides...62
III. ASPECTS BIOLOGIQUES DU SAPL
...63A/ Outils diagnostiques du SAPL ...63
1) Lupus anticoagulant (LA)………..63
2) Anticorps anticardiolipines (aCL)……….…64
3) Anti-β2-glycoprotéine I (anti- β2GPI)………65
4) Stratégie diagnostique………..…66
5) Quels aPL sont pathogènes?...66
B/ Explorations complémentaires si le diagnostic est confirmé...68
C/ En pratique quand faut il rechercher les aPL ? ...69
Manifestations cardiaques du SAPL 6
IV. ASPECTS THÉRAPEUTIQUES
...71A) Traitement des manifestations cardiaques du SAPL...71
1/ valvulopathies………..71
2/ atteinte coronaire………...73
3/ thrombus intracardiaque………..73
4/HTAP……….74
5/ dysfonction ventriculaire ……….…………74
B) Traitement des thromboses artérielles et veineuses…...74
C) Traitement du SAPL...76
V. PERSPECTIVES D’AVENIR
...76CONCLUSION...78
RÉSUMÉS...81
Manifestations cardiaques du SAPL 7
Introductio
Manifestations cardiaques du SAPL 8
1/ HISTORIQUE
En 1952, Conley et Hartmann avaient déjà décrit au cours d’un lupus systémique un syndrome hémorragique lié à un anticoagulant circulant [1]. Quelques années après, en 1963, Bowie et Coll ont observé des
thromboses au cours du lupus, associées à la même anomalie biologique
[2]
.
Plus tard, Nilson a décrit à son tour l’association de morts fœtales et d’un anticoagulant circulant.
Cinq ans après deux français : Soulier et Boffa ont confirmé l’existence d’une entité associant des avortements répétés, des thromboses et la prévalence d’un anticoagulant circulant [3]
.
Ce n’est qu’en 1983 que Hughes et Harris ont réellement scellé pour la postérité l’existence du syndrome des anticorps anti-phospholipides (SAPL), en décrivant les anticardiolipines au cours du lupus compliqué de thromboses [4].
2/ DÉFINITIONS
2-1-ANTICORPS ANTIPHOSPHOLIPIDES [6]
Le terme « anticorps antiphospholipides » (aPL) au sens strict regroupe une large famille d’anticorps reconnaissant aussi bien des phospholipides anioniques que neutres (Tableau I).Ces phospholipides sont pour la plupart des constituants des membranes plasmiques cellulaires et sont organisés en bicouche avec une distribution asymétrique entre la membrane externe et interne (Figure 1).
Manifestations cardiaques du SAPL 9 On a élargi le nom des aPL à des anticorps dont les cibles antigéniques sont non seulement les phospholipides eux-mêmes (« vrais » aPL), mais aussi des
protéines plasmatiques associées à ces phospholipides ou ces protéines seules (Figure 1).
Parmi les aPL, ceux dits « conventionnels », lupus anticoagulants (LA) et anticorps anticardiolipine (anticardiolipide en français) (aCL), sont
classiquement associés au syndrome des antiphospholipides (SAPL) et, bien que non spécifiques du SAPL, ils constituent les critères biologiques pour le
diagnostic de ce syndrome.
Anioniques Neutres
Cardiolipine Phosphatidyléthanolamine
Phosphatidylsérine Sphingomyéline
Acide phosphatidique Phosphatidylcholine
Phosphatidylinositol
Phosphatidylglycérol
Tableau 1 : Les phospholipides cibles des aPL
Manifestations cardiaques du SAPL 10 Les LA
Le terme de LA désigne des anticorps définis par leur capacité à prolonger certains tests de coagulation dépendants des phospholipides. Il est admis que ces anticorps reconnaissent des cofacteurs protéiques liés aux phospholipides
anioniques. Les principaux cofacteurs des LA sont la bêta2-glycoprotéine I (β2-GPI) et la prothrombine.
Il est important de noter que les LA et les aPL mis en évidence par des techniques immunoenzymatiques peuvent être des entités distinctes.
Bien que ces anticorps soient fréquemment associés au cours du SAPL, leur taux de recouvrement n'est que de 60 % et donc, il conviendra de rechercher la
présence d’aPL avec des tests immunologiques et des tests d’hémostase. Figure 1 : Diversité des cibles antigéniques des aPL
Manifestations cardiaques du SAPL 11 Les aCL
La cardiolipine est un phospholipide anionique. C’est un constituant de la membrane interne des mitochondries, et récemment, sa présence a été établie dans le plasma sous forme complexée à des lipoprotéines [7] et à la surface de cellules apoptotiques [8].
Les aCL reconnaissent la cardiolipine mais aussi les autres phospholipides anioniques : phosphatidylglycérol, phosphatidylinositol et phosphatidylsérine. C’est la forme oxydée de la cardiolipine qui serait principalement reconnue par les aCL réagissant avec des néo-épitopes présents sur la cardiolipine oxydée [9]. Il convient de distinguer les aCL pour lesquels la réactivité vis-à-vis de la cardiolipine n’est pas dépendante de la présence d’un cofacteur plasmatique dans le milieu réactionnel (« vrais » aCL) de ceux « dépendants » parce qu’ils reconnaissent un complexe cardiolipine-cofacteur, voire même le cofacteur lui-même. Les premiers sont essentiellement retrouvés au cours d’infections alors que les autres sont présents au cours de maladies autoimmunes, dont le SAPL.
La β2-GPI, protéine plasmatique appelée aussi apolipoprotéine H, a été identifiée comme le principal cofacteur des aCL [10].
2-2- SYNDROME DES ANTICORPS ANTIPHOSPHOLIPIDES (SAPL) Le SAPL est une thrombophilie acquise de définition clinico-biologique,
caractérisée par un risque augmenté de thromboses et de complications obstétricales. Cette définition, initialement empirique, basée sur des
observations cliniques s’appuie actuellement sur des critères de classification régulièrement révisés par un consensus d’experts [5].
Manifestations cardiaques du SAPL 12 En effets, les critères révisés en 1999 dits de Sapporo ont fait l’objet en 2006 d’une actualisation lors du consensus international de Sydney [5]
. Ainsi selon ces nouveaux critères la présence d’un SAPL peut être affirmée devant l’association d’une au moins des manifestations cliniques caractéristiques et la mise en
évidence sur le plan biologique d’aPL par une technique de référence (tableau II).
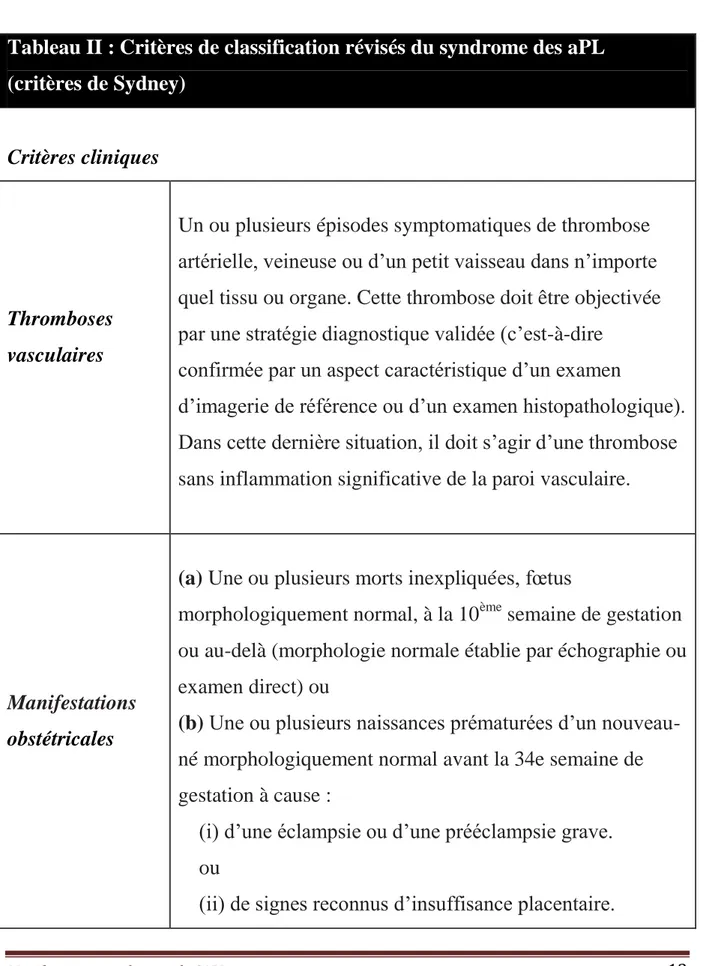
Manifestations cardiaques du SAPL 13 Tableau II : Critères de classification révisés du syndrome des aPL
(critères de Sydney)
Critères cliniques
Thromboses vasculaires
Un ou plusieurs épisodes symptomatiques de thrombose artérielle, veineuse ou d’un petit vaisseau dans n’importe quel tissu ou organe. Cette thrombose doit être objectivée par une stratégie diagnostique validée (c’est-à-dire
confirmée par un aspect caractéristique d’un examen
d’imagerie de référence ou d’un examen histopathologique). Dans cette dernière situation, il doit s’agir d’une thrombose sans inflammation significative de la paroi vasculaire.
Manifestations obstétricales
(a) Une ou plusieurs morts inexpliquées, fœtus
morphologiquement normal, à la 10ème semaine de gestation ou au-delà (morphologie normale établie par échographie ou examen direct) ou
(b) Une ou plusieurs naissances prématurées d’un
nouveau-né morphologiquement normal avant la 34e semaine de gestation à cause :
(i) d’une éclampsie ou d’une prééclampsie grave. ou
Manifestations cardiaques du SAPL 14 ou
(c) Au moins 3 avortements spontanés consécutifs avant la
10ème semaine de gestation sans cause anatomique ou hormonale maternelle et sans cause chromosomique maternelle ou paternelle.
Critères biologiques
(Confirmés au moins 2 fois à une distance de 6 semaines ou plus)
1. Présence d’un anticoagulant circulant (« lupus anticoagulant » – LA), à 2
reprises au moins, espacées de 12 semaines, mis en évidence en suivant les recommandations de l’International Society on Thrombosis and Haemostasis (ISTH).
2. Anticorps anticardiolipines (aCL) d’isotype IgG et/ou IgM dans le sérum ou
le plasma, avec un titre moyen ou élevé (> 40 GPL ou MPL, ou > 99e
percentile), présents à 2 reprises au moins avec des mesures espacées de 12 semaines ou plus, par ELISA standardisé.
3. Anticorps anti-ß2 GPI d’isotype IgG et/ou IgM dans le sérum ou le plasma,
avec un titre moyen ou élevé (> 40 GPL ou MPL, ou > 99e percentile), présents à 2 reprises au moins avec des mesures espacées de 12 semaines ou plus, par ELISA standardisé.
Manifestations cardiaques du SAPL 15 Le SAPL initialement décrit au cours du LES peut aussi survenir en dehors de tout contexte pathologique auto-immun. Ainsi on distingue :
D’une part, un syndrome primaire (SAPL I) caractérisé par l’association des anomalies cliniques et biologiques présentées dans le tableau I, mais sans aucune maladie auto-immune associée. C’est la forme la plus
fréquente du SAPL (53 %).
D’autre part, un syndrome secondaire (SAPL II) associé à une maladie auto-immune (47%), essentiellement à un lupus systémique (37%) (tableau III).
Il faut bien distinguer la rareté du syndrome clinico-biologique de la fréquence du phénomène biologique (aPL) qui n'est pas une anomalie spécifique.
Depuis la reconnaissance de ce syndrome un grand nombre de manifestations cardiaques ont été rapportées en association avec les aPL: valvulopathies, atteinte coronaire, thromboses intracardiaques, cardiomyopathies, hypertension artérielle pulmonaire [12].
Manifestations cardiaques du SAPL 16 Tableau III: Critères d’exclusion du SAPL primaire [13]
La présence de l'un de ces critères n'est pas compatible avec le diagnostic de SAPL primaire :
• Eruption malaire. • Lupus discoïde.
• Ulcération orale ou pharyngée (sauf ulcération ou perforation de la cloison nasale).
• Arthrite franche.
• Pleurésie en l’absence d’embolie pulmonaire ou d’insuffisance cardiaque gauche.
• Péricardite en, l’absence d’infarctus du myocarde ou d’insuffisance rénale marquée.
• Protéinurie supérieure à 0 .5 g /jour due à une glomérulonéphrite par complexes immuns prouvée histologiquement.
• Lymphopénie < 1 000/ul.
• Anticorps anti-ADN natif, par radio-immunologie ou immunofluorescence sur Crithidia.
• Anticorps anti-antigènes nucléaires solubles. • Anticorps anti-nucléaires à un titre > 1/320. • Traitement connu comme inducteur d'aPL.
Manifestations cardiaques du SAPL 17
3/ RAPPEL PHYSIOPATHOLOGIQUE
Deux mécanismes physiopathologiques principaux rendent compte de la pathogénicité de ces anticorps :
I- INTERFÉRENCE DES ANTI-PHOSPHOLIPIDES (APL) AVEC LES SYSTÈMES INHIBITEURS PHYSIOLOGIQUES DE I'HÉMOSTASE
- Inhibition de l’activité de l'antithrombine [14].
- Inhibition de la voie de la protéine C : par inhibition de l'activation de la
protéine C [15], ainsi qu’une résistance acquise à la protéine C activée ; il s'agit là du mécanisme pathogénique le plus souvent décrit pour les aPL. Ce mécanisme est PL dépendant et serait médié par la β2-GPI [16].
- Déficit fonctionnel en protéine S : pouvant être du à la présence d'anticorps anti-protéine S et/ou à la présence d'anticorps anti- β2-GPI qui empêcheraient la β2-GPI de déplacer la liaison C4bBP-protéine S, diminuant ainsi le taux de protéine S libre [17].
- Interférence avec les propriétés anticoagulantes de l'annexine V [18].
- Suppression de l'activité inhibitrice du tissu factor pathway inhibitor (TFPI)
[19]
.
II-ACTIVATION CELLULAIRE, PAR LES APL, RESPONSABLE D’UN ÉTAT PROTHROMBOTIQUE
- Activation plaquettaire [20].
- Activation des cellules endothéliales [21].
- Activation monocytaire avec augmentation de la production de facteurs tissulaires [22].
Manifestations cardiaques du SAPL 18
4/ OBJECTIF DE NOTRE TRAVAIL
Notre travail concerne trois cas de patientes ayant présenté des manifestations cardiaques du SAPL colligées au service de cardiologie B du centre hospitalier universitaire Ibn Sina de Rabat. Nous proposons en première partie de relater les trois observations cliniques et en seconde partie de revoir à travers une revue de la littérature les aspects cliniques, paracliniques et la prise en charge
Manifestations cardiaques du SAPL 19
observations
1)
PREMIÈRE OBSERVATION
Mme Z.K ; âgée de 25 ans, mère d’un enfant a été admise au service le 22/12/05 au douzième jour du post-partum pour douleur thoracique.
Manifestations cardiaques du SAPL 20 L’interrogatoire a retrouvé la notion d’une sérologie syphilitique positive au cours de la grossesse. La patiente a été traitée par pénicillothérapie pendant 6 semaines.
L’accouchement à terme s’est fait par voie basse. Il a été compliqué d’une rétention placentaire ayant nécessité plusieurs révisions utérines.
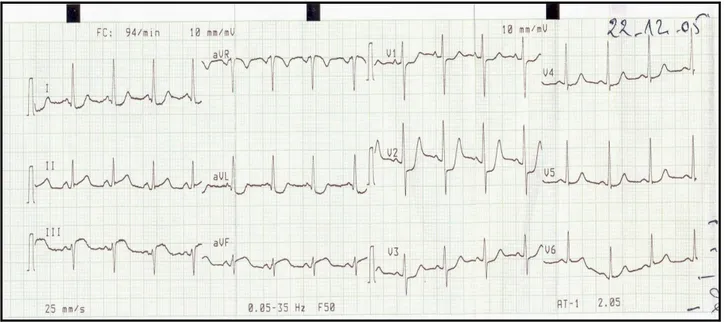
Au dixième jour du post-partum, la patiente a présenté de manière inaugurale, au repos et en dehors de toute contrariété une douleur rétrosternale constrictive prolongée sans irradiation ni signes accompagnateurs, d’où son hospitalisation. À l’admission, la patiente ne souffrait plus. L’examen physique était normal. L’ECG (figure 2) a montré une tachycardie sinusale à 130 bat/min avec un sus décalage du segment ST en postéro-inférieur et un sous décalage ST en antéro-septal et en latéral haut.
La Radiographie thoracique était normale.
Les enzymes cardiaques faites à la 10ème heure étaient élevées : Troponine à 2µg/L (20 x la normale), CPK à 1905 UI/L (11 x la normale), LDH à 3050 U/L (5x la normale), ASAT à 248 UI/L (5x la normale).
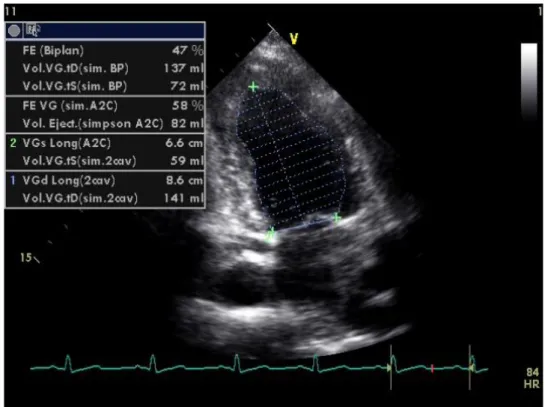
L’échocardiographie trans-thoracique (figure 3) a retrouvé une légère dilatation du ventricule gauche (DTD = 56mm) avec akinésie des segments moyen et apical de la paroi inférieure et hypokinésie de la paroi septale avec une FE au Simpson à 47%.
La patiente a été mise sous HBPM, antiagrégants plaquettaires : aspirine et clopidogrel, bétabloquants et inhibiteurs de l’enzyme de conversion (IEC). Le reste du bilan biologique a mis en évidence :
Manifestations cardiaques du SAPL 21 - un syndrome inflammatoire avec une anémie (Hb = 8g/dl) normochrome
normocytaire, une hyperleucocytose à prédominance neutrophile et une VS et une CRP élevées.
- un TCA spontanément allongé avec un indice de Rosner à 90, 23. La sérologie syphilitique, était dissociée (TPHA négatif, VDRL positif),
La recherche d’anticorps anticardiolipines de type IgG (recontrôlés à 6 semaines d’intervalle) était positive à 180 u GPL/ml. La recherche de l’anticoagulant lupique (LA) était également positive mais pas celle des anticorps anti-nucléaires.
Au troisième jour de son hospitalisation, la patiente a ressoufert sans modification électrique.
La coronarographie réalisée le 10/01/2006 a montré des artères
angiographiquement saines avec une akinésie inférieure à la ventriculographie. La patiente a été mise sous traitement anticoagulant par vois orale.
L’évolution avec un recul de deux ans a été marquée par une stabilité clinique sous anticoagulants et IEC, la régression des signes électriques (figure 4) et des données échographiques stationnaires. Une deuxième grossesse a pu être menée à terme : l’accouchement et les suites de couche se sont déroulés sans incidents.
Manifestations cardiaques du SAPL 22 Figure n°2 : ECG à l’admission: sus décalage du segment ST en postéro- inférieur et sous décalage du segment ST en antéro- latéral.
Manifestations cardiaques du SAPL 23 Figure n° 3 : ETT à l’admission : incidence parasternale grand axe montrant
Manifestations cardiaques du SAPL 24 Figure n°4 : ECG de contrôle: normalisation des signes électriques
Manifestations cardiaques du SAPL 25
2)
DEUXIEME OBSERVATION
Melle J.F, âgée de 19 ans, mère d’un enfant, sans antécédents particuliers, a été hospitalisée le 28/03/2005 pour prise en charge d'une dyspnée d’effort apparue au 40e jour du post-partum.
A l’examen la patiente était fébrile à 38°C avec une tension artérielle à 120/60 mmHg et une FC à 100 b/min. L’auscultation cardiaque a retrouvé un souffle systolique 3/6 e au foyer mitral et un éclat du B2 pulmonaire. Il n’y avait pas de signes d’insuffisance cardiaque, les pouls étaient présents et symétriques. Le reste de l’examen était sans particularité.
L'électrocardiogramme (figure5) inscrivait un rythme régulier sinusal à 120 c/min, une abrasion de l’onde R en antéro-septal, un aspect QS en apico-latéral. La radiographie pulmonaire (figure 6) a objectivé une cardiomégalie avec un rapport cardio-thoracique à 0,54 ; un débord de l'arc inférieur droit et une surcharge hilaire bilatérale.
Le bilan biologique a comporté :
- un ionogramme sanguin qui était normal - des hémocultures qui sont restées négatives. - un TCA spontanément allongé.
- un bilan inflammatoire perturbé, avec une VS à 43 mm, une CRP à 28 mg/1, et une anémie inflammatoire (Hb= 11,2 g/d1).
L'échocardiographie transthoracique (ETT) a objectivé des valves
d’échostructure et de cinétique normales avec présence d’une masse échogène, mobile mesurant 22 mm de longueur adhérant au bout distal du versant
Manifestations cardiaques du SAPL 26 une dilatation ventriculaire gauche (68 mm de diamètre télédiastolique) avec une akinésie antéroseptale (figure 7) et une altération de la fonction systolique: fraction d’éjection calculée au Simpson à 30% ; Le doppler a mis en évidence une insuffisance mitrale minime.
La recherche d'une porte d'entrée infectieuse est restée négative : ECBU, examens gynécologique, buccodentaire et ORL.
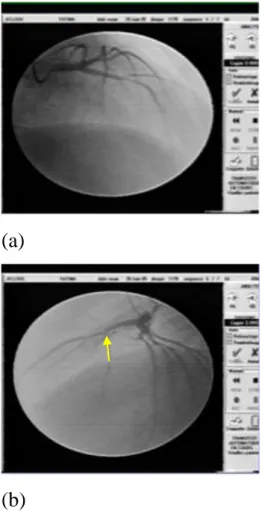
Le bilan a été complété par une coronarographie (figures 8,9) qui a révélé une sténose serrée de 1'interventriculaire antérieure moyenne.
Un bilan de thrombophilie a été réalisé. La recherche des LA réalisée à 6 semaines d'intervalle était positive.
La recherche des aCL était négative.
L’examen à J8 de l’hospitalisation a noté une diminution du poul pédieux gauche. L’échodoppler demandé en urgence a mit en évidence une oblitération de l'artère poplitée gauche. Parallèlement le contrôle échocardiographique (figure 10) a montré la disparition de la masse valvulaire dévoilant l’existence d'un petit nodule hyperdense au bout distal de la grande valve.
La patiente a été mise, en plus des bêtabloquants et IEC, sous héparine (avec relais par les AVK) et anti-agrégants plaquettaires.
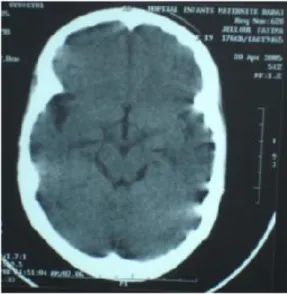
La patiente a également fait l’objet d’une TDM cérébrale (figure 11) qui a révélé la présence d'une zone d'ischémie dans la région insulaire gauche.
L'évolution a été marquée par la survenue de poussées d'insuffisance cardiaque globale ayant nécessité des hospitalisations itératives.
La patiente est décédée 9 mois plus tard dans un tableau d’insuffisance cardiaque réfractaire.
Manifestations cardiaques du SAPL 27
DI DII DII aVF aVR aVL V1 V2 V3 V4 V5 V6
Fig.5 : ECG à l’admission: rythme régulier sinusal à 120 c/min, abrasion de l’onde R en antéro-septal et aspect QS en apico-latéral.
Fig.6 : Radiographie pulmonaire de face à l’admission montrant une cardiomégalie V1 (rapport cardio-thoracique à 0,54), un débord de l'arc inférieur droit et une surcharge hilaire bilatérale.
Manifestations cardiaques du SAPL 28
(a) (b)
Fig.7 : Echocardiographie trans-thoracique en incidence parasternale grand axe: masse échogène mesurant 22 mm de grand axe adhérant au versant auriculaire du bout distal de la GVM : (a) image en systole (b) image en diastole
Manifestations cardiaques du SAPL 29 (a)
(b)
Figure n°.8 : Réseau coronaire gauche en incidence oblique antérieure droite crâniale (a) et en incidence profil gauche (b) mettant en évidence une sténose serrée de
1'interventriculaire antérieure moyenne.
Figure n° 9 : Artère coronaire droite d’aspect normal en incidence face crâniale.
Manifestations cardiaques du SAPL 30
(a) (b)
Figure n°10 : Echocardiographie transthoracique en incidence parasternale grand axe montrant la disparition de la masse valvulaire et l’épaississement du bout distal de la GVM. (a) image en diastole (b) image en systole
Manifestations cardiaques du SAPL 31
Figure n°11: Scanner cérébral montrant une hypodensité intéressant la région insulaire gauche.
Manifestations cardiaques du SAPL 32
3)
TROISIÈME OBSERVATION
La troisième observation est celle d’une patiente de 28 ans (Mme S.N.), mère de trois enfants, hospitalisée en octobre 2002 pour bilan d’un accident vasculaire cérébral ischémique (AVCI).
La patiente avait présenté un an auparavant un AIT à type de monoparésie gauche. Elle n’avait pas d’antécédents pathologiques et notamment pas de notion d’avortements à répétition.
24h avant son admission, elle a présenté une hémiparésie gauche avec aphasie et participation faciale. La TDM cérébrale a confirmé la présence d’un AVC
temporo-pariétal droit récent et a également objectivé une lésion ischémique séquellaire capsulo-lenticulaire gauche (figure 15).
L’examen à l’admission dans le service a trouvé une patiente consciente, bien orientée dans le temps et dans l’espace, en bon état hémodynamique (TA à 100/60 mmHg, FC à 80 b/min). L’examen cardio-vasculaire était normal. L’examen neurologique a retrouvé une diminution de la motricité avec conservation de la sensibilité au niveau de l’hémicorps gauche.
L’ECG a montré un RRS à 75 c/ min, un axe QRS en DII, avec quelques ESV à type de retard droit, sans anomalie du QRS ni de troubles de la repolarisation (figure 12).
La radiographie du thorax était normale (figure 13).
L’ETT a révélé l’existence d’un anévrysme du segment apical de la paroi inféro-latérale avec thrombus apical adhérent. Le VG était par ailleurs de taille normale avec une altération modérée de la fonction systolique (FE= 51%).
Manifestations cardiaques du SAPL 33 Le bilan biologique (NFS, ionogramme, TP et INR) était normal. La sérologie syphilitique était dissociée. Les anti-phospholipides étaient positifs.
Le bilan a été complété par une coronarographie qui était normale (figures 16, 17).
La patiente a été mise sous héparine avec relais par les AVK (INR cible à 2,5), IEC et oxygénateurs cérébraux.
L’évolution a été marquée par la régression progressive du déficit moteur, et la disparition du thrombus apical sur les échocardiographies de contrôle (figure 14).
Trois ans plus tard, suite à un arrêt prolongé des AVK, la patiente a présenté un déficit droit avec convulsions généralisées et troubles de la conscience. La TDM cérébrale a mis en évidence un nouvel AVCI étendu au niveau du territoire
profond de la sylvienne gauche avec de multiples lésions séquellaires.
Il n’y avait pas de thrombus visible à l’ETT. La patiente est décédée deux jours plus tard.
Manifestations cardiaques du SAPL 34
aVF aVR aVL DI DII DII
V1 V2 V3 V4 V5 V6
Figure n°.12: ECG montrant un rythme régulier sinusal à 75 cycles/min, un axe QRS en D2, un PR à 0.16s, sans anomalie du QRS ni troubles de repolarisation.
Manifestations cardiaques du SAPL 35 Fig.13: Radiographie thoracique de face: normale.
Manifestations cardiaques du SAPL 36 (a) (b) Figure n°14 : Echocardiographie transthoracique en incidence parasternale grand axe (a) et en incidence apicale des 4 cavités (b) montrant l’anévrysme apical.
Manifestations cardiaques du SAPL 37
Figure n° 15 : TDM cérébrale à l’admission en 2002: AVCI temporo- pariétal droit récent avec lésion ischémique séquellaire
Manifestations cardiaques du SAPL 38
(a) (b)
Figure n° 16 : Réseau coronaire gauche normal en incidence OAG crâniale (a) et OAD crâniale (b)
Manifestations cardiaques du SAPL 39
discussion et
revue de la
littérature
I. ÉPIDÉMIOLOGIE
Le SAPL est observé chez 20 à 30% des patients présentant un lupus. En revanche, il est beaucoup plus difficile d’estimer la prévalence du SAPL
Manifestations cardiaques du SAPL 40 primaire car elle est directement liée aux performances du test de détection des aPL utilisé.
Le SAPL, même primaire, est essentiellement féminin. Il touche des sujets dont l’âge moyen est nettement inférieur à 45 ans. Nos observations rejoignent les données de la littérature puisqu’elles concernent des patientes dont l’âge est inférieur à 28 ans. Dans certains cas, il s’agit même d’enfants, chez qui le diagnostic est souvent particulièrement difficile.
Des formes familiales ont été décrites sans que l’on puisse identifier des gènes candidats majeurs [23]. Néanmoins, cette prédisposition génétique semble liée à l’antigène HLA-DR4 DRB1*0301(DR7) et 0302 dans le SAPL primaire et à l’antigène DR4, DR7 et DQB1*0301,0302 et 0303 dans le SAPL associé au lupus.
Au cours du lupus, la prévalence du LA est d’environ 15 à 20% [24]
, et celle des aCL de 12 à 45%.
Certains patients présentent des aPL sans conséquence clinique. Cependant, dans la cohorte prospective de Baltimore, la présence d’un LA est prédictive tant de la survenue d’une première thrombose veineuse que d’un événement artériel, notamment coronarien [25].
Les manifestations vasculaires du SAPL peuvent toucher tous les organes. Le cœur est par ordre de fréquence, le deuxième territoire atteint après le système nerveux central.
Ainsi, les manifestations cardiaques sont retrouvées chez 40% des patients porteurs de SAPL [53]. La plupart de ces manifestations sont dues à des lésions thrombotiques.
Manifestations cardiaques du SAPL 41
II. ASPECTS CLINIQUES DU SAPL
A. MANIFESTATIONS CARDIAQUES DU SAPL
a) ATTEINTE VALVULAIRE
Les lésions valvulaires les plus fréquentes au cours du SAPL sont à type
d’épaississement diffus des valves avec dysfonction valvulaire (insuffisance ou rarement sténose valvulaire) ou de masses ou végétations (endocardite non infectieuse de Libman-Sacks). Ces lésions hétérogènes spécifiques concernent presque exclusivement le cœur gauche [26]
.
Cette atteinte valvulaire est la manifestation cardiaque la plus fréquente du
SAPL[27,28]; en effet , elle est présente dans 30 à 60 % des cas selon les auteurs
[29-31]
.
Cette fréquence atteint même 82% dans une étude échocardiographique
transoesophagienne menée par Turiel et al. [33] chez 40 patients avec un SAPL primaire.
Ces variations de fréquence tiennent essentiellement à trois facteurs : - l’hétérogénéité des populations étudiées,
- la sensibilité de l’examen échocardiographique utilisé (ETT ou ETO), - les variations des titres d’anticorps retenus pour définir le syndrome.
L'épaississement des feuillets valvulaires est la plus commune lésion détectée par échocardiographie chez les patients avec SAPL primaire ou atteints de LES. L’épaisseur de la valve augmente de 2 à 3 fois ou plus par rapport à la normale [32, 36]. La valve mitrale est la plus fréquemment impliquée, suivi de la valve aortique.
Manifestations cardiaques du SAPL 42 Par ailleurs l’importance de l’épaississement valvulaire semble être corrélée au taux des aCL. Ainsi selon Turiel et al. [33] les patients dont le titre était > 40 GPL avaient une épaisseur de valve mitrale > 3 millimètre.
Ces anomalies valvulaires peuvent ressembler à l’atteinte valvulaire du rhumatisme articulaire aigu (RAA). Cependant plusieurs différences échocardiographiques sont à noter.
Au cours du SAPL, l’épaississement est généralement diffus, et lorsqu’il est localisé, il intéresse essentiellement la partie médiane et basale de la valve. Par ailleurs, l’atteinte de l’appareil sous valvulaire est rarement notée alors qu’au cours du RAA, l’épaississement valvulaire prédomine habituellement au bout distal de la valve, et l’épaississement et la fusion des cordages sont des traits caractéristiques [38].
A noter enfin que pour Quaddoura et al.[37]la lésion caractéristique serait un épaississement nodulaire et surtout symétrique au point de coaptation des feuillets valvulaires comme il était le cas chez notre deuxième patiente. La constatation de cet épaississement devant mener à la réalisation d’investigations plus poussées pour confirmer le diagnostic du SAPL.
La plupart des valves épaissies développent des anomalies hémodynamiques, aussi, rare sont celles dont l'épaississement constitue l’unique lésion.
Ainsi, l’évaluation de nombreuses séries échocardiographiques de patients avec un SAPL primaire indique une prévalence de 32% à 38% d’insuffisance
valvulaire.
Par ailleurs, l'analyse de données provenant de plusieurs études montre que la régurgitation mitrale est la plus fréquente dysfonction valvulaire. Elle s’observe respectivement chez 22% des patients ayant un SAPL primaire et 26% des
Manifestations cardiaques du SAPL 43 patients avec LES. La régurgitation aortique est moins fréquente, survenant respectivement dans 6% et 10% des cas. Les sténoses aortique et mitrale sont rares, et accompagnent habituellement la régurgitation valvulaire.
L’implication des valves droites est également rare, et reflète probablement l’hypertension artérielle pulmonaire secondaire à l’atteinte du cœur gauche. En fait dans de nombreux cas, deux valves ou plus sont impliquées. [38-40]. Bien que plusieurs études aient documenté une association statistiquement significative entre l’atteinte valvulaire et la présence des aPL [34, 35, 40, 41]
, d'autres n'ont trouvé aucune différence significative chez les patients lupiques ayant des aPL positifs et des aPL négatifs [39,42, 43]. Pourtant, une méta-analyse [44] a montré que 48% des patients lupiques qui avaient des aPL positifs présentaient une valvulopathie, versus 21% seulement pour les patients lupiques avec aPL négatifs.
A côté des épaississements valvaires, de nombreux cas cliniques d’endocardite de Libman-Sacks ont été rapportés dans la littérature [44, 45]. Pour certains auteurs
[44]
, elle serait présente chez 10 % des patients atteints de lupus et ou de SAPL. Ici également, les quatre valves peuvent être atteintes, mais la valve mitrale est la plus fréquemment touchée [41,44-47].
La pathogenèse des anomalies valvulaires dans le SAPL n'est pas parfaitement élucidée. La principale étude histo-pathologique réalisée au cours du SAPL primaire [48] et qui a porté sur l’analyse histologique de 18 valves a montré des dépôts de fibrine chez 7 patients, une fibrose et une hyalinisation dans un tiers des cas, des nodules calcifiés et un amas de fibroblastes respectivement 5 et 4 fois, une hyperplasie vasculaire et une thrombose dans 3 cas. Il existe donc une prépondérance de lésions de type fibrosante ou post- inflammatoire.
Manifestations cardiaques du SAPL 44 Ce type de lésion évoque d’avantage une atteinte primitivement immunologique ou inflammatoire (avec éventuellement de la thrombose surajoutée) que
l’évolution histologique de thromboses valvulaires isolées. Par conséquent, comme dans le lupus, il est vraisemblable que les valves soient primitivement lésées par un mécanisme immunologique/inflammatoire favorisant la survenue de thromboses secondaires dues aux aPL[49].
Garcia-Torres et al [22, 50]ont eux avancé l’hypothèse de dommages capillaires endothéliaux intravalvulaires primaires causés par l'interaction des aPL avec les antigènes locaux. Ceux-ci pouvant conduire à des thromboses intracapillaires, une inflammation focale et le développement de fibrose et de lésions
cicatricielles.
Finalement, les deux voies peuvent entraîner des déformations valvulaires qui peuvent être hémodynamiquement significative.
Le suivi évolutif des patients atteints de SAPL est aussi particulièrement intéressant. Les anomalies valvulaires peuvent régresser, rester stables [51] ou progresser plus ou moins rapidement.
Dans le travail de Turiel et al. [52], 56 patients atteints de SAPL avec à l’ETO un épaississement valvulaire dans 61 % des cas et un aspect d’endocardite de Libman-Sacks dans 5 cas, ont été suivis sur une période de 5ans. Au cours du suivi, il a été noté trois décès: une complication hémorragique après
valvuloplastie, un IDM et une défaillance viscérale multiple avec coagulation intravasculaire disséminée [CIVD]. À 5 ans, l’échocardiographie était inchangée chez 30 patients (64 %) et de nouvelles anomalies étaient retrouvées chez 17 patients (36 %). Les patients ayant des titres élevés d’aCL étaient plus à risque de développer de nouvelles lésions cardiaques.
Manifestations cardiaques du SAPL 45 De la même manière, Cervera et al.[53] dans une étude de suivi
échocardiographique à long terme de 61 patients avec LES a confirmé que la présence d’un taux élevé d’aCL type Ig G été associé au développement d’une insuffisance valvulaire sévère.
Enfin, Berkun et al. [128] dans une revue de la littérature a constaté que 6% des patients avec un SAPL associé à une insuffisance mitrale ont évolué vers une insuffisance cardiaque congestive. La moitié d’entre eux a nécessité un remplacement valvulaire mitral.
b) ATTEINTE CORONAIRE
L’IDM est l’expression clinique le plus fréquente de l’atteinte coronaire au cours du SAPL.
En effet, de nombreux cas d’IDM au cours du SAPL ont été rapportés dans la littérature aussi bien dans le SAPL primaire que secondaire [54,56]. Leur
Manifestations cardiaques du SAPL 46 Considéré d’abord comme un mode de révélation exceptionnel [58]
, et de survenue habituellement assez tardive par rapport à la découverte des aPL, l’IDM a pourtant été le symptôme inaugural chez 2,8 % des 1000 patients porteurs de SAPL de la cohorte de « Euro-phospholipid » [55].
Le tableau clinique est habituellement typique cependant il n’est pas rare que ces infarctus soient silencieux [59]. Ainsi, si chez notre première patiente, l’IDM a été révélateur et douloureux, notre deuxième patiente n’a pas présenté de scène infarctoïde.
Plusieurs études ont essayé d’éclaircir la relation entre les aPL et l’IDM. Leur rôle dans la survenue d’un IDM reste controversé.
Dans une étude portant sur 4 081 hommes sains d’âge moyen, Vaarala [54]
et al. ont montré que la présence d’un titre élevé d’aCL était un facteur de risque indépendant de survenue d’un IDM ou d’un décès d’origine cardiaque. Ce risque relatif serait de l’ordre de 2,0. C’est un risque indépendant des facteurs
communs d’athérosclérose comme l’âge, le tabac, la pression artérielle, le taux de LDL ou de high density lipoprotein (HDL).
Certains considèrent même que c’est un facteur de récidive d’IDM. Ainsi, dans l’étude de Hamsten et al. [60]
qui a porté sur 62 patients, âgés de moins de 45 ans, sans lupus ni autre maladie auto-immune cliniquement détectable, les
anticardiolipines de type IgG dosés à 3, 12 et 36 mois après un premier infarctus du myocarde ont été retrouvés chez 21 % des patients. Le taux de récidive
d’accidents cardiovasculaires dans le groupe avec aCL positifs était de 61% alors qu’il ne dépassait pas 25% dans le groupe sans aCL.
Ces données ne font pas l’unanimité des auteurs. Par exemple Stelnes et al. [61]
Manifestations cardiaques du SAPL 47 retrouvé des aPL positifs chez 13,2% des patients, versus 4,4% dans la
population témoin. Mais l’analyse multivariée après ajustement aux facteurs de risque cardiovasculaires majeurs, n’a pas identifié les aPL comme étant un facteur de risque indépendant d’accident vasculaire cérébral, de réinfarctus ou de mortalité.
Sur le plan physiopathologique, les atteintes coronaires observées au cours du SAPL relèvent de deux principaux mécanismes la thrombose et l’athérosclérose accélérée :
l’athérosclérose accélérée : [62]
Il a été retrouvé une corrélation entre le titre des aCL et les anticorps anti-LDL oxydés qui sont considérés comme des marqueurs d’athérosclérose. La présence d’aCL et d’anticorps anti-LDL oxydés semble conférer un risque additif d’IDM. La présence d’anticorps anti-LDL oxydées a pu être confirmée au cours du SAPL primaire ou secondaire soulignant l’importance des phénomènes d’athérosclérose chez ces patients. Ces phénomènes sont vraisemblablement secondaires à la réaction croisée entre aCL et anti-LDL oxydées, à
l’internalisation des LDL oxydées en présence d’anticorps antiβ2-GP1 et aux immuns complexes formés qui sont, eux aussi, internalisés par les macrophages dans la paroi endothéliale, aggravant le développement de la plaque d’athérome. Par ailleurs, en particulier au cours du LES, des anticorps anti-HDL ont pu être mis en évidence [63]. Leur titre est inversement corrélé à l’activité de la
paraoxonase, enzyme diminuant la peroxydation lipidique et donc la formation de la plaque d’athérome. L’activité de cette enzyme est abaissée chez les
Manifestations cardiaques du SAPL 48 secondaire [63]. De plus, au cours du LES avec aPL, on note un profil
proathérogène associant une baisse duHDL-cholestérol et de l’apolipoprotéine A1 qui est vraisemblablement lié à une activité anti-HDL et anti-ApoA1 des aCL [64,29].
Enfin, certaines études ont démontré que les aPL ont un rôle athérogène propre et qu’il ne sont pas seulement un épiphénomène ; et cela par le biais de
l’oxydation des LDL et de leur accumulation dans la paroi artérielle, ainsi que par le développement d’une inflammation chronique [69-71]
.
la thrombose :
On observe dans ces cas [65-67] soit des thromboses localisées des gros troncs coronaires, soit des microthromboses mises en évidence par les études
autopsiques [68], mais également retrouvées sur des biopsies endomyocardiques comme l’a montré Kattwinkel [67]
.
Dans notre travail les coronarographies de la première et de la troisième patiente étaient normales, mais vu que l’examen a été réalisé à distance de la phase
aigue, il nous est difficile d’avancer l’hypothèse d’une atteinte de la
microcirculation et d’écarter complètement la possibilité d’une thrombose d’un gros tronc coronaire reperméabilisé comme il était le cas dans le travail de Raddino [72]. Chez la seconde patiente, la coronarographie a révélé une lésion serrée du segment moyen de l’IVA qui pourrait être due à un athérome accéléré mais face au contexte clinique, la possibilité d’un thrombus organisé n’est pas à écarter.
Certaines auteurs suggèrent que le SAPL n’est pas suffisant à lui seul pour causer des thromboses [112], mais plutôt son association à des circonstances
Manifestations cardiaques du SAPL 49 favorisantes: thrombopénie induite à l’héparine, certains médicaments, le post-partum comme il était le cas chez nos deux premières patientes.
Enfin, il faut rappeler qu’une élévation du taux d’aCL peut s’observer au décours d’un IDM. Ainsi, les aPL sont retrouvés chez 5 à 15% des patients présentant un IDM [53]. Cette élévation se fait suite à l’exposition d’antigènes phospholipides endothéliaux ou myocardiques (les fibres musculaires sont riches en mitochondries dont la membrane interne contient de la cardiolipine).
Cependant cette augmentation n’a pas d’incidence pronostique en raison soit du taux qui reste faible n’atteignant pas le seuil considéré habituellement comme significatif, soit du fait d’un idiotype particulier ou de la non- dépendance à la β2-GPI (seuls les anticardiolipines ayant comme cofacteur la β2- GPI seraient pathogènes).
À coté des atteintes coronaires aigues, le SAPL peut être à l’origine d’une
insuffisance coronarienne chronique. En effet dans l’étude « Euro-APS» portant sur 1 000 sujets, les signes d’angor étaient retrouvés chez 2,7 % des patients [55]
.
Occlusion des greffons après pontage coronaire et resténose après angioplastie coronaire (PTCA)
L’occlusion précoce des greffons (10-20%) semble être due à des facteurs techniques et hémodynamiques incluant le calibre du greffon, une anastomose imparfaite et un mauvais lit d’aval.
Cependant Bick et al. [73] a constaté qu'un pourcentage très élevé de jeunes patients (ceux âgés de moins de 50 ans) qui ont été victime d’un IDM aigu ou
Manifestations cardiaques du SAPL 50 qui ont présenté une resténose après angioplastie coronaire (ACTP) ou après pontage aorto-coronaire ont des aCL positifs.
Dans une autre étude, Gavaghan et al. [74] a constaté que 33% des patients qui ont présentés une occlusion tardive du greffon après chirurgie de pontage
coronaire avaient des aCL positifs en préopératoire. Des résultats similaires ont été rapportés par Morton et al. [75], dans une série de 83 patients ayant subi un pontage aorto-coronaire.Ces données suggèrent fortement l'existence d'une association entre l'occlusion du greffon et les aPL.
Concernant la resténose après angioplastie, les études les plus intéressantes sont celles d’Eber et Ludia. Pour Eber et al. [76]
, dans une série de 65 hommes ayant une coronaropathie traitée par ACTP, les patients avec resténose avaient un taux élevé d’aCL à type d’IgM.
Ludia et al. [77] ont analysé la fréquence de resténose chez 60 coronariens qui ont fait l’objet d’un dosage des aPL avant angioplastie. Les aPL ont été retrouvés chez 15 patients, et la resténose a été observée chez 13 patients. Parmi ces derniers, 7 avaient des aPL négatifs et 6 avaient des aPL positifs. Par ailleurs la resténose était précoce dans le groupe de patients avec aPL positifs.
c) THROMBUS INTRACARDIAQUE
Si des thromboses artérielles ou veineuses périphériques sont fréquentes dans le SAPL, les thromboses intra-cardiaques sont plus rarement décrites [81,82]. En effet, c’est une manifestation rare, rapportée dans seulement 0,4 % des cas dans l’étude « Euro-APS » [55]
Manifestations cardiaques du SAPL 51 Leur recherche doit être systématique au cours du SAPL. D'autre part, le
diagnostic de SAPL doit être évoqué chez les patients présentant un thrombus intracardiaque sans cardiopathie sous-jacente.
Les différentes cavités peuvent être concernées, mais la localisation préférentielle est auriculaire droite [26].
Par ailleurs, les thrombus du cœur gauche se compliquent souvent d’AVC [26]. Ce qui a été constaté chez notre seconde patiente qui a présenté des
complications emboliques à type d’AVCI insulaire gauche mais aussi d’ischémie du membre inférieur gauche.
Les thrombus des oreillettes posent le problème du diagnostic différentiel avec les myxomes. D’autant plus que les caractéristiques en faveur du processus thrombotique; qui sont la présence de calcifications et l’existence de masses multiples, peuvent se rencontrer dans certains myxomes [83].Il peut être
impossible de les différencier : dans ce cas, l’imagerie par résonance magnétique (IRM) cardiaque est utile. Après injection de gadolinium, le
myxome se rehausse en T2 habituellement, alors que le thrombus non.[62]
Notre troisième patiente avait un thrombus intraventriculaire gauche qui était dû essentiellement à l’existence d’un anévrysme pariétal, mais la présence des aPL pourrait également avoir favorisé la formation du thrombus.
Par ailleurs la pathogénie de la formation d’un thrombus intra cavitaire est inconnue; il peut résulter de la propagation d’une thrombose veineuse distale
[84]
, la surface endocardique peut également être un site propice à la formation d’un thrombus chez les patients porteurs aPL [85]. C’est le cas de notre deuxième
patiente dont le point d’appel à la thrombose auriculaire gauche est probablement l’épaississement du bout distal de la grande valve mitrale.
Manifestations cardiaques du SAPL 52
D) DYSFONCTION VENTRICULAIRE
Fonction systolique
L’atteinte myocardique a été récemment documentée chez les malades avec SAPL. Parmi les 75 patients lupiques étudiés par Leung et al. [46], 5 avaient une dysfonction ventriculaire gauche isolée dont 4 avaient un taux élevé d’aPL; cette dysfonction était globale dans deux cas et segmentaire chez les deux autres [46]. Dans l’étude échocardiographique de Nihoyannopoulos et al. [40]
, seuls les patients avec des aCL positifs (10% des patients) avaient une dysfonction myocardique globale ou segmentaire.
En l’absence de cause spécifique, la dysfonction ventriculaire gauche reste rare
[86]
. Des microthromboses myocardiques répétées ou des lésions endothéliales pourraient être à l’origine de ces dysfonctions [40]
. Fonction diastolique
Au cours du SAPL primaire, il existe aussi des anomalies de la fonction diastolique du ventricule gauche. Cependant, ces résultats doivent être
considérés avec prudence, d’autres facteurs confondants existent que ce soit les valvulopathies associées ou l’ischémie coronarienne.
Fonction ventriculaire droite
Tektonidou et al. en 2001[87] soulignent que les patients porteurs d’un SAPL primaire ou secondaire au LES ont une altération significative de la fonction diastolique du ventricule droit, en particulier pour le SAPL primaire. De plus, l’ancienneté du SAPL, la présence d’une hypertension pulmonaire, le titred’aCL
Manifestations cardiaques du SAPL 53 IgG sont corrélés positivement à l’altération de la fonction diastolique du
ventricule droit.
E) ATTEINTE PÉRICARDIQUE
L’atteinte péricardique clinique ne semble pas une donnée caractéristique du SAPL et n’a rien de spécifique. En effet Leung et al. [46]
ont trouvé des
anomalies péricardiques chez 37 % de patients atteints de lupus sans différence, selon que des aPL étaient présents ou absents.
Par contre Nihoyoannopoulos et al. [40] observent que, environ 20 % de patients ayant un lupus ont des signes échographiques d’atteinte péricardique et que ces atteintes péricardiques sont plus fréquentes chez les patients avec un taux élevé des aCL.
F) HYPERTENSION ARTÉRIELLE ET SAPL
L’existence d’une hypertension artérielle systémique est parfois rapportée au cours du SAPL [88], mais sa pathogénie n’a été que rarement discutée. Deux mécanismes principaux sont évoqués: les thromboses des artères rénales ou bien des microthrombi au niveau des vaisseaux glomérulaires et néphroangiosclérose.
g) HYPERTENSION ARTÉRIELLE PULMONAIRE (HTAP) [62]
La fréquence de l’hypertension pulmonaire est estimée à 1,8 % du SAPL secondaire au LES et à 3,5 % du SAPL primaire. Cette fréquence est de 2,2 % dans l’étude « Euro-APS » [55]. Il s’agit le plus souvent d’une hypertension
Manifestations cardiaques du SAPL 54 d’une hypertension pulmonaire post-embolique varie entre 10 et 20 %. Au cours du LES, l’hypertension pulmonaire est significativement associée aux aPL [89]
. De plus, ces aPL ne semblent pas être simplement satellites de l’hypertension pulmonaire comme le suggère leur fréquence bien plus élevée en présence d’une hypertension pulmonaire post-embolique qu’en présence d’une HTAP
idiopathique. Plus rarement, une hypertension artérielle portopulmonaire ou une hypertension pulmonaire par maladie veino-occlusive peut aussi survenir chez des patients ayant des aPL [90]. Le sombre pronostic des hypertensions
pulmonaires post-emboliques observées au cours du SAPL nécessite une forte anticoagulation (INR ≥ 3).
B. AUTRES MANIFESTATIONS CLINIQUES DU SAPL
1/ LES THROMBOSES VEINEUSES ET ARTERIELLES [91]
Le SAPL se caractérise par des thromboses qui peuvent toucher tous les
vaisseaux sanguins : les artères, les capillaires ou les veines, quelle que soit leur taille et leur topographie. Ces thromboses sont généralement « spontanées », sans aucune anomalie de la paroi des vaisseaux, ce qui permet de les distinguer des thromboses qui compliquent les vascularites.
Les thromboses veineuses sont plus fréquentes et touchent surtout les veines des membres inférieurs, mais presque toutes les localisations sont possibles : veines rénales, veines porte et sous hépatiques, veines
mésentériques, veines caves inférieur et supérieure, veines pulmonaires, veines cérébrales et superficielles. Ces complications veineuses souvent récidivantes peuvent se compliquer d’embolies pulmonaires mortelles.
Manifestations cardiaques du SAPL 55 Les thromboses artérielles sont moins fréquentes, mais toutes aussi
polymorphes, touchant presque tous les territoires en particulier les coronaires, les artères mésentériques, rétiniennes, rénales, hépatiques. Les manifestations cliniques du SAPL dépendent donc directement de la localisation (unique ou multiple) de ces thromboses. Cela explique l’étonnant polymorphisme des manifestations décrites dans la littérature.
2/ LES ASPECTS OBSTETRICAUX DU SAPL [92]
Les complications obstétricales sont à l’origine de la description historique du SAPL. Ces complications s’observent dans le SAPL primaire et secondaire. On peut considérer que près de 10 % des pertes fœtales répétées sont liées à un SAPL. Trois aspects différents peuvent être considérés comme la conséquence de ce syndrome (voir la classification de Sydney tableau II).
Ces morts fœtales, qui peuvent survenir à différents moments de la grossesse, semblent essentiellement liées à la survenue d’infarctus placentaires. Ces lésions sont essentiellement la conséquence des aPL dirigés contre l’annexine V qui est un anticoagulant naturel présent en forte concentration dans le cordon et le placenta.
Chez la mère, les risques thrombotiques de la grossesse et du post-partum sont plus importants. Plus exceptionnellement, il est observé des thromboses des gros vaisseaux fœtaux artérioveineux car les aPL d’isotype IgG peuvent traverser le placenta.
3/ LES MANIFESTATIONS NEUROLOGIQUES SONT ASSEZ FRÉQUENTES
Manifestations cardiaques du SAPL 56 Les signes cliniques sont habituellement la conséquence d’accidents
ischémiques constitués, rarement massifs, souvent limités, touchant généralement le territoire de l’artère sylvienne [93]
. Ce qui est le cas chez notre patiente n°3 qui a présenté un AVCI récidivant intéressant le territoire profond de la sylvienne gauche. En revanche, les thromboses veineuses sont assez rares. La répétition de ces accidents ischémiques peut mener à des syndromes
démentiels irréversibles ou des affections démyélinisantes de type sclérose en plaques.
D’autres manifestations neurologiques sont vraisemblablement la conséquence d’un SAPL. La chorée, l’épilepsie, la myélite transverse sont statistiquement associées à la présence d’aPL au cours du lupus, mais leur mécanisme n’est pas univoque [94-97].
D’autres manifestations, comme les troubles psychiatriques, les surdités brusques, la migraine ou les neuropathies périphériques sont citées, mais leur relation avec le SAPL n’est pas établie [98-101]
.
Sur une étude récente, il a été démontré une association fortement significative entre les manifestations du système nerveux central et l’atteinte valvulaire. Cette dernière constitue un facteur de risque de la première [102].
Manifestations cardiaques du SAPL 57
4/ LES MANIFESTATIONS DERMATOLOGIQUES PEUVENT ÊTRE ÉVOCATRICES
La manifestation dermatologique la plus connue est le livedo qui est statistiquement associé à la présence d’aPL au cours du lupus [103]
. Quand ce livedo s’associe à des lésions ischémiques cérébrales, il définit le syndrome de Sneddon qui s’associe à des aPL dans 30 à 40 % des cas (Figure 18) [104]
Manifestations cardiaques du SAPL 58
D’autres manifestations cutanées sont possibles, en particulier des ulcérations cutanées postphlébites superficielles (Figure 19), des nécroses distales,
parfois des hémorragies en flammèches sous-unguéales qui sont évocatrices du SAPL, mais pas totalement spécifiques (Figures 20 et 21) [105].
Figure 18 : Livedo d’un syndrome de Sneddon associé à des
anticardiolipines
Figure 19 : Ulcère post-phlébitique compliquant un syndrome des antiphospholipides
Manifestations cardiaques du SAPL 59
5/ LE SAPL DOIT ÊTRE ÉVOQUÉ EN CAS D’INSUFFISANCE RÉNALE INEXPLIQUÉE
Les thromboses peuvent toucher tous les vaisseaux rénaux, en particulier l’artère ou la veine rénale, mais également les artérioles et les capillaires glomérulaires
[106, 107]
. Le tableau clinique est souvent trompeur, dominé généralement
par une hypertension rénovasculaire compliquée d’une insuffisance rénale de gravité et d’évolutivité variables. Seule la biopsie rénale permet de confirmer le diagnostic.
Figure 20 :
Hémorragies sous-unguéales “en flammèches”associées à un syndrome des antiphospholipides
Figure 21 : nécrose cutanée du menton chez une patiente révélant un SAPL primaire.
Manifestations cardiaques du SAPL 60
6/ LES COMPLICATIONS RESPIRATOIRES SONT PARFOIS SÉVÈRES
Au cours du SAPL, les embolies pulmonaires sont responsables de 4 à 10 % de la mortalité. Cette complication, parfois révélatrice, peut être de diagnostic difficile. Elle se manifeste parfois par de petits embols itératifs responsables de douleurs intermittentes ou d’épanchements pleuraux fugaces [108]
. Le SAPL pourrait être également responsable d’HTAP apparemment primitive [109]
.
7/ LES MANIFESTATIONS DIGESTIVES ET HÉPATIQUES SONT RARES, MAIS DOIVENT ÊTRE RECHERCHÉES
Les manifestations hépatiques sont rares et parfois sévères, comme la thrombose des veines sus-hépatiques responsable du syndrome de Budd-Chiari. Des
infarctus hépatiques ou des thromboses de la veine porte ont été décrits [110]. Parfois il s’agit de lésions microthrombotiques ou vasculaires intrahépatiques qui se révèlent par une maladie veino-occlusive ou une hyperplasie nodulaire régénérative. Ces différentes complications peuvent être responsables
d’une hypertension portale révélée par une splénomégalie. Plus rarement, il a été observé des thromboses veineuses et artérielles intestinales responsables souvent de tableaux bâtards avec des douleurs et des troubles du transit chroniques [91].
8/ LES COMPLICATIONS HÉMATOLOGIQUES SONT POSSIBLES
Le SAPL, qu’il soit primaire ou associé à un lupus, peut être révélé par une thrombopénie habituellement modérée (50 à 100 000/ml). Dans la plupart des cas, il s’agit d’une thrombopénie périphérique liée à des auto-anticorps
Manifestations cardiaques du SAPL 61 antiglycoprotéines plaquettaires (surtout anti-IIbIIIa). D’autres mécanismes sont possibles comme l’illustrent de rares observations de microangiopathies caractérisées par une consommation plaquettaire par de multiples
microthrombus périphériques. Plus rarement, elle peut être la conséquence d’un hypersplénisme, d’une hypertension portale secondaire à des thromboses hépatiques. L’anémie hémolytique semble très rare dans le SAPL primaire, mais plus fréquente dans la forme associée au lupus [91].
9/ LES COMPLICATIONS ENDOCRINIENNES SONT RARES, MAIS ORIGINALES
Elles se manifestent par une insuffisance surrénale aiguë souvent post-opératoire résultant d’un infarctus veineux surrénal bilatéral. Les autres complications endocriniennes sont exceptionnelles ; elles sont surtout caractérisées par des atteintes ischémiques hypophysaires et/ou hypothalamiques [91].
10/ LES COMPLICATIONS OSTÉO-ARTICULAIRES SONT DOMINÉES PAR LES OSTÉONÈCROSES ASEPTIQUES
Il s’agit d’ostéonécroses aseptiques épiphysaires surtout fémorales qui
compliquent surtout le SAPL associé au lupus. Ces complications sont très rares dans le SAPL primaire, ce qui suggère le rôle de facteur associé comme les corticoïdes, souvent utilisés dans le lupus. Plus rarement, il s’agit de nécrose osseuse plus étendue [111].
Manifestations cardiaques du SAPL 62
11/ LE SYNDROME « CATASTROPHIQUE » DES ANTIPHOSPHOLIPIDES
Chez la plupart des patients, les manifestations thrombotiques surviennent isolément. Les récurrences peuvent survenir plusieurs mois ou années après l’épisode initial. Cependant, certains patients peuvent présenter de multiples thromboses simultanées conduisant parfois au décès [112].
Ce syndrome, appelé « syndrome catastrophique des aPL », est défini par l’atteinte d’au moins trois organes sur une période de quelques jours ou
semaines avec la preuve histologique de multiples occlusions des vaisseaux de petit et gros calibre [111]. Il s’agit généralement d’une atteinte presque
exclusivement microcirculatoire. Le diagnostic est difficile en raison de la multitude des diagnostics différentiels (microangiopathie thrombotique, coagulation intravasculaire disséminée, embolie de cholestérol, syndrome thrombotique thrombopénique induit par l’héparine…).
La connaissance de ce diagnostic exceptionnel est impérative, car elle justifie une prise en charge thérapeutique urgente (plasmaphérèses). Malgré cela, la mortalité est de près de 50 %[111].
Manifestations cardiaques du SAPL 63
III.
ASPECTS BIOLOGIQUES DU SAPL A/ OUTILS DIAGNOSTIQUES DU SAPLL’exploration d’un SAPL, nécessite dans un premier temps, la recherche de deux critères biologiques: lupus anticoagulant ou LA et anticorps
anticardiolipines ou aCL.
1) LUPUS ANTICOAGULANT (LA)
Le terme « lupus anticoagulant » fait référence d’une part à l’activité
anticoagulante in vitro de ces anticorps, d’autre part au fait qu’ils ont été décrits pour la première fois chez des patients lupiques. Ces anticorps sont mis en évidence par une combinaison de tests de coagulation afin d’augmenter la sensibilité et la spécificité [114].
La présence d’un LA dans un plasma est suspectée sur l’allongement d’un temps de coagulation phospholipides-dépendant. Il peut s’agir d’un déficit en facteur de coagulation ou de la présence d’un anticorps (inhibiteur), qui est soit de type aPL, soit dirigé contre un facteur de coagulation. La présence d’un inhibiteur est démontrée par l’étude de mélanges de plasmas (malade + témoin). Il est
recommandé d’utiliser au minimum deux tests de coagulation [104]
.
Le test le plus employé est le TCA, avec des résultats exprimés en indice de Rosner. Ce dernier se calcule par A – B ÷ C × 100,
où A représente le temps de mélange de plasmas à volume égal, B celui du plasma témoin et C celui du malade.
Manifestations cardiaques du SAPL 64 Piette et al. [24] proposent d’étudier le TTD (temps de thromboplastine diluée au 1/500) si le LA n’est pas détecté par le TCA. Il est positif si le rapport temps du mélange / temps du témoin est > 1,15.
2) ANTICORPS ANTICARDIOLIPINES (aCL)
Ces anticorps sont recherchés par Elisa, test largement commercialisé, facile d’utilisation et automatisable.
Deux paramètres sont à considérer avec attention [113] :
2-1- L’ISOTYPE
Au cours du SAPL, les aCL sont essentiellement d’isotype IgG. L’isotype IgM est plus rare et presque toujours associé à l’IgG. Lorsqu’il est isolé, sa présence est le plus souvent transitoire et associée à un contexte infectieux ou à la prise de certains médicaments. L’isotype IgA est exceptionnel au cours du SAPL et sa recherche est sans intérêt [113].
2-2- LE TAUX
Selon le consensus international de Sydney 2004, les aCL avec un taux moyen ou élevé sont les plus significatifs du diagnostic de SAPL. Il existe cependant des exceptions à cette règle et c’est la présence des autres anticorps qui va aider au diagnostic [113].
L’absence des aCL n’élimine pas en elle-même le diagnostic puisque 20 à 30 % des patients atteints de SAPL ont un anticoagulant circulant positif et des aCL négatifs [115].
Manifestations cardiaques du SAPL 65
3) ANTICORPS ANTI-β2-GPI
La β2-GPI est le principal cofacteur des aCL. C’est une protéine plasmatique monocaténaire qui a un fort tropisme pour les molécules chargées négativement, en particulier pour les phospholipides anioniques.
Les anti-β2-GPI sont plus étroitement associés aux complications cliniques du SAPL que les aCL eux-même. La β2 - GPI semble même constituer la véritable cible antigénique des aCL pathogènes [118]. Ils ne sont pas encore à ce jour reconnus comme marqueurs diagnostiques du SAPL. Cependant, cela ne saurait tarder du fait de leur grande spécificité et de leur présence isolée chez des
patients présentant les symptômes cliniques caractéristiques du syndrome. Il est même possible dans le futur, que leur recherche, actuellement réservée à des laboratoires spécialisés supplante celle des aCL.
Comme dans le cas des aCL, c’est l’isotype IgG qui devra surtout être
recherché, les cas de patients avec signes évocateurs de SAPL et anti-β2-GPI d’isotype IgM isolés étant exceptionnels [113]
.
Comme pour les aCL, les anti-β2-GPI sont détectés par des tests mmunologiques de type ELISA (Enzyme-Linked Immunosorbent Assay), utilisant des plaques recouvertes de phospholipides, le plus anciennement utilisé étant la cardiolipine. La plupart des laboratoires emploient des kits commerciaux de détection d’aCL. Le résultat est fourni sous forme quantitative, en unités GPL pour les anticorps de classe IgG, et MPL pour ceux de classe IgM. Chaque laboratoire doit
indiquer ses propres normes, la valeur-seuil séparant le normal du pathologique variant en fonction du kit employé.