MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE UNIVERSITE AKLI MOHAND OULHADJ – BOUIRA
FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET DES SCIENCES DE LA TERRE DEPARTEMENT DE BIOLOGIE
Réf : ……./UAMOB/F.SNV.ST/DEP.BIO/2017
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV Filière : Sciences Biologiques.
Spécialité : Biotechnologie microbienne.
Présenté par :
KADDOUR Soumia & IRARI Saida
Thème
Etude de l’effet antibacterien des extraits polyphenoliques de
Juniperus communis et Juniperus phoenicea
Soutenu le : 01 / 07 / 2018
Devant le jury composé de :
Nom et Prénom Grade
Mme. MESSAD Sara MCB Univ. de Bouira présidente Mme. DJOAUHRA-FAHEM Djamila MAA Univ. de Bouira Promotrice Mme .BEN- SMAIL Souhila MAA Univ. de Bouira Co promotrice Mme AIT MIMOUNE Nouara MCB Univ. de Bouira Examinatrice
Année Universitaire : 2017/2018
Remerciements
En premier lieu, je tiens à remercier mon DIEU qui m’a
donné la force pour accomplir ce modeste travail.
Nous tenons à remercier profondément notre promotrice Madame
FAHEM- DJOUAHRA Djamila et notre co-promotrice Madame BEN
SMAIL Souhila pour m’avoir encadrés, en me faisant bénéficier de
leurs connaissances, de leur aide et de leurs conseils.
Nous tenons chaleureusement à remercier Madame MESSAD Sara de
m’avoir fait l’honneur d’accepter de présider le jury et évaluer m travail.
Nous exprimons aussi à remercier Madame AIT MIMOUNE Nouara
d’avoir accepté juger notre travail
Nous tenons à remercier madame MOSRAN Karima pou
leur aide et de leurs conseils.
Dédicace
Je dédie ce modeste travail
A la mémoire de la plus chère au monde,
ma mère
A mon Très chère père qui m’a toujours soutenu, et qu'a été
toujours présent pour moi
À ma grande mère
A mon cher fiancé Ali et ses parents
A mes chères sœurs
A mes chers frères
A mes familles KADDOUR, RABHI et MADANI
A toutes mes amies
A ma collègue saida
A toute personne qui me connait
Dédicaces
Je dédie ce travail à mes chers parents, surtout ma mère, qu’ils
Trouvent ici l’expression de mon affection pour leurs aides et
leurs
Soutiens.
A mes frères et mes sœurs chacun son nom et ses enfants
A ma binôme Soumia
A toutes mes amies
A tous ceux qui me sont chers
A tous ceux qui aiment la science…..
Sommaire
Liste des figures
Liste des tableaux
Liste des abréviations
Introduction
………01Partie I : synthèse bibliographique
Chapitre 1 : Description des plantes étudiées
……….…….02I. Généralité sur le genre Jniperus………..…….02
II. Taxonomie………...02
III. Importance ………..………....02
IV. Juniperus communis ………..…....…....02
IV.1. Répartition géographique……….…...02
IV.2. Caractéristiques botaniques………..…....03
IV.3. Utilisations ..………..…..…04 V. Juniperus phoenicea………..……….…….04 V.1. Répartition géographique ………...…...05 V.2. Caractéristiques botaniques ………...05 V.3. Composition chimique ………....06 V.4. Utilisation ……….…...06
Chapitre II : Les polyphénols
I. Les composés phénoliques ……….………...07II. Classification des composées phénolique………..08
1. Les acides phénolique……….…..08
3. Les anthocyanes ……….…...09
4. Les flavanes ……….…...10
5. Les tannins ………...10
III. Effets biologiques des polyphénols……….…....11
IV. L’activité antimicrobienne des polyphénols…….……12
Chapitre III : Caractéristiques des quelque souches bactériennes utilisées
I. Pseudomonas aeruginosa ………...13II. Staphylococcus aureus……….14
III. Escherichia coli………...14
IV. Enterococcus faecalis ………...15
Partie II : étude expérimental
I.Matériels et Méthodes
………161. Matériels ……….………...16
1.1. Matériel biologique ……….16
1.1.1. Le matériel végétal ………..………16
1.1.2. Souches bactériennes testées ………..………16
1.2. Matériel non biologique .………17
2. Méthodes ………..…………17
2.1. Préparation da la poudre de la plantes ………18
2.2. Screening phytochimique ……… ………19
2.3. Extractions des polyphénols totaux………...21
2.4. Détermination des rendements……… …...22
Sommaire
2.5.1. Préparation des extraits méthanolique………22 2.5.2. Dosage des polyphénols totaux……… ………....22 2.6. Evaluation de l’activité antibactérienne des polyphénols…………..23
II.
Résultats et discussion
………..……….26Conclusion et perspective
………...39Référence bibliographiques
Liste des figures :
Figure 1 : Les feuilles de J .communis………03
Figure 2 : Feuilles et fruits de J. communis………04
Figure 3 : Aspect du genévrier de Phénicie……….04
Figure 4 : Aire de répartition des genévriers du groupe phoenicea ……… ...05
Figure 5 : Feuilles en écailles de J. phoenicea (loupe x20) ……… ...06
Figure 6 : Feuilles et fruits de J. Phoenicea ………06
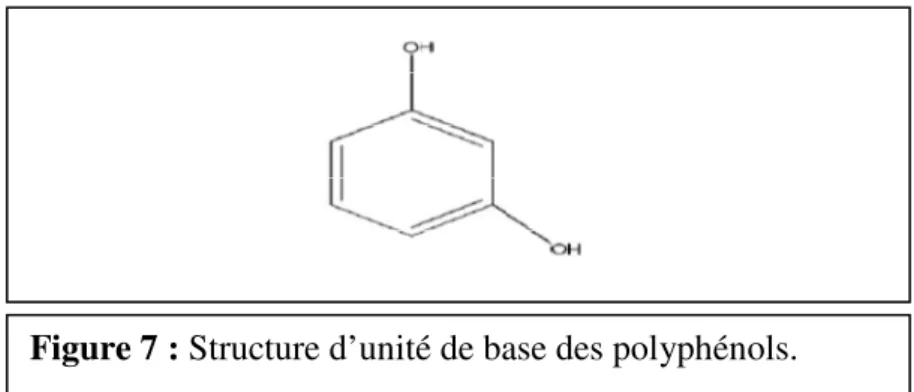
Figure 7 : Structure d’unité de base des polyphénols………..07
Figure 8: Exemple de quelques acides phénols de la série benzoïque………. ..08
Figure 9: Exemple de quelques acides phénols de la série cinnamique………...08
Figure 10 : Structure de base des flavonoïdes………09
Figure 11 : Structure de base des anthocyanes ……….09
Figure 12 : Structure de la catéchine ………...10
Figure 13 : Structure des tanins hydrolysables (Acide Tannique) et leur monomère………..11
Figure 14 : P. aeruginosa au microscope électronique à balayage ………. ….13
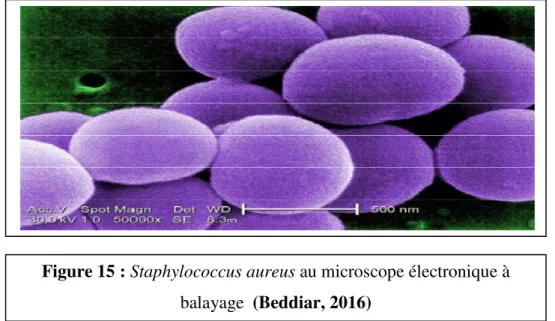
Figure 15 : Staphylococcus aureus au microscope électronique à balayage ………..14
Figure 16 : Escherichia coli sous microscope électronique ………...15
Figure 17 : Enterococcus faecalis (observation par balayage en microscopie électronique)……….15
Figure 18 : Schéma général des différentes étapes du travail………..18
Figure 19 : Aspect de la poudre végétal après le broyage de Juniperus communis et Juniperus phoenicea ………....18
Liste des figures
Figure 21 : Préparation des boites de Petri………24 Figure 22 : Histogramme de rendement d’extraction des polyphénols de
Juniperus communis et Juniperus phoenicea …...29 Figure 23 : courbe d’étalonnage de l’acide gallique pour le dosage des polyphénols totaux………..30
Figure 24 : Histogrammes du teneur des polyphénols totaux de Juniperus communis
et Juniperus phoenicea………31
Figure 25 : Histogrammes des diamètres des zones d’inhibition des extraits
Liste des tableaux
Tableau I : Les souches bactériennes utilisées……… 16 Tableau II : Lecture des résultats de l’activité antimicrobienne.………..25 Tableau III : Résultat du criblage phytochimique Juniperus communis ..………26 Tableau IV : Résultat du criblage phytochimique des extraits de Juniperus phoenicea … 27 Tableau V : Rendement d’extraction des composés phénoliques des deux plantes ………..28 Tableau VI : Les diamètres d’inhibition de déférant concentration de l’extrait
méthanolique de Juniperus communis et Juniperus phoenicea ……….32
Tableau VII : Les photographies des résultats de l’effet antibactérien des extraits
méthanolique de J communis et J phoenicea sur des bactéries Gram positive et Gram négative ………..…..34
Liste des abréviations
Liste des abréviations
ALCl3 : Chlorure d’aluminium
CHCl3 : Chloroforme
d : Diamètre DO : Densité optique
EAG : Equivalant d’acide galique EXT : Extrait
FeCl3 : Chlorure de fer
HCl : Acide chlorydrique I2 : Diiode g : Gramme KI : Iodure de potassium m : Mètre MeOH : Méthanol mg : Milligramme ml : Millilitre Ms : Matière sec Na2CO3 : Carbonates de sodium NH4OH : Ammoniaque nm : Nanomètre
PPT : Teneur de polyphénols totaux R : Rendement
UFC : Unité formant colonie UV : Ultra violet
Depuis des milliers d'années, l'humanité a toujours utilisé diverses plantes trouvées dans son environnement, afin de traiter et soigner toutes sortes de maladies. Ces plantes ont l’aptitude de synthétiser de nombreux composés appelés métabolites secondaires, elles constituent donc un immense réservoir de composés d’une grande diversité chimique, possédant un large éventail d’activités biologiques. Ainsi, l'évaluation de ces activités demeure une tâche très intéressante qui peut faire l'intérêt de nombreuses études (Jaccot et Campillo., 2003).
Actuellement, le développement de la résistance microbienne aux antibiotiques a conduit les chercheurs à puiser dans le monde végétal et particulièrement les plantes médicinales et culinaires en quête de molécules naturelles efficaces et dénuées de tout effet adverse
(Abedini., 2013).
La projection d’extraits de plantes pour l’activité antimicrobienne a montré que les plantes représentent une source potentielle de nouveaux agents anti-infectieux (Achat ,2013). Face à ce constat, il est jugé utile de contribuer à l’étude de l’activité antimicrobienne des extraits de deux plantes Juniperus communis et Juniperus phoenicea.
La présente étude porte sur la récupération des extraits foliaires bruts et une contribution à la mise en évidence de leur composition chimique et leur activité microbiologique.
Le mémoire se structure en deux parties. La première se repartit en trois chapitres.
Le premier est consacré à une étude bibliographique sur les plantes. Le deuxième chapitre traite quelques principes actifs. Le dernier est consacré à la présentation des microorganismes. Le premier chapitre de la deuxième partie illustre les matériels et les méthodes utilisés dans les différentes manipulations. Il a abordé les conditions opératoires employées à l’échelle de laboratoire avec une présentation des techniques d’extraction. Il a traité enfin des protocoles utilisés aux cours des tests microbiologiques. Le deuxième chapitre est consacré aux résultats obtenus accompagnés d’une discussion et ponctués d’une conclusion générale.
Chapitre I Description des plantes étudiées
I. Généralité sur juniperus
Le genévrier est une plante gymnosperme appartenant à l’embranchement des spermaphytes
(Villar, 2011). Le genre Juniperus comprend un grand nombre d’espèces (environ soixante)
avec des variétés rigides aux aiguilles piquantes et des variétés souples aux feuillages en écailles (Mansouri et al., 2010).
Le genévrier constitue une essence forestière dite de protection, il existe en Algérie quatre espèces de genévrier (genévrier de phénicie, genévrier oxycèdre et genévrier thurifère et le genévrier commun appelé Juniperus communis) (Bouyahyaoui, 2017).
II. Taxonomie
Le genre Juniperus appartient au sous embranchement des gymnospermes ; il fait partie de la famille des Cupressaceae ; à l’ordre des Pinales et à la classe des Coniféropsides (Conifères).
(Callen, 1976 ; Debazae, 1991). III. Importance
Les espèces de Juniperus sont généralement utilisées dans la médecine alternative pour le traitement de différentes maladies: les rhumatismes, les maladies inflammatoires, la bronchite, la dysenterie, la gale, les champignons, hémorroïdes, etc.
IV. Juniperus communis
Le genévrier commun est généralement associé à une végétation de zones dégradées ou en évolution (friches, landes, ou pelouses herbeuses) et est très résistant au gibier (Riou-Nivert,
2001). Cette espèce est dioïque, les inflorescences mâles est femelles apparaissent sur des
sujets séparés (Callen, 1976).
IV.1. Répartition géographique
Le genévrier commun est parmi les gymnospermes largement distribué dans l’ holarctique, s’étendant des montagnes circum -Méditerranéen jusqu’à la toundra subarctique. Cette espèce montre une distribution nordique continue en Europe Centrale, mais les populations deviennent progressivement réduites en fragments dans les secteurs de haut-montagne du Bassin méditerranéen (Garcia et al., 2000).
En Algérie, il est abondant sur les crêtes du Djurdjura et plus rare sur les Aurès et Babors, où il se situe à l’étage de la cédraie (Quezel et Gast, 1998).
Cette espèce se développe aux basses altitudes dans des terres de pâturages, des champs abandonnés, mais aussi dans les hautes altitudes, dans les zones sabalpines en montagnes et dans les terres sèches en montagnes circum-Méditerranéennes (Garcia et al., 2000).
IV.2. Caractéristiques botaniques IV.2.1. Feuillages
Totalement aciculaire, feuilles verticillées par trois autour du rameau de 5à 15 mm de longueur sur 1.5 à 2 mm de largeur, la plus grande largeur à la base, rétrécies progressivement vers la points, aigues, rigides, très piquantes, la face supérieure avec deux bandelettes blanchâtres de stomates, très rapprochées, ne paraissent former qu’une seule bandelette médiane, la face inférieure verte et carénée (Debazac, 1991). Les stomates excrètent une fine résine blanche, cette exsudation est si abondante qu’elle couvre toute la surface et cache la nervure (Gaussen, 1968).
IV.2.2. Bourgeons
De très petites dimensions et de couleur verte (Callen, 1976), souvent cachés par touffe d’aiguilles (Riou-Nivert, 2001).
Chapitre I Description des plantes étudiées
IV.2.3. Fruit
C’est une pseudo-baie ou galbule à écailles charnues, de forme sphérique ou ovoïde de 5 à 6 mm de diamètre, vert la première année, violet foncé et noir à maturité la deuxième année
(Callen, 1976).
IV.3. Utilisation
Le genévrier commun est bien documenté dans le domaine de la médecine traditionnelle pour ses valeurs médicinales contre les diarrhées, les douleurs abdominales, les tumeurs, la
bronchite et l'indigestion (Mansouri et al., 2011).
V. Juniperus phoenicea
Le Genévrier de Phénicie ou genévrier rouge (J. phoenicea) (Figure 3) est un arbrisseau touffu ou un arbuste de 1 à 3 m de hauteur mais pouvant atteindre cependant jusqu’à 8 à 10 mètres. (Bouyahyaoui, 2017). Cette espèce est monoique, assez rarement dioïque à feuillage persistant et aromatique (Abdelli ,2017); la floraison a lieu pendant l’hiver et la fructification a la fin de l’été de l’année suivante.
Figure 2 : Feuilles et fruits de J. communis (Enescu et al., 2016)
Autres noms : Genévrier roug
Les provençaux l’appellent « m L’étiquette phoenicea vient du qui décrit la couleur des baies
V.1. La répartition géograph
L’aire de répartition du genév altitude et les formations fores se trouve en circumméditerr subtropicale dans l’océan atla Tunisie, Lybie et Egypte) (Fig En Algérie, il est abondant sur et du constantinois, dans les (régions de Maafa, Beni Fodha
V.2. Caractéristique botaniq
Les feuilles de Juniperus pho imbriquées, opposées, forman années. Le fruit globuleux dev
Figure 4 : Aire de répartition d
uge, Genévrier de Lycie, Araâr (en Arabe), Cad morven » ou genévrier à fruits rouges.
du latin phoenicus qui signifie rouge éclatant s (Abdelli ,2017).
phique
évrier rouge s’intercale entre les formations s restières et préforestières à chêne vert (Manso rranéenne, en Europe méridionale, en tlantique (îles Canaries) et en Afrique du nor igure 4).
ur les hauts plateaux et l’Atlas saharien de l’or es montagnes des Aurès, notamment dans le
hala) (Abdelli ,2017).
ique
hoenicea sont en aiguilles et d’autres en écail ant le feuillage vert persistant de l’arbre a evient rouge et luisant à maturité (figure 5).
n des genévriers du groupe phoenicea (Quezel et M
ade endormi.
nt ou rouge pourpre
steppiques de basse
souri et al., 2010). Il
Asie tempérée et ord (Algérie, Maroc,
oranais, de l’algérois le sud de ce massif
illes très petites, très après les premières
Zones de couverture
Chapitre I Description des plantes étudiées
V.3. Composition chimique
Des études phytochimiques ont montré que l’espèce contient également de la résine, des acides gras, des tanins, des flavonoïdes, des alcaloïdes, des stérols, triterpènes et des glucides
(Abdelli ,2017). V.4. Utilisation
Cette espèce est l’une des plus importantes plantes médicinales du fait qu’elle soit largement employée en médecine traditionnelle.
Les branches feuillées sont exploitées pour la production du goudron végétal pour traiter certains cas d’eczéma et en inhalation contre l’asthme, bronchite, maux de tête, étourdissements et pour contrôler l’arthrite (Abdelli ,2017). Les feuilles sont utilisées sous forme de décoction contre le diabète, la diarrhée et le rhumatisme, alors que les fruits séchés et réduits en poudre peuvent guérir les ulcérations de la peau et les abcès (Mansouri et al.,
2010). De plus, elle possède des propriétés diurétiques mises à profit pour combattre toute
sorte de maladies du système urinaire (infections et inflammations, calculs, goutte, etc.)
(Bouyahyaoui, 2017).
Fig.5 : Feuilles en écailles de J.
phoenicea (Bouyahyaoui, 2017)
Fig.6 : Feuilles et fruits de
À coté des métabolites primaires classiques (glucides, protides et lipides), les végétaux accumulent fréquemment des métabolites dits « secondaires » dont la fonction physiologique n’est pas toujours évidente mais qui représente une source importante de molécules utilisables par l’homme dans des domaines aussi différents que la pharmacologie ou l’agroalimentaire
(Herbert, 1989).
Les métabolites secondaires appartiennent à des groupes chimiques très variés tels les alcaloïdes, les composés phénoliques, etc. (Macheix et al., 2005).
I. Les polyphenols
Comme la majorité des métabolites secondaires, les polyphénols sont des dérivés non azotés
(Ghnimi, 2015) ; synthétisés pour accomplir certaines fonctions lors du développement de la
plante. ils participent aux réactions de défense face à différents stress biotiques (agents pathogènes, blessures, symbiose) ou abiotiques (lumière, rayonnements UV, faible température, carences) (Boubekri ,2014). Ils sont localisés dansdifférentes parties des plantes selon l’espèce végétale et le groupe polyphénolique considéré (Akroum, 2011). Les polyphénols jouent un rôle structural comme la lignine constituant la rigidité du bois
(Ghnimi, 2015). Plus de 8000 structures ont étés identifiées, allant de simples molécules
comme les acides phénoliques à des substances hautement polymérisées comme les tanins
(Boubekri ,2014). Dans les aliments, les polyphénols peuvent donner l'amertume,
astringence, couleur, saveur, odeur et stabilité d'oxydation (Sandru et al., 2016).
II.1. Définition des composés phénoliques
Selon Ghnimi 2015,il existe deux propositions pour définir les polyphénols. La première les définis comme étant une structure moléculaire qui porte plusieurs groupement phénoliques tandis que la deuxième indique la présence d’un groupement phénol polyhydroxylé (Figure7).
Chapitre II Les polyphénols
II. Classification des polyphénols
Selon Akroum 2011, les polyphénoles sont classés en cinq groupes principaux à base de leur
structure.
II.1. Les acides phénols
Ce sont des composés organiques rares dans la nature (Ghnimi, 2015 ; Akroum, 2011) non
flavonoïdes (Boubekri ,2014); possédant au moins une fonction carboxylique et un hydroxyle phénolique (Achat ,2013). Ils sont représentés par deux sous-classes les dérivés de l’acide benzoïque (Les acides hydroxybenzoïques) et de l’acide cinnamique (Acides hydroxycinnamiques) (Rong, 2010).
Exemple : L’acide gallique et l’acide protocatéchique sont produits par hydroxylation de l’acide benzoïque (Ghnimi, 2015) (Figure 8).
Acide p-coumarique et l’acide caféique sont produit par hydroxylation de l’acide cinnamique (figure 9)
Figure 8 : Exemple de quelques acides phénols de la série benzoïque (Boubekri ,2014).
Acide cinnamique Acide p-coumarique Acide caféique
Figure 9 : Exemple de quelques acides phénols de la série cinnamique (Ghnimi, 2015)
1 2
1 : l’acide benzoïque
2 : dérivés de l’acide benzoïque
R1=R2=R4=H, R3=OH Acide p-hydroxybenzoïque R1=R4=H, R2=R3=OH Acide protocaatéchique R1=R4=H, R2=OCH3, R3=OH Acide vanillique R1=H, R2=R3= R4=OH Acide gallique R1=OH, R2=R3= R4=H Acide salicylique
II.2. Les flavonoïdes :
Les flavonoïdes constituent la plus vaste classe de composés phénoliques (Ghnimi, 2015) ; ils assemblent un groupe de plus de 6000 composés naturels qui sont quasiment universels chez les plantes vasculaires. Tous les flavonoïdes possèdent quinze atomes de carbone et une même structure de base formé de 2 noyaux benzéniques A et B reliés par un noyau C qui est un hétérocycle pyranique (Boubekri ,2014) (figure 10) .Ces composés existent sous forme libre dite aglycone ou sous forme d’hétérosides, c'est à- dire liée à des oses et autres substances (Akroum, 2011).
Ils interviennent dans la pigmentation des fleurs et dans les processus de défense contre le rayonnement UV et les attaques microbiennes (Achat ,2013).
II.3. Les anthocyanes
Les anthocyanes (en grec Anthos signifie fleur, et kyanos signifie bleu) (Boubekri ,2014) sont des pigments hydrosolubles qui donnent la plus grande partie des couleurs rouge, violet et bleu observées dans la nature (Ghnimi, 2015). La couleur des anthocyanes dépendent du pH c'est-à-dire dans des conditions acide donnent une coloration rouge et une coloration bleu dans des conditions basique (Rong, 2010; Achat ,2013).
Les anthocyanes sont des flavonoïdes ; ils ont le même nombre de carbone et la même structure de base sauf que les anthocyanes ont une charge positive sur l’oxygène de l’hétérocycle central C (Akroum, 2011). Ils interviennent directement dans les interactions plantes animaux et surtout dans l’attraction des pollinisateurs par la couleur des fleurs
(Buchanan et al., 2000).
Figure 10 : structure de base des flavonoïdes (Achat ,2013)
Chapitre II Les polyphénols
II.4. Les flavanes
Les flavanes sont sous forme de monomères (ex : la catéchine) ou sous forme de polymères (dimères, trimères…de catéchine) (Akroum, 2011). Ce sont des composés dont l’hétérocycle central C est saturé et qui n’ont pas de fonction cétone (Ghnimi, 2015).
II.5. Les tannins
Les tannins sont appelés aussi les polyphénols complexes ; ils représentent une classe très importante de polyphénols localisés dans les vacuoles, Ces substances ont en effet la propriété de se combiner aux protéines (Achat , 2013 ;Boubekri , 2014).
Les tannins se divisent selon leur structure en deux groupes principaux : tanins hydrolysables (ce sont des esters du D-glucose et de l’acide gallique ou de ses dérivés ; un glucose se lie à plusieurs molécules d'acide gallique) (figure 13) et tannins condensés (proanthocyanidines : des polyphénols hétérogènes, sous forme des polymères constitués d’unités flavane reliées par des liaisons entre les carbones C4 et C8 ou C4 et C6) (Boubekri, 2014).
Les tannins présentent des propriétés antioxydants, antibactériennes, antifongiques et antivirales (Ghnimi, 2015).
III. Effets biologiques des polyphénols
Les recherches récentes sur les composés phénoliques en générale et les flavonoïdes en particulier sont très poussées en raison de leurs divers propriétés physiologiques comme les activités antiallergique, anti-inflammatoire, hépatoprotective, antimicrobienne, antivirale, et d’autre activité(Middleton et al., 2000; Ksouri et al., 2007).
Les effets bénéfiques des polyphénols intéressent particulièrement deux domaines: la phytothérapie et l’hygiène alimentaire (Leong et Shui, 2002). D’après les études multiples attestant de l’impact positif de la consommation de polyphénols sur la santé et la prévention des maladies, les industriels commercialisent maintenant des aliments enrichis en polyphénols ou des suppléments alimentaires. De plus, leur activité antioxydante assure une meilleure conservation des denrées alimentaires en empêchant la peroxydation lipidique.
En ce qui concerne les flavonoïdes sont des composés phénoliques commun à plusieurs plantes, qui empêchent la peroxydation et les lipoxygénases de lipide (Favier, 2003), ils jouent un rôle très important dans le traitement du diabète (inhibant l’ aldose réductase), de la goutte (inhibant la xanthine oxydase), des inflammations (inhibition de la lipoxygenase, la phospholipase et la cyclooxygenase), des hépatites, des tumeurs, de l’hypertension (quercétine), des thromboses (flavonols), des allergies et des affections bactériennes et virales (anti-HIV) (Yao et al., 2004).
Acide gallique Acide tannique (gallotannin)
Chapitre II Les polyphénols
III.1. L’activité antimicrobienne des polyphénols
Les polyphénols sont doués d'activités antimicrobiennes importantes, probablement dû à leurs diversités structurales. Le mécanisme des effets antimicrobiens des polyphénols est sans doute très complexe.
Daglia, 2012 émet 3 hypothèses sur cette activité :
Inhibition des fonctions de la membrane cytoplasmique due à l’intercalation des polyphénols dans les phospholipides membranaires.
Inhibition du métabolisme énergétique microbien.
Caractéristiques des quelque souches bactériennes utilisées
:Les infections bactériennes sont généralement traitées par des antibiotiques. Mais la très grande utilisation souvent inadaptée de ces molécules antibactériennes a entraîné la sélection de souches multirésistantes (Abedini, 2013).
I. Pseudomonas aeruginosa
P. aeruginosa (ou bacille pyocyanique) est une bactérie à Gram négatif, aérobie stricte, dépourvue de capsule. Comme la plupart des espèces appartenant au genre Pseudomonas
(Christiane, 2013), capable de ce développer dans un large spectre de températures (+4°C à +42°C)(Filopon, 2005).
L’espèce P. aeruginosa est ubiquitaire dans l’environnement et peut être commensale du tube digestif. Dans l’environnement, elle est trouvée dans le sol, dans l’eau, à la surface des plantes, des animaux et dans le milieu hospitalier (Christiane, 2013).
Pathogénicité
Il provoque une gamme d’infections aiguë et chronique en milieu communautaire, mais surtout en milieu hospitalier où il est impliqué dans diverses infections associées aux soins. Responsable de 10 à 20% des infections nosocomiales, le bacille pyocyanique est considéré de nos jours comme un sérieux problème de santé publique (Guilherme, 2013 ; Bricha et al.,
2009).
Cette bactérie possède particulièrement une résistance naturelle à différentes classes d’antibiotiques. Cette résistance peut être soit intrinsèque ou extrinsèque suite à l’acquisition des déterminants génétiques de résistance au fil du temps (James et al., 2003).
Figure 14 : P. aeruginosa au microscope électronique
Chapitre III : Caractéristiques des quelque souches bactériennes utilisées
II. Staphylococcus aureus :
Ce sont des bactéries cocci à Gram positif ubiquitaire qui est commensal de l'homme et se révèle être pathogène opportuniste dans certains cas (Abedini, 2013).
Les manifestations pathologiques dues à Staphylococcus aureus sont très nombreuses, elles sont suppurations, nécrotiques ou entériques :
- Les suppurations localisées,
- Les septicémies et les endocardites, - Les manifestations digestives,
- Le syndrome de choc toxique (Fauchère et Avril, 2002).
Les souches communautaires sont généralement résistantes aux pénicillines G et A, mais sensibles aux pénicillines M. Elles sont souvent sensibles aux macrolides, au synergistines, aux fluoroquinolones (Fauchère et Avril, 2002).
III. Escherichia coli
E.coli est un bacille à gram négatif (Berche et al., 1988), de forme non sporulée, de type anaérobie facultative, généralement mobile grâce aux flagelles, sa longueur varie de 2 à6 µm, alors que sa largeur est de 1,1 à 1,5 µm (Steven et al., 2004).
Elle peut devenir pathogène si les défenses de l'hôte se trouvent affaiblies ou si elle acquiert des facteurs de virulence particuliers (Nauciel et Vildé, 2005).
Figure 15 : Staphylococcus aureus au microscope électronique à
La bactérie était initialement sensible à beaucoup d'antibiotiques, mais l'acquisition de résistances est fréquente, surtout en milieu hospitalier (Nauciel et vildé, 2005).
I. Enterococcus faecalis:
C’est une bactérie Gram positive, anaérobie facultative, qui colonise le tube digestif des humains et d'autres mammifères.
Elle cause des infections mortelles chez l'homme, particulièrement dans les environnements hospitaliers.
Elle possède un haut niveau de résistance naturelle aux antibiotiques tels que les aminoglycosides, l’aztréonam, les céphalosporines et la clindamycin.
Figure 17 : Enterococcus faecalis (observation par
microscopie électronique à balayage) (Abedini, 2013).
Figure 16 : Escherichia coli sous microscope électronique (Avril
Chapitre I : Matériels et méthodes
1. Matériels :
Ce travail a été réalisé au niveau de laboratoire de microbiologie et de biochimie de la Faculté des Sciences de la nature et de la vie, l’Université Akli Mohaned Oulhadje Bouira durant une période allant de Mars à Mai.
1.1. Matériel biologique : 1.1.1. Le matériel végétal
Le matériel végétal au quel nous nous sommes intéressé est constitué des feuilles de deux espèces des la famille de cupressacés qui sont Juniperus communis et Juniperus phoenicea collectée dans la région de Bouira. Les feuilles des deux plante ont étés séchées à l’ombre avant utilisation.
1.1.2. Souches bactériennes testées :
Tableau I : les souches bactériennes utilisées
Les souches bactériennes
Les Bactéries GRAM positif
Enterococcus faecalis ATCC 49452 Bacillus cereus ATCC10876
Staphylococcus aureus M ATCC43300
Les Bactéries GRAM négatif
Salmonella typhimurium ATCC13311
Escherichia coli ATCC25922
Listeria innocua CLIP74915
1.2. Matériels non biologique 1.2.1. Matériel de laboratoire
Spectrophotomètre (OPTIZEN 322OUV). Etuve. Balance. Agitateur mécanique. Autoclave. Bec bensène. Broyeur. Vortex. Réfrigérateur. Micropipette.
1.2.2. Réactifs chimiques et solvants
Dans cette étude nous avons utilisé: le méthanol comme solvant et les réactifs chimiques: AlCl3; acide chlorhydrique; chlorure de fer à 5%; acétate de soduim ; solution de plomb; éthanol ; iode ; chloroforme ; ammoniaque ; hydroxyde de potassium à 10% ; acide sulfurique ; éther ; réactif de Dragendroff ; Reactif acide phosphotungstique phosphomolybdique (réactif de folin) et solution de carbonate de sodium à 20%.
1.2.3. Milieu de culture
On a utilisé la gélose nutritive pour la revivification des souches et le milieu, Mueller Hinton pour l’étude de la sensibilité des souches bactériennes à différentes concentrations d’extrait méthanolique.
2. Méthodes
Notre travail a comporté plusieurs étapes. L’ensemble de ces étapes sont illustrés dans le diagramme ci-dessous
Chapitre I : Matériels et méthodes
Figure 18 : schéma général des différentes étapes du travail
2.1. Préparation da la poudre de la plantes
Le séchage de la plante à été effectué dans un endroit sec et à l’abri des rayons solaires, après le broyage, les plantes séchées ont été conservé dans des bouteilles en verre.
Récolte de la plante (Juniperus communis et Juniperus phoenicea)
Séchage – Broyages
poudre végétale des feuilles de Juniperus communis et Juniperus phoenicea
Etude phytochimique
Extrait phénolique
Extractions des polyphénols totaux
Evaluation de l’activité antibactérienne Dosages des polyphénols totaux
Juniperus communis Juniperus phoenicea
Figure 19 : Aspect des poudres végétals (Juniperus communis et Juniperus
2.2. Screening phytochimique :
L’objectif des tests phytochimique est la mise en évidence la présence ou l’absence de certains composés appartenant aux familles chimiques des métabolites secondaires chez ces plantes Juniperus communis et Juniperus phoenicea, ces tests phytochimiques spécifiques fondés sur des réactions de coloration, de turbidité ou de précipitations. Ils sont effectués soit sur la poudre de la plante, soit sur leur infusés à 5%.
Les méthodes de caractérisation utilisées dérivent de celles décrites par Boizit et charpentier
(2006).
Préparation de l’infusés à 5%
L’infusé à 5% est préparé par l’addition de 5g de la poudre de la plante à 100 ml d’eau distillée chaude. Après 15 à 20 minutes, le mélange est filtré et le filtrat obtenu est ajusté à 100 ml par l’eau distillée.
Identification des tannins
La présence des tanins est mise en évidence en ajoutant à 5 ml de l’infusé quelque gouttes d’une solution de chlorure de fer (FeCl3) à 5%. L’apparition d’une coloration bleu noir indique la présence des tanins.
Identification des tannins galliques
Le test des tannins est réalisé par l’addition de 2g d’acétate de sodium et quelques gouttes de chlorure de fer à 5 ml d’infusé. L’apparition d’une coloration bleu foncé indique la présence des tannins gallique.
Identification des anthocyanes
Leur présence est révélé en traitant 5 ml de l’infusé avec quelque gouttes d’acide chlorhydrique (HCl). Un test positif est révélé par une coloration rouge.
Identification des saponosides
Ce test est réalisé par l’addition de quelques gouttes de solution de plomb à 2ml d’infusé, l’apparition d’un précipité blanc indique la présence des saponosides.
Chapitre I : Matériels et méthodes
Identification des mucilages
L’identification des mucilage est réalisé par l’addition de 5ml d’éthanol absolu à 1ml d’infusé. Le mélange est incubé à une température ambiante pendant 15 minutes. L’apparition d’un précipité floconneux indique la présence des mucilages.
Identification des irridoïdes
Pour recherche les irridoïdes, on ajoute quelques gouttes d’HCL à 2ml d’infusé, et on chauffe le mélange sur plaque chauffante. La coloration bleue indique leur présence.
Identification des quinones libres
2g de la poudre végétale humectés par 2ml d’acide chlorhydrique, sont mis en contacte avec 20ml de chloroforme pendante 3 heures. Le filtrat est agité avec 5ml d’ammoniaque. L’apparition d’une coloration rouge indique la présence des quinones libres.
Identification des alcaloïdes
Le test des alcaloïdes est effectué sur 5g de la poudre végétal humectés avec l’ammoniaque ½, l’ensemble est macérés dans 50ml d’un mélange éther /chloroforme pendant 24h. Après filtration, le filtrat récupéré est épuisé par l’acide chlorhydrique 2N. En présence d’alcaloïdes, le réactif de dragendroff donne un précipité rouge.
Identification de l’amidon
Pour ce test, 2g de poudre végétale sont imbibés par quelques gouttes d’iode. La formation d’une coloration bleu violette indique la présence de l’amidon.
Identification de coumarines
Ce test consiste à bouillir à reflux 2g de la poudre végétale dans la 20ml d’éthanol pendant 15 minutes. Le mélange est filtré. À 5 ml de du filtrat, on additionne 10 gouttes d’hydroxyde de potassium à 10% et quelques gouttes d’acide chlorhydrique à 10%. La présence des coumarines indique par la formation d’un trouble.
2.3. Extraction des polyphénols totaux
2.3.1. Objectif d’extraction des polyphénols totaux
On utilise des solvants organiques pour extraire le maximum de molécules chimiques contenants dans les feuilles de Juniperus communis et Juniperus phoeniceae.
2.3.2. Mode opératoire
L’extrait aqueux est préparé par macération. Une quantité de 30g de la poudre de la plante est mise en contacte avec 100mL de méthanol (Djouahra et al., 2014) puis soumise à une agitation continue durant 3 jours. La solution ainsi obtenue est filtrée sur coton, puis à travers parier filtre (1FSTA130). Le filtrat est conservé à 4°C dans un flacon à l’abri de la lumière pendant une nuit, puis une délipidtion de l’extrait par le n-hexane (3 fois) dans une ampoule à décanter est effectué.
L’extrait méthanolique est évaporé dans une étuve pendant 3 jours à 40°C jusqu’à évaporation total de méthanol.
Le schéma de figure 20 récapitule les différentes étapes d’extraction des composés phénolique.
Figure 20 : Les étapes de l’extraction des polyphénols totaux
Macération de 30 g de la poudre de la plante +100ml de méthanol à température ambiante et à l’ombre pendant 72 h
Filtration à travers d’un papier filtre
Délipidation avec 30ml de n-hexane dans une ampoule a décanté (3fois)
Evaporation
Chapitre I : Matériels et méthodes
2.4. Détermination du rendement (R)
Le rendement désigne la masse de l’extrait déterminée après évaporation du solvant, il est exprimé en pourcentage par rapport à la masse initiale de la plante soumise à l’extraction
(Okou et al., 2018 ; Falleh et al., 2002).
Il est calculé par la formule suivante : R% = ((P1-P0) / P) X 10 Avec :
P : Poids initial de l’échantillon (g) P0 : Poids du bécher vide (g)
P1 : poids du bécher après évaporation totale (g)
2.5. Quantification des polyphénols
2.5.1. Préparation des extraits méthanolique
L’extrait méthanolique est solubilisé dans le méthanol à une concentration de 1 mg/ ml pour les polyphénols totaux.
2.5.2. Dosage des polyphénols totaux (ppt) 2.5.2.1. Principe
Les polyphénols ont été déterminés par spectrophotométrie selon la méthode de Folin- Ciocalteu (Singleton et al., 1999); ce réactif de couleur jaune est constitué par un mélange d’acide phosphotungstique et d’acide phosphomolybdique. Lorsque les polyphénols sont oxydés, ils réduisent le réactif de Folin-Cioclateu en un complexe ayant une couleur bleue (huang et al,. 2005) constitué d’oxyde de tungstène et de molybdène. L’intensité de la couleur, dont l’absorption maximum est comprise entre 725 et 760 nm, est proportionnelle aux taux des composés phénoliques oxydés et présents dans les extraits végétaux (Boizot et
al., 2006).
2.5.2.2. Mode opératoire
1 ml de chaque extrait méthanolique a été introduit dans des tubes à essai contenant 5ml d’eau distillée. Un volume de 0,5 ml de réactif Folin- Cioclateu (10 fois dilué dans l’eau) a été additionné dans chaque tube. ;
Après 3 minutes, 0,5 ml de la solution de carbonates de sodium (Na2CO3 à 20 %) ont été ajoutés. Par la suite ces solutions ont été incubées à l’ombre, à température ambiante pendant 1 heure. L’absorbance est mesurée à 760 nm contre un blanc qui contient le méthanol à la place de l’extrait.
L’acide gallique est le standard le plus souvent employé dans la méthode au Folin- Ciocalteu
(Maisuthisakul et al., 2008). (La courbe d’étalonnage est préparée en utilisant l’acide
gallique)
2.5.2.3. Expression des résultats
Les résultats sont exprimés en milligramme équivalent d’acide gallique par gramme de matière sèche (mg EAG/g EXT) en utilisant l'équation de régression. Cette équation est obtenue à partir de la courbe d'étalonnage de l’acide gallique.
Et les teneurs en polyphénols totaux (PPT) sont calculées selon la formule suivante
(Bentabet-lasgaa, 2015) :
a : concentraion en polyphénols en mg/ml déterminée à partir de la courbe d’étalonnage. f : facteur de dillution
b : concentration initial de l’extrait (mg/ml)
2.6. Evaluation de l’activité antibactérienne des polyphénols
Nous avons testé l’activité des polyphénol totaux à différentes concentrations vis-à-vis de Quelques souches bactériennes.
Préparation des extraits éthanolique
Les extraits de Juniperus communis et Juniperus phoeniceae sont solubilisés dans l’éthanol à une concentration de 0,25g/ ml.
Préparation des disques
Des disques de 6 cm sont préparés à partir de papier Wattman. Ensuite ils sont mis dans un tube à essai, et stérilisés à l'autoclave et conservés jusqu'à l'utilisation. Avant d’utiliser les disque dans l’antibiogramme, nous avons déposé à l’aide d’une micropipette et un volume de l’extrait éthanolique de 40, 60, 80 et 100 µL corresponds à des concentration de 0,01 ; 0,015 ; 0,02 et 0,025 mg/disque.
Préparation de milieu de culture
Le milieu de culture est stérilisé par autoclavage à 121°C pendant 15 min, après refroidissement le milieu est coulé dans les boites de Petri à 4 mm de hauteur et on laisse quelques minutes jusqu'à la solidification (Harrar, 2012).
Chapitre I : Matériels et méthodes
Repiquage des souches bactériennes
Les souches bactériennes à tester sont repiquées par la méthode des stries dans des boites de pétri contenant de la gélose nutritive, puis incubées pendant 24 h à 37°C afin d'obtenir des colonies isolées.
Préparation de La suspension bactérienne
Des colonies bien séparées des souches bactériennes étudiées sont prélevées à l'aide d'une anse de platine et homogénéisées dans 9 ml d'eau physiologique stérile.
La densité optique est ajustée à l’aide d’un spectrophotomètre à une longueur d’onde de 620 nm. La densité optique doit être comprise entre 0,08 et 0,1 l’équivalent de 10 UFC /ml L’inoculum ainsi préparé est dilué au 1 100⁄ dans de l’eau physiologique. La densité optique finale obtenue de l’inoculum doit être équivalente à 10 UFC /ml.
Utilisation des milieux de culture
La gélose de Muller Hinton est coulée et répartie dans des boites de pétri stériles. Ces dernières sont séchées pendant 30 min à une température ambiante avant leur emploi.
Ensemencement
L’ensemencement est réalisé par écouvillonnage en stries serrées. En tournant la boite d’environ 60°, l'ensemencement s'effectue de telle sorte à assurer une distribution homogène des bactéries sur les boites.
Dépond des disques
Sur chaque boite ensemencée. On a déposé après séchage, les disques contenant différentes concentrations d’extrait (0,01 ; 0,015 ; 0,02 et 0,025 g / disque) de même un disque témoin contenant l’éthanol est déposé dans les mêmes conditions. Une fois appliqué, le disque ne doit pas être déplacé (Rahal et al., 2011).
Incubation
Selon Duval et Soussy, (1990), les boites sont mises à 4°C pendant 2 à 4 heures pour assurer la diffusion des extraits testés dans le milieu ensemencé. les boites sont incubé à l’étuve à 37°C pendant 24 heures.
Lecture des résultats
La lecture des résultats se fait après l’incubation par la mesure de diamètre de la zone d’inhibition autour de chaque disque par le pied coulisse. Plus le diamètre de cette zone est grand plus la souche est sensible (Choi et al., 2006).
L’échelle de l’estimation de l’activité antimicrobienne est donnée par (Meena et Sethi,
1994 ; Aboul et al., 1996) (Tableau II).
Tableau II : lecture des résultats de l’activité antimicrobienne (Meena et Sethi, 1994 ; Aboul et al., 1996)
Diamètre (mm) Sensibilité des souches
d˂7 Non sensible / résistance (+)
8˂ d˂14 Sensible (+)
15˂d˂19 Très sensible (++)
Chapitre II : Résultats et discussion
Notre travail consiste à effectuer une étude phytochimique et évaluer le rendement, le dosage des polyphénols totaux et l’activité antibactérienne des extraits des feuilles de deux plantesJuniperus communis et Juniperus phoenicea.
II.1. Screening phytochimique
Les tests phytochimiques ont été réalisés sur des extraits préparés à partir des feuilles des plantes Juniperus communis et Juniperus phoenicea. Le screening phytochimique nous a permis de mettre en évidence la présence des métabolites secondaires au niveau des feuilles de nos plantes. La détection des ces composés chimiques a été établi par l’utilisation des réactifs spécifiques de révélation basés sur des réactions de précipitation et de turbidité ou un changement de couleur spécifique.
Tests phytochimique sur les extraits de Juniperus communis et Juniperus phoenicea
Les résultats expérimentaux du criblage phtytochimique sont mentionnés dans le tableau III et le tableau IV.
Tableau III : Résultat du criblage phytochimique Juniperus communis
Substance Résultats positives Junipeus communis
Mucilages Précipité floconneux (+++)
Irridiodes Coloration bleu (-)
Anthocyanes Coloration rouge (+)
Tannins totaux Coloration bleu noire (+++)
Tannins galliques Coloration bleu foncé (+++)
Quinones libre Coloration rouge (-)
Coumarines Formation d’un trouble (+++)
Saponosides Précipité blanc (+++)
Amidon Coloration bleu violette (-)
Alcaloïdes Précipité rouge (+)
test Fortement positif : +++ test moyennement positif: ++ Réaction douteuse : + teste négative : -
Tableau IV : Résultat du criblage phytochimique des extraits de Juniperus phoenicea Substance Résultats positives Juniperus phoenicea
Mucilages Précipité floconneux (+++)
Irridiodes Coloration bleu (-)
Anthocyanes Coloration rouge (-)
Tannins totaux Coloration bleu noire (+++)
Tannins galliques Coloration bleu foncé (+++)
Quinones libre Coloration rouge (-)
Coumarines Formation d’un trouble (+++)
Saponosides Précipité blanc (+++)
Amidon Coloration bleu violette (-)
Alcaloïdes Précipité rouge (-)
Glucoside Coloration rouge brique (+++)
test Fortement positif : +++ test moyennement positif: ++ Réaction douteuse : + teste négative : -
Les résultats expérimentaux des tests phytochimiques réalisés sur Juniperus communis ont montré la présence des mucilages, tannins totaux, tannins galliques, coumarines, saponosides et les Glucoside en grand quantité, les Anthocyanes et les Alcaloïdes en faible quantité alors que les irridiodes, quinones libre, amidon sont absents.
Les résultats expérimentaux des tests phytochimiques réalisés sur Juniperus phoenicea ont montré la présence des mucilages, tannins totaux ,tannins galliques, coumarines , saponosides et les glucoside en grand quantité et l’absence des irridiodes, anthocyanes , alcaloïdes, quinones libre et l’amidon.
Chapitre II : Résultats et discussion
D’après les résultats du criblage phytochimique des deux plantes du même genre (Juniperus communis et Jjuniperus phoenicea) nous avons constaté que nos plantes n’ont pas le même profil chimique.L’étude phytochimique de Pankaj kumar (2010) sur Juniperus communis a montrée la présence des alcaloïdes et des tanins dans cette plante.
Les tests phytochimiques réalisés sur les feuilles de Juniperus phoenicea de la région de Naâma ont démontré la présence des tanins et des saponosides et l’absence des quinones et des anthocyanes (Bouyahyaoui ,2011). Ceci est comparable à nos résultats. Mais nous y avons décelé l’absance des alcaloïdes à l’inverse de Bouyahyaoui (2011).
De même, les résultats de Beddiar (2016) sur Juniperus phoenicea récolté de la région de Tébessaaussi comparable à nos résultats (la recherche des alcaloïdes, amidons, coumarines et les tanins) sauf concernent la présence des saponosides.
D’autres résultats reportés par Ennajar et al (2009) ont montré que les tannins sont présente en grande quantité dans les feuille de Juniperus phoenicea et les anthocyanes en petite quantité.
La présence de ces polyphénols au niveau des deux plantes étudiées explique leur fort pouvoir thérapeutique. Notamment, la richesse de ces plantes en tanins qui ont un pouvoir bactériostatique ou bactéricide sur plusieurs souches bactériennes (Chung et Wei, 2001), ils permettent aussi de lutter contre les infections et drainer les sécrétions excessives comme les diarrhées (Ybert et al. 2000).
Par conséquent, ces résultats justifient leur large utilisation dans la médecine traditionnelle par la population locale.
Ces résultats nous ont permis de nous orienter vers l’extraction et l’étude des composés phénoliques et l’activité antibactérienne de ces plantes.
II.2. Le rendement des extraits des feuilles
L’extraction des composés phénoliques par le méthanol, nous a permis de déterminer les rendements de ces extraits bruts. Les résultats obtenus sont représentés dans le tableau V.
Tableau V : Rendement d’ex Masse de bécher vide (g) Juniperus communis 46.255 Juniperus phoenicea 45.395
Le calcul des rendements par
Juniperus phoenicea montre
pour les deux plantes, respectiv Pour Juniperus communis, bibliographie étant donné que rendement en extrait méthanol Comparativement à la littératu
Juniperus phoenicea est in
été de l’ordre de 26,2 %. 0 2 4 6 8 10 Juniperus comm re n d em en t (% ) Figure 22 : Histogramme communis et Juniperus ph
extraction des composés phénoliques des deu Masse de bécher + l’extrait (g) Masse de l’extrait (g) Masse de poudre utilisée (g 48.285 2.030 30 48.185 2.790 30
ar rapport au poids total de la poudre de Junip re des proportions moyennes de l’ordre de 6
tivement.
, il est difficile de comparer les résultats ue notre étude est parmi les premier à met olique de cette plante.
ture, notre résultat sur le rendement de L’extra inferieur à celui trouvé par l’étude d’Ennajar
rendement (%)
ommunis Juniperus phoenicea
e de rendement d’extraction des polyphénols
phoenicea eux plantes de re (g) Rendement en % 6.766 9.300 niperus communis et 6.766% et 9.300 % ts avec ceux de la ettre en évidence le trait méthanolique de jar et al (2009) qui a plante ls de Juniperus
Chapitre II : Résultats et discussion
A partir des résultats trouver par Ennajar et al (2009) et nos résultat, nous avons constaté que les teneurs en extraits secs varient non seulement d’une plante à une autre de la même famille (Juniperus communis et Juniperus phoenicea) mais également en fonction des paramètres de l’extraction solide-liquide des polyphénols, le solvant d’extraction et des autres facteurs. Comme Lee et al (2003) ; Dai et Mumper (2010) ont trouvé que les rendements des extraits des plantes peuvent être influencés par plusieurs paramètres et dépendent entre autre de la composition chimique et les caractéristiques physiques de la matière végétale ainsi que la méthode et les conditions dans lesquelles l’extraction a été effectuée.II.3. Dosage des polyphénols totaux (analyse quantitative)
La teneur en polyphénols a été estimée par la méthode colorimétrique au Folin-ciocalteu. C’est l’une des méthodes les plus ancienne conçue pour déterminer la teneur en polyphénols des plantes médicinales et des aliments (Abdel-Hameed, 2009).L’acide gallique est le standard le plus souvent employé dans la méthode au Folin-ciocalteu (Maisuthisakul et al.,
2008).
La courbe d’étalonnage est établie avec une équation de régression (figure 23) : Y (absorbance) = 47,41x ; coefficient de corrélation R2= 0,991.
0 0,2 0,4 0,6 0,8 1 1,2 1,4 0 0,005 0,01 0,015 0,02 0,025 0,03 D O (7 6 5 ) [C] mg/ml DO y= 47,41x R = 0,9912
Figure 23 : Courbe d’étalonnage de l’acide gallique pour le dosage des polyphénols
À partir de la courbe d’étalonnage, Les concentration des polyphénols totaux sont 100 et 79,1 mg EAC/g EXT, pour les extraits méthanolique de Juniperus phoenicea et Juniperus
communis respectivement.
Les résultats du dosage des polyphénols totaux des deux plantes ont montré que l’extrait méthanolique des Juniperis phoenicea représente l’extrait le plus riche en polyphénols totaux que l’extrait méthanolique de Juniperus communis.
Il est difficile de comparer la teneur en polyphénol totaux de Juniperus communis avec ceux de la bibliographie étant donné que notre étude est la première à mettre en évidence la teneur en polyphénol totaux de cette plante.
Dans une étude faite sur les feuilles et les fruits le la plante médicinale Juniperis phoenicea,
Ennajar et al (2009) ont trouvé que la teneur des polyphénols totaux est de 217 et 52 mg
EAG/g Ps pour les extraits méthanolique des feuilles et des fruits respectivement, la première teneur est relativement élevée et la deuxième est relativement faible à nos résultats. Ils ont trouvé que les feuilles J. phoenicea étaient plus riches en polyphénols que les fruits.
En plus de ces résultats, Ennajar et al (2009) ont testés plusieurs solvants d’extraction comme le méthanol , l’éthanol, acétate d’éthyle et le dichloromethane et ils ont trouvé que la meilleur teneur des polyphénols est trouvé par l’extrait méthanolique.
Hayouni et al (2007), ont teste deux méthodes d’extraction (macération et soxlet) et
différents solvants d’extraction sur le genévrier de Phénicie provenant de la Tunisie, ils ont trouvé que la quantité de phénols totaux variait dans les différents extraits (de 66 à 202 mg
0 20 40 60 80 100 120
Juniperus communis Juniperus phoenicea
m g E A C /g E X T plante
Chapitre II : Résultats et discussion
GAE/g MS). Ils ont constaté que la teneur en polyphénols défère selon le solvant et la méthode d’extraction.Cependant, nos résultats (de J communis et J phoenicea) montre des teneurs plus par rapport aux résultats trouvés par Djeridane et al (2006) qui est de l’ordre de 12,7 mg EAG /g pour
Juniperus oxycedrus. Cette différence s’explique par le solvant d’extraction et l’espèce
végétale utilisée.
Des études ont montré que la quantité de polyphénols dans les plantes dépend de facteurs biologiques (génotype, organes …), ainsi que de conditions environnementales (température, salinité, stress hydrique, rayonnement U.V et l'intensité lumineuse). En outre, la solubilité des composés phénoliques est régie par le type de solvant utilisé, le degré de polymérisation des composés phénoliques, et leurs interactions (Ksouri et al., 2008).
II.4. Activité antibactérienne
L'activité antimicrobienne des extraits de plantes a été évaluée sur des souches bactériennes Gram positives et Gram négatives avec la méthode de diffusion en milieu gélosé Mueller Hinton agar.
Les résultats présentés dans le Tableau 6 montrent que les extraits ont des activités antimicrobiennes de degrés variables contre les souches des différents micro-organismes testés.
Tableau VI : Diamatre d’inhibition de différentes concentration de l’extrait méthanolique de Juniperus communis et Juniperus phoenicea .
Concentration de l’extrait (g/µl)
Diamètre des zones d’inhibition (mm)
Juniperus communis Juniperus phoenicea Salmonella typhimurium ATCC13311 0.01 12 12.5 0 .015 12 13 0.020 12 14 0.025 13 14 0.01 0 0
Escherichia coli ATCC25922 0 .015 0 0 0.020 0 0 0.025 0 0 Bacillus cereus ATCC10876 0.01 12 14 0 .015 13 14.5 0.020 14 15 0.025 14 17 Listeria innocua CLIP74915 0.01 10 11 0 .015 12 12 0.020 14 13 0.025 14 13 Pseudomonas aeroginosa 0.01 11 14 0 .015 12 15 0.020 12 16 0.025 13 17 Enterococcus faecalis ATCC 49452 0.01 11 12 0 .015 12 13 0.020 13 14 0.025 14 16 Staphylococcus aureus M ATCC43300 0.01 0 0 0 .015 0 0 0.020 0 0 0.025 0 0
Chapitre II : Résultats et discussion
Tableau VII: Résultats de l’effet antibactérien des extraits méthanolique de J. communis et J. phoenicea sur des bactéries Gram positive et Gram négative
Juniperus communis Juniperus phoenicea
Salmonell typhimurium ATCC13311 Escherichia coli ATCC25922 Bacillus cereus ATCC10876
Listeria innocua CLIP74915 Pseudomonas aeroginosa Enterococcus faecalis ATCC 49452
Chapitre II : Résultats et discussion
Staphylococcus aureus M ATCC43300
L’activité antibactérienne des extraits a été estimée en termes de diamètre de la zone d'inhibition autour des disques contenant les extraits à tester.
D’après les résultats obtenus nous avons estimé que les deux extraits ont un effet inhibiteur sur presque toutes les souches bactériennes testées, et l’effet inhibiteur augmentent considérablement avec la concentration des extraits.
L’activité de l’extrait méthanolique des feuilles du Juniperus communis montre une activité sur les bactéries Bacillus cereus, Salmonella typhimurium, Listeria innocua, Pseudomonas
aeroginosa et Enterococcus faecalis contrairement au Staphylococcus aureus et Escherichia coli qui ont été résistantes à cet extrait.
Concernant l’étude de l’activité antibactérienne de l’extrait méthanolique de Juniperus
phoenicea elle a permet de classer les bactéries étudiés en 3 types : des bactéries résistantes
(Staphylococcus aureus et Escherichia coli) des bactéries sensibles (Salmonella
typhimurium) et des bactéries très sensible (Bacillus cereus, Listeria innocua, Pseudomonas aeroginosa et Enterococcus faecalis).
0 2 4 6 8 10 12 14 16 L'effet de l d iam èt re ( m m ) 0 2 4 6 8 10 12 14 16 18 L'effet de l'éxt d iam èt re ( m m )
Figure 25 : Diamètres des zo
communis et Juniperus phoen
de l'éxtrait méthanolique de Juniperus comm
es
0,01 0,015 0,02 0,025
xtrait méthanolique de Juniperus phoenicea
espece
zones d’inhibition des extraits polyphénoliques
enicea 0,01 0,015 0,02 0,025 munis mg/disque mg/disque mg/disque mg/disque espece 0,01 0,015 0,02 0,025 ea mg/disque mg/disque mg/disque mg/disque s de Juniperus