Faculté de Médecine et de Pharmacie de Rabat Centre des Etudes Doctorales de la Vie et de la Santé
ANNEE: 2015 THESE N° 3/15 CSVS
THÈSE DE DOCTORAT
DÉPISTAGE PRÉNATAL DU SYNDROME DE DOWN
:OPINIONS ET ATTENTES DES FEMMES MUSULMANES DANS LA RÉGION DE RABAT Équipe de Recherche en Tératovigilance (ERTV)
Formation Doctorale:
É
pidémiologie clinique et sciences médicochirurgicalesPrésentée et soutenue le 20 novembre 2015 par
Amina BELAHCEN
Jury
Professeur Moustapha Hida Président Faculté de Médecine et de Pharmacie de Fès, Université Sidi Mohammed Ben Abdellah
Professeur Asmaa Mdaghri Alaoui Directeur de thèse Faculté de Médecine et De Pharmacie de Rabat, Université Mohammed V de Rabat
Professeur Najia Zeraidi Rapporteur Faculté de Médecine et De Pharmacie de Rabat, Université Mohammed V de Rabat
Professeur Amal Thimou Izgua Rapporteur Faculté de Médecine et De Pharmacie de Rabat, Université Mohammed V de Rabat
Professeur Latifa Chat Examinateur Faculté de Médecine et De Pharmacie de Rabat, Université Mohammed V de Rabat
Professeur Sanaa Chala Examinateur Faculté de Médecine Dentaire de Rabat, Université Mohammed V de Rabat
Professeur Asmae Khattabi Examinateur Ecole nationale de Santé Publique, Université Mohammed V de Rabat
2
Dédicace
À feu ma mère, Elfaiz Kébira
,
Qui a incarné la foi, l'espérance et l'amour à travers sa
foi en Dieu, son travail, et son dévouement aux autres.
Et À mon père
Mohammed Belahcen,
Aucune dédicace ne pourrait compenser ni exprimer ma
reconnaissance pour tous les sacrifices et les efforts que vous
aviez fournis jour et nuit pour mon éducation et mon bien être
Puissiez-vous toujours être rappelé combien Amina vous aime.
« Mon Seigneur, aie pitié d’eux (mes parents) tout comme ils
m’ont soigné durant mon enfance. »
(le Saint Coran, chapitre 17, verset 25)
A mon mari Abdelkader Azzayakh
et à mes enfants Manal, Ahmed et Youssef,
Tous les mots du dictionnaire n’exprimeront jamais assez ma
gratitude pour votre soutien, vos encouragements et votre
patience sans lesquels je n’aurais jamais pu achever ce travail.
3
Remerciements aux membres du jury.
Je suis reconnaissante aux membres du jury d’avoir accepté d’évaluer ce
travail. En effet, leur collaboration va permettre d’améliorer ce travail par leur
expertise scientifique émanant de différentes universités et de différentes
disciplines.
4
Remerciements
J’adresse mes sincères remerciements et toute ma gratitude à Madame le
Professeur Asmaa Mdaghri Alaoui, Centre Hospitalier Ibn Sina (service de
néonatologie, hôpital d’Enfants), Faculté de médecine et de pharmacie,
Université Mohammed V et à tous les membres de l’Équipe de Recherche en
Tératovigilance pour avoir facilité la thèse et pour avoir entrepris tout ce qui
était nécessaire pour qu’elle voie le jour.
Je remercie également toutes les personnes qui ont participé ou aidé de
quelque façon que ce soit à la réalisation de ce travail.
Tout particulièrement Monsieur le Professeur Jamal Taoufik et toute l’équipe
du Centre d’Etudes Doctorales des sciences de la vie et de la santé (CEDOC
SVS), Faculté de médecine et de pharmacie, Université Mohammed V Monsieur
le Professeur Redouane ABOUKAL et toute l’équipe du Laboratoire de
Biostatistique et de Recherche Clinique et Épidémiologique (LBRCE) Faculté
de médecine et de pharmacie, Université Mohammed V, pour leurs conseils
scientifiques et leur soutien , le Professeur Latifa Chat du service de
radiologie, Hôpital d’enfants, CHU Ibn Sina, Rabat pour avoir enrichie ce travail
par une iconographie de qualité et par ses pertinentes réflexions sur le sujet et
tous les membres de L’Association Marocaine de Soutien et d’Aide aux
trisomiques
(AMSAT) pour leur participation à l’enquête.
5
Liste des Abréviations
AMSAT AFP CCAM CCNE CN DPN DPSD DPT hCG IMG MFIU MS PAPP-A PFS SA SD VPP CVS TD TFP MoM uE3
Association Marocaine de Soutien et d’Aide aux trisomiques Alpha-foetoprotéine
Classification commune des actes médicaux Comité consultatif national d’éthique Clarté nucale
Diagnostic prénatal
Dépistage prénatal du syndrome de down Dépistage prénatal de la trisomie 21
Hormone chorionique gonadotrope humaine Interruption médicale de grossesse
Mort fœtale in utero Marqueurs sériques
Protéine plasmatique placentaire de type A Pertes fœtales spontanées
Semaines d’aménorrhée révolues Syndrome de down
Valeur prédictive positive
Prélèvements des villosités choriales Taux de détection
Taux de faux positif Multiples de la médiane Œstradiol
6
Table des matières
LISTE DES TABLEAUX ...8
LISTE DES FIGURES ... 10
INTRODUCTION ... 11
1.1/CONTEXTE ... 12
1.2/PROBLÉMATIQUE... 15
1.3/LES OBJECTIFS DE L’ÉTUDE ... 16
PARTIE BIBLIOGRAPHIQUE ... 18
DÉPISTAGE PRÉNATAL DU SYNDROME DE DOWN ... 19
1/CONCEPTS ... 19
2/ INTÉRÊT... 20
3/OBJECTIFS DU DÉPISTAGE PRÉNATAL SYNDROME DE DOWN ... 21
4/HISTORIQUE ... 21
5/PRINCIPES ... 23
6/ LES DIFFÉRENTS TYPES DE MARQUEURS DU DÉPISTAGE PRÉNATAL DU SYNDROME DE DOWN ... 25
7/LES DIFFÉRENTES COMBINAISONS DE DÉPISTAGE DU SYNDROME DE DOWN ... 33
8/LE DÉPISTAGE NON-INVASIF ... 43
9/QUEL TEST CHOISIR ? ... 45
10/DÉROULEMENT DU DPSD ... 46 11/STRATÉGIES DE DÉPISTAGE ... 47 12/ÉTHIQUE ... 49 PARTIE PRATIQUE ... 51 INTRODUCTION ... 52 MATÉRIEL ET MÉTHODE ... 53
7 SUJETS DE L'ÉTUDE ... 53 MÉTHODE ... 54 DÉROULEMENT DE L’ENQUÊTE. ... 55 ANALYSE STATISTIQUE ... 55 RÉSULTATS ... 56 PROFIL SOCIODÉMOGRAPHIQUE :... 56
CONNAISSANCES DES PARTICIPANTES ... 58
OPINION ET ATTENTES DES PARTICIPANTES. ... 67
LES FACTEURS DÉTERMINANTS DES RÉPONSES DES PARTICIPANTES ... 69
DISCUSSION ... 77 CONCLUSION... 83 PERSPECTIVES ... 83 GLOSSAIRE ... 86 RÉFÉRENCES... 91 ANNEXES ... 112
QUESTIONNAIRE ANONYME DE L’ENQUÊTE SUR LE DIAGNOSTIC PRÉNATAL DE LA TRISOMIE 21 PRODUCTION SCIENTIFIQUE
ARTICLE SOUMIS À LA REVUE ÉTHIQUE ET SANTÉ
L’ANNONCE DU SYNDROME DE DOWN SUITE AU DÉPISTAGE PRÉNATAL
8
Liste des tableaux
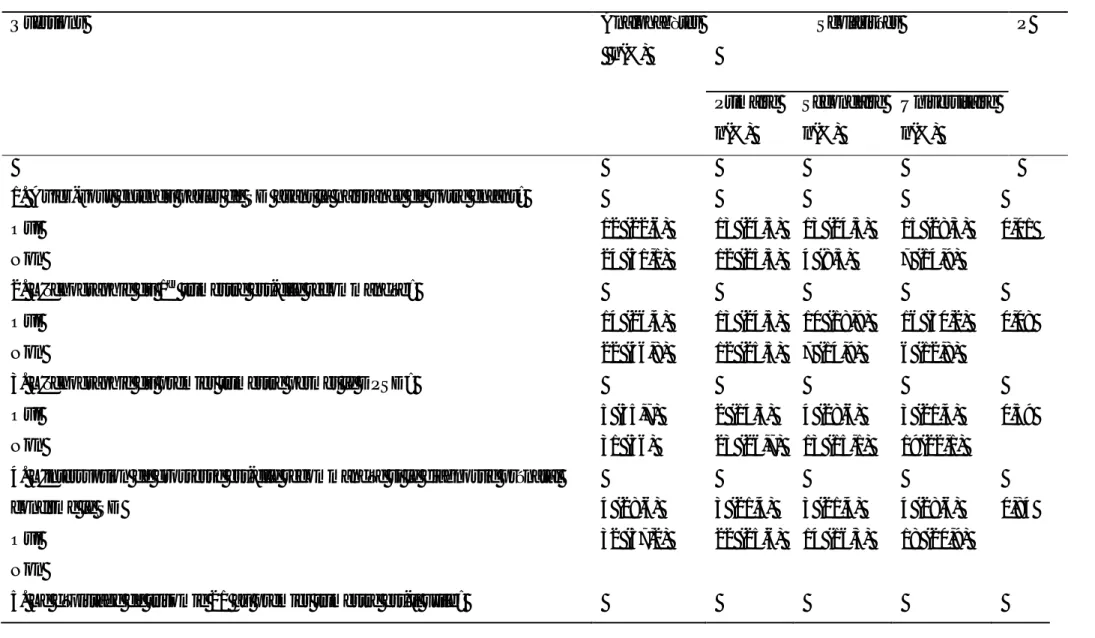
Tableau 1-1 performances de l’âge maternel avancé pour le DPSD -->26 Tableau 1-2 performances de la clarté nucale pour le DPSD -->27 Tableau 1-3 performances des marqueurs échographiques du deuxième trimètre pour le DPSD -->31 Tableau 1-4: performances du test combiné pour le DPSD -->35 Tableau 1-5: performances des différentes combinaisons des marqueurs du deuxième trimestre associées à l’âge maternel -->38
Tableau 2-1: profil démographique selon la répartition des participantes en groupe sans (groupe 1) et avec enfants affecté de syndrome de Down (groupe 2) -->57
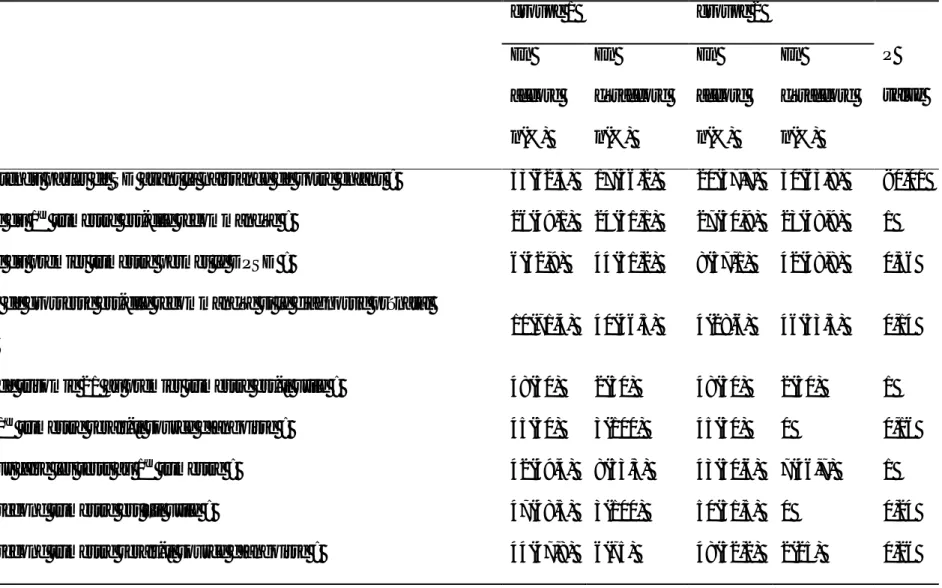
Tableau 2- 2 : opinons des participantes sur le dépistage prénatal du syndrome de Down-->59 Tableau 2-3: opinons des participantes sur le dépistage prénatal du syndrome de Down, comparaison entre groupe sans (groupe 1) et avec (groupe 2) enfant affecté de syndrome de Down. -->62 Tableau 2-4 : opinons des participantes sur le dépistage prénatal du syndrome de Down selon leur niveau d’instruction -->64 Tableau 2-5 : déclarations des mamans d’enfants affectés de syndrome de Down, selon l’âge à la naissance de l’enfant affecté de syndrome de Down, qui justifiaient leur refus d’interrompre la grossesse……… .-->68 Tableau 2-6 influence des caractéristiques maternelles sur les connaissances (aviez- vous entendu parler de SD avant la naissance de votre enfant) ->70 Tableau 2-7 influence des caractéristiques maternelles sur les connaissances (l’échographie est recommandée au premier trimestre)……… ->71 Tableau 2-8 influence des caractéristiques maternelles sur les connaissances (l'échographie du premier trimestre permet le DPSD -->72 Tableau 2-9: influence des caractéristiques maternelles sur le souhait de connaitre le diagnostic de syndrome de Down en prénatal -->73
9
Tableau 2-10: influence des caractéristiques maternelles sur la volonté de poursuivre la grossesse, même si le diagnostic de SD est confirmé -->74
Tableau 2-11: influence des caractéristiques maternelles sur le souhait d’informer, en début de grossesse, toutes les femmes marocaines sur le DPSD -->75
Tableau 2-12: influence des caractéristiques maternelles sur le souhait d’un programme national pour le DPSD au Maroc -->76
10
Liste des figures
Figure I: Image d’une clarté nucale normale 28 Figure II: Image d’une clarté nucale épaissie 28
11
12
1.1 / Contexte
Le domaine de la santé connaît, depuis le début du siècle, un développement sans précédent. La promotion de la santé de la population est devenue la préoccupation constante de toutes les nations en particulier dans le cadre de la santé maternelle et infantile. Ainsi, les soins prénataux ont connu une progression rapide et continue. De même, la technologie génétique a réalisé une avancée majeure et a pris un essor mondial, elle a été encouragée par les actions de l’OMS et des organismes internationaux indépendants tels que la Foundation for Genomics and Population Health. En effet, en 2007, l’American College of Obstetricians and Gynecologists (ACOG) a recommandé la proposition du dépistage prénatal des aneuploïdies fœtales à toutes les femmes enceintes [1]. En 2010, l’OMS a pris la résolution de rendre la prévention, le traitement des malformations congénitales et les avantages de la science et de la génomique disponible et accessibles dans tous les pays [2]. Ainsi en 2011, elle a mis en place des services de santé dit « services de génétiques communautaires » destinés aux pays à revenu faible ou intermédiaire [3]. La technologie génétique a également progressé grâce aux revendications de l’équité en prestation de soins de santé mondiale et aux profits commerciaux de plus en plus importants. Son utilisation en pratique clinique permet de dépister, par un simple test sanguin, de nombreuses maladies graves et/ou génératrices de handicap dont le syndrome de Down (SD). Ainsi, le dépistage hyper précoce du SD, vers 7 ou 8 SA, à partir de la détection de l’ADN libre fœtal circulant (cff-ADN) dans le sang maternel avec un taux de détection de 99,2 % (95 % IC, 98,5 - 99,6) et un taux de faux positifs de 0,09 % (95 % IC, 0,05 - 0,14), est devenu de nos jours une réalité [4, 5].
Le syndrome de Down (SD) est dû à une anomalie génétique congénitale, qui est la présence d’un chromosome surnuméraire de la 21e paire ou d’une partie [6], d’où son appellation : la trisomie 21. Le caryotype de la majorité des individus atteints montre une trisomie 21 libre (95 % des cas). Celle-ci résulte d’une non-disjonction maternelle ou d’une erreur de la division cellulaire lors de la méiose des cellules germinales, elle est le plus souvent homogène, une mosaïque de cellules trisomiques et normales est rarement retrouvée (2-4 % des cas). La mutation d’autres gènes lui est parfois associée. Rarement une translocation avec une autre paire de chromosomes (5 % des cas) est retrouvée [7].
Le SD représente un problème de santé publique majeure ; c’est la cause la plus fréquente de déficience intellectuelle congénitale [8, 9] en plus d’une morbidité élevée. Il se manifeste par un phénotype particulier, un déficit intellectuel et une vulnérabilité psychique. Il s’associe
13
parfois à d’autres malformations ou pathologies plus ou moins sévères [10]; les plus fréquentes sont les malformations cardiaques, l’hypothyroïdie, la leucémie, la maladie cœliaque, le diabète, la dépression, l’autisme et la maladie d'Alzheimer [11]. Les personnes affectées de SD souffrent de l'exclusion sociale et de la solitude. Ils sont négligés à l’école et sont considérés comme un fardeau pour leur famille et la société. Les besoins de cette population sont nombreux et de longue durée. Ces besoins, liés à leurs déficits corporels et intellectuels, imposent la réalisation d’un nouveau projet de vie adaptée et une prise en charge adéquate qui reste souvent lourde pour la famille [12]. Dans de nombreux pays développés, durant la dernière décennie, la qualité de vie pour la plupart des personnes atteintes du syndrome de Down est devenue meilleure. Leur survie s’est améliorée avec une longévité qui atteint actuellement 60 ans [13, 14]. L’accès à une éducation et la formation adéquate et les thérapies permettent d’acquérir une alphabétisation, des compétences de communication, une autonomie et pour certains une activité professionnelle au prix d’un coût direct et indirect élevé. À l’heure actuelle, on ne dispose pas de traitement préventif.
La prévalence du SD est globalement estimée à environ 1/1000 naissances vivantes [15-17], elle varie d’une région à l’autre et d’un pays à l’autre selon leur politique de dépistage et de l’interruption des grossesses affectées, elle a tendance à progresser en raison de l'augmentation du nombre de mères plus âgées qui accouchent [18-19]. En effet, le risque de SD augmente avec l’âge [16]; le risque relatif est de 2,2 (1,6 - 2,9) pour les mamans âgées de moins de 35 ans vs 3,5 (2,1 - 5,5) pour les mamans âgées de 35 ans et plus et il s’accentue d’avantage pour les mamans d’enfants affecté de SD [20]. Penrose en 1930 a démontré que l’âge paternel n’était pas un facteur étiologique significatif [21], cependant le risque de SD est accru si l’âge du père dépasse 50 ans [22]. Vagnini et al ont découvert qu’il y a une altération de l’ADN du sperme croissante avec l’âge [23].
Au Royaume du Maroc, la prévalence du SD n’est pas établit, toutefois est le SD est la plus fréquente des anomalies chromosomiques. Dans une série publiée par un centre de référence national en cytogénétique 1504 cas d’anomalies chromosomiques ont été répertoriés entre 1993 et 2010 dont 1095 cas de SD soit 72,8 % (24). La médiane d’âge des mamans d’enfants porteurs de trisomie 21 était de 35,39 ans [25]. La population féminine au Maroc âgée de 15 à 49 ans s’est accrue de 2,60 million en 1960 à 18,23 million en 2014 et l’âge moyen au premier mariage a augmenté de 17,5 ans en 1960 à 26,6 ans en 2010 [26]. En 2010, la couverture des soins prénatals était de 80,2 % (2010) et en 2013, le taux de fécondité des
14
femmes âgées de plus de 35 ans était respectivement de 69, 30 et 5 pour mille femmes en âge de procréer (15 à 49 ans) pour les tranches d’âge de 35-39, 40-44 et 45-49 ans [26].
Depuis le début des années 80, le dépistage prénatal du syndrome de Down (DPSD), par l’échographie et les tests biochimiques, est devenu une pratique de routine dans les pays développés [27-30]. Il est proposé aux femmes enceintes selon la politique et stratégie propre de chaque pays pour détecter les femmes à haut risque auxquels des tests invasifs, une choriocentèse entre 10 à 13 SA ou une amniocentèse au-delà de 15 SA, sont proposés pour confirmer ou infirmer le diagnostic [31]. Les tests invasifs peuvent avoir de sérieuses complications (Fausse couche, pied bot varus équin, fuite de liquide amniotique, saignement …) et/ou un échec de culture [32,33].
Cette démarche a pour résultat, soit de proposer une interruption médicale de la grossesse affectée (IMG) (34-36), « l’IMG ne permet pas de traiter l’affection, mais de supprimer le fœtus porteur de l’affection » Patrick Leblanc [37] soit de préparer la naissance du nouveau-né en améliorant l’accueil et la prise en charge, proposer un éventuel traitement et amener les parents à accepter cette naissance et assurer leur accompagnement psychologique pour une santé et un bien-être optimal. Les professionnels de santé dans cette démarche devraient prendre en considération les préférences, les valeurs et les droits de leurs patients.
Dans les pays ou l’avortement est légal, la plupart des femmes optent pour l’interruption de grossesse [38-42] avec pour arguments « la méconnaissance de la trisomie 21 et du handicap de la part des parents, la recherche de l’enfant parfait, le rejet du handicap dans la société, et une politique de santé publique en faveur de l’interruption de grossesse pour trisomie 21 » [43], cette attitude est qualifiée d’eugénisme[44].
Dans d’autres pays, pour des considérations religieuses, l’IMG est interdite par la loi sauf si la vie de la mère est en danger tel que l’Irlande, Malte, certains pays d’Amérique latine et la plupart des pays musulmans [34]. L’intérêt du DPSD serait de permettre aux parents de prendre le temps de s’informer et de se préparer pour cette naissance. Cependant, le consentement à faire les tests du DPSD dépend des convictions religieuses et spirituelles des parents, des sentiments d’affection et d’attachement qu’ils portent à leur enfant et de leur perception de la qualité de vie [45-46].
Le Royaume du Maroc, pays musulman sunnite, interdit et pénalise l’interruption de grossesse sauf quand la vie de la mère est menacée [47]. Outre, les ressources limitées dans le secteur de la santé, d’autres problèmes de santé publique, en particulier la mortalité maternelle
15
et infantile sont considérés plus prioritaires que les anomalies congénitales. Dans notre pratique quotidienne, nous ne disposons pas ni de données nationales sur les anomalies congénitales, ni de politique de santé pour la mise en œuvre du dépistage prénatal du syndrome de Down ni de recommandations de bonnes pratiques qui précisent ses indications et ses modalités [48-50]. La surveillance de la grossesse est basée sur l’échographie obstétricale, qui est une pratique courante pour les grossesses suivies dans notre contexte. Par contre, l’accès à l’amniocentèse et à l’étude cytogénétique est très limité et les tests biochimiques de dépistage prénatal ne sont disponibles que dans des laboratoires privés qui sous-traitent avec des laboratoires étrangers. De même, les organismes sociaux de soutien pour personnes affectées de SD sont limités et les structures sanitaires sont peu habilitées à leur prise en charge.
1.2 / Problématique
En raison des progrès technologiques, le fœtus est devenu un patient à part entière d’où l’intérêt croissant du dépistage prénatal, de la mise en valeur des considérations éthiques, de la perception de la sévérité du syndrome de Down, de l’évaluation du bénéfice-risque des examens prescrit, de la limitation des ressources financières et de la forte composante émotionnelle à l’annonce du diagnostic par l’opinion publique. Ceci a incité de nombreux auteurs à reconnaitre les attitudes des femmes et le devenir des grossesses affectées suite au DPSD dans différents contextes notamment religieux, culturel et politique ; ainsi, au Royaume uni, les femmes pakistanaises étaient favorables au dépistage prénatal mais moins favorable à l’interruption de la grossesse affectée par rapport à leurs concitoyennes d’origine anglaise [51].
Les principales questions de cette étude sont :
- les femmes au Maroc seraient-elles favorables ou défavorables au dépistage prénatal du syndrome de Down ?
- En cas de confirmation du diagnostic quel serait le devenir de la grossesse ?
Il y a peu de données publiées concernant le DSPD au Maroc. On sait peu sur les connaissances et attitudes des femmes marocaines pour envisager le développement de tels tests. Aucune étude similaire n’a été publiée auparavant. De même, on sait peu sur les attentes des femmes et leur opinion envers le dépistage prénatal du syndrome de Down et le devenir de la grossesse affectée au Maroc. En outre, on se demande en quoi on peut avoir une
16
liberté à demander un examen si en définitive, il est interdit de demander une IMG face à la réalité de la découverte de la maladie ? Que va rapporter la réalisation de ce travail aux femmes marocaines ? D’où la pertinence de cette étude sur le plan social et éthique. Pour répondre à ces questions, nous avons présumé que les femmes au Maroc, du fait de l’interdiction de l’IMG ne seraient pas favorables au DPSD et que l’issue de la grossesse en cas de confirmation du diagnostic serait l’interruption de la grossesse. L’accès au DPSD sera-t-il considéré comme un droit ou excessif ?
Cette étude est réalisée dans l'espoir de développer les soins de santé reproductive. En effet, ces résultats seront utiles aux médecins, personnels soignants lors de leur pratique quotidienne et peuvent contribuer auprès des décideurs en politique de santé à prendre en compte les points de vue des femmes à l’égard du DPSD lors de l’élaboration des plans d’actions santé. En outre, ils pourront inciter à l’élaboration des recommandations de bonnes pratiques sur le dépistage prénatal, le conseil génétique et la prévention, ils vont promouvoir l’information, l’éducation des femmes et l’opinion publique, ils vont orienter l’activité psycho-sociale des groupes de soutien et vont ouvrir un débat sur de nouvelles perspectives morales, juridiques et sociales. De même, ils vont inciter à la réalisation d’autres travaux de recherche.
1.3 / Les objectifs de l’étude
À la lumière de notre recherche bibliographique sur l’attitude des femmes marocaine à l’égard du DPSD, nous n’avons pu colliger aucune étude effectuée dans notre contexte.
Cette étude a pour but de reconnaitre l’opinion des femmes au Maroc, avec ou sans enfant atteint, sur le DPSD et le devenir de la grossesse.
Ce travail a permis de documenter, en se basant sur l’évidence scientifique, les connaissances et les attitudes des femmes marocaines et déterminer les facteurs qui les influencent. Cette étude visait les objectifs suivants :
Les objectifs primaires :
Reconnaitre si les femmes, au Maroc étaient favorables au DPSD
Reconnaitre si les femmes, au Maroc étaient favorables à la poursuite de la grossesse affectée en cas de confirmation du diagnostic
Les objectifs secondaires :
1. Evaluer les connaissances des femmes marocaines concernant le dépistage du syndrome de Down.
17 2. Déterminer leur point de vue le DPSD
3. Évaluer l’influence de l'âge, du niveau d'instruction, du niveau socio-économique et de la culture sur les réponses des femmes marocaines
4. Déterminer les raisons de leur attitude
18
19
Dépistage prénatal du syndrome de Down
ette revue de la littérature est une mise à jour des différents outils et programmes actuels du dépistage prénatal du syndrome de Down (DPSD) et de leurs performances. L’échographie tient une place importante dans le DPSD par la mesure de la clarté nucale entre 10 et 14 SA, et des « soft markers » au deuxième trimestre, il en va de même pour les marqueurs du sérum maternel au premier et deuxième trimestre. Actuellement, le dépistage non-invasif (DPNI) par la détection d’ADN fœtal circulant dans le sang maternel, de par sa grande sensibilité, sa spécificité et son innocuité est, de plus en plus sollicité malgré son coût élevé.
Une feuille de route sur l’annonce des résultats du dépistage pour orienter les professionnels de santé dans leur pratique quotidienne est incluse en annexe.
1 / Concepts
Le dépistage prénatal du syndrome de Down (DPSD) est un processus destiné aux femmes pendant la grossesse, il comprend un ensemble de tests dont le but est de détecter, à l’échelle d’une population, les femmes enceintes qui ont un risque supérieur à un seuil fixé d’avoir un fœtus qui présente le Syndrome de down (SD), celles-ci sont dites à « risque élevé ». Lorsqu’une femme enceinte est considérée à risque élevé, un examen invasif (une amniocentèse ou une biopsie du trophoblaste) est proposé pour confirmer ou infirmer le diagnostic de SD et chercher d’autres anomalies chromosomiques associées [52, 53].
Les différents tests de dépistage (la mesure de la clarté nucale par échographie, le dosage des marqueurs sériques et le DPNI) sont des procédures dénuées de risque iatrogène. Les risques sont associés aux résultats « faux positifs » et « faux négatifs » du dépistage [52, 53].
Un test de dépistage est évalué par la sensibilité, la spécificité et le taux de faux positif Cependant, la valeur prédictive positive et la valeur prédictive négative sont plus signifiantes pour la femme enceinte. La combinaison de différentes techniques augmente la sensibilité et diminue le taux de faux positif d’où la combinaison de plusieurs tests pour le DPSD
La valeur seuil de risque est une valeur prédéterminée. Une valeur de risque élevé augmenterait le taux de détection du SD, mais elle augmenterait aussi le taux d’amniocentèses générées.
20
La valeur de risque est une valeur qui permet de classer la personne testée dans une zone à risque et donc de décider ou non d’une amniocentèse. Elle est obtenue à partir des renseignements fournis par le médecin prescripteur (date de naissance, date de la grossesse calculée à l'échographie de préférence, poids, tabac) et des taux des marqueurs sériques [54]. La valeur de risque est comparée à la valeur seuil de risque. Quand la valeur obtenue est supérieure à une valeur seuil, on parle de « risque élevé » ou de dépistage «positif». Ceci n’implique pas la présence d’un fœtus atteint, mais suggère la nécessité de confirmer le diagnostic par d’autres examens. De même, quand la valeur obtenue est inférieure à la valeur seuil, on parle de « risque faible » ou d’un dépistage « négatif ». Ceci n’exclut pas la possibilité d’une naissance d’un enfant trisomique.
La stratégie de dépistage est définie par le type de test (biochimiques et échographiques), la combinaison des tests utilisés et par la valeur seuil de risque Le diagnostic invasif par analyse cytogénétique est proposée uniquement aux femmes
qui ont un risque d’aneuploïdie fœtal élevé avec un résultat du dépistage au dessus de la valeur seuil, en cas d’anomalies à l’échographie fœtale en faveur d’une aneuploïdie, en cas de FIV avec injection de sperme intra cytoplasmique, en cas d’ATCD d’enfant affecté chez l’un des parents ou s’ils sont porteurs d’une translocation Robertsonienne équilibrée [53].
2 / intérêt
Le dépistage précoce des complications de la grossesse permet d’améliorer l’issue de la grossesse grâce à des soins prénataux appropriés et à un suivi adapté à la maladie. Cependant, le syndrome de Down est une anomalie congénitale qui ne peut être ni guérie ni traitée ni évitée. Toutefois, le dépistage prénatal a des intérêts multiples [52,53]
Limiter le nombre de femmes enceintes candidates au diagnostic invasif (choriocentèse et amniocentèse) et de limiter ainsi les complications tel que les pertes fœtales, le pied-bot varus équin, la fuite de liquides amniotique, le saignement, les contractions utérines et l’anxiété liée à la procédure
Palier aux insuffisances des ressources : nombre limité des établissements et du personnel qualifiés
Réduire le coût des examens
21
Donner aux parents suffisamment de temps pour se préparer et planifier les soins de santé adapté leurs besoins, leurs valeurs, leurs croyances et les ressources disponibles et de les préparer psychologiquement et socialement à la naissance de cet enfant différent.
Entamer une prise en charge psychosociale [55].
3 / Objectifs du dépistage prénatal syndrome de Down
Le but du dépistage est de reconnaitre, dans la population générale, les femmes enceintes qui sont exposées à un risque accru de donner naissance à un enfant présentant le SD. Le dépistage prénatal n’est pas une prévention au sens médical du terme, il n’est pas non plus « un moyen de « sélectionner » l’enfant qui mérite de naître » [52]. Les objectifs que l’on peut fixer au dépistage de la trisomie 21 sont :
Objectif principal
limiter le nombre de tests invasifs en vue d’établir le diagnostic positif de SD. Objectifs secondaires
donner l’accès à l’information appropriée.
fournir les services appropriés pour un accès équitable et une assurance qualité.
assister les femmes enceintes pour faire un choix éclairé sur le devenir de la grossesse.
4 / Historique
En 1933, Penrose LS démontre que l’âge maternel est un facteur étiologique du SD [56].
En 1966, Steele MW et Breg WR Jr démontrent la possibilité de cultiver les cellules fœtales présentes dans le liquide amniotique et de les utiliser pour l’analyse des chromosomes à partir des cellules du liquide amniotique [57].
1968, Nadler HL publie la première série de cas de diagnostic prénatal par amniocentèse et discute son implication en pratique clinique [58].
En 1970, Gertner M rapporte que le DPSD était fondé sur l’âge maternel avancé (40 ans et plus), les femmes ayant eu un enfant porteur d’une anomalie chromosomique, les femmes ayant des antécédents familiaux de SD [59].
En 1983, Philip J et al remettent en question les indications de l’amniocentèse et qui étaient : l’âge maternel > 35 ans, les femmes ayant eu un enfant porteur d’une anomalie chromosomique, les familles avec des membres porteurs de translocation ou autre maladie
22
chromosomique héréditaires, les familles où le père était âgé de 50 ans ou plus et les femmes ayant des antécédents familiaux de SD [60].
Depuis lors, le dépistage prénatal du SD a connu un développement rapide et continue. Plusieurs types de tests ont été élaborés.
En 1984, Merkatz IR et al ont découvert que le taux sérique d’AFP était plus bas chez les femmes enceintes dont le fœtus présentait un SD [61].
En 1987, Bogart MH et al ont découvert une élévation des taux sériques d’hormone choriogonadotrope (hCG) chez les femmes enceintes dont le fœtus présentait un SD [60]. En 1988, Canick JA et al ont rapporté un abaissement des taux sériques d’œstriol non conjugué (uE3) 21 chez les femmes enceintes d’un fœtus trisomique 21 [63].
En 1988, Wald NJ et al et Cuckle HS et al ont proposé un calcul de risque de SD prenant en compte l’âge maternel et les taux des trois marqueurs sériques AFP, hCG et uE3 au deuxième trimestre (15- 20 SA) [64-66].
En 1990, Macri JNet al ont proposé de remplacer le dosage de la hCG totale par celui β-hCG libre [67].
En 1990, Szabó J et Gellén J découvrent une accumulation de liquide dans la nuque du fœtus par échographie vaginale [68].
En 1992, Wald et al découvre des taux bas de la Pregnancy-associated plasma protein A ou Pappalysin-1 ou PAPP-A chez les femmes enceintes d’un fœtus avec SD et proposent de l’associer aux autres marqueurs pour le DPSD au premier trimestre [69].
En 1992, Nicolaides KH et al rapportent l’association entre le SD et une mesure par échographie de la nuque du fœtus dite « clarté nucale », entre 11 et 14 semaines, au-delà de 3 mm [68].
En 1993, Gänshirt-Ahlert D met en évidence la présence de cellules fœtales avec une trisomie 21 dans le sang maternel [71].
En 1997, Lo YM et al mettent en évidence la présence d’ADN fœtal dans le sérum maternel. [72]
.
En 1997, mise en place, en France, du dépistage du deuxième trimestre du SD par les marqueurs sériques maternels double test (AFP et hCG ou bhCG) [52].
En 2002, Christiansen M et al instaurent le dépistage contingent [73].
En 2004, le dépistage de la trisomie 21 sur le seul critère d’âge n’est plus justifiable [74]; la stratégie universelle proposée est la mesure de la clarté nucale combinée avec le dosage des marqueurs sériques au 1er trimestre et le dosage des marqueurs sériques du 2e trimestre (quadruple test) pour les femmes consultant après 13 semaines de grossesse ou la
23
combinaison de la mesure de la clarté nucale et des marqueurs sériques au 1er et au 2e trimestre avec le calcul d’un seul niveau de risque.
En 2007, Lo YM et al instaurent le dépistage non-invasif (DPNI) du SD par Plasma placental RNA allelic ratio et la PCR digitale à un âge de grossesse très précoce au cours du 1er trimestre [75, 76]
En 2011, le DPNI par la nouvelle génération de séquençage d’ADN fœtal a permis la détection d’ADN fœtal circulant dans le sang maternel cff-ADN pour la détection des aneuploïdies à une échelle commerciale ; elle est diffusée aux USA, il est recommandé en deuxième intention chez les femmes identifiées à haut risque de SD ou d’une autre aneuploïdie [77].
En 2013, le DPNI par cff-ADN est introduit en France [78].
5 / Principes
La Haute Autorité de la Santé (HAS) [52] et la «Society of Obstetricians and Gynaecologists of Canada» [79] ont émis un certain nombre de recommandations concernant le DPSD.
Le risque de donner naissance à un enfant atteint de SD augmente avec l’âge maternel. Cependant, l’évaluation du risque en se basant sur l’âge maternel est peu spécifique et peu sensible. Ceci a motivé l’association d’autres tests pour améliorer les performances du dépistage quel que soit l’âge de la mère. De ce fait, la proposition des tests invasifs sur le seul critère de l’âge ≥ 40 ans n’est plus valide [80].
Le choix du marqueur repose sur la précision, l’exactitude, l’accessibilité, la commodité, la faisabilité, le rapport qualité prix, l’âge de la grossesse et la compatibilité avec les autres marqueurs. Un test de dépistage du premier trimestre est valide si ce test à une sensibilité ≥ 85 % avec un TFP ≤ 2,5 % et un test de dépistage du deuxième trimestre est valide si la sensibilité ≥ 85 % avec un TFP ≤ 3,5 %. La précision et l’exactitude des résultats des tests dépendent de la datation de la grossesse et de la déclaration des caractéristiques maternelles. En cas de grossesses multiples, le DPSD (1er et du 2e trimestre) est moins fiable que dans les grossesses uniques [53].
Le DPSD est intégré à l’ensemble des activités de dépistage prénatal afin de détecter les autres maladies qui pourraient être dépistées par les mêmes techniques. Il est réalisé dans le cadre d’un programme défini qui est mis à jour avec les nouveautés (technologies et protocoles) et dans le cadre d’un réseau organisé qui englobe des laboratoires agrées, des unités d’échographies spécialisées, de conseil génétique, d’éducation sanitaires des patients,
24
de diagnostic invasif, de gestion des données, de gestion administrative et un personnel qualifié pour s’assurer que les résultats des marqueurs sériques et des échographies répondent aux normes de contrôle de la qualité. Un contrôle continu avec un audit annuel devrait évaluer leur performance et garantir une assurance qualité. Ainsi, la mesure de la clarté nucale et l’échographie fœtale sont accréditées si elles sont effectuées dans un centre spécialisé par un personnel qui a reçu une formation spécifique et selon un procédé standardisé et avec un appareil adéquat.
Les examens de diagnostic prénatal (DPN), doivent être accessibles en cas de test de dépistage positif. Le prélèvement d'échantillons est effectué par prélèvement de villosités choriales (CVS, entre 10+0 et 13 + 6 SA) ou amniocentèse (après 15 + 0 SA). Elle peut opter pour l’analyse des prélèvements par quantitative fluorescence polymerase chain reaction (QF-PCR) fluorescent in situ hybridisation (FISH) ou par caryotype. L’analyse par la QF-PCR est moins performante que le caryotype. [81] De plus, la précocité du diagnostic par choriocentèse en cas de dépistage précoce n’est pas évidente.
Les femmes enceintes sont informés que les tests de diagnostic invasifs encourent un risque de fausse-couche de 1 % [82].
La datation de la grossesse doit être précise et évaluée au mieux par échographie au lieu de la date des dernières règles ou la date de conception [53].
Le DPSD n’est pas obligatoire mais volontaire. La décision de recourir au dépistage doit être éclairée et documentée [52, 53, 83].
En cas de dépistage effectué au 1er trimestre, un dépistage au 2e trimestre n’est pas indiqué sauf s’il est réalisé dans le cadre du dépistage intégré ou séquentiel [53].
Les marqueurs échographiques mineurs du 2e trimestre (18-20 SA) sont interprétés pour modifier le risque d’aneuploïdie, en tenant compte de l’âge de la femme, de son histoire et des résultats du dépistage sérique [53].
Le DPNI doit être réglementé et les normes de laboratoire doivent être fixées et appliquées pour éviter que la qualité du test ne soit compromise [84].
L’information sur le dépistage doit être mise à la disposition de toutes les femmes enceintes, elle doit être compréhensible, inclure les différentes options de dépistage et délivrée par différents moyens tels que les dépliants ou le discours direct. Le counseling ne doit pas être directif [53].
25
6 / les différents types de marqueurs du dépistage prénatal du syndrome de
Down
Le DPSD a été utilisé depuis les années 70 afin d’évaluer le risque de porter un fœtus affecté. Depuis lors, plusieurs tests ont été élaborés pour améliorer sa performance. Actuellement, plusieurs types de marqueurs ou tests sont utilisés
6.1 / L’âge maternel avancé (AMA)
L’âge maternel avancé est le premier test utilisé pour le DPSD. Penrose en 1930 a constaté qu’a partir de l’âge de 35 ans la femme enceinte a plus de risque d’avoir un enfant affecté de SD [56]. Le rapport de l’EUROCAT( registre qui couvre 31 % de toutes les naissances de l’Union Européenne et qui inclut 20 pays) précise que le ratio du taux de prévalence (PRR) du SD chez les mamans âgées de 40 ans et plus comparé aux mamans âgées de 25-29 ans était de 17,3 (95 % IC, 16,3 – 18,4), et comparé aux mamans âgées 35–39 ans était de 5,5 (95 % IC, 5,2–5,8) [85]. Le “likelihood” du SD est de 1/1300 à l’âge de 25 ans, 1 / 295 à l’âge de 35 ans, 1/100 à l’âge de 40 ans et 1/30 à l’âge de 45 ans [86, 87].
La sensibilité de l’AMA varie selon les auteurs (voir tableau1.1), elle est estimée à 60 % avec un TFP de 20 % L’âge maternel de 35 ans n’est pas recommandé comme valeur seuil pour le DPSD, afin de réduire le TFP l’âge de 38 ans semble être plus approprié [88]. Toutefois, l'âge maternel seul ne devrait pas être utilisé pour recommander des tests invasifs lorsque d’autres tests de l'aneuploïdie sont disponibles [53].
26
Tableau 1-1 : performance de l’âge maternel avancé pour le dépistage prénatal du syndrome de Down
Test Valeur seuil sensibilité(%) TFP(%) Auteur, année
AMA ≥ 35 ans 58 18 Saltvedt S, 2005 (89)
AMA ≥ 35 ans 63,3 21,8 Kagan KO, 2015 (90)
AMA ≥ 40 ans 44 16 Chitayat D, 2011 (53)
AMA ≥ 35 ans 30 5 Nickolaides, 2004 (91)
27 6.2 / L’échographie
L’examen par échographie pendant la grossesse est un examen anodin qui fournit des informations inestimables sur le fœtus. Il est réalisé en pratique courante dans le but d’évaluer l’âge de la grossesse, le bien-être fœtal, le nombre de fœtus et les anomalies morphologiques fœtales [92]. Le risque chez une femme enceinte d’avoir un fœtus affecté par le SD est évalué en se basant sur un algorithme de calcul qui combine des anomalies décelées à l’échographie ou marqueurs échographiques et des marqueurs biochimiques multiples. Ainsi, l’échographie fœtale est une pièce maitresse du DPSD, elle permet :
une datation précise de la grossesse ; un âge gestationnel précis permet d’améliorer l’exactitude des tests de dépistage.
la mesure de la clarté nucale : la clarté nucale (CN) est une couche liquidienne anéchogène visualisée par échographie, elle est située derrière la nuque et la partie inférieure du crâne du fœtus, elle correspond à l’espace entre la peau de la nuque fœtale et l’aponévrose recouvrant le rachis cervical, elle est obtenue par voie transabdominale et en cas de difficulté par voie transvaginale [70] (voir figure I).
la recherche d’autres marqueurs spécifiques du risque de SD à chaque période de la grossesse.
6.2.1 / Au premier trimestre de la grossesse (11-13 + 6 SA) L’âge gestationnel
L’âge gestationnel est obtenu par la mesure de la distance vertex-coccyx par approche transabdominale ou transvaginale avec une précision de quatre à sept jours près [93].
La clarté nucale
La clarté nucale (CN) est mesurée au 1er trimestre de la grossesse entre 11 + 0 et 13 + 6 SA quand la longueur crânio-caudale est de 45 à 84 mm. La valeur prédictive positive (VPP) de la mesure de la clarté nucale seule serait comprise entre 1,5 % et 5,8 % [52].
L’épaisseur de la CN varie légèrement avec l'âge gestationnel et la longueur crânio-caudale, elle est indépendante de l'âge maternel. Une clarté nucale épaissie signifie la présence d’un œdème de la nuque. Une valeur de la CN > 3 mm ou > 95e percentile pour la longueur crânio-caudale ou une valeur médiane de 1,96 MoM (95 % IC, 1,63 – 2,35) évoque une anomalie fœtale, elle peut être associée à des anomalies chromosomiques fœtales, des anomalies structurelles majeures (pulmonaire, gastro-intestinale, génito-urinaire, cardiaque, cérébrale
28
et/ou musculo-squelettique), des infections congénitales, des troubles métaboliques et hématologiques [70, 94] (voir figure II).
Clarté nucale
Figure I: Image d’une clarté nucale normale, photographie, 2011, Latifa Chat, Hôpital d’enfants, CHU Ibn Sina, Rabat.
Clarté nucale
LCC= longueur cranio-caudale
Figure II: Image d’une clarté nucale épaissie, photographie, 2011, Latifa Chat, Hôpital d’enfants, CHU Ibn Sina, Rabat.
La sensibilité de la mesure de la CN pour la détection de la trisomie 21 varie d'environ 40 % à 80 %, elle dépend de la compétence de l’examinateur, du patient et de la résolution de l'image [95] (
voir tableau 1.2). Si ces tests sont normaux, le risque d’une anomalie grave ou d’un retard du neuro-développement est alors identique à celui de la population générale [96].
29
Tableau 1-2 : performance de la clarté nucale pour le DPSD
Test Sensibilité(%) TFP(%) Auteur, année
CN 64 5 Spencer K, 1999 (97)
CN 51 5 Wald NJ, 2003 (98)
CN 76,8 4,2 Nicolaides KH, 2004 (91)
CN 60 5 Fergal D, 2005 (99)
30
Le caryotype fœtal est proposé quand la CN ≥ 3,5 mm. En l’absence d’anomalies chromosomiques, un examen échographique détaillé et une échocardiographie fœtale doivent être réalisés pour éliminer d’autres anomalies associées [53].
Une clarté nucale ≤ 3 mm est en faveur d’un fœtus euploïde. Cependant, une CN < 3 mm ne garantis pas un fœtus non affecté ; la proposition d’un caryotype fœtal dépend du résultat des tests de dépistage du premier trimestre [52, 53].
Les autres marqueurs
Le retard d'ossification de l’os nasal du fœtus a une sensibilité de 68,8 % avec un TFP de 1,4 %. Cependant, il varie selon l’ethnie, de la longueur crânio-caudale, la clarté nucale. Cet examen est peu reproductible en inter et en intra-opérateur. L'inclusion de l'os nasal dans le DPSD améliore la sensibilité du DPSD [91-100].
D’autres anomalies à l’échographie évoquent également le SD tel que : le retard de croissance fœtale, la tachycardie, le flux anormal dans le ductus venosus, la megavessie, l’omphalocéle et l'artère ombilicale unique [92].
6.2.2 / Au cours deuxième trimestre de la grossesse (14-26 SA)
Le moment idéal pour faire un examen complet du fœtus est entre 18 à 20 SA (101). Plusieurs anomalies sont en faveur du SD quoique l’absence d’anomalie a été rapportée dans 50 % des cas [102].
Cet examen explore: L’âge gestationnel
L’âge gestationnel est déterminé par la combinaison des mesures du diamètre bipariétal, du périmètre crânien, du périmètre abdominal et de la longueur du fémur avec une précision de 10 à 14 jours prés [93].
L’épaisseur de la clarté nucale
Une mesure de la CN ≥ 6 mm est en faveur d’un SD avec une sensibilité de 39 % et une spécificité de 96 % (99). Elle est également observée en cas d’une infection congénitale, d’une anomalie génétique (syndrome de Noonan,…), de mort fœtale ou de retard du neuro-développement de 3 à 5 % [53] (tableau 1-3).
31
Tableau 1-3 : performances des marqueurs échographiques du deuxième trimètre pour le DPSD [107].
Marqueur Sensibilité TFP Auteurs
Épaisseur de la nuque (mm) Borrell et al, Gray et al, Odibo et al
≥6 12-35 0,1-1
≥5 15-78 2,1-3
Os nasal absent ou
hypoplasique
29-81 1-11 Bromley et al., Odibo et al.
Hypertrophie ventriculaire 5,6-28,6 0,1-0,2 Wax et al, Aagaard-Tillery Humérus court 17,1-47,9 2,8-7,4 Agathokleous et al.
Fémur court 19,3-38,1 4,7-8,8 Agathokleous et al
Intestin hyperéchogéne 0-21,3 1-2,1 Vintzileos et al, Bahado-Singh et al Pyélectasie 0-28,6 1,2-3,9 Vintzileos et al, Weisz et al, Carbone
32 Les malformations cardiaques
La transposition des gros vaisseaux (TGA), la déficience du septum auriculo-ventriculaire (CAV), la tétralogie de Fallot (TOF) et l’hypoplasie du cœur gauche (HCG) sont systématiquement recherchées [53].
Les anomalies de fermeture du tube neural.
D’autres signes échographiques peuvent être associés au SD, ils sont appelés les marqueurs mineurs ou « soft markers », ce sont : la perturbation du flux sanguin dans le cordon ombilical et dans le canal d’Arantius, les anomalies de la fréquence cardiaque fœtale, le kyste du plexus choroïde, une dilatation de la grande citerne, un foyer cardiaque échogène, l’intestin échogène, une pyelectasie rénale ≥ 4 mm à 20 SA, deux vaisseaux dans le cordon et un fémur court. La mise en évidence de marqueurs mineurs, sans autres anomalies structurelles à l’échographie ou des tests biochimiques (test combiné ou autres) associés, n’a pas de signification particulière. Cependant dans certains centres si le nouveau risque calculé est augmenté, le DPNI est proposé. En cas de résultat rassurant, une échographie de réévaluation est souhaitable au troisième trimestre [101, 104, 105, 106].
6.2.3 / Perspectives
Le développement de la technologie des ultrasons permet d’obtenir des images de hautes définitions et une meilleure visualisation des anomalies fœtales et en particulier les caractéristiques phénotypiques du SD [79]. Ainsi, l'échographie tridimensionnelle haute définition va contribuer à améliorer le diagnostic prénatal [108, 109].
6.3 / Les marqueurs biochimiques maternels
Le placenta chez la femme enceinte sécrète des substances qui sont détectées dans le sang maternel. Le dosage de ces substances permet d’évaluer le risque de certaines anomalies chez le fœtus, elles sont dites des « marqueurs biochimiques ». Les marqueurs répertoriés dans la littérature sont nombreux, les plus fréquemment utilisés sont la protéine plasmatique placentaire de type A (PAPP-A), L'hormone chorionique gonadotrope humaine (hCG), l’alpha-foetoprotéine (AFP), l’Œstradiol (uE3), et l’inhibine-A. La mesure de ces marqueurs est exprimée en multiple de la médiane (MoM). Chaque marqueur a été préalablement évalué chez une population avec SD fœtale et une population normale. Parmi les marqueurs biochimiques, seules la PAPP-A et la ß-hCG libre sont intéressantes au premier trimestre, leur
33
dosage est effectué entre 9 et 14 SA. En cas de SD, on trouve un taux bas de PAPP-A (< 0,4 MoM) et/ou un taux bas de hCG (< 0,5 MoM) [52, 53, 79].
D’autres marqueurs sériques sont en cours d’exploration tel que le Facteur de croissance placentaire (PIGF), le récepteur apparenté de la hCG LH/hCG-R ou LHCGR et son récepteur soluble sLHCGR [110, 111], et la protéine inhibitrice du plasma C1. Dans les urines, l’analyse des protéines par Spectrométrie de Masse MALDI-TOF qui aurait la capacité de détecter le SD avec une sensibilité de 99 % et un TFP <1 % au premier trimestre semble prometteuse [112]
.
Au deuxième trimestre, l’AFP, la hCG, l’uE3, et l’inhibine-A sont plus intéressantes. Un taux d’AFP > 2,5 MoM ou < 0,25 MoM et/ou d’hCG > 3,0 MoM et/ou d’inhibine-A > 2,0 MoMet/ou d’estriol non conjugué < 0,5 MoM sont associées à un SD. Par contre, un taux bas de hCG ou d’inhibine-A, ainsi qu’un taux élevé d’estriol non conjugué ne sont pas en faveur d’une anomalie fœtale [113]. D’autres marqueurs sont en cours d’étude l’alpha gonadotrophine chorionique humaine (αhCG) libre, la SP2, la CA125, la proform of eosinophil major basic protein (proMBP) [114], la SAMP et la PAPP-A2 sont augmentées dans le plasma maternel en cas de fœtus affecté par le SD [115, 116].
7 / Les différentes combinaisons de dépistage du syndrome de Down
7.1 / Les combinaisons de dépistage du premier trimestre (11+0 et 13+6 SA)Depuis la mise en place du DPSD, plusieurs combinaisons de tests, pour le dépistage au premier trimestre de la grossesse, ont été élaborées pour améliorer sa performance et atteindre la sensibilité acceptable de 75 % et le TFP de 3 % [53]. Ces tests biochimiques sont associés ou non à la mesure échographique de la CN [117]. Actuellement, le dépistage au premier trimestre prend beaucoup de considération ; les femmes enceintes le préfèrent au dépistage du deuxième trimestre, car il a l’avantage de donner, dés le début de la grossesse, plus de temps pour réfléchir aux résultats des tests avant de prendre des décisions importantes sur le devenir de la grossesse.
7.1.1 / Le dépistage combiné
Le dépistage combiné ou test combiné (TC) repose sur la combinaison de plusieurs marqueurs, indépendants statistiquement, mesurés au cours de la même période de la grossesse. La valeur de risque combiné est obtenue par la multiplication du risque lié à l’âge maternel et celui lié de la mesure de la clarté nucale entre 11+0 et 13+6 SA à celui lié au
34
dosage des marqueurs sériques du 1er trimestre (fraction libre de la β-hCG et PAPP-A) soit [(risque après CN x risque lié à l'âge) x risque après MS].
La sensibilité du TC varie avec l’âge gestationnel, en effet selon Kagan, pour un TFP de 5 % la sensibilité était respectivement de 94 % à 11 SA, 90 % à 12 SA, et 83 % à 13 SA. L’âge maternel associé aux tests biochimiques a une sensibilité de 65 % pour un TFP de 5 %. Pour un TFP de 3 %, la sensibilité était respectivement de 92 % à 11 SA, 85 % à 12 SA, 83 % à 13 SA. Pour atteindre une sensibilité de 96 % avec un TFP de 5 %. Il est conseillé de faire les tests biochimiques à 10 SA et la mesure de la clarté nucale à 12-13 SA [118] (voir tableau 1-4). Le Dépistage du premier trimestre classe les patients à haut risque, à risque intermédiaire ou à faible risque. La valeur seuil de risque la plus utilisée est de 1/200.
La combinaison d’autres marqueurs (l’absence d’os nasal et la mesure du flux sanguin dans le « ductus veinosus », dans l’artère hépatique et au niveau de la valve tricuspide) au TC chez le groupe à risque intermédiaire permet de les reclasser comme à faible ou à haut risque [119, 120, 121, 53]
. En cas de grossesse gémellaire, chez les jumeaux dizygotes, la sensibilité est de 86 % pour un TFP de 5 % et la spécificité est de 95 %. Chez les jumeaux monozygotes, la sensibilité est de 87 % pour un TFP de 5 % et la spécificité est de 95 % [122].
35
Tableau 1-4 : performances du test combiné pour le DPSD [123].
étude effectif Sensibilité(%) TFP(%) Valeur seuil pays
Alamillo, 2013 23 329 100 6,3 1/300 USA Valinen, 2012 1 000 66,7 4,6 1/200 Finland Marttala, 2011 56 076 54,5 4,5 1/250 Finland Sorensen, 2011 19 694 72,7 1,0 1/300 Denmark Kagan, 2015 675 332 92,2 8,0 Germany O'Leary P, 2006 [124] 22 280 83 3,7 1/300 Australia
36
Le test combiné permet de dépister d’autres anomalies fœtales telles que le Patau syndrome, l’Edward syndrome, le syndrome de Turner, et d’autres anomalies chromosomiques (délétions, trisomies partielles, translocations non équilibrées, et autres aneuploïdies des chromosomes sexuels).
7.1.2 / les nouvelles combinaisons en perspectives
L’association des PIGF et de l’α-foetoprotéine (AFP) au TC (clarté nucale, Protéine Plasmatique Placentaire de type A (PAPP-A), fraction β libre de l'hormone choriogonadotrophique (β –hCG libre)) permet d’obtenir une sensibilité de 88,2 % pour un TFP de 3 % [125]. De
Le récepteur apparenté de la hCG, le LH/hCG-R ou LHCGR ou son récepteur soluble le sLHCGR sont associé à la PAPP A ou au test combiné pour améliorer leurs performances [111, 126]
La protéine inhibitrice du plasma C1 peut être associée à la ß-HCG, à la PAPP A et à la clarté nucale pour améliorer la performance du test combiné [115]
L’AFP peut être utilisée pour le dépistage du deuxième trimestre [127].
7.2 / Les combinaisons de dépistage du deuxième trimestre (15 et 20 SA)
Le DPSD repose sur le dosage des marqueurs sériques maternels combinés à l’âge maternel pour le calcul de risque. Il existe plusieurs marqueurs et associations dont les performances sont bien établies sous réserve d’une datation correcte du début de la grossesse et d’une interprétation correcte des résultats. La performance recommandée pour qu’une combinaison soit valide et d’assurer au minimum une sensibilité de 75 % avec un TFP de 5 % [128]. La méta-analyse de Alldred publiée par la Cochrane Data Base [114] répertorie les combinaisons de marqueurs les plus utilisées, ce sont :
Le quintuple test : c’est une combinaison de l’âge maternel avec les taux sérique de la hCG totale (ou la β hCG libre), l’AFP, l’uE3, l’Inhibin A et la PAPP-A
Le quadruple test : c’est une combinaison de l’âge maternel, avec les taux sérique de la hCG totale (ou la β hCG libre), l’uE3, l’AFP et l’Inhibine A.
Le triple test : c’est une combinaison de l’âge de la mère avec les taux sérique de la hCG totale, l’uE3, l’AFP ou la combinaison de l’âge de la mère avec les taux sérique de la β hCG libre, l’AFP et l’uE3 ou la combinaison de l’âge de la mère avec les taux sérique de la hCG totale, l’Inhibin A, l’AFP.
37
Le double Test : c’est une combinaison de l’âge de la mère avec les taux sérique de la hCG totale (ou la β hCG libre) et l’AFP.
Le test unique : c’est une combinaison de l’âge de la mère avec les taux sérique de la hCG totale ou la β hCG libre ou l’AFP.
D’autres tests ont été rapportés, mais leur sensibilité est faible. Les combinaisons incluant l’inhibine A sont plus performantes mais non de façon significative. Les associations entre deux ou trois marqueurs à l'âge maternel sont plus performantes qu’un seul marqueur [114] (voir tableau 1-5).
38
Tableau 1-5 : performances des différentes combinaisons des marqueurs du deuxième trimestre associées à l’âge maternel [114]
Tests Effectif(cas) Sensibilité
(%) Spécificité (%) TFP (%) Valeur seuil étude Quintuple T
hCG totale, AFP, uE3, Inhibin A, PAPP-A βhCG libre, AFP, uE3, Inhibin A,PAPP-A
1092 (82) 82,9 84 5 5 Wald 2003 Wald 2003 Quadruple T
hCG totale, AFP, uE3, Inhibin A
38342 (150)
80,5 5 Wald, 2003
73,9 94,8 1/250 Debieve 2000; Palomaki 2006
85,0 91,5 1/300 Malone, 2005
βhCG libre, uE3, AFP, Inhibin A 84,1 94,3 1/250 Wald 2003
Triple test
βhCG libre, AFP, uE3
10541 (249) 65,1 5 Knight 1998; Sancken 2003; Wald
2003
81,5 97,9 1/250 Cioffi 2000; Wald 2003a
hCG totale, AFP, uE3 89047 (648) 53,5 5 Bahado-Singh 1999; Bahado-Singh
2000; Bartels 1994a; Haddow 1994; Knight 1998; Sancken 2003; Wald 2003
76.9 93,6 1/250 David 1996; Debieve 2000;
39
1999
hCG totale, Inhibin A, AFP 88.9 93,5 1/250 Debieve 2000
Double test
hCG totale, AFP 133783 (473) 61,7 5 Bartels 1994; Knight 1998; Lam
2002; Wald 2003
69,9 95,3 1/250 Audibert 2001; Beekhuis 1993;
Benattar 1999; David
1996; Debieve 2000; Roberts 2000
β hCG libre, AFP 45597 (341) 61,7 5 Anandakumar 1999; Hsu 1997;
Knight 1998; Rozenberg 2002; Wald 2003 75,5 91,6 1/250 Brajenovic 1998; Kadir 1999; Rozenberg 2002 10098 (12) 67 8 1/270 Chao AS, 1999(126) test unique hCG totale 57668 (280) 56,1 5
Knight 1998; Muller 1996a; Wald 2003
β hCG libre 14985 (192) 52,6 5 Hsu 1997; Knight 1998; Wald 2003
40
7.3 / Les dépistages combinant les tests du premier et du deuxième trimestre [53] 7.3.1 / Le dépistage intégré
Le dépistage intégré est la combinaison des résultats des tests de dépistage du premier trimestre (CN, PAPP-A) à ceux du deuxième trimestre (double, triple ou quadruple test) pour obtenir un calcul de risque unique au deuxième trimestre. Les résultats du test combiné du premier trimestre ne sont pas communiqués à la femme. Les résultats ne sont annoncés que lorsque tous les tests ont été réalisés. L’intérêt de ce test est une diminution du TFP et des gestes invasifs. Le moment optimal pour la mesure de PAPP-A est de 9 à 10 SA, de la clarté nucale est entre 11-13 SA.
Le dépistage intégré permet également le dépistage des anomalies de fermeture du tube neural et la trisomie 18 [53].
Le dépistage intégré sérique.
Lorsque la mesure de la clarté nucale n’est pas incluse au calcul de risque, on parle alors de dépistage intégré sérique c.à.d. on mesure le taux de la PAPP-A ou les taux de la PAPP-A et de la β-hCG libre au premier trimestre, et au deuxième trimestre, on complète par le triple test (l'AFP et uE3) ou le quadruple test [53].
Pour tout dosage des marqueurs sériques anormal calculé à partir de la date des dernières règles, une échographie de datation devrait être faite pour confirmer l'âge gestationnel [53].
7.3.2 / Le dépistage contingent
Le dépistage contingent est une alternative au dépistage intégré. La majorité des femmes reçoivent leur résultat après le dépistage du premier trimestre. Ainsi, un test invasif est offert aux femmes à haut risque (e. g. risque > 1/50), les femmes à faible risque (risque < 1/1 500) ne nécessitent pas d'autres explorations. Les femmes avec un risque intermédiaire (c.-à-d.entre 1/50 et 1/1 500) vont faire d’autres tests au deuxième trimestre dont les résultats vont être combinés à ceux du premier trimestre pour un résultat définitif. Le test contingent comparé au test combiné a une sensibilité de 88,6 % pour un TFP de 1,3 % vs 90,9 % pour un TFP de 2,8 %. Le test contingent a une efficacité similaire au test combiné, un coût plus faible et moins de procédures invasives [130].
41
Le dépistage séquentiel se déroule en plusieurs phases distinctes au cours du temps, il combine les résultats des tests du premier trimestre (clarté nucale et/ou marqueurs sériques) avec ceux du dépistage du deuxième trimestre (marqueurs sériques). Chaque visite a un objectif prédéfini et les résultats sont utilisés pour modifier la valeur du risque spécifique estimée à partir de l'évaluation initiale. Le risque est estimé selon une valeur seuil appropriée. Le risque initial est évalué à partir de l'âge maternel, celui-ci est modifié par les résultats de l'échographie puis par les résultats des tests biochimiques du premier trimestre puis par les résultats des tests biochimiques du deuxième trimestre [121]. Le résultat du test combiné est fourni à la patiente et le dépistage du 2e trimestre est réalisé à moins que la patiente ait recours au caryotype fœtal. Ainsi, le dépistage séquentiel sélectionne les femmes pour le dépistage du deuxième trimestre sur la base des résultats du dépistage du premier trimestre. Ainsi, les tests invasifs sont proposés aux femmes à haut risque selon le résultat du dépistage du premier trimestre. Celles qui ont un risque intermédiaire un dépistage sérique supplémentaire est réalisé au deuxième trimestre avec des valeurs seuils appropriées [53]. Il y a 3 approches pour le dépistage séquentiel :
Le dépistage séquentiel indépendant
L’interprétation de chacun des tests du 1er trimestre et du 2e trimestre est indépendante. Ainsi, le test du 2e trimestre est interprété sans tenir compte des résultats du test combiné du 1er trimestre.
Le dépistage séquentiel en 2 étapes
Le caryotype est proposé si le résultat du test combiné du 1er trimestre est supérieur à la valeur d’un seuil spécifié. Si le résultat du dépistage du 1er trimestre est en dessous de ce seuil, le dosage des marqueurs sériques maternels au 2e trimestre est proposé à la patiente, et le risque final est déterminé en intégrant les résultats des marqueurs sériques maternels au 2e trimestre aux résultats du test combiné du 1er trimestre.
Le dépistage séquentiel conditionnel
En fonction des résultats du test combiné, les femmes sont classées dans un des 3 groupes de risque suivants : risque élevé, intermédiaire ou faible. Les seuils de risque au sein de ces groupes varient en fonction de la définition des groupes de risque. La réalisation d’un caryotype fœtal précoce est proposée aux femmes appartenant au groupe à risque élevé. Les femmes du groupe à risque faible après test combiné sont rassurées et le double, triple ou quadruple test ne leur est pas proposé. En revanche, le dosage des marqueurs sériques du 2e trimestre est proposé aux femmes appartenant au groupe à risque intermédiaire et le risque
42
final comporte la combinaison du résultat du test combiné au résultat du double, triple ou quadruple test [54].
7.4 / Les facteurs qui influencent les performances du dépistage
Certains facteurs influencent les performances du dépistage. Un ajustement par un facteur de correction est nécessaire.
7.4.1 / L’âge gestationnel
Les taux des marqueurs sériques différents avec l’âge gestationnel. Une datation précise par échographie est nécessaire pour un dépistage précis au premier et deuxième trimestre [131]. 7.4.2. / Le poids
Les taux des marqueurs sériques différents avec le poids de la mère. Un ajustement du risque pour le dépistage au premier et deuxième trimestre est nécessaire. En raison des différences entre le poids moyen de la population servie et la population source, les formules de correction du poids publiées ne sont pas universelles. Chaque laboratoire devrait calculer son propre facteur de correction du poids.
7.4.3 / L’âge maternel
L’âge maternel utilisé pour la détermination du risque est celui de la donneuse au moment du prélèvement. Un ajustement du risque pour le dépistage au premier et au deuxième trimestre est nécessaire.
7.4.4 / Le diabète insulinodépendant
Les taux de l’AFP et de l’uE3 sont plus bas chez la femme diabétique. Les autres marqueurs ne changent pas. Un ajustement du risque pour le dépistage du deuxième trimestre est nécessaire [132]. L’estimation précise du risque pour le test combiné du premier trimestre nécessite un ajustement de la PAPP-A en cas de diabète de type 2 chez la femme enceinte [133]
.
7.4.5 / L’origine ethnique
Les taux de l’AFP, de la hCG totale, de la PAPP-A, de l’uE3 et de l’inhibine A varient selon l’origine ethnique de la femme. Un ajustement du risque pour le dépistage du premier et du deuxième trimestre est nécessaire. Par ailleurs, les mesures de la CN sont variables selon l’origine ethnique de la femme cependant, elle ne justifie pas un ajustement du risque pour le dépistage du premier trimestre.
43
L’âge maternel est remplacé par l’âge de la donneuse au moment du prélèvement de l'œuf. En raison du traitement hormonal, les taux de la PAPP-A, du β-hCG, de l'hCG totale et de l’uE3 sériques changent. Un ajustement du risque pour le dépistage du premier et deuxième trimestre est nécessaire.
7.5 / Les autres anomalies dépistées par les marqueurs biochimiques
En pratique d’autres anomalies sont dépistées par les marqueurs sériques :
-La PAPP-A- l'AFP, l’uE3, la hCG , l'inhibine et la clarté nucale sont utilisés pour le dépistage de la trisomie 18, 13, le syndrome de Turner et le syndrome de Smith-Lemli-Opitz [118, 134, 135]
.
-Les marqueurs sériques ont la possibilité de détecter d’autres anomalies liées à la grossesse telle que l’éclampsie, le placenta prævia, le travail prématuré, la rupture prématurée des membranes, l’avortement spontané, la mort fœtale in utero, le faible poids de naissance et les anomalies structurelles fœtales [136, 113, 137].
8 / Le dépistage non-invasif
L’INSERM a rapporté « sur 800 000 grossesses par an, plus de 80 000 femmes subissent le test invasif, qui déclenche plus de 800 fausses couches de fœtus sains » [138]. D’où l’intérêt de mettre en place d’autres techniques non-invasives et plus performantes comme alternatives à l’amniocentèse et à la ponction des villosités choriales pour leur risque de fausse couche. Grâce aux avancées rapides de la technologie génétique, le dépistage non-invasif du SD permet un dépistage précoce à partir de 7-8 SA avec une sensibilité de 99 % et un TFP de 0,1 % [139] avec comme risques uniquement ceux liés à un prélèvement sanguin. Actuellement, le DPNI est devenu de plus en plus accessible dans les pays développés, mais son coût reste cher et il n’est pas remboursé par les assurances maladies [140].
Plusieurs techniques sont rapportées dans la littérature :
8.1 / La recherche de cellules fœtales circulantes :
Elle est basée sur le recueil de cellules trophoblastiques dans le sang maternel circulant, cependant son analyse est difficile du fait du faible taux de cellules circulantes et du rendement médiocre des méthodes d’enrichissement en cellules fœtales et de la mauvaise conservation de l’intégrité de l’ADN des cellules fœtales circulantes. Une amplification génomique pour réaliser des techniques de cytogénétique moléculaire est nécessaire [141].



![Tableau 1-3 : performances des marqueurs échographiques du deuxième trimètre pour le DPSD [107]](https://thumb-eu.123doks.com/thumbv2/123doknet/15043036.692206/32.892.105.790.187.682/tableau-performances-marqueurs-échographiques-deuxième-trimètre-dpsd.webp)
![Tableau 1-4 : performances du test combiné pour le DPSD [123] .](https://thumb-eu.123doks.com/thumbv2/123doknet/15043036.692206/36.892.109.796.152.449/tableau-performances-test-combiné-dpsd.webp)
![Tableau 1-5 : performances des différentes combinaisons des marqueurs du deuxième trimestre associées à l’âge maternel [114]](https://thumb-eu.123doks.com/thumbv2/123doknet/15043036.692206/39.1263.103.1136.166.785/tableau-performances-combinaisons-marqueurs-deuxième-trimestre-associées-maternel.webp)