HAL Id: dumas-01402410
https://dumas.ccsd.cnrs.fr/dumas-01402410
Submitted on 24 Nov 2016HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires
Diatomées et odontologie légale : mise en place d’un
protocole méthodologique pour l’étude de la diffusion
passive des diatomées au niveau des dents au sein d’un
milieu de culture
Jane Gourgues
To cite this version:
Jane Gourgues. Diatomées et odontologie légale : mise en place d’un protocole méthodologique pour l’étude de la diffusion passive des diatomées au niveau des dents au sein d’un milieu de culture. Chirurgie. 2016. �dumas-01402410�
Université de Bordeaux
Collège des Sciences de la Santé
UFR des Sciences Odontologiques
Année 2016 N°74
Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN CHIRURGIE DENTAIRE
Présentée et soutenue publiquement par Jane GOURGUES
Née le 30 mai 1992 à Bordeaux (33), France Le 17 novembre 2016
Diatomées et odontologie légale
Mise en place d’un protocole méthodologique pour l’étude
de la diffusion passive des diatomées au niveau des dents
au sein d’un milieu de culture
Directeur de thèse Docteur Christophe BOU
Membres du Jury
Président Mme M.-J. BOILEAU Professeur des Université
Directeur M. C. BOU Maître de Conférences des Universités Rapporteur Mme K. LEVET Assistante Hospitalo-Universitaire Assesseur Mme C. BADET Maître de Conférences des Universités
MAJ 01/10/2016
M. TUNON DE LARA Manuel M. PELLEGRIN Jean-Luc
Mme BERTRAND Caroline 58-02
Mme ORIEZ-PONS Dominique 58-01
M. FRICAIN Jean-Christophe 57-02 M. LASSERRE Jean-François 58-02
Mme Caroline BERTRAND Prothèse dentaire 58-02
Mme Marie-José BOILEAU Orthopédie dento-faciale 56-02
Mme Véronique DUPUIS Prothèse dentaire 58-02
M. Bruno ELLA NGUEMA Sciences anatomiques et physiologiques - Biomatériaux 58-03 M. Jean-Christophe FRICAIN Chirurgie buccale – Pathologie et thérapeutique 57-02
Mme Elise ARRIVÉ Prévention épidémiologie – Economie de la santé – Odontologie légale 56-03
Mme Cécile BADET Sciences biologiques 57-03
M. Etienne BARDINET Orthopédie dento-faciale 56-02
M. Michel BARTALA Prothèse dentaire 58-02
M. Cédric BAZERT Orthopédie dento-faciale 56-02
M. Christophe BOU Prévention épidémiologie – Economie de la santé – Odontologie
légale 56-03
Mme Sylvie BRUNET Chirurgie buccale – Pathologie et thérapeutique 57-02 M. Sylvain CATROS Chirurgie buccale – Pathologie et thérapeutique 57-02 M. Stéphane CHAPENOIRE Sciences anatomiques et physiologiques 58-03 M. Jacques COLAT PARROS Sciences anatomiques et physiologiques 58-03 M, Jean-Christophe COUTANT Sciences anatomiques et physiologiques 58-03
M. François DARQUE Orthopédie dento-faciale 56-02
M. François DE BRONDEAU Orthopédie dento-faciale 56-02
M. Yves DELBOS Odontologie pédiatrique 56-01
M. Raphael DEVILLARD Odontologie conservatrice- Endodontie 58-01
M. Emmanuel D'INCAU Prothèse dentaire 58-02
M. Dominique GILLET Odontologie conservatrice – Endodontie 58-01
M. Jean-François LASSERRE Prothèse dentaire 58-02
M. Yves LAUVERJAT Parodontologie 57-01
Mme Odile LAVIOLE Prothèse dentaire 58-02
M. Jean-Marie MARTEAU Chirurgie buccale – Pathologie et thérapeutique 57-02
Mme Javotte NANCY Odontologie pédiatrique 56-01
M. Adrien NAVEAU Prothèse dentaire 58-02
Mme Dominique ORIEZ Odontologie conservatrice – Endodontie 58-01 M. Jean-François PELI Odontologie conservatrice – Endodontie 58-01
Directrice
Directrice Adjointe – Chargée de la Formation initiale
Directeur Adjoint – Chargé de la Recherche Directeur Adjoint – Chargé des Relations Internationales
PROFESSEURS DES UNIVERSITES
MAITRES DE CONFERENCES DES UNIVERSITES
UNIVERSITE DE BORDEAUX
COLLEGE DES SCIENCES DE LA SANTE
UNITE DE FORMATION ET DE RECHERCHE DES SCIENCES ODONTOLOGIQUES
ENSEIGNANTS DE L'UFR
Président
M. Philippe POISSON Prévention épidémiologie – Economie de la santé – Odontologie
légale 56-03
M. Patrick ROUAS Odontologie pédiatrique 56-01
M. Johan SAMOT Sciences biologiques 57-03
Mme Maud SAMPEUR Orthopédie dento-faciale 56-02
M. Cyril SEDARAT Parodontologie 57-01
Mme Noélie THEBAUD Sciences biologiques 57-03
M. Eric VACHEY Odontologie conservatrice – Endodontie 58-01
Mme Audrey AUSSEL Sciences anatomiques et physiologiques 58-03 M. Wallid BOUJEMAA AZZI Odontologie conservatrice – Endodontie 58-01 Melle Camille BOULÉ-MONTPEZAT Odontologie pédiatrique 56-01
M. Mathieu CONTREPOIS Prothèse dentaire 58-02
M Jean-Baptiste CULOT Sciences anatomiques et physiologiques 58-03 Mme Clarisse DE OLIVEIRA Orthopédie dento-faciale 56-02 M. Cédric FALLA Prévention épidémiologie – Economie de la santé – Odontologie
légale 56-03
M. Guillaume FENOUL Odontologie conservatrice – Endodontie 58-01
Mme Elsa GAROT Odontologie pédiatrique 56-01
Mme Olivia KEROUREDAN Odontologie conservatrice – Endodontie 58-01 Mme Alice LE NIR Sciences anatomiques et physiologiques 58-03 Mme Karine LEVET Prévention épidémiologie – Economie de la santé – Odontologie
légale 56-03
M. Alexandre MARILLAS Odontologie conservatrice – Endodontie 58-01
Mme Marie MÉDIO Orthopédie dento-faciale 56-02
Mme Darrène NGUYEN Sciences biologiques 57-03
M. Ali NOUREDDINE Prothèse dentaire 58-02
Mme Chloé PELOURDE Orthopédie dento-faciale 56-02
M. Mathieu PITZ Parodontologie 57-01
Mme Charlotte RAGUENEAU Prothèse dentaire 58-02
M. Clément RIVES Odontologie conservatrice – Endodontie 58-01
M. François ROUZÉ L'ALZIT Prothèse dentaire 58-02
M. François VIGOUROUX Parodontologie 57-01
Remerciements
A notre président de thèse,
Madame le Professeur Marie-José BOILEAU
Professeur des Universités – Praticien HospitalierSous-section Orthopédie dento-faciale 56-02
Je vous remercie sincèrement du très grand honneur que vous me faites d’avoir accepté la présidence de mon jury de thèse. Veuillez recevoir l’expression de ma gratitude et de mon profond respect.
A notre directeur de thèse,
Monsieur le Docteur Christophe Bou
Maître de conférences des Universités – Praticien Hospitalier
Sous-section Prévention épidémiologie – Economie de la santé – Odontologie légale 56-03
Je vous remercie de m’avoir fait découvrir ce sujet, de votre motivation et de votre enseignement au cours de ces dernières années. Votre enthousiasme à l’hôpital comme au laboratoire a été communicatif et moteur dans la réalisation de cette thèse. Merci encore !
A notre rapporteur de thèse,
Madame le Docteur Karine Levet
Assistante Hospitalo-Universitaire – Praticien Hospitalier
Sous-section Prévention épidémiologie – Economie de la santé – Odontologie légale 56-03
Je vous remercie du temps accordé à la relecture et à la correction de mon travail ainsi que pour votre gentillesse et votre disponibilité. Veuillez accepter mes remerciements les plus sincères.
A notre assesseur de thèse,
Madame le Docteur Marie-Cécile Badet
Maître de conférences des Universités – Praticien Hospitalier Sous-section Sciences biologiques 57-03
Je vous suis très reconnaissante d’avoir accepté de faire partie de ce jury. Votre aide et votre bonne humeur ont toujours contribué à l’agréable ambiance de
Remerciements personnels
A
Eshane
, pour tout !A mes parents, mes grands-parents et le reste de la famille
A Pierre
A Natha, à Nicolas
A Sarah
, pour toutes ces années d’amitié, pour ces belles randonnées et petits voyages passés et à venir !A Maeva
pour la motivation, les mangues josé, les nombreux rangs tricotés ensemble!A Mélissa
, pour ta joie de vivre à toute épreuve et pour ces années à côté de toi en amphiA Noémie et Anael
pour votre bonne humeur et tous ces kilomètres de piscine et de couloirs de Saint-André parcourus ensembleA Mathilde,
ma petite binôme !A Islaine, Juliette, Sylvain, Clément
et les autresA Maxime
pour notre amitié durable !Table des matières
Introduction ...9
1 – Rappels sur les diatomées et leur utilisation en médecine légale ...11
1.1 Généralités sur les diatomées (1–3) ...11
1.2 Les diatomées en médecine légale ...12
1.2.1 Le diagnostic de noyade (1,4–7) ...12
1.2.2 Le test de la diatomée... 13
2 – Elaboration d’un milieu de culture ...15
2.1 Problématique ...15 2.2 Hypothèse ...15 2.3 Objectifs...15 2.4 Méthodologie...16 2.5 Résultats ...16 2.6 Discussion ...19 2.7 Conclusion ...20
3 – Protocole de décontamination par NaOH ...21
3.1 Problématique ...21 3.2 Hypothèses ...22 3.3 Objectifs...22 3.4 Méthodologie...22 3.5 Résultats ...23 3.6 Discussion ...26 3.7 Conclusion ...27
4 – Protocole d’extraction de la moelle osseuse et de la pulpe dentaire...28
4.1 Problématique ...28 4.2 Hypothèse ...28 4.3 Objectifs...29 4.4 Méthodologie...29 4.4.1 Premier Protocole : ... 30 4.4.2 Deuxième Protocole :... 32
4.5 Application du protocole pour l’étude de la diffusion passive sur dents humaines
extraites et immergées dans l’aquarium ...33
4.6 Résultats ...35
5 – Application du protocole et test de la diatomées sur dents de noyés ...36
5.1 Méthodologie...36
5.2 Résultats ...38
6 - Discussion...41
6.1 Faux positifs ...41
6.2 Méthodologie et perte de données ...41
6.2.1 Matériel d’observation... 41
6.2.2 Méthode de digestion ... 42
6.2.3 Technique de prélèvement... 42
6.3 Diffusion passive la moelle osseuse ...43
6.4 Diffusion passive dans la pulpe dentaire ...43
6.5 Test de la diatomées sur dent de noyé et perspectives...44
7 – Conclusion...45
Table des illustrations ...47
Introduction
En médecine légale, le diagnostic positif de noyade est l’un des plus délicats à établir. En effet, si une victime est retrouvée dans un milieu aquatique, cela ne signifie pas nécessairement qu’elle s’y est noyée.
Dans la plupart des milieux aquatiques, se développent les diatomées, des organismes unicellulaires eucaryotes. Elles sont pourvues d’un exosquelette en silice ou frustule, essentiel à leur identification. On dénombre ainsi plus de 10 000 espèces de diatomées.
Lors du processus de noyade, la victime meurt par asphyxie après inhalation d’eau. Durant la phase agonique, les diatomées présentes dans l’eau pénètrent dans l’organisme de la victime par les poumons et sont distribuées à travers les alvéoles pulmonaires dans les organes tels que le cerveau, les reins, la moelle osseuse via la circulation sanguine. En médecine légale, le test de la diatomée permet de détecter ces diatomées notamment dans la moelle osseuse, et leur présence est un élément clé pour établir un diagnostic positif de noyade.
Il est communément admis que si la victime était déjà morte avant son immersion, les diatomées ne sont pas distribuées dans ses organes en absence de circulation sanguine. Cependant, il peut exister des faux positifs dans le test de la diatomée car des phénomènes de diffusion passive inhérents à des séjours prolongés dans l’eau, en particulier dans des cas de décomposition avancée du corps ou de blessures type fracture avant la noyade peuvent être à l’origine d’une contamination au sein de la moelle osseuse.
Trouver un milieu « protégé » au sein de l’organisme humain et qui présente une vascularisation semble indispensable pour valider le test de la diatomée comme indicateur fiable dans le diagnostic de la noyade. Une structure anatomique qui présente l’ensemble de ces indications est le système dentaire et en l’occurrence la pulpe dentaire. En effet, l’anatomie dentaire et les diverses structures histologiques la composant, permettraient de réduire l’obtention de faux positifs dus à une diffusion passive tout en simplifiant le protocole de prélèvement.
Précédemment, le travail du Dr Emile Hourqueig (1) a permis de mettre en évidence la présence de ces phénomènes de diffusion passive sur des os de volailles fracturés et fissurés au préalable, avant leur immersion. En revanche, les expérimentations effectuées sur des os intacts de volaille et de la pulpe dentaire d’agneau, ne permettaient pas, lors de l’analyse des résultats, d’établir avec certitude si la présence de diatomées était due à une diffusion passive, eu égard au temps d’immersion ou à une contamination externe occasionnée par les diverses manipulations de laboratoire au cours de ces prélèvements.
Les objectifs de notre travail sont :
- Dans un premier temps, mettre en place un « biotope » constitué d’un aquarium comprenant des apports successifs de prélèvement d’eau de rivière contenant des diatomées. Ce milieu nous permettra de mettre en immersion des structures anatomiques afin de valider ou pas le processus de diffusion passive
- Dans un second temps, afin d’éliminer les nombreuses contaminations instrumentales occasionnées lors des divers stades de prélèvement et d’analyse, une étude évaluative d’une solution d’hydroxyde de soude à des concentrations différentes permettra de définir le dosage adéquat et le temps requis nécessaire pour permettre une élimination complète des diatomées au niveau des divers instruments et accessoires qui seront utilisés.
- Dans un troisième temps, l’étude d’une éventuelle diffusion passive sur des os longs d’animaux et sur dents humaines isolés et immergés dans notre biotope comprenant les diatomées sera évaluée.
1 – Rappels sur les diatomées et leur utilisation en
médecine légale
1.1 Généralités sur les diatomées (1–3)
Les diatomées sont des algues microscopiques, unicellulaires, ayant pour particularité de posséder un exosquelette de silice appelé frustule. Elles sont présentes dans la majorité des milieux aquatiques et vivent grâce à la photosynthèse et aux échanges avec le milieu. Elles absorbent le dioxyde de carbone pour synthétiser des carbonhydrates, essentiels à la chaine alimentaire marine.
Le développement des diatomées dépend de plusieurs facteurs tels que la température, le pH, la salinité, la teneur en silice des eaux… Chaque diatomée vit dans un équilibre écologique caractéristique de son espèce.
Il existe des diatomées d’eau douce et des diatomées marines. De plus, dans certains milieux humides et à proximité de points d’eau, des diatomées aérophiles peuvent se trouver sur des objets non immergés. Des diatomées peuvent aussi survivre dans des milieux extrêmes à pH très élevés ou très bas, et à de hautes températures. Il y a environ 100 000 espèces répertoriées mais il en existe sans doute beaucoup plus.
Les diatomées planctoniques vivent en eau libre et prédominent dans les cours moyens et inférieurs des grands fleuves.
Les diatomées périphytiques se développent en profondeur et sont présentes sous formes fixées ou libres. Elles peuvent évoluer en colonies grâce à la sécrétion de mucus ou de filaments de chitine.
Les frustules sont composés d’une épithèque et d’une hypothèque qui s’emboitent pour envelopper la cellule, d’où le nom de diatomée, dérivé du grec diatomos (« coupé en deux »). Chaque thèque est composée d’une valve (épivalve et hypovalve) avec des cingulums composés de copulae.
Le frustule est poreux (aréoles) pour permettre les échanges avec le milieu. Ces pores constituent les différentes ornementations conférant aux diatomées leurs caractéristiques permettant leur identification. Le frustule est ainsi observé en microscopie en face valvaire ou en face connective, face où l’on distingue l’épithèque et l’hypothèque.
On distingue ainsi les diatomées pennées avec raphé (odre Bacillariophyceae) et sans raphé (Fragilariophyceae), et les diatomées centriques (Coscinodiscophyceae). Chaque ordre est divisé en sous-ordres et familles
Les diatomées ont plusieurs modes de reproduction.
La phase végétative est non sexuée. Elle s’effectue par bipartition : une cellule mère donnant naissance à 2 cellules filles. Chaque cellule fille garde une des deux thèques de la diatomée d’origine et synthétise l’autre moitié de la boîte. Ainsi au cours des cycles, les diatomées diminuent en taille.
Lorsqu’un certain seuil de taille est atteint, les diatomées peuvent passer en phase sexuée ou phase de rajeunissement. Lorsque 2 gamètes se rencontrent, il y a formation d’une auxospore qui, lorsque sa taille est suffisante, devient une nouvelle cellule végétative.
Certaines espèces de diatomées peuvent aussi produire des spores qui survivront à des conditions de vie défavorables pour l’espèce et permettront ainsi la recolonisation du milieu lorsque celui-ci redeviendra favorable.
La culture de diatomées est utilisée dans l’industrie, pour la culture ostréicole, la fabrication de cosmétiques… Leur étude sert aussi à l’établissement d’indices écologiques (qualité de l’eau) et d’indicateurs géologiques.
1.2 Les diatomées en médecine légale
1.2.1 Le diagnostic de noyade (1,4–7)Il existe 3 processus de noyade différents : la noyade vraie ou mort par submersion, l’hydrocution ou noyade-inhibition et la noyade sèche.
La noyade vraie correspond à la pénétration d’un liquide dans les voies aériennes qui entraine une asphyxie secondaire avec perte de conscience et arrêt cardiaque. Ce mécanisme est différent selon que l’immersion se produit en eau douce (hypotonique) ou en eau salée (hypertonique). C’est cette mort par submersion que nous cherchons à déterminer avec la recherche de diatomées intra-corporelles.
La mort par hydrocution est due à un effet de choc thermique lors de l’entrée en contact dans le milieu liquide à basse température. Cela entraîne une vasoconstriction des vaisseaux périphériques à l’origine d’une bradycardie allant jusqu’à la syncope puis l’arrêt cardio-respiratoire.
La noyade sèche ou mort subite est un phénomène peu répandu. L’asphyxie serait due à une contraction soudaine du larynx lors de la pénétration du liquide dans les voies aériennes. L’eau ne pénètre alors pas dans les poumons, on parle donc de noyade sèche.
Le diagnostic de noyade se fait grâce à un faisceau d’indices.
Les signes externes sont observés lors de la levée du corps sur le lieu de découverte du cadavre et lors de l’autopsie.
Les signes internes sont recueillis lors de l’autopsie et sont complétés par des examens histochimiques et anatomo-pathologiques dont fait partie le test de la diatomée.
Mais une grande partie de ces indices s’effacent assez vite en cas de séjour prolongé dans l’eau, d’autant plus que la plupart de ces signes ne sont pas considérés comme des preuves caractéristiques d’une mort par noyade. C’est pourquoi le diagnostic de noyade est un des plus compliqués à établir en médecine légale.
1.2.2 Le test de la diatomée
Le principe du test de la diatomée repose sur la diffusion des diatomées dans la circulation sanguine par les alvéoles puis par les capillaires pulmonaireses. (8) Elles se retrouvent ainsi dans de nombreux organes tels que le foie, les reins, le cerveau et particulièrement la moelle osseuse.
Le test quantitatif sert de principal argument pour le diagnostic de noyade. Le test qualitatif permet la recherche du lieu de noyade avec la comparaison entre les espèces recueillies sur le site présumé de noyade et celles retrouvées durant le test. (9)
La recherche des diatomées peut aussi permettre d’émettre des arguments sur la durée d’immersion d’un corps, en étudiant le dépôt de diatomées sur les restes trouvés, et la recherche de suspects impliqués dans le crime en comparant les diatomées du lieu du crime avec celles retrouvées éventuellement sur le suspect.(10,11)
Mais ce test présente certaines limites.
Il existe des doutes sur la présence physiologique de diatomées dans un corps humain : la consommation de certains aliments comme les fruits de mer, le contact fréquent avec un environnement riche en diatomées (travail dans des carrières de diatomites, pêcheurs, etc.) (4,12) pourraient augmenter le nombre de diatomées ante mortem présent dans l’organisme.
Certaines informations peuvent être perdues lors de l’une des phases du test de la diatomée : la phase de digestion. En effet, cette étape délicate consiste à éliminer le maximum de déchets organiques pour une détection optimale des frustules de silice. Elle peut être effectuée par différentes techniques : (12–15)
- la digestion acide : par de l’acide sulfurique, de l’acide chlorhydrique, de l’acide nitrique,
- la digestion enzymatique grâce à la protéinase K - des techniques de filtration par membranes - la digestion par du soluène-350
De plus lors de ces phases d’analyse, de nombreuses contaminations peuvent s’effectuer, que ce soit lors de la phase de prélèvement ou lors de l’utilisation d’une instrumentation souillée ou de réactifs contenant des diatomées. (4)
Lors d’une mort par hydrocution, il est aussi très probable d’obtenir de faux négatifs puisque l’eau n’a pas eu le temps de pénétrer dans les poumons.(4,16,17)
Des phénomènes de diffusion passive des diatomées lors d’un temps d’immersion prolongée du corps peuvent survenir. Ils ont été étudiés par plusieurs auteurs (5,6,12,18) mais majoritairement sur les tissus mous alors que la moelle osseuse est considérée comme une source très fiable de prélèvement pour le test de la diatomée (19).
Mais même obtenu à partir de prélèvements de moelle osseuse, le test peut être remis en cause. En effet au vu des travaux précédents d’Emile Hourqueig (1) une diffusion passive à travers certains trous nourriciers présents sur les os longs est susceptible d’entraîner des faux positifs . C’est pourquoi la confirmation de la présence de ces gradients de diffusion et l’étude du test de la diatomée sur la pulpe dentaire sont des objectifs pertinents dans l’établissement d’un test plus fiable.
2 – Elaboration d’un milieu de culture
Cette étape préalable est essentielle pour la suite de notre travail, car nous n’avons aucune idée de la durée de survie de ces diatomées après le prélèvement de l’eau et surtout quand le conditionnement s’effectue en dehors de son contexte naturel.
2.1 Problématique
Lors des expérimentations précédentes (1), l’immersion en milieu naturel ouvert des différents éléments anatomiques animaux, nous a imposé la réalisation de contenants, des boîtes en fil de fer permettant de limiter les perturbations occasionnées par le courant de la rivière.
Les auteurs Zhu et Al. (5) utilisaient aussi un système de cages pour immerger les rats dans une rivière. Cependant ce système ne nous semble pas approprié pour nos expérimentations avec des dents humaines, en partie à cause de l’agitation du courant. De plus, pour les expérimentations prévues, il semblait nécessaire d’avoir un milieu « réservoir » de diatomées à portée de main pour des raisons pratiques (météo, accessibilité) mais également « éthiques », s’agissant de restes anatomiques humains.
2.2 Hypothèse
N’ayant aucune expérience dans ce domaine, nous formulons l’hypothèse nulle ou H0 que le taux de survie de ces diatomées au sein de d’un aquarium possédant un oxygénateur, sera équivalent à la survie de diatomées prélevées et contenues dans de simples bouteilles plastiques pendant 30 jours.
2.3 Objectifs
- L’objectif principal est de maintenir des diatomées vivantes le plus longtemps possible dans un milieu clos
- L’objectif secondaire est de permettre d’avoir un « réceptacle » assez spacieux pour les futures immersions d’os et de dents
Les paramètres à contrôler pour la survie des diatomées et pour reproduire au mieux leur milieu naturel sont : la température de l’eau et de l’environnement, la luminosité, l’oxygénation de l’eau, la présence de sels minéraux.
2.4 Méthodologie
Après l’achat d’un aquarium de 30 litres avec un oxygénateur, nous avons effectué des prélèvements riches en diatomées au niveau de deux cours d’eau : Le Touch (affluent de la Garonne dans le département de la Haute Garonne) et l’Espagno (Landes), que nous avons transféré dans l’aquarium. Deux enrichissements en diatomées ont été effectués en 8 mois, liés à une évaporation naturelle.
Les prélèvements de diatomées ont été effectués par brossage et grattage des rochers des lits des 2 cours d’eau. Nous avons aussi prélevé des roches, de la vase, du sable et des animaux d’eau douce (crevettes, larves de libellule, escargots d’eau douce…) pour reproduire au mieux le biotope.
Pour évaluer la survie des diatomées dans l’aquarium, nous avons effectué les prélèvements sur le fond de l’aquarium et les parois à 2 semaines, 1 mois et 3 mois.
2.5 Résultats
Figure 1: L'aquarium (Photo : Jane Gourgues)
L’aquarium a été mis en fonctionnement en octobre 2015
Les examens microscopiques des lames comprenant de l’eau de l’aquarium et ayant pour objectif d’observer des diatomées à l’état frais, sont réalisés à 2
présence de diatomées toujours vivantes et actives mais également de nombreuses frustules vides. (Tableau 1)
Le biotope s’est aussi révélé viable pour les larves de libellules et les escargots ; toujours vivants à 3 mois.
La température de l’eau variait entre 17 et 20 °C.
En janvier 2016, des algues apparaissent et des frustules vides de diatomées ont été observées sur des prélèvements de surface de l’eau.
En avril 2016, avec l’augmentation de la luminosité, un changement d’équilibre est survenu. Les algues sont devenues prédominantes, les larves de libellules ont disparu. Nous avons dès lors décidé de déplacer l’aquarium de façon à ce qu’il soit moins exposé à la lumière directe de la fenêtre. Ainsi un équilibre s’est de nouveau installé sans changement et prolifération d’algues à ce jour.
Gyrosigma Cocconeis placentula Face connective d’une diatomée
Cymbella Face connective Gomphonema
Pinnularia Navicula Melosira
Navicula ou Achanthes
Gomphonema Encyonema
Pinnularia Aulacoseira
Tableau 1: Diatomées de l’aquarium. Les échantillons ont été observés à l’état frais, sans préparation optimale pour l’identification des frustules. (crédit photo
2.6 Discussion
L’objectif de cette première phase était de réussir à constituer un milieu de culture permettant à des diatomées de rester vivantes. Cependant, avec cet aquarium, nous n’avons pas effectué d’évaluation qualitative des diverses espèces de diatomées, les apports d’eau successifs ne permettant pas de faire une étude fiable. Certaines espèces semblent s’être adaptées au nouveau milieu que constitue l’aquarium et d’autres n’ont pas survécu et ont été observées à l’état de frustules vides.
La culture de diatomées reste un domaine très spécifique et le nombre de paramètres à contrôler pour la sélection des espèces à cultiver est trop important pour que cela s’avère possible pour notre étude. De plus, la diversité de diatomées présentes dans l’aquarium se rapproche du milieu naturel.
Pour leur étude de l’évolution post-mortem de cadavres dans l’eau sur modèle animal (6), Di Giancamillo et Al ont utilisé des porcelets déjà morts naturellement immergés dans de l’eau riche en diatomées. Ils ont alors étudié l’évolution des tissus et la présence de diatomées sur différents organes à 1, 2 et 3 mois.
Pour l’immersion des cadavres de porcelets, deux bacs à l’air libre ont été remplis avec deux tiers d’eau courante et un tiers d’eau enrichie en diatomées. Un comptage systématique des diatomées par millimètre de lame a été effectué pour contrôler la richesse en diatomées en début d’étude. Il n’y a pas eu de contrôle de la survie des diatomées à 3 mois, durée de l’immersion des carcasses de porcelets. Il n’est pas non plus précisé les espèces observées et sélectionnées pour cette étude. Lors de l’analyse et la visualisation des lames, il est très intéressant de constater que les espèces retrouvées dans notre aquarium sont de petite taille (comme les naviculas), ce qui demeure compatible avec les espèces susceptibles de participer à des phénomènes de diffusion passive dans l’os ou la dent.
Les diatomées ont une taille variant de 0,2µm à environ 1 mm (2,3) mais seules des diatomées d’une taille inférieure à 30µm sont capables de traverser la barrière alvéolo-capillaire. (7,8,16,20)
On peut supposer que l’on pourra retrouver dans la pulpe des espèces de diatomées similaires à celles retrouvées dans la moelle osseuse (Stephanodicus parvus, Navicula, Synedra ulna…) (21) car la constriction apicale d’une dent est de l’ordre de 210 à 224 μm.
2.7 Conclusion
A cette étape de l’expérimentation, les résultats positifs obtenus sur la vitalité des diatomées au sein d’une structure close sur un intervalle de temps supérieur à 3 mois, nous permettent de pouvoir étudier la diffusion passive de ces diatomées au travers de diverses structures anatomiques, qu’elles soient osseuses ou dentaires.
Afin d’éliminer toutes les erreurs méthodologiques de contamination inhérentes aux diverses manipulations, la phase suivante sera de déterminer le protocole de nettoyage à utiliser pour les divers prélèvements à effectuer suite à l’immersion.
3 – Protocole de décontamination par NaOH
3.1 Problématique
Actuellement, la validité de la méthode de diagnostic de la noyade par les diatomées pose de nombreux doutes (12,22,23), car de multiples contaminations peuvent intervenir aux différents temps opératoires, par exemple lors des prélèvements humains, que ce soit à cause de l’instrumentation utilisée ou de la méthode de prélèvement utilisée. (6,12)
En effet, même dans des cas de noyade dans l’eau de bain, on retrouve des diatomées (24). Nous pouvons donc nous poser la question d’une contamination par l’eau courante utilisée lors d’une autopsie de « routine ».
Dans l’étude de DiGiancamillo en 2010 (6), pour l’étude de la diffusion passive des diatomées sur des porcelets morts avant leur immersion, les risques de contamination croisée sont évoqués mais non détaillés ; et en 2013, Lunetta (12), pour l’étude de la diffusion passive des diatomées sur des cadavres en état de putréfaction, précisait que ce risque de contamination post-mortem augmentait avec le degré de putréfaction du corps mais cette conclusion n’est valable que pour les tissus mous testés, la moelle osseuse n’ayant pas été prise en compte.
Pour éliminer l’hypothèse d’une contamination post-mortem, il faut une règle stricte de prélèvement et de traitement des échantillons. Or il n’existe pas de consensus sur un protocole établi de décontamination de l’instrumentation avant les prélèvements. Les diatomées sont présentes dans quasiment tous les milieux aquatiques même à dose infime (eau du robinet). De plus, le nombre de diatomées pour lequel le test est considéré comme positif diffère selon les auteurs. (12,19)
Les protocoles de décontamination de l’instrumentation trouvés dans la littérature sont vagues : trempage des instruments 24h dans une solution de soude équimolaire pour certains auteurs (4,12,19) ou rinçage à l’eau distillée pour d’autres. (5)
Les protocoles de prélèvements de la moelle osseuse (fémur ou sternum) sont aussi très peu décrits et la question du risque de contamination par les tissus mous environnants n’est pas toujours évoquée.
Un protocole rigoureux et fiable permettrait d’éliminer au maximum les risques de faux positifs par contamination et de mettre en évidence les phénomènes de diffusion passive des diatomées dans la moelle osseuse dans les cas d’analyse de corps putréfiés et de longs séjours dans un milieu aquatique.
3.2 Hypothèses
La soude caustique (NaOH) a été retenue pour mettre en place le protocole de décontamination pour ses propriétés dissolvantes sur les composés silicieux et sa solubilité dans l’eau. Elle a, de plus, déjà été évoquée par certains auteurs pour la décontamination des instruments utilisés pour le test de la diatomée.(4,12,19)
Nous établissons alors l’hypothèse nulle : la variation de concentrations de NaOH n’a aucun effet sur les diatomées.
L’hypothèse alternative sera que la concentration de NaOH a une influence sur la destruction des frustules de diatomées.
3.3 Objectifs
- Observer la quantité de frustules de diatomées résiduelles après trempage dans différentes concentrations de NaOH.
- Observer l’action du NaOH sur les frustules silicieux
- Déterminer le temps et la concentration de NaOH nécessaires pour une destruction totale des frustules
La variable dépendante de l’expérimentation sera alors la concentration de diatomées et les variables indépendantes, la concentration NaOH et le temps.
3.4 Méthodologie
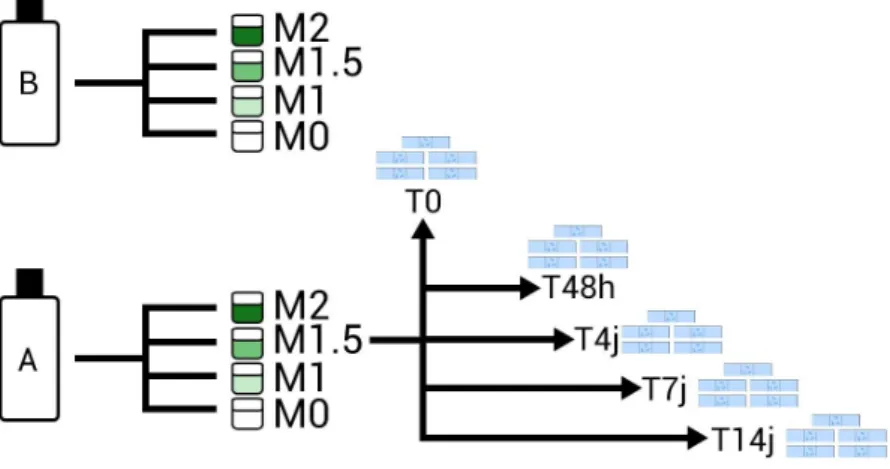
Deux prélèvements (A et B) de 1,5 L d’eau chargée en diatomées ont été effectués sur deux sites différents du Touch.
Chaque prélèvement a été divisé en 4 échantillons de 25 cl environ.
Dans chaque échantillon, de l’hydroxyde de sodium (ou soude caustique) à différentes concentrations a été ajoutée :
- 1 échantillon sans NaOH = M0
- NaOH à 1 mole par litre, solution équimolaire = M1 - NaOH à 1,5 mole par litre = M1,5
- NaOH à 2 moles par litre = M2
Pour une solution équimolaire de soude, la concentration était de 40 grammes de cristaux de NaOH dilués dans 1 litre d’eau distillée ; pour une solution à 1,5 mole par litre, il faut donc 60 grammes de cristaux de NaOH dilués dans 1 litre d’eau distillée, et pour une solution à 2 moles par litre, 80 grammes.
Nous avons effectués des prélèvements dans ces échantillons à différents instants : T=0, T=48h, T=4jours, T=7jours et T=14jours.
Au début, nous avions prévu de répartir sur des lamelles mises à sécher puis fixées avec de l’Eukitt® mais nous avons été confrontés à un problème de visibilité due à la re-cristallisation de la soude, rendant les lames illisibles au microscope.
Nous avons donc mis en place un deuxième protocole avec des prélèvements de 1ml de chaque échantillon après agitation pour homogénéiser la répartition des diatomées dans l’échantillon.
Chaque échantillon a été dilué dans 20 ml d’eau distillée puis nous avons neutralisé l’effet de la soude caustique avec de l’acide chlorhydrique à 23% jusqu’à obtenir un pH neutre dans les échantillons.
De chacun de ces échantillons, cinq lames ont été réalisées et observées à l’état frais au microscope avec un objectif x20.
Le comptage des diatomées a été systématique pour chaque lame. Dès qu’une frustule était identifiable, même incomplète, elle a été comptabilisée.
Figure 2: Protocole NaOH (source : Jane Gourgues)
3.5 Résultats
40 échantillons ont été réalisés et 200 lames observées.
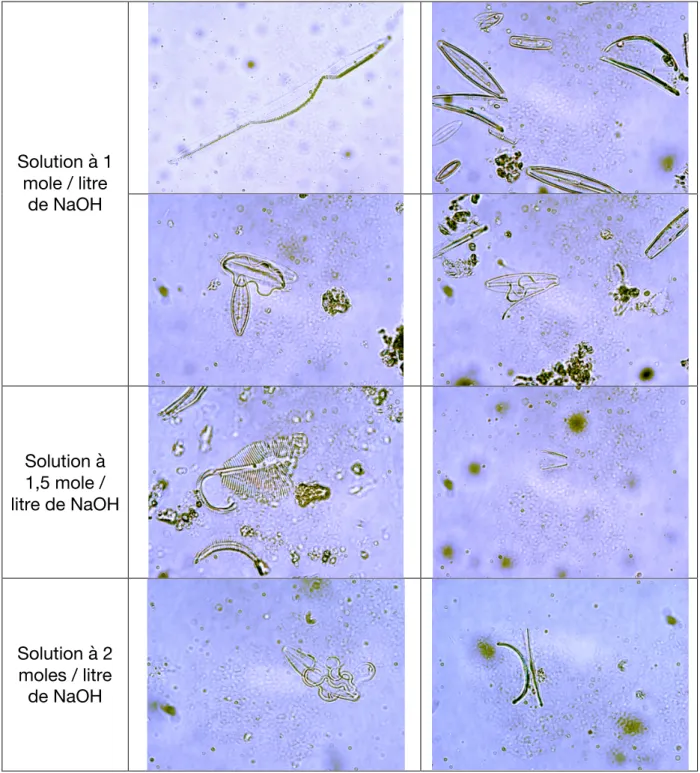
Sur la structure même des frustules, nous avons constaté une déformation et une destruction progressive des frustules silicieux en fonction du temps et de la concentration de NaOH. (Tableau 2)
L’analyse quantitative du nombre de diatomées par lames en fonction du temps et de la concentration de NaOH a montré que l’effet sur les frustules ne devenait significatif qu’à partir d’une concentration à 1,5 moles par litre. On constate la destruction totale des frustules à partir de deux semaines. (Tableau 3 et Figure 3)
Solution à 1 mole / litre de NaOH Solution à 1,5 mole / litre de NaOH Solution à 2 moles / litre de NaOH
Tableau 2: Résultats qualitatifs: effet de NaOH à 48h sur la structure silicieuse des diatomées (crédit photo Jane Gourgues)
[NaOH] Echantillon lames T0 T48h T4j T7j T14j P1 300 300 300 300 300 P2 300 300 300 300 300 P3 300 300 300 300 300 P4 300 300 300 300 300 A P5 300 300 300 300 300 P1 300 300 300 300 300 P2 300 300 300 300 300 P3 300 300 300 300 300 P4 300 300 300 300 300 0 B P5 300 300 300 300 300 P1 300 292 245 220 21 P2 300 300 231 212 28 P3 300 273 198 198 16 P4 300 298 233 187 20 A P5 300 300 224 209 22 P1 300 298 236 187 10 P2 300 277 197 170 12 P3 300 300 225 179 9 P4 300 284 206 183 15 1 B P5 300 296 188 175 10 P1 300 102 85 35 0 P2 300 93 106 43 1 P3 300 117 65 48 1 P4 300 108 89 39 0 A P5 300 90 71 50 4 P1 300 114 96 61 1 P2 300 102 120 52 0 P3 300 120 54 74 0 P4 300 95 86 69 0 1,5 B P5 300 104 102 54 2 P1 300 72 42 18 1 P2 300 84 57 9 0 P3 300 95 39 27 0 P4 300 93 31 15 1 A P5 300 86 45 12 0 P1 300 53 19 10 0 P2 300 74 13 8 0 P3 300 60 14 7 0 P4 300 52 22 3 0 2 B P5 300 83 20 8 1
Tableau 3: Résultats quantitatifs obtenus après comptage systématique des lames
Figure 3: Nombre de frustules observées en fonction du temps et de la concentration en NaOH
3.6 Discussion
On observe que le trempage des instruments dans une solution équimolaire de soude pendant 24h proposé par Grandmaison et Lunetta (4,12,19) n’est pas suffisant. En 1994, Ludes (25) proposait le trempage de l’instrumentation 24h dans une solution à 2 N de NaOH (2 unité de normalité ce qui correspond pour NaOH à 2 unités molaires). Néanmoins, l’effet de la soude sur les frustules silicieux, quelque soit sa concentration, au bout de 24h ne peut pas être retenu comme suffisant pour une bonne décontamination. Les résultats deviennent significatifs avec une solution de soude concentrée à 2 moles par litre au bout de 4 jours.
Pour obtenir ces résultats, nous avons utilisé des échantillons avec de fortes concentrations diatomées qui ne seraient pas aussi importantes sur une instrumentation utilisée pour des prélèvements post-mortems mais les résultats quantitatifs et qualitatifs de l’effet de la soude sur les frustules démontrent qu’il faut une concentration et une durée de trempage de plus de 48h pour observer une destruction significative des frustules.
Le protocole de trempage des instruments dans une solution de NaOH concentrée à 2 moles par litre au moins 14 jours avant leur utilisation peut ainsi être proposé. L’utilisation de NaOH à de fortes concentrations est néanmoins dangereuse et toutes les précautions d’usage devront être entreprises. Ce protocole est long, il faut donc prévoir une instrumentation décontaminée à l’avance et se pose aussi la question de la conservation de l’instrumentation exempte de diatomées.
Lors de la recherche de frustules dans les prélèvements post-mortem un autre facteur important à prendre en compte est la taille des diatomées observées. En effet, le risque de contamination doit être évoqué pour des frustules de plus de 10 à 30 µm (7,16,20), dimensions au dessus desquelles les diatomées ne peuvent
pas pénétrer les capillaires sanguins.
De plus, la comparaison des frustules retrouvées durant le test avec celles prélevées sur le site de noyade présumé peut aussi aider à déterminer une éventuelle contamination. (26)
3.7 Conclusion
Nous avons établi qu’une concentration de 2 moles par litre de NaOH est susceptible de détruire toutes les frustules d’un échantillon à 14 jours.
Ces résultats nous permettent d’établir un protocole de décontamination de l’instrumentation utilisée pour les prélèvements post mortem destinés au test de la diatomée.
Nous réduisons ainsi le risque de contamination des échantillons aux diatomées présentes à la surface des tissus à prélever (périoste pour la moelle osseuse, émail et cément pour la pulpe dentaire).
4 – Protocole d’extraction de la moelle osseuse et de la
pulpe dentaire
4.1 Problématique
En l’état actuel des connaissances, le test de la diatomée pose un problème lors de cas de putréfaction avancée ou de fracture des os longs. En effet, il est très certain qu’une diffusion passive des diatomées du milieu aquatique s’établisse et ne permette pas d’établir le diagnostic de noyade avec certitude.
Il y a peu d’études dans la littérature sur la diffusion passive des diatomées dans la moelle osseuse (référence actuelle pour le test de la diatomée). (5,6,12,18)
Précédemment, la thèse d’Emile Hourqueig (1) a mis en évidence une diffusion passive sur des os de volaille fracturés immergés avec un gradient de diffusion par rapport à la zone endommagée.
Sur os intacts, des diatomées ont été mises en évidence avec des valeurs en dessous des valeurs seuils. Il existait donc un doute sur une contamination extérieure ou sur l’existence d’une vraie diffusion passive.
Pour les premiers essais sur la pulpe dentaire d’agneau, aucune diffusion passive n’a été démontrée.
Afin d’appliquer le test de la diatomée sur dents de noyés, il est nécessaire de prendre en amont toutes les précautions afin de diminuer et idéalement de supprimer toutes les sources de contamination des prélèvements.
Un protocole systématique et simple est donc nécessaire afin d’extraire la pulpe dentaire de dents et la moelle osseuse de victimes présumées de noyades sans que celle-ci soit contaminée par les diatomées déposées sur l’extérieure de la dent et sur l’instrumentation utilisée.
4.2 Hypothèse
- Le trempage de l’instrumentation dans une solution à 2 moles par litre de NaOH pendant 15 jours suffit à détruire tous les résidus de frustules silicieuses pouvant être présentes sur les instruments
- La décontamination de la surface externe des dents et os à étudier permet de réduire la contamination interne de la pulpe et de la moelle.
4.3 Objectifs
Réduire les contaminations de la pulpe dentaire et de la moelle osseuse par les diatomées potentiellement présentes sur la surface externe des dents de noyés et des diatomées potentiellement présentes sur les instruments.
4.4 Méthodologie
Nous avons déterminé toute l’instrumentation nécessaire au protocole d’extraction de la pulpe dentaire sur dents de noyés
- flacons
- racleurs et limes endodontiques - disques
- pipettes - lames - précelles
Tous les instruments ont été plongés 15 jours dans un bac contenant 2 litres d’une solution à 2 moles par litre de NaOH. Un deuxième bac de soude a été prévu pour le roulement de l’instrumentation afin que chaque instrument utilisé en contact avec des diatomées soit décontaminé 15 jours dans la soude. (Figure 4)
Deux bacs d’eau distillée ont été mis en place pour le rinçage des instruments à la sortie du bac de soude. (Figure 5) L’eau distillée a été contrôlée par 4 lames réalisées avec des échantillons des fonds de chaque bac. Aucune diatomée n’a été détectée sur ces échantillons.
Figure 4: Instrumentation dans la solution à 2M/L de NaOH (photo : Jane Gourgues)
Figure 5: Bacs de décontamination et de rinçage de l'instrumentation (photo : Jane Gourgues)
4.4.1 Premier Protocole :
Dans un premier protocole, nous voulions étudier la diffusion passive des diatomées sur dents de veau et moelle osseuse de poulet.
Nous avons immergé 3 semaines deux os de poulets et une mâchoire de veau pourvue de ses dents dans l’aquarium.
de NaOH à une concentration de 2 moles par litre, afin d’étudier la diffusion passive des diatomées sur modèle animal.
Les dents de veau ont été fixées sur un bloc de polystyrène afin d’éviter le passage de la soude par les apex ouvertes et ainsi de détruire les diatomées potentiellement présentes dans la pulpe (.Figure 7 et Figure 8)
Mais au bout de quelques jours, nous avons observé une destruction des tissus dentaires et osseux, rendant les échantillons non exploitables. (Figure 9)
Figure 7: Dents de veau et os de poulets utilisés pour l'immersion dans NaOH à 2M/L (photo : Jane Gourgues)
Figure 8: Os de poulet et dents de veau immergés dans la solution à 2M/L de NaOH (photo : Jane Gourgues)
Figure 9: Os de poulet et dents de veau après 7 jours d'immersion dans la solution de NaOH à 2M/L (photo : Jane Gourgues)
4.4.2 Deuxième Protocole :
Après l’échec du premier protocole, nous n’avions plus d’échantillons animaux exploitables et avons décidé de changer complètement le protocole et de l’appliquer directement sur les dents humaines.
Pour parvenir à extraire la pulpe de dents immergées ou de noyés, en éliminant les diatomées de surface, nous avons établi un protocole systématique, appliqué à toutes les dents que nous avons analysées. (Figure 10)
Nous avons gratté la surface de la racine la plus proche de l’apex. Ce raclage s’est fait sous rinçage à l’eau distillée et avec un bistouri stérile.
Nous avons ensuite procédé à la coupe de l’apex dentaire avec un disque préalablement décontaminé 15 jours dans la solution de soude à 2M/L.
Avec des limes et racleurs endodontiques décontaminés eux aussi, nous avons extrait la pulpe dentaire.
La pulpe extraite est mise en solution dans un flacon avec de l’eau distillée et le manche des instruments endodontiques est sectionné avec le même disque afin que la partie travaillante de l’instrument soit récupérée dans le flacon sans avoir été en contact avec les gants souillés de l’utilisateur.
Figure 10: Protocole d'extraction de la pulpe de dents de noyés ou immergées (source : Jane Gourgues)
4.5 Application du protocole pour l’étude de la diffusion passive sur
dents humaines extraites et immergées dans l’aquarium
Nous avons prélevé les pulpes de 7 dents que nous avons immergées pendant 3 semaines dans l’aquarium. (Figure 11)
Ces dents provenaient d’extractions effectuées sur des patients présentant des problèmes parodontaux.
Les pulpes de ces dents ont été extraites suivant le protocole décrit au chapitre précédent. (Figure 10)
Nous avons réalisé et observé 10 lames à l’état frais de l’échantillon concentré en pulpes de dents immergées.
Pour chaque lame, toute la surface a été observée et analysée au microscope grossissement x40. Les diatomées retrouvées ont été photographiées le plus souvent possible.
Figure 11: Dents immergées dans l'aquarium (photo : Jane Gourgues)
Figure 12: Instrumentation utilisée pour les prélèvements, après trempage dans la solution de NaOH (photo : Jane Gourgues)
Figure 13: Echantillon des pulpes issues des 7 dents immergées (photo : Jane Gourgues)
4.6 Résultats
Lames 1 2 3 4 5 6 7 8 9 10 Diatomées détectées 0 0 1 navicula 0 0 1 navicula 0 0 0 0Tableau 4:Nombre de diatomées observées sur les lames à l'état frais des échantillons obtenus après prélèvement des pulpes de dents immergées dans
l’aquarium (source Jane Gourgues)
Nous avons donc observé 10 lames à l’état frais et seulement 2 diatomées de type Navicula ont été repérées.
5 – Application du protocole et test de la diatomées sur dents de
noyés
Lors de deux autopsies réalisées à l’Institut médico-légal du CHU de Bordeaux sur des cas de noyade présumée, il a été possible de prélever deux dents sur chaque cadavre. Nous avons donc mis en application le test de la diatomée sur les pulpes dentaires extraites selon le protocole établi précédemment.
5.1 Méthodologie
Nous avons prélevé les pulpes des 4 dents selon le même protocole que précédemment. (Figure 10)
Nous avons ainsi constitué un échantillon pour chaque victime, contenant deux pulpes dentaires extraites. (Figure 18)
Nous avons réalisé et observé 10 lames à l’état frais.
De plus, nous avons voulu appliquer un protocole de digestion à ces échantillons afin d’obtenir une meilleure lisibilité des lames.
La moitié des 2 échantillons des pulpes de noyés a donc été digérée selon le même protocole que la thèse d’Emile Hourqueig (1) avec de l’acide chlorhydrique à 23% puis de l’eau oxygénée (13) et suivant des étapes de décantation et de dilution à l’eau distillée. 5 lames de chacun des 2 échantillons ont été ensuite fixées avec de l’Eukitt®.
De la même façon que pour les dents immergées dans l’aquarium, pour chaque lame, toute la surface est observée et analysée au microscope grossissement x40. Les diatomées retrouvées ont été photographiées.
Figure 14: Dents de noyés après nettoyage de la surface (photo : Jane Gourgues)
Figure 15: Les deux dents de noyés après section au disque de l’apex (photo : Jane Gourgues)
Figure 16: Les deux dents de noyés après section de l'apex (photo : Jane Gourgues)
Figure 17: Instruments endodontiques utilisés pour l'extraction de la pulpe, la partie travaillante sectionnée (photo : Jane Gourgues)
Figure 18: Echantillon de pulpe issue d'une dent d'une victime de noyage supposée (photo : Jane Gourgues)
5.2 Résultats
A l’état frais, 20 lames ont donc été observées par screening et 10 lames fixées à l’Eurkitt® ont été analysées de la même manière. Les résultats et photographies obtenues ont été synthétisés dans les deux tableaux ci-dessous. (Tableau 5 et Tableau 6)
Lames Noyé 1 Noyé 2 1 1 navicula 0 2 0 0 3 1 navicula + 1 cyclotella austriaca 0 4 0 1 navicula 5 0 0 6 1 navicula 0 7 0 0 8 1 navicula 0 9 0 1 navicula 10 0 0
Tableau 5: Nombre de diatomées observées sur les lames à l'état frais des échantillons obtenus après prélèvement des pulpes de dents de noyés
Echantillon Lames Nombre de diatomées Photos N1L1 0 N1L2 1 navicula N1L3 0 N1L4 0 Noyé 1 N1L5 0 N2L1 0 N2L2 0 N2L3 0 N2L4 0 Noyé 2 N2L5 0
Tableau 6: Résultats obtenus après digestion enzymatique des échantillons et fixation des lames à l'Eukitt® (source : Jane Gourgues)
6 - Discussion
Les résultats obtenus sur les dents de noyés semblent être plus probants que sur les dents immergées mais restent non significatifs compte tenu du petit nombre de dents testées.
6.1 Faux positifs
Pour nos expérimentations, nous avons éliminé le risque de contamination des échantillons par le trempage des instruments plus de quatorze jours dans de la soude concentrée à deux moles par litre et par le nettoyage précautionneux de la surface de coupe des dents avant prélèvement de la pulpe.
Durant nos analyses, nous avons retrouvé seulement des diatomées de petite taille, ce qui est un élément favorable dans le sens d’une absence de contamination externe.
Pour les dents que nous avons immergées dans l’aquarium ainsi que pour les dents issues de victimes présumées de noyade, nous n’avions pas de données personnelles sur les patients (âge, alimentation, lieu de vie etc.). Certains éléments auraient pu être mis en corrélation avec la présence de diatomées dans leur pulpe dentaire car pour certains auteurs tels que Lunetta et Al. et Yen et. Al. (12,22), la présence de diatomées en ante-mortem dans l’organisme peut être due à de nombreux facteurs comme: un habitat ou travail proche d’un cours d’eau ou de la mer ou d’une carrière de diatomite, une alimentation riche en produits de la mer, etc. De plus, l’expérience de Krstic et Al. sur des rats ayant eu une alimentation riche en diatomées pendant 7 jours a montré la présence de diatomées dans tous les organes testés dont la moelle osseuse.
6.2 Méthodologie et perte de données
Certaines informations ont pu être perdues au cours de l’analyse des données. En effet, la majorité des lames ont été observées à l’état frais et le screening ou comptage des lames s’est parfois avéré difficile de part les dépôts résiduels toujours observables.
6.2.1 Matériel d’observation
Pour l’observation des lames, nous disposions d’un microscope Olympus BH-2 avec un objectif de grossissement x40.
Il semblerait que la majorité des auteurs utilisent des grossissements plus importants pour la détection des diatomées, grâce à un objectif à immersion. Cela augmenterait le temps de recherche mais deviendrait plus intéressant pour mieux discerner les types de diatomées.
La fixation systématique de toutes les lames constituerait un élément très intéressant pour la vérification ultérieure des lames et une plus haute reproductibilité.
6.2.2 Méthode de digestion
La méthode de digestion acide que nous avons utilisée est simple et rapide, elle a de plus montré ses preuves et présente des résultats satisfaisants pour la conservation des frustules. (7,13)
Mais d’après des études récentes la méthode la plus fiable pour la digestion des débris organiques, nécessaire à une observation très précise des frustules est la digestion enzymatique à l’aide de la protéinase K. Cette méthode a été décrite dans de nombreuses publications.(15,27,28)
De nouvelles méthodes de biologie moléculaire avec détection de l’ADN des diatomées semblent très pertinentes afin d’être certain de ne passer à côté d’aucune trace de diatomées. (29)
Le comptage automatique des frustules en microscopie électronique s’avère être aussi un excellent moyen de détection fiable des diatomées. (30)
Ces méthodes permettraient de s’affranchir d’un certain « entrainement » à détecter les frustules car même en tenant compte de l’extrême diversité des diatomées, de nombreuses frustules peuvent passer inaperçues notamment pour la détection des espèces maritimes qui peuvent présenter des formes moins remarquables que les frustules observées dans notre aquarium. (formes rondes plus discrètes). Cette étape très subjective du test de la diatomée peut aussi être à l’origine d’une absence de concordance quant à la valeur seuil pour lequel un test est considéré comme positif. (12)
6.2.3 Technique de prélèvement
A ce jour, le protocole d’extraction de la moelle osseuse sur les victimes présumées de noyade, n’est pas précisément décrit dans la littérature. Nous avons mis en place un protocole simple et reproductible pour tous nos prélèvements de pulpe dentaire.
Il serait intéressant d’appliquer notre protocole d’extraction de la pulpe dentaire à la moelle osseuse, en prenant en compte un potentiel gradient de diffusion dans la moelle osseuse par rapport à des trous nourriciers. (1)
6.3 Diffusion passive la moelle osseuse
La diffusion passive des diatomées sur modèle animal a été plusieurs fois explorée par de nombreux auteurs.
Svetislav et Al. (18) ont étudié différents groupes de rats, dont un groupe de rats tués puis immergés 7 jours dans une eau riche en diatomées. Une diffusion passive était présente dans les organes mous mais la moelle osseuse n’a pas été testée.
Pour DiGiancamillo et Al. (6), sur des porcelets immergés jusqu’à 3 mois dans des bacs riches en diatomées, la diffusion passive a aussi été mise en évidence à travers les tissus mous mais la moelle osseuse n’a pas été testée.
L’étude de Lunetta et Al. (12) portait sur l’étude de la diffusion passive dans des organes de cadavres en décomposition avancée, par injection d’eau riche en diatomées dans leurs poumons. Là encore, la moelle osseuse n’a pas été vérifiée.
La présence d’une diffusion passive dans la moelle osseuse reste donc un sujet délicat qu’il serait très judicieux d’approfondir.
6.4 Diffusion passive dans la pulpe dentaire
Nous avons pour la première fois testé la présence de diatomées dans la pulpe dentaire humaine sur dents extraites immergées dans l’aquarium. Ces résultats ne paraissent pas significatifs.
Le petit nombre de lames réalisées durant nos expérimentations ne permet pas d’affirmer ou d’infirmer la présence d’une diffusion passive dans la pulpe dentaire. L’étude d’un plus grand nombre d’échantillon paraît nécessaire afin d’obtenir des résultats significatifs et d’en tirer des conclusions exploitables.
La très petite taille d’échantillon de pulpe testée peut aussi laisser supposer une trop grande dilution de l’échantillon
Le modèle animal reste toujours une solution pertinente pour approfondir nos recherches.
Les résultats encourageants sur l’étude de la diffusion passive sur dents d’agneau par Emile Hourqueig en 2015 (1) laissaient penser que la diffusion passive était très faible voire inexistante. Il faut noter que les expériences ont été réalisées sur des dents en place dans leur os alvéolaire.
L’étude de la diffusion passive sur la pulpe dentaire sur mâchoires animales permet de se rapprocher au plus près d’un milieu comparable à celui d’une victime, c’est à dire la présence autour de la dent de la barrière que constituent l’os alvéolaire et le ligament alvéolo-dentaire.
Les aspects éthiques et pratiques sont à considérer pour étudier ces différents facteurs sur modèle humain.
6.5 Test de la diatomées sur dent de noyé et perspectives
Nous avons effectué les premiers tests de diatomées sur dents appartenant à des victimes présumées de noyade.
Jusqu’ici, les principales études sur le test de la diatomée mettaient en rapport les résultats obtenus sur moelle osseuse, rein, poumons ou foie de victimes probables de noyade. Même si le prélèvement de la moelle osseuse est considéré comme l’élément essentiel de la fiabilité du test de la diatomée(4,19), une étude récente de Coelho et Al. (2016) (9) montre la présence de diatomées dans des tissus mous tels que l’estomac et les poumons mais l’absence de diatomées dans la moelle osseuse des 37 cas reste incompréhensible.
Il serait aussi judicieux de comparer des échantillons de moelle osseuse, rein, poumons, foie, et pulpe dentaire sur des victimes présumées de noyade, tout en les mettant en corrélation avec les autres éléments recueillis lors de l’autopsie et lors de l’établissement de l’histoire de la victime (habitudes alimentaire, lieu de vie et travail). L’état bucco-dentaire général de la victime pourrait aussi être pris en compte afin de voir l’impact sur la présence de diatomées ou non dans la pulpe : âge du patient, volume pulpaire, ouverture de l’apex etc.
Il serait aussi intéressant de tester des dents extraites provenant de patients ayant été exposés à un environnement riche en diatomées.
La cartographie des espèces de diatomées d’eau douce et/ou salée reste toujours un enjeu pour comparer les diatomées retrouvées dans le corps de la victime et celles présentes sur site de noyade (24,26,31). Elle peut aussi permettre de relier un suspect à scène de crime (11). Une cartographie des espèces retrouvées au sein d’un même cours d’eau semble trop compliquée à exploiter à des fins de médecine légale en raison des nombreuses variations des proportions d’espèces de diatomées selon les saisons, les variations météorologiques etc. Elle peut en outre servir à déterminer si la noyade a eu lieu en eau douce ou salée. (9)
7 – Conclusion
Le test de la diatomée est aujourd’hui controversé en raison de multiples biais d’interprétation des résultats, dus majoritairement à de nombreuses sources de contamination lors des prélèvements.
Afin d’établir avec certitude la fiabilité du test de la diatomée, l’étude de la diffusion passive des diatomées dans la moelle osseuse s’avère incontournable. D’après les travaux précédents, un doute persiste sur l’existence d’un gradient de diffusion passive dans la moelle osseuse des os longs même si les expérimentations ont été effectuées sur modèle animal. La recherche d’un milieu de prélèvement potentiellement plus fiable tel que la pulpe dentaire est un enjeu non négligeable pour l’établissement du test de la diatomée. Pour cela nous avions besoin : de constituer un biotope riche en diatomées afin de procéder aux expérimentations et d’éliminer les sources de contaminations des échantillons pour une fiabilité augmentée des résultats.
La mise en place d’un milieu réservoir à diatomées s’est avéré être un succès. Les différents contrôles ont mis en évidence la survie d’un nombre important de diatomées dans l’aquarium, ce qui a permis d’étudier la diffusion passive des diatomées sur dents humaines directement en laboratoire. Cela n’aurait pas été possible en milieu naturel.
Afin de réduire au maximum les risques de pollution externe des échantillons, nous avons établi un protocole de décontamination des instrumentations utilisées pour le test de la diatomée. En testant différentes concentrations d’hydroxyde de sodium sur des échantillons riches en diatomées, nous avons démontré qu’un trempage intégral de l’instrumentation utilisée est nécessaire dans une solution concentrée à 2 moles par litre d’hydroxyde de sodium (soit 80 grammes pour 1 litre d’eau distillée) durant 14 jours. Il est donc impératif d’utiliser ce protocole de décontamination pour tout instrument susceptible d’être mis en contact avec les prélèvements effectués.
Nous avons de plus, mis au point un protocole pour l’extraction de la pulpe dentaire sur dents monoradiculées, malgré l’échec d’un premier protocole détruisant les échantillons de moelle osseuse de volaille et de dents de veau procurés afin de préciser la présence ou non d’une diffusion passive.
Ce protocole établi pourrait s’appliquer facilement pour extraire de la moelle osseuse pour de futures expérimentations.
Le succès de ces expérimentations repose sur l’établissement d’une méthodologie fiable et reproductible pour la constitution de futurs échantillons, complétant ainsi les expérimentations précédentes (1) sur l’étude de cette diffusion passive dans la moelle osseuse animale sur os intacts.
Les résultats de l’étude de la diffusion passive des diatomées sur des dents humaines et des premiers tests de la diatomée sur dents de noyés présumés restent
prometteurs bien que non significatifs. Ces résultats restent à confirmer notamment avec des échantillons plus importants.
De nombreux aspects restent à explorer notamment sur les méthodes de préparation des échantillons et de détection automatique des diatomées par microscopie électronique ou par méthode de PCR. L’étude comparative de la détection de diatomées dans la pulpe dentaire et dans les autres organes communément testés comme les poumons et la moelle osseuse est une piste intéressante à explorer, surtout pour des cas de corps en état de putréfaction avancée.