Royaume du Maroc Université Mohammed V
Faculté de Médecine et de Pharmacie de RABAT
MEMOIRE
Pour obtention du diplôme de :
Chirurgie pédiatrique
Présenté par :
Dr. DALERO OMAR
Sous la direction :
Professeur Hicham ZERHOUNI
MOTS CLES : Prolapsus – urètre – traitement chirurgical
Année universitaire : 2020
PROLAPSUS DE L’URETRE
AU SERVICE DES URGENCES CHIRURGICALES
PEDIATRIQUES
DU CENTRE HOSPITALIER UNIVERSITAIRE
IBN SINA - RABAT
(A PROPOS DE 10 CAS)
Introduction ... 1
Matériels et méthodes ... 3
Résultats ... 5
I. Observation ... 6
II. Analyse des résultats ... 7
1. Profil épidémiologique ... 7 1.1. Age de diagnostic ... 7 1.2. Antécédents médicaux ... 8 1.3. Antécédents chirurgicaux ... 8 2. Motif d’hospitalisation ... 8 3. Examen clinique ... 9 4. Examens paracliniques ... 11 5. Traitement ... 11 Discussion ... 14 I. Etiopathogénie ... 15
1. Prolapsus de l’urètre : congénital ou acquis ? ... 15
2. Facteurs de risque ... 17
3. Autres facteurs de risque ... 18
II. Epidémiologie ... 21
1. Fréquences ... 21
2. Ethnie et âge de découverte ... 22
III. Etude clinique ... 24
1. Symptomatologie et mode de découverte ... 24
2. Diagnostics différentiels ... 27
3. Examen clinique ... 28
3.1. Description clinique ... 32
3.2. Classification clinique du prolapsus urétral ... 34
IV. Etude paraclinique ... 35
1. Imageries ... 35
1.1. Echographie pelvienne ... 35
2. Explorations urodynamiques ... 35
2.1. Débimétrie ... 36
4. Biologie ... 38
V. Traitement ... 38
1. Modalités thérapeutiques ... 38
1.1. Traitement médical ... 38
1.2. Traitement chirurgical ... 40
1.3. Autres moyens thérapeutiques... 45
1.4. Quel traitement adopter ? ... 46
1.5. Durée d’hospitalisation... 51
1.6. Impact économique ... 52
2. Evolution ... 52
Conclusion ... 54
1
2
Le prolapsus urétral est une affection peu fréquente (1/3000) qui concerne les filles prépubères et plus rarement les femmes ménopausées. Il s’agit de l’éversion complète de la muqueuse urétrale congestive à travers le sphincter urinaire.
Chez l’enfant, il concerne les filles avec un pic de fréquence de quatre à six ans et il prédomine chez les sujets d’origine sub-saharienne.
Cliniquement, il se présente comme un bourrelet circonférentiel pseudo-tumoral plus ou moins volumineux rosé ou violacé œdématié saignant volontiers. Il se manifeste par des saignements, une dysurie, ou une tuméfaction vulvaire.
Sa présentation est typique, et son diagnostic purement clinique.
C’est une affection qui pose un problème médico-légal. En effet, devant une hémorragie génitale chez une fille impubère de découverte fortuite, les parents, ainsi que les professionnels de santé suspectent en premier lieu un sévice sexuel.
Aucun examen complémentaire n’est nécessaire.
Le traitement peut être médical, mais il est surtout chirurgical, il consiste en la réalisation d’une exérèse circonférentielle de la partie prolabée sur une sonde de Foley, suivie d’une suture muco-muqueuse au fil résorbable par des points séparés. Les résultats sont observés 48h à 72h après l’ablation de la sonde vésicale.
Sur une période de 22 ans, nous avons rapporté 10 cas de prolapsus urétral chez la fille, aux urgences chirurgicales pédiatriques de l’Hôpital d’Enfants de Rabat, et nous avons étudié les différents aspects cliniques et thérapeutiques de cette pathologie, pour faciliter sa prise en charge.
Le but de notre étude est d’attirer l’attention sur deux points importants : 1. Penser au prolapsus de l’urètre devant un saignement vulvaire chez la
fille prépubère.
2. Le traitement reste un grand sujet de controverse, entre le traitement conservateur et la chirurgie.
3
4
Notre étude est rétrospective et concerne une série de 10 patientes, opérées entre février 1998 et avril 2020, présentant un prolapsus urétral, aux urgences chirurgicales pédiatriques de l’Hôpital d’Enfants de Rabat.
Nous avons étudié :
Les antécédents médicaux à la recherche de pathologies chroniques, comme une constipation ou un asthme bronchique qui peuvent être à l’origine d’élévation de la pression abdominale. On a aussi apprécié le statut infectieux de ces filles notamment la recherche d’infections urinaires à répétition et d’oxyuroses.
Les antécédents chirurgicaux.
Les antécédents gynécologiques nous renseignent sur l’âge de la ménarche. Les signes fonctionnels.
L’examen clinique a d’abord recherché les caractères sexuels secondaires selon la classification de Tanner, suivi d’un examen minutieux de la région périnéale.
Les diagnostics différentiels.
Aucun examen complémentaire n’a été nécessaire : 02 de nos patientes ont bénéficié d’une échographie pelvienne, une seule a bénéficié d’un asp., une autre a bénéficié d’un examen cytobactériologique des urines, et toutes ont bénéficié d’une numération formule sanguine, un ionogramme et un bilan de crase sanguine (taux de prothrombine et temps de céphaline activée).
On a réalisé un traitement chirurgical en première intention chez toutes nos patientes, sauf une, qui a bénéficié d’un traitement médical.
La même technique chirurgicale a été utilisée chez toutes les patientes. Toutes les patientes sont sorties sous soins locaux avec bonne évolution. Aucun cas de récidive, de sténose urétrale, ni d’infection n’a été rapporté.
5
6
I. Observation
ATCD : Antécédents
MH : Motif d’hospitalisation
ECBU : Examen cytobactériologique des urines
N Age (ans) Ethnie ATCD MH Clinique Paraclinique Traitement Suites
1 8 Blanche Saignement
vulvaire
Bourrelet circonférentiel violacé, œdématié, saignant au contact
Résection chirurgicale +
suture muco-muqueuse Favorable
2 5 Blanche Saignement
vulvaire Saignement isolé
Traitement médical +
Réduction manuelle Favorable 3 5 Blanche Angines à répétition Saignement
vulvaire Saignement isolé
Résection chirurgicale +
suture muco-muqueuse Favorable
4 11 Blanche Processus
urétral
Bourrelet circonférentiel, pseudo-tumoral, rosé, œdématié, saignant au
contact
Résection chirurgicale +
suture muco-muqueuse Favorable
5 12 Blanche Processus
urétral
Bourrelet circonférentiel, pseudo-tumoral, violacé, œdématié, saignant
au contact
Echographie pelvienne :
normale
Résection chirurgicale +
suture muco-muqueuse Favorable
6 9 Blanche Angines à répétition Convulsions fébriles à l’âge de 5 ans Processus urétral
Bourrelet circonférentiel violacé, œdématié, saignant au contact
Résection chirurgicale +
suture muco-muqueuse Favorable
7 5,5 Blanche Pyélonéphrite aigue à l’âge d’1 an Saignement vulvaire
Bourrelet circonférentiel, rosé, œdématié ASP : normale Echographie pelvienne : normale Résection chirurgicale +
suture muco-muqueuse Favorable
8 5 Blanche Saignement
vulvaire
Bourrelet circonférentiel, pseudo-tumoral, violacé, œdématié, saignant
au contact
Résection chirurgicale +
suture muco-muqueuse Favorable
9 5 Blanche Constipation chronique Oxyurose
Saignement urétral
Bourrelet circonférentiel violacé, œdématié, saignant au contact
ECBU : stérile Parasitologie des selles : oxyurose
Résection chirurgicale +
suture muco-muqueuse Favorable
10 7 Blanche Processus
urétral
Bourrelet circonférentiel, rosé, œdématié
Résection chirurgicale +
7
II. Analyse des résultats
1. Profil épidémiologique
Sur le profil épidémiologique : aucune de nos patientes n’est de race noire, et 9/10 des patientes sont en période de pré puberté.
1.1. Age de diagnostic
Il varie entre 05 ans et 12 ans avec une médiane d’âge de 08 ans. - 50% de nos patientes avaient 05 ans.
- 30% entre 07 et 09 ans. - 20% entre 11 et 12 ans.
8
1.2. Antécédents médicaux
Aucune de nos patientes ne présentait d’asthme ni de pneumopathies, qui pourraient causer une toux chronique, par ailleurs 2/10 (20%) ont présenté des angines à répétition dans l’enfance, une patiente a présenté une infection urinaire, une patiente a présenté des convulsions fébriles, une autre rapporte une constipation chronique et une autre présente une oxyurose, confirmée en per-opératoire.
1.3. Antécédents chirurgicaux
Ils étaient sans particularités.
2. Motif d’hospitalisation
Le motif d’hospitalisation majeur est le saignement vulvaire : 6/10, soit 60%, alors que 40% ont consulté pour un processus de la région urétrale.
9
3. Examen clinique
L’examen clinique réalisé, a permis le diagnostic du prolapsus urétral chez 8/10 des filles soit 80%, qui apparaît dans la majorité des cas comme un bourrelet circonférentiel, pseudo tumoral, plus ou moins volumineux, rosé ou violacé, œdématié, saignant au contact. Dans 20% des cas c’est un examen sous anesthésie générale pour de meilleures conditions d’examen qui a permis de faire le diagnostic du prolapsus urétral.
L’hymen était intact chez toutes les patientes.
Graphique 3 :Examen clinique a l’admission.
0% 10% 20% 30% 40% 50% 60% 70% 80%
Examen normal Prolapsus urétral
10
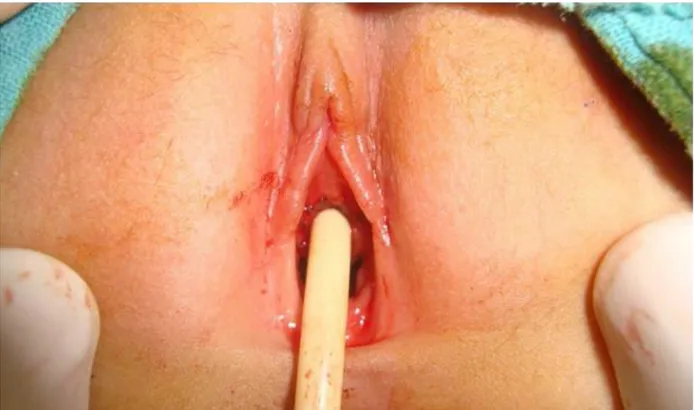
Figure 1 : Prolapsus muqueux à travers le méat urétral chez une fillette de 5 ans
11
4. Examens paracliniques
Un cliché d’abdomen sans préparation a été réalisé chez une patiente, il n’a montré aucune anormalité.
Deux patientes ont bénéficié d’une échographie pelvienne, ces dernières étaient sans particularités.
5. Traitement
Un traitement médical : fait de crème d’œstrogènes et anti inflammatoires non stéroïdiens suivi d’une réduction manuelle a été instauré chez une seule patiente.
Un traitement chirurgical : chez le reste des patientes, il consiste en la mise en place d’une sonde Foley, puis une résection de la muqueuse urétrale prolabée sur le pourtour, suivie d’une suture muco-muqueuse (entre muqueuse urétrale saine et vulvaire), en utilisant la technique des quatre quadrants. La sonde urinaire a été enlevée après 5 jours et les patientes sont sorties sous soins locaux, après une durée moyenne d’hospitalisation de 5 jours.
Les suites opératoires étaient favorables à 100%.
Les patientes ont été revues à 1 mois puis à 6 mois de l’acte chirurgical : Aucun cas de sténose urétrale, de rétention urinaire, ni de récidive.
12
Figure 5 : Aspect post-opératoire.
Figure 4 : Excision de l’excédent de la muqueuse prolabée et suture
13
Tableau 1 : Type de traitement instauré chez chacune de nos dix patientes, avec l’évolution à 6 mois
FQET : Four Quadrant Excision Technique
Patientes Age (ans) Traitement Complications
1 8 Résection avec cathéter in situ (FQET) Aucune
2 5 Réduction manuelle Aucune
3 5 Résection avec cathéter in situ (FQET) Aucune
4 11 Résection avec cathéter in situ (FQET) Aucune
5 12 Résection avec cathéter in situ (FQET) Aucune
6 9 Résection avec cathéter in situ (FQET) Aucune
7 5,5 Résection avec cathéter in situ (FQET) Aucune
8 5 Résection avec cathéter in situ (FQET) Aucune
9 5 Résection avec cathéter in situ (FQET) Aucune
14
15
Le prolapsus urétral se définit comme l’éversion de la muqueuse urétrale. Il a été décrit pour la première fois, il y a près de 250 ans, par Solingen en 1732, et depuis, moins de 400 cas ont été enregistrés.
Sauerland (1929) a recueilli tous les exemples qu'il a pu trouver jusqu’à cette date et a rapporté seulement 270 cas. Il a analysé 211 patientes atteintes : presque la moitié était des enfants.
Après cette période, il y a eu un certain nombre d’études, la grande majorité rapportait un seul cas par étude. Une seule grande série, celle d’Owens et Morse (1968) qui portait sur 54 enfants.
Les premiers auteurs ont remarqué que la pathologie survenait soit dans l'enfance soit à un âge avancé, et rarement entre la puberté et 60 ans.
Le plus jeune âge rapporté était un nouveau-né de sexe féminin âgé seulement de 05 jours (Barnes, 1953).
Récemment des auteurs américains, Peters (1962), puis Owens et Morse (1968), ont noté une prédilection pour les filles noires. Cette préférence raciale ne semble pas affecter les patientes âgées.
I. Etiopathogénie
1. Prolapsus de l’urètre : congénital ou acquis ?
Dans la littérature l’étiologie exacte du prolapsus urétral, reste un mystère. Deux grandes théories tentent d’expliquer la pathologie, on distingue alors le prolapsus congénital et le prolapsus acquis [2], [3].
Les causes congénitales regroupent :
Les causes de faiblesse des structures du plancher pelvien, comme un problème d’attachement inadéquat des structures pelviennes, ou un problème de mobilité de l’urètre comme le syndrome de l’urètre hypermobile.
16
Les anomalies intrinsèques de l’urètre, comme un urètre dilaté, un excès de muqueuse urétrale.
Les désordres neuro musculaires, les malpositions de l’urètre, ou les anomalies du tissu conjonctif (le syndrome d’Ehlers Danos).
Parmi les facteurs favorisants, on retrouve :
Des causes générales : affaiblissement de l’organisme (convalescence de maladies aigues ou chroniques), ou un état constitutionnel particulier (développement imparfait).
Des causes locales :
Malformation de l’urètre. Méat dilaté.
Inflammation vulve-urétrale. Angiome du méat.
Dans une série italienne, l'examen post-mortem chez des enfants par Lowe et al. [2] a signalé que les défauts anatomiques les plus fréquemment détectés étaient :
L’éversion de la muqueuse urétrale. La congestion vasculaire du corpus.
Les causes acquises sont moins fréquentes chez l’enfant et regroupent les traumatismes abdominaux et pelviens et la malnutrition.
Dans ce contexte de traumatismes, il est important de souligner la présence dans certains pays d’Afrique subsaharienne d’un phénomène de mutilation génitale chez la jeune fille, « the Female Genital Mutilation » (FGM) [4].
Cette pratique traditionnelle, consiste à enlever le clitoris et parfois les lèvres.
17
La mutilation la plus extrême étant l'ablation du clitoris, des grandes et des petites lèvres et de l'infibulation (ou circoncision pharaonique) qui consiste à coudre l'entrée du vagin.
Cette pratique est motivée par des motifs traditionnels : préservation de la virginité chez la jeune fille, accroissement du plaisir chez l'homme pendant le coït, et l'interdiction aux femmes l'accès au plaisir. Adesiyun AG et al. a rapporté dans une série de 12 filles que, 16% de ses patientes avaient une forme de mutilation génitale : Female Genital Mutilation (FGM).[4]
Tableau 2 : types de mutilations génitales chez la fille [5]
Type 1 Excision de la peau entourant le clitoris, avec le clitoris qui reste
soit intact, soit excisé partiellement ou complètement
Type 2 Excision de la totalité du clitoris avec tout ou une partie des
lèvres
Type 3 Couverture partielle de l’urètre et de l’orifice vaginal par
assemblage des surfaces créées initialement par les grandes lèvres
Type 4
Le clitoris, petites et grandes lèvres, vulve et vagin sont
endommagés par : cautérisation, substances corrosives, piercing et sutures.
2. Facteurs de risque
Il est donc difficile d’expliquer exactement l’origine du prolapsus urétral, mais une recherche approfondie des facteurs de risque nous a permis de nous en approcher.
La théorie la plus populaire est celle proposée par Lowe et al.[2], qui a décrit la cause comme étant le clivage entre la couche musculaire circulaire-oblique et la couche longitudinale lisse dû à une augmentation de la pression intra abdominale. Cette situation a été soulevée dans plusieurs études et notamment dans une étude de 34 filles recensées dans le département d’urologie infantile à Brooklyn à New-York avec un chiffre de 69% [6].
18
L’élévation de la pression abdominale se voit en cas d’asthme bronchique,
de constipation chronique, de traumatisme abdominal, ou de chirurgie récente.
Ainsi il faudra préciser et rechercher :
L’ethnie : la race noire étant la population la plus touchée. Les facteurs de risque.
Les antécédents chirurgicaux et plus particulièrement les interventions sur le pelvis.
Les tares et traitements associés : les épisodes de toux chronique, de constipation (augmentation de la pression abdominale).
Les troubles pelviens associés : incontinence anale ou difficulté à évacuer les selles, incontinence urinaire ou dysurie, impériosités mictionnelles. L’histoire du prolapsus : circonstances de découverte, évolution.
Traitements déjà entrepris.
Dans notre série aucun de ces facteurs n’a été retrouvé chez nos patientes, une seule patiente sur dix présentait des infections urinaires à répétition, ce qui soulève une autre question : cause ou conséquence ?
En effet, selon certains auteurs, l’infection / mauvaise hygiène a également été proposée comme un facteur [7], bien que cela soit toujours contesté.
3. Autres facteurs de risque
- Le surpoids.Des études précédentes de Valérie et al. [8] et de Sugerman et al. [9], ont rapporté que, les enfants en surpoids sont sujets à développer un prolapsus de l’urètre, par le mécanisme de l’augmentation de la pression abdominale.
19
ans : sur les 20 patientes, on avait enregistré les données concernant le poids et la taille.
Résultats :
Sur les 19 des 20 patientes, 15 avaient un indice de masse corporelle supérieur au 50ème percentile, et 7 avaient un indice de masse corporelle supérieur au 75ème percentile.
Tableau 3 : les données concernant le poids et la taille dans l’étude de Valérie et al.[8]
Dans l’étude de Hiller et al. [6] sur 34 cas au département d’urologie infantile aux états- unis, l’indice de masse corporelle des filles présentant un prolapsus de l’urètre se situait entre 25% -97%, avec un nombre plus important à partir du 75ème percentile (Figure 9) montrant ainsi qu’une augmentation soudaine de la pression abdominale participerait à ce phénomène. [6]
20
Cependant, malgré que le prolapsus urétral apparût chez les enfants avec un poids supérieur au 70ème percentile, son incidence n’a pas augmenté à partir de ce même taux (Figure 9) [6]
Figure 6 : indice de masse corporelle chez des filles avec prolapsus de l’urètre
- Modifications physiologiques.
Lors de l’âge pré pubertaire et de la ménopause, il se produit des modifications de l’appareil génito-urinaire qui sont à la fois histologiques, morphologiques et fonctionnelles, faisant intervenir :
- un taux réduit de collagène. [10]
- une involution des fascias et des ligaments. [10] - une involution des muscles striés pelviens.
- une perte de la tonicité et une diminution de la longueur du vagin.
Ces perturbations seraient dues à un déficit oestrogénique, qui serait selon les dernières études la cause la plus probable du prolapsus urétral.
21
II. Epidémiologie
1. Fréquences
L’incidence du prolapsus urétral chez la fille est de 1/3000 [11, 12], une étude anglaise a rapporté la présence de 270 cas jusqu'en 2009, 46 cas étaient adultes [13].
La « Cochrane Library et Medline Database » ont été consultées pour les publications sur le prolapsus urétral parues entre 1980 et 2011. Il en ressort que le prolapsus urétral reste une affection peu fréquente : les plus grandes séries sont rapportées par Da Silva-Anoma et al (65 cas colligés en neuf ans [14,15], Rudin JE et al (58 cas en 15 ans) [16], Jerkins et al (40 cas en 19 ans) [17], Doletskii Sia et al (39 cas en 19 ans) [18], Hillyer S et al (34 cas en 23 ans) [6].
Notre étude rapporte 10 cas colligée en 22 ans.
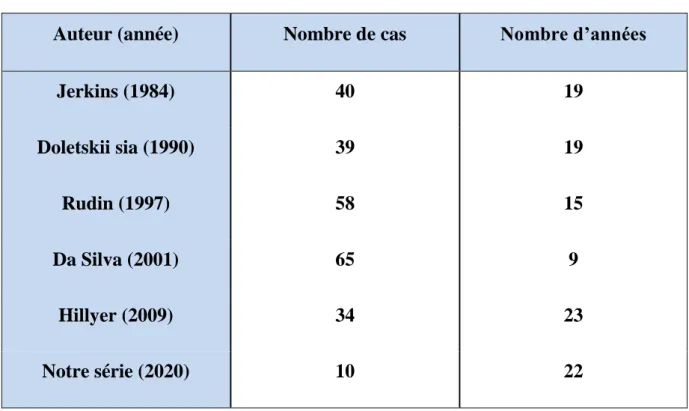
Tableau 4 : Fréquence des cas de prolapsus de l’urètre rapportée par les différentes séries de la littérature
Auteur (année) Nombre de cas Nombre d’années
Jerkins (1984) 40 19 Doletskii sia (1990) 39 19 Rudin (1997) 58 15 Da Silva (2001) 65 9 Hillyer (2009) 34 23 Notre série (2020) 10 22
22
2. Ethnie et âge de découverte
Il existe une prédisposition raciale à développer cette pathologie. En effet, il a été remarqué qu’il y avait une prédominance chez les filles d’Afrique noire [8], [19], [20], [21].
Bien que considéré comme exclusif chez la fillette de race noire, le prolapsus urétral a également été décrit dans une grande série de filles blanches par Radin et al. [16].
Dans une autre série de 23 cas, par Fernandes et al. : plus de la moitié des filles étaient de race blanche [3], d’autres séries rapportées en Russie, Pologne et Corée confirment ce constat [7, 8,16, 18].
Dans notre série 100% des filles sont de race blanche, ce qui prouve que la pathologie ne concerne pas uniquement la race noire.
Le prolapsus de l'urètre chez l'enfant est une maladie des filles prépubères, Akpo et al. [4] a également partagé ce point de vue.
Dans la littérature, cette condition survient généralement chez les filles moins de 10 ans, et l'âge des patientes varie de 4 à 7 ans. [19,22]
Statistiquement, l’âge moyen de 08 ans dans notre étude est en désaccord
avec les 4,9 années signalées par Anveden-Hertzberg et al [23], mais nos résultats montrent aussi un âge de diagnostic prépondérant à 05 ans.
En effet :
- 50% de nos patientes avaient 05ans ; - 30% entre 07 et 09 ans,
- 20% entre 11 et 12 ans.
Nous avons soulevé ici deux questions concernant l’âge de diagnostic : Retard de diagnostic, parce que les malades sont d’abord vues par un
23
médecin non spécialiste, qui tente différents traitements médicaux. Notre série ne contient que 10 cas, donc les statistiques pourraient être biaisées. Une autre tranche d’âge serait aussi intéressée par la pathologie, c’est les femmes en post ménopause de race blanche.
En effet, Richardson et al. A rapporté dans une série de 162 patientes que : deux tranches d’âge sont intéressées par le prolapsus de l’urètre, la pré puberté et la post ménopause [24].
A noter que la majorité des patientes (40%) en pré puberté avaient un âge entre 4 et 7 ans.
Figure 7 : Distribution du prolapsus de l’urètre dans une population de 162 patientes [24]
L’atteinte de ces deux générations serait expliquée par un déficit en œstrogènes [25]. En effet l’extrémité distale du méat urétral serait pourvue d’une quantité importante de récepteurs à l’œstrogène [5].
Enfin, selon des données italiennes une recrudescence estivale est remarquée avec un taux de 53% [26].
Dans notre série ce taux est de 37,5% pour l’été, 50% pour la saison du printemps.
24
III. Etude clinique
1. Symptomatologie et mode de découverte
Le mode de découverte peut être : urinaire (dysurie ou rétention aiguë), douloureux ou hémorragique [27].
Le saignement est le mode de révélation le plus commun [26]. Un saignement vulvaire chez une enfant prépubère est toujours considéré comme un symptôme alarmant à la fois par les parents et par les professionnels de santé.
Généralement, l'une des premières hypothèses est l'abus sexuel ce qui en fait un vrai problème médico-légal.
Par leur ordre de fréquence, voici les motifs de consultations les plus rapportés par la littérature :
- Hémorragie génitale hématurie - Polype urétral - Viol - Polype vaginal - Prolapsus urétral - Malformation génitale - Leucorrhées - Traumatismes
Richardson et al. A rapporté dans une série de 162 patients adultes et enfants que le saignement vulvaire reste le mode de révélation le plus fréquent avec un taux de 88% chez les filles. [24]
25
Tableau 5 : motifs de consultation par leur ordre de fréquence dans la série de Richardson et al. [24]
Cependant, dans une étude anglo-saxonne sur 21 cas en 2011, une masse ou un processus urétral n’est pas rare comme mode de révélation. En effet, (6/21 patients) présentent un saignement vulvaire, (8/21 patients) ont consulté pour une masse, (6/21 patients) pour dysurie, et un seul cas de constipation [28].
Dans notre série : 6 filles sur 10 ont consulté pour saignement vulvaire, et les 4 restantes ont consulté pour une masse de découverte fortuite.
Symptômes Nombre de Nombre de P Filles (%) Femmes (%) Douleur 4(3) 14(47) P< 0.001 Saignement 113(88) 15(50) P< 0.001 Dysurie 33(26) 22(73) P< 0.001 Masse 27(21) 12(40) P< 0.01 Traumatisme 19(15) 1(3) Ns Pression 26(20) 5(17) Ns Abdominale Total 129 30 Ns : non signifiant
26
Graphique 4 : Motifs de consultation dans notre série
Parfois, il s’agit d’une découverte fortuite lors d’un examen systématique. Autres modes de découverte :
Les masses périnéales sont aussi fréquentes, viennent ensuite la dysurie, et les infections urinaires à répétition.
Enfin, le prolapsus peut être asymptomatique.
27
2. Diagnostics différentiels
Le saignement vulvaire pose également un problème de diagnostic différentiel.
Sugar et Graham se sont basés sur l’examen clinique afin de reconnaitre et classifier tout saignement vulvaire chez l’enfant [27], ainsi en présence d’une lésion associée au saignement, le diagnostic différentiel était limité à :
- Un lichen scléreux et atrophique - Une lésion traumatique
- Hémangiome néoplasie
- La présence de caractères sexuels secondaires oriente vers une pseudo puberté précoce
- Un abus sexuel doit être écarté.
En l’absence de lésion visible, il faut penser à une éventuelle hématurie, rectorragies, infection vaginale, néoplasie.
D’autres diagnostics différentiels sont rapportés dans la littérature [30] : - Polype
- Condylome - Urétérocèle
- Hydrométrocolpos - Urètre ectopique
Différentes causes peuvent être à l’origine d’un saignement vulvaire chez la fille prépubère. En présence d’une masse, le premier diagnostic à évoquer est le prolapsus urétral, l’urétérocèle, un hydrométrocolpos, et un abcès péri urétral n’est pas rare.
28
Les condylomes viennent en tête pour les tumeurs bénignes, et les sarcomes pour les tumeurs malignes.
La présence d’une lésion associée au saignement doit faire suspecter en premier lieu un abus sexuel, ce qui est en fait un problème médico-légal.
En l’absence de masse les causes infectieuses et traumatiques sont au premier plan.
Comme le montre ce tableau : [5]
Tableau 6 : Les différentes causes de saignement vaginal chez la fille prépubère [5]
Présence de masse
Anatomique : Prolapsus de la vessie, urétérocèle, urètre ectopique, hydrométrocolpos
Infections : Abcès périurétral Causes malignes : Sarcomes
Causes bénignes : Polype, condylome, hémangiome Traumatismes : post opératoire, sévice sexuel
Absence de masse
Infections : Vulvo-vaginite
Traumatismes : Post opératoire, sévice sexuel Causes vasculaires : Ménarche, coagulopathie
3. Examen clinique [31]
Le diagnostic du prolapsus urétral chez la fille est purement clinique. Ce dernier, bien qu’indolore, n’est pas anodin et nécessite la confiance et la coopération de l’enfant. Le premier temps de la consultation consiste donc à rassurer l’enfant et ses parents et à établir une relation privilégiée avec l’enfant ainsi qu’un espace de parole.
29
La présence des parents lors de l’examen est souhaitable pour les jeunes enfants, mais souvent laissée à leur choix entre 10 et 13 ans. Au-delà de 13 ans, l’adolescente est habituellement vue seule.
Chez l’enfant prépubère
L’examen commence par les mesures de la taille et du poids. Le développement pubertaire est évalué selon le stade de tanner. On réalise ensuite un examen abdominal externe à la recherche d’une cause de douleur spontanée ou provoquée. De nombreuses positions ont été décrites afin de réaliser l’examen gynécologique, la plus adaptée étant celle dite de la « grenouille » : l’enfant est allongée, jambes repliées, talons contre fesses, genoux écartés, correctement éclairée, et le médecin est face à l’enfant. La vulve est non oestrogénisée ; elle est verticale, avec de petites lèvres rose pâle fines et parfois courtes. Le clitoris est visualisé et mesuré après avoir récliné le capuchon clitoridien afin de ne pas confondre un capuchon épais avec une clitoridomégalie. Il est normalement infracentimétrique.
Les grandes lèvres ne recouvrent pas le clitoris et les petites lèvres. Ces grandes lèvres sont ensuite doucement écartées par une traction vers le bas et l’extérieur exercée par les deux pouces posés à leur base afin de bien voir la vulve, l’hymen et le vagin. Le praticien doit absolument éviter une traction latérale des grandes lèvres qui déclenche une tension douloureuse de la fourchette vulvaire et entraîne une réaction de défense entravant la poursuite de l’examen.
L’hymen prépubère est fin, rouge et non oestrogénisé. Sa taille et sa forme sont variables, mais l’on observe le plus fréquemment :
- L’hymen annulaire avec un rebord hyménéal de largeur variable et un orifice annulaire et régulier ;
30
- L’hymen semi lunaire constitué d’un rebord hyménéal postérieur en forme de croissant dont les extrémités se raccordent aux parois latérales de l’orifice vaginal. Il n’existe pas de tissu hyménéal sous-urétral ;
- L’hymen festonné avec un rebord large formant des replis.
Figure 9 : Examen de la vulve de l’enfant.
Les deux premières formes sont plus fréquentes de trois ans jusqu’au début de la puberté, et la dernière est souvent observée avant l’âge de trois ans (fig. 10).
31
En saisissant les grandes lèvres à mi-hauteur et en les attirant vers soi sans tirer, l’hymen s’ouvre et laisse apparaître l’orifice vaginal et les deux tiers inférieurs du vagin. Cette manœuvre est parfaitement indolore et bien tolérée par l’enfant. Certaines configurations hyménéales peuvent parfois amener à s’aider d’une petite sonde souple et arrondie pour déplisser le rebord hyménéal et s’assurer de la perméabilité vaginale. On estime que le diamètre de l’orifice vaginal est de 4 à 5 mm chez l’enfant de moins de cinq ans, puis qu’il reste inférieur à 1 cm jusqu’au début de la puberté. Ces mesures données à titre indicatif varient en fonction de la position de l’enfant, du degré de relaxation du périnée, de la forme de l’hymen et du degré d’œstrogénisation.
En effet, certains hymens intacts permettent une vue de l’orifice vaginal évocatrice, à tort, d’abus sexuel pour un œil inexpérimenté. On doit donc rester prudent en évitant les interprétations hâtives. La toux forcée peut permettre d’identifier un écoulement vaginal. Dans certaines situations, le toucher rectal a sa place afin de ramener un écoulement vaginal leucorrhéique ou sanguin, ou palper l’utérus dans un contexte de douleur pelvienne.
Enfin, il ne faut pas négliger l’examen du périnée et de la marge anale.
Chez l’adolescente
Bien que l’adolescente soit plus apte à comprendre l’intérêt et le déroulement de l’examen gynécologique, son acceptation n’est pas assurée et dépend de multiples facteurs psychologiques, sociaux et culturels. Il faut donc prendre le temps de discuter, mettre en confiance, et connaître l’histoire personnelle et familiale de l’adolescente.
Le déroulement de l’examen clinique est identique à celui de l’enfant si l’adolescente n’a pas eu de rapports sexuels. Dans le cas contraire, le toucher vaginal et l’examen au spéculum sont utiles. La vulve s’est horizontalisée sous l’action des estrogènes, les petites lèvres se sont développées et sont plus pigmentées ; les grandes lèvres recouvrent la vulve. L’hymen a épaissi et pâli, et
32
on observe des sécrétions vaginales physiologiques. L’inspection et la palpation mammaires et des aires ganglionnaires sus-claviculaires et axillaires font partie intégrante de l’examen.
La consultation peut être l’occasion de dépister des facteurs de risque cardiovasculaire, en calculant l’indice de masse corporelle et en mesurant la pression artérielle, d’autant plus si une contraception hormonale est demandée.
Enfin, on peut délivrer des informations sur la vaccination anti-Human PapillomaVirus qui préviendrait la survenue de 70 % des cancers du col de l’utérus. En France, elle est remboursée et indiquée à 13 ans ou en rattrapage entre 14 et 23 ans, avant le début de la vie sexuelle ou durant la première année de la vie sexuelle.
3.1. Description clinique
L’examen clinique permet facilement de faire le diagnostic, le prolapsus de l'urètre a un aspect typique et a été décrit comme une petite masse hémorragique en forme de beignet (doughnut), vulvaire antérieure entourant le méat urétral. [32] Classiquement décrit comme un bourrelet circonférentiel, pseudo tumoral, plus ou moins volumineux, rosé ou violacé, œdématié, saignant au contact, et circonscrivant le méat urétral, le prolapsus peut être total ou ne concerner qu’une partie de sa circonférence. Il peut également se compliquer, dans certains cas [33], l’évolution se fait vers l’ischémie par thrombose. La nécrose donne un aspect ulcéré, friable avec une hémorragie de contact.
Dans notre série, dans 80% des cas l’examen initial fut concluant, pour les 20% restants le diagnostic de prolapsus urétral fut posé sous anesthésie générale.
33
Figure 11 : Prolapsus de l’urètre avec saignement chez une fille de 05 ans [22]
Graphique 5 : Diagnostic du prolapsus de l’urètre à l’admission.
0% 10% 20% 30% 40% 50% 60% 70% 80%
Examen normal Prolapsus urétral
34
3.2. Classification clinique du prolapsus urétral
La classification du prolapsus de l’urètre comprend quatre types [5] : Grade 1 : prolapsus minime ou partiel, sans signes inflammatoires. Grade 2 : prolapsus circonférentiel, avec œdème.
Grade 3 : masse œdémateuse prolabée à travers les petites lèvres. Grade 4 : saignement sévère, ou nécrose ou ulcère du prolapsus.
35
IV. Etude paraclinique
1. Imageries
Aucun examen radiologique n’est nécessaire pour le diagnostic positif du prolapsus de l’urètre [8, 34]. Cependant devant un saignement vulvaire chez une fille prépubère, les chirurgiens pédiatres ainsi que les gynécologues tirent la sonnette d’alarme et demandent systématiquement certains examens à tort, alors qu’un examen clinique minutieux permettra de faire le diagnostic.
1.1. Echographie pelvienne
La prescription systématique d’une échographie pelvienne devant tout problème gynécologique de l’enfant n’est pas de règle. L’examen clinique est souvent suffisant, et l’interprétation des données échographiques doit être prudente et tenir compte des variations physiologiques en fonction de l’âge.
Les indications de l’échographie pelvienne concernent essentiellement les pathologies ovariennes fonctionnelles ou organiques. L’étude échographique de l’utérus et du vagin est indiquée dans les pathologies malformatives, dans les anomalies du développement pubertaire, ou pour le diagnostic de rares tumeurs cervicovaginales [31].
Dans notre étude on a réalisé cet examen chez 2/10 des patientes, il est revenu complètement normal.
2. Explorations urodynamiques [35]
Ces explorations, bien que très importantes dans l’exploration des prolapsus génitaux chez la femme, n’ont aucun intérêt dans le prolapsus urétral chez la fille.
a- Principe : les explorations urodynamiques permettent une évaluation
objective du fonctionnement vésico-sphinctérien et une analyse physiopathologique des symptômes urinaires pour lesquels il existe une terminologie précise. L’exploration urodynamique est habituellement plus
36
qu’un simple examen : sa prescription n’est souvent que le prétexte à une consultation spécialisée dépassant la seule détermination du mécanisme physiopathologique des troubles vésico-sphinctériens. Un ECBU stérile est un préalable à toute exploration.
b- Indications : l’examen urodynamique doit être réalisé soit pour établir un
lien de causalité entre les symptômes et les résultats de l’examen (syndrome d’hyperactivité vésicale, dysurie), soit quand il existe une discordance, soit quand il existe un prolapsus important (> stade II) impliquant une forte incidence des troubles mictionnels et des incontinences potentielles, soit quand une chirurgie est envisagée.
2.1. Débimétrie
Cet examen est utile dans le diagnostic de sténose urétrale post opératoire, il est recommandé de le prescrire 2 à 4 mois après le geste chirurgical.
La débimétrie permet l’étude objective et quantitative de la miction en appréciant le volume mictionnel, le résidu post-mictionnel (obtenu par échographie ou sondage) et le débit urinaire maximal (qmax). Une interprétation est possible dès lors que le volume mictionnel dépasse 150 ml.
Le résidu post-mictionnel est « pathologique » quand il dépasse 10 % du volume mictionnel. Le débit maximal doit être supérieur à 15 ml/s, mais l’aspect de la courbe compte beaucoup ; une courbe normale a un aspect en « cloche » (fig. 16) ; une courbe aplatie, prolongée, évoque une sténose urétrale ; une courbe polyphasique avec plusieurs jets successifs peut rendre compte d’une compression extrinsèque (prolapsus par exemple) ou d’un spasme itératif du sphincter strié (soit fonctionnel, soit neurogène dans le cadre d’une dyssynergie vésico-sphinctérienne). L’existence d’une anomalie pose le problème de son mécanisme : obstruction liée à la cystocèle (effet pelote ou « urethral kinking » des anglo-saxons), ou défaut de contractilité détrusorienne. L’étude pression-débit permet de résoudre cette question.
37
Figure 13 : Débimétrie normale
La courbe du haut représente le débit maximal.
La courbe du bas représente le volume mictionnel (437 ml pour cette patiente).
L’aspect de cette courbe est normal (en « cloche ») avec un débit maximal normal de 35ml/s.
38
3. Endoscopie
L’endoscopie n’a aucun intérêt dans le diagnostic. Si demandée, ce sera par excès, à la recherche d’autres malformations décrites dans ce cadre. En effet, dans une étude de Hillyer et al à New-York, réalisée chez 34 filles sur une période de 23 ans, une cystoscopie fut réalisée chez 2 de leurs patientes, à la recherche d’un urétérocèle [6].
La cystoscopie exclue la présence d'autres malformations du tractus urinaire, souvent associées selon la littérature.
Dans notre étude aucune des patientes n’en a bénéficié.
4. Biologie
Comme pour la radiologie, la biologie n’a pas d’intérêt dans le diagnostic du prolapsus urétral [8,34]. Toujours dans l’étude de Hiller sur 34 filles, l’ECBU a été réalisé chez 32 patientes des 34, aucun n’est revenu positif. [6]
Dans notre série, un ECBU a été demandée et est revenu stérile. Les autres examens (NFS, crase) ont été réalisés dans le cadre d’un bilan pré-opératoire.
V. Traitement
1. Modalités thérapeutiques
Jusqu’à 1985 le traitement du prolapsus urétral était chirurgical. Actuellement la stratégie thérapeutique du prolapsus urétral propose deux options de traitement : le traitement médical et le traitement chirurgical [11, 36, 37].
1.1. Traitement médical
Le traitement médical implique l'utilisation de bains de siège, l'application locale d'antibiotiques et de stéroïdes, les œstrogènes à application locale à utiliser 2 à 3 fois par jour, la durée totale du traitement est de 2 semaines, sans excéder
39
une semaine d’hospitalisation, le traitement pourra être continué en ambulatoire si besoin. L'essence du bain de siège est de diminuer l'enflure et l’œdème [24].
Richardson et al. [24] rapporte dans une série américaine de 5 cas de prolapsus urétral chez la fille, recueillis sur une période de 1 an, que le traitement fut uniquement médical, utilisant : bains de siège, ampicilline, bétadine, et crème d’œstrogènes.
Pour toutes les patientes, le prolapsus a disparu dans une moyenne de deux semaines, sans aucune récidive dans les trois mois qui suivent.
Dans une autre série russe, le traitement fut médical de 28 filles sur une période de 04 jours, avec une bonne évolution chez 25% des cas, alors que 50% ont dû continuer le traitement en ambulatoire avec une évolution tout aussi favorable, et échec du traitement chez les 8 filles restantes [16].
Le traitement médical permettrait de réduire le prolapsus urétral complet circulaire en prolapsus partiel [10].
Cependant, le traitement médical reste un traitement associé à un taux élevé d'échec [11, 16] et une incidence élevée de récidive [16].
En effet Redman et al. A [36] démontré en 1982 que sur une période de trois ans après le début du traitement conservateur, les symptômes à type de saignement, et de dysurie disparaissaient mais que le prolapsus urétral persistait.
Dans une série de 42 patientes traitées médicalement, rapportée par Trotman et Brewster et al. [11], on a remarqué un taux d’échec important de 77%.
L’échec du traitement médical peut-être dû à une mauvaise observance des bains de siège et l’utilisation d’œstrogènes locaux, il faut également ajouter que les antibiotiques locaux n’aboutissent pas, car l'infection n'est généralement pas présente [8].
40
1.2. Traitement chirurgical
Le traitement chirurgical reste le traitement de référence, il permet la restauration de l'anatomie fonctionnelle, en particulier dans les cas de prolapsus sévère avec une muqueuse nécrosée [17].
En 1922, Kelly-Burnman initie la chirurgie du prolapsus de l’urètre par une simple excision du prolapsus suivie d’une simple suture de la muqueuse urétrale. Dans la série de Rudin JE et al. [16] : sur 58 patientes, 40 ont été opérées par la technique de Kelly-Burnman, avec un taux de 10% de complications faites de: sténose, hémorragie, et récidive.
En 1926, Dannreuther innove la technique en trois étapes [24] : 1. Une suture est placée sous le prolapsus
2. Après excision du prolapsus, le point de suture est tracté le long du méat externe de l’urètre afin d’éviter la rétraction de la muqueuse urétrale. 3. Suture des autres points muco-muqueux.
Dans la même optique, celle d’éviter le risque de rétraction de la muqueuse urétrale, des travaux d’innovation ont été proposés par Zeigerman et Kimbrough [38], et Johnston [39].
41
42
D’autres techniques chirurgicales étaient utilisées, la plus célèbre mais aussi très invasive, est celle de Hepburn actualisée par devine et Kessel. [40]
Figure 15 : Technique chirurgicale de Hepburn
The Hepburn procédure [40] Dissection de l’espace de retins
Le prolapsus est tracté vers le haut et la vessie ancrée à la symphyse pubienne.
Figure 16 : la technique chirurgicale d’Owens et morse.
43
Actuellement, il existe différentes méthodes chirurgicales dans le traitement des prolapsus de l'urètre, ils comprennent :
- La ligature de la muqueuse sur un cathéter. - La cautérisation de la muqueuse.
- L'excision de la muqueuse avec un cathéter in situ [8].
L’excision de la muqueuse avec cathéter in situ, est la technique la plus populaire [34]
Dans une étude du Kings County Hospital à New-York sur 20 patientes, toutes traitées chirurgicalement, avec excision de la muqueuse autour d’une sonde de Foley et seulement un cas de récidive après un an [8].
Sanda rapporte une série de 22 cas traitée par excision de la muqueuse sur sonde de Foley, suivie d’une suture muco-muqueuse, les suites opératoires se sont soldés de succès 48 à 72 heures après ablation de la sonde urinaire [42], et seulement un seul cas de rétention urinaire.
Cependant la technique d’excision sur sonde urinaire présente un inconvénient majeur : la rétraction de la muqueuse proximale qui pourrait rendre l’anastomose de muqueuse à muqueuse difficile, ce qui entraîne un risque élevé de sténose post-opératoire du méat [34].
Afin de prévenir cette complication, la technique d'excision des quatre quadrants a été introduite [34] : The Four Quadrant Excision Technique.
Dans cette procédure, les quatre points de suture sont tenus aux positions 3, 6, 9 et 12 heures, ce qui empêche la rétraction de la muqueuse proximale après excision, puis facilite le rapprochement de la muqueuse [4].
Dans une série nigérienne sur 12 patientes, la Four Quadrant Excision Technique a été appliquée chez 7(58%) patientes. L’excision a été réalisée sans cathéter in-situ chez 4(33%) patientes et avec un cathéter in-situ chez une seule patiente.
44
La seule complication de fonctionnement rencontrée dans cette étude était : la rétention urinaire chez une patiente traitée par l'excision sans cathéter in situ. Il n'y avait pas de récidive rapportée dans cette étude.
Figure 17 : Prolapsus de l’urètre
45
1.3. Autres moyens thérapeutiques
Certains auteurs pensent que l'exérèse chirurgicale n'est presque jamais nécessaire et recommandent une simple réduction manuelle sous anesthésie générale qui peut être curative, sinon permet de réduire de façon significative le prolapsus.
En effet cette technique était d’usage dès le début du siècle dernier décrite par Sauerland [43].
Turner et al [44] l’utilisa en 1973 avec succès sur une seule patiente, mais ne la recommanda pas pour autant.
Dans les formes non compliquées, la réduction manuelle sous anesthésie générale est une méthode peu invasive qui présente un risque de réduction partielle et de récidive, respectivement survenues chez 62 % et 12 % des patients dans la série de Holbrook et al. [28].
Autrefois, le prolapsus de l’urètre était traité par du nitrate d’argent, des extraits de plante, l’acide tannique, et même du radium, toutefois le problème majeur de ces techniques, était leur utilisation focale et donc la surface endommagée n’était point contrôlée [24].
Dans notre série le traitement fut médical suivi d’une réduction manuelle chez une patiente, et chirurgical chez les 7 filles restantes. Il consiste en la mise en place d’une sonde Foley, puis une résection de la muqueuse prolabée sur le pourtour suivi d’une suture muco-muqueuse (entre muqueuse urétrale saine et vulvaire), en utilisant la technique des quatre quadrants.
Aucune complication ne fut notée dans notre étude, pour les deux types de traitement.
46
1.4. Quel traitement adopter ?
La question qui se pose ici, est de connaitre les bénéfices du traitement chirurgical par rapport au traitement médical.
Les avis sur la prise en charge du prolapsus de l’urètre sont encore partagés sur les avantages du traitement conservateur par rapport à la chirurgie.
Le traitement conservateur semble être efficace pour la plupart des patientes asymptomatiques sinon avec de légers symptômes. Cependant, son efficacité reste limitée (de 33% dans l'étude de Trotman et Brewster [11] et 38% Holbrook et [28] de misera sur 21 filles dont 13 traitées médicalement), et le taux de récidive est élevé (26% dans l’étude de Radin [16]).
Owen et morse [44] ont traité 2 patientes par des bains de siège, avec une bonne évolution dans 6 à 10 jours.
Esposito et al. [45] rapporte le cas d’une fillette de 3 ans traitée médicalement, récusée de la chirurgie à cause d’une pneumopathie ; la patiente n’a présenté aucune complication sur un recul de 4ans.
Caparo et al. [46] a décrit le cas d’une fille de 7ans traitée par des bains de siège uniquement, avec résolution complète au bout de 2 semaines.
Jones et Fisher et al. [47] ont traité deux fillettes (5 et 6ans) par ampicilline par voie orale, des corticoïdes et de la néomycine à application locale.
Perlman et al. [48] a rapporté la résolution complète d’un prolapsus traité par crème d’œstrogènes chez une fille de 8 ans.
Nous avons remarqué que dans la littérature, les auteurs qui prônent les avantages d’un traitement conservateur :
- se sont basés sur des travaux très anciens jusqu'à 70 ans en arrière, - les cohortes sont d’effectif réduit.
Devrions-nous donc nous baser sur ces expériences pour classer le traitement conservateur comme un traitement de choix ?
47
Le traitement chirurgical a été présenté comme une valeur sûre [16]. Ses complications sont la sténose urétrale et la dysurie [11, 16] avec une incidence faible par rapport au traitement conservateur : 5% dans l’étude de Hiller et al. [6] Adesiyun et al. [4] rapporte dans sa série de 15 filles : 12 des patientes ont été traitées chirurgicalement par excision alors que, 3 patientes avaient déjà été traité sans succès avec des bains de siège.
Da Silva et al. [15] rapporte dans une série ivoirienne de 65 filles que 12 ont reçu un traitement médical et 53 ont été opérées :
- 38 par la technique de Doria - 15 par excision-suture
Sous traitement exclusivement médical, une régression complète du prolapsus muqueux de l’urètre sans récidive a été observée chez trois patientes soit 4,6% seulement des patientes, avec un recul moyen de 1an, alors que 100% des patientes traitées chirurgicalement ont eu des résultats satisfaisants, sans complications dans l’année qui suit [15].
48
Hiller et al. [6] a rapporté que dans une série de 34 filles ayant eu un prolapsus de l’urètre entre 1983 et 2006, 06 filles ont reçu un traitement conservateur fait de bains de siège et de crème d’œstrogène, 02 d’entre elles n’ont pas répondu favorablement au traitement et se sont fait opéré.
Les 6 patientes recevant un traitement conservateur ont d'abord été vues par un gynécologue.
Au total, sur les 34 patientes, 30 ont subi l'excision chirurgicale de la muqueuse prolabée, la procédure a été réalisée par excision de la muqueuse du prolapsus sur une sonde de Foley.
Le cathéter a été retiré au bout de 3-4 heures dans la salle de réveil avant la sortie pour 4 des 34 patientes.
Pour 23 enfants, le cathéter a été retiré le premier jour postopératoire. Tous les enfants ont été renvoyés à la maison immédiatement après le retrait du cathéter.
Trois patientes ont gardé la sonde de Foley en place pendant 2-3 jours. Aucune récidive n'a été signalée sur une période de suivi d’un mois après la chirurgie.
49
Tableau 8 : Les résultats du traitement et du suivi des patientes de la série de Hillyer [6]
Pour notre série la sonde urinaire a été enlevée après 5 jours et les patientes sont sorties sous soins locaux.
Après cette revue de littérature, nous pensons qu’on peut écourter la durée d’hospitalisation à 2 jours, en retirant précocement la sonde urinaire, puisque aucune complication n’a été rapportée concernant le retrait précoce de cette dernière.
Une autre série réalisée sur 10 ans [4] de 1995 à 2004 recense 12 filles opérées, sans aucune complication décelée, traitées par la technique des quatre quadrants :
50
Tableau 9 : Caractères des patientes traitées chirurgicalement de 1995 à 2004[38]
SERIE AGE (ANS) PRESENTATION CLINIQUE CULTURE DES URINES TECHNIQUE CHIRURGICALE COMPLICATIONS POST-OPERATOIRE 1 6 Saignement vulvaire
Stérile Excision avec
cathéter in situ Aucune 2 6 Saignement vulvaire Non disponible
Excision Rétention urinaire
3 7 Masse et FGM Proteus
SPP
FQET Aucune
4 4 Saignement
vulvaire
Stérile FQET Aucune
5 9 Saignement
vulvaire et FGM
Stérile Excision Aucune
6 3 Masse Non disponible FQET Aucune 7 3 Masse Klebsiella SPP Excision Aucune 8 6 Saignement vulvaire Non disponible FQET Aucune 9 3 Saignement vulvaire
Stérile FQET Aucune
10 7 Saignement vulvaire Proteus SPP Excision Aucune 11 5 Saignement vulvaire Escherichia Coli FQET Aucune 12 4 Saignement vulvaire
Stérile FQET Aucune
FGM : Female Genital Mutilation (mutilation génitale féminine)
51
1.5. Durée d’hospitalisation
Ballouhey et al. [49] rapportent en 2013 que, sur une série de 28 filles ayant un prolapsus de l’urètre avec 19 traitées chirurgicalement :
- la durée d’hospitalisation moyenne est de 4,6 jours avec une moyenne de 3 jours pour les patientes traitées initialement par chirurgie,
- la durée d’hospitalisation moyenne est de 8,8 jours chez les patientes traitées initialement par un traitement médical puis converti en chirurgie.
La durée de séjour à l’hôpital serait donc considérablement réduite si on choisit de traiter initialement par chirurgie.
Tableau 10 : Durée d’hospitalisation des patientes avec prolapsus de l’urètre [49].
Pour notre série, la durée moyenne d’hospitalisation est de 5 jours.
Dans la même initiative, de retirer plus précocement la sonde urinaire, nous pourrions ainsi écourter le séjour de la malade à l’hôpital, et réduire aussi le coût de l’hospitalisation.
52
1.6. Impact économique
Hillyer et al. [6] ont évalué le coût de la prise en charge chirurgicale versus la prise en charge médicale, et pour ce, ils ont établi des paramètres de mesures : si la fille est admise dans un tableau de saignement vulvaire, elle est d’abord vu dans la salle d’urgence, cette consultation, à elle seule coûte 200$.
Le coût de la consultation d’admission, l’excision chirurgicale, et les consultations de suivi, ont été estimés à 846$ versus 516$ pour les patientes ayant bénéficié d’un traitement conservateur. Mais chaque consultation de suivi pour les filles traitées médicalement est facturée à 70$, ce qui peut à la longue excéder le prix d’une prise en charge chirurgicale.
Tableau 11 : Différence de coût entre le traitement conservateur et chirurgical [6].
2. Evolution
Dans une étude du Pan African Urologic Surgeons en 2012 sur 22 cas hospitalisés et opérés au service de chirurgie pédiatrique au Niger, la ligature autour d’une sonde de Foley n’est plus utilisée du fait des complications postopératoire (récidives, infections, douleur).
L’exérèse chirurgicale complète et circonférentielle de la muqueuse prolabée assure de bons résultats dans un délai de 24 à 72 heures [3,6,16,50, 51].
Chez leurs patientes, l’excision chirurgicale et la suture muco-muqueuse ont été couronnées de succès 48 à 72 heures après ablation de la sonde de Foley.
53
Un seul cas de rétention aigue d’urines postopératoire a été enregistré. Elle a été traitée par sondage, et anti-inflammatoire non stéroïdien en suppositoire.
Dans notre série, les suites opératoires étaient favorables à 100%, aucune patiente n’a présenté de sténose urétrale, ni de rétention urinaire, ni de récidive.
54
55
Le prolapsus urétral chez la fille est une entité rare, décrite pour la première fois par Solingen en 1732, elle prédomine chez la fille prépubère de race noire entre 4 et 7 ans, avec une recrudescence estivale.
La cause de la maladie reste inconnue, actuellement on différencie l’origine congénitale dominée par la faiblesse du plancher pelvien, et l’origine acquise dominée par le phénomène de mutilation génitale. Cependant, les dernières études ont permis d’isoler certains facteurs de risque, en effet tout ce qui augmenterait la pression abdominale est susceptible de provoquer un prolapsus de l’urètre. Le déficit en œstrogènes expliquerait la prédominance chez la fille prépubère et la femme en post ménopause.
La présentation clinique est dominée par le saignement vulvaire, ce qui est en fait un problème médico-légal. Le diagnostic reste facile est purement clinique. Aucun examen complémentaire n’est nécessaire.
Les dernières recommandations prônent les bénéfices du traitement chirurgical, et conseillent de toujours débuter par celui-ci, aux dépens d’un traitement médical qui connait un taux d’échec et de récidive élevé. Parmi les trois techniques chirurgicales connues, l’excision-suture reste la technique de choix, et la procédure des quatre quadrants permet d’éviter les complications post opératoires, surtout la sténose urétrale. Le retrait de la sonde urinaire devrait se faire précocement, pour permettre d’écourter le séjour de l’hospitalisation et ainsi le coût de la prise en charge.
56
57
[1]. Perlemuter L, Waligora J : Cahiers d’anatomie, Masson 1987.
[2]. Lowe FC, Hill GS, Jeffs RD. Urethral prolapse in children: insights into
etiology and management. J Urol. 1993; 135:100-103
[3]. Fernandes E, Dekermacher S, Sabadin M, Vas F: Urethral prolapse in
children. Urology 1993; 41: 240 – 2
[4]. A. G. Adesiyun and M.O. Childhood urethral mucosa prolapse: outcome of
surgical treatment. Nigerian journal of surgical research Vol 8 No 1 – 2, 2006: 63 – 66
[5]. Mia E. Lang, Azza Darwish, Ann Marie Long: Vaginal bleeding in the
prepubertal child, CMAJ May 10, 2005 vol. 172 no.10
[6]. Hillyer S, Mooppan U, Kim H, Gulmi F: Diagnosis and treatment of
urethral prolapse in children: experience with 34 cases. Urol 2009;73(5):1008-11.
[7]. Zymkiewicz C, Smolinska-Bellen E: Urethral mucosa prolapse in little
girls. Pediatr Pol 1976;51(10):1213–6
[8]. Valerie E, Gilchrist BF, Frischer J, Scriven R, Klotz DH, Ramenofsky ML:
Diagnosis and treatment of urethral prolapsed in children. Urology 1999 ;54 :1082-4.
[9]. Sugerman H, Windsor A, Bessos M, et al. Effects of surgically induced
weight loss on urinary bladder pressure, sagittal abdominal diameter and obesity co-morbidity. Int J Obes. 1998; 22:230-235
[10]. JACKSON SR, AVERY NC, TARLTON JF, ECKFORD SD, ABRAMS
P, BAILEY AJ. Changes in metabolism of collagen in Genito-urinary prolapse. Lancet 1996; 347: 1659.
58
[11]. Trotman MDW, Brewster EM: Prolapse of the mucosa in prepubertal west
Indian girls. Br J Urol. 1993; 72:503-506
[12]. Mitre A, Nahas W, Gilbert A et al.: Urethral prolapsed in girls: familial
case. J Urol.1987; 137:115
[13]. Rackley R, Vasavada S. Urethral prolapse. Accessed June 15, 2006.
[14]. Da Silva Anoma S, Sefton E, Shenoy MU, Rance CH: Urethral prolapsed
in premenarchal girls. BJU International 2000;86(3):402.
[15]. Da Silva-Anoma S, Bertin KD, Ossenou O, Gaudensv, Yao D, Roux C.
Prolapse of the urethral mucosa in young girls from the Ivory Coast. Ann Urol (Paris) 2001;35(1):60–3.
[16]. Rudin JE, Geldt VG, Alekseev EB: Prolapse of urethral mucosa in white
female children: experience with 58 cases. J Pediatr Surg 1997;32(3):423– 5.
[17]. Jerkins GR, Verheeck K, Noe HN: Treatment of girls with urethral
prolapse. J Urol 1984 Oct ;132(4):732–3.
[18]. Doletski˘ı SIa, Gel’dt VG, Rudin IuE, Alekseev EB, Muzykantova VS.
Prolapse of the urethral mucosa in girls. Khirurgiia (Mosk) 1990; 8:52–7.
[19]. Pouya M, Van Cangh PJ, Wese FX, Opsomer RJ, Saleh M.: Mucous
prolapse of the urethra. Acta Urol Belg 1995; 63:23-9.
[20]. Lopez C, Bochereau G, Eymeri JC. Urethral mucosal prolapse in girls:
Apropos of 24 cases. Chir Pédiatr 1990; 31:169-72.
[21]. Falandry L.: Prolapse of the urethra in black girls: Personal experience in
59
[22]. Akani CI, Pepple DK, Ugboma HA: Urethral prolapse: A retrospective
analysis of hospitalized cases in Port Harcourt: Niger J Med 2005;14:396-9.
[23]. Anveden-Hertzberg L, Gauderer MW, Elder JS. Urethral prolapse: An
often misdiagnosed cause of urogenital bleeding in girls. Pediatr Emerg Care 1995; 11:212-4.
[24]. Richardson D.A., Hajj S.N., Herbst A.l. Medical treatment of urethral
prolapse in children: Obstet Gynecol. 1982; 59: 69 - 72.
[25]. Katz AL. Benign gynecologic disorders. In: Mattei P, editor. Surgical
directives: Pediatric surgery. Philadelphia: Lippincott William and Wilkins; 2003. p. 765-70.
[26]. Shavit I, Solt I. Urethral prolapse misdiagnosed as vaginal bleeding in a
premenarchal girl. Eur J Pediatr 2008; 167:59
[27]. Park BJ, Kim YW, Kim TE, Lee DH: Urethral prolapse in a premenarchal
asian girl. Obstet Gynecol 2009; 113:506–7.
[28]. Holbrook C, MIsraD. Surgical management of urethral prolapsed in girls:
13 years’ experience. BJU Int 2012; 110:132-4.
[29]. Noah P. Kondamudi, Ayush Gupta, Amina Watkins, and Amy Bertolotti,
PREPUBERTAL GIRL WITH VAGINAL BLEEDING, The Journal of Emergency Medicine, Volume 46, Issue 6, June 2014, Pages 769-771
[30]. Lang ME, Darwish A, Long MA. Vaginal bleedingin the prepubertal girls.
CMAJ 2005; 172:1289-90
[31]. Z. Chakhtouraa, A. Simonb, C. Duflosa,b, E. Thibaudb, Gynécologie de
l’enfant et de l’adolescente. Journal de pédiatrie et de puériculture (2013) 26, 38—56
60
[32]. Shetty A, Coffman K, Harmon E: Urethral prolapse. J
Pediatr.1998;133:552
[33]. Ballouhey A, O. Abboa, S. Sansonb, T. Cochet C, P. Galinier a, C.
Pienkowski: Urogenital bleeding revealing urethral prolapsed in a prepubertal girl. Gynécologie Obstétrique & Fertilité 41 (2013) 404– 406
[34]. Shurtleff, B.T., Barone, J.G. Urethral prolapse: Four quadrant excisional
technique. J Paed Adolescent Gynaecology. 2002 ; 15(4) : 207 – 211.
[35]. Defieux X., Hubeaux K., Mordefroid M., Fernandez H., Amarenco G.
Explorations complémentaires dans les troubles de la statique pelvipérinéale. EMC (Elsevier Masson SAS, Paris), Gynécologie, 2007 ; 290-A-40.
[36]. Redman, J. Conservative management of urethral prolapse in female
children. Urology. 1982; 19: 505 - 506.
[37]. Turner, R. Uretheral prolapse in female children. Urology 1983; 2: 530
v-533.
[38]. Ziegerman JH, Kimbrough RA: Circular prolapsed of the urethra. Am J
Obstet Gynecol 56:950, 1948
[39]. Johnston HW: Prolapse of the urethral mucous membrane. Can Med Assoc
J 41:389, 1939
[40]. Devine PC, Kessel HC: Surgical correction of the urethral prolapse. J Urol
123:856, 1980
[41]. Owens SB, Morse WH: Prolapse of the female urethra in children. J Urol
61
[42]. G.O.Sanda, A.Soumana, H.Oumarou The urethral mucosal prolapse in
young girls: a series of 22 cases and a literature review African Journal of Urology (2012) 18, 93–96
[43]. Sauferlin H: Uber den vorfall des Harnohre bei der Frau. Z. Geburtshilfe
Gynaekol. 94:630, 1929
[44]. Turner RW: Urethral porlapse in female children. Urology 2:530 1973. [45]. Esposito: Circular prolapse of the urethra in children. Obstet Gynecol
31:363, 1968.
[46]. Caparo VJ, Bayonet-Rivera NP, Magoss I: Vulvar tumor in children due to
prolapsed of urethral mucosa. Am J Obstet Gynecol 108:572, 1970
[47]. Jones HE, Fisher HJ: Urethral prolapsed in girls. Arch Dis Child 46:107,
1971.
[48]. Perelman R, Boralevi CI, Reinert PH, et al.: A rare cause of genital
hemorrhage in a girl:Prolapsed urethral mucosa treated with estrogens. Ann. Pediatr 16:457, 1969.
[49]. Q. Ballouhey a, P. Galinier b, A. Gryn c, A. Grimaudo a,C. Pienkowski d,
L. Fourcade a: Benefits of primary surgical resection for symptomatic urethral prolapse in children. Journal of Pediatric Urology (2014) 10, 94e97
[50]. Fiogbe MA, Hounnou GM, Koura A, Agossou-Voyeme KA. Urethral
mucosal prolapse in young girls: a report of nine cases in Cotonou. Afr J Paediatr Surg 2011;8(1):12–4.
[51]. Ho CC, Yu TJ. Urethral prolapsed: a case report. Changgeng Yi Xue Za





![Tableau 3 : les données concernant le poids et la taille dans l’étude de Valérie et al.[8]](https://thumb-eu.123doks.com/thumbv2/123doknet/14387558.700659/23.892.161.729.393.864/tableau-données-concernant-poids-taille-étude-valérie-al.webp)

![Figure 7 : Distribution du prolapsus de l’urètre dans une population de 162 patientes [24]](https://thumb-eu.123doks.com/thumbv2/123doknet/14387558.700659/27.892.199.697.463.790/figure-distribution-prolapsus-l-urètre-population-patientes.webp)